-
近年来,随着太湖水体富营养化的加剧,太湖蓝藻暴发呈逐年上升趋势。蓝藻不仅会造成水质恶化,破坏水体生态系统,而且多数蓝藻还会释放藻毒素,藻细胞死亡裂解后释放至水体中,威胁城市日常饮用水安全和公众健康[1]。目前,应急打捞是我国减除蓝藻水污染生态灾害和降低再次暴发强度的最直接的有效措施[2]。但打捞的大量蓝藻如不进行及时处理,则会在陆地上发生二次污染。因此,如何实现蓝藻泥的高效处理处置已成为目前亟待解决的环境问题。
蓝藻中富含蛋白质、碳水化合物以及少量的脂质[3],是理想的厌氧发酵的底物。通过将厌氧消化控制在产酸阶段,可以得到附加值较高的VFAs;并且还能使蓝藻减量,实现蓝藻资源化、减量化的目的。KIM等[4]以提取了脂质的微藻作为底物进行厌氧发酵产酸,产酸效率(1 g VS中VFAs的占比)为36%。SEO等[5]采用提取了脂质的微藻残留物作为底物进行发酵产酸,产酸量达到8.17 g·L−1,产酸效率(1 g COD中VFAs的占比)为40%。然而,目前利用蓝藻发酵生产VFAs的报道不多。
本研究考察了太湖蓝藻泥厌氧发酵产VFAs的效果,并采用热碱预处理对蓝藻进行破壁处理,研究了蓝藻水解及产酸效果,考察了发酵前后底物的降解情况,剖析了预处理前后及发酵后溶解性有机物(DOM)的成分变化,分析预测了工业规模下的蓝藻发酵产酸的经济可行性,为蓝藻厌氧发酵产酸的工业化推广提供了可靠的理论和数据支持。
全文HTML
-
蓝藻浆来自江苏省无锡市太湖藻水分离站,将蓝藻浆放置于4 ℃冰箱中储存备用。序批式运行期间,TSS调至72 g·L−1,VSS/TSS为55%;半连续运行期间,TSS调至80 g·L−1,VSS/TSS为80%。
种泥来自宜兴某企业处理柠檬酸废水工艺的UASB产甲烷颗粒污泥,且使用前进行了驯化:将产气颗粒污泥在105 ℃加热2 h,以杀死产甲烷菌,将经过热处理的颗粒污泥添加到实验室UASB反应器中,以重新驯化激活;将活化营养液连续泵入UASB以富集产酸细菌,并将温度保持在(37±2) ℃。当电解质pH降至4.0以下时,认为产酸种泥驯化完成[6]。驯化周期超过21 d。产酸种泥及各阶段进料底物的基本理化性质如表1所示。
-
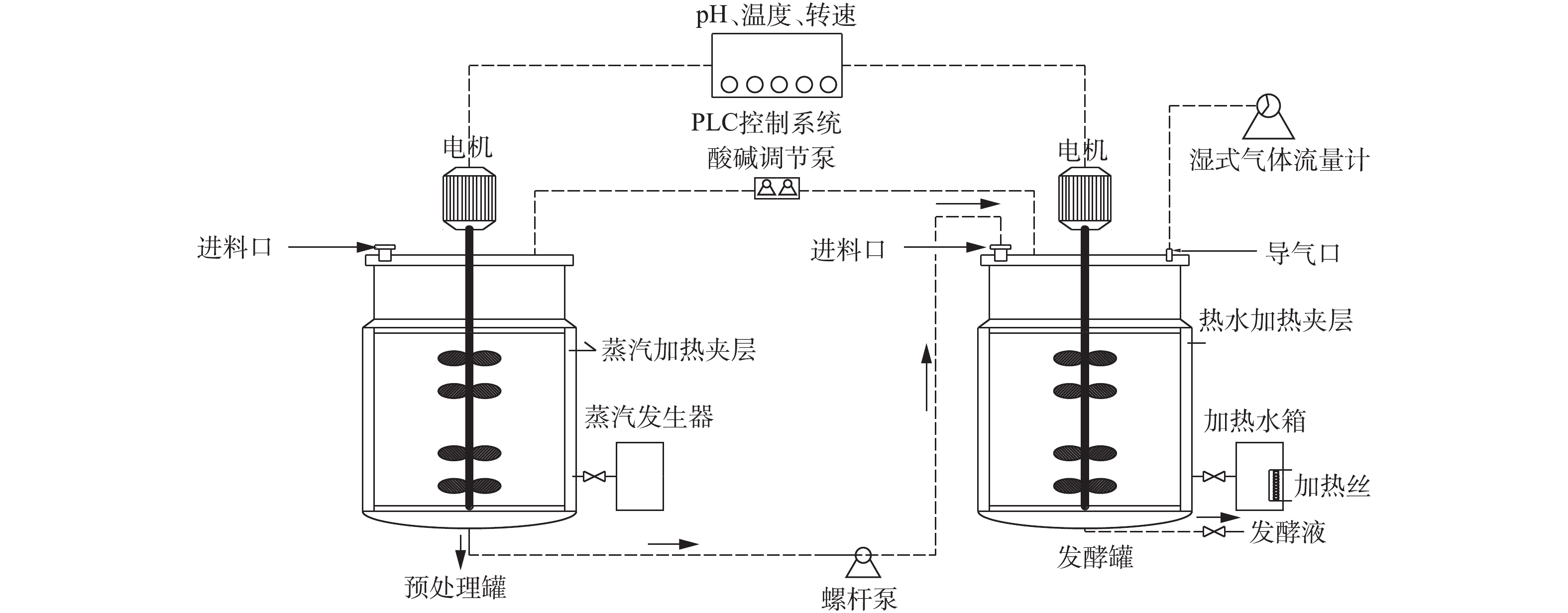
实验装置为自动机械搅拌不锈钢发酵罐(GUJS-30C型,镇江东方生物工程设备技术有限责任公司),有效容积为21 L。工艺流程如图1所示。热碱预处理后的蓝藻泥经螺杆泵进入发酵罐中,发酵罐配有PLC自控系统,可实时监控调节发酵罐内温度、pH和搅拌转速。反应器外导气口通过硅胶管联通湿式气体流量计,发酵后的发酵液经过泥水分离,进行VFAs的回收。
-
在进行蓝藻热碱预处理实验时,将在藻水分离站中取回来的藻浆用自来水调TSS为72 g·L−1(序批式)或80 g·L−1(半连续运行),然后储存在4 ℃冰箱里冷冻保存。每2 d取4.2 L新鲜藻浆放置在预处理罐中,用酸碱调节泵泵入10 mol·L−1氢氧化钠(NaOH),调节pH至12±0.02,蒸汽发生器产生的蒸汽至蒸汽加热夹层,使预处理罐维持温度在(90±2) ℃,电机搅拌转速为(80±10) r·min−1,在预处理罐中反应2 h,冷却至室温后,泵入发酵罐中进行产酸反应。
在进行蓝藻厌氧发酵产酸实验时,将实验分为序批式启动阶段和半连续运行阶段。序批式启动阶段:产酸种泥的接种量为30%,即将TSS=72 g·L−1、VSS/TSS=55%(序批式)的新鲜藻浆14.7 L经过热碱预处理后泵入发酵罐中,再加入6.3 L驯化好的产酸种泥;在整个发酵运行过程中,采用酸碱调节泵泵入10 mol·L−1 NaOH溶液或10 mol·L−1盐酸(HCl)溶液,调节反应器内pH,维持发酵罐pH=10±0.02 [7],电机转速设定为(80±10) r·min−1,温度维持在(37±2) ℃。半连续运行阶段:待产酸稳定后,开始更换蓝藻底物进行半连续厌氧发酵产酸;污泥停留时间(SRT)为10 d,即每2 d排出4.2 L发酵后藻浆,同时将4.2 L TSS=80 g·L−1、VSS/TSS=80%(半连续)的新鲜藻浆经过热碱预处理后泵入发酵罐中;整个发酵过程运行的参数条件与序批式阶段相同。
-
将采集好的水样经过10 000 r·min−1离心10 min后,取上清液通过0.45 µm滤膜,用于测定SCOD、溶解性蛋白质、溶解性碳水化合物、氨氮(
NH+4 -N)、总氮(TN)和VFAs类型及浓度。溶解性蛋白质采用BCA试剂盒法[8]。蓝藻TSS、VSS、TCOD、SCOD、溶解性碳水化合物、
NH+4 -N、TN均采用国家标准方法[9]测定;VFAs采用气相色谱法测定,测量仪器为高效气相色谱仪(2010型,岛津公司),主要配置:AOC-20i自动进样器、FID检测器、PEG-20M色谱柱(30 m×0.32 mm×0.5 µm,大连中北分析仪器);采用一阶程序升温,初温80 ℃,保持3 min,然后以15 ℃·min−1的速率升至200 ℃,保持2 min。载气为氮气,吹尾流量30 mL·min−1。进样室(SPL)和检测器(FID)的温度均设为250 ℃。蓝藻溶出率[10]按式(1)进行计算。
式中:R为溶出率;CSCODa表示蓝藻预处理后的SCOD,mg·L−1;CSCODb为预处理前蓝藻的SCOD,mg·L−1;CtCOD为蓝藻总COD,mg·L−1。
1.1. 蓝藻与产酸种泥来源
1.2. 实验装置
1.3. 实验方法
1.4. 分析方法
-
热碱预处理可以极大促进蓝藻有机质释放到液相。由于蓝藻细胞壁的高抗性,蓝藻生物质比污水污泥更难降解[11],破壁成为了厌氧发酵过程中的主要瓶颈。因此,需要预处理来加速其水解[12]。图2反映了蓝藻热碱预处理后SCOD及溶出率的变化(提供给半连续运行反应器)。调浆后的蓝藻初始SCOD为4 250.4 mg·L−1,SCOD在热碱预处理后增大到48 081.5 mg·L−1,最高达到50 323.8 mg·L−1,预处理后的平均浓度是初始浓度的11.31倍,平均溶出率为58.1%。由SCOD增长变化可以看出,热碱预处理能有效地将蓝藻有机质从固相转移到液相。
-
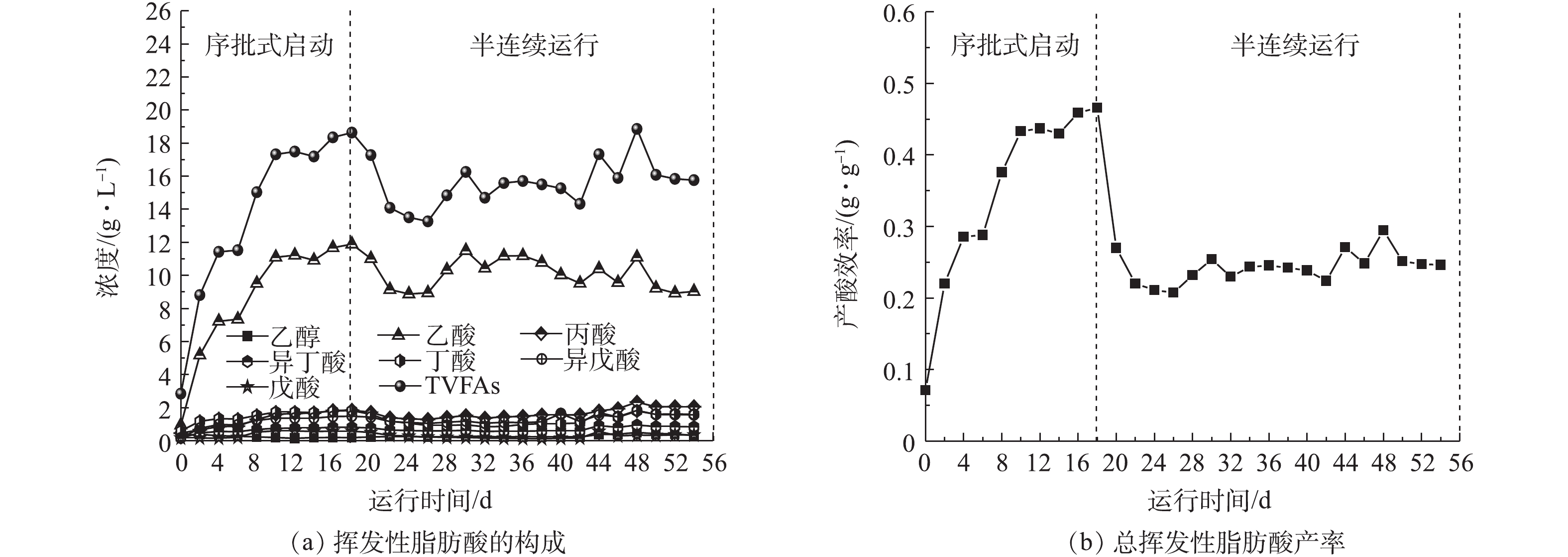
蓝藻产酸效果如图3所示。蓝藻厌氧发酵过程分为序批式启动阶段和半连续运行阶段。在序批式启动阶段,底物采用TSS=72 g·L−1、VSS/TSS=55%热碱预处理后的蓝藻浆,TVFAs最高可达18.64 g·L−1,产酸效率(1 g VSS中VFAs的占比)最高为46%;在半连续运行阶段,由于更换进料底物,采用TSS=80 g·L−1、VSS/TSS=80%热碱预处理后的蓝藻浆,TVFAs平均浓度为15.56 g·L−1,产酸效率稳定在26%。而EHIMEN等[13]对未预处理的小球藻进行发酵产酸,产酸效率(1 g VS中VFAs的占比)为13%,本研究序批式启动阶段中的产酸效率为其3.54倍,半连续运行阶段的产酸效率为其2倍,这说明预处理能有效提高后续发酵产酸效率。SURESH等[14]以碱-超声预处理蓝藻,以序批式运行得到的产酸效率(1 g VS中VFAs的占比)为27%,本研究序批式启动阶段的产酸效率为其1.7倍。在以蓝藻为底物进行厌氧发酵过程中,所产酸中以乙酸为主,丙酸、丁酸为次,这主要与在碱性条件下,发酵底物中富含碳水化合物、蛋白质有关[15]。
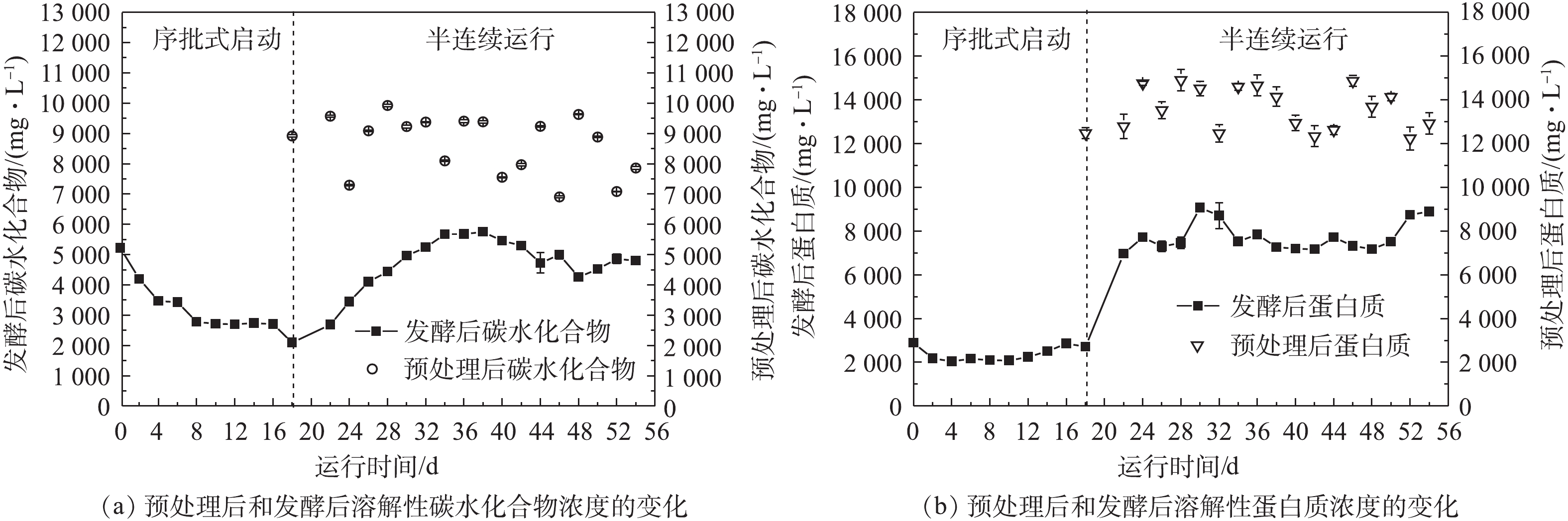
在发酵过程中溶解性碳水化合物及蛋白质浓度变化如图4所示。在序批式阶段,溶解性碳水化合物浓度由5 219.3 mg·L−1降至2 096.7 mg·L−1,而溶解性蛋白质浓度由2 888.2 mg·L−1降低至2 713.3 mg·L−1。检测到的溶解性碳水化合物和蛋白质浓度是释放速率和降解之间净平衡的结果[16];由于发酵罐中的产酸微生物对溶解性蛋白质的降解超过了蓝藻生物质的水解,初期呈现下降趋势,此后蛋白质的降解和释放保持平衡。然而,检测到的溶解性碳水化合物浓度却呈现出下降的趋势;这可能是由于在厌氧发酵过程中,产酸微生物更倾向于利用碳水化合物生成VFAs。在半连续运行阶段,溶解性碳水化合物和蛋白质浓度分别稳定在4 259.09 mg·L−1和7 172.79 mg·L−1,碳水化合物降解率为50.43%,蛋白质降解率为47.04%。溶解性蛋白质和碳水化合物浓度都是先升高再趋于稳定,这是因为在半连续运行阶段进料底物中溶解性有机质的增加,导致发酵罐内溶解性蛋白质和碳水化合物浓度的增加。
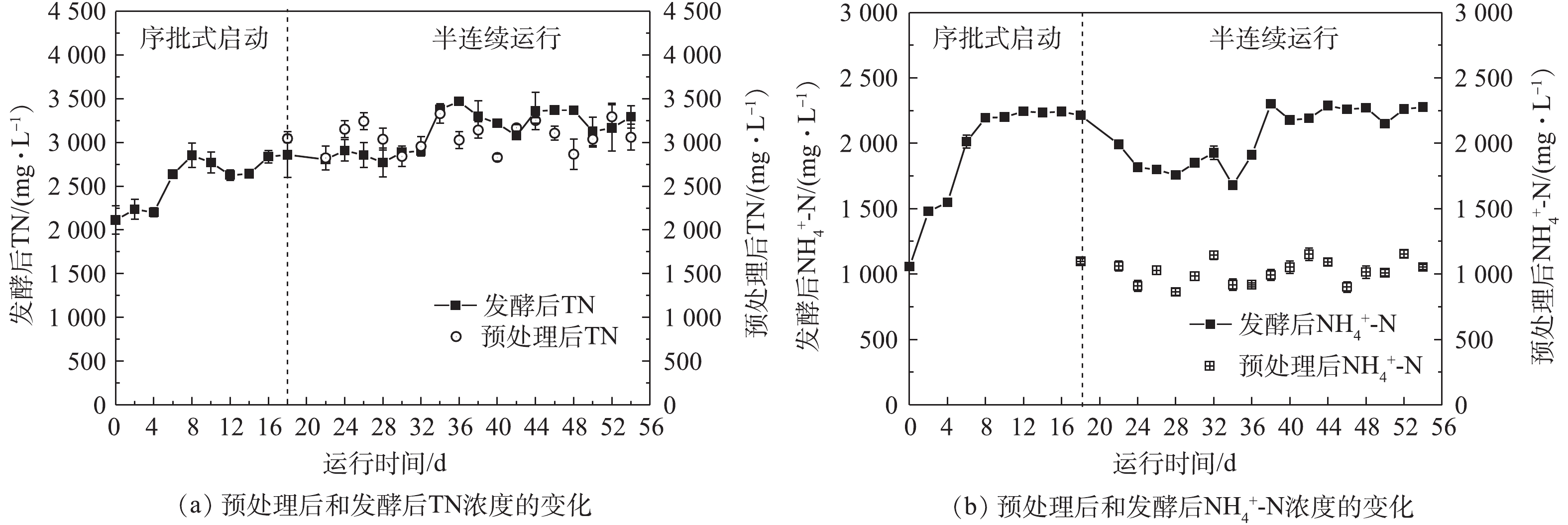
氨氮是影响后续发酵产酸的重要指标[17]。氨氮浓度过高时,会抑制后续的厌氧发酵产酸过程。蓝藻预处理后和发酵后TN、
NH+4 -N变化如图5所示。蓝藻浆经过预处理后,初始和预处理后NH+4 -N平均浓度分别为46.7 mg·L−1和1 020.8 mg·L−1,预处理后的平均浓度是初始浓度的21.9倍。预处理后TN平均浓度达到3 068.4 mg·L−1,比预处理前升高了5.44倍,这是因为在热碱预处理过程中,随着蓝藻细胞的破裂,一方面,含氮化合物从固相转移到液相,使得溶解性总氮含量不断增加;另一方面,溶解性蛋白质也在不断水解,生成多肽、二肽、氨基酸,甚至进一步水解成小分子有机酸、氨氮及二氧化碳[18]。在序批式厌氧发酵阶段,TN浓度由2 114.3 mg·L−1上升到2 860.5 mg·L−1;
NH+4 -N浓度从1 055.8 mg·L−1上升到2 213.4 mg·L−1,直至保持稳定,NH+4 -N和TN的变化趋势一致。有研究[19-20]发现,当氨氮浓度高于4 920 mg·L−1时,会出现厌氧消化受到抑制的现象;当氨氮浓度高于8 000 mg·L−1时,厌氧消化被100%抑制。本研究中各阶段的NH+4 -N浓度均低于4 920 mg·L−1,故未出现抑制现象。在半连续运行阶段,发酵前后的TN浓度基本不发生变化,平均浓度分别为3 068.4 mg·L−1和3 118.8 mg·L−1。这是因为蛋白质的发酵过程可分为溶解主导阶段和转化主导阶段[16]。在第18天进行半连续发酵时,产酸过程已经维持稳定,蛋白质的发酵过程主要以转化为主,即含氮化合物转化为氨氮,导致出水氨氮升高。而溶解性总氮包括溶解性蛋白质、水解产物(多肽、二肽、氨基酸等)、氨氮等,总氮浓度基本不会发生变化。热碱预处理和发酵后氨氮平均浓度分别为1 020.83 mg·L−1和2 062.6 mg·L−1,氨氮浓度增加了50.5%。 -
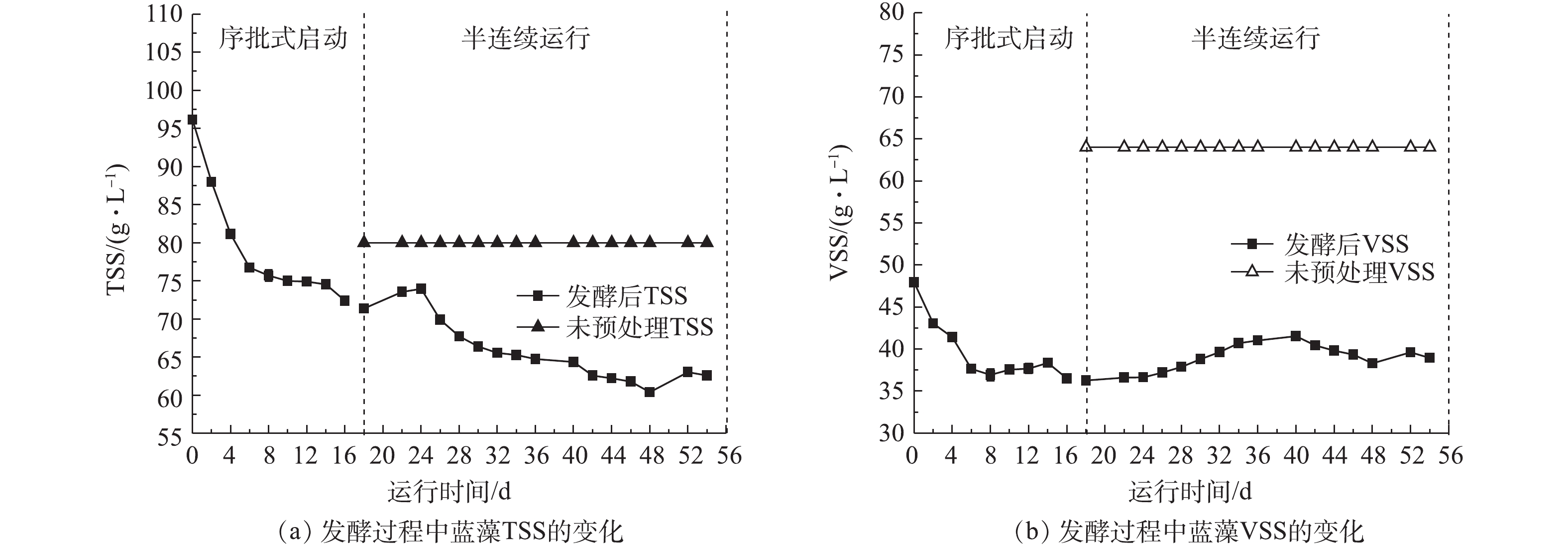
在半连续运行阶段,将新鲜蓝藻经过热碱预处理后泵入发酵罐中进行后续的发酵产酸。蓝藻的减量效果如图6所示。对于未预处理的蓝藻,初始TSS=80 g·L−1、VSS=64 g·L−1。在半连续运行稳定阶段,TSS下降到最低,为60.4 g·L−1,VSS下降到36.2 g·L−1,TSS和VSS的降解率分别为24.5%和43.4%,VSS的降解率远高于传统厌氧污泥消化的VSS降解率[18]。在半连续运行初期,VSS浓度逐渐上升,这是因为在半连续运行阶段,进料蓝藻替换成了VSS浓度更高的蓝藻,系统尚未稳定;随着半连续的运行,发酵罐内低VSS蓝藻逐渐被替换成高VSS蓝藻,并趋于稳定。水解和酸化过程都有助于底物的减量,包括固体溶解、有机物的分解和生物降解转化为VFAs[21]。通过热碱预处理和发酵产酸可以促进难降解有机质的水解和生物转化。
-
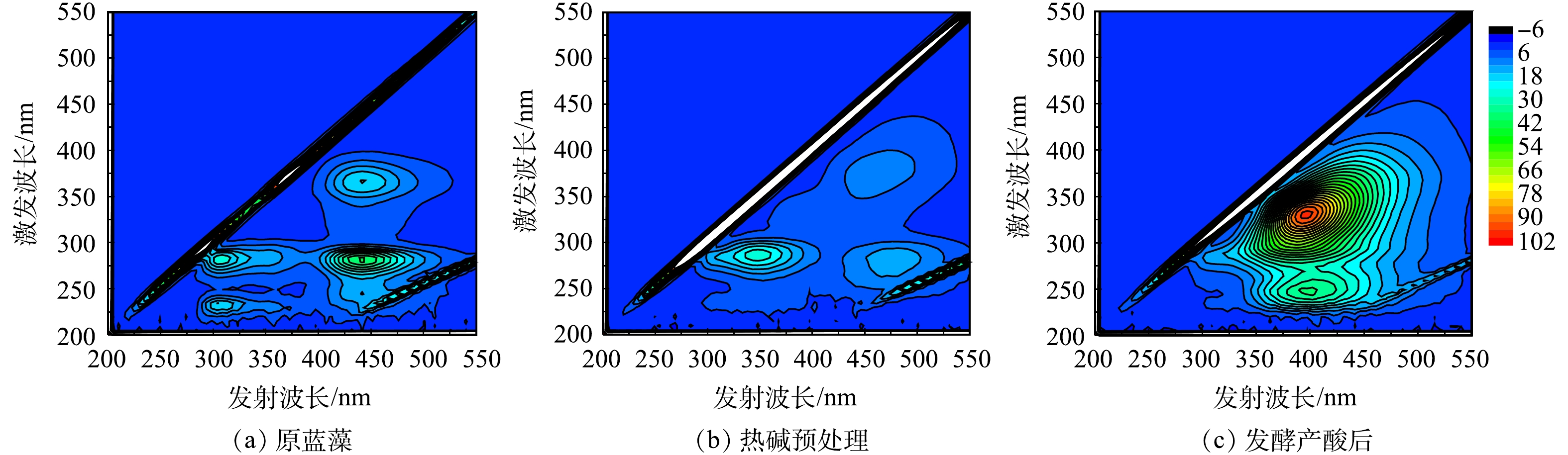
为更深入了解预处理前后及发酵后DOM的成分变化,对蓝藻溶解性有机物进行3D-EEM分析,结果如图7所示。对于三维荧光光谱图,通过激发波长(Ex)及发射波长(Em)范围可以将蓝藻中DOM分为5个区域[22]。其中区域A(Ex:250~400 nm;Em:380~500 nm)对应腐殖酸类有机物;区域B(Ex:250~400 nm;Em:280~380 nm)对应可溶性微生物副产物;区域C(Ex:220~250 nm;Em:380~450 nm)对应富里酸类有机物;区域D(Ex:220~250 nm;Em:330~380 nm)对应色氨酸类蛋白质;区域E(Ex:220~250 nm;Em:280~330 nm)对应酪氨酸类蛋白质。由图7(a)可以看出,原蓝藻的DOM主要是由少部分酪氨酸类蛋白质、少部分可溶性微生物副产物及部分腐殖酸类有机物组成。在经过热碱预处理后,可溶性微生物副产物增加,同时酪氨酸类蛋白质及腐殖酸类物质大量减少(图7(b))。然而一般认为,可溶性微生物副产物是可生物降解的[23],腐殖酸类物质会抑制厌氧消化过程[24]。对蓝藻进行热碱预处理无疑有利于提高其生化性,减少腐殖酸类物质对厌氧消化的抑制效果,促进后续厌氧发酵产酸的进行。产酸发酵后的DOM中可溶性微生物副产物大大减少(图7(c)),与此相对应,腐殖酸类有机物及富里酸类有机物大量富集。这与WANG等[22]的研究结果大致相同,DOM中可溶性微生物副产物逐渐减少,而腐殖酸类物质逐渐增加。随着厌氧消化时间的延长,有机质会逐渐趋于稳定化,而高腐殖质化的有机质相较于低腐殖质化有机质更稳定[25]。
-
为了衡算太湖蓝藻产挥发性脂肪酸的经济效益,基于本次研究得到的数据(如有机酸转化率、水耗、电耗以及药品消耗等)进行了经济可行性分析。假定日处理蓝藻100 m3(含水率为85%),那么蓝藻干物质的质量为15 000 kg,按照VSS/TSS=80%计,所含VSS量为12 000 kg。根据本研究结果,蓝藻发酵产挥发性脂肪酸有机质的降解率为43.4%,产酸效率(1 g VSS中VFAs的占比)按26%计,则100 m3蓝藻可以产生1 354.1 kg VFAs。由于发酵液中有机酸浓度高,不需要提取,且发酵后的残留物中,未生物转化的有机物主要以蛋白质和碳水化合物形式存在,可直接回流至污水处理池中作为补充碳源强化脱氮除磷,因此,不需要考虑提取成本。按照VFAs的市场价为6 520元·m−3计算,1 m3蓝藻产挥发性脂肪酸收益则为88.3元。工业烧碱的实际消耗量为5 kg·m−3蓝藻,工业烧碱市场价为2 000元·m−3,1 m3蓝藻所耗药剂费为10元。配备2名工作人员,月薪4 500元·人−1。设备总投资(包括基建、维修等)共计2 929万元,折旧期为10 a,预计净残值率为3%,则设备折旧费为77.8元·m−3蓝藻。综上所述,蓝藻通过发酵产酸净收益为117.6元·m−3,每年净收益为429.4万元。
2.1. 热碱水解对蓝藻泥的预处理效果
2.2. 蓝藻厌氧发酵产酸
2.3. 蓝藻的减量效果
2.4. 各阶段蓝藻DOM组成分析
2.5. 经济可行性分析
-
1)经过热碱预处理后,蓝藻中大部分有机质可从固相转移到液相中,平均水解率为58.1%;SCOD、溶解性蛋白质、溶解性碳水化合物浓度相比于未经过预处理的情况下均有大幅度的提高,分别提高了10.3、4.8和12.3倍,从而促进了后续厌氧发酵产酸。
2)厌氧发酵产酸实现了蓝藻的资源化和减量化。以TSS=72 g·L−1、VSS/TSS=55%的蓝藻为底物,在碱性条件下进行序批式发酵,VFAs最高浓度为18.64 g·L−1,产酸效率(1 g VSS中VFAs的占比)为46%。半连续稳定阶段,蓝藻TSS=80 g·L−1、VSS/TSS=80%,平均VFAs浓度为15.56 g·L−1,产酸效率(1 g VSS中VFAs的占比)为26%。且TSS和VSS的降解率分别为24.5%和43.4%。
3)经过热碱预处理后,蓝藻可生物利用组分显著增加,同时腐殖酸类物质大量减少,提高了蓝藻的生化性,降低了腐殖质类物质对后续厌氧消化过程的抑制效果;发酵后DOM逐渐趋于稳定,腐殖化程度显著提高。
4)当蓝藻发酵产挥发性脂肪酸放大至处理量为100 m3·d−1时,净收益为117.6元·m−3,每年净收益为429.4万元。





 下载:
下载: