-
近年来,难降解有机污染物的降解问题引起了人们的广泛关注,因为它们对自然环境和人类健康造成了极大的危害[1]。特别是,煤化工生产过程产生的高浓度盐水中含有大量的难降解的有机物(如PAHs、杂环化合物等),这些物质通常具有复杂的芳族分子结构,这使得它们更稳定并且更难以降解。如果不加以处理,这些有害物质会引起某些健康危害和环境污染[2]。虽然传统的处理技术,如物理吸附[3-4],化学氧化[5]和生物方法[6],已经研究从废水中去除难降解有机物,但许多问题仍然是不可避免的,如二次污染[7]和伴随污染物的生物降解延迟[8]。高级氧化过程(AOPs),定义为利用羟基(·OH)进行氧化的那些技术[9-10],在过去几十年中,这些技术在废水处理技术的研究中受到越来越多的关注。这些过程(如光催化氧化,芬顿化学和臭氧催化氧化[11-12])已成功应用于去除或降解顽固污染物,或用作预处理将污染物转化为短链化合物,然后再通过常规或生物方法处理[13]。其中之一的经典方法是非均相臭氧催化氧化工艺,它利用不溶性催化剂对有机污染物进行氧化还原和矿化,臭氧催化氧化因其效率高、操作简单而被认为是一种很有前途的工艺[14-15]。这一过程的关键因素是制备有效的非均相催化剂,因此,须进一步探索研究,以找出廉价、高效和稳定的非均相催化剂,在催化臭氧氧化中高效降解有机物污染物。
因此,本研究采用浸渍-煅烧法制备了负载活性金属氧化物的活性氧化铝型催化剂,以煤化工高浓盐水为目标污染物,探索催化剂的制备工艺和反应操作条件对高盐废水COD去除率的影响,为高效的臭氧催化体系的开发及其在煤化工高盐废水处理领域的应用提供参考。
-
实验水样来自某化工企业煤制天然气废水,共分为3种废水:水样1来自二次反渗透浓盐水;水样2来自二沉池出水;水样3来自一次反渗透浓盐水,基本水质指标如表1所示。由表1可知,水样1中TDS超过了3.5%,属于高盐废水,且COD较高;水样2、水样3中的TDS和COD相对降低,采用3种水样对比实验来考察臭氧催化氧化对高盐废水中的COD去除效果。
-
采用浸渍-煅烧的方法制备催化剂,具体制备过程如下:取一定质量的活性Al2O3或者陶瓷材料球状载体(载体粒径为3~6 mm),浸渍至含有1 mol·L−1的Mn、Fe、Cu、Ni、Co、Ce等过渡金属的硝酸盐溶液中,室温下,以150 r·min−1振荡30 min,使其完全混匀,过滤得到固体,在105 ℃下烘干,然后在500 ℃下煅烧4 h后,制备所得的催化剂。
-
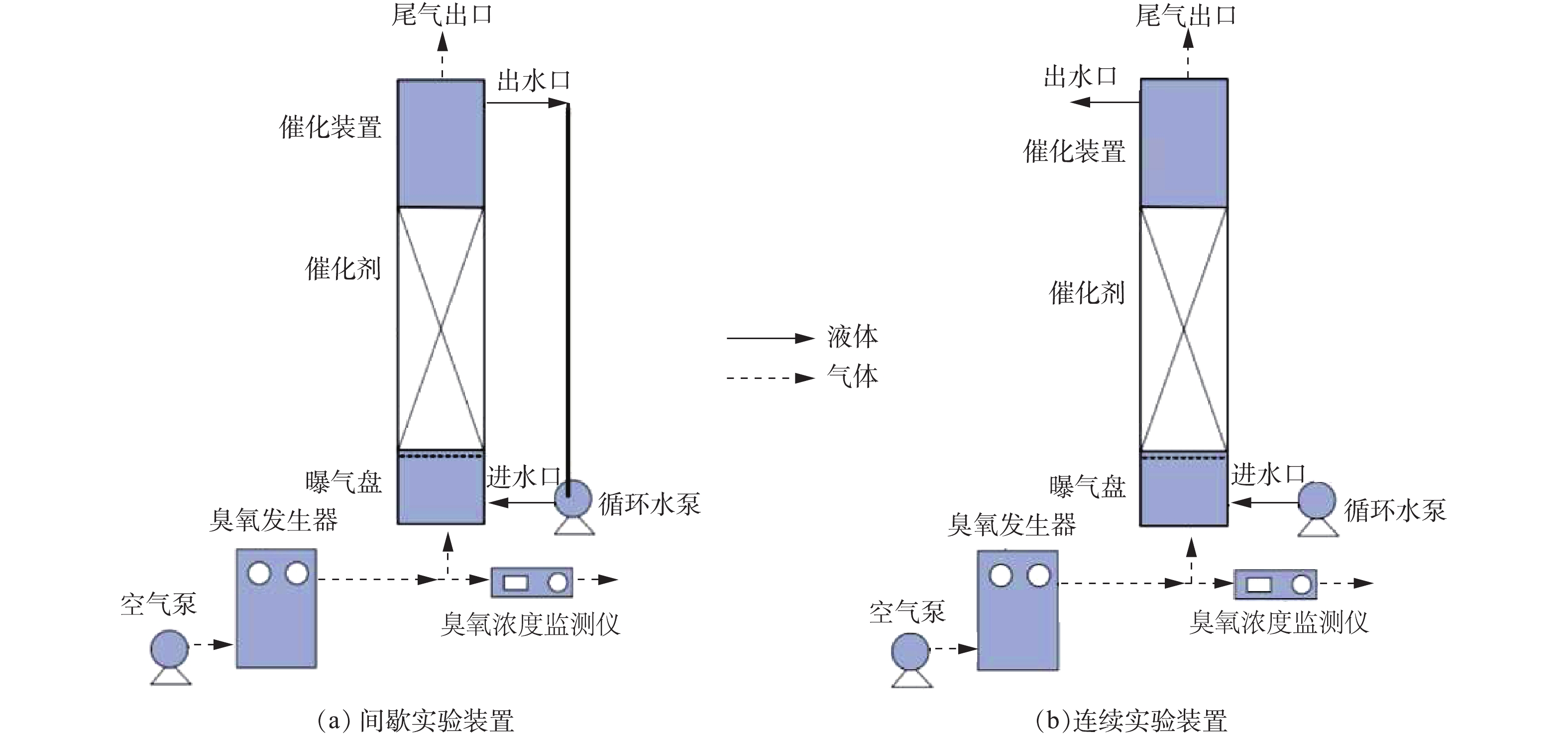
臭氧催化氧化实验装置示意图如图1所示。臭氧催化氧化实验分为以下2步。间歇性实验:在1 L废水中加入一定量的催化剂,反应装置为玻璃柱(内径4 cm,高度1.5 m),废水采用蠕动泵循环以便混合均匀,控制臭氧发生器出口O3气体流量为0.8 L·min−1,O3浓度为3~10 mg·L−1,每隔一段时间检测COD的变化。连续性实验:反应装置连续进出水,出水不返回到进水端,每隔60 min检测COD的变化。
-
采用GB 11914-1989中重铬酸钾滴定法,测定废水中化学需氧量(COD);X射线衍射分析(XRD)由X射线衍射仪(D8 Advance,布鲁克,德国)进行物相分析,测试条件为CuKα辐射,电压为40 kV,电流为40 mA,扫描角度为3°~90°,扫描速度为3(°)·min−1;比表面积和孔径(BET)采用ASAP 2020型比表面积与孔径测定仪(麦克仪器公司,美国)测试,在77 K液氮温度下,进行N2吸附-脱附测定;采用S-4800场发射扫描电子显微镜(SEM)观察样品的整体形貌;采用Noran7型X射线能谱仪(EDS)进行样品微区成分分析;采用原子吸收光谱法(AAS)测定溶液中的金属离子浓度。
-
首先单独使用活性氧化铝和陶粒进行臭氧催化氧化实验,以水样1为实验水样,实验发现活性氧化铝对COD的去除率达到了14.6%,高于陶粒的8.9%,而且活性氧化铝能提高污水的可生化性。相比于陶粒,活性氧化铝臭氧催化氧化污水后,B/C值为0.42,远高于陶粒的0.23。由此可见,氧化铝载体催化性能优于陶粒。
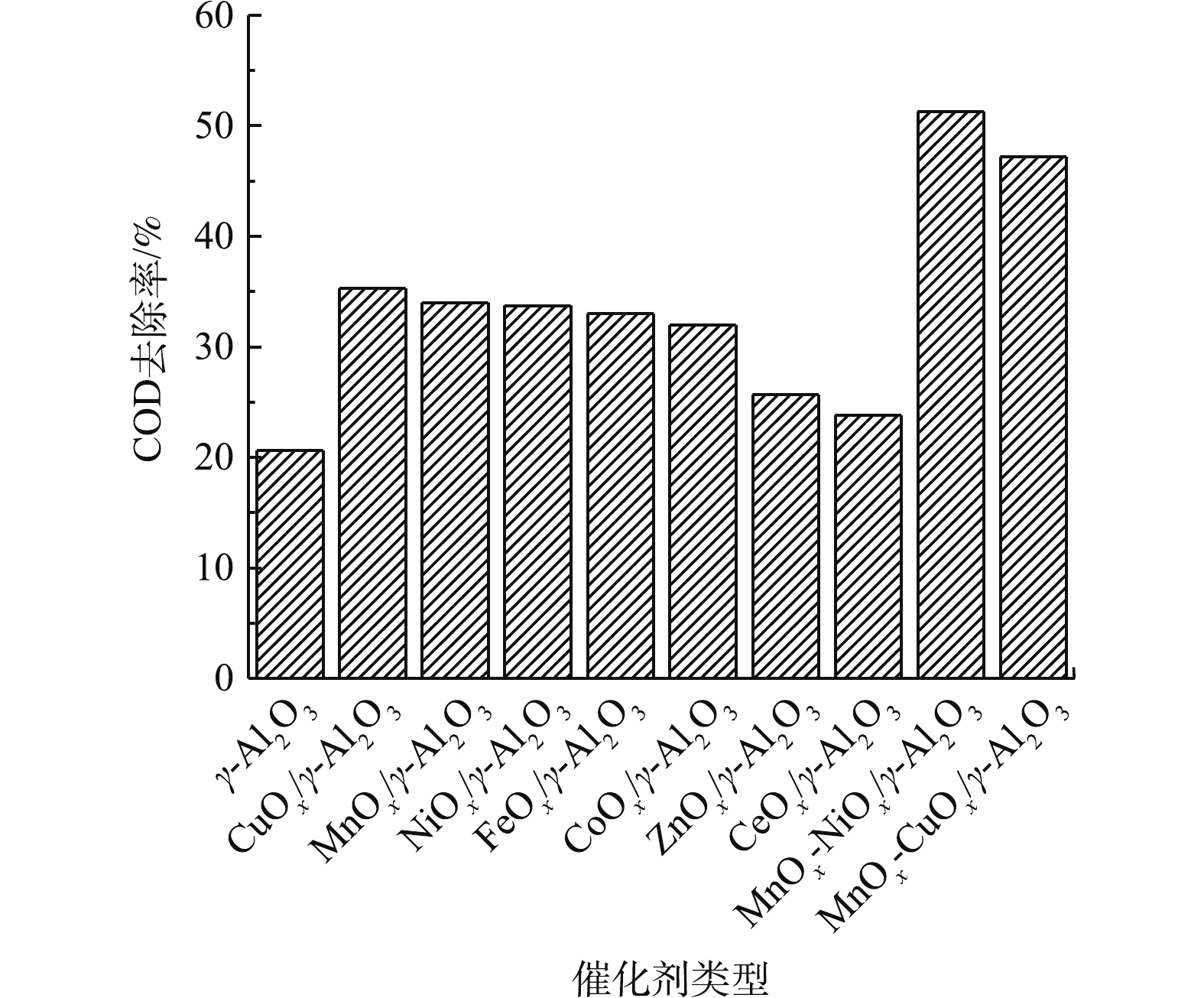
以活性氧化铝作为载体制得金属氧化物负载型催化剂,考虑的活性组分主要有稀土元素(Ce)、过渡金属(Mn、Fe、Cu、Ni、Co)。各种金属元素都以氧化物的形式负载于活性氧化铝上,以水样1作为目标污染物,以反应60 min COD去除率为评价因子,考察不同活性组分对催化剂催化性能的影响,结果如图2所示。实验发现在活性氧化铝表面负载活性组分后的催化活性明显强于未负载活性组分的情况。其中活性氧化铝负载Cu、Mn、Ni、Fe、Co的催化活性较高,反应60 min后,COD去除率分别为35.29%、34.01%、33.73%、33.01%、31.99%,明显强于负载Ce和Zn条件下的去除率,该结果和DHANDAPANI等[16]的研究结果一致。其可能的原因是,催化剂表面的羟基相当于Bronsted酸,金属离子和其中的不饱和氧原子相当于Lewis酸和碱,但由于不同氧化物的存在,使得催化剂表面的酸碱性有所不同,O3的作用方式不同,对产生羟基自由基的促进作用就会有所差别。由于铜、锰、镍氧化物的催化活性高和不饱和氧原子反应较快,且给出质子的倾向较强,因此,在臭氧的结合下对COD的去除效果最好。锰、镍等活性组分存在多种价态,金属氧化物价态变化所转移的电子促进臭氧分子分解产生·OH,有利于有机污染物的降解[17-18]。
此外,前30 min,COD去除较快,之后去除率变化较小。这主要是因为反应开始前,废水pH为8.56,碱性条件有利于臭氧与水溶液中的OH−反应产生·OH,故初始反应速率较快。随着反应的进行,废水中的有机物逐渐被降解为小分子有机酸、醛、酮,致使废水的pH降低至6以下,从而导致表面(S)直接吸附臭氧分子释放出一个氧气分子而不产生·OH,导致催化活性降低,反应如式(1)~式(3)所示。在30 min后,去除率接近稳定[19]。
-
采用BET对活性氧化铝载体催化剂的比表面积、孔容和平均孔径进行检测,结果表明,MnOx-NiOx/γ-Al2O3的比表面积为153.525 m2·g−1,孔容为0.421 cm3·g−1,平均孔径为6.858 nm,γ-Al2O3的比表面积为189.997 m2·g−1,孔容为0.481 cm3·g−1,平均孔径为6.325 nm。相比未负载的活性氧化铝,MnOx-NiOx/γ-Al2O3的比表面积和孔容降低,平均孔径增加,可能的原因是锰、镍等活性金属进入氧化铝的中孔内,起到了一定的孔支撑作用。同样活性金属进入中孔内,阻塞了一些中孔通道,导致催化剂比表面积和孔容降低。而且比表面积越大,越有利于臭氧分子的吸附,增加了臭氧在水中的溶解度,有利于传质反应的进行;同时强化了臭氧分子与催化剂表面活性位点的接触,促进了臭氧分子分解产生·OH[20]。
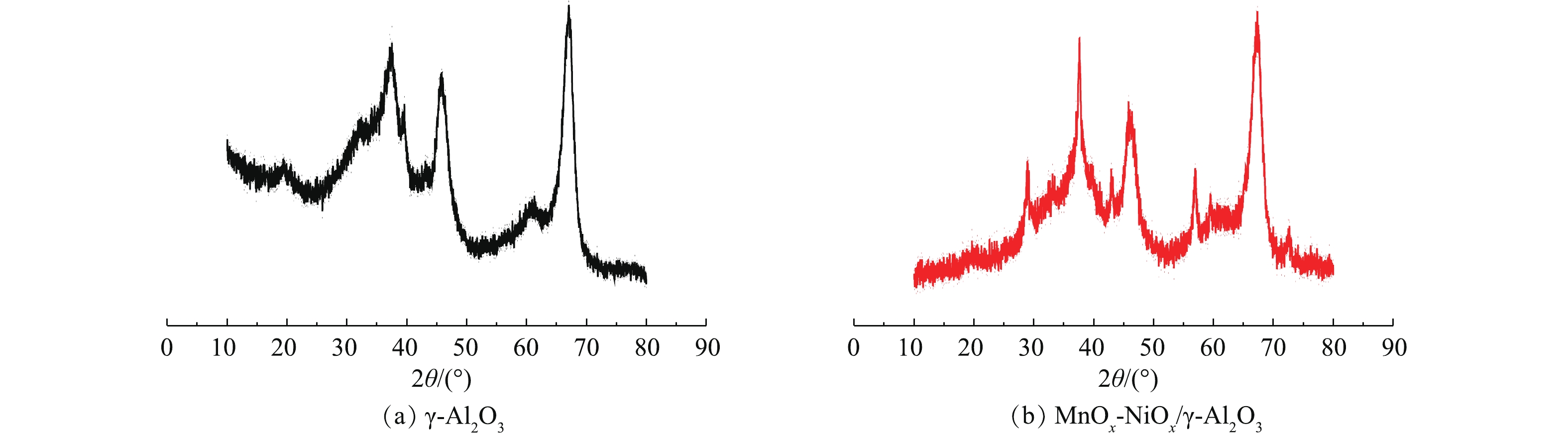
图3为γ-Al2O3、MnOx-NiOx/γ-Al2O3的XRD图谱。由图3(b)可知,对于MnOx-NiOx/γ-Al2O3,在29.1°和56.8°附近出现的衍射峰主要对应于四方α-MnO2(JCPDS 42-1169)。以上结果表明,负载的Mn主要以四方α-MnO2存在。在MnOx-NiOx/γ-Al2O3的XRD图谱中未出现NiOx明显的特征峰,这可能是镍元素含量过低导致的。在2种催化剂的XRD图谱中均出现了γ-Al2O3的特征衍射峰(2θ为67.13°、45.99°、37.56°),由Jade5.0软件根据Sherrer公式计算晶粒尺寸大小,γ-Al2O3和MnOx-NiOx/γ-Al2O3的平均晶粒分别为23.9 nm和22.8 nm,由此可知,负载Mn、Ni后,γ-Al2O3催化剂晶粒略有减小,这与BET结果相吻合。
图4为各催化剂的SEM表征图。由图4(a)和图4(b)可知,500 ℃活化的γ-Al2O3和MnOx-NiOx/γ-Al2O3均具有多孔表面,而后者被紧密堆积的层状颗粒覆盖,如报道的典型MnOx的形态。鉴于XRD图谱中未出现NiOx的特征峰,进一步采用EDS对MnOx-NiOx/γ-Al2O3进行元素含量测试,结果显示,MnOx-NiOx/γ-Al2O3中Mn和Ni的元素含量分别为2.73%和1.22%,2种元素摩尔比接近2∶1,这说明负载效果较好。
-
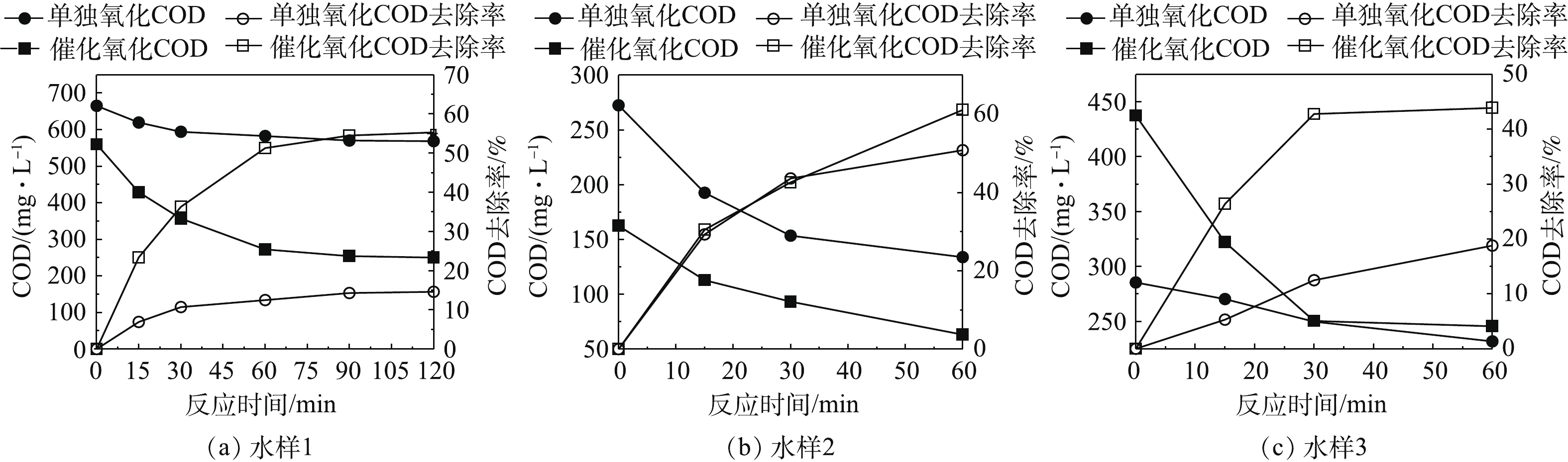
固定催化剂投加量为50 g·L−1废水,臭氧投加量为180 mg·(L·h)−1,分别比较了臭氧单独氧化与臭氧催化氧化(以MnOx-NiOx/γ-Al2O3为催化剂)对3种实际废水的COD去除效果,结果如图5所示。结果表明,对于不同废水,臭氧催化氧化均比臭氧单独氧化去除COD效果更好。对于水样1,反应60 min后,O3单独氧化对于COD去除率仅为12.5%,这是由于臭氧难以直接矿化污染物,更多的是产生了氧化中间产物,而催化氧化去除率为51.3%,比前者高38.8%;对于水样2和水样3,臭氧催化氧化COD去除率分别比单独臭氧氧化高出10.3%和25.1%,这说明臭氧催化氧化能有效去除煤化工高盐废水的COD。通过添加催化剂能明显改善COD的去除率,这是由于3种组分在一定的配比下具有良好的协同作用,能提高臭氧快速分解产生·OH的能力,而且在非均相O3催化氧化降解有机污染物过程中,金属氧化物在水溶液中由于水合作用,在其表面覆盖羟基,这些羟基形成具有孤对电子或π电子的吸附中心,可使有机物吸附于催化剂表面。同时,金属氧化物表面的羟基也是O3在催化剂表面产生·OH的活性点,从而O3在催化剂表面分解为具有更强氧化作用的·OH活性物种,生成的·OH可以在催化剂表面和溶液中引发自由基链式反应,实现有机污染物降解[21-22]。
-
本研究对比了单独氧化和臭氧催化氧化2种体系中臭氧的利用效率。在臭氧催化氧化过程中,臭氧在气相和液相中存在质量平衡,计算方法[23]见式(4)。
式中:CT、CO、CR和CD分别为初始加入、排出、残余和消耗的臭氧浓度,mg·L−1。CD可按式(5)进行计算。
则臭氧的利用效率(
Ru )计算方法[24]见式(6)。式中:
v 为气体流速,m3·s−1;V为溶液体积,m3。臭氧单独氧化和臭氧催化氧化去除单位质量COD所消耗的臭氧量的计算方法见式(7)。式中:η为臭氧消耗量与COD去除量的比值;
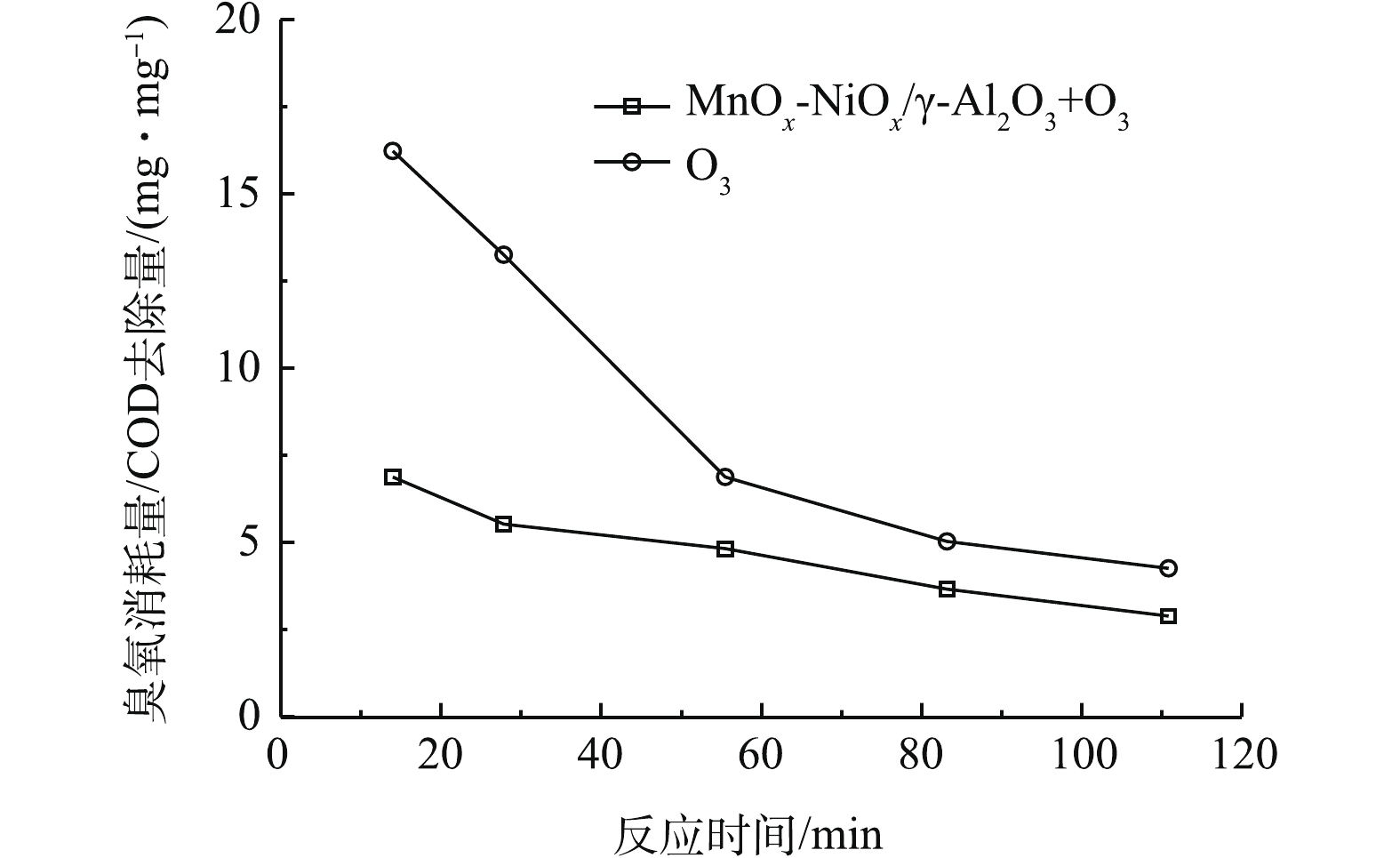
C0 为初始状态废水的COD,mg·L−1,Ct 为反应t时间后废水的COD,mg·L−1。如图6所示,在15~120 min处理过程中,MnOx-NiOx/γ-Al2O3臭氧催化氧化得到较低的η。在不同的臭氧化体系中,易降解物质在初始阶段逐渐被降解。随着时间的推移,废水中的易降解物质逐渐被消耗,难降解物质相对含量增多,η逐渐降低,但MnOx-NiOx/γ-Al2O3臭氧催化氧化的η仍然低于单独的臭氧氧化,这意味着MnOx-NiOx/γ-Al2O3催化剂可以有效地将臭氧分解成活性氧(ROS)而有利于废水中污染物的降解。
-
以水样1为目标污染物,固定臭氧投加量为350 mg·(L·h)−1,催化剂分别投加50 g·L−1废水和100 g·L−1废水,考察催化剂投加量对废水COD去除率的影响,实验结果如图7所示。结果表明,在30 min之前,随着催化剂投加量的增多,COD去除率增加,这可能是由于催化剂投加量的增加,活性位点增多,碰撞和接触概率增大,能吸附更多的有机物和臭氧,生成更多的·OH。但是随着时间到达60 min,COD的去除率随臭氧投加量的增多变化不明显,可能的原因是催化剂的活性位点已不是限制催化反应的主要因素,臭氧的投加量等成为主要的限制因素。另外,过多的催化剂投加量还会降低臭氧的传质效率,从而降低臭氧的利用率,这和图6的实验结论相一致,因此,催化剂最佳投加量应为100 g·L−1。
以水样1为目标污染物,固定催化剂投加量为100 g·L−1废水,考察臭氧投加量对COD去除率的影响,实验结果如图8所示。由图8可知,COD去除率随着臭氧投加量的增加而增加,当臭氧投加量为180、274和350 mg·(L·h)−1时,反应180 min后,COD去除率为55.3%、60.9%和72.3%。这主要是因为随着臭氧投加量的增多,溶解在水中的臭氧量增加,在催化剂的作用下,产生更多的·OH,从而有利于COD去除率的提高,因此,臭氧最佳投加量应为350 mg·(L·h)−1。
-
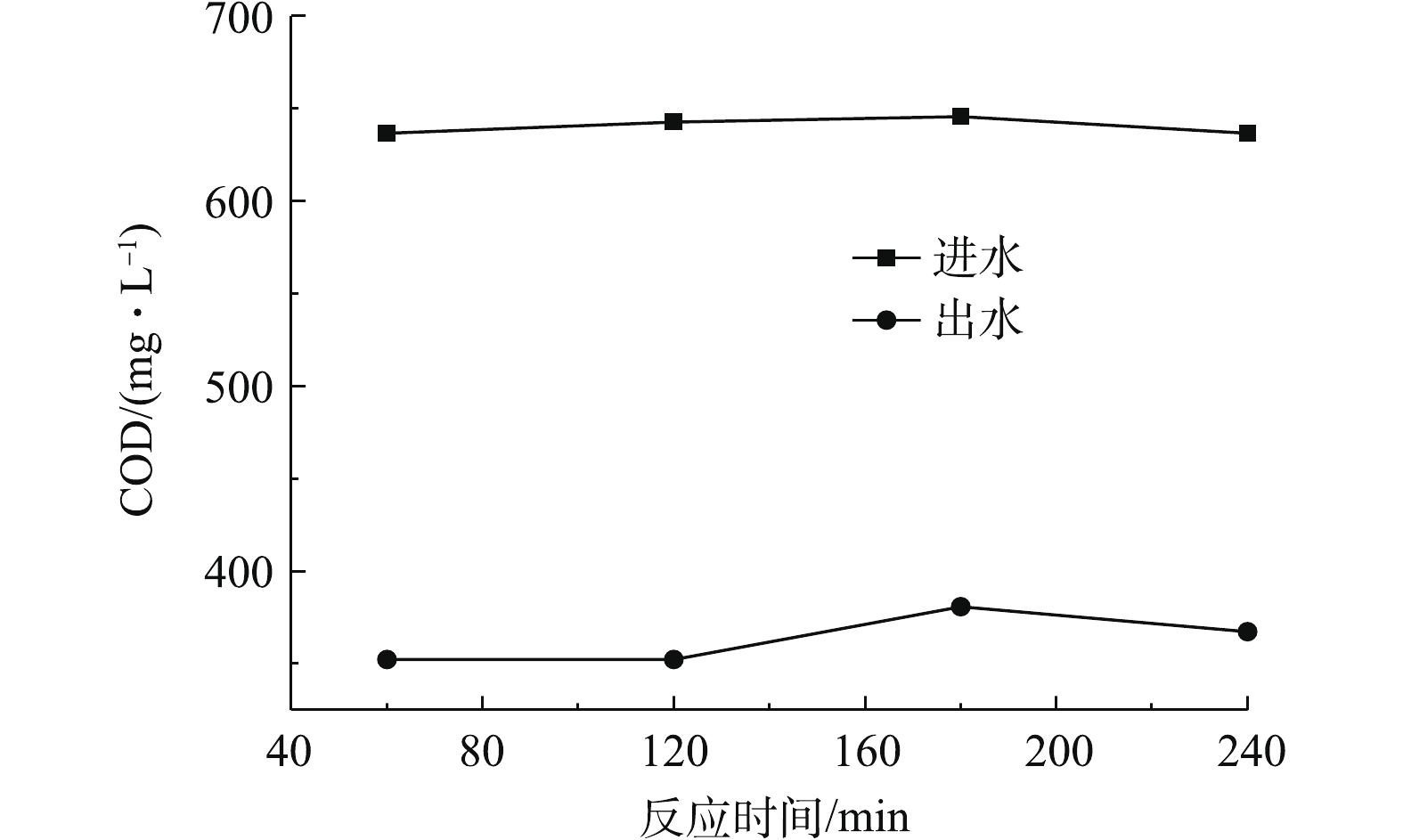
以水样1为目标污染物,固定催化剂投加量为120 g,废水流量为1.2 L·h−1,连续进水、出水,废水下进上出,反应器底部曝气,O3投加量约为300 mg·L−1,实验结果如图9所示。可以看出,进水COD约为640 mg·L−1时,出水COD稳定在350~380 mg·L−1,其去除率为41%~45%,催化剂催化性能变化较小。采用原子吸收光谱仪每隔60 min测定实验过程中锰、镍活性组分在水中的溶出情况,结果表明,锰镍离子在水中的含量均小于0.5 mg·L−1,这说明该催化剂的稳定性较好,重复利用性较高。
-
1)活性氧化铝载体催化性能优于陶粒,活性氧化铝负载Cu、Mn、Ni的催化活性较高,将活性组分进行组合制得的MnOx-NiOx/γ-Al2O3催化剂,60 min的臭氧催化氧化能有效去除51.3%的COD。
2)利用BET、SEM-EDS、XRD对催化剂进行表征和分析。结果表明,Mn、Ni成功负载到活性氧化铝表面和孔隙内,2种元素负载量摩尔比约为2∶1,且主要以氧化物形式存在。
3)通过计算臭氧利用效率发现,MnOx-NiOx/γ-Al2O3臭氧催化氧化的臭氧利用效率低于单独的臭氧氧化,这意味着通过MnOx-NiOx/γ-Al2O3催化剂可以有效地将臭氧分解成活性氧。
4)通过优化臭氧投加量和催化剂投加量发现,催化剂投加量为100 g·L−1废水,臭氧投加量为350 mg·(L·h)−1时,反应180 min后COD去除率能达到72.3%。
5)连续进行4 h的臭氧催化氧化实验后发现,MnOx-NiOx/γ-Al2O3稳定性和重复利用性较好,COD去除率能维持在42%左右不变,锰、镍离子的溶出量均小于0.5 mg·L−1。
煤化工高盐废水臭氧催化氧化脱除COD
COD removal from high-salt wastewater in coal chemical industry by ozone catalytic oxidation
-
摘要: 针对煤化工高盐废水中有机物难降解问题,采用浸渍-煅烧法制备了负载有活性金属氧化物的活性氧化铝型催化剂,探索催化剂的制备工艺和反应操作条件对废水COD去除率的影响。结果表明:活性氧化铝载体催化性能优于陶粒,活性氧化铝负载Cu、Mn、Ni的催化活性较高,将2种活性组分进行组合制得的MnOx-NiOx/γ-Al2O3催化剂,在经过60 min的臭氧催化氧化后,COD的去除率可达51.3%;利用BET、SEM-EDS、XRD对催化剂进行了表征和分析,Mn、Ni成功负载到活性氧化铝表面和孔隙内,2种元素负载量摩尔比约为2∶1,且主要以氧化物形式存在;通过计算臭氧利用效率,发现MnOx-NiOx/γ-Al2O3臭氧催化氧化的η值低于单独的臭氧氧化,这意味着通过MnOx-NiOx/γ-Al2O3催化剂可以有效地将臭氧分解成活性氧;通过优化臭氧和催化剂投加量后发现,在臭氧为350 mg·(L·h)−1、催化剂投加量为100 g·L−1废水中,反应180 min后,COD去除率可达到72.3%;在连续进行4 h的臭氧催化氧化实验后,MnOx-NiOx/γ-Al2O3稳定性和重复利用性均较好,COD去除率能维持在约42%,锰、镍离子的溶出量均小于0.5 mg·L−1。以上研究结果可为高效的臭氧催化体系在煤化工高盐废水处理领域的应用提供参考。
-
关键词:
- 煤化工高盐废水 /
- MnOx-NiOx/γ-Al2O3催化剂 /
- COD去除率 /
- 臭氧催化氧化
Abstract: Aiming at the problem of refractory degradation of organic matters in high-salt wastewater from coal chemical industry, an active alumina-type catalyst loaded with active metal oxide was prepared by an impregnation-calcination method. The effects of catalyst preparation and reaction conditions on COD removal rate from wastewater were investigated. The experimental results showed that the catalytic performance of activated alumina carrier was better than that of ceramsite, and activated alumina supported with Cu, Mn, Ni had high catalytic activity, of which the MnOx-NiOx/γ-Al2O3 catalyst prepared by the combination of the two active components could catalyze the ozone oxidation reaction with 51.3% COD removal after 60 minutes. The catalyst was characterized and analyzed by BET, SEM-EDS, XRD. The results showed that Mn, Ni elements were successfully loaded on the surface and pores of activated alumina, and their molar ratio was about 2∶1, and their oxide forms mainly appeared. Through calculating the ozone utilization efficiency, the η value of the MnOx-NiOx/γ-Al2O3 catalyst was lower than that of ozone alone. This implied that the MnOx-NiOx/γ-Al2O3 catalyst could effectively decompose ozone into ROS. After optimizing the dosage of ozone and the dosage of the catalyst, the optimum dosages of catalyst and ozone were 100 g·L−1 and 350 mg·(L·h)−1, respectively, at which the COD removal rate could reach 72.3% after 180 min reaction. After 4 hours ozone catalytic oxidation, the stability and reusability of MnOx-NiOx/γ-Al2O3 were good, COD removal rate maintained about 42% and the release amounts of manganese and nickel ions were less than 0.5 mg·L−1. This study can provide a reference for the development of an efficient ozone catalytic system and its application in the field of high-salt wastewater treatment in the coal chemical industry. -
抗生素作为一类新兴的药物和个人护理产品(pharmaceutical and personal care products,PPCPs)[1-2],被广泛用于治疗和预防人体、畜禽和水产品的疾病和细菌性病害。近年来,由于新兴冠状病毒肺炎(corona virus disease 2019,COVID-19)疫情的爆发,世界各地抗生素的使用急剧增加[3],由抗生素类毒物引起的水生环境污染问题也已成为全世界备受关注的问题[4]。
由于抗生素类药物分子结构稳定,被食用后不易被生物体完全吸收,会以代谢活性产物甚至原结构形式排出体外进而释放到环境中[5-6]。此外,未使用或过期的药物以及生产废水的不当处理使更多的抗生素进入自然水系统中,包括饮用水源[7-8]。据估计,2013年共有53 800 t抗生素被释放到中国的河流和水道中[9]。联合国的“2017年前沿报告”指出,水产养殖中75%的抗生素可能会流失到周围环境中[10],这对生态系统和人类健康均存在潜在的威胁[11-12]。因此,对水体中抗生素的去除很有必要。然而,常规水处理工艺对这类痕量污染物去除效果有限[13-14],一些深度处理技术例如膜处理技术、臭氧技术、吸附技术、电化学氧化技术等,在处理抗生素时虽然可以实现一定程度的降解[15],但存在着处理费用高、操作过程复杂、稳定性低、再循环能力差等问题,这也对世界各国抗生素污水的处理提出了新的挑战。
近年来,基于TiO2的光催化技术由于其有效性、低成本、高稳定性和环境友好性被广泛用于光催化降解含抗生素类废水。将TiO2纳米粒子通过水热处理制备得到的钛酸纳米材料(titanate nanomaterials,TNM)通常具有较大的比表面积和精细的纳米级结构,具有良好的去除多种污染物的性能[16]。但是,由于纳米TiO2光催化剂的带隙(Eg)(3.2~3.4 eV)较大,只对波长低于380 nm的紫外光有响应,以及快速的电子-空穴对复合速率,使得TiO2和TNM的可见光响应较弱,从而限制了其在太阳/可见光下的应用[17-18]。因此,开发新兴、高效的催化剂成为近年来研究的热点。研究人员利用将光催化剂与金属和非金属掺杂、设计和构建异质结等方法,合成了大量的TiO2基光催化材料[19],并应用于对水体中各类有机污染物的高效去除。
本研究中通过将铌酸盐作为光反应促进剂掺入钛酸盐中,水热法合成一类新型片状纳米复合材料-铌酸盐/钛酸钠米片(niobate/titanate nanoflakes,Nb-TiNFs),利用 XRD、XPS、FT-IR、SEM、TEM等多种手段对Nb-TiNFs材料进行表征和分析。选取氟喹诺酮类抗生素的代表环丙沙星(ciprofloxacin,CIP)作为目标污染物,探究了Nb-TiNFs在模拟日光下对水中CIP的光催化性能和机理,以期为光催化降解水中新兴有机污染物提供参考。
1. 材料与方法
1.1 试剂与仪器
试剂:二氧化钛(TiO2(P25),德国Degussa 公司)、五氧化二铌(Nb2O5,国药集团化学试剂有限公司)、环丙沙星(C17H18FN3O3,上海阿拉丁试剂)、对苯醌(C6H4O2,天津市清华津英科技有限公司)、碘化钾(KI,天津市北联精细化学品开发有限公司)、叔丁醇(C4H10O,天津市恒兴化学试剂制造有限公司)、呋喃甲醇(C5H6O2,上海吉至生化科技有限公司)、无水乙醇(CH3CH2OH,天津市富宇精细化工有限公司)、氢氧化钠(NaOH,上海阿拉丁试剂)、盐酸(HCl,国药控股有限公司),氯化钠(NaCl,天津市大茂化学试剂厂)、氯化钙(CaCl2,天津市恒兴化学试剂制造有限公司)、氯化铁(FeCl3,上海吉至生化科技有限公司)均为分析纯,乙腈(C2H3N,赛默飞世尔科技(中国)有限公司)、甲酸(CH2O2,赛默飞世尔科技(中国)有限公司)均为色谱纯。
仪器:电子分析天平(BSA224S,赛多利斯科学仪器(北京)有限公司),pH计(FE28,梅特勒-托利多仪器(上海)有限公司),高速离心机(KH20R,湖南凯达科学仪器有限公司),磁力搅拌器(78-1,常州荣华仪器制造有限公司),电热鼓风干燥箱(GZX-9023MBE,上海博讯实业有限公司医疗设备厂),300W氙灯弧光灯光源(Microsolar 300W 氙灯光源,泊菲莱),Zeta电位仪(Nano-ZS90,英国Malvern Instruments公司),X射线衍射仪(XRD)(D8 ADVANCE,德国Bruker公司),热场发射扫描电镜(SEM)(JSM-7001F,日本电子株式会社),高分辨透射电子显微镜(TEM)(JEM-2010,日本电子株式会社),X射线光电子能谱仪(XPS)(Thermo Scientific K-Alpha),傅里叶红外光谱仪(IRTracer-100 光谱仪,日本岛津),高效液相色谱法(HPLC,Agilent 1260,美国)。
1.2 Nb-TiNFs纳米材料的制备
采用一步水热法合成Nb-TiNFs纳米材料,具体步骤为:首先将0.8 g TiO2和0.2 g Nb2O5投加到66.7 mL的NaOH (10.0 mol·L−1 ) 溶液中,于25 ℃下放置于磁力搅拌器(500 r·min−1)上搅拌12 h。接着将混合均匀的溶液移入到100 mL的聚四氟乙烯内衬中,随后放置于不锈钢反应釜中,并置于烘箱中 (130 °C) 进行水热处理。72 h后,将反应釜自然冷却至室温,用去离子水反复洗涤几次至生成物近中性,用无水乙醇将生成物分散后置于烘箱中80 °C烘干,研磨备用。
1.3 材料的表征
使用X射线衍射仪(XRD)对制备好的Nb-TiNFs进行晶体结构分析测定。将样品粉末用KBr压片法制成样品试片,在X射线衍射仪上检测产物的晶型,扫描范围2θ为10°~80°,扫描速度为4°·min−1。
使用扫描电镜(SEM)和透射电镜(TEM)对制备好的Nb-TiNFs进行形貌和微观结构分析;使用 X 射线光电子能谱法(XPS)表征表面化学组成,辐射源为单色 Al 的 Kl 射线,所有的结合能都以284.8 eV 的外来碳信号做内标进行校正以消除静电效应;使用傅里叶红外光谱仪测量样品的傅里叶变换红外光谱(FT-IR),以 KBr 为背景,制样中 KBr 与样品质量比为 100∶1,扫描范围为 400~4 000 cm−1;使用Zeta电位仪测量不同pH下的Zeta电位,将样品按照0.2 g·L−1的比例投入超纯水中制成悬浊液,用0.1 mol·L−1 HCl或0.1 mol·L−1 NaOH调节溶液pH,将确定pH的悬浊液注入Zeta电位仪的测量池,进行测量。
1.4 环丙沙星(CIP)降解实验
环丙沙星光催化降解实验在300W氙灯弧光灯光源下模拟太阳光(AM1.5模式)进行。称量0.015 g的催化剂,将其分散于150 mL 10 mg·L−1环丙沙星溶液中,用0.1 mol·L−1氢氧化钠和盐酸溶液调整pH。首先,将混合溶液在避光条件下搅拌30 min,使CIP在光催化剂上达到吸附平衡。然后,将反应器置于氙灯光源下,在预设时间间隔取样,样品过 0.22 μm 尼龙滤膜,用高效液相色谱仪测定滤液中CIP浓度。整个实验过程中采用循环冷却水装置以控制反应器温度为(25±1) °C。此外,在高效液相色谱法中使用ZORBAX SB-C18柱(250 mm×4.6,5 µm),柱温40°C,荧光检测器激发波长280 nm,发射波长450 nm。流动相体积分数为85%甲酸水(甲酸比例为0.1%),15%乙腈,流动相流速为0.25 mL·min−1,反应时间为240 min。CIP的降解率根据式(1)进行计算。
D=C0−CtC0×100% (1) 式中:D为降解率,%;C0是CIP的初始浓度,mg·L−1;Ct是t时刻CIP的浓度,mg·L−1。
1.5 溶液pH的影响
配置初始质量浓度为10 mg·L−1的环丙沙星溶液(150 mL),投加15 mgNb-TiNFs(催化剂质量浓度为0.1 g·L−1),用0.01 mol·L−1的 HCl 和 NaOH 溶液将反应体系的初始 pH 调节为2、4、6和8。经氙灯光源照射在预设时间间隔取样,过膜待测。
1.6 常规无机离子的影响
配置初始质量浓度为10 mg·L−1的环丙沙星溶液(150 mL),加入不同浓度水中常见无机离子(Na+、Ca2+和Fe3+)溶液,投加15 mg Nb-TiNFs(催化剂质量浓度为0.1 g·L−1),调节溶液pH为6。氙灯光源照射过程中在预设时间间隔取样,过膜待测。其中,Na+、Ca2+浓度分别设0.5、1和1.5 mmol·L−1三个梯度,Fe3+浓度设0.5、1和1.5 µmol·L−1,总反应时长为180 min。
1.7 淬灭实验
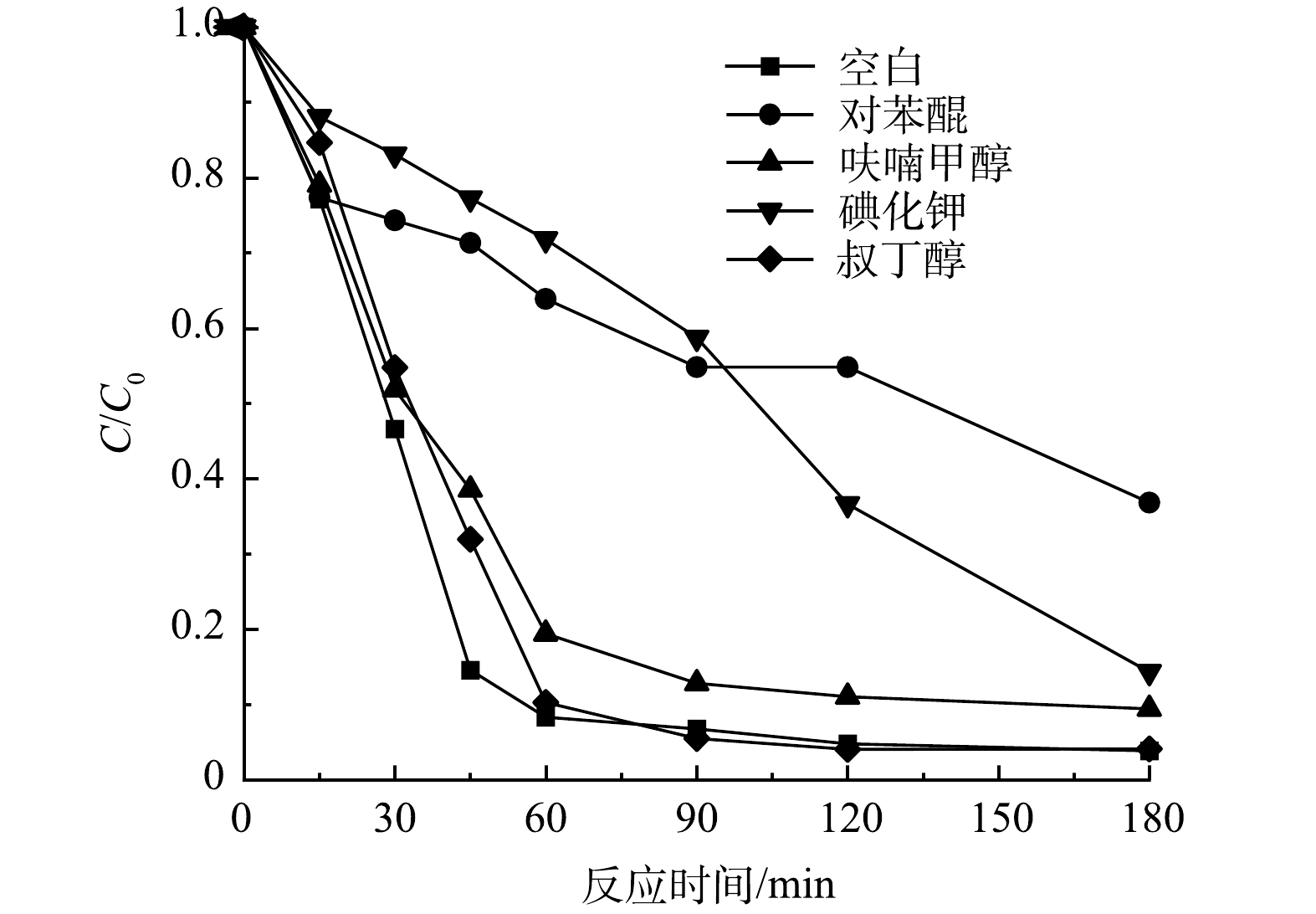
利用对苯醌(BQ)、碘化钾(KI)、呋喃甲醇(FA)和树丁醇(TBA)分别作为超氧自由基(·O2-),空穴(h+),单线态氧(1O2)和羟基自由基(·OH)的淬灭剂 ,考察不同可能存在的活性物种对环丙沙星去除率和降解速率的影响。在光催化反应开始前,加入活性物种淬灭剂 (0.01 mol·L−1 ) ,在设定时间取样过膜后检测。
1.8 催化剂重复利用实验
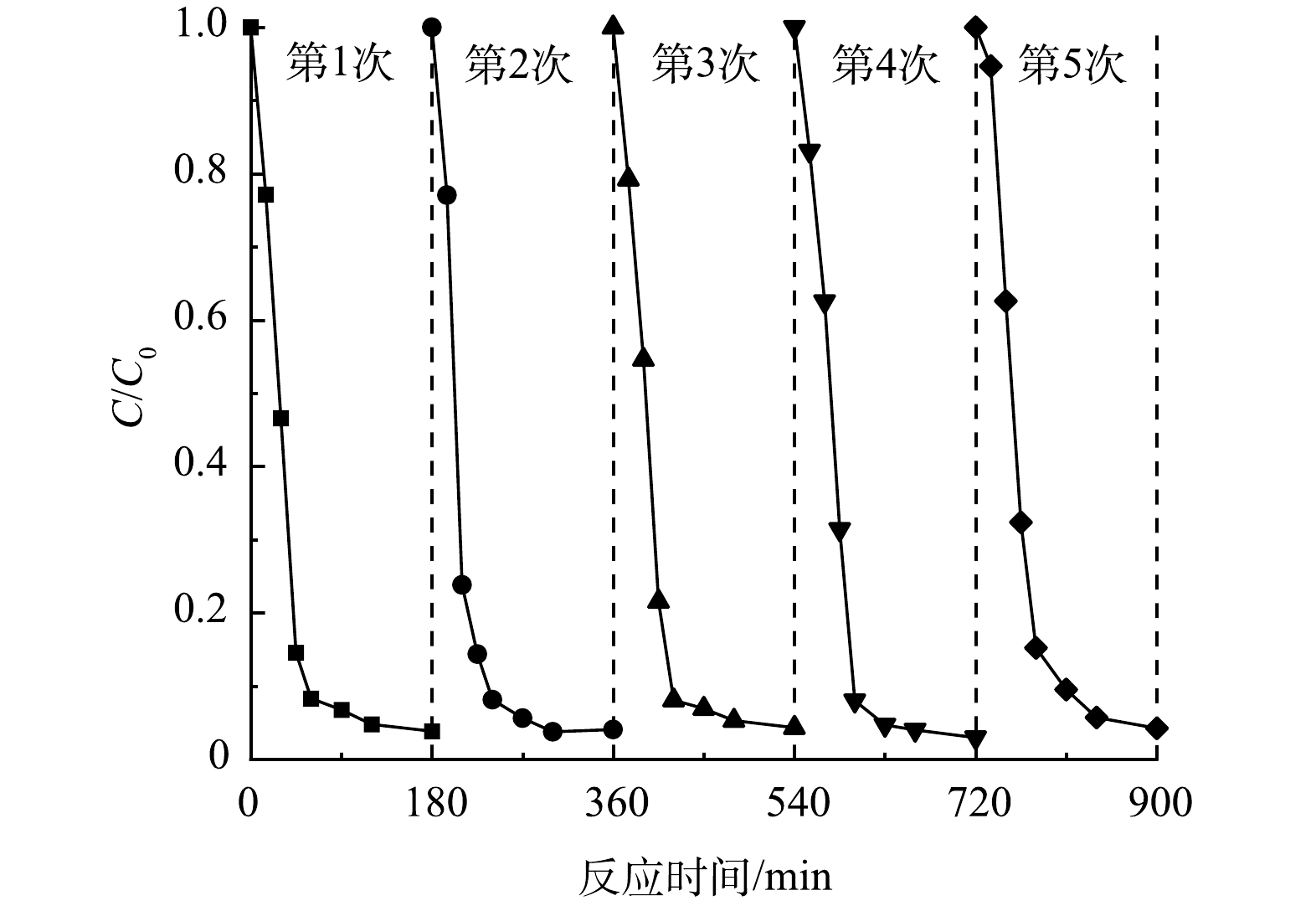
配置环丙沙星初始质量浓度为10 mg·L−1, Nb-TiNFs为0.1 g·L−1的溶液,调节pH为6,在氙灯光源照射下预设时间取样,过膜待测。180 min反应结束后,混合溶液经0.22 µm水系滤膜真空抽滤,将滤得的粉末纯水清洗、烘干后重复利用。通过 5 次连续循环实验探究材料的可重复利用性能。
2. 结果与讨论
2.1 催化剂的表征与分析
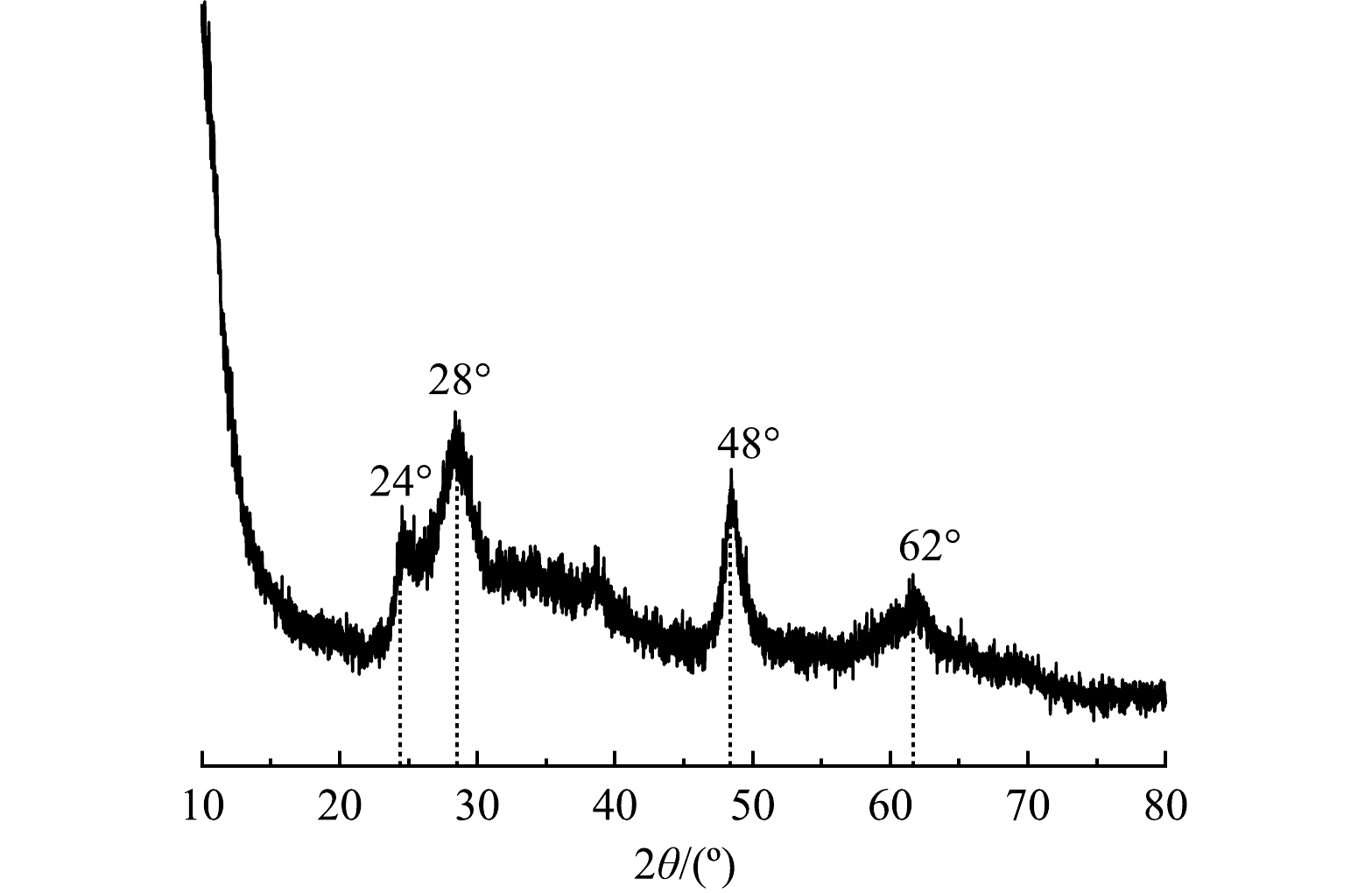
Nb-TiNFs的XRD表征结果如图1所示。可见,在2θ为24°、28°、48°、62°处的特征衍射峰说明Nb-TiNFs为钛酸钠的晶型,可用化学式Na2H2-xTi3O7 .n H2O表示(x取决于钠含量)[20]。因此,水热合成后生成的Nb-TiNFs主体为钛酸盐,该钛酸盐由三重的[TiO6]八面体(骨架)和层间可交换的Na+/H+组成[20-21]。另外,在Nb-TiNFs的XRD图谱中未检测到铌酸盐的特征峰。这可能是掺入铌的量较少,铌酸盐未形成晶体结构。
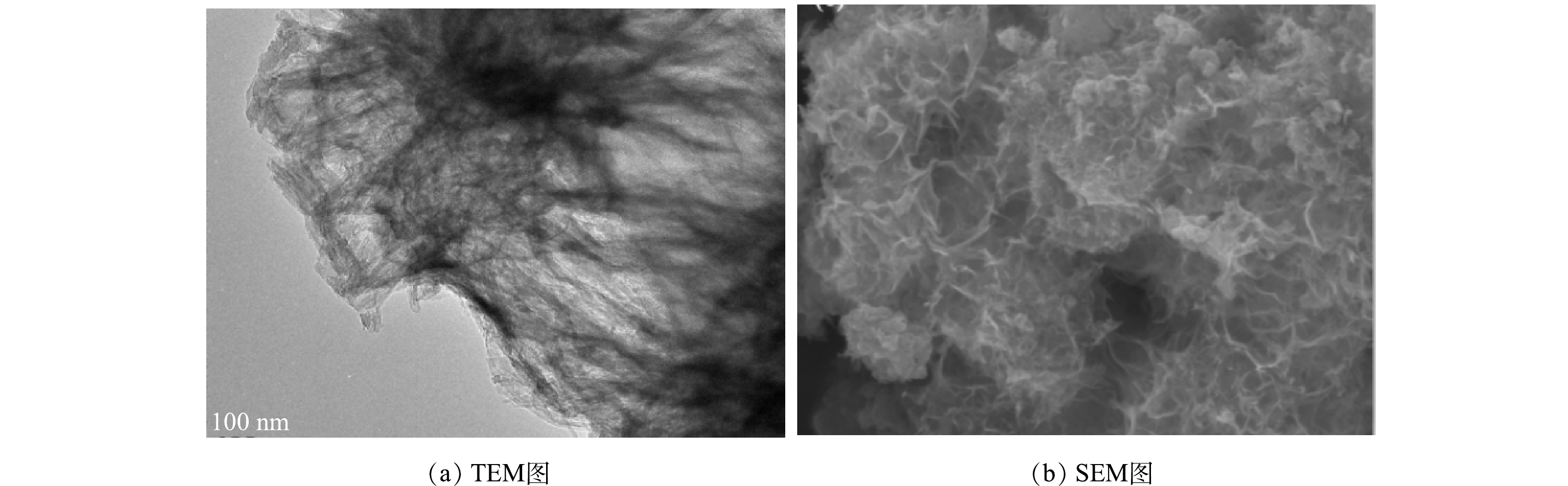
Nb-TiNFs的TEM和SEM表征结果分别如图2(a)和图2(b)所示。由图2(a)可以看出,复合材料呈现清晰的片状结构,可见其为钛酸钠米片结构。通常情况下,P25在130 °C和72 h的水热条件下可形成钛酸纳米管[22],而片状结构一般是形成管状结构前的中间产物。本研究中未成管的原因可能是Nb2O5的掺杂影响了复合材料的最终构型[23]。由图2(b)也可以看出,Nb-TiNFs呈片层无序堆叠形成的块状形态。
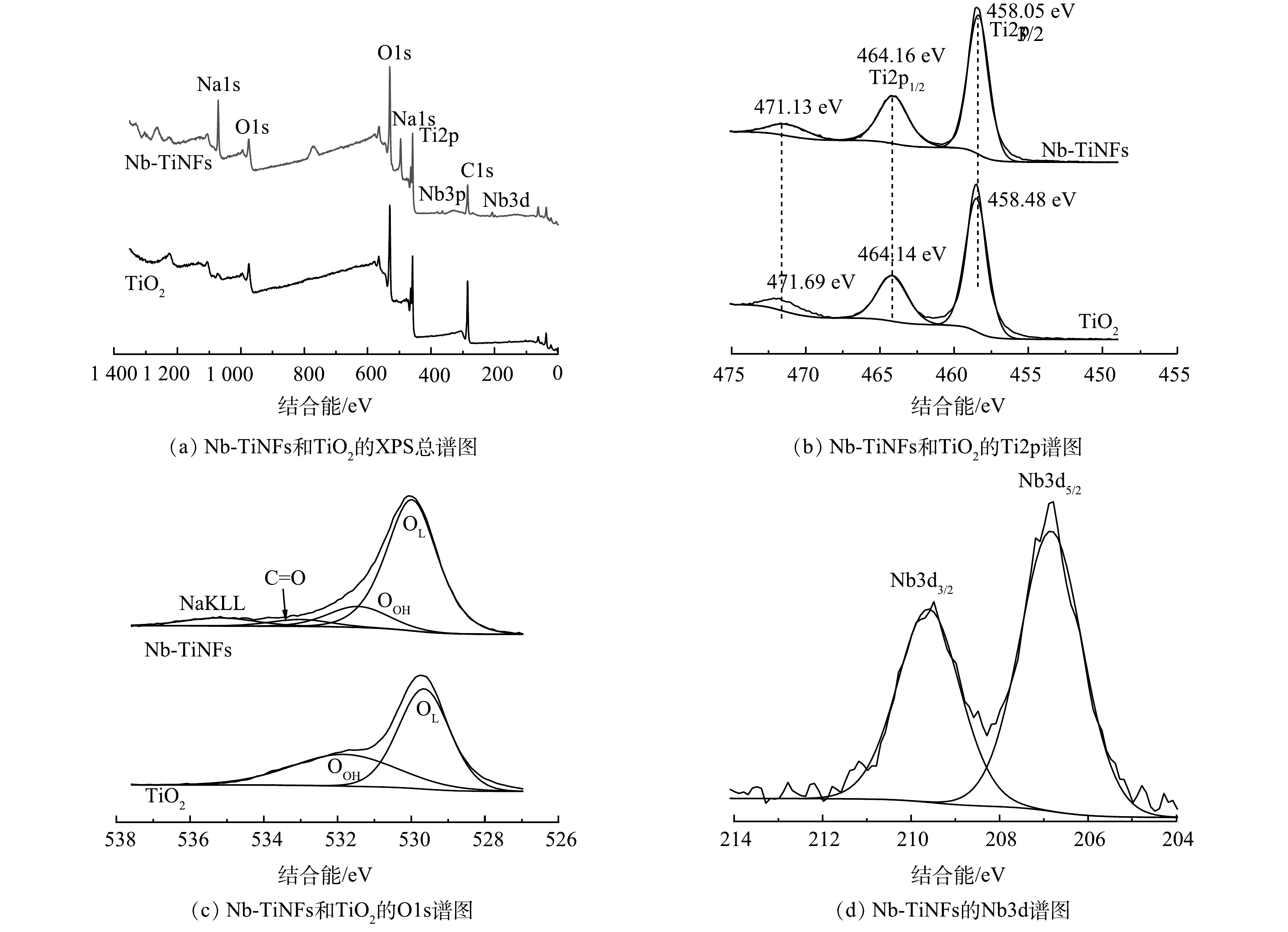
Nb-TiNFs和TiO2 的XPS谱图如图3所示,其中,图3(a)、图3(b)、图3(c)、图3(d)中的所有信号都经过了C1s校准。由XPS总谱(图3(a))中可以看出,Nb-TiNFs的主要元素是O(60.69%)、Ti(21.14%)、Na(17.23%)、Nb(0.95%),显然,在这种合成条件(130 ℃,72 h)下,钛酸盐的产率远远高于铌酸盐。在Ti2p谱图(图3(b))中,结合能分别位于458.05 eV和464.16 eV的 Ti2p3/2峰和 Ti2p1/2峰表明Nb-TiNFs中的Ti为Ti4+的特征[24]。在O1s谱图(图3(c))中,TiO2具有2个特征谱峰,其中,位于低结合能529.68 eV附近的信号峰对应于晶格氧(OL),位于高结合能531.82 eV附近的信号峰对应于材料表面吸附的羟基(·OH);Nb-TiNFs材料具有4个谱峰,其中低结合能530.0 eV附近处的信号峰对应于晶格氧(OL),高结合能531.4 eV附近的信号峰对应于材料表面吸附的羟基(·OH),533.0 eV处的信号峰对应C=O键的信号峰,535.2 eV处的信号峰对应NaKLL峰。在Nb3d谱图(图3(d))中,掺杂的Nb元素的Nb 3d3/2峰和Nb 3d5/2峰均以Nb5+的形式存在[25-28]。
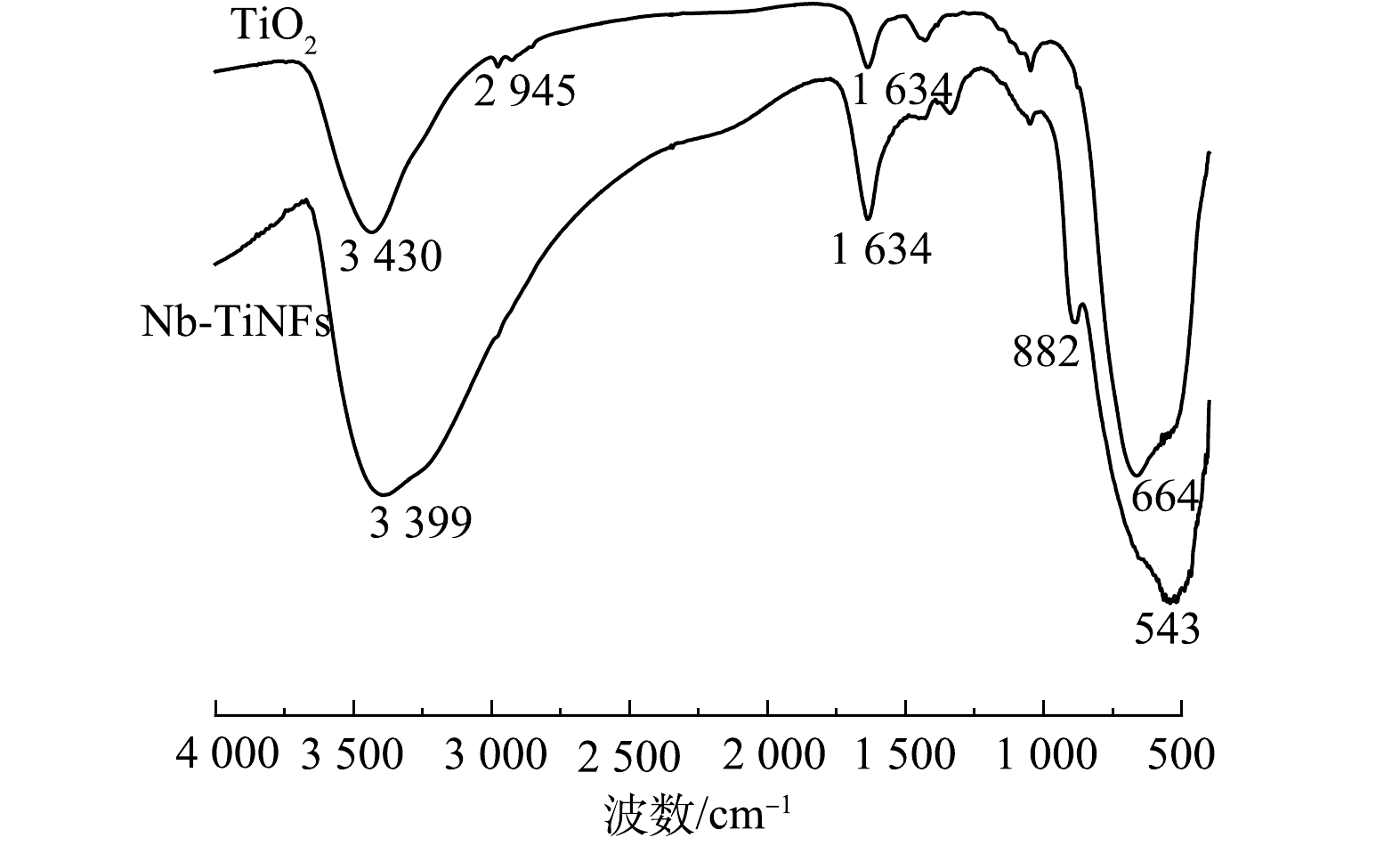
Nb-TiNFs和TiO2的红外图谱如图4所示,3 430 cm−1和3 399 cm−1附近的宽峰为 Ti-OH 及 吸 附 水 的—OH 伸缩振动峰,TiO2和Nb-TiNFs的峰有轻微偏移,可能是由于Nb的掺杂所导致。TiO2在2 945cm−1附近的峰为—CH2—的吸收峰,1 634 cm−1附近的峰为催化剂表面物理吸附水的H—O—H 弯曲振动峰,400~700 cm−1对应着金属氧化物键,664 cm−1 和 543 cm−1对应着Ti—O 键,882 cm−1处的峰对应着Nb—O键[29-30]。分析说明该催化剂表面存在较丰富的羟基官能团,而表面羟基有利于捕获光生空穴,生成强氧化性的羟基自由基,有利于光催化降解[31]。
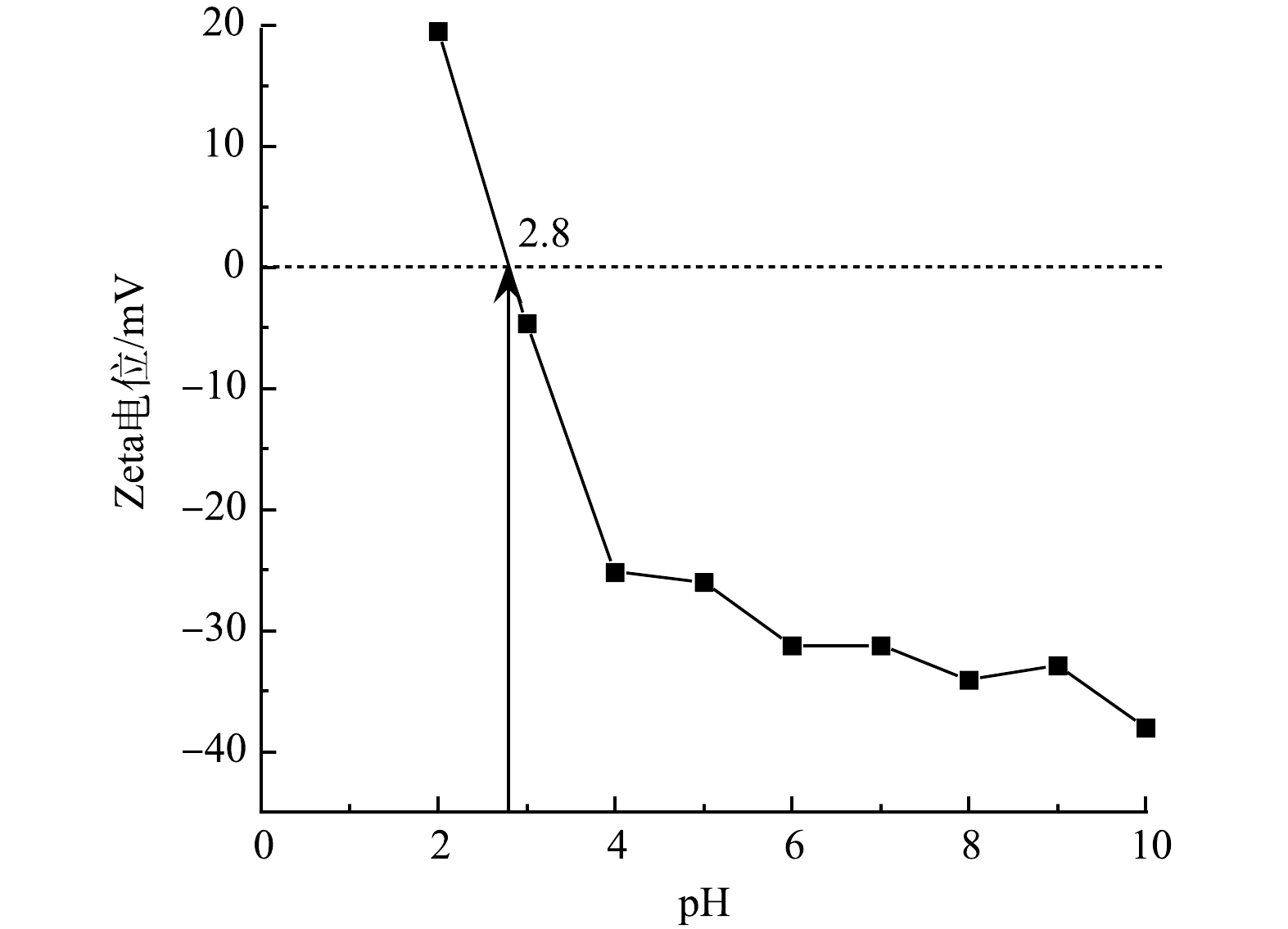
Nb-TiNFs在不同pH下的Zeta电位见图5。可见,Nb-TiNFs的等电点约为2.8。当溶液 pH 为2.8时,Nb-TiNFs所带电荷为零;当溶液pH 小于等电点时,导致碱性解离小于酸性解离, 则 Nb-TiNFs的 Zeta 电位为正值;当溶液pH 大于等电点时, 导致碱性解离大于酸性解离,则 Nb-TiNFs的 Zeta 电位为负值。因此,当pH<2.8时,Nb-TiNFs的表面带正电,当pH>2.8时,Nb-TiNFs的表面带负电。
2.2 光催化降解性能分析
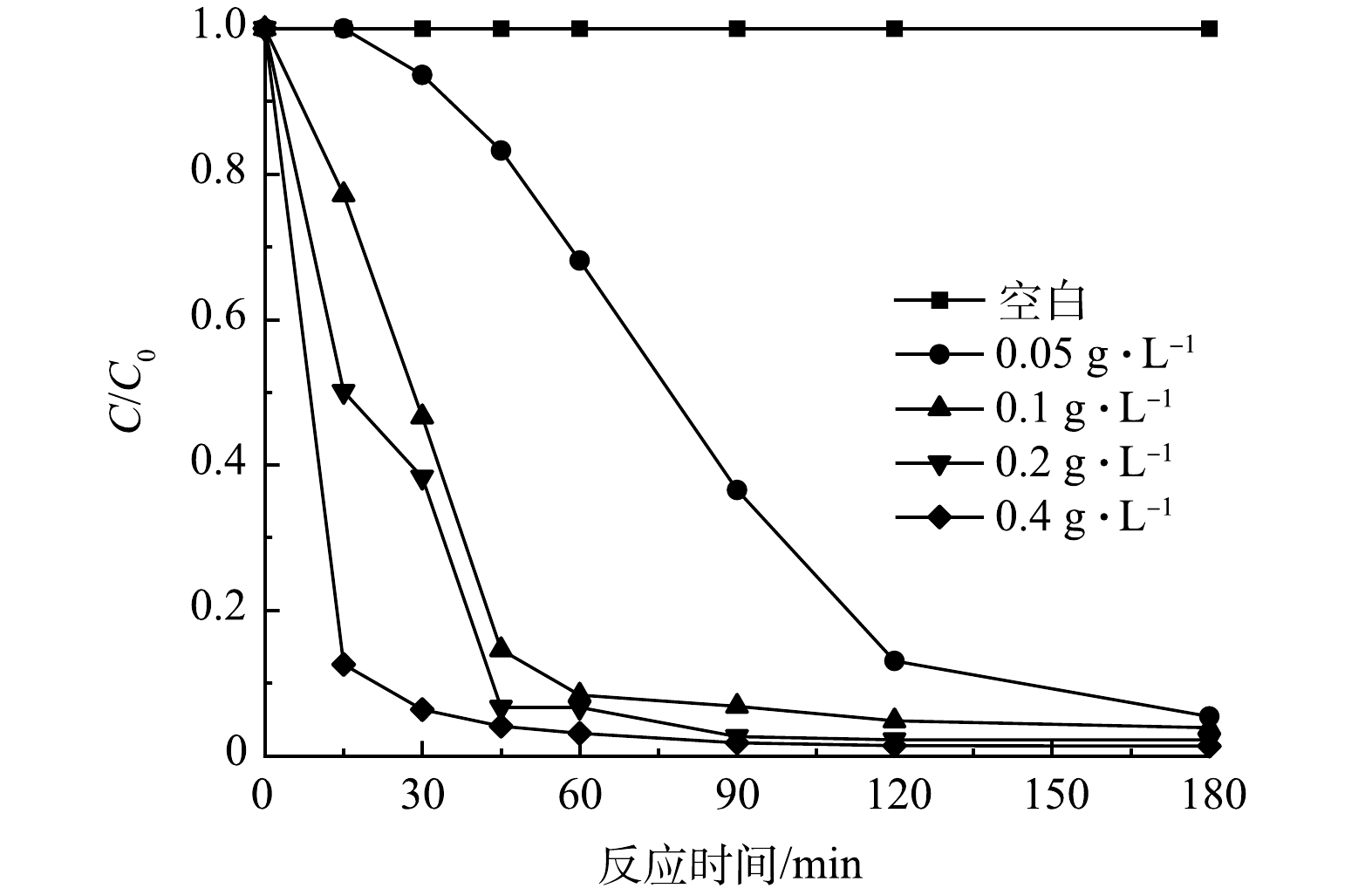
黑暗条件下的吸附预实验结果表明,CIP(初始质量浓度10 mg·L−1)在30min内达到吸附平衡,材料对CIP的吸附量为2.68%,可忽略不计。在光催化实验中,光催化剂的投加量是影响催化效率的1个重要因素[32]。图6反映了在CIP的初始质量浓度为10 mg·L−1,pH为6的条件下,催化剂质量浓度(0.05~0.4 g·L−1)对CIP降解的影响情况。结果表明,CIP的去除率随着光催化剂投加量的增加而升高,当催化剂质量浓度为0.05 g·L−1时,60 min内CIP的去除率为30.89%,催化剂质量浓度为0.1 g·L−1时,60 min左右CIP的去除率达到91.67%,催化剂的质量浓度增加到0.2 g·L−1和0.4 g·L−1时,60 min内去除率分别增至93.33%和96.92%。当催化剂为0.05、0.1、0.2 和0.4 g·L−1时,180 min后CIP的去除率分别为94.6%,96.1%,97.8%和98.7%。出于实际应用考虑, 0.1 g·L−1催化剂即可以满足应用需求,故之后的实验选用投加0.1 g·L−1光催化。
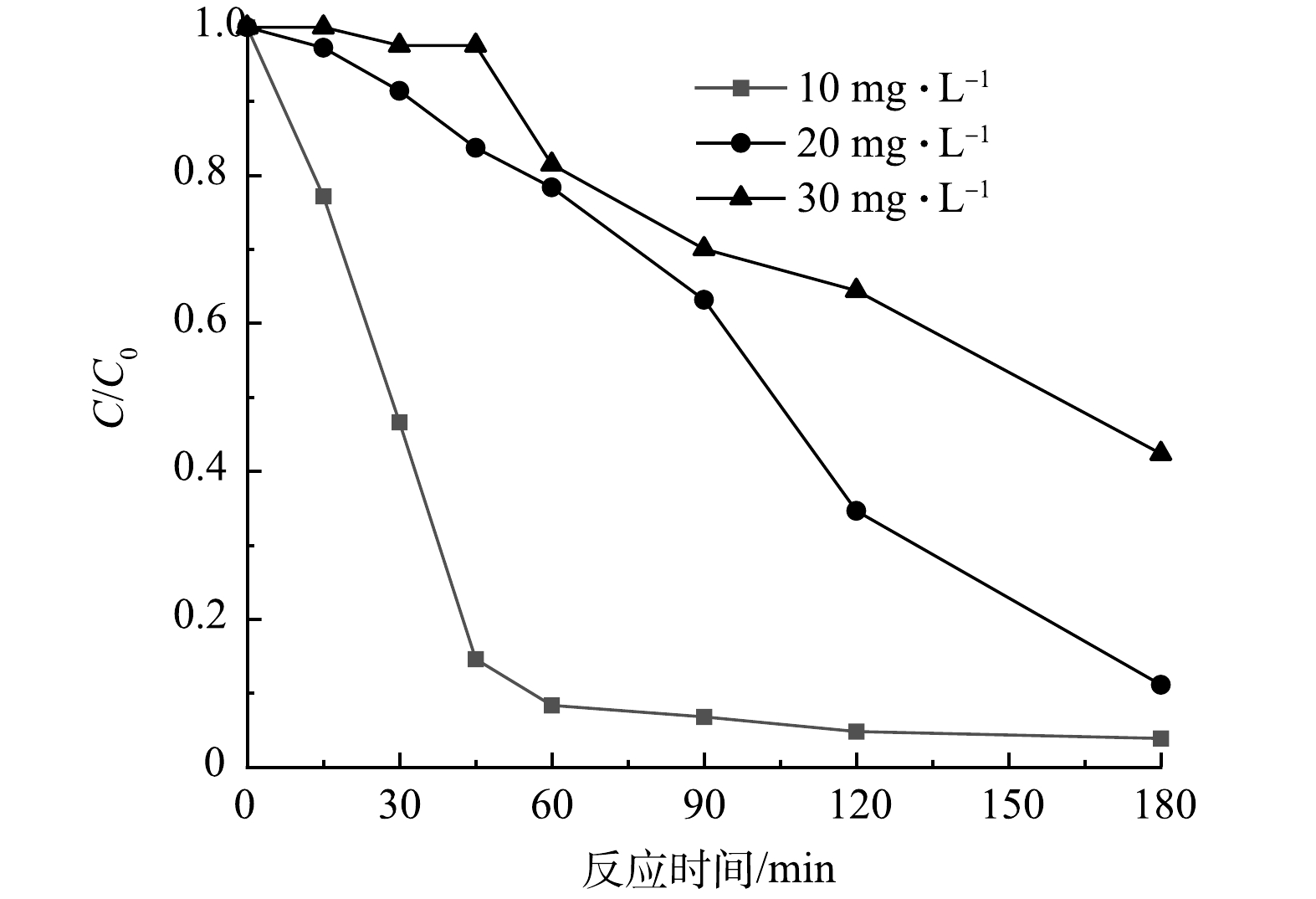
目标污染物的初始质量浓度也会对光催化剂的催化效率产生重要影响,为此,本研究考察了在相同催化剂浓度下不同初始质量浓度CIP的降解性能(图7)。如图7所示,当Nb-TiNFs为0.1 g·L−1、pH为6、CIP初始质量浓度为10 mg·L−1时,起初CIP被迅速降解,60 min左右即达到平衡,3 h后降解率达96%。随着CIP初始质量浓度升高,其降解率逐渐下降,当CIP质量浓度为20 mg·L−1和30 mg·L−1时,3 h后降解率分别下降至92%和56%。
为探究Nb-TiNFs在可见光驱动(visible light drive,VLD)下的降解性能,本研究使用UV滤光片(<420 nm)滤掉紫外光以考察Nb-TiNFs在可见光下对CIP的降解性能。如图8所示,在CIP初始质量浓度为10 mg·L−1,Nb-TiNFs质量浓度为0.1 g·L−1,pH为6的条件下,当使用滤光片反应180 min后,CIP的去除率由96.1%降至46.1%。因此,在日光下,可见光CIP的去除贡献为46.1%,紫外光的去除贡献为50%。如前所述,TiO2基光催化剂只对紫外光响应[17-18],而Nb-TiNFs材料对CIP的降解过程中虽然紫外光仍起着重要作用,但结果表明,铌酸盐的掺入一定程度上增强了材料的可见光驱动性能。
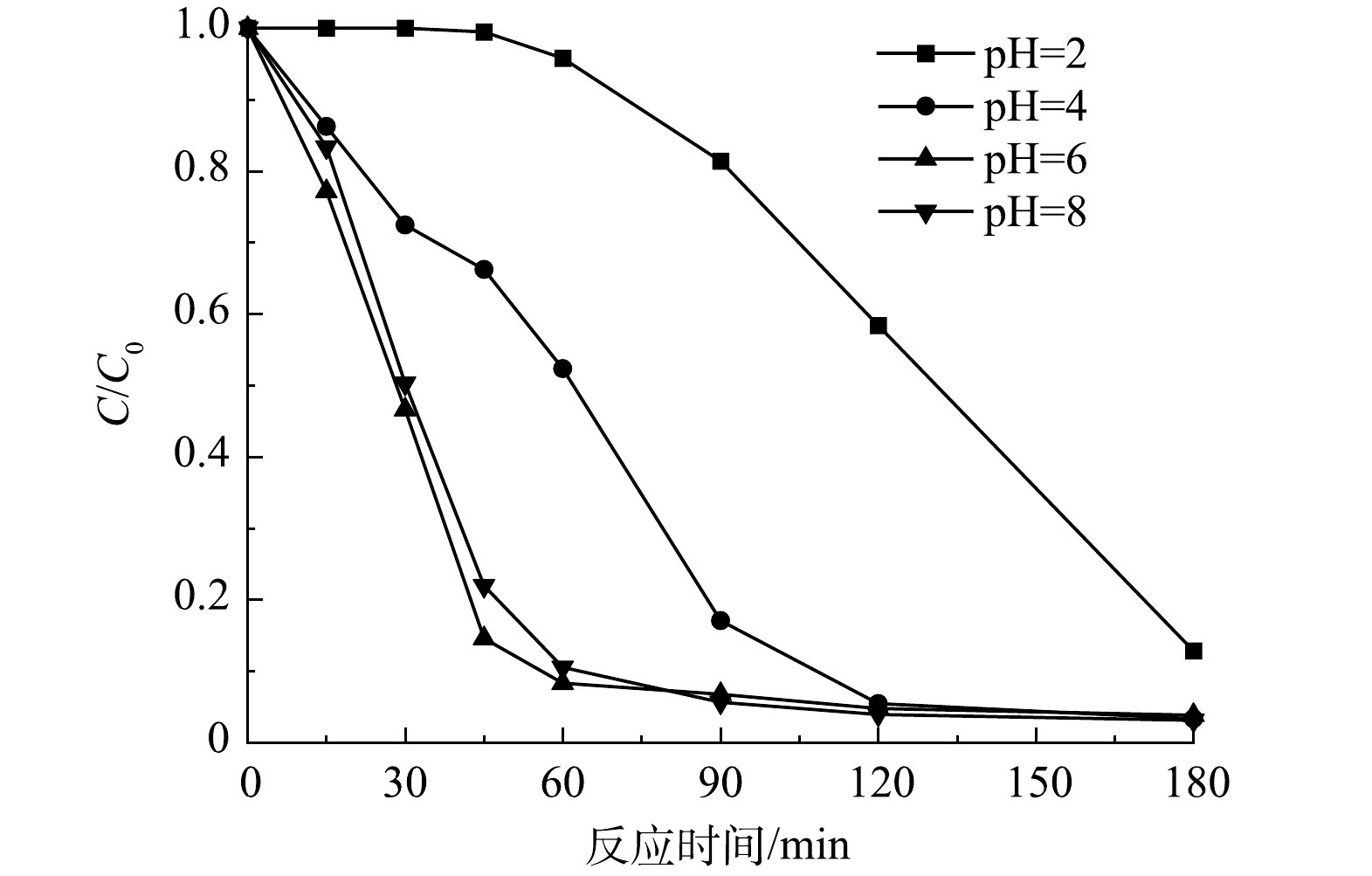
溶液 pH 在水处理过程中是不可忽略的因素。溶液的 pH 会影响催化剂的表面性质和污染物分子的形态分布,进而通过静电作用影响催化剂对污染物的去除[33]。同时,溶液 pH 也会影响光催化过程中活性氧物种的形成和活性,影响光催化体系的氧化能力。不同溶液 pH 对Nb-TiNFs光催化降解环丙沙星的影响情况见图9。结果表明,在CIP初始质量浓度为10 mg·L−1,Nb-TiNFs质量浓度为0.1 g·L−1的条件下,当溶液pH=2时,反应180 min后CIP的去除率最低,为87%,而当pH为4、6和8时,180 min后CIP的最终去除率分别为95.6%、96.1%、95.9%。有研究[34]表明,CIP作为一种可解离抗生素,由于其结构中的亚氨基-NH和羧基-COOH上的质子化和脱质子化过程,使其在不同的pH条件下呈现不同的存在形式,在 pH<8.7 的溶液中CIP表现为正电,在溶液 pH为 8.7~10.6 时CIP呈电中性,在溶液 pH>10.6 时CIP显示负电性。在本研究中,Nb-TiNFs的等电点为2.8,因此,溶液 pH为 2 时,Nb-TiNFs表面带正电,与CIP之间存在静电斥力,进而导致环丙沙星去除率的下降。而pH为4、6和8时,Nb-TiNFs表面带负电,CIP带正电,两者之间的静电吸引促使Nb-TiNFs能够捕获更多的CIP,从而进一步增强其降解效率。此外,随着 pH 的升高溶液中的氢氧根数量增多,为羟基自由基的产生提供了更多可能性,这也可能是引起环丙沙星去除效率升高的原因。
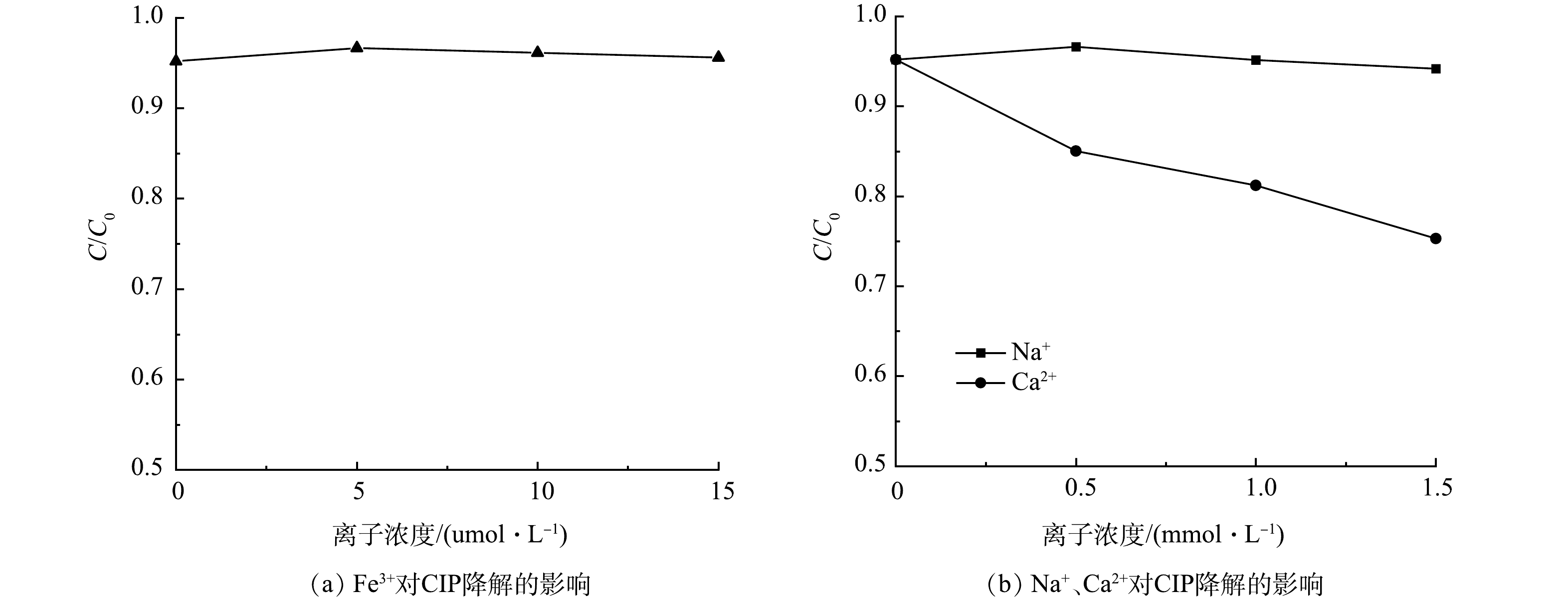
实际水体中普遍存在的无机阳离子可能对环丙沙星的去除产生影响[35]。本研究考察了在初始CIP质量浓度为10 mg·L−1,光催化剂质量浓度为0.1 g·L−1的条件下,水中典型Na+、Ca2+和Fe3+对Nb-TiNFs在可见光下降解CIP的影响(图10)。由图10可见,当Na+浓度在 0.5~1.5 mmol·L−1时,其对环丙沙星的光催化去除的影响微乎其微。当Na+浓度为 1.5 mmol·L−1 时,氙灯照射下120 min 后环丙沙星的去除率为 94.17%,比未加入Na+时仅降低了 1.02%。然而,当共存Ca2+浓度为0.5~1.5 mmol·L−1时,光催化120 min后,溶液中CIP降解率降低了10.2%~19.9%,抑制作用较为显著。这可能是由于带正电的 Ca2+与环丙沙星在催化剂表面竞争吸附位点,从而抑制了环丙沙星的去除。而当溶液中共存的阳离子浓度相同时, Ca2+的影响大于Na+,这可能是因为带正电的阳离子与环丙沙星在催化剂表面竞争吸附,二价阳离子的竞争力更强,此外,Ca2+与有机污染物的螯合能力较强,Ca2+可以与环丙沙星键合形成分子量较大的络合物,不利于环丙沙星在催化剂表面的吸附和光催化去除[36],考虑到常温下Fe(OH)3的溶度积Ksp为4×10−38,因此中性水体中存在的Fe3+浓度较小,故添加共存Fe3+浓度为5~15 µmol·L−1。少量共存的Fe3+可轻微促进CIP的光催化去除,当加入5 µmol·L−1 Fe3+时,可见光照射120 min后CIP的去除率由原来的95.19%升高至96.67%,这可能是因为 Fe3+的电子捕获作用进一步促进了电子和空穴的分离,有利于材料表面活性自由基的产生,但随着Fe3+浓度的增加,促进作用更加微弱,几乎可以忽略不计。
2.3 环丙沙星的降解机理及降解过程中的活性物种分析
不同淬灭剂对环丙沙星降解速率的影响如图11所示。其中初始CIP质量浓度为10 mg·L−1,淬灭剂质量浓度为0.01 mol·L−1,pH为6。结果表明,在加入BQ、KI、FA和TBA后,光照60 min内CIP的去除率由 91.7%分别降至 36.1%、28.2%和 80.6%和89.7%,与未添加淬灭剂相比,去除率分别降低了 55.6%、63.5%和 11.1%和2%,180 min反应结束后,CIP的去除率由 96.2%分别降至 42.8%、85.6%和 90.6%和95.9%。结果表明,超氧自由基、空穴、单线态氧和羟基自由基在环丙沙星的降解过程中均发挥了作用,其中超氧自由基发挥的作用最显著。
根据以上结果推测在模拟日光下Nb-TiNFs光催化CIP的机理。经过水热处理,具有不同能带隙(Eg)的2种半导体材料可能形成异质结构。当太阳光照射时,钛酸盐和铌酸盐均可被激发,从而形成具有不同能带间隙的2种材料的导带(conduction band,CB)和价带(valence band,VB)(式(2)和式(3)),光子激发价带(VB)上的电子跃迁至导带(CB)形成光生电子,同时VB上留下光生空穴。通常情况下,产生的光生空穴-电子对(h+-e−)易发生复合而耗散能量,而由于Nb的掺杂和异质结构的形成,导致导带发生偏移,使得钛酸盐上生成的电子转移到铌酸盐的CB上(式(4))从而抑制了h+-e− 的复合,增加了载流子的分离效率。转移的e− 将被其他受体(氧气)捕获以形成·O2−(式(5)),并进一步产生·OH(式(6)),同时,空穴(h+)氧化H2O分子可产生·OH(式(7)),并且空穴也可以直接攻击CIP将其降解(式(9))。另一方面,O2受光能量激发后生成1O2(式(8))。CIP被生成的活性氧(reactive oxygen species,ROS)(·O2−、·OH、1O2)降解甚至矿化(式(10))。
钛酸盐+hv→e−Ti+h+Ti (2) 铌酸盐+hv→e−Nb+h+Nb (3) 铌酸盐+e−Ti→铌酸盐−e−Ti(电子转移) (4) O2+e−→·O−2 (5) ⋅O−2+2e−+2H+→⋅OH+OH− (6) H2O+h+→⋅OH (7) O2+hv→1O2 (8) CIP+h+→中间产物→CO2+H2O (9) CIP+ROS→中间产物→CO2+H2O (10) 2.4 光催化剂的重复利用性能
光催化剂的稳定性与其是否可以在实际工程中应用紧密相关,只有重复使用过程中性能稳定的催化剂才具备经济性,图12为Nb-TiNFs光催化剂的可重复利用性能测试结果,其中催化剂的质量浓度为 0.1 g·L−1,CIP溶液质量浓度为 10.0 mg·L−1, pH 为 6.0。结果表明,5次循环利用过程中,反应180 min后CIP的去除率没有显著下降,仅由 96.2%降低为 94.3%。说明 Nb-TiNFs催化剂在重复使用过程中具有较高的稳定性,并且保持着较高的活性,该催化剂具有实际应用的潜力。
3. 结论
1) Nb-TiNFs复合材料呈现出铌酸盐和钛酸盐的异质结构,其形貌为掺杂铌酸盐的钛酸纳米片。
2) Nb-TiNFs在模拟太阳光下可高效快速光催化降解水中新兴污染物CIP,在pH为6时,0.1 g·L−1 Nb-TiNFs光催化剂180min内对10 mg·L−1CIP的降解率可达96.2%。pH、共存离子等因素对Nb-TiNFs光催化降解水中CIP影响程度不同。
3) ROS(·O2−,·OH,1O2)在环丙沙星的降解过程中均发挥了作用,其中超氧自由基发挥的作用最显著。
4) 5轮光催化重复去除实验中,CIP的去除率由 96.2%降低为 94.3%,仅下降 1.9%。说明Nb-TiNFs催化剂具有较高的稳定性,具有实际应用前景。
5)钛酸盐和铌酸盐的异质结构导致带状复合材料的带隙偏移,便于转移激发电子从钛酸盐到铌酸盐,抑制电子-空穴对的复合,从而极大地促进了太阳光驱动的光催化活性。与基于TiO2的光催化剂相比,Nb-TiNFs不需要强制性的额外UV光源来激发反应过程,在太阳光下即可彻底反应。
-
表 1 实验水样基本水质
Table 1. Basic water quality of experimental water samples
水样序号 pH 电导率/(mS·cm−1) TDS/(g·L−1) 氯离子/(mg·L−1) COD/(mg·L−1) 1 8.09 14.10 7.05 3 400 457~665 2 7.55 2.97 1.50 570 126~272 3 8.36 4.57 2.28 1 040 285~437 -
[1] DENISE M A, ISABELLE M C, DARREN S D, et al. Organic and inorganic composition and microbiology of produced waters from pennsylvania shale gas wells[J]. Applied Geochemistry, 2015, 60(4): 116-125. [2] ZHANG L, LIU X, GUO X, et al. Investigation on the degradation of brilliant green induced oxidation by NiFe2O4 under microwave irradiation[J]. Chemical Engineering Journal, 2011, 173(3): 737-742. doi: 10.1016/j.cej.2011.08.041 [3] GUPTA V K, SUHAS. Application of low-cost adsorbents for dye removal: A review[J]. Journal of Environmental Management, 2009, 90(8): 2313-2342. doi: 10.1016/j.jenvman.2008.11.017 [4] ADAK A, BANDYOPADHYAY M, PAL A. Removal of crystal violet dye from wastewater by surfactant-modified alumina[J]. Separation & Purification Technology, 2005, 44(2): 139-144. [5] SLOKAR Y M, MAJCEN L M A. Methods of decoloration of textile wastewaters[J]. Dyes & Pigments, 1998, 37(4): 335-356. [6] MANAL M A, EL-NAGGAR S, EL-AASAR A, et al. Bioremediation of crystal violet using air bubble bioreactor packed with pseudomonas aeruginosa[J]. Water Research, 2005, 39(20): 5045-5054. doi: 10.1016/j.watres.2004.08.001 [7] LIAO Y, FU M, CHEN L, et al. Catalytic oxidation of toluene over nanorod-structured Mn-Ce mixed oxides[J]. Catalysis Today, 2013, 216(18): 220-228. [8] CHEN C C, LIAO H J, CHENG C Y, et al. Biodegradation of crystal violet by pseudomonas putida[J]. Biotechnology Letters, 2007, 29(3): 391-396. doi: 10.1007/s10529-006-9265-6 [9] MEHRJOUEI M, SIEGFRIED M, DETLEV M. A review on photocatalytic ozonation used for the treatment of water and wastewater[J]. Chemical Engineering Journal, 2015, 263(1): 209-219. [10] ANA M, REY A, FERNANDO J, et al. Solar photo-ozonation: A novel treatment method for the degradation of water pollutants[J]. Journal of Hazardous Materials, 2016, 317(1): 36-43. [11] 杨静, 王建兵, 王亚华, 等. 高级氧化工艺处理煤化工浓盐水[J]. 环境工程学报, 2015, 9(8): 3680-3686. doi: 10.12030/j.cjee.20150815 [12] 王超, 赵旭, 侯子义, 等. 光电催化氧化处理反渗透浓水[J]. 环境工程学报, 2014, 1(8): 3189-3194. [13] WANG J L, XU L J. Advanced oxidation processes for wastewater treatment: formation of hydroxyl radical and application[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(3): 251-325. doi: 10.1080/10643389.2010.507698 [14] 王利平, 沈肖龙, 倪可, 等. 非均相催化臭氧氧化深度处理炼油废水[J]. 环境工程学报, 2015, 9(5): 2297-2302. [15] 杜松, 金文标, 王吉坤, 等. 非均相催化臭氧氧化处理煤化工高含盐废水[J]. 煤炭科学技术, 2018, 46(9): 54-58. [16] DHANDAPANI B, OYAMA S T. Gas phase ozone decomposition catalysts[J]. Applied Catalysis B: Environmental, 1997, 11(2): 129-166. doi: 10.1016/S0926-3373(96)00044-6 [17] CHEN C, LI Y, MA W, et al. Mn-Fe-Mg-Ce loaded Al2O3 catalyzed ozonation for mineralization of refractory organic chemicals in petroleum refinery wastewater[J]. Separation and Purification Technology, 2017, 183(1): 1-10. [18] 亓丽丽. 非均相臭氧催化氧化对氯苯酚机理研究及其工艺应用[D]. 哈尔滨: 哈尔滨工业大学, 2013. [19] 庄海峰. 催化臭氧化-生物组合工艺深度处理煤制气废水效能的研究[D]. 哈尔滨: 哈尔滨工业大学, 2015. [20] 朱秋实, 陈进富, 姜海洋, 等. 臭氧催化氧化机理及其技术研究进展[J]. 化工进展, 2014, 33(4): 1010-1014. [21] IKHLAQ A, BROWN D R, KASPRZYK-HORDERN B. Mechanisms of catalytic ozonation: An investigation into superoxide ion radical and hydrogen peroxide formation during catalytic ozonation on alumina and zeolites in water[J]. Applied Catalysis B: Environmental, 2013, 129(1): 437-449. [22] QI F, XU B, CHEN Z, et al. Catalytic ozonation of 2-iso-propyl-3-methoxypyrazine in water by γ-AlOOH and γ-Al2O3: Comparison of removal efficiency and mechanism[J]. Chemical Engineering Journal, 2013, 219(1): 527-536. [23] DAI Q, WANG J, YU J, et al. Catalytic ozonation for the degradation of acetylsalicylic acid in aqueous solution by magnetic CeO2 nanometer catalyst particles[J]. Applied Catalysis B: Environmental, 2014, 144(1): 686-693. [24] AFZAL S, QUAN X, ZHANG J. High surface area mesoporous nanocast LaMO3(M=Mn, Fe) perovskites for efficient catalytic ozonation and an insight into probable catalytic mechanism[J]. Applied Catalysis B: Environmental, 2017, 206(1): 692-703. -





 下载:
下载: