-
透水铺装是低影响开发常用技术措施之一,通常应用在非机动道路、广场、停车场等,在铺装面层、找平层、基层或土基层应用透水性能良好、空隙率较高的材料,使雨水进入铺面后直接渗入土基或通过铺面内部的排水管排出,从而达到雨水渗入地下、减少地表径流等目的,并可有效缓解不透水铺装对环境造成的影响[1-4]。透水铺装对雨水径流有较好的控制效果,FASSMAN等[5]的研究表明,透水铺装延迟出流时间可达2.4 h,峰值流量平均削减率为83%;WATANABE[6]研究发现,透水铺装可削减15%~20%的径流峰值量;COLLINS等[7]监测了透水联锁砖、混凝土网格砖和现浇透水混凝土的径流控制效果,结果表明,3种铺装对雨水径流的平均削减率为98.17%~99.86%,各种透水铺装系统对雨水径流水量均有良好的控制效果。
根据透水铺装面层的材料组成,可将透水铺装分为透水砖、透水混凝土和透水沥青混凝土[8-9]。透水砖是人行道、停车场、公园等透水性铺装应用最为广泛的面层材料,其根据透水原理可分为2种:一种是利用砖体材料本身的孔隙结构实现雨水下渗的普通透水砖;另一种是砖体材料本身不透水,或透水能力很小,主要靠砖体外观的异型结构将雨水径流导入基层的构造透水砖,如常见的嵌草砖等,构造透水砖与普通透水砖相比,具有不易堵塞、雨水下渗速度快等特点。目前,关于构造透水砖和普通透水砖水量控制效果的比较尚未见报道,在实际工程应用中缺乏对透水砖选择的科学依据。针对此现状,本研究选用海绵城市建设中2种具有代表性的普通透水砖与构造透水砖,人工模拟重现期分别为1、3、5和10 a的降雨,研究了2种不同透水砖在不同降雨条件下的水量控制效果,为不同类型透水砖在工程的应用提供参考。
全文HTML
-
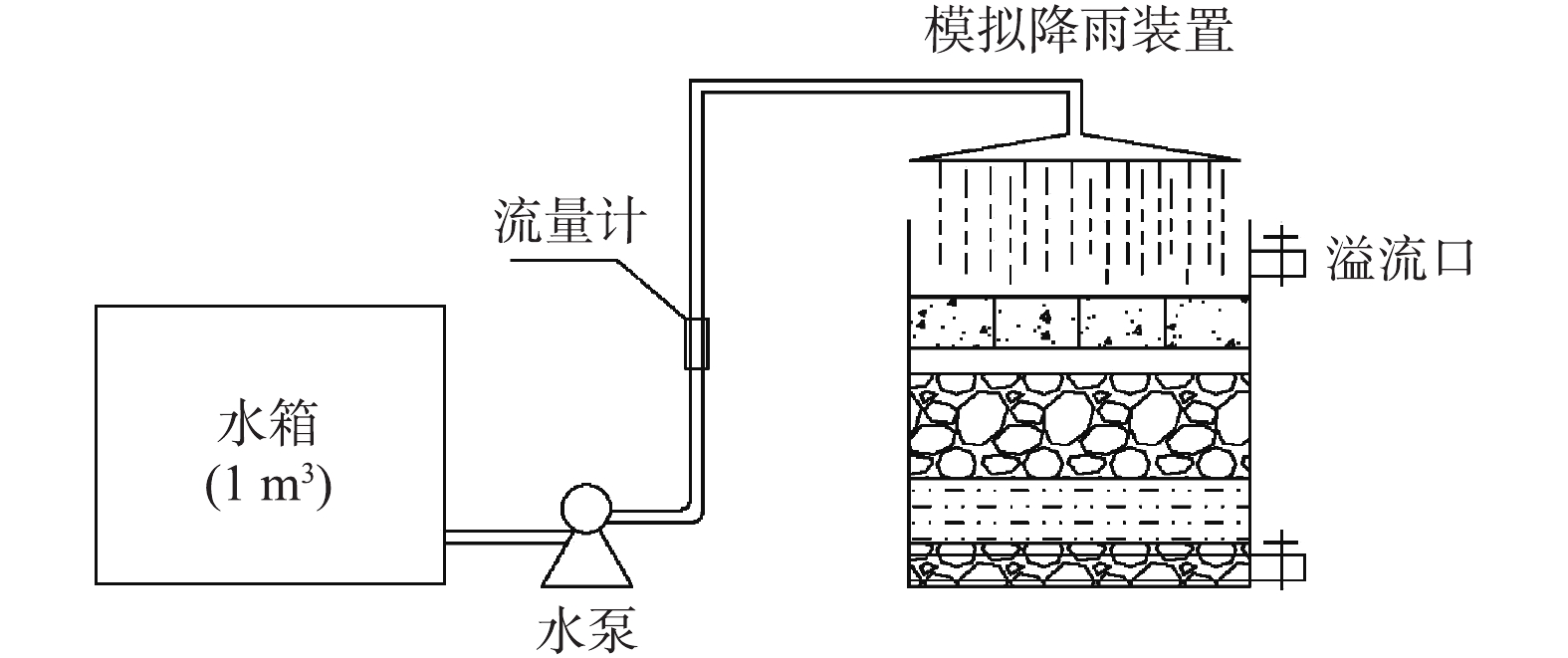
实验装置组成见图1。透水铺装实验台尺寸为1 000 mm×500 mm×600 mm,在其底部设置PP-R集水管,集水管直径为20 mm,穿孔孔径为2 mm。为防止集水管堵塞,其外壁包裹透水土工布(100 g),溢流口高度为10 mm。透水铺装结构从下至上依次为排水层、土基层、基层、找平层、面层。透水铺装结构示意图见图2。
-
为了系统研究面层不同类型透水砖对雨水水量控制效果的影响,选用海绵城市建设中2种具有代表性的普通透水砖与构造透水砖进行对比实验,其实物照片分别见图3和图4。实验期间,除了面层透水砖类型不同外,其他的实验参数设置均相同。2种不同类型透水砖具体参数如表1所示。2种透水砖原材料均为混凝土,构造透水砖进水导流孔直径为12 mm,蓄水空腔体积占砖体体积的9.6%,实验中的渗透系数为透水砖或铺装的饱和渗透系数(或稳定渗透系数)。砖体渗透系数指普通透水砖、构造透水砖砖体本身的渗透系数,铺装结构整体渗透系数指实验中铺设的透水铺装从面层至基层的整体渗透系数。
找平层主要功能是保证面层平整,并具有一定透水功能,其厚度一般为25~50 mm[10]。根据《透水砖路面技术规程》(CJJ/T 188-2012)[11],找平层可使用细砂、中砂、粗砂以及砂浆,为保证透水铺装较高的强度和透水能力,工程应用中常用中砂和粗砂[12]。本研究中铺设找平层的材料为中砂,铺设厚度为40 mm。
透水铺装的基层一般空隙率较高,具有良好的蓄水功能,一般采用稳定性和强度均较好的天然砂砾或级配碎石和无砂混凝土的组合。本实验中基层采用级配碎石,其级配组成参考《透水砖路面施工与验收规程》(DB11/T 686-2009)[13],如表2所示,基层铺设厚度为200 mm。
土基层材料与基层和面层所使用的大孔隙材料相比,渗透能力较差。因此,土基层的渗透能力是影响透水铺装透水效率的控制性因素。本实验中土基层材料采用砂壤土,铺设厚度为100 mm。
为测量透水铺装在降雨过程中的自然下渗量,在土基层下方设置碎石层,铺设材料选用粒径为5~15 mm的碎石,其厚度为50 mm,内部铺设直径为20 mm的穿孔集水管。
-
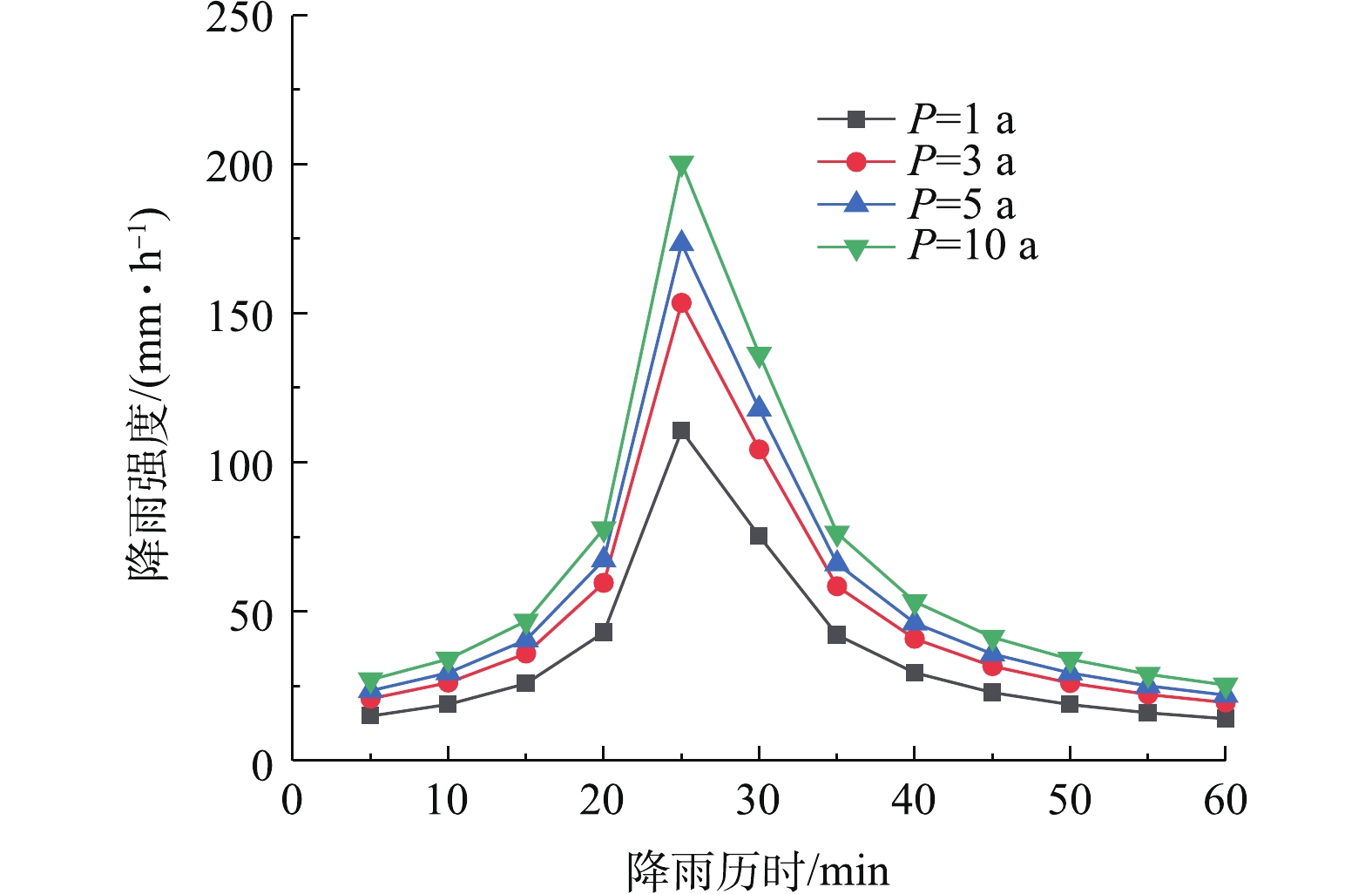
实验采用人工模拟降雨方法,降雨选择芝加哥雨型,降雨历时取60 min,根据北京地区(Ⅱ区)暴雨强度计算方法(式(1)),计算不同重现期下的降雨强度过程线(图5)。
式中:q为设计降雨强度,L·(s·hm2)−1;P为设计降雨重现期,a;t为降雨历时,min。
1.1. 透水砖铺装结构设计
1.2. 实验方法
-
透水铺装控制雨水径流主要通过以下几种途径:透水铺装各结构层材料的孔隙可消纳吸收部分雨水;部分雨水暂时滞留在基层级配碎石孔隙中;下渗雨水通过土基层排走或通过集水管排走。
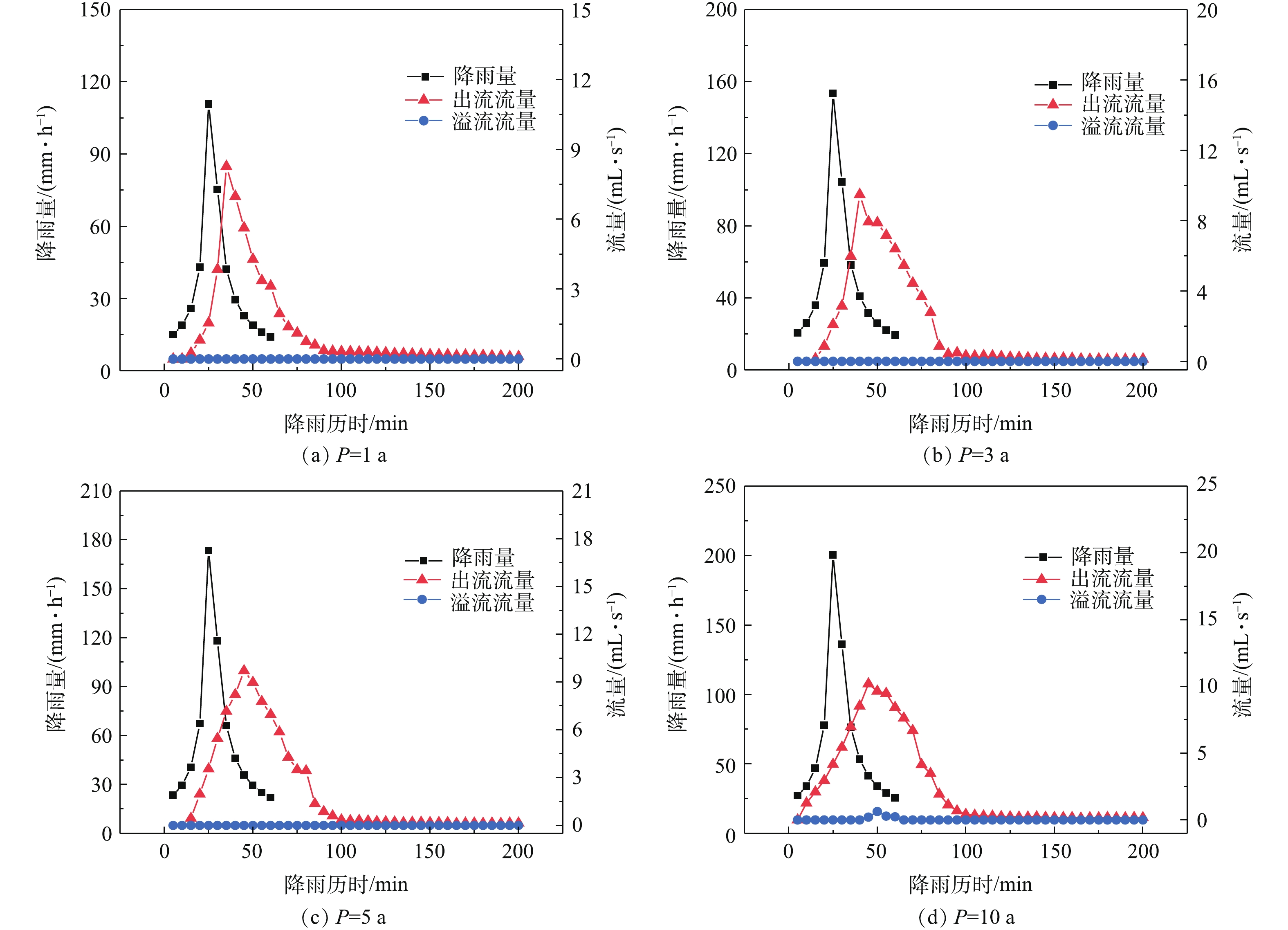
雨水在普通透水砖表面通过透水砖本身的孔隙结构以及砖缝下渗。当土基层的渗透能力小于透水砖的渗透能力时,雨水将在基层碎石的孔隙中蓄积,蓄积的雨水最终渗透过土基层,自然下渗或排出。普通透水砖在不同重现期下的水量控制效果如图6所示。可以看出,普通透水砖在10 a重现期时出现溢流,但溢流量较小,占降雨总量的1.3%。透水铺装出流时间在低重现期时(P=1、3、5 a)均为15 min,当重现期增至10 a时,出流时间提前至10 min。原因可能是,由于在降雨初期,雨水在重力和毛细管力的作用下进入铺装各结构层,直至穿透土基层后,通过集水管排出,达到这一出流时刻的累积降雨量称为临界降雨量;低重现期时,达到临界降雨量的时间高于高重现期,因此,高重现期时出流时间缩短。重现期由1 a延长至10 a时,峰值流量由7.9 mL·s−1上升至10.2 mL·s−1,峰值延迟时间由10 min增至20 min。原因主要是,随着重现期的增大,降雨强度不断增大,渗入铺装内部的雨水量不断增加,由于土基层渗透系数较小,来不及下渗的雨水会在基层级配碎石的孔隙中蓄积,蓄积的雨水高度随着重现期的增大而增加,基层中水位的上升会使水头压力变大,增大出水流量,出水流量达到最大值,因此,随着重现期的增大,峰值流量逐渐增加;在低重现期时,雨水全部入渗,出水峰值流量发生在降雨峰值过后降雨强度开始小于铺装渗透能力的时刻(临界雨强),随着重现期的增加,临界雨强发生时间逐渐延后,因此,峰值延迟时间随着重现期的增大而增加。
-
构造透水砖利用其结构特点进行透水,砖块中央的导流孔以及圆台型蓄水空腔可将雨水从面层快速向下渗透,然后进入找平层、基层、土基层中,其透水性能好,导水速率远远大于普通透水砖透水速率。并且在降雨强度超过土基层渗透能力时,砖体的空腔还可蓄存部分雨水径流,在降雨结束后,又可将储存的雨水渗透释放,有效削减雨水径流。构造透水砖可以有效降低铺装堵塞频率,提高雨水径流渗透量和渗水速率。
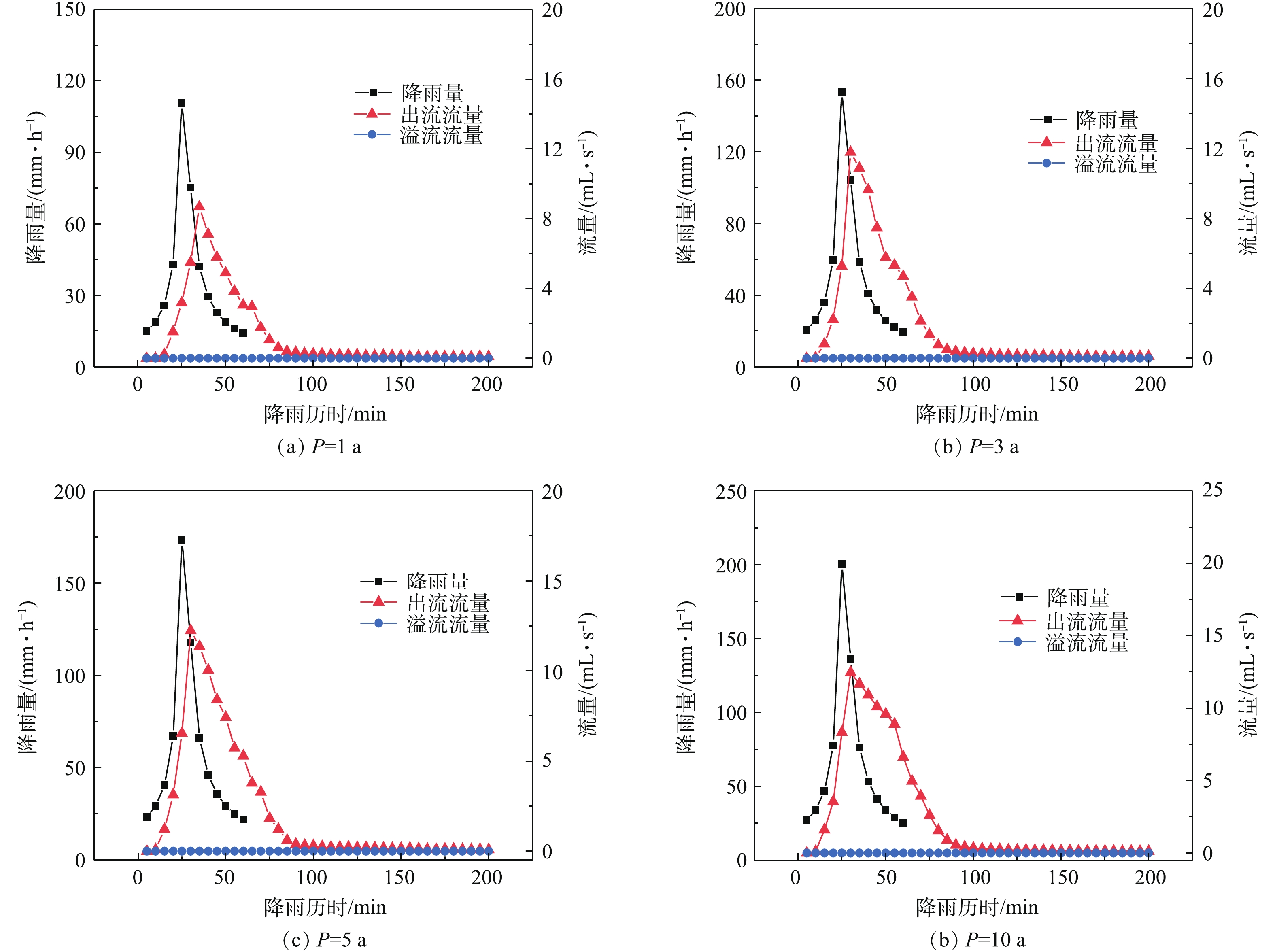
构造透水砖在不同重现期下的水量控制效果如图7所示。可以看出,构造透水砖在1、3、5、10 a重现期内均未出现溢流,可有效提高雨水径流削减效果。峰值延迟时间在低重现期时较大,当重现期由1 a增大至10 a时,峰值延迟时间由10 min减少至5 min,出流时间由15 min减少至10 min。这是由于雨水须在满足装置中各材料的初步的浸润损失后才能出流,在低重现期时,累积的降雨量较小,未满足装置的出流条件;当重现期增大时,相同的降雨时间内总的降雨量较大,因此,导致出流时间提前。
-
普通透水砖与构造透水砖在不同重现期下实验结果如表3所示。普通透水砖与构造透水砖均呈现随着重现期的增大,峰值削减率逐渐增大的变化趋势。本实验中普通透水砖对峰值流量的平均削减率为43.3%,这与BROWN[14]的研究结果一致,其在对一透水性联锁块铺装(非构造透水)的研究中发现,透水性联锁块铺装对峰值流量的平均削减率为40%。但构造透水砖对峰值流量的控制效果较好,平均削减率为51.9%,主要是由于构造透水砖渗透性能要优于普通透水砖,降雨峰值流量到来时,雨水能快速渗过构造透水砖,减少雨水在面层中的流动时间,构造透水砖的蓄水腔体能蓄存一部分降雨峰值流量,使降雨峰值流量更为集中地渗透至出水管,形成较大的出水峰值流量;而普通透水砖在降雨峰值流量到来时,不能使雨水快速完成在面层中的渗透,还会出现在铺装表面积水的情况,使降雨峰值流量较为缓慢 、分散地下渗至出水管,形成的出水流量要小于构造透水砖在短时间内集中出水形成的出水峰值流量,因此,构造透水砖的出水峰值流量大于普通透水砖。构造透水砖的快速导水能力减少了雨水在面层中的停留时间,从而减少出流延迟时间与峰值延迟时间,构造透水砖的平均峰值延迟时间为6.3 min,普通透水砖为16.3 min,构造透水铺装的平均出流延迟时间为11.3 min,要低于普通透水铺装(13.8 min)。由于构造透水砖蓄水腔体的存在,相当于提高了构造透水铺装的蓄渗容量,其总量控制效果要优于普通透水砖。在本实验条件下,构造透水砖和普通透水砖的总量控制率平均值均超过95%。
2.1. 普通透水砖水量控制效果
2.2. 构造透水砖水量的控制效果
2.3. 不同类型透水砖水量控制效果对比
-
1)普通透水砖的平均峰值延迟时间与平均出流延迟时间均大于构造透水砖,普通透水砖和构造透水砖的平均峰值延迟时间分别为16.3 min和6.3 min,平均出流延迟时间分别为13.8 min和11.3 min。
2)普通透水砖与构造透水砖均能有效控制雨水径流峰值流量,但构造透水砖由于蓄水腔体的存在,对峰值流量的控制效果更好,普通透水砖的平均峰值流量削减率为43.3%,构造透水砖的平均峰值流量削减率为51.9%,在实际工程应用中可选择构造透水砖提高雨水径流控制效果。
3)普通透水砖与构造透水砖对雨水水量均有较好的控制效果,与普通透水砖相比,构造透水砖具有更高的雨水径流滞蓄能力,但这2种透水砖均有堵塞风险,因此,在实际应用中,还应关注这2种透水砖的长期运营维护问题。



 下载:
下载: