-
土壤是社会经济可持续发展的重要物质基础,土壤质量更是直接关系到人类生存和健康。由于工农业高速发展,废污水大量直排,我国土壤污染问题形势严峻,而重金属已成为土壤主要污染因子。《全国土壤污染状况调查公报(2014年)》显示,我国耕地土壤环境质量堪忧,其中镉污染最为严重,点位超标率达7.0%。我国南方土壤污染重于北方,重金属污染使得长江三角洲地区10%的土壤基本丧失生产力[1]。沉积物是水环境的重要组成部分,也是污染物(重金属等)的重要载体,环境条件改变会使重金属从沉积物释放到上覆水中[2]。外源输入水环境中的重金属,会在沉积物中不断累积,危及底栖生物[3]。土壤/沉积物中富集的重金属会成为潜在污染源,通过植物吸收或生物摄食进入食物链,最终威胁到人类健康[4-5]。因此,深入研究土壤/沉积物中重金属污染,准确有效地评估重金属生态风险及其对人类健康的危害十分迫切。
通过手口行为无意间摄入土壤是人体(特别是儿童)重金属暴露的重要途经[6-7]。进入人体的重金属,受重金属形态(可交换态/酸溶解态等)、土壤性质(pH等)、土壤中停留时间等因素影响,其生物有效态或生物可利用态含量会低于总摄入量[8-11]。基于总量的生态风险评价,可能会高估土壤中重金属暴露对人类健康的风险,导致重金属风险预估不当,而且增加了评估成本。准确分析土壤中重金属生物有效性(体内实验)和生物可利用性(体外实验),对于精准评估重金属暴露对人类健康的影响至关重要[12]。在沉积物或其表层水环境中,底栖动物会摄食沉积物颗粒来满足自身营养需要[13]。而摄食沉积物也是底栖动物累积重金属的主要途径,沉积物中生物可利用态重金属被消化吸收后,能通过食物链传递,影响人类健康[14]。故有关沉积物中重金属生物有效性的研究方法及其影响因素一直是关注热点[14-16]。
生物有效性和生物可利用性是评价土壤/沉积物中重金属环境效应有效的指标。当前,关于重金属的环境效应研究,已由单纯重金属总量/形态向重金属生物有效性/生物可利用性转变[12, 17-18]。同时,诸多学者致力于研发经济有效的重金属生物有效性和生物可利用性分析方法,并将其应用到土壤/沉积物中重金属的风险评估[19-23]。本研究通过对国内外相关文献的归纳和整理,具体介绍了重金属生物有效性和生物可利用性的定义,系统阐述了土壤/沉积物中重金属生物有效性和生物可利用性的研究方法及其应用,详细分析了土壤/沉积物中重金属生物有效性和生物可利用性的影响因素,并对未来这一领域的研究方向提出了建议。
-
重金属生物有效性(bioavailability)和生物可利用性(bioaccessibility)常被混淆。为了对生物有效性有一个清晰的认识,美国土壤/沉积物中污染物生物有效性委员会(NRC)提出使用“生物有效性过程”这一术语,概述一种受体生物分解、运输和吸收环境污染物所涉及的机制[24]。在临床药理学科中,生物有效性指进入循环系统的药物前体占总给予剂量的比例。其中,当药物通过静脉注射途径进入生物体时,默认生物有效性为100%;当通过其他途径(如口服)进入生物体时,由于吸收不完全和首过代谢,生物有效性会降低。临床药理学科中有关生物有效性的定义也被引入环境科学领域,具体定义为污染物通过皮肤接触、摄入或吸入途径被吸收进入生物体的量,包括绝对生物有效性(absolute bioavailability,ABA)和相对生物有效性(relative bioavailability,RBA)[24-25]。
重金属绝对生物有效性是指通过皮肤接触、摄入或吸入途径实际被吸收并进入生物体循环系统的部分或百分比。由于绝对生物有效性分析过程复杂,涉及血液取样且重金属浓度常低于检测限,故在实际研究过程中很少分析[7]。重金属相对生物有效性是指风险评估中暴露介质(如土壤)的吸收分数与毒性研究中参照物质的吸收分数的比值。在分析相对生物有效性过程中,参照物质通常包括醋酸铅[26]、砷酸钠[27]、氯化镉[28]等,生物靶器官会用到血液[29]和肝脏、肾脏、骨头等对重金属具有连续累积效应的器官[7]。上述概念多用于土壤中重金属生物有效性研究,而在沉积物中,重金属同化效率(assimilation efficiencies)被定义为在整个消化循环过程中生理上被摄取的颗粒态重金属量的百分比[30],这一定义已被用于帮助量化海洋双壳类动物从不同食物源摄入重金属的生物有效性[31-35]。
重金属生物可利用性(bioaccessibility,BAc)是指可溶解于肠胃液中能被潜在吸收的部分。这一概念常被用于土壤中重金属体外评估模型中[25],计算方法见式(1)。生物可利用性也可用相对的含义表示,即相对生物可利用性(relative bioaccessibility,RBAc),是指分析样品中重金属生物可利用性与参照物质中重金属生物可利用性的比值[36],计算方法见式(2)。
式中:LBAc为重金属生物可利用性;LRBAc为重金属相对生物可利用性;cE为利用体外肠胃液模拟溶出的重金属量;cT为分析样品中重金属总量;TBAc为分析样品中重金属生物可利用性;RBAc为参照物质中重金属生物可利用性。
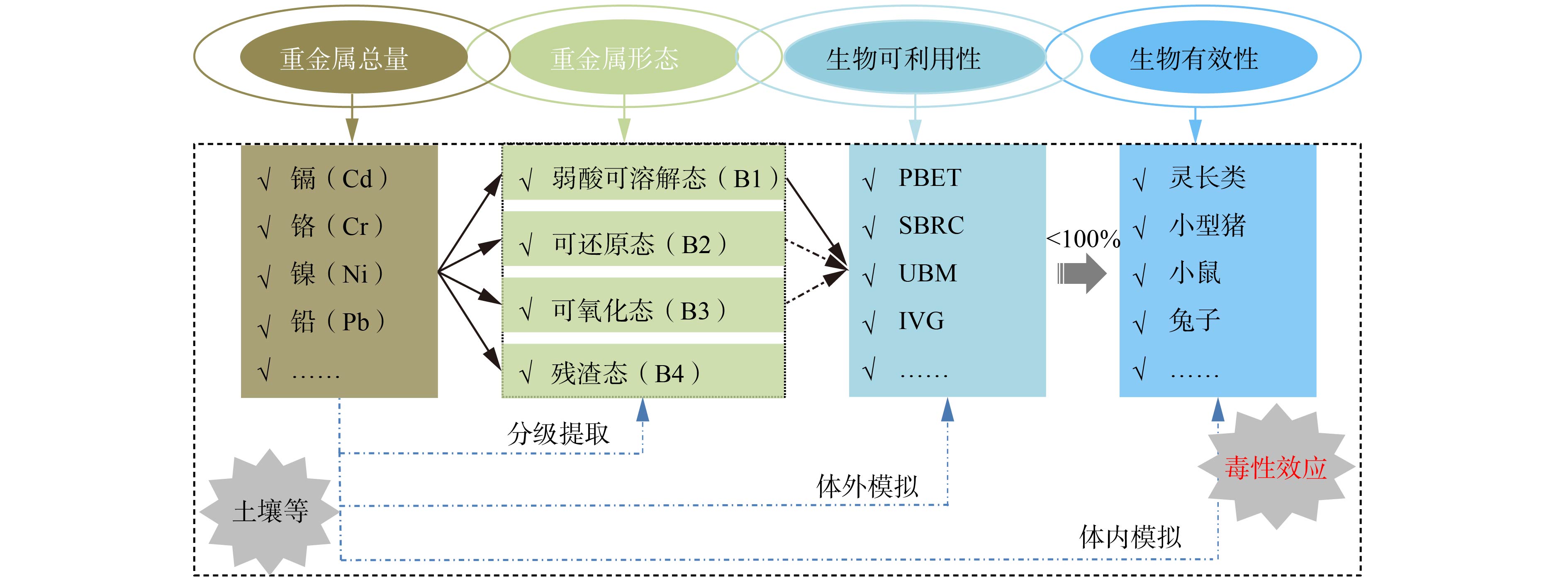
土壤/沉积物中重金属的研究经过了“总量-形态-生物可利用性-生物有效性”的发展历程(图1)。根据欧洲共同体标准物质局提出的3步连续提取法(European Community Bureau of Reference,BCR)[37],土壤/沉积物中重金属赋存形态分为4种形态:弱酸可溶解态(B1),即可交换态及碳酸盐结合态;可还原态(B2),即Fe/Mn氧化物结合态;可氧化态(B3),即有机物及硫化物结合态;残渣态(B4),即结合在硅铝酸盐矿物晶格中重金属。一般认为,弱酸可溶解态重金属具有生物可利用性;可还原态和可氧化态重金属可转化后被生物利用,具有潜在生物可利用性;残渣态重金属较稳定,基本不具有生物可利用性[38]。对于土壤中生物可利用态重金属,经过胃液消化后进入肠中不会完全被吸收,故重金属生物有效性一般要低于其生物可利用性[36]。
-
利用动物模型开展体内实验常被应用于评价土壤中重金属暴露对人类健康的影响,也是目前评价重金属生物有效性最可靠的方法。土壤中重金属可通过皮肤吸收、口腔摄入或吸入3种暴露途径进入人体,其中口腔摄入往往是土壤中重金属主要的暴露途径,美国国家环境保护局(U.S. Environmental Protection Agency,USEPA)估计2~3岁儿童偶然摄入土壤量为0.135 g·d–1[36]。土壤中重金属生物有效性研究最常用的动物模型为啮齿类,包括兔子[19]、猪[27]、小鼠[39]等。此外,虽然灵长类和人类亲缘关系最近,但由于其实验费用昂贵,难以得到广泛应用[40]。生物有效性的研究终点包括分析血液/尿液/粪便/靶器官中污染物、尿液代谢物、DNA加合物和诱导酶等[25],具体研究过程中终点选择取决于重金属种类和可用的研究资源。
猪作为土壤中重金属生物有效性研究的模型动物,其优点在于猪与人类的消化系统结构和消化时间十分相似,且幼猪的体型、体重和骨骼重量比与幼儿也相似,故常被用来评估土壤中重金属偶然摄入风险,但猪模型存在饲养时间长、费用高等不足[41-42]。猪模型已被应用到分析不同类型土壤中砷(As)、镉(Cd)、铅(Pb)等重金属生物有效性。其中,JUHASZ等[27]分析了铁路周边土壤中As(总量42~1 114 mg·kg−1)的RBA为11.2%~74.7%,矿区土壤中As(总量577~807 mg·kg−1)的RBA为6.90%~40.8%;SCHRODER等[28]测定了Cd总量为23.8~456 mg·kg−1废弃物堆放区土壤中Cd-RBA为10.4%~116%;MARSCHNER等[43]确定了Pb总量为12~199 mg·kg−1土壤中Pb-RBA为17%~63%。小鼠模型优点在于重金属体内分配和代谢动力学与人体相似,具有易购置、饲养费用低、可通过实验操作来确定生物变异对重金属胃肠道吸收的影响等优点,使其在土壤中重金属生物有效性研究方面得到广泛运用[39]。其中,BRADHAM等[39]利用小鼠模型测出美国9处住宅区土壤As-RBA为11%~53%;LI等[26]利用小鼠模型分析得出中国12处不同类型土壤(矿区、冶炼区、农业区)中Pb-RBA分别为7.0%~26%、31%~84%、51%~61%。由于土壤类型、实验设计、剂量水平等不同,多种动物模型分析同一土壤中重金属生物有效性的结果会存在一定差异。
-
沉积物中重金属生物有效性研究常采用的实验模型物种为底栖动物(表1),一些底栖无脊椎动物每天要摄食其体重2倍多的沉积物来满足自身营养需要[13]。底栖无脊椎动物在摄食沉积物后,会消化、吸收沉积物中生物可利用态重金属,而这些重金属能够通过食物链传递影响到人类健康[14]。在具体研究中,GRISCOM等[30]采用波罗海白樱蛤(Macoma balthica)得到沉积物中Ag、Cd和Co的同化效率分别为12%~22%、6%~13%和8%~20%;GAGNON等[44]测得沉积物中Hg和CH3Hg在贻贝(Mytilus edulis)体内的同化效率分别为1%~9%和87%。此外,近年来,许多学者也将梯度扩散薄膜技术(diffusive gradients in thin-films,DGT)应用到预测沉积物中重金属生物有效性。AMIRBAHMAN等[45]利用汞(Hg)专属DGT装置预测了河口沉积物中Hg对大型底栖无脊椎动物的生物有效性,发现DGT技术可作为一种有效监测方法用于预测底栖无脊椎动物对沉积物中Hg的生物有效性。
-
土壤中重金属生物可利用性常用的研究方法是体外模拟实验。由于人类消化系统极其复杂,体外模拟实验主要模拟其关键过程,包括口腔、胃和肠3个阶段。其中,食物在口中停留时间较短(约2 min),不会显著促进土壤中重金属释放,可根据研究需要选择。目前,体外模拟实验法主要有PBET(physiologically based extraction test)、IVG(in vitro gastrointestinal method)、SBRC(solubility bioavailability research consortium)和UBM(unified BARGE method)[19-20, 22, 47](表2)。其中,PBET[19]是最早基于人体生理学原理建立的体外模拟消化法,包括肠相和胃相2个阶段(2~3岁儿童);IVG[20]简化了胃液成分,在模拟过程中加入了生面团,并参考了人类胃蛋白酶相关文献,增加了胃蛋白酶浓度,缩短了肠液提取时间;SBRC[47]进一步简化了胃液成分,只添加了甘氨酸,肠相提取时间仍较长;UBM[22]是由欧洲生物可利用性研究小组于2011年提出的,提取成分最为复杂,且增加了唾液相,旨在建立一套适用于各种类型土壤中重金属生物可利用性的研究方法。对于上述方法不能简单判断其好坏,每种方法都有其特定的理论基础和适用对象,方法的选择取决于研究目的、研究对象、操作条件等因素。目前,PBET、IVG、SBRC和UBM等体外实验方法已被广泛应用于土壤中重金属生物有效性的研究,主要还是集中于As、Cd和Pb(表3)。
PBET可用于分析土壤中As、Cd、Cu和Pb等多种重金属生物可利用性,且通过与动物模型结果进行比较,该方法被不断完善。RUBY等[36]采集了不同类型土壤样品对PBET进行了验证,考虑到进食后幼儿胃液pH会升高,比较了3个模拟胃液pH(1.3-空腹状态、4.0-进食状态、2.5-空腹和进食之间状态)。结果发现,pH从1.3升到2.5过程中,胃相中溶解性Pb平均下降了57%,进入小肠相又下降了约74%,说明模拟相中Pb的生物可利用性会随pH的升高而降低;pH=2.5胃相得到的Pb-RBAc可以很好地预测Pb的生物有效性(大鼠模型),故其他研究中常采用pH为2.5的胃相提取。LI等[12]利用小鼠模型分析了中国12个土壤中Cd(总量3~296 mg·kg−1)的生物有效性,进而与PBET结果进行比较验证,发现PBET具有预测受污染土壤中Cd生物有效性的潜力。近年来,PBET也被尝试应用于水体沉积物中重金属生物可利用性测定。DEVESA-REY等[48]用PBET测得9处河流沉积物中As的生物可利用性,结果为1%~11%,和其他萃取方法相比,PBET能更好地评估底栖动物直接摄入重金属污染沉积物的毒性风险。UNDA-CALVO等[49]采用修正的PBET(胃相停留时间为3 h,pH=2.5)分析沉积物中重金属生物可利用性,发现胃相中Zn、Cu、Ni、Cd和Pb生物可利用性分别为22.1%、6.2%、37.7%、11.2%和15.4%,而肠相中Zn、Cu、Ni、Cd和Pb生物可利用性分别为4.0%、7.6%、24.3%、5.7%和5.7%。
1999年,RODRIGUEZ等[20]开发了IVG用来预测污染土壤和固相介质中As的生物有效性,该研究采用IVG测定了15个土壤样品中As(总量401~17 456 mg·kg−1)的生物可利用性,发现IVG胃相和肠相提取的生物可利用态As与幼猪模型获得的生物有效性态As呈较好线性关系。随着方法的改进和推广,IVG又被应用于测定Cd和Pb的生物可利用性,并利用动物模型进行验证。SCHRODER等[28]利用IVG评估了污染土壤中Cd生物可利用性,发现不添加食物(生面团)的胃提取和添加食物的肠提取可较好地预测受污染土壤中Cd相对生物有效性(猪模型)。SCHRODER等[52]继续对IVG进行验证,发现与生面团相关的植酸可能会降低生物可利用态Pb含量。MARSCHNER等[43]利用七步顺序提取法比较了体外实验(IVG)得到的Pb生物可利用性和体内实验(幼猪模型)得到的Pb生物有效性,发现土壤中Pb的绝对和相对生物有效性与IVG(胃相或肠相)提取的生物可利用态Pb均无相关性。
SBRC可很好地预测动物模型体内实验得到的Pb生物有效性。JUHASZ等[21]用SBRC胃提取和肠提取的体外方法评估了铅在污染土壤中的生物可利用性,用Pb参考物质(乙酸铅,1~10 mg·L−1)测定相对生物可利用性。该研究结果显示,胃相和肠相测定的Pb生物可利用性分别为35.7%~64.1%和1.2%~2.7%;通过乙酸铅在pH=6.5(肠相)下的溶解度计算污染土壤中铅相对生物可利用性,其值在11.7%~26.1%之间。UBM建立旨在形成统一的生物可利用性研究方法,适用于不同类型土壤中多种重金属生物可利用性研究。ROUSSEL等[51]收集了27个城市表层土壤样品(花园和草坪),采用UBM测定了Cd、Pb和Zn的生物可利用性。结果表明,Cd、Pb和Zn的生物可利用性在胃相中分别为68%、62%和47%,而在胃肠相中分别为31%、32%和23%。XIA等[10]收集了7种类型澳大利亚土壤,采用UBM评估了As和Cd对Pb生物可利用性的影响。结果表明,胃相中Pb生物可利用性为(44±9)%~(100±7)%,而肠相中降为(1±0.2)%~(36±1.7)%;As和Cd对Pb的生物可利用性都没有影响,说明As和Pb(Cd和Pb)混合物的生物可利用性为简单加和效应。
-
底栖动物摄取沉积物后会经历生物体消化的独特生化过程,这一过程也可用来研究沉积物中重金属生物可利用性。MAYER等[23]研究了从海洋无脊椎动物中提取的消化液对沉积物中Cu和Pb的溶解效应,发现不同物种消化液对沉积物中重金属的溶解存在差异,表明即使在相同摄取模式下,沉积物中重金属生物可利用性相对多种物种也是不同的。WESTON等[53]采用双壳类(Macoma nasuta)生物累积实验和一种新的体外消化液(食用沉积砂屑的多毛类,Arenicola brasiliensis)提取方法,对沉积物中重金属的生物可利用性进行了同步检测。结果显示,消化液中提取的Cd和Pb含量与28 d暴露后双壳类生物体中含量高度相关,表面消化液体外提取法可作为一种预测沉积物中重金属生物积累风险的工具。BAUMANN等[54]采用放射性示踪法研究了多毛类(Alitta succinea)消化沉积物中砷的机理,通过测定沉积物中不同颗粒态砷在肠液或牛血清白蛋白(一种肠液模拟物)中的释放,发现其与多毛类同化效率有关。体外实验能克服体内实验在时间和费用上的限制,从而提供一种与动物模型相比更快速和廉价的生物有效性替代分析方法。目前,有关沉积物中重金属生物可利用性的体外研究方法还处于探索阶段,更多的集中在底栖生物体外消化液模拟提取的研究,还没有像土壤中重金属生物可利用性研究的成熟方法。
-
在重金属离子进入土壤后,会发生吸附、络合、淋溶等一系列反应,进而形成不同的化学形态。不同形态重金属的化学稳定性存在较大差异,使得其生物可利用性和生物有效性亦有所不同,从而产生不同的毒性效应。土壤中重金属的赋存形态与其生物可利用性密切相关,TANG等[18]研究发现PBET测得的Cd-BAc会显著受到弱酸可溶解态Cd含量的影响。土壤中重金属生物有效性会受到重金属化学价态的影响。VAHTER等[55]通过小鼠模型发现在低剂量条件下,肠胃中亚砷酸盐吸收量明显高于砷酸盐,而在高剂量情况下则相反。BCR[37]分级提取的土壤中重金属赋存形态分为4种,其中,弱酸可溶解态、可还原态和可氧化态重金属均具有或潜在具有生物可利用性,而残渣态重金属结合在硅铝酸盐矿物晶格中,通常比较稳定,故不具有生物可利用性[38]。
-
为了维持营养状态,人类每天会摄入大量糖类和蛋白质,而通过口腔暴露摄入的污染土壤会与其他食物发生作用,故摄食状态会影响土壤中重金属生物有效性和生物可利用性的研究。ODANAKA等[56]通过小鼠模型的研究结果表明,小鼠通过口腔摄入最终被肠胃吸收的五价As比例为48.5%,远低于VAHTER等[55]研究的结果(89%),其差异可归因于VAHTER等[55]研究中小鼠在给药前后48 h没有进食,而在ODANAKA等[56]研究中小鼠没有进食限制。人类空腹时胃pH约为1.3~1.5,部分进食时高于2.5,完全进食时高于4.5,而小肠具有接近中性的pH(约为7)。显然,pH会影响重金属在人类消化系统内的溶解度。KENYON等[57]发现,给小鼠喂食纤维含量较低或体积较小的饲料,与用标准啮齿动物食谱的小鼠相比,As的吸收率增加了10%。体外实验也同样表明食物状态会影响土壤中重金属生物可利用性。SCHRODER等[52]利用IVG研究发现食物(生面团)存在会影响土壤中Pb的生物可利用性,进一步发现与生面团相关的植酸会降低Pb的生物可利用性。
-
不同类型土壤的理化性质会对重金属的生物有效性和生物可利用性有着不同程度的影响。对于多数重金属,随 pH 降低,重金属在土壤溶液中的溶解性会增大,土壤对其吸附能力会减弱,进而重金属生物可利用性和生物有效性会升高[51]。此外,土壤中矿物质含量、其他污染改变土壤性质/竞争吸附位点等方式都影响重金属生物有效性和生物可利用性。NG 等[25]总结了前人研究 As 的绝对生物有效性和相对生物有效性结果,发现与毒性研究中通用的纯可溶性盐相比,As 在土壤或灰尘中口服生物利用性要低得多。DAVIS 等[8]指出,这主要是由于控制胃肠相中 As 溶解度的矿物质含量不同所致,如含 As 矿物质本身的溶解度和不溶性基质 (二氧化硅等) 的包封。XIA 等[58]研究了土壤性质对 As 和 Cd 生物可利用性的影响,结果表明,土壤有机碳、氧化铁和氧化铝是影响 As 和 Cd 生物可利用性的关键参数。
土壤中重金属老化是指重金属进入土壤中后,其生物可利用性和生物有效性可能会随时间推移而逐渐降低的过程[11,59]。TANG等[59]研究了老化过程对中国5种典型Cd污染土壤中Cd生物可利用性的影响。结果显示,在强酸性(pH=4.5)土壤中,Cd生物可利用性在老化第1周急剧下降后接近稳定水平(胃相和肠相分别为76.5%~76.9%和52.0%~52.6%);在高pH(>6.0)土壤中,Cd生物可利用性要低得多(胃相和肠相分别为53.3%~72.7%和29.9%~43.4%),且需要2周老化才能达到稳定水平。JUHASZ等[11]使用体外和体内实验评估了长达12个月的As标定土壤的相对生物有效性。结果显示,加标土壤中As的老化过程导致土壤A中(红壤)As的相对生物有效性(猪模型)下降了75%以上,但土壤B(棕壤)即使在老化12个月后,As的相对生物有效性也没有显著影响。
-
酸挥发性硫化物(acid volatile sulphides,AVS)定义为沉积物中用浓度为1 mol·L−1冷HCl处理沉积物后可释放出的硫化物部分,主要由铁锰硫化物组成[60-61]。在厌氧沉积物中,硫酸盐主要由硫酸盐还原菌还原,从而形成AVS[61-62]。沉积物中AVS形成和分布环境非常复杂,与孔隙水理化性质的季节和空间变化有关[63]。在沉积柱中,AVS含量一般随沉积深度增加而升高[64-65]。而在较深层沉积物中观察到较低水平AVS和Fe,可能是由于活性Fe和AVS被沉积物中稳定态或结晶部分所取代[63]。相关研究表明,AVS可能对深层沉积物(约20 cm)中重金属活性起主导作用[16, 66-67]。硫化物在缺氧沉积物中溶解度较低,故AVS含量足够高就能不停地结合阳离子重金属,进而降低对底栖动物对重金属的生物可利用性和生物有效性[68-69]。已有研究通过硫化物标定,发现沉积物中Cu和AVS结合可使其对浅海底片脚类动物幼体的毒性降低[70]。
-
有机质泛指沉积物中来源于生命的物质,如动植物残体、动物粪便、生物膜等[71-72]。在化学分组中,可将有机质分为溶解性有机质、微生物生物炭、胡敏酸、富里酸和胡敏素[73]。有机质(尤其细颗粒)对沉积物中重金属的溶解度和生物有效性有显著影响。在沉积物中,颗粒状有机质相会与重金属结合,已被证明这一过程可降低多种重金属的溶解性和毒性[60, 74-75]。一般认为,粒径小于63 μm的沉积物是重金属吸附和迁移的重要组成部分,这与其具有较大表面积和特殊地球化学组成有关。沉积物中重金属对底栖生物的毒性,在细颗粒有机质含量较高时(尤其是小于63 μm)往往不明显,故基于小于63 μm沉积物组分来预测不同属性沉积物中Cu的亚致死阈值,被普遍认为是有效的[62, 76-78]。此外,已有研究结果还强调了沉积物中有机质在调节底栖生物群落、物种分布和生物量方面的作用[79],可能与生物进食习惯和沉积物中食物分布有关。
-
氧化还原电位(oxidation-reduction potential,ORP)被认为是控制沉积物中重金属迁移转化重要影响因素[80-83],会直接影响到重金属的稳定性和生物有效性。根据含氧量,沉积物氧化还原带通常可垂直分为3层,包括好氧层(氧还原)、亚氧层(硝酸盐和锰铁氧化物还原)和厌氧层(硫酸盐还原和甲烷生成)[60, 75],这3层不同的ORP状态对于沉积物中重金属的生物可利用性和生物有效性有重要影响。此外,沉积物ORP升高会促进硫化物氧化过程,加速有机质降解,从而使得沉积物中吸附/络合态重金属释放,进而改变重金属的生物可利用性和生物有效性[83]。沉积物中硫化物结合态重金属被认为是一种稳定的形态,基本没有生物可利用性和生物有效性。但已有研究表明,随着沉积物中ORP上升,稳定的硫化物结合态Cd比例从65%下降到30%,Cd会转变为具有或潜在具有生物可利用性和生物有效性的形态[82, 84]。也有研究发现沉积物ORP对水丝蚓体内铜和锌的生物累积有一定影响[85]。
-
生活在沉积物中的底栖生物(多毛纲、双壳纲、角足目等)及多种微生物,是目前常用的监测性生物[61, 78, 86-88]。底栖生物的生活特性与沉积物环境密切相关,也会直接影响沉积物中重金属的生物可利用性和生物有效性。一些底栖动物生活行为(摄食方式、生物扰动、摄食深度等)都会影响其对重金属暴露途径[89]。对于沉积物或碎屑捕食者来说,颗粒相可能是重金属暴露的主要途径。例如:两足动物水羽龙,在觅食过程中会摄入大量沉积物,而重金属饮食暴露可能会对其产生毒性作用[70, 90];一些双壳类生物,如樱蛤[78],可通过过滤沉积物-水界面颗粒物,使其在消化道内长期滞留[89];一些底栖双壳类动物也被认为是沉积食性动物,会通过摄食途径在体内累积重金属[62, 91]。沉积物中微生物作用分解有机质的过程,会改变重金属形态,影响其生物可利用性和生物有效性。已有研究发现,由于微生物分解不稳定有机质,促使沉积物中Cu生成铜硫化物,降低了Cu的生物可利用性和生物有效性[91-93]。
-
1)重金属生物有效性和生物可利用性的研究种类主要集中于As、Cd和Pb,未来需要拓展重金属研究种类,丰富土壤/沉积物中重金属生物有效性和生物可利用性的基础数据,同时制定不同分析方法的参考标准,提升不同实验室分析结果的可比性和一致性。
2)重金属生物有效性和生物可利用性的研究对象主要集中于土壤,未来需要借鉴土壤的相关分析方法,推进沉积物中重金属生物有效性和生物可利用性的研究,具体包括分析技术和方法、影响因素和规律、变化过程和驱动机制等方面。
3)有关重金属生物可利用性体外模拟研究方法的适用性研究较少,未来需要结合土壤/沉积物中重金属生物可利用的影响因素,针对性地研发用于不同类型土壤/沉积物中特定重金属或一种类型土壤/沉积物中多种重金属的普适性分析方法。
4)土壤/沉积物中重金属生物有效性和生物可利用性的影响因素十分复杂,未来需要继续研究更多的影响因子,并系统分析多种影响因子的耦合作用,进而为土壤/沉积物中重金属污染控制技术的研发提供参考。
土壤/沉积物中重金属生物有效性和生物可利用性的研究进展
Research progress of bioavailability and bioaccessibility of heavy metals in soil or sediment
-
摘要: 土壤/沉积物中重金属的污染问题越来越引起重视,而重金属在环境中的生态风险与其生物可利用性和生物有效性密切相关。在总结国内外研究的基础上,明确了重金属生物有效性和生物可利用性的定义;概述了用于研究土壤/沉积物中重金属生物有效性的生物模型(小鼠、猪、兔子等);总结了用于研究土壤/沉积物中重金属生物可利用性的几种体外方法,包括模拟人类肠胃消化(PBET、SBRC、UBM等)和底栖生物消化;分析了土壤/沉积物中重金属生物有效性和生物可利用性的关键影响因素(土壤/沉积物理化性质和分析方法)。提出了未来土壤/沉积物中重金属生物有效性和生物可利用性的研究方向,以期为重金属生态风险的评价和控制提供参考。Abstract: Heavy metal pollution of soil/sediment has attracted increasing attention, and heavy metal risk in the environment is closely related to their bioavailability and bioaccessibility. Based on the previous work, this paper clarified the definition of heavy metal bioavailability and bioaccessibility, summarized several animal models (mice, pigs, rabbits, etc.) for assessing heavy metal bioavailability and in vitro digestion models of simulating human stomach (PBET, SBRC, UBM, etc.) or benthon digestion for assessing heavy metal bioaccessibility in soil/sediment, analyzed the key factors (physico-chemical properties of soil/sediment and analysis methods) affecting their bioavailability and bioaccessibility. This study also pointed out the suggestion for future research directions, aiming at providing support for risk assessment and control of heavy metals in soil/sediment.
-
Key words:
- heavy metals /
- bioavailability /
- bioaccessibility /
- soil /
- sediment
-
21世纪以来西藏地区社会经济得到快速发展,生活污水量随之增加[1],为保护脆弱的高原生态环境,高原生活污水的有效处理成为必然。目前西藏地区主要采用A2O、多级AO、氧化沟等工艺,设计和建设中通常参照内地经验,但污水处理厂出水水质却难以稳定达标[2],此外也面临运行操作困难、运行能耗高、污泥膨胀等问题[3]。究其原因,主要有以下3个方面。1)其独特饮食习惯使西藏地区生活污水碳氮比(3~10)偏低[4],而聚磷菌和反硝化菌对有限碳源的竞争[5],导致系统氮磷去除效果不佳。2)高海拔地理条件下,西藏地区主要城市大气压力为52.93~59.87 kPa,含氧量50.36%~67.24%[6],低压条件下不仅水中氧气溶解度降低,曝气时气泡数量和气体滞留律的降低也会间接影响氧气的传质[7];低氧条件与鼓风曝气机的曝气效率直接相关,需要加大曝气量来提高水中的DO。在高原低压低氧环境条件协同作用下,相同工艺的曝气能耗显著增加。3)在高海拔地理条件下,西藏地区城镇污水水温最低可至8 ℃[8],而低温条件下微生物酶活性、基质降解效率、微生物代谢活性、微生物比增长速率都会出现不同程度降低[9],污泥活性的降低使得工艺出水难以达标;此外,低温条件下系统易发生污泥膨胀,包括非丝状菌膨胀和丝状菌膨胀[10-12]。
针对以上高原城镇污水处理困境,近年来有学者进行了高原环境下适用处理工艺的探究。王利等[13]搭建了SBR系统,在低温低压低氧条件下实现系统的快速启动稳定,但出水NH4+-N未能达到《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级B标准。吴永刚[14]改造了氧化沟工艺,将所有预处理设施置于室内,并通过锅炉余热利用和蒸汽加热等措施克服低温问题,冬季出水可稳定达到GB 18918-2002一级B标准,但建设及维护成本显著增加。吕学斌等[15]搭建了深井中试装置实现高压曝气,可以克服低温低压低氧问题,但施工难度大。目前改良或新开发的工艺存在出水水质不稳定、成本高、施工难等不足,难以在高原推广应用。因此,针对高原气候环境三低特点和进水水质,提出适应高原环境且出水水质稳定达标的城镇污水低碳处理工艺十分必要。
本研究构建了多阶折流A2O一体化中试装置,分析了装置的启动运行特征,考察了常温下气水比、污泥内外回流比、进水量等工艺参数对运行效能的影响,解析了污染物的去除效能、磷在系统中的分布。以期为高原生活污水的高效低碳处理提供参考。
1. 材料与方法
1.1 实验装置
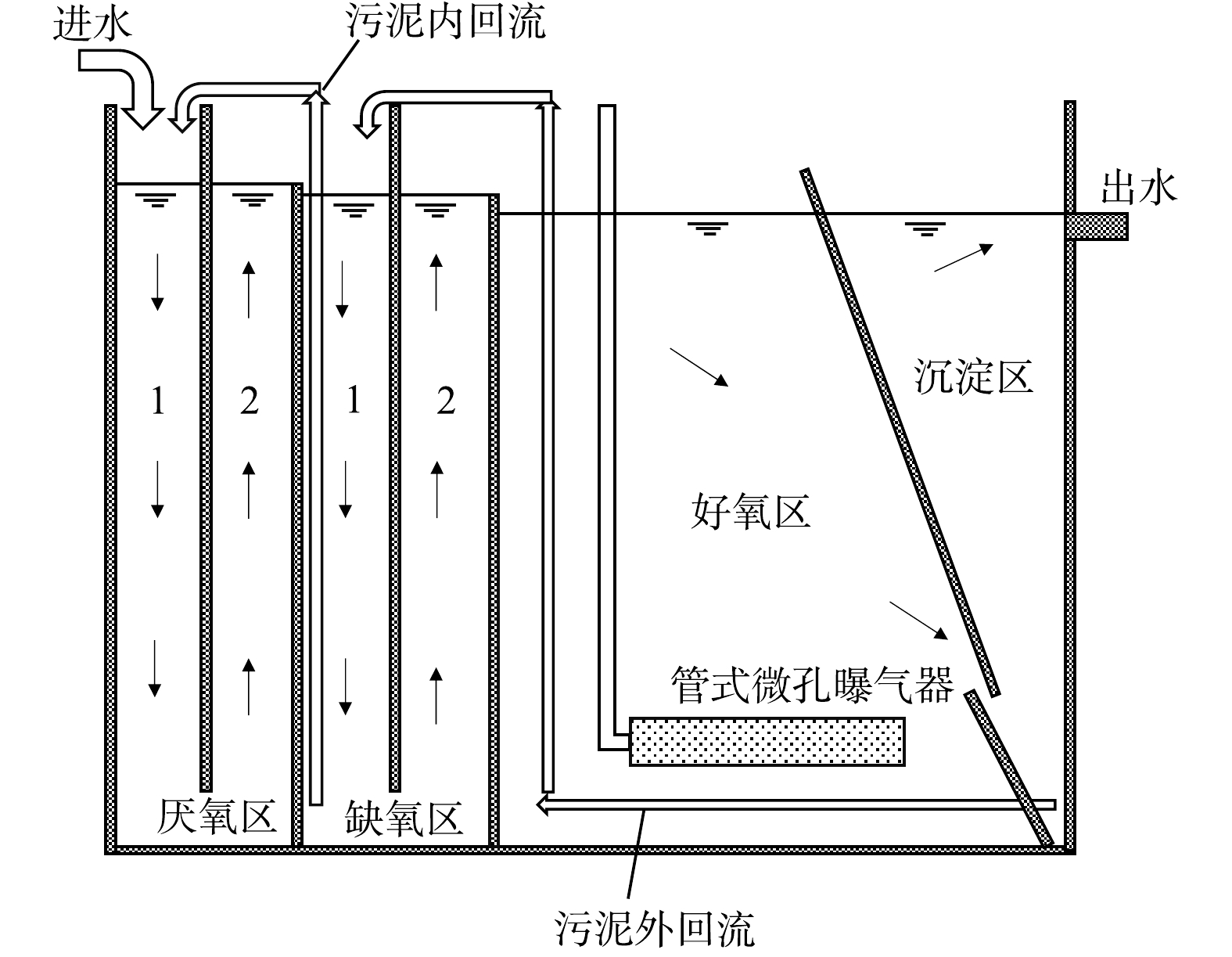
如图1所示,实验装置由厌氧区、缺氧区、好氧区和沉淀区顺序连接组成。污水由进水泵提升进入一体化中试装置,厌缺氧区内设置竖向导流板,将厌氧区和缺氧区均分别隔成1区和2区2个竖向流串联的反应室,污水通过重力流从第1格到最后一格上下折流至好氧区。好氧区池底配有膜式曝气器,混合液从隔板缝隙进入沉淀区泥斗中下部,上清液由排水槽收集后排放。沉淀区底部设置污泥外回流管,沉淀污泥气提外回流至缺氧1区;缺氧1区底部设置内回流管,污泥气提内回流至厌氧1区。含有硝酸盐的沉淀区外回流污泥与含有磷的厌氧区出水在缺氧区混合,具有发生反硝化除磷的条件[16]。
多阶折流A2O一体化中试装置有效容积为5.7 m³,厌氧区和缺氧区中的2个分区容积均为0.6 m³,好氧区和沉淀区的容积分别为2.35 m³和0.95 m³,进水流量为2~3 m³·d−1。如图2所示,装置循环运行,运行单周期为20 min,分为2个阶段。阶段1好氧区曝气且污泥气提回流;阶段2停止曝气,各区污泥沉降。其中阶段1的时间可根据实验需求进行调整(不超过10 min)。单周期的前10 min不进水,后10 min进水,进水控制在污泥沉降阶段,以使污泥保持悬浮状态。
1.2 实验废水水质与实验方法
一体化中试装置在拉萨市某污水处理厂内运行,实验实验用水取自污水厂粗格栅井。污水水质如表1所示。可见,进水COD/N比值为5.5~6.5,属于典型的低C/N污水。其中6月中旬至8月末为拉萨雨季,污染物的质量浓度较低。接种污泥取自污水处理厂改良型氧化沟工艺,接种后好氧区初始污泥质量浓度为2 100 mg·L−1左右,初始运行参数设置为进水量2 m³·d−1、气水比30、污泥内外回流比均为14。启动运行稳定后,以出水水质稳定达到《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级B标准为目标,依次优化进水量、气水比、污泥内外回流比等参数。实验历时110 d,期间未排泥,进水水温为18~20 ℃。
表 1 实验进水水质Table 1. Water quality of experimental influentmg·L−1 统计值 COD NH4+-N TN TP 范围 126.2~227.0 15.9~29.1 20.3~36.4 1.9~3.4 平均值 167.1 21.9 27.8 2.8 1.3 常规项目检测
水样经过0.45 μm滤膜(上海新亚)过滤后,COD、NH4+-N、NO3−-N、TN、TP分别采用快速消解分光光度法、纳氏试剂分光光度法、紫外分光光度法、碱性过硫酸钾消解紫外分光光度法、钼酸铵分光光度法测定[17],药剂为连华科技预制试剂。采用称量法测定污泥质量浓度MLSS,通过SV30测定污泥体积指数SVI。采用多参数水质检测仪(哈希HQ30d)测定DO及ORP值。
1.4 污泥磷含量分析
多阶折流A2O工艺可在不排泥情况下,通过单位质量污泥TP含量和装置污泥总量的增加,实现系统可储磷总量不断提高从而达到工艺除磷目标,本研究考察分析了一体化中试装置稳定运行阶段单位质量污泥TP含量及不同形态磷分布。
单位质量污泥不同形态磷含量采用欧洲标准测量组织提出的SMT(Standards,Measure-ments and Testing Programme)法[18]测定,该方法将磷分为5种形态,包括总磷(TP)、有机磷(OP)、无机磷(IP)、非磷石灰态无机磷(NAIP,Fe、Mn、Al结合的磷)、磷灰石态无机磷(AP,与Ca结合的磷),采用钼酸铵分光光度法[19]测定各级提取液中磷。
2. 结果与分析
2.1 装置启动
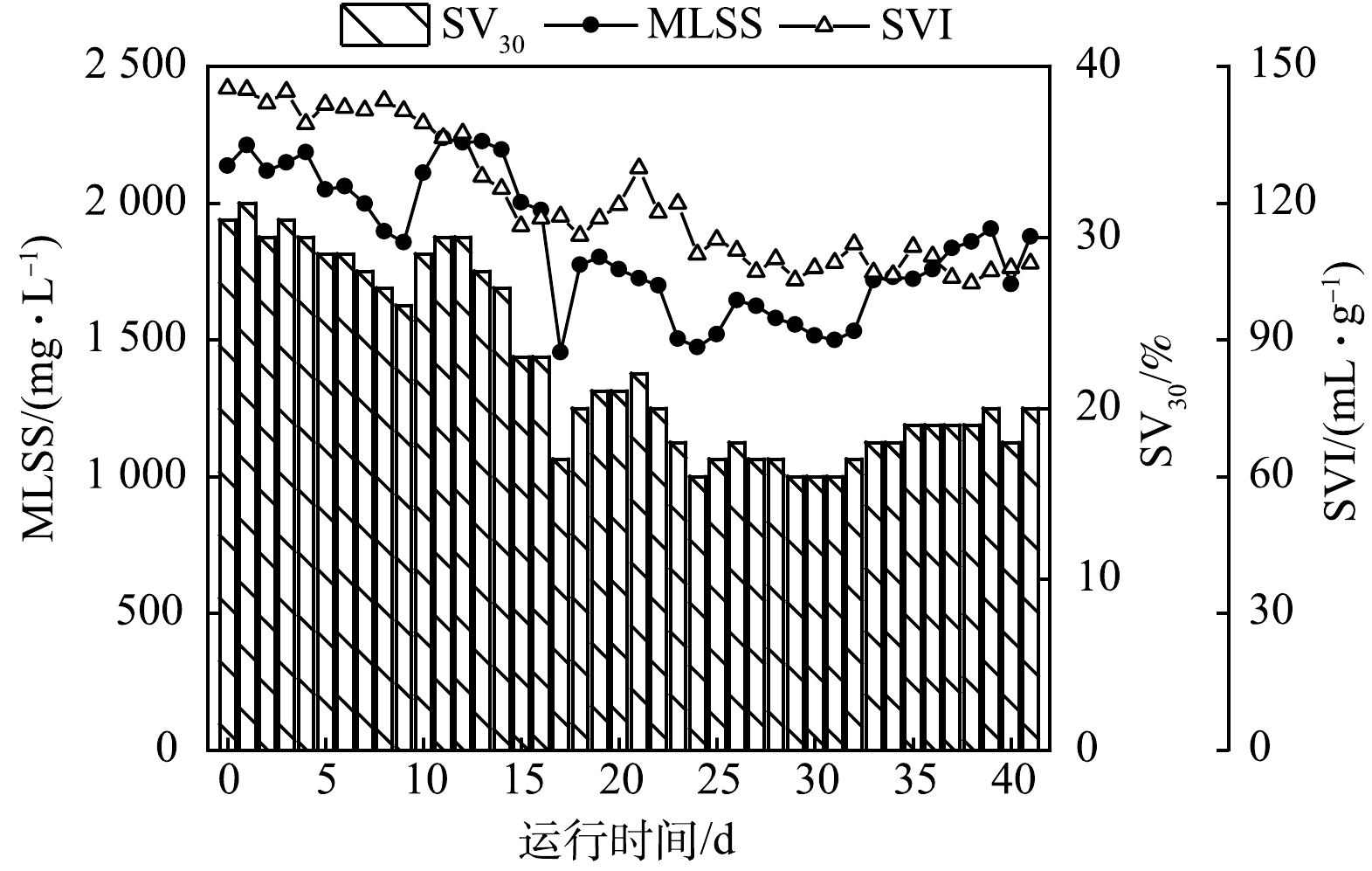
启动培养期间好氧区的污泥参数变化如图3所示。因厌氧缺氧折流区域污泥沉降均匀不一,取好氧区曝气混合状态下的污泥样品可反映工艺全池污泥参数变化。接种污泥后好氧区MLSS为2 136 mg·L−1,因沉淀区表面频繁出现漂浮老化污泥并清理,故系统污泥量缓慢降低,启动第23天好氧区MLSS已降至1 500 mg·L−1左右。随着活性污泥对池内环境逐步适应,系统污泥量逐渐上升,启动培养42 d后好氧区MLSS恢复至1 876 mg·L−1。实验中取自污水厂氧化沟的接种污泥SVI高达145 mL·g−1,处于膨胀状态,沉降性能差,启动培养41 d后好氧区SVI降至107 mL·g−1,沉降性能显著改善。这表明工艺间歇运行模式可有效抑制污泥膨胀[11]。
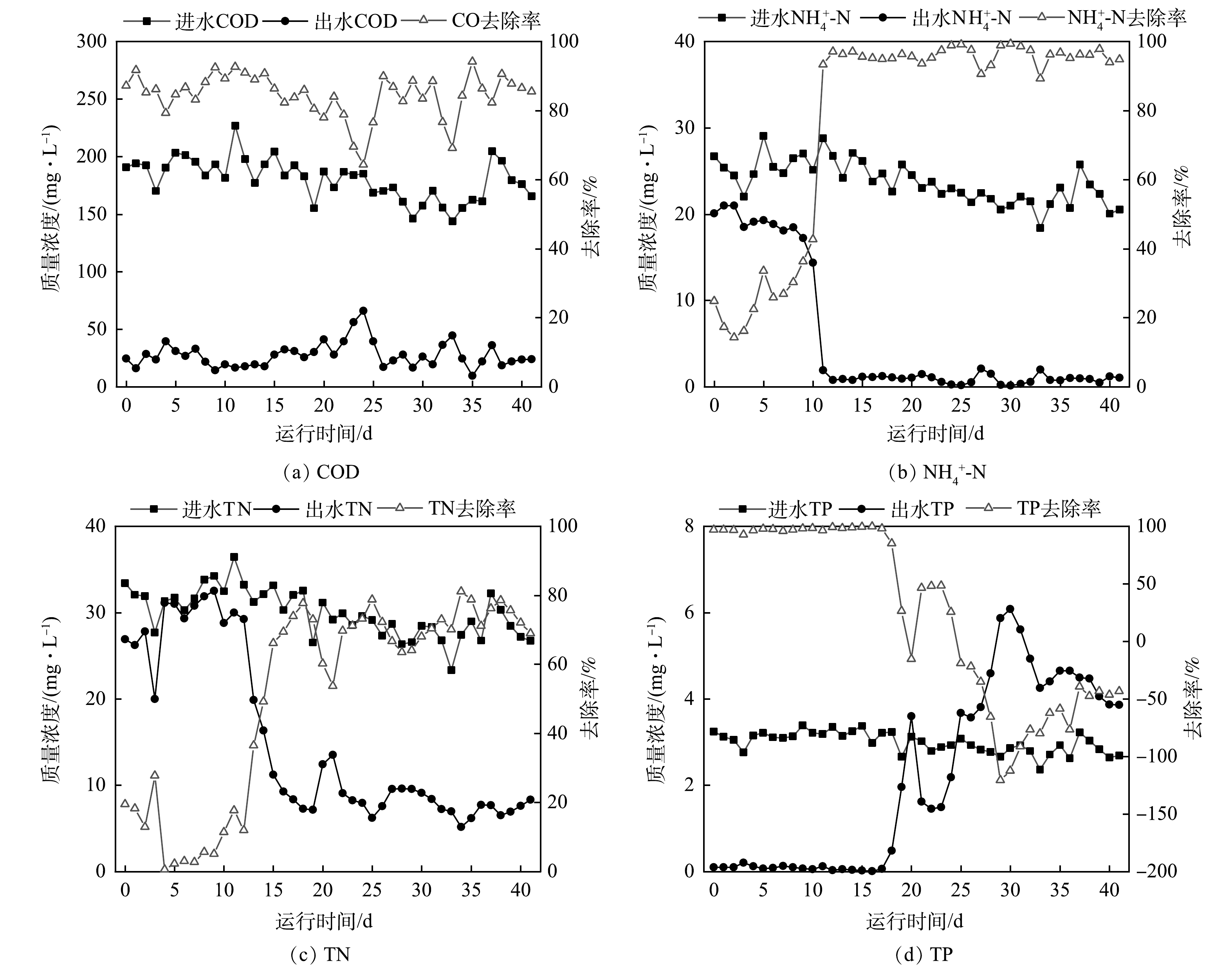
启动期间工艺处理效果如图4所示。出水COD为(40.3±25.8) mg·L−1,大部分时间可达到《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准。启动前10 d,出水NH4+-N为(17.7±3.3) mg·L−1;第11天出水NH4+-N快速下降至1.9 mg·L−1。硝化效率的快速增长得益于有机物在前端厌氧、缺氧区得到了充分去除,并且在好氧区中28.2 h的水力停留时间为硝化菌的生长提供良好环境[20-21]。在硝化效率得到提升时,出水TN随反硝化脱氮作用的增强而持续降低,启动17d后出水TN为(8.8±3.6) mg·L−1。TP变化不同于其他指标,启动前17 d出水TP低于0.5 mg·L−1,但伴随着出水TN的降低,出水TP却于第18天快速波动上升,最高值达到6.1 mg·L−1,远高于进水TP(3.1 mg·L−1),富集于污泥中的磷得到释放。
厌氧区未实现厌氧环境是出水TP超标的主要原因。曝气结束时好氧区DO为3.6 mg·L−1,而在污泥内外回流共同作用下,部分富氧污泥从沉淀区经缺氧区回流至厌氧区,由于DO与ORP值呈正相关[22],导致污泥回流后厌氧1区ORP值提升至-75.8 mV,破坏了厌氧环境,进而影响有机物的转化和厌氧释磷[23]。另一方面,启动10 d后硝化效率显著提升,大量NO3−-N 在高内外污泥回流比时,从好氧区依次回流至缺氧区、厌氧区,并于厌氧区发生反硝化,与厌氧释磷过程竞争碳源,从而导致内碳源PHA生成量减少[24],好氧区聚磷过程所需能量不足,因此,在出水TN浓度降低的同时,TP浓度大幅上升。
2.2 进水量2 m³·d−1参数优化对装置处理效能影响
为使出水TP达标,保持进水量为2 m³·d−1,调整气水比与污泥内回流比,以提供厌氧区厌氧释磷所需的环境条件。气水比在参数未优化的起始时刻和参数优化第3天由30分别降至25、20,气水比调整后好氧区DO降至(2.6±0.1) mg·L−1,厌氧区ORP值稳定低于−150 mV,满足厌氧释磷所需的厌氧区ORP低于-100 mV的条件[25-26]。
污泥内回流比在参数优化后的第7、24和41天由14分别降至12、9和7,内回流污泥NO3−-N 质量浓度保持在(5.5±0.5) mg·L−1,未发生显著变化,但回流总量降至初始的50%,携带至厌氧区NO3−-N量显著减少,因此,反硝化对厌氧释磷的碳源竞争减弱。装置运行中需通过一定的回流量维持厌氧区、缺氧区污泥悬浮所需的水力条件,避免污泥沉淀导致污泥厌氧发酵,因此,未进一步调低污泥内回流比。
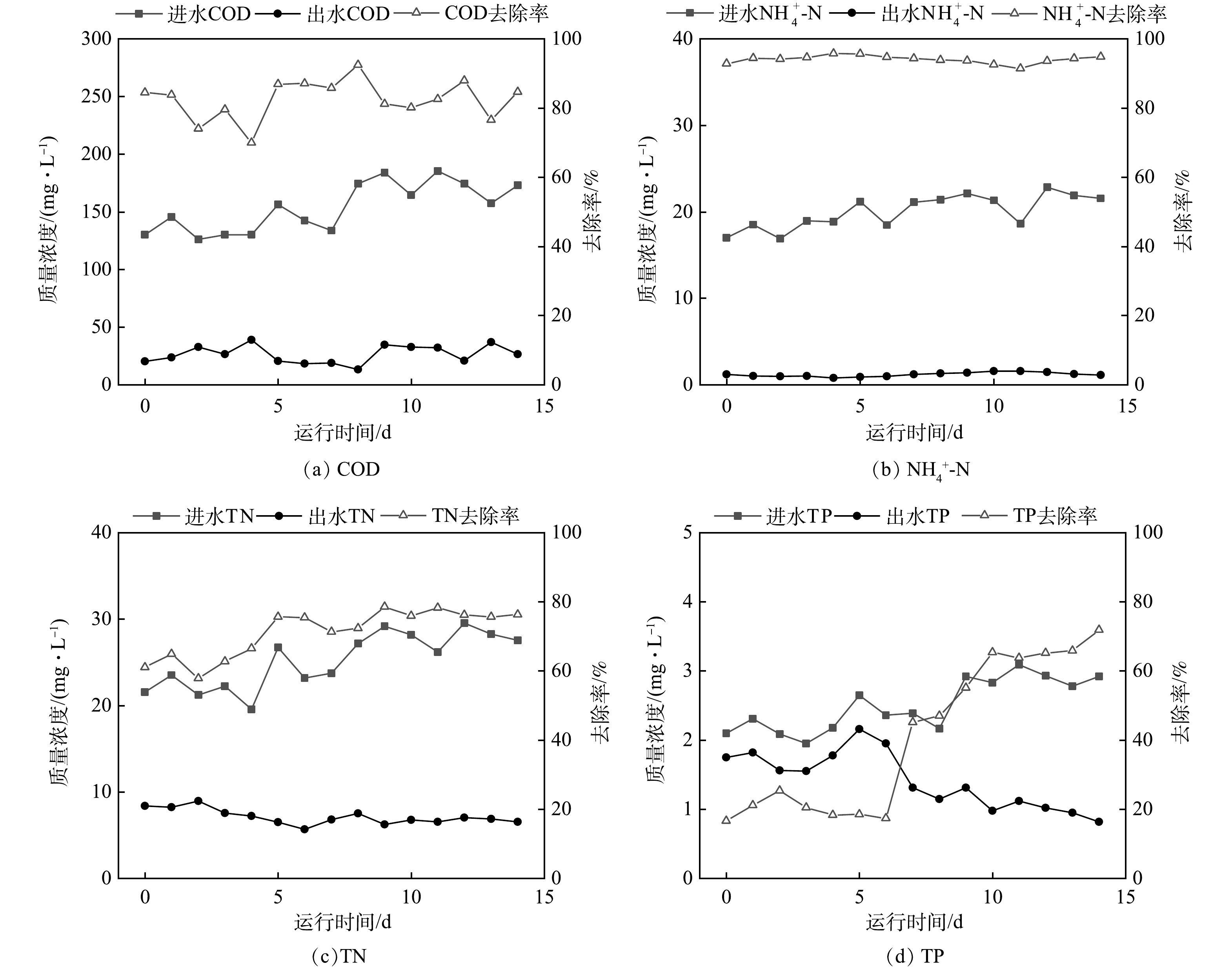
参数优化期间工艺处理效果如图5所示。出水COD、TN、NH4+-N分别为(25.2±15.1)、(7.8±3.1)和(1.1±0.8) mg·L−1,稳定达到《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准。参数优化43 d后出水TP降至(2.1±0.3) mg·L−1,相较于进水平均降低0.5 mg·L−1,系统除磷性能有所恢复。
2.3 进水量3 m³·d−1参数优化对装置处理效能影响
参数未优化的起始时刻将进水量提高至3 m³·d−1,污泥内外回流量不变,但污泥内外回流比分别降至4.5、9.5,减少了反硝化对厌氧释磷过程碳源竞争的影响,同时兼顾了厌氧区和缺氧区混合液水力搅拌需求。
参数优化期间工艺处理效果如图6所示,出水COD、TN、NH4+-N分别为(26.1±12.9)、(7.3±1.6)和(1.2±0.6) mg·L−1,与2 m3·d−1优化运行期间出水水质相当,稳定达到《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准。参数优化后的第14天出水TP降至0.8 mg·L−1,去除率提升至71%,明显优于2 m3·d−1处理量时的TP去除率。
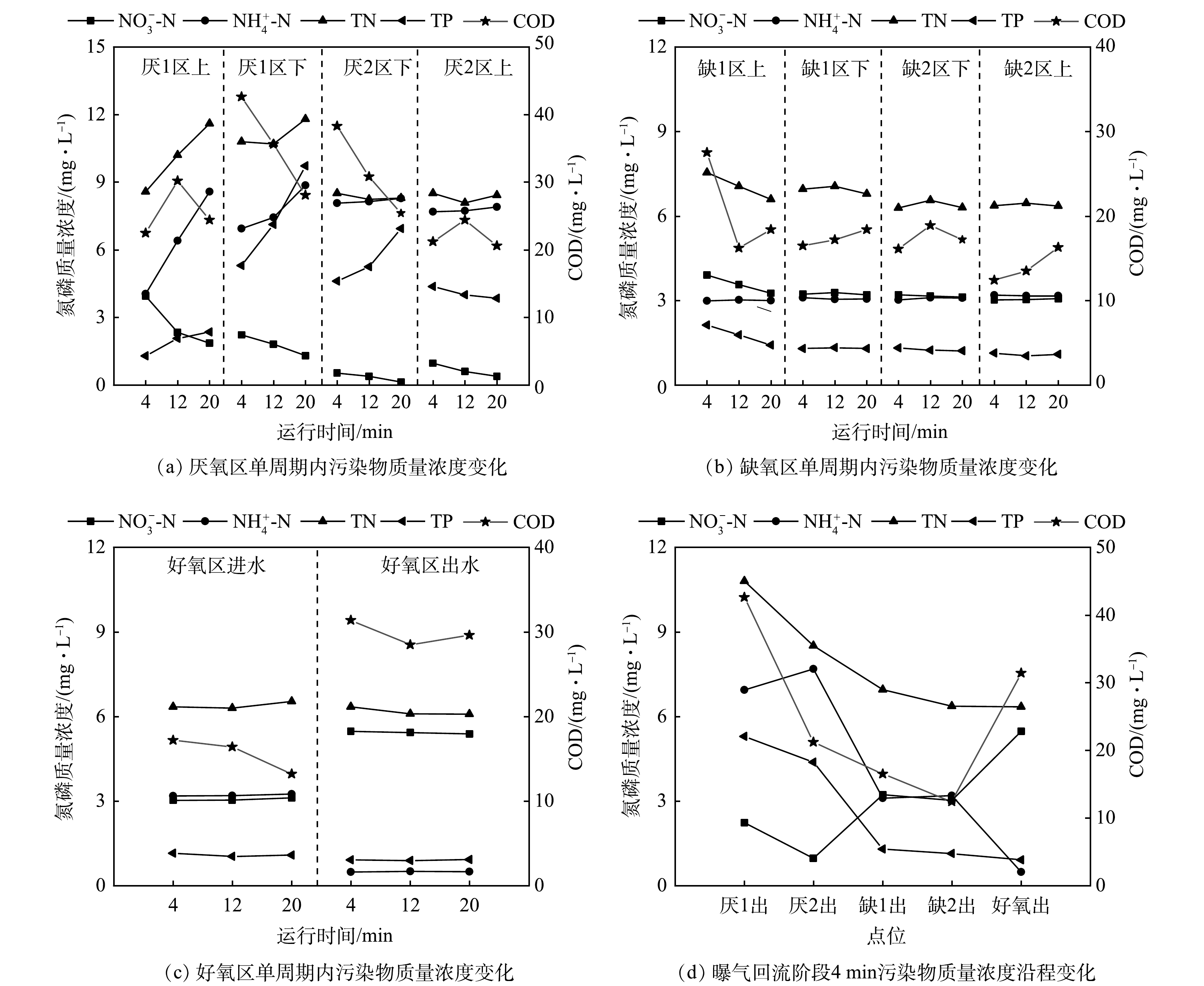
参数优化后的第14天分析了反应装置污染物浓度的沿程变化。在20 min运行周期内,分别考察曝气回流阶段(4 min)、污泥沉降中期(12 min)和污泥沉降末期(20 min,即单周期结束时)厌氧1区和2区、缺氧1区和2区上下层、好氧区进水和出水的水质变化,同时考察了曝气回流阶段(4 min)装置沿程水质。其中厌氧、缺氧折流区上下层水样采样点为每一单格水面以下0.1 m和池底以上0.1 m。由于多阶折流A2O工艺污泥内外回流比相较于常规活性污泥工艺更高[27],因此,对进水污染物稀释作用明显,各池污染物质量浓度变化较小。
厌氧区水质变化如图7(a)所示。曝气回流阶段上一周期的进水在内回流推流作用下,分布于厌氧区,厌氧1区下层和2区下层的COD分别为42.6 mg·L−1和38.3 mg·L−1。沉降阶段伴随着厌氧释磷和反硝化反应的进行,厌氧1区下层和2区下层COD分别降至28.1 mg·L−1和25.4 mg·L−1 。曝气回流阶段厌氧1区上层和2区上层NO3−-N 分别为3.9 mg·L−1和0.7 mg·L−1,降低了3.2 mg·L−1。沉降阶段厌氧1区上层和1区下层NO3−-N 分别降低2.1 mg·L−1和0.9 mg·L−1,表明厌氧1区是厌氧区脱氮反应主要区域。曝气回流阶段厌氧2区上层TP为4.4 mg·L−1,释磷比达到157.7%,满足后端超量吸磷需求[28]。沉降阶段由于厌氧区碳源供给充分,因此是主要厌氧释磷区域,释磷后厌2区下TP最高达到9.7 mg·L−1。
缺氧区水质变化如图7(b)所示。曝气回流阶段缺氧1区上层和2区上层TP和NO3−-N分别为 2.1、1.1 mg·L−1和3.9、3.0 mg·L−1,对应质量浓度分别下降1.0 mg·L−1和0.9 mg·L−1,反硝化除磷过程去除的磷与氮理论比
ΔPO43−/ΔNO3−−N= 好氧区水质变化如图7(c)所示。曝气阶段NH4+-N由3.2 mg·L−1降至0.5 mg·L−1,NO3−-N由3.0 mg·L−1升至5.5 mg·L−1,硝化效果良好。COD由17.2 mg·L−1升至31.4 mg·L−1,其主要原因是好氧区水力停留时间达到18.8 h,部分衰亡期污泥在曝气过程中氧化分解释放有机物[30],回流至缺氧区后也为缺氧区的反硝化提供了碳源。由于聚磷菌内碳源在缺氧区的反硝化除磷过程被消耗,好氧聚磷的能量不足,TP仅由1.1 mg·L−1降至0.9 mg·L−1。
曝气回流末期沿程水质变化如图7(d)所示。水中有机物在厌氧区和缺氧区消耗后降至12.4 mg·L−1,而因部分老化污泥曝气氧化分解,好氧区出水增至31.4 mg·L−1。厌氧释磷后厌氧区出水TP为4.4 mg·L−1,外回流污泥中TP为1.1 mg·L−1,外回流污泥与厌氧区出水按9.5:4.5比混合汇入缺氧区前端,因此缺氧区进水TP为2.1 mg·L−1,经反硝化除磷作用缺氧区出水降至1.1 mg·L−1,缺氧区对磷去除的贡献率为83.3%。厌氧区出水NH4+-N为7.7 mg·L−1,在外回流污泥稀释作用及少量同化作用下,缺氧区出水NH4+-N降至3.2 mg·L−1,经硝化作用好氧区出水NH4+-N进一步降至0.5 mg·L−1。好氧区出水NO3−-N为5.5 mg·L−1,而通过外回流污泥(回流比为9.5)和内回流污泥(回流比为4.5),NO3−-N被带回厌氧区和缺氧区进行脱氮反应,厌氧区内和缺氧区内去除的NO3−-N分别为3.2 mg·L−1和0.9 mg·L−1,厌氧区、缺氧区对氮去除的贡献率分别为62.7%、37.3%。
综上所述,厌氧区实现有机物转化和厌氧释磷的同时,承担了系统主要脱氮功能;缺氧区发生反硝化除磷,其除磷脱氮比与理论值接近,是系统主要除磷单元;好氧区通过硝化反应有效去除NH4+-N,基本实现了多阶折流A2O工艺设计的各分区污染物去除功能。
2.4 不同阶段单位质量污泥磷含量
自启动以来,仅清除厌氧区少量漂浮老化污泥,没有排出剩余污泥,进水TP为(2.7±0.7) mg·L−1,后期出水稳定低于1.0 mg·L−1。不同阶段单位质量污泥磷含量如表2所示,A、B、C分别为进水量2 m³·d−1参数优化开始、结束(53 d)和进水量3 m³·d−1参数优化结束(14 d)的装置沉淀区污泥样品,3份污泥样品TP含量为23.45~27.99 mg·g−1,较西藏地区污泥中TP含量平均值(15.9~16.2 mg·g−1)高60% [31],表明高原环境下多阶折流A2O工艺相较于其他工艺表现出更强的污泥储磷能力。随着时间的推移,单位质量污泥TP含量也在不断增高,进水量2 m³·d−1参数优化结束(B)较2 m³·d−1参数优化开始(A)增加1.87 mg·g−1,进水量3 m³·d−1参数优化结束(C)较2 m³·d−1参数优化结束(B)增加2.67 mg·g−1,好氧区MLSS由1 876 mg·L−1(A)提升至2 450 mg·L−1(C),单位质量污泥TP含量和污泥量的增加代表系统可储磷总量不断提高。在运行3~4个月后,可排出一部分污泥以维持系统稳定运行,并将磷移出系统外,长时段内集中排泥有利于污泥的处置管理,符合西藏地区污水厂运维技术薄弱现状。
表 2 不同阶段单位质量污泥磷含量及污泥质量浓度Table 2. Phosphorus content in per unit mass of sludge at different stages样品 TP/(mg·g−1) IP/(mg·g−1) NAIP/(mg·g−1) AP/(mg·g−1) OP/(mg·g−1) MLSS/(mg·L−1) A 23.45 17.46 11.46 6.52 4.62 1876 B 25.32 19.25 12.59 6.52 5.62 2368 C 27.99 22.36 16.69 5.54 5.11 2450 IP是污泥中总磷主要存在形态,IP在TP中的占比为74.5%~79.9%;而NAIP则是主要无机磷形态,NAIP的占比为65.4%~74.6%。本研究中,这2种磷形态占比与国内市政污水厂单位质量污泥磷形态占比统计结果一致[31]。生物有效磷也是与SMT磷分类法密切相关的指标,其为能够以溶解态磷酸盐释放,并被植物、藻类等生物生长利用的磷[32]。根据RUBAN等[18]提出的方法,生物有效磷可通过NAIP+OP粗略计算得出。本系统中单位质量污泥生物有效磷占TP比例为68.6%~77.8%,表明系统中大部分的磷可以被生物利用,可为阶段性排放的污泥通过堆肥实现资源化利用提供参考。
3. 结论
1)多阶折流A2O工艺启动运行稳定后,出水TN、NH4+-N和COD稳定达到《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A标准。通过优化气水比、污泥回流比等参数,可为系统提供厌氧释磷和反硝化除磷环境。当进水量为3 m³·d−1、气水比为20、污泥内回流比为4.5、污泥外回流比为9.5时,在系统不排泥的情况下,出水TN、NH4+-N和COD稳定达到一级A标准,TP稳定达到一级B标准。
2)多阶折流A2O工艺中单位质量污泥TP含量较西藏污水厂平均水平高60%,其表现出更强的储磷能力,随着单位质量污泥TP含量和污泥量的增加,系统储磷总量不断提高,表明该工艺可用于高原城镇生活污水的处理。
-
表 1 沉积物中重金属生物有效性测定常用模型
Table 1. Models for the determination of heavy metal bioavailability in sediment
元素 模型物种 沉积物中重金属含量 同化效率/% 参考文献 Ag 波罗海白樱蛤(Macoma balthica) 0.2~4.8 µg·g−1(可提取态) 14.7~27.6 [46] Ag 贻贝(Mytilus edulis) 0.2~4.8 µg·g−1(可提取态) 2.6~3.5 [46] Ag 波罗海白樱蛤(Macoma balthica) 0.43~0.84 µg·g−1(总量) 12~22 [30] Cd 波罗海白樱蛤(Macoma balthica) 0.17~0.40 µg·g−1(总量) 6~13 [30] Cd 波罗海白樱蛤(Macoma balthica) <0.2 µg·g−1(可提取态) 9~21 [34] Cd 贻贝(Mytilus edulis) <0.2 µg·g−1(可提取态) 15.7~ 35.4 [34] Cd 菲律宾哈仔(Ruditapes philippinarum) — 29.7~36.1 [35] Cd 波罗海白樱蛤(Macoma balthica) 0.02~0.2 µmol·g−1(可提取态) 13.7~20.5 [46] Cd 贻贝(Mytilus edulis) 0.02~0.2 µmol·g−1(可提取态) 10.3~19.1 [46] Co 波罗海白樱蛤(Macoma balthica) 8.8~17.6 µg·g−1(总量) 8~20 [30] Hg 贻贝(Mytilus edulis) — 1~9 [44] CH3Hg 贻贝(Mytilus edulis) — 5~87 [44] 表 2 土壤中重金属生物可利用性体外模拟实验法
Table 2. In vitro gastrointestinal simulation models for the determination of heavy metal bioaccessibility in soil
方法 提取相 组成成分 固液比 温度/℃ pH 时间/h 优点与不足 PBET 胃 1.25 g胃蛋白酶,0.5 g苹果酸钠,0.5 g柠檬酸钠,420 μL乳酸,500 μL醋酸 1∶100 37 2.5 1 胃相提取成分中加有机酸类,参照2~3岁儿童消化系统,但没有考虑食物影响 肠 1.75 g胆汁(猪),0.5 g胰液素(猪) 1∶100 37 7.0 4 IVG 胃 10 g胃蛋白酶(猪),8.77 g NaCl 1∶150 37 1.8 1 胃相提取成分简单,肠相提取时间短,但仅考虑单一食物进食影响 肠 3.5 g胆汁(猪),0.35 g胰液素(猪) 1∶150 37 5.5 1 SBRC 胃 30.03 g甘氨酸 1∶100 37 1.5 1 胃相提取成分简单,但肠相提取时间较长 肠 1.75 g胆汁(牛),0.5 g胰液素(猪) 1∶100 37 7.0 4 UBM 唾液 0.896 g KCl,0.888 g NaH2PO4,0.2 g KSCN,0.57 g Na2SO4,0.298 g NaCl,1.8 mL NaOH (1 mol·L−1),0.2 g尿素,0.145 g α-淀粉酶,0.05 g黏蛋白,0.015 g尿酸 1∶15 37 6.5 1/360 增加了唾液相,结果更准确,普适性更强,但各个提取相成分复杂,操作繁琐 胃 0.824 g KCl,0.266 g NaH2PO4,2.752 g NaCl,0.4 g CaCl2,0.306 g NH4Cl,8.3 mL HCl(37%),0.085 g尿素,0.65 g葡萄糖,0.02 g葡萄糖醛酸,0.33 g氨基葡萄糖盐酸盐,3.0 g黏蛋白,1.0 g血清蛋白(牛),1.0 g胃蛋白酶 1∶37.5 37 1.2 1 肠 0.94 g KCl,12.3 g NaCl,11.4 g NaHCO3,0.08 g KH2PO4,0.05 g MgCl2,0.36 mL HCl(37%),0.35 g尿素,0.42 g CaCl2,2.8 g血清蛋白(牛),3.0 g胰液素,0.5 g脂肪酶,6.0 g胆汁(包括十二指肠液和胆汁液) 1∶97.5 37 6.3 4 表 3 不同类型土壤中重金属生物可利用性
Table 3. Heavy metal bioaccessibility in different types of soil
元素 土壤类型 样本数量/个 体外方法 BAc/% 参考文献 As 住宅区土壤 2 PBET肠相 44~501) [36] As 中国土壤(耕地、采矿区和冶炼区) 11 UBM胃相 7.59~52.4 [50] As 中国土壤(耕地、采矿区和冶炼区) 11 UBM肠相 5.74~52.9 [50] As 中国土壤(耕地、采矿区和冶炼区) 11 SBRC胃相 2.33~49.2 [50] As 中国土壤(耕地、采矿区和冶炼区) 11 SBRC肠相 0.46~32.6 [50] As 中国土壤(耕地、采矿区和冶炼区) 11 IVG胃相 7.26~44.1 [50] As 中国土壤(耕地、采矿区和冶炼区) 11 IVG肠相 2.32~42.3 [50] As 中国土壤(耕地、采矿区和冶炼区) 11 PBET胃相 1.33~37.7 [50] As 中国土壤(耕地、采矿区和冶炼区) 11 PBET肠相 0.86~42.8 [50] Cd 危险废弃物堆放区土壤 10 IVG胃相(有生面团) 11.7~47.5 [28] Cd 危险废弃物堆放区土壤 10 IVG肠相(有生面团) 4.05~19.5 [28] Cd 危险废弃物堆放区土壤 10 IVG胃相(无生面团) 21.3~95.9 [28] Cd 危险废弃物堆放区土壤 10 IVG肠相(无生面团) 15.0~55.0 [28] Cd 污染土壤(农业区、采矿区、住宅区等) 12 PBET胃相 35~97 [12] Cd 污染土壤(农业区、采矿区、住宅区等) 12 PBET肠相 19~64 [12] Cd 污染土壤(农业区、采矿区、住宅区等) 12 SBRC胃相 59~103 [12] Cd 污染土壤(农业区、采矿区、住宅区等) 12 SBRC肠相 38~77 [12] Cd 污染土壤(农业区、采矿区、住宅区等) 12 UBM胃相 61~99 [12] Cd 污染土壤(农业区、采矿区、住宅区等) 12 UBM肠相 20~56 [12] Cd 污染土壤(农业区、采矿区、住宅区等) 12 IVG胃相 54~107 [12] Cd 污染土壤(农业区、采矿区、住宅区等) 12 IVG肠相 42~88 [12] Cu 城市表层土壤 27 UBM胃相 682) [51] Cu 城市表层土壤 27 UBM肠相 312) [51] Pb 矿渣 2 PBET胃相 9.5~351) [36] Pb 矿渣 2 PBET肠相 4.6~8.31) [36] Pb 住宅区土壤 2 PBET胃相 70~831) [36] Pb 住宅区土壤 2 PBET肠相 29~541) [36] Pb 危险废弃物堆放区土壤 18 IVG胃相(无生面团) 32.22) [52] Pb 危险废弃物堆放区土壤 18 IVG肠相(无生面团) 1.062) [52] Pb 危险废弃物堆放区土壤 18 IVG胃相(有生面团) 23.02) [52] Pb 危险废弃物堆放区土壤 18 IVG肠相(有生面团) 0.562) [52] Pb 德国土壤(耕地、采矿区和冶炼区) 15 IVG胃肠相 (无牛奶) 3~20 [43] Pb 德国土壤(耕地、采矿区和冶炼区) 15 IVG胃肠相 (有牛奶) 11~56 [43] Pb 住宅区土壤 2 SBRC胃相 35.7~ 61.0 [21] Pb 住宅区土壤 2 SBRC肠相 2.1~2.7 [21] Pb 焚烧厂土壤 3 SBRC胃相 60.9~64.1 [21] Pb 焚烧厂土壤 3 SBRC肠相 1.2~2.3 [21] Pb 城市表层土壤 27 UBM胃相 622) [51] Pb 城市表层土壤 27 UBM肠相 322) [51] Zn 城市表层土壤 27 UBM胃相 472) [51] Zn 城市表层土壤 27 UBM肠相 232) [51] 注:1)为相对生物可利用性;2)为均值。 -
[1] 蔡美芳, 李开明, 谢丹平, 等. 我国耕地土壤重金属污染现状与防治对策研究[J]. 环境科学与技术, 2014, 37(2): 223-230. [2] 俞慎, 历红波. 沉积物再悬浮-重金属释放机制研究进展[J]. 生态环境学报, 2010, 19(7): 1724-1731. doi: 10.3969/j.issn.1674-5906.2010.07.038 [3] ZAHRA A, HASHMI M Z, MALIK R N, et al. Enrichment and geo-accumulation of heavy metals and risk assessment of sediments of the Kurang Nallah-Feeding tributary of the Rawal Lake Reservoir, Pakistan[J]. Science of the Total Environment, 2014, 470: 925-933. [4] SOFUOGLU S C, SOFUOGLU A. An exposure-risk assessment for potentially toxic elements in rice and bulgur[J]. Environmental Geochemistry and Health, 2018, 40(3): 987-998. doi: 10.1007/s10653-017-9954-1 [5] WATANABE T, WANG P Y, LIU A P, et al. Dietary intake of cadmium and lead by kindergarten children in several cities and villages in china[J]. Biomedical Research on Trace Elements, 2017, 28(1): 18-27. [6] JUHASZ A L, WEBER J, SMITH E, et al. Assessment of four commonly employed in vitro arsenic bioaccessibility assays for predicting in vivo relative arsenic bioavailability in contaminated soils[J]. Environmental Science & Technology, 2009, 43(24): 9487-9494. [7] 李士伟. 污染土壤中典型重金属的人体生物有效性研究[D]. 南京: 南京大学, 2017. [8] DAVIS A, RUBY M V, BERGSTROM P D. Bioavailability of arsenic and lead in soils from the Butte, Montana, mining district[J]. Environmental Science & Technology, 1992, 26(3): 461-468. [9] XIA Q. Assessing exposure risk of arsenic, cadmium and lead (or mixed with PAHs) in soils using in-vitro methods[D]. Queensland: The University of Queensland, 2016. [10] XIA Q, PENG C, LAMB D, et al. Effects of arsenic and cadmium on bioaccessibility of lead in spiked soils assessed by unified BARGE method[J]. Chemosphere, 2016, 154: 343-349. doi: 10.1016/j.chemosphere.2016.03.133 [11] JUHASZ A L, SMITH E, WEBER J, et al. Effect of soil ageing on in vivo arsenic bioavailability in two dissimilar soils[J]. Chemosphere, 2008, 71(11): 2180-2186. doi: 10.1016/j.chemosphere.2007.12.022 [12] LI S W, SUN H J, LI H B, et al. Assessment of cadmium bioaccessibility to predict its bioavailability in contaminated soils[J]. Environment International, 2016, 94: 600-606. doi: 10.1016/j.envint.2016.06.022 [13] LOPEZ G R, LEVINTON J S. Ecology of deposit-feeding animals in marine sediments[J]. The Quarterly Review of Biology, 1987, 62(3): 235-260. doi: 10.1086/415511 [14] 汪飞, 黄小平. 海洋沉积物中重金属对底栖无脊椎动物的生物有效性[J]. 生态学杂志, 2012, 31(1): 207-214. [15] ZHANG C, YU Z G, ZENG G M, et al. Effects of sediment geochemical properties on heavy metal bioavailability[J]. Environment International, 2014, 73: 270-281. doi: 10.1016/j.envint.2014.08.010 [16] NASR S M, KHAIRY M A, OKBAH M A, et al. AVS-SEM relationships and potential bioavailability of trace metals in sediments from the Southeastern Mediterranean Sea, Egypt[J]. Chemistry and Ecology, 2014, 30(1): 15-28. doi: 10.1080/02757540.2013.831080 [17] MEYLAN S, BEHRA R, SIGG L. Accumulation of copper and zinc in periphyton in response to dynamic variations of metal speciation in freshwater[J]. Environmental Science & Technology, 2003, 37: 5204-5212. doi: 10.1021/es034566+ [18] TANG W Z, XIA Q, SHAN B Q, et al. Relationship of bioaccessibility and fractionation of cadmium in long-term spiked soils for health risk assessment based on four in vitro gastrointestinal simulation models[J]. Science of the Total Environment, 2018, 631-632: 1582-1589. doi: 10.1016/j.scitotenv.2018.03.154 [19] RUBY M V, DAVIS A, LINK T E, et al. Development of an in vitro screening test to evaluate the in vivo bioaccessibility of ingested mine-waste lead[J]. Environmental Science & Technology, 1993, 27(13): 2870-2877. [20] RODRIGUEZ R R, BASTA N T. An in vitro gastrointestinal method to estimate bioavailable arsenic in contaminated soils and solid media[J]. Environmental Science & Technology, 1999, 33(4): 642-649. [21] JUHASZ A L, WEBER J, SMITH E, et al. Evaluation of SBRC-gastric and SBRC-intestinal methods for the prediction of in vivo relative lead bioavailability in contaminated soils[J]. Environmental Science & Technology, 2009, 43(12): 4503-4509. [22] WRAGG J, CAVE M, BASTA N, et al. An inter-laboratory trial of the unified BARGE bioaccessibility method for arsenic, cadmium and lead in soil[J]. Science of the Total Environment, 2011, 409(19): 4016-4030. [23] MAYER L M, CHEN Z, FINDLAY R H, et al. Bioavailability of sedimentary contaminants subject to deposit-feeder digestion[J]. Environmental Science & Technology, 1996, 30(8): 2641-2645. [24] National Research Council. Bioavailability of Contaminants in Soils and Sediments: Processes, Tools and Applications[M]. Washington: The National Academies Press, 2003. [25] NG J C, JUHASZ A, SMITH E, et al. Assessing the bioavailability and bioaccessibility of metals and metalloids[J]. Environmental Science and Pollution Research, 2015, 22(12): 8802-8825. doi: 10.1007/s11356-013-1820-9 [26] LI J, LI K, CAVE M, et al. Lead bioaccessibility in 12 contaminated soils from China: Correlation to lead relative bioavailability and lead in different fractions[J]. Journal of Hazardous Materials, 2015, 295: 55-62. doi: 10.1016/j.jhazmat.2015.03.061 [27] JUHASZ A L, SMITH E, WEBER J, et al. Comparison of in vivo and in vitro methodologies for the assessment of arsenic bioavailability in contaminated soils[J]. Chemosphere, 2007, 69(6): 961-966. doi: 10.1016/j.chemosphere.2007.05.018 [28] SCHRODER J L, BASTA N T, SI J T, et al. In vitro gastrointestinal method to estimate relative bioavailable cadmium in contaminated soil[J]. Environmental Science & Technology, 2003, 37(7): 1365-1370. [29] RUBY M V, SCHOOF R, BRATTIN W, et al. Advances in evaluating the oral bioavailability of inorganics in soil for use in human health risk assessment[J]. Environmental Science & Technology, 1999, 33(21): 3697-3705. [30] GRISCOM S B, FISHER N S, LUOMA S N. Kinetic modeling of Ag, Cd and Co bioaccumulation in the clam Macoma balthica: Quantifying dietary and dissolved sources[J]. Marine Ecology Progress Series, 2002, 240: 127-141. doi: 10.3354/meps240127 [31] LUOMA S N, JOHNS C, FISHER N S, et al. Determination of selenium bioavailability to a benthic particulate and solute pathways[J]. Environmental Science & Technology, 1992, 26(3): 485-491. [32] GAGNON C, FISHER N S. The bioavailability of sediment-bound Cd, Co, and Ag to the mussel Mytilus edulis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(1): 147-156. doi: 10.1139/f96-256 [33] WANG W X, FISHER N S. Modeling the influence of body size on trace element accumulation in the mussel Mytilus edulis[J]. Marine Ecology Progress Series, 1997, 161: 103-115. doi: 10.3354/meps161103 [34] GRISCOM S B, FISHER N S, LUOMA S N. Geochemical influences on assimilation of sediment-bound metals in clams and mussels[J]. Environmental Science & Technology, 2000, 34(1): 91-99. [35] FAN W, WANG W X. Sediment geochemical controls on Cd, Cr, and Zn assmilation by the clam Ruditapes philippinarum[J]. Environmental Toxicology Chemistry, 2001, 20(10): 2309-2317. doi: 10.1002/etc.v20:10 [36] RUBY M V, DAVIS A, SCHOOF R, et al. Estimation of lead and arsenic bioavailability using a physiologically based extraction test[J]. Environmental Science & Technology, 1996, 30(2): 422-430. [37] RAURET G, LOPEZ-SANCHEZ J F, SAHUQUILLO A, et al. Application of a modified BCR sequential extraction (three-step) procedure for the determination of extractable trace metal contents in a sewage sludge amended soil reference material (CRM 483), complemented by a threeyear stability study of acetic acid and EDTA extractable metal content[J]. Journal of Environmental Monitoring, 2000, 2(3): 228-233. doi: 10.1039/b001496f [38] 杨洁, 瞿攀, 王金生, 等. 土壤中重金属的生物有效性分析方法及其影响因素综述[J]. 环境污染与防治, 2017, 39(2): 217-223. [39] BRADHAM K D, SCHECKEL K G, NELSON C M, et al. Relative bioavailability and bioaccessibility and speciation of arsenic in contaminated soils[J]. Environmental Health Perspectives, 2011, 119(11): 1629-1634. doi: 10.1289/ehp.1003352 [40] REES M, SANSOM L, ROFE A, et al. Principles and application of an in vivo swine assay for the determination of arsenic bioavailability in contaminated matrices[J]. Environmental Geochemistry and Health, 2009, 31: 167-177. doi: 10.1007/s10653-008-9237-y [41] PATTERSON J K, LEI X G, MILLER D D. The pig as an experimental model for elucidating the mechanisms governing dietary influence on mineral absorption[J]. Experimental Biology and Medicine, 2008, 233(6): 651-664. doi: 10.3181/0709-MR-262 [42] MOCHIZUKI S, MAKITA T. Differences in intestinal length between specific-pathogen-free (SPF) and conventional swine[J]. Journal of Veterinary Medical Science, 1998, 60(5): 545-548. doi: 10.1292/jvms.60.545 [43] MARSCHNER B, WELGE P, HACK A, et al. Comparison of soil Pb in vitro bioaccessibility and in vivo bioavailability with Pb pools from a sequential soil extraction[J]. Environmental Science & Technology, 2006, 40(8): 2812-2818. [44] GAGNON C, FISHER N S. Bioavailability of sediment-bound methyl and inorganic mercury to a marine bivalve[J]. Environmental Science & Technology, 1997, 31(4): 993-998. [45] AMIRBAHMAN A, MASSEY D I, LOTUFO G, et al. Assessment of mercury bioavailability to benthic macroinvertebrates using diffusive gradients in thin films (DGT)[J]. Environmental Science-Processes & Impacts, 2013, 15(11): 2104-2114. [46] LEE B G, GRISCOM S B, LEE J S, et al. Influences of dietary uptake and reactive sulfides on metal bioavailability from aquatic sediments[J]. Science, 2000, 287(5451): 282-284. doi: 10.1126/science.287.5451.282 [47] KELLEY M E, BRAUNING S E, SCHOOF R A, et al. Assessing Oral Bioavailability of Metals in Soil[M]. Columbus, OH: Battelle Press, 2002. [48] DEVESA-REY R, PARADELO R, DIAZ-FIERROS F, et al. Fractionation and bioavailability of arsenic in the bed sediments of the Anllóns River (NW Spain)[J]. Water, Air and Soil Pollution, 2008, 195(1/2/3/4): 189-199. [49] UNDA-CALVO J, MARTINEZ-SANTOS M, RUIZ-ROMERA E. Chemical and physiological metal bioaccessibility assessment in surface bottom sediments from the Deba River urban catchment: Harmonization of PBET, TCLP and BCR sequential extraction methods[J]. Ecotoxicology and Environmental Safety, 2017, 138: 260-270. doi: 10.1016/j.ecoenv.2016.12.029 [50] LI S W, LI J, LI H B, et al. Arsenic bioaccessibility in contaminated soils: Coupling in vitro assays with sequential and HNO3 extraction[J]. Journal of Hazardous Materials, 2015, 295: 145-152. doi: 10.1016/j.jhazmat.2015.04.011 [51] ROUSSEL H, WATERLOT C, PELFRENE A, et al. Cd, Pb and Zn oral bioaccessibility of urban soils contaminated in the past by atmospheric emissions from two lead and zinc smelters[J]. Archives of Environmental Contamination and Toxicology, 2010, 58(4): 945-954. doi: 10.1007/s00244-009-9425-5 [52] SCHRODER J L, BASTA N T, CASTEEL S W, et al. Validation of the in vitro gastrointestinal (IVG) method to estimate relative bioavailable lead in contaminated soils[J]. Journal of Environmental Quality, 2004, 33(2): 513-521. doi: 10.2134/jeq2004.5130 [53] WESTON D P, MARUYA K A. Predicting bioavailability and bioaccumulation with in vitro digestive fluid extraction[J]. Environmental Toxicology and Chemistry, 2002, 21(5): 962-971. doi: 10.1002/etc.v21:5 [54] BAUMANN Z, KOLLER A, FISHER N S. Factors influencing the assimilation of arsenic in a deposit-feeding polychaete[J]. Comparative Biochemistry and Physiology C: Toxicology & Pharmacology, 2012, 156(1): 42-50. [55] VAHTER M, NORIN H. Metabolism of 74As-labeled trivalent and pentavalent inorganic arsenic in mice[J]. Environmental Research, 1980, 21(2): 446-457. doi: 10.1016/0013-9351(80)90049-3 [56] ODANAKA Y, MATANO O, GOTO S. Biomethylation of inorganic arsenic by the rat and some laboratory animals[J]. Bulletin of Environmental Contamination and Toxicology, 1980, 24(3): 452-459. [57] KENYON E M, HUGHES M F, LEVANDER O A. Influence of dietary selenium on the disposition of arsenate in the female B6C3F1 mouse[J]. Journal of Toxicology and Environmental Health, 1997, 51(3): 279-299. [58] XIA Q, PENG C, LAMB D, et al. Bioaccessibility of arsenic and cadmium assessed for in vitro bioaccessibility in spiked soils and their interaction during the unified BARGE method (UBM) extraction[J]. Chemosphere, 2016, 147: 444-450. doi: 10.1016/j.chemosphere.2015.12.091 [59] TANG X Y, ZHU Y G, CUI Y S, et al. The effect of ageing on the bioaccessibility and fractionation of cadmium in some typical soils of China[J]. Environment International, 2006, 32(5): 682-689. doi: 10.1016/j.envint.2006.03.003 [60] DI TORO D M, MCGRATH J A, HANSEN D J, et al. Predicting sediment metal toxicity using a sediment biotic ligand model: Methodology and initial application[J]. Environmental Toxicology and Chemistry, 2005, 24(10): 2410-2427. doi: 10.1897/04-413R.1 [61] DE JONGE M, EYCKMANS M, BLUST R, et al. Are accumulated sulfide-bound metals metabolically available in the benthic oligochaete Tubifex tubifex?[J]. Environmental Science & Technology, 2011, 45(7): 3131-3137. [62] CAMPANA O, SIMPSON S L, SPADARO D A, et al. Sub-lethal effects of copper to benthic invertebrates explained by sediment properties and dietary exposure[J]. Environmental Science & Technology, 2012, 46(12): 6835-6842. [63] HERNANDEZ-CRESPO C, MARTIN M, FERRIS M, et al. Measurement of acid volatile sulphide and simultaneously extracted metals in sediment from Lake Albufera (Valencia, Spain)[J]. Soil & Sediment Contamination, 2012, 21(2): 176-191. [64] CHEN F R, YANG Y Q, ZHANG D R, et al. Metals associated with reduced sulfur in sediments from different deposition environments in the Pearl River estuary, China[J]. Environmental Geochemistry and Health, 2006, 28(3): 265-272. doi: 10.1007/s10653-006-9042-4 [65] FANG T, LI X D, ZHANG G. Acid volatile sulfide and simultaneously extracted metals in the sediment cores of the Pearl River Estuary, South China[J]. Ecotoxicology and Environmental Safety, 2005, 61(3): 420-431. doi: 10.1016/j.ecoenv.2004.10.004 [66] LOURINO-CABANA B, LESVEN L, CHARRIAU A, et al. Potential risks of metal toxicity in contaminated sediments of Deule river in Northern France[J]. Journal of Hazardous Materials, 2011, 186(2/3): 2129-2137. [67] ZHUANG W, GAO X L. Assessment of heavy metal impact on sediment quality of the Xiaoqinghe estuary in the coastal Laizhou Bay, Bohai Sea: Inconsistency between two commonly used criteria[J]. Marine Pollution Bulletin, 2014, 83(1): 352-357. doi: 10.1016/j.marpolbul.2014.03.039 [68] BESSER J M, BRUMBAUGH W G, KEMBLE N E, et al. Effects of sediment characteristics on the toxicity of chromium(III) and chromium(VI) to the amphipod, Hyalella azteca[J]. Environmental Science & Technology, 2004, 38(23): 6210-6216. [69] NIZOLI E C, LUIZ-SILVA W. Seasonal AVS-SEM relationship in sediments and potential bioavailability of metals in industrialized estuary, southeastern Brazil[J]. Environmental Geochemistry and Health, 2012, 34(2): 263-272. doi: 10.1007/s10653-011-9430-2 [70] SIMPSON S L, WARD D, STROM D, et al. Oxidation of acid-volatile sulfide in surface sediments increases the release and toxicity of copper to the benthic amphipod Melita plumulosa[J]. Chemosphere, 2012, 88(8): 953-961. doi: 10.1016/j.chemosphere.2012.03.026 [71] HONG S W, KIM H S, CHUNG T H. Alteration of sediment organic matter in sediment microbial fuel cells[J]. Environmental Pollution, 2010, 158(1): 185-191. doi: 10.1016/j.envpol.2009.07.022 [72] WOOD P J, ARMITAGE P D. Biological effects of fine sediment in the lotic environment[J]. Environmental Management, 1997, 21(2): 203-217. doi: 10.1007/s002679900019 [73] 易文利, 王圣瑞, 金相灿, 等. 长江中下游浅水湖沉积物中有机质及其组分的赋存特征[J]. 西北农林科技大学学报(自然科学版), 2008, 7(5): 141-148. doi: 10.3321/j.issn:1671-9387.2008.05.026 [74] BESSER J M, BRUMBAUGH W G, MAY T W, et al. Effects of organic amendments on the toxicity and bioavailability of cadmium and copper in spiked formulated sediments[J]. Environmental Toxicology and Chemistry, 2003, 22(4): 805-815. doi: 10.1002/etc.v22:4 [75] STROM D, SIMPSON S L, BATLEY G E, et al. The influence of sediment particle size and organic carbon on toxicity of copper to benthic invertebrates in oxic/suboxic surface sediments[J]. Environmental Toxicology and Chemistry, 2011, 30(7): 1599-1610. doi: 10.1002/etc.v30.7 [76] SADEGHI S H R, HARCHEGANI M K, YOUNESI H A. Suspended sediment concentration and particle size distribution, and their relationship with heavy metal content[J]. Journal of Earth System Science, 2012, 121(1): 63-71. doi: 10.1007/s12040-012-0143-4 [77] ZHAO H T, LI X Y, WANG X M, et al. Grain size distribution of road-deposited sediment and its contribution to heavy metal pollution in urban runoff in Beijing, China[J]. Journal of Hazardous Materials, 2010, 183(1/2/3): 203-210. [78] CAMPANA O, BLASCO J, SIMPSON S L. Demonstrating the appropriateness of developing sediment quality guidelines based on sediment geochemical properties[J]. Environmental Science & Technology, 2013, 47(13): 7483-7489. [79] JYVASJARVI J, BOROS G, JONES R I, et al. The importance of sedimenting organic matter, relative to oxygen and temperature, in structuring lake profundal macroinvertebrate assemblages[J]. Hydrobiologia, 2013, 709(1): 55-72. doi: 10.1007/s10750-012-1434-0 [80] DE JONGE M, TEUCHIES J, MEIRE P, et al. The impact of increased oxygen conditions on metal-contaminated sediments part II: Effects on metal accumulation and toxicity in aquatic invertebrates[J]. Water Research, 2012, 46(10): 3387-3397. doi: 10.1016/j.watres.2012.03.035 [81] KALANTZI I, BLACK K D, PERGANTIS S A, et al. Metals and other elements in tissues of wild fish from fish farms and comparison with farmed species in sites with oxic and anoxic sediments[J]. Food Chemistry, 2013, 141(2): 680-694. doi: 10.1016/j.foodchem.2013.04.049 [82] KELDERMAN P, OSMAN A A. Effect of redox potential on heavy metal binding forms in polluted canal sediments in Delft (The Netherlands)[J]. Water Research, 2007, 41(18): 4251-4261. doi: 10.1016/j.watres.2007.05.058 [83] PENG J F, SONG Y H, YUAN P, et al. The remediation of heavy metals contaminated sediment[J]. Journal of Hazardous Materials, 2009, 161(2/3): 633-640. [84] ZOUMIS T, SCHMIDT A, GRIGOROVA L, et al. Contaminants in sediments: Remobilisation and demobilisation[J]. Science of the Total Environment, 2001, 266(1/2/3): 195-202. [85] SPEELMANS M, LOCK K, VANTHUYNE D R J, et al. Hydrological regime and salinity alter the bioavailability of Cu and Zn in wetlands[J]. Environmental Pollution, 2010, 158(5): 1870-1875. doi: 10.1016/j.envpol.2009.10.040 [86] LEE J S, LEE B G, LUOMA S N, et al. Influence of acid volatile sulfides and metal concentrations on metal partitioning in contaminated sediments[J]. Environmental Science & Technology, 2000, 34: 4511-4516. [87] TAN Q G, KE C H, WANG W X. Rapid assessments of metal bioavailability in marine sediments using coelomic fluid of sipunculan worms[J]. Environmental Science & Technology, 2013, 47(13): 7499-7505. [88] PALLER M H, KNOX A S. Amendments for the in situ remediation of contaminated sediments: Evaluation of potential environmental impacts[J]. Science of the Total Environment, 2010, 408(20): 4894-4900. doi: 10.1016/j.scitotenv.2010.06.055 [89] LEE B G, LEE J S, LUOMA S N, et al. Influence of acid volatile sulfide and metal concentrations on metal bioavailability to marine invertebrates in contaminated sediments[J]. Environmental Science & Technology, 2000, 34(21): 4517-4523. [90] SIMPSON S L, KING C K. Exposure-pathway models explain causality in whole-sediment toxicity tests[J]. Environmental Science & Technology, 2005, 39(3): 837-843. [91] SIMPSON S L, YVERNEAU H, CREMAZY A, et al. DGT-Induced copper flux predicts bioaccumulation and toxicity to bivalves in sediments with varying properties[J]. Environmental Science & Technology, 2012, 46(16): 9038-9046. [92] SIMPSON S L, BATLEY G E. Predicting metal toxicity in sediments: A critique of current approaches[J]. Integrated Environmental Assessment and Management, 2007, 3(1): 18-31. doi: 10.1002/ieam.5630030103 [93] STOCKDALE A, DAVISON W, ZHANG H. Formation of iron sulfide at faecal pellets and other microniches within suboxic surface sediment[J]. Geochimica Et Cosmochimica Acta, 2010, 74(9): 2665-2676. doi: 10.1016/j.gca.2010.02.005 期刊类型引用(25)
1. 袁贝,刘虎鹏,杜平,陈娟,张云慧,张昊. 基于参数优化和蒙特卡罗模拟的砷污染地块健康风险评估. 环境科学. 2024(02): 1049-1057 .  百度学术
百度学术
2. 蒋羽雄,文美兰,潘启明,蒋柏昌,王忠伟. 广西荔浦市土壤—农作物中重金属迁移转化及生态效应. 物探与化探. 2024(03): 858-867 .  百度学术
百度学术
3. 陈颖乐,刘璐冰,王志宏,杨柳,王颂,曾雷. 外源铅在基质-大球盖菇子实体系统的迁移规律研究. 林业与环境科学. 2024(03): 33-40 .  百度学术
百度学术
4. 张永江,李希希,邓茂,吴丽君,马双,周洵平. 典型锰矿区河流沉积物重金属分布特征、来源解析及生态风险评价. 中国环境监测. 2024(04): 183-194 .  百度学术
百度学术
5. 陈礼瀚,吕奇蔚,张光正,胡红青. 生物有机肥对土壤镉形态及玉米镉积累的影响. 华中农业大学学报. 2024(05): 126-131 .  百度学术
百度学术
6. 张森,曹莹,高存富,孟甜,李强. 典型废弃锑冶炼厂土壤重金属污染特征、风险评价及来源解析. 环境科学. 2024(10): 6171-6184 .  百度学术
百度学术
7. 崔艳梅,张华威,薛敬林,罗晶晶,高琪,李佳蔚,孙琰晴,徐英江,韩典峰. 刺参中铝的赋存形态分析. 食品安全质量检测学报. 2024(20): 35-42 .  百度学术
百度学术
8. 孙境蔚,赵洁妮,张云峰,侯雅涵. 城市公园绿地土壤重金属的生物可利用性分析. 泉州师范学院学报. 2024(05): 1-9 .  百度学术
百度学术
9. 陈伟,魏志莹,杨秀雯,易佳佩,秦超杰,景一鸣,郭军,张家泉,罗泽娇,祁士华. 土壤重金属植物有效性的化学评价法综述. 农业环境科学学报. 2024(11): 2615-2626 .  百度学术
百度学术
10. 赵丹,吴畏达,孙倩,於方. 场地复合污染的生态效应与风险评估研究进展和展望. 环境科学研究. 2023(01): 30-43 .  百度学术
百度学术
11. 张志永,万成炎,胡红青,杨中华,袁玉洁,朱稳. 长江中上游表层沉积物重金属形态分布特征及风险评价. 环境科学. 2023(02): 770-780 .  百度学术
百度学术
12. 舒广强,李宁,彭莹,尹秀贞,薛煜宝. 山东济宁金乡大蒜产地重金属在土壤—农作物中迁移转化特征研究. 山东国土资源. 2023(03): 79-87 .  百度学术
百度学术
13. 黄思程,童春富,朱宜平. 浮床种植对挺水植物中重金属赋存特征的影响. 华东师范大学学报(自然科学版). 2023(03): 33-42 .  百度学术
百度学术
14. 保欣晨,马娇阳,徐武美,王豪吉,王成尘,向萍. 西南某矿区土壤重金属的人体生物有效性及健康风险评估. 土壤学报. 2023(02): 458-468 .  百度学术
百度学术
15. 郭可欣,李天元,宋繁永,傅晓文,张强,季蕾. 土壤-作物中重金属生物有效性和可给性研究进展. 中国环境科学. 2023(08): 4164-4174 .  百度学术
百度学术
16. 都诚,夏玉林,谢得宝,陈辉,陆海明,杨剑,王凯,唐文忠,张洪. 长荡湖入湖河流底泥污染特征和潜在生态风险评价. 环境工程学报. 2023(12): 3849-3858 .  本站查看
本站查看
17. 吉心怡,陆海明,史佳莹,陈辉,唐文忠,李红静,梁庆华,张洪. 基于表层沉积物污染状态的环保清淤范围划定:以长荡湖为例. 环境工程学报. 2023(12): 3870-3879 .  本站查看
本站查看
18. 李韵雪,闵远洋,麦晋贤,韩正洲,马庆,黄煜权,廖沛然,杨全. 岗梅药材重金属生物可给性及其人体健康风险评价. 生态毒理学报. 2022(02): 402-412 .  百度学术
百度学术
19. 张加文,田彪,罗晶晶,吴凡,张聪,刘征涛,王晓南. 土壤重金属生物可利用性影响因素及模型预测. 环境科学. 2022(07): 3811-3824 .  百度学术
百度学术
20. 叶俊沛,陈楠,张盼月,蔡雅静,杨卓越,常建宁,朱桂芬. 生物炭促进硫诱导土著硫杆菌调控土壤铅形态. 环境工程学报. 2021(10): 3270-3278 .  本站查看
本站查看
21. 马娇阳,保欣晨,王坤,王成尘,崔道雷,张梦妍,向萍. 土壤镉污染的人体健康风险评价研究:生物有效性与毒性效应. 生态毒理学报. 2021(06): 120-132 .  百度学术
百度学术
22. 刘悦畅,李保珍,王涛,王兰. 2种菌联合修复农田土壤镉污染的研究. 水土保持学报. 2020(04): 364-369 .  百度学术
百度学术
23. 蒋金凤,缪侃滢,周一敏,彭胤斐,雷鸣. 海藻酸钠对土壤中锑形态分布的影响. 广东化工. 2020(17): 61-62+26 .  百度学术
百度学术
24. 王春彦,贾彦龙,孙嘉龙,宁增平,邢丹,侯林. 土壤砷生物有效性及其调控措施研究进展. 环保科技. 2019(06): 55-64 .  百度学术
百度学术
25. 严小菊,崔小爱,王彧,周蕾. 土壤重金属的治理方法和研究展望. 环境与发展. 2019(11): 254+256 .  百度学术
百度学术
其他类型引用(37)
-






 下载:
下载: