-
随着工业的迅速发展、人口的增长和城市化进程的加快,水资源短缺、环境污染和生态恶化已成为世界性问题[1-3]。充足的水供应和可持续发展的能源变得越来越重要,正渗透(FO)技术已经成为缓解水和能源短缺的潜在技术之一[2-4]。近年来,膜生物反应器(MBR)联合正渗透(FO)工艺在废水处理和回收领域受到越来越多的关注[4-5]。正渗透膜生物反应器(OMBR)能从反应器内的混合液体(污染水源)中提取净水,以达到缓解水资源紧缺的目的。
最近,在OMBR的研究应用上也存在一些制约其发展的问题,如水通量低、反应器内盐积累和汲取液回收成本高等[3, 6-8]。汲取液的选择是OMBR工艺过程的关键因素,选择带电荷离子和低分子质量的汲取溶液可以产生高渗透压,从而得到较高的水通量[9]。如NaCl,其溶解度高,毒性小,在FO工艺中作为汲取液被广泛应用,而采用脱盐再浓缩工艺对其回收,其过程也较为容易;然而,NaCl回收过程中的高耗能仍然是制约FO发展的关键[7]。有研究采用化肥作为OMBR工艺的汲取液以解决汲取液回收成本高的难题[10-11]。稀释后的化肥溶液可以直接用于农业灌溉而不需要回收工艺,从而减少工艺设备和能耗。一个需要考虑的问题是反向盐通量对生物反应器内活性污泥的影响。反向盐通量不仅会降低渗透驱动力,还会因为生物反应器中高浓度盐含量而抑制微生物活性[12-14]。针对OMBR工艺过程中盐累积的挑战,研究者们提出了几种方法:污泥定期排放;将MF或UF工艺与OMBR结合排放生物反应器中的无机盐等[15-18];另一种创新的方法是使用可被生物降解的汲取液以缓解反应器中盐的积累[9, 12, 19]。在选择OMBR体系的有机盐汲取液时,需要考虑2个因素。第1个因素是分子尺寸太大的汲取液对渗透压和反应器内生物降解能力都有不利影响,因此,本研究选择尺寸较小的有机碳链乙酸作为汲取液的阴离子[9, 20]。除此之外,乙酸还能有效提高植物对氮肥的吸收[21]。第2个因素是溶液中应含有植物营养元素(如N、K),这样组合的有机盐可以直接与已有研究测试过的无机盐或有机盐汲取液[22-24]进行比较。选择铵(NH3)、钾(K)和钠(Na)作为汲取液的阳离子,这3种阳离子与乙酸盐阴离子的结合可以得到3种有机离子盐溶液:乙酸铵(NH4C2H3O2)、乙酸钠(NaC2H3O2)和乙酸钾(KC2H3O2)。因此,选择硫酸铵((NH4)2SO4)、氯化钠(NaCl)和氯化钾(KCl)作为其对应无机离子进行对比实验。
本研究的目的是评价有机离子盐作为正渗透反应器汲取液的可行性。首先,通过测定FO水通量和反向盐通量探究了不同汲取液以去离子水为料液的FO实验效果;随后,通过比较OMBR水通量、反应器内盐含量、有机物的降解和膜污染方面的差异性,评价其在OMBR工艺中的性能并为正渗透生物反应器的实际应用提供参考。
全文HTML
-
乙酸铵(NH4C2H3O2)、乙酸钠(NaC2H3O2)、乙酸钾(KC2H3O2)、硫酸铵((NH4)2SO4)、氯化钠(NaCl)和氯化钾(KCl)均为分析纯。本研究使用的活性污泥来自澳大利亚新南威尔士州悉尼中央公园的污水处理厂的污泥,该水厂采用的是MBR与UF组合工艺。接种后,生物反应器内以人工合成的生活污水作为水源使微生物可以稳定地在生物反应器内生长。合成的生活污水与悉尼中央公园原污水强度相等,其组成包括215 mg·L−1葡萄糖、100 mg·L−1 CH3COONH4、22 mg·L−1 KH2PO4、10 mg·L−1 MgSO4、10 mg·L−1 FeSO4、75 mg·L−1 (NH4)2SO4、40 mg·L−1 NaHCO3和25 mg·L−1尿素。
-
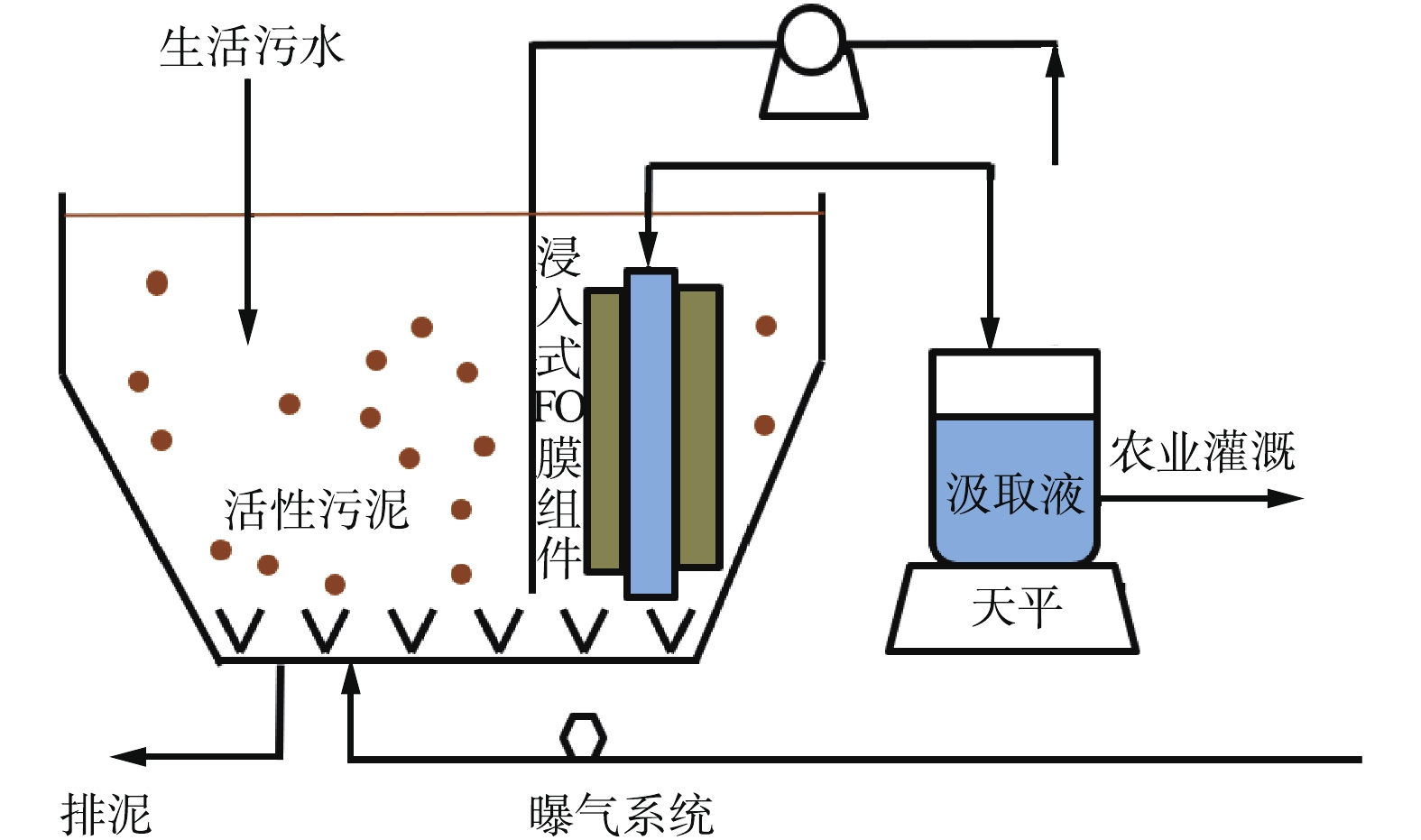
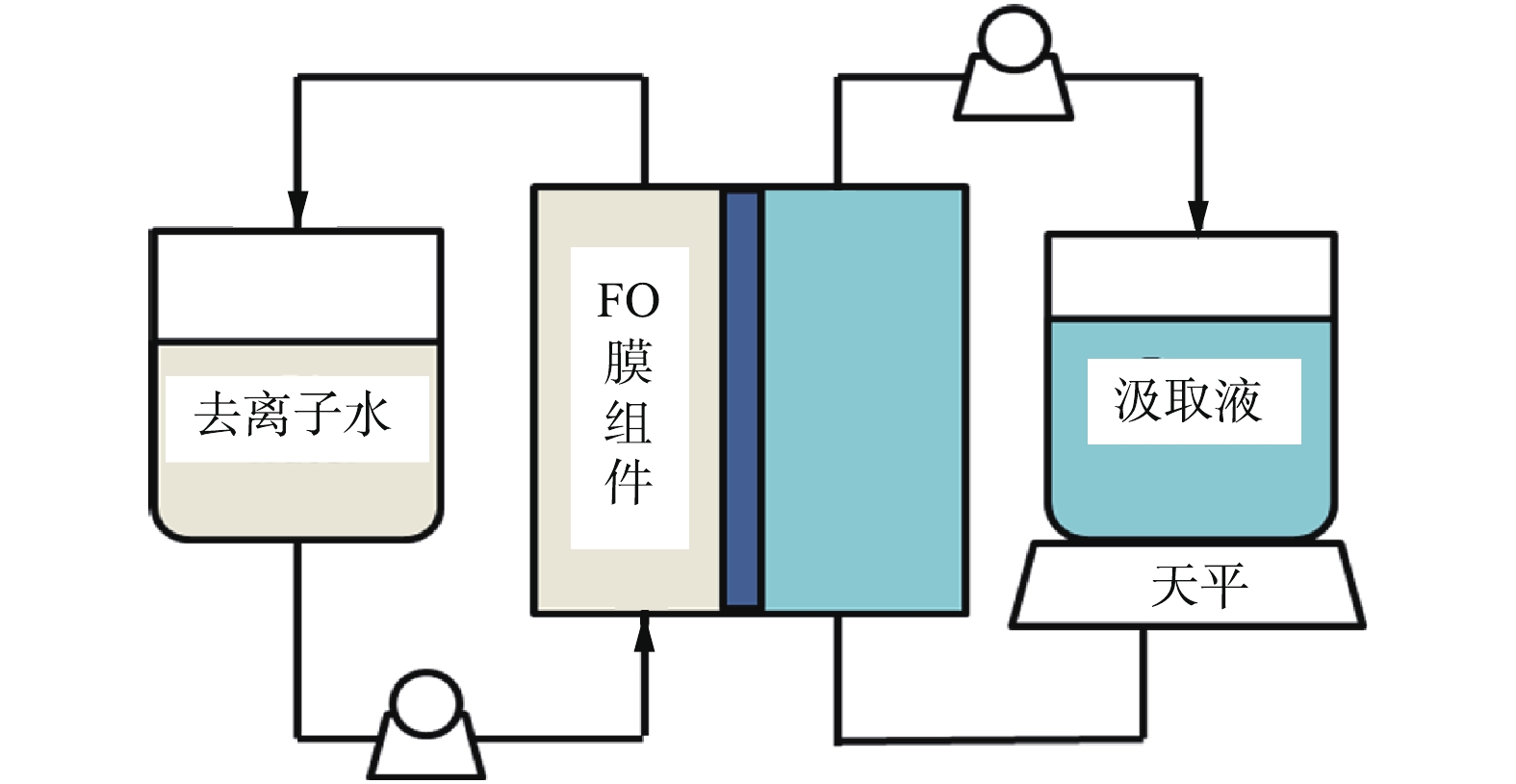
FO工艺性能实验装置采用的是图1中所描述的实验室规模的FO系统。在图1中,FO膜组件两侧分别为料液(去离子水)和汲取液。本装置采用的膜是由日本东丽公司提供的新型TFC膜,其内含聚酯网格而且具有一定的机械强度。膜与汲取液和料液接触的有效膜面积为20.02 cm2。该FO组件中内置网格间隔,采用变速齿轮泵(Micropump L20562,美国Cole-Parmer公司)以25 cm·s−1的速度在闭环中循环流动。在汲取液侧,采用数字天平(LBK6A,澳大利亚Adam Equipment公司)记录实验过程中汲取液质量的变化,保持料液和汲取液的温度在(22±0.5) ℃。
OMBR工艺性能实验装置采用的是图2中所描述的实验室规模OMBR系统。采用2个如图2所示完全相同的生物反应器用于有机和无机汲取溶液实验性能的对比,此生物反应器由丙烯酸塑料制成,其体积为10 L。采用蠕动泵(Masterflex L/S PTFE,美国Cole-Parmer公司)循环汲取液,反应器中溶液体积由水位浮阀控制,采用曝气扩散器(SYB-92,澳大利亚Aqua One公司)曝气。OMBR实验中使用的FO膜的有效接触膜面积为0.026 m2。反应器进水为人工合成污水,pH保持在7左右,液体温度恒定在(22±0.5) ℃。
-
在FO工艺性能实验中,正渗透膜的活性层面向料液侧。所有汲取液的初始浓度为0.6 mol·L−1,以去离子水为料液,进行3 h正渗透浓缩实验,计算其平均水通量和反向盐通量。
在OMBR工艺性能实验中,正渗透膜活性层面向人工合成污水料液以防止污染阻塞膜孔[25]。为了尽量降低污泥的积累而减少对膜表面的污染[26-27],待到其混合液悬浮固体(MLSS)浓度稳定在5~6 g·L−1,将20 L活性污泥等量倒入2个10 L的生物反应器中(见图2),分别以1 mol·L−1乙酸铵(NH4C2H3O2)和硫酸铵((NH4)2SO4)为2个反应器的汲取液对比其OMBR性能。连续测定OMBR的水通量和生物反应器内盐含量,每天测定生物反应器内的化学需氧量(COD)、铵态氮(
NH+4 -N)和硝态氮(NO3-N)浓度。当实验水通量下降到1 L·(m2·h)−1左右时,结束OMBR实验。此时将2个反应器的混合液混合,以人工合成污水为水源,重新稳定活性污泥的活性,直到其恢复到同样的初始盐浓度。随后,以1 mol·L−1乙酸钠(NaC2H3O2)和氯化钠(NaCl)为汲取液,重复以上OMBR性能对比实验;最后,对比1 mol·L−1乙酸钾(KC2H3O2)和氯化钾(KCl)。碱性盐(如NaC2H3O2和KC2H3O2)中反向渗透的Na和K会增加反应器内pH,而(NH4)2SO4和NH4C2H3O2的反向渗透会降低反应器内pH,因此,在操作过程中须加入一定量的HCl和NaHCO3以调整pH,使pH维持在6~8。 -
在实验中,电导率和pH使用便携式多参数水质分析仪(HQd,德国HACH公司)测量。采用电子扫描电镜(SEM)分析仪(Zeiss Supra 55VP,德国Carl Zeiss AG公司),对原始膜和污染膜样品的膜表面形貌和元素特征进行分析。COD、铵态氮和硝态氮的浓度由德国Merck Millipore公司提供的测定试剂盒测定。采用记录天平记录汲取液重量的变化以确定水通量,水通量以通过1 m2膜表面的水的体积来量化,其计算方法如式(1)所示。
式中:Jw为反应装置的水通量,L·(m2·h)−1;mt1为实验开始时汲取液的质量,g;mt2是实验结束时汲取液的质量,g;ρw是纯水的密度,g·m−3;Δt是实验起始到结束的时间,h;Am是膜的有效膜面积,m2。
1.1. 实验原料
1.2. 实验装置
1.3. 实验方法
1.4. 分析方法
-
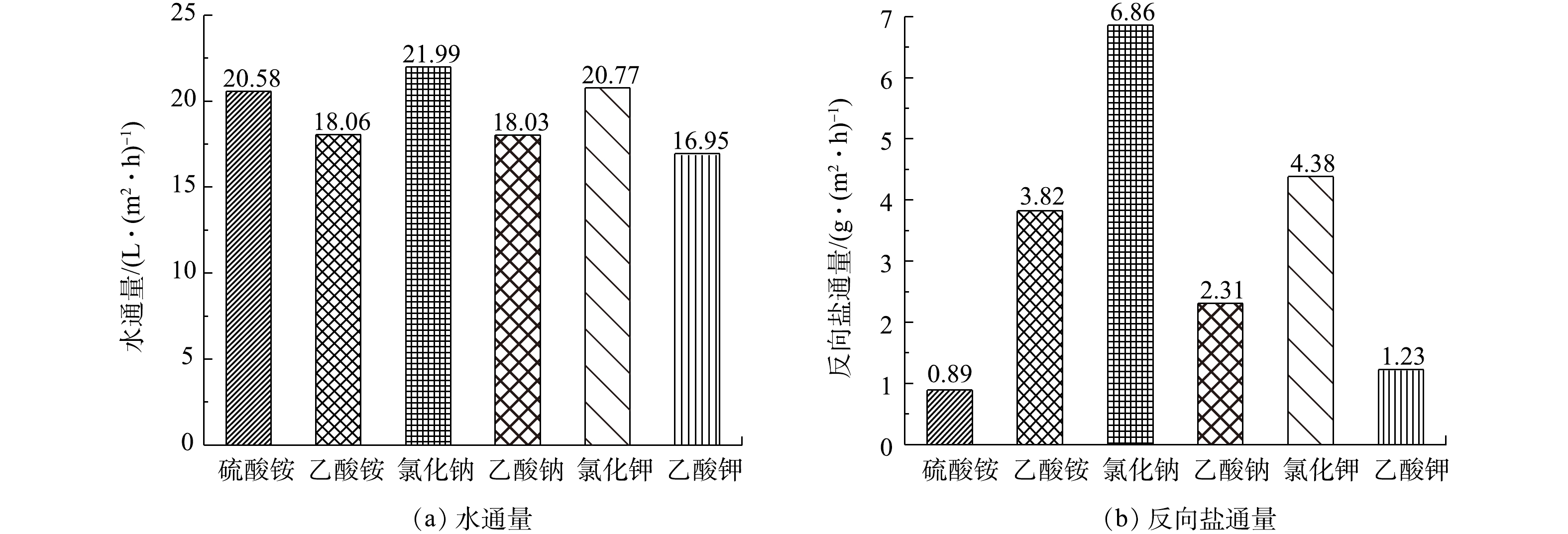
有机离子和无机离子汲取液的FO工艺性能结果见图3。可以看出,与无机离子汲取液相比,有机离子汲取液的水通量略低于其对应的无机离子汲取液,而反向盐通量结果表明,除了乙酸铵高于硫酸铵,其他有机离子汲取液反向盐通量都低于其对应的无机离子汲取液。其中NaCl的水通量最高为21.99 L·(m2·h)−1,而KC2H3O2的最低为16.96 L·(m2·h)−1。一般来说,溶液的渗透压决定着FO的水通量大小,但有机离子的渗透压却显示了稍微不同的趋势。实际上,(NH4)2SO4渗透压最高,造成这种渗透压与水通量不成比例增加的情况可能是由于汲取液黏度和扩散系数的差异及内浓差极化(ICP)的影响、诱导膜内的传质阻力(K)和支持层的变化[27-28];具有较高扩散系数的无机离子汲取液更容易扩散到膜的支持层,从而呈现较高的水通量[29-30];(NH4)2SO4、NaC2H3O2、KC2H3O2的反向盐通量低于NH4C2H3O2、NaCl、KCl。这一结果与先前的研究结果[21]一致。越大的离子尺寸的溶液,其跨膜反向盐通量越小。
-
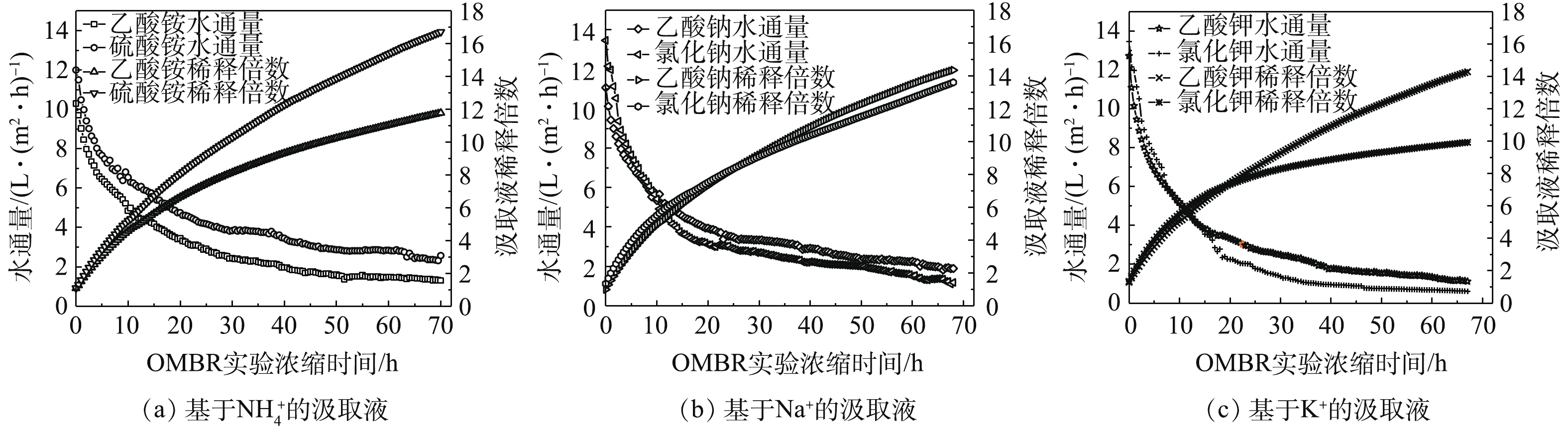
图4为OMBR中有机离子和无机离子汲取液所获得的水通量(Jw)和稀释倍数。在实验开始时,均观察到OMBR的水通量迅速下降,这是由于较高的初始水通量也会造成汲取液的驱动力迅速减小,这一结果与之前的研究[13]一致。总体来说,有机离子汲取液的OMBR水通量略高于其对应无机离子汲取液;但其中有机盐NH4C2H3O2的水通量并未高于其对应无机盐(NH4)2SO4,这可能是因为,(NH4)2SO4反向渗透的铵根离子可以为微生物的生长和硝化提供营养物质而降低反应器内的渗透压,从而可以达到较高的OMBR水通量,而NaCl和KCl的反向渗透的Na和K却会抑制反应器内生物的活性[31]。从稀释倍数结果来看,(NH4)2SO4作为OMBR汲取液时,其汲取液被稀释的倍数最高,为16.73倍。稀释倍数也是OMBR工艺中为农业提供肥料溶液的关键评价因素[19, 29, 32],稀释倍数越高,污水的回用率也越高。
-
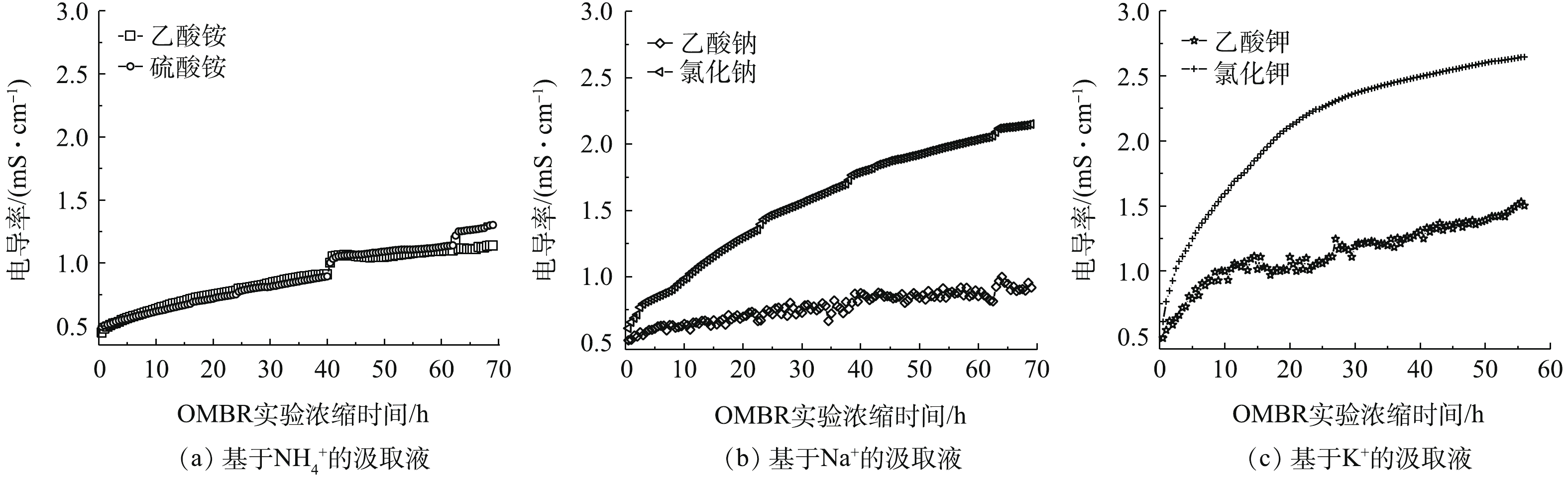
图5反映了在OMBR中不同汲取液的盐累积随时间的变化情况。有机汲取液NH4C2H3O2、NaC2H3O2、KC2H3O2的电导率的增长比其对应无机汲取液(NH4)2SO4、NaCl、KCl要缓慢,说明有机离子汲取液可以有效降低OMBR中的盐度的积累;在FO实验中,呈现较低反向盐通量的(NH4)2SO4却在OMBR实验中,显示比NH4C2H3O2更高的盐度积累趋势,但二者相差不大;而在基于Na+和基于K+的汲取液对比中,有机离子和无机离子汲取液的盐积累效应相差较大,这是因为,NaC2H3O2和KC2H3O2中反向渗透的Na和K会抑制生物反应器中微生物的活性,从而导致盐含量迅速上升。结合图4所示的OMBR水通量和图5所示的盐积累结果,可以得出,OMBR中盐度是影响水通量下降的重要因素之一,微生物可以降解由反向扩散的乙酸盐,从而减缓OMBR中盐度的积累以维持较高的OMBR水通量。
-
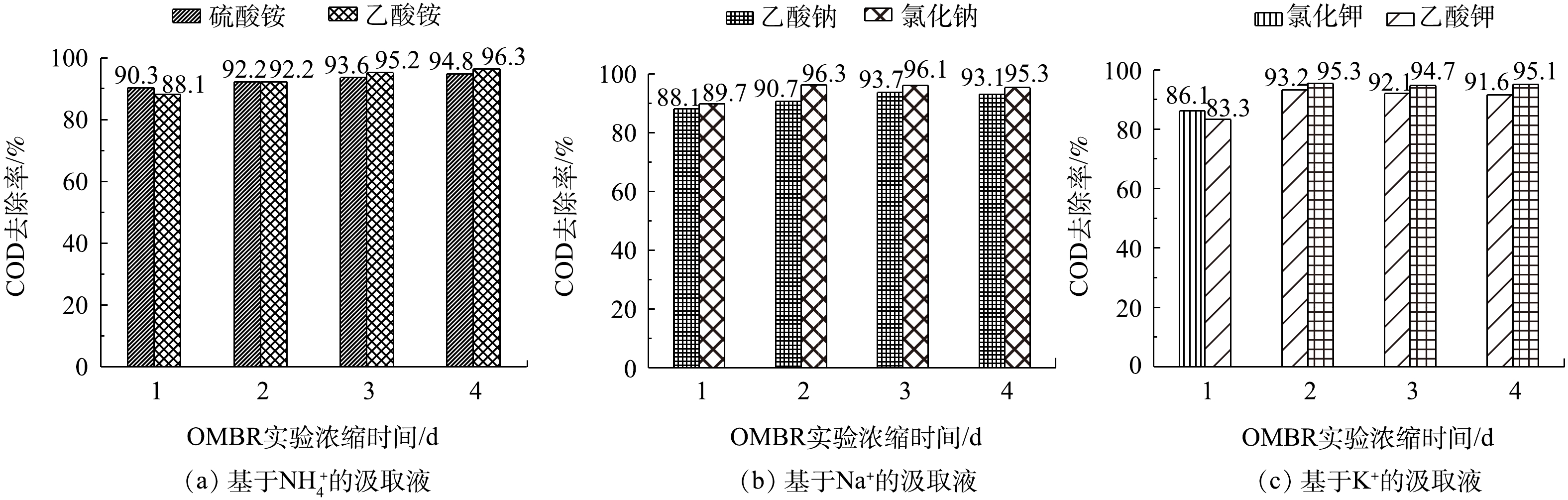
图6显示的是生物反应器内不同汲取液COD去除率的结果。所有实验的COD去除率基本都在90%以上,这一结果也符合以前的研究报道[26, 32-33];但第1天的所有实验的COD去除率都低于未来几天,这是因为第1天OMBR的水通量较大,大量盐离子通过正渗透膜的汲取液一侧渗透到反应器一侧,造成有机负荷较大,导致其COD去除率较低;但随着实验的进行,有机离子的反向盐通量明显减少,COD的去除率呈现逐渐上升的趋势;有机离子汲取液的COD去除率略高于无机离子汲取液,这是因为汲取液反向渗透的有机离子也贡献了一部分有机质含量,从而提高了反应器中微生物的活性。
-
生物反应器内的铵态氮和硝态氮浓度变化如图7所示。在好氧条件下,由于亚硝化细菌和硝化细菌的亚硝化和硝化作用,会将铵态氮(
NH+4 -N)最终转换成硝酸盐(NO−3 -N)。理论上,这些氮的种类大多可以被正渗透膜过滤掉[34]。在OMBR中观察到的相同现象是:所有反应器中NO−3 -N的含量一直在增加,这是因为硝化作用最终产生的硝酸盐(NO−3 )会部分透过正渗透膜而进入生物反应器中。对于(NH4)2SO4和NH4C2H3O2(铵盐)汲取液,前2 d,NH+4 浓度显著升高,这主要是由于汲取液中含有高浓度的NH+4 反向渗透到反应器中导致的。而之后,随着水通量的降低,反向盐通量也在降低;对比于其他的汲取液(钠盐和钾盐汲取液),反应器中NH+4 -N前2 d因为没有反向铵盐的影响,所以其含量并没有显著升高;在图7(b)和图7(c)中,当有机盐作为汲取液时,其最终的NO−3 -N浓度高于无机盐作为OMBR汲取液时的浓度,这反映了在每天氨氮负荷相同的情况下,有机盐(乙酸钠和乙酸钾)作为汲取液时,微生物的亚硝化作用和硝化作用将更多的NH+4 -N转化为NO−3 -N。这可能是由于较高的反向无机盐离子(Cl−)对硝化细菌的硝化和亚硝化作用具有抑制作用,表明选择有机离子作为OMBR的汲取液可以提高反应器中的氨氮去除率。 -
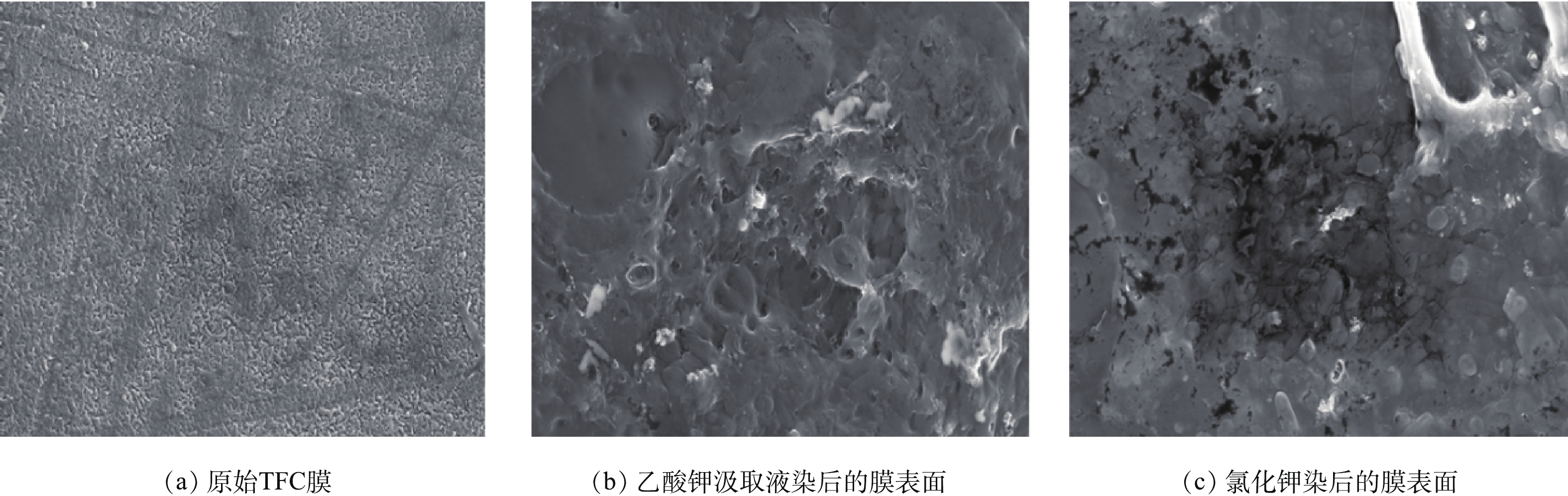
图8为有机离子盐和无机离子盐作为OMBR汲取液的受污染FO膜表面现象。结果表明,当有机离子作为汲取液时,在膜表面发现了一层凝胶状的土黄色污染层,呈现出比无机离子更严重的污染状况。图9为原始膜表面、有机汲取液(KC2H3O2)污染后的膜表面和无机汲取液(KCl)污染后的膜表面SEM图像。与原始膜相比,污染膜的活性层上覆盖着一层薄薄的、凝胶状的可逆污染层,污染物层的厚度为1.68 μm(由SEM图像比例尺寸推测出来的),这比MBR的污染层要薄[23]。当无机离子盐作为汲取液时,此时对膜污染的形成影响较小,因为无机离子可以抑制微生物生长并限制膜污染分子在膜表面形成分子之间的桥接;当有机离子作为汲取液时,微生物为利用其有机离子更容易附着在膜的表面并能够产生更多的生物代谢产物,从而加重膜的污染。
2.1. FO工艺性能
2.2. OMBR水通量
2.3. 生物反应器中的盐度积累
2.4. 生物反应器中COD的去除率
2.5. 生物反应器中的铵态氮和硝态氮的浓度
2.6. 膜表面污染特性
-
1)在FO实验中,当乙酸铵、乙酸钠和乙酸钾有机离子溶液作为FO的汲取液时,其水通量值略低于硫酸铵、氯化钠和氯化钾无机离子溶液,在有机离子汲取液中,乙酸铵的水通量最高为18.06 L·(m2·h)−1。
2)在OMBR工艺中,有机离子汲取液可以缓解反应器中盐的积累并促进有机物的降解,但更容易产生膜污染。
3)乙酸铵可以做为OMBR工艺长期操作的汲取液来处理生活污水,此研究为正渗透膜反应器汲取液的选择提供了新的方向,但为了实现正渗透反应器的实际应用,还须进一步研究其膜污染的机理和清洗策略。



 下载:
下载: