-
近年来,城市水体病原微生物污染问题日益突出[1],雨水径流是主要污染源之一。我国城市雨水径流粪大肠菌群(fecal coliforms)浓度为105~107 CFU·L−1,高出地表水环境质量标准[2](III类和V类水体粪大肠菌群不超过10 000 个·L−1和40 000 个·L−1,当粪大肠菌群采用滤膜法或平板计数法测定时,其计数单位为菌落数,表示为CFU·L−1)1~3个数量级[3]。在一些以合流制为主的老城区,含有生活污水的合流制溢流水直接排入城市的河湖,也会引起病原微生物污染,对人体健康及城市水生态造成威胁。
雨水具有分散、水量大的特点,因此,常见的紫外消毒、加氯消毒等技术很难应用于雨水消毒。生物滞留池是海绵城市建设主要推广的雨水净化技术措施之一,当采用特殊基质作为其换土层中的一部分时,如改性活性炭[4]、生物炭[5]、沸石[6]、负载银纳米颗粒的木片[7]等,可以增强其细菌去除效能,达到去除雨水径流中的病原微生物的目的。无机金属离子抗菌材料具备长效性、抗菌广谱性等优点,尤其是银系材料和铜系材料[8]在水处理领域中应用广泛。以沸石做负载类抗菌填料不仅制备方法简单、成本更低[9],而且还可去除雨水径流中的氨氮[10]。
在国外关于雨水滤池或生物滞留池除菌性能的研究中,进水病原菌浓度较低(104~105 CFU·L−1),与国内的实际雨水水质差距较大,而且没有合流制溢流水的相关研究[11]。本研究制备了载铜沸石和载银沸石作为雨水滞留池换土层基质,以细沙作为对照基质,通过静态摇瓶实验和动态填料柱模拟实验,考察其在不同大肠杆菌浓度和合流制溢流水进水情况下的除菌效果,以期为除菌雨水滞留池的基质选择和设计提供参考。
-
葡萄糖(C6H12O6)、氯化铵(NH4Cl)、磷酸二氢钾(KH2PO4)、氯化铜(CuCl2·2H2O)、硝酸银(AgNO3)、硝酸钾(KNO3)、尿素(CH4N2O)、氯化钠(NaCl)、盐酸(HCl)均为分析纯;大肠埃希式菌(E.coli,CMCC 44102);天然沸石。
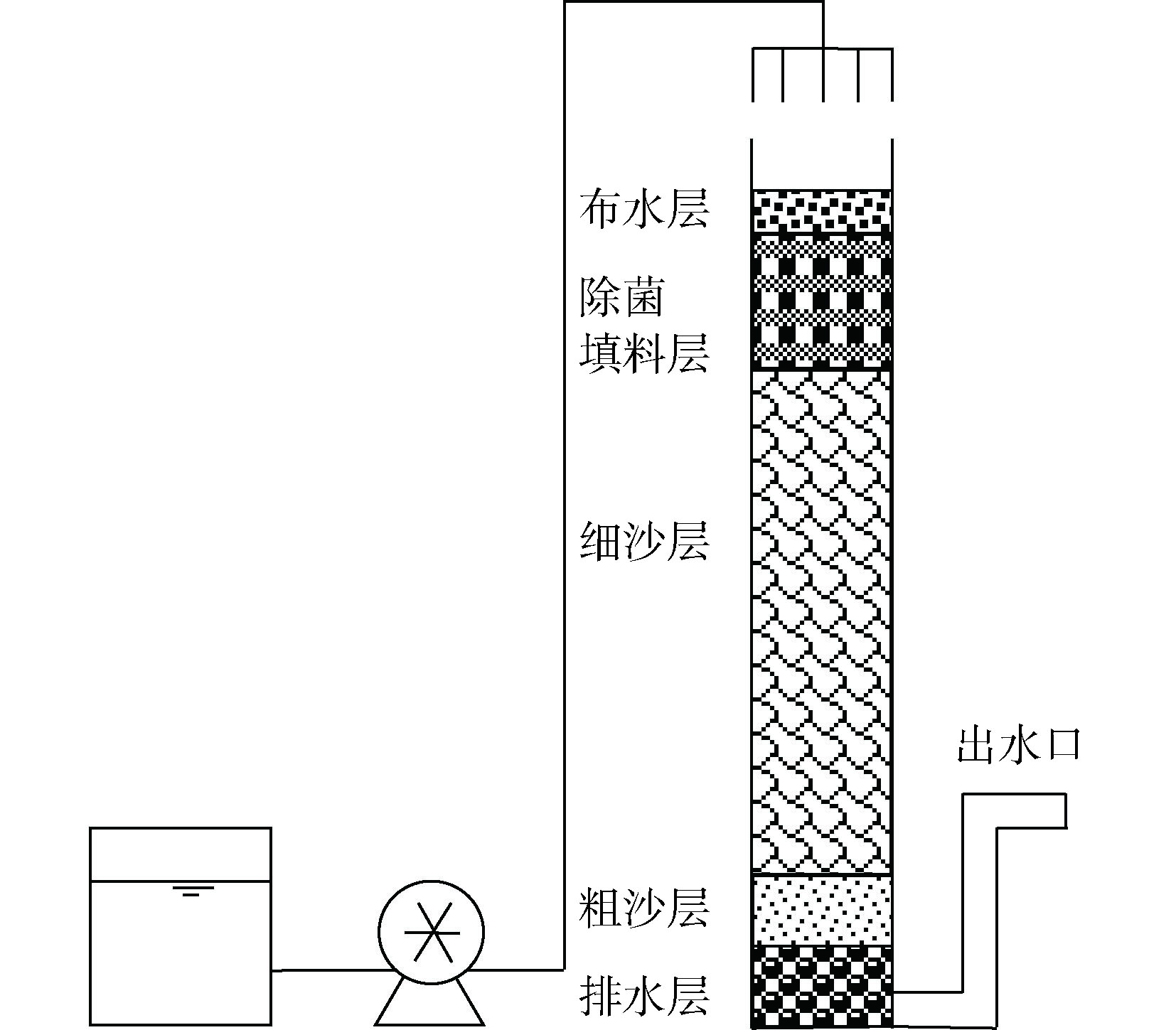
依据文献中复杂生物滞留池的相关要求[12],设计雨水滞留池填料柱。采用3个结构相同的有机玻璃圆柱形填料柱模拟雨水滞留池,直径150 mm,壁厚5 mm,总高度1 000 mm(填充高度940 mm),底部通过玻璃管抬升出水高度至300 mm,以形成淹没区。实验用水从顶部泵入,经过分散布水器流经各层填料,由底部玻璃管流出。实验装置见图1。
实验柱中分层填充不同中值粒径(D50)和高度(H)的填料,自上而下依次为卵石布水层(D50=10 mm,H=50 mm)、除菌填料层(H=170 mm)、细沙层(D50=0.3 mm,H=550 mm)、粗沙层(D50=1 mm,H=70 mm)和卵石排水层(D50=15 mm,H=100 mm)。3个实验柱的除菌填料层的基质分别为载银柱(负载银的改性沸石100 mm+天然沸石70 mm),载铜柱(负载铜的改性沸石100 mm+天然沸石70 mm)和填充细沙的对照柱。
-
1)沸石改性与铜银负载。将天然沸石用去离子水清洗、烘干后进行改性。为提高离子交换率,先制备Na沸石。取天然沸石按质量比为1∶5的比例加入到2 mol·L−1 氯化钠溶液中,搅拌、静置、洗涤后干燥,制得改性Na沸石。取Na沸石80 g加入到400 mL 0.1 mol·L−1硝酸银溶液中,调节pH至7.00,水浴60 ℃搅拌2 h,静置24 h后,洗涤、烘干,制得载银沸石。取Na沸石80 g加入到400 mL 0.1 mol·L−1 氯化铜溶液中,水浴80 ℃搅拌2 h,调节pH至8.00,继续搅拌2 h,过夜静置、洗涤、烘干;于180 ℃中焙烧2 h,洗涤、烘干,制得载铜沸石。
2)静态摇瓶实验。准确称取干燥后的1.00 g细沙、天然沸石、载银沸石和载铜沸石,分别投入E.coli 浓度为107 CFU∙L−1的大肠杆菌菌液和合流制溢流水的锥形瓶中,锥形瓶已灭菌并用无菌透气封口膜密封,置于恒温水浴振荡摇床中控制25 ℃、150 r·min−1振荡240 min,分别在第0、10、30、60、120、240分钟取上清液,测定其E.coli菌数和Ag+、Cu2+浓度。
3)动态填料柱模拟实验。① 阶段1。实验进水为去离子水配制的E.coli菌液,浓度分别为107、106、105 CFU·L−1,考察填料柱对不同E.coli浓度进水的除菌效果。E.coli浓度为107、106 CFU·L−1的实验分别持续13 d,1~5 d每1 d进水1次,其后设置落干期,每3 d进水1次;E.coli浓度为105 CFU·L−1的实验持续8 d,每1 d进水1次。每一E.coli浓度条件下的实验结束后,用无菌去离子水淋洗3 d。②阶段2。实验进水为人工配制的合流制溢流水[13](生活污水∶雨水=1∶4),考察COD、TN和TP等污染物对实验柱除菌效果的影响。进水水质为COD 194 mg·L−1、TN 16 mg·L−1、TP 1.8 mg·L−1、E.coli 106 CFU·L−1。实验持续18 d,进水设置落干期。2个阶段的每次进水的历时均为6 h,进水流量为0.6 L·h−1,水力负荷为36.13 L·(h·m3)−1。实验期间测定进出水水样的COD、TN、TP、E.coli菌数及Ag+、Cu2+浓度。
4)参照相关国家标准[14],采用重铬酸钾法测定COD、紫外分光法测定TN、钼酸铵光度法测定TP、平板计数法测定大肠杆菌菌数。金属负载量采用王水-高氯酸法[15]消解沸石样品,电感耦合等离子原子发射光谱(ICP-AES)测定Ag+、Cu2+浓度,Ag+、Cu2+浓度流失量也采用ICP-AES测定。
-
本研究制得的金属负载沸石的银负载量为0.50 mg·g−1,铜负载量为7.4 mg·g−1。载银沸石、载铜沸石的比表面积、孔容高于天然沸石,平均孔径则小于天然沸石,具体参数如表1所示。
摇瓶实验的振荡初期,2种沸石的金属离子流失较快,前10 min的流失量达到总流失量的60%,之后逐渐放缓,在120 min时达到稳定。在相同的实验条件下,载银沸石的最大Ag+流失量为0.013 mg·g−1,载铜沸石的最大Cu2+流失量为0.009 mg·g−1。
-
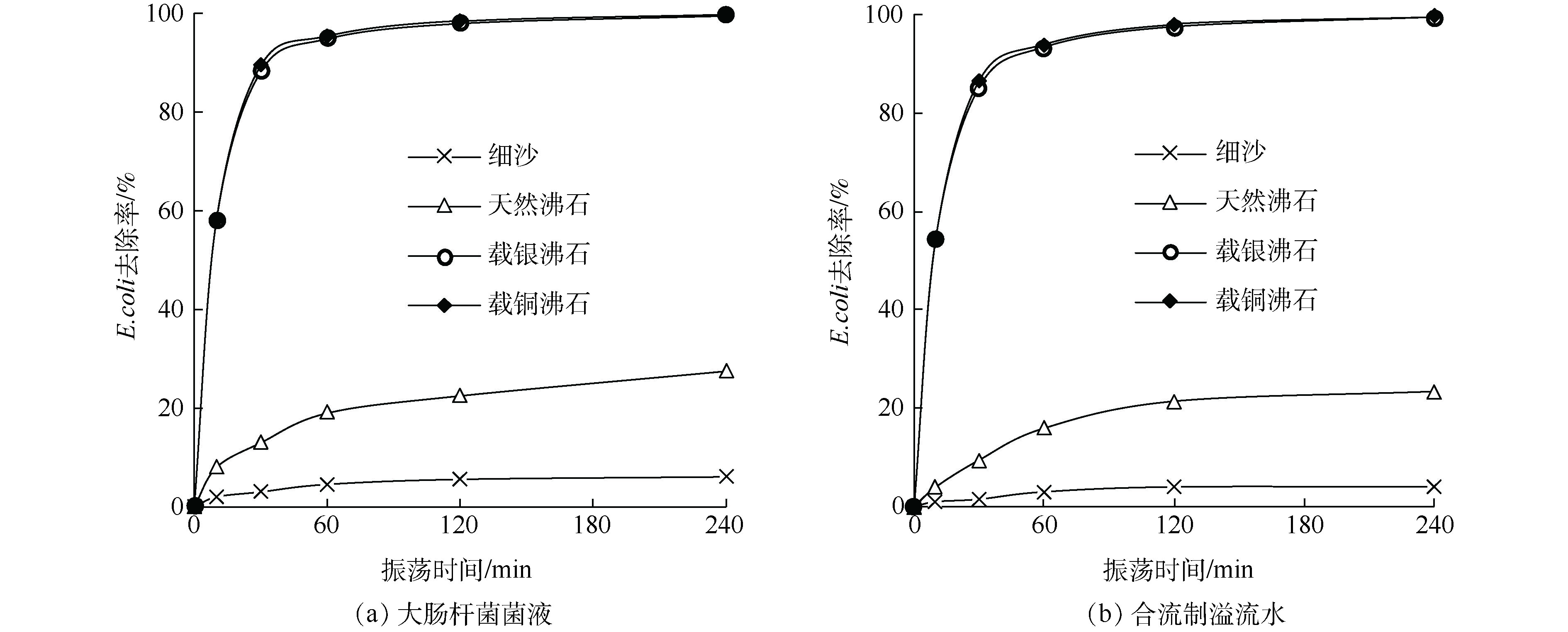
从图2可以看出,同一种基质对大肠杆菌液和模拟合流制溢流水的E.coli去除率无显著差异(P>0.05),但4种基质之间存在显著差异(P<0.05)。在进水E.coli浓度为107 CFU·L−1时,反应30 min后,载银、载铜沸石对E.coli的去除率就达到了88%以上,远远高于天然沸石和细沙;反应时间240 min时,出水E.coli浓度已经远低于地表V类水所规定的40 000个∙L−1。
-
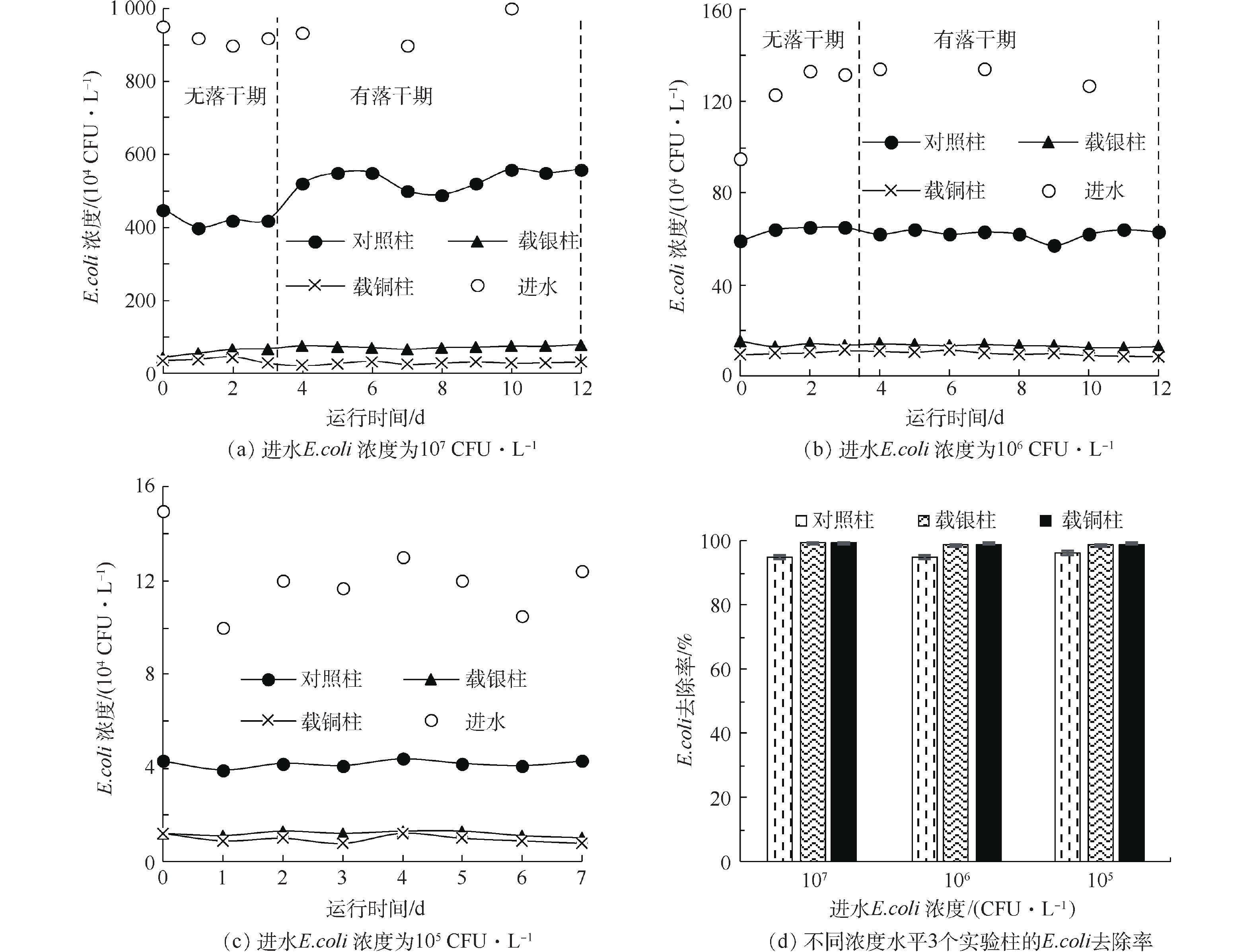
图3反映了3种实验柱在不同进水E.coli浓度下的除菌情况。在同一进水浓度下,出水E.coli浓度由高到低顺序为细沙对照柱、载银沸石柱、载铜沸石柱;在3个进水浓度水平下,载铜、载银沸石柱的E.coli去除率均达到90%以上,彼此差异不显著(P>0.05),但与对照柱相比则均有显著差异(P<0.05)。当进水E.coli浓度为105 CFU·L−1时,载铜沸石柱出水平均E.coli浓度为9.75×103 CFU·L−1,达到地表水III类标准(10 000 个·L−1)的要求;当进水E.coli浓度为106 CFU·L−1时,载铜沸石柱出水平均E.coli浓度为5. 52×104 CFU·L−1,略高于地表水V类标准(40 000个·L−1)的要求。
E.coli的去除率与基质的表面性质有关,细沙对照柱主要依靠截滤、沥滤与吸附过程去除E.coli,能力有限[16]。沸石与带负电的细菌外膜的接触,使得负载的Cu2+、Ag+等离子通过静电引力吸附在带有负电荷的细胞壁上,Ag+通过与细菌细胞壁蛋白的N或O结合[17],Cu2+通过使细胞膜脂质过氧化[18],破坏胞壁结构, 从而进入细胞内,扰乱细菌的生理活动,致使E.coli失活[19]。
实验柱沸石的载银量远低于载铜量,但在运行中银的流失率高于铜的流失率,与静态摇瓶实验的测定结果一致。当进水E.coli浓度为106 CFU·L−1时,载银柱出水的Ag+浓度为(0.007±0.001) mg·L−1,而载铜柱出水的Cu2+浓度为(0.002±0.001) mg·L−1,远远低于地表水环境质量标准III类水要求的1.0 mg·L−1。从减少重金属污染的角度看,载铜沸石比载银沸石更适合作为雨水滞留池的填料。
在实验阶段1的落干期,柱内水面高度维持在除菌填料层以下。负载沸石上流失进入水中的Ag+、Cu2+浓度很低,不足以起到持续杀菌效果。由图3(a)和图3 (b)可以看出,落干期时出水E.coli浓度较稳定,无显著变化(P>0.05)。与LI等[20]的研究一致,本实验中淋洗时也观察到5.2%~8.1%(去离子水冲洗后出水/最后一周期过滤出水)的E.coli净流出现象,并且随着进水E.coli浓度的下降而下降。由此推测,实验柱内可能的变化是:初期进水E.coli浓度较高,实验柱内有一部分E.coli截留在填料缝隙或吸附在上层沸石表面,负载的Ag+、Cu2+等与E.coli的接触不充分;随着运行周期的延长,这部分E.coli逐渐脱附、随水流出,同时上层的沸石、细沙逐渐恢复了与E.coli的有效接触。
-
在实验阶段2,即模拟合流制溢流水的处理实验中,实验柱对COD、TN、TP和E.coli的平均去除效果及随出水流失的Ag+、Cu2+情况如表2所示。3种实验柱对TP和COD的去除率相近,无显著差异(P>0.05),载铜、载银沸石柱对TN的去除效果高于细沙对照柱;经过2 d的落干期后,COD、TN和TP的去除率均有一定程度的增加。与阶段1相比,随出水流失的Ag+、Cu2+浓度稍高,但仍低于地表水III类标准。
-
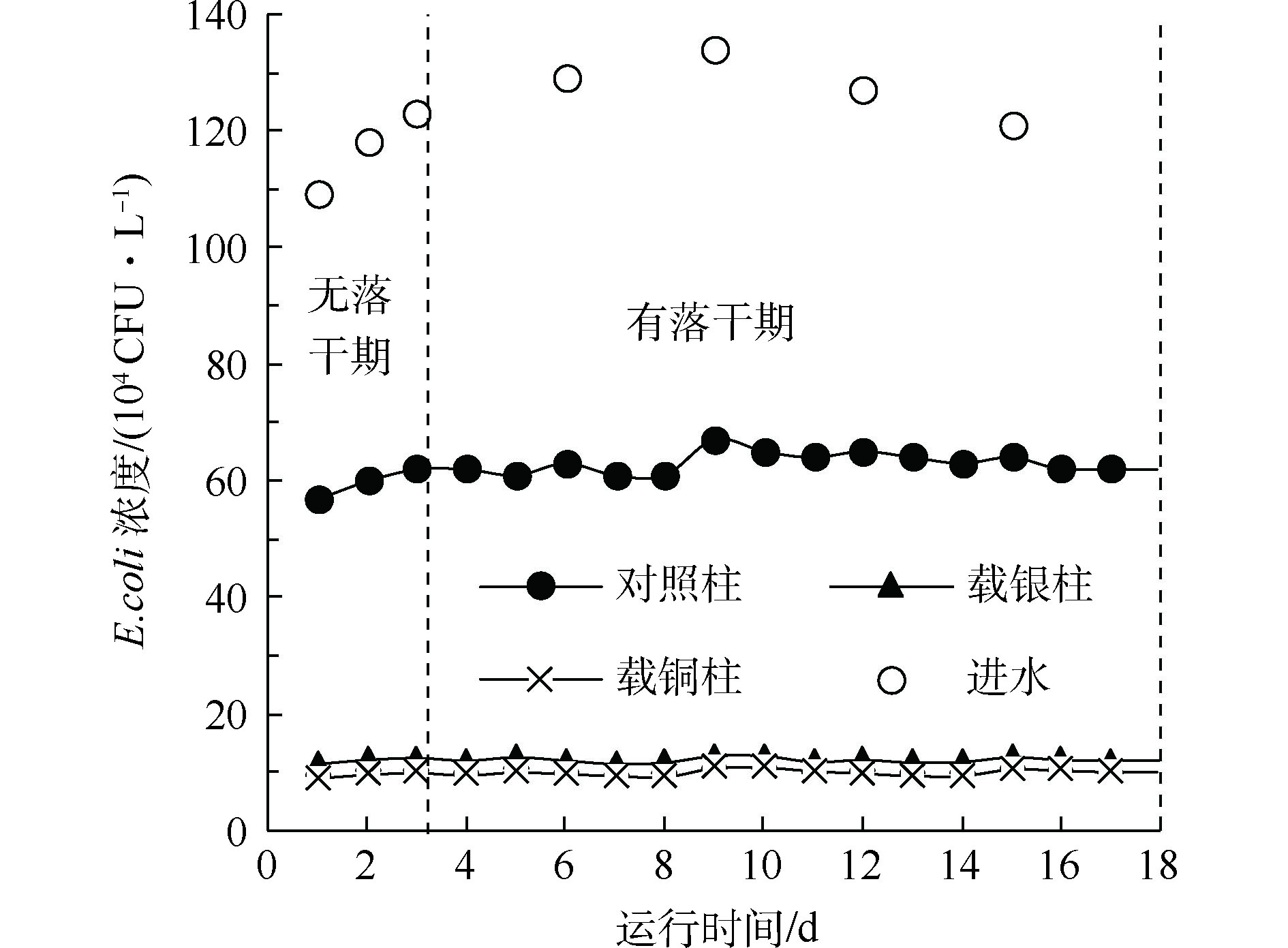
图4显示了3种实验柱出水的E.coli浓度。当合流制溢流水中E.coli进水浓度为106 CFU·L−1时,载铜沸石柱出水E.coli最低,稳定在9.76×104 CFU·L−1左右;载银沸石柱略高,平均为1.20×105 CFU·L−1;细沙对照柱最高,为6.23×105 CFU·L−1。3个实验柱对E.coli的去除率(见表2)与实验阶段1相同E.coli水平下的去除率(91.91%)持平(P>0.05),基本不受合流制溢流水中其他污染物的影响。
-
在实验的8个运行周期内,COD、TN、TP虽然对E.coli的去除没有显著影响,但金属离子的流失有所增加。由于运行时间较短,实验柱内未生长生物膜,故吸附是实验柱去除COD、TN、TP等的主要方式;随着运行周期的延长,沸石吸附更多的正离子,或加重Ag+、Cu2+的流失,同时,阻碍金属离子与E.coli的接触,最终导致E.coli去除率下降。
在溢流水实验中,去除率最高的载铜沸石柱出水E.coli浓度、COD值和TN的浓度分别为9.76×104 CFU·L−1、122.03 mg·L−1和6.01 mg·L−1,高于地表水V类的相关标准。另外,有研究表明,过多的有机物和营养物质不仅会与指示菌竞争吸附位点[21],还能为指示菌的繁殖提供养分、减少自然衰亡、延长其存活时间[22]。因此,采用除菌雨水滞留池同步去除有机污染物、氮、磷和细菌,更适合在雨水水质相对较好的地区使用,或设置预处理设施。
-
1)采用负载金属的沸石基质滞留池模拟实验柱去除雨水中以E.coli为指示菌的病原菌。在105~107 CFU·L−1的进水E.coli浓度下,载铜沸石和载银沸石基质的实验柱均保持了90%以上的E.coli去除率,载铜柱的去除效果更好。当进水E.coli浓度为105 CFU·L−1且无有机物和氮磷污染时,载铜沸石柱出水平均E.coli为9.75×103 CFU·L−1,达到地表水环境质量标准中III类水的要求。
2)负载金属的沸石基质会有少量的金属流失,但实验柱出水中的Ag+和Cu2+远低于地表水III类标准,且Cu2+流失量更低,故载铜沸石比载银沸石更适合作为雨水滞留池的填料。
3) 合流制溢流水中的有机物、氮和磷对E.coli的去除率基本无影响,与单纯E.coli进水下的去除率持平(P>0.05);同时,实验柱对有机物和氮均有一定的去除效果,对磷的去除率达97%。
铜银负载沸石基质雨水滞留池的除菌性能
Bacterial removal performance of rainwater retention tank with copper or silver loaded zeolite substrate
-
摘要: 针对城市水体的病原微生物污染问题,设计了以铜银负载沸石为基质的雨水滞留池模拟柱,用于去除合流制溢流水中的以大肠菌群为指示菌的病原微生物;通过静态实验考察了制备的载铜和载银沸石的铜、银的流失量和除菌效果,并用模拟柱进行了含不同大肠杆菌浓度的进水及合流制溢流水的除菌实验。结果表明:载铜沸石的Cu2+流失量相对于载银沸石的Ag+流失量更小;在105~107 CFU·L−1的进水大肠杆菌浓度下,2种沸石柱的除菌率均在90%以上;在连续18 d的运行过程中,2种沸石实验柱对大肠杆菌浓度为106 CFU·L−1的合流制溢流水的除菌率也保持在90%以上,且未受到水中的COD、TN、TP的影响。载铜和载银沸石基质滞留池可以有效地降低雨水中的病原微生物风险。Abstract: To control pathogenic microorganisms pollution in urban water, a rainwater retention tank with filter media of copper or silver loaded zeolite was designed to remove pathogenic microorganisms with coliform bacteria as indicator bacteria in combined sewer overflow. The metal loss and bacteria-eliminating abilities of copper loaded and silver loaded zeolite were investigated by batch experiments, and the latter was further proved by filled simulated columns test for treating synthetic water with different coliform bacteria concentrations or combined sewer overflow. The results show that Cu2+ loss from copper loaded zeolite was lower than Ag+ loss from silver loaded zeolite. The bacterial removal efficiencies of the two zeolite columns were above 90% at the influent E. coli. concentration of 105~107 CFU·L−1. During 18 d consecutive filtration operation, the bacterial removal efficiencies of the two zeolite columns maintained above 90% for the combined sewer overflow with E. coli. of 106 CFU·L-1, which was not affected by COD, TN and TP. In short, the retention tank with filter media of copper or silver loaded zeolites can effectively reduce the risk of pathogenic bacteria in rainwater runoff.
-
表 1 3种沸石的比表面积与孔径
Table 1. Specific surface area and pore size of three zeolites
沸石种类 比表面积/(m2·g−1) 总孔容/(cm3·g−1) 平均孔径/nm 天然沸石 34.885 0.083 1 5.339 载银沸石 42.127 0.097 6 4.671 载铜沸石 45.223 0.098 8 4.258 表 2 实验柱对合流制溢流水中COD、TN、TP 和E.coli的去除效果及出水Ag+、Cu2+浓度
Table 2. COD, TN, TP and E.coli removal effects from combined sewer overflow by experimental columns and Ag+, Cu2+ concentrations in effluent
阶段 指标 细沙对照柱 载银沸石柱 载铜沸石柱 进水当天 COD去除率/% 38.72 ± 1.66 40.79 ± 1.84 41.64 ± 1.62 TN去除率/% 49.70 ± 2.43 62.17 ± 1.13 62.77 ± 0.92 TP去除率/% 94.52 ± 0.16 96.96 ± 0.16 97.20 ± 0.21 E.coli去除率/% 48.92 ± 1.26 89.99 ± 0.47 91.80 ± 0.33 Ag+出水浓度/(mg·L−1) 0.003 ± 0.000 0.017 ± 0.004 0.002 ± 0.000 Cu2+出水浓度/(mg·L−1) 0.001 ± 0.000 0.002 ± 0.000 0.009 ± 0.002 滞留期后 COD去除率/% 54.45 ± 1.79 56.20 ± 0.81 56.92 ± 1.18 TN去除率/% 65.23 ± 4.14 71.54 ± 1.16 72.96 ± 2.23 TP去除率/% 97.86 ± 0.78 98.93 ± 0.34 99.05 ± 0.27 E.coli去除率/% 50.31 ± 0.20 90.55 ± 0.51 92.13 ± 0.44 Ag+出水浓度/(mg·L−1) 0.002 ± 0.000 0.016 ± 0.006 0.003 ± 0.000 Cu2+出水浓度/(mg·L−1) 0.002 ± 0.000 0.002 ± 0.000 0.010 ± 0.002 -
[1] 杨勇, 魏源送, 郑祥, 等. 北京温榆河流域微生物污染调查研究[J]. 环境科学学报, 2012, 32(1): 9-18. [2] 国家环境保护总局. 地表水环境质量标准: GB 3838-2002[S]. 北京: 中国环境科学出版社, 2002. [3] 庄芳芳, 苏建强, 陈辉煌, 等. 基于高通量定量PCR研究城市化小流域微生物污染特征[J]. 生态毒理学报, 2017, 12(5): 141-152. [4] GUEST R M, SCHANG C, DELETIC A, et al. Zinc-sulphate-heptahydrate coated activated carbon for microbe removal from stormwater[J]. Water Science & Technology, 2012, 66(7): 1582-1589. [5] MOHANTY S K, BOEHM A B. Effect of weathering on mobilization of biochar particles and bacterial removal in a stormwater biofilter[J]. Water Research, 2015, 85: 208-215. doi: 10.1016/j.watres.2015.08.026 [6] LI Y L, DELETIC A, MCCARTHY D T. Removal of E.coli from urban stormwater using antimicrobial-modified filter media[J]. Journal of Hazardous Materials, 2014, 271(4): 73-81. [7] SCHIFMAN L A, KASARANENI V K, SULLIVAN R K, et al. New antimicrobially amended media for improved nonpoint source bacterial pollution treatment[J]. Environmental Science and Technology, 2015, 49(24): 14383-14391. doi: 10.1021/acs.est.5b03782 [8] FILIPOVIĆ N, BORRMANN H, TODOROVIĆ T, et al. Copper(II) complexes of N -heteroaromatic hydrazones: Synthesis, X-ray structure, magnetic behavior, and antibacterial activity[J]. Inorganica Chimica Acta, 2009, 362(6): 1996-2000. doi: 10.1016/j.ica.2008.09.019 [9] PENG J, CAO Y, RIRRY M A, et al. Indicator and pathogen removal by low impact development best management practices[J]. Water, 2016, 12: 600-623. [10] 古励, 潘龙辉, 何强, 等. 沸石对降雨径流中氨氮的吸附特性[J]. 环境工程学报, 2015, 9(1): 107-112. [11] RIRRY M A. Meeting the criteria: Linking biofilter design to fecal indicator bacteria removal[J]. Wiley Interdisciplinary Reviews Water, 2015(2): 577-592. [12] 中华人民共和国住房城乡建设部. 海绵城市建设技术指南: 低影响开发雨水系统构建(试行)[M]. 北京:中国建筑工业出版社, 2015. [13] 刘翠云, 车伍, 董朝阳. 分流制雨水与合流制溢流水质的比较[J]. 给水排水, 2007, 33(4): 51-55. doi: 10.3969/j.issn.1002-8471.2007.04.012 [14] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2009: 210-229. [15] 郑云华. 火焰原子吸收分光光度法测土壤中铜、锌: 用王水+高氯酸消化样品消化时间对测定结果影响[J]. 环境科学导刊, 2011, 30(1): 84-86. doi: 10.3969/j.issn.1673-9655.2011.01.024 [16] AUSET M, KELLER A A, BRISSAUD F, et al. Intermittent filtration of bacteria and colloids in porous media[J]. Water Resources Research, 2005, 41(9): 477-487. [17] LEE J H, CHAE J D, KIM D G, et al. Comparison of the efficacies of silver-containing dressing materials for treating a full-thickness rodent wound infected by methicillin-resistant Staphylococcus aureus[J]. Korean Journal of Laboratory Medicine, 2010, 30(1): 20-27. doi: 10.3343/kjlm.2010.30.1.20 [18] WAKSHLAK B K, PEDAHZUR R, MENAGEN B, et al. An antibacterial copper composite more bioactive than metallic silver[J]. Journal of Materials Chemistry B, 2016, 4(24): 4322-4329. doi: 10.1039/C6TB00719H [19] HU X J, LIU Z X, WANG Y D, et al. Synchrotron FTIR spectroscopy reveals molecular changes in Escherichia coli upon Cu2+ exposure[J]. Nuclear Science and Techniques, 2016, 27(3): 160-167. [20] LI Y L, DAVID T, MCCARTHY D T, et al. Stable copper-zeolite filter media for bacteria removal in stormwater[J]. Journal of Hazardous Materials, 2014, 273: 222-230. doi: 10.1016/j.jhazmat.2014.03.036 [21] BOMO A M, EKEBERG D, STEVIK T K, et al. Retention and removal of the fish pathogenic bacterium Yersinia ruckeri in biological sand filters[J]. Journal of Applied Microbiology, 2004, 97(3): 598-608. doi: 10.1111/jam.2004.97.issue-3 [22] TUNCSIPER B, AYAZ S C, AKCA L. Coliform bacteria removal from septic wastewater in a pilot-scale combined constructed wetland system[J]. Environmental Engineering & Management Journal, 2012, 11(10): 1873-1879. -




 下载:
下载: