-
随着工农业的迅速发展,氯代烃类有机物作为生产原料和溶剂被人类广泛地应用在工业生产、农药、干洗和医疗等行业[1],造成了一系列环境问题。氯代烃类在环境中随着雨水、径流等渗滤到土壤中[2],被土壤吸附一部分后渗漏到地下含水层,导致地下水污染[3],其中地下水中四氯乙烯、三氯乙烯及四氯化碳等污染尤为普遍[4-6]。本研究中选取一种典型氯代烃PCE作为研究对象,该物质是在常温下易挥发、非易燃的重质非水溶相液体(dense non-aqueous phase liquids,DNAPLs),化学性质稳定,且有很强的生物毒性和潜在的生物累积性,并具有刺激性、致敏性、致突变性、致畸性、致癌性等特性,已被较多国家列为优先控制污染物[7]。一旦PCE通过各种途径进入地下环境,会下渗到地下水深层,严重污染地下水资源,对生态环境和人体健康产生极大的危害[8]。1999年北京市地下水有机污染调查结果表明,北京地区有2处氯代烃污染区域面积超过10 km2,主要污染物为TCE和PCE,最高浓度分别为487.6 μg∙L−1和63.74 μg∙L−1,其中PCE的检出率较高[9]。为了保护生态环境及促进可持续发展,地下水中氯代烃污染问题亟待解决,地下水水质保护和污染修复刻不容缓[10]。
考虑到微生物修复技术具有易于原位修复、处理成本低、无二次污染且可以实现无害化等优点,故进一步研究微生物群落对PCE的降解非常必要[11]。近年来,国内外研究人员对氯代烃的生物降解进行了大量探索和研究[12-19]。在厌氧条件下,氯代烯烃可以作为某些细菌的终端电子受体,通过厌氧微生物作用发生还原脱氯,生成次级产物,最终达到无害化的修复目的,而加入一些有机质进行共代谢可以提高其降解速率[12-14]。有研究[15]发现,将厌氧细菌Y51株和好氧性混合株P. pseudocalcaligenes KF707-D3株综合运用可以将难生物降解的PCE完全分解。实际上,单一的厌氧菌或好氧菌很难彻底快速降解PCE[16]。迄今为止,仅发现Dehalococcoides mccartyi属的菌株能使PCE完全脱氯[17],且该属菌株对碳源要求较高,一般需要醋酸盐作为碳源[18],生长条件较为苛刻。然而,多种常见微生物如脱硫单胞菌,硫磺菌等可以协同合作将PCE还原脱氯[19]。
目前,对微生物修复氯代烃的研究主要集中在单一好氧菌株以及厌氧菌株的运用。因此,有必要研究地下水环境中微生物群落降解氯代烃的特性,从而进一步探索提高氯代烃生物降解速率的可行方法。尽管有很多学者研究某类共代谢基质条件下微生物菌株是否能够成功脱氯,但很少有学者针对微生物群落在不同共代谢基质条件下的脱氯能力开展相关研究[20]。因此,根据现阶段氯代烃修复的研究经验,本研究选取一种典型氯代烃PCE,旨在评估模拟地下水环境下降解菌群的共代谢脱氯能力。本研究采用振荡培养法[21]来筛选并鉴定出PCE优势降解菌群,对环境因素开展实验并对其进行了条件优化,探索了不同共代谢基质条件下PCE降解的规律,建立了反应动力学模型,比较了不同共代谢基质条件下微生物的脱氯能力。
-
四氯乙烯(C2Cl4)和甲醇(CH3OH)为色谱纯,酵母浸膏和维生素B12为生物试剂,乙醇(CH3CH2OH)、三水合磷酸氢二钾(K2HPO4∙3H2O)、七水合硫酸亚铁(FeSO4∙7H2O)、一水合磷酸二氢钠(NaH2PO4∙H2O)、氯化铵(NH4Cl)、七水合硫酸镁(MgSO4∙7H2O)、七水合硫酸锰(MnSO4∙7H2O)、七水合硫酸锌(ZnSO4∙7H2O)、乳酸钠(dl-C3H5O3Na)、葡萄糖(C6H12O6)、六水合氯化钴(CoCl2∙6H2O)、一水合次氮基三乙酸三钠(N(CH2CO2Na)3∙H2O)均为分析纯。
-
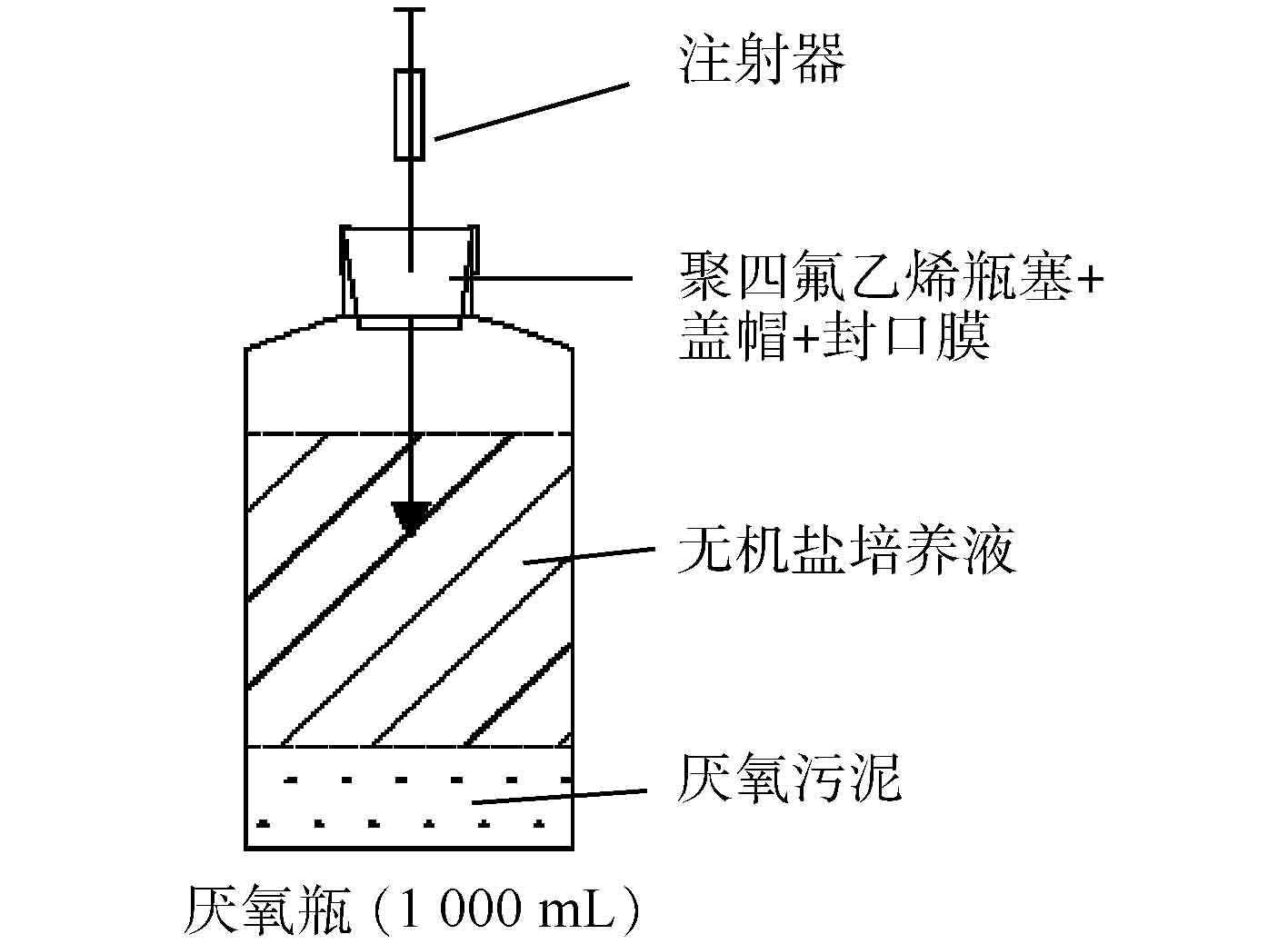
实验过程中使用的仪器设备:恒温振荡箱(MQL-621R,上海旻泉仪器有限公司)、厌氧培养箱(YQX-Ⅱ型,上海新苗医疗器械制造有限公司)、立式压力蒸汽灭菌锅(YM30型,上海三申医疗器械有限公司)、紫外可见分光光度计(TU-1810,北京普析通用仪器有限责任公司)、氮吹仪器(ANPEL DC12,上海安谱实验科技股份有限公司)、气相色谱仪(Agilent7820A,安捷伦科技有限公司)、Illumina Mi Seq平台(微基生物科技(上海)有限公司)。驯化实验采用厌氧瓶密封操作,实验装置见图1,可定期使用注射器采样。
-
PCE降解菌群的驯化筛选。以南京某污水处理厂的厌氧活性污泥为菌种来源,采用图1的实验装置对厌氧活性污泥进行驯化培养,整个实验操作过程在厌氧培养箱中完成。实验配制无机盐培养基来模拟地下水[22],其组成成分为:K2HPO4∙3H2O 1.05 g∙L−1、NaH2PO4∙H2O 0.25 g∙L−1、NH4Cl 0.49 g∙L−1、N(CH2CO2Na)3∙H2O 0.03 g∙L−1、dl-C3H5O3Na 0.112 g∙L−1、MgSO4∙7H2O 0.05 g∙L−1、FeSO4∙7H2O 3 mg∙L−1、MnSO4∙7H2O 0.74 mg∙L−1、ZnSO4∙7H2O 0.74 mg∙L−1、CoCl2∙6H2O 0.25 mg∙L−1、维生素B12 0.05 mg∙L−1[23]。PCE降解菌群的驯化采用梯度驯化法[24],按PCE浓度由低到高进行,先将200 mL活性污泥接种到700 mL除氧灭菌后的无机盐培养基中(除非特殊说明,pH均在6.80~7.25),随后采用聚四氟乙烯瓶塞和铝卷曲盖密封血清瓶,并采用无菌注射器加入PCE溶液。PCE溶液浓度初次设定为0.5 mg∙L−1,然后放置于30 ℃、转速为30 r∙min−1的恒温振荡培养箱中进行培养驯化7 d,之后更新培养基并将浓度依次递增为1、2、3、4、5 mg∙L−1[22],每个阶段均培养7 d。
PCE降解特性研究。将100 mL无机盐培养基置于血清瓶中,所有培养基在使用前均利用氮气吹扫30 min,然后用高压灭菌锅在121 ℃下灭菌30 min,最后放入厌氧培养箱中冷却备用。将经过梯度驯化后获得的菌液按5%投加量接入含有100 mL无机盐培养基的血清瓶中,随后采用特氟隆表面橡胶隔膜(美国安捷伦公司)和铝卷曲盖密封血清瓶,PCE初始投加量设定为1 mg∙L−1,随后置于30 ℃、30 r∙min−1条件下恒温振荡器中培养。实验过程中每隔24 h采样1次,测定培养基中残留PCE的浓度以及吸光度,分析驯化所得菌群的PCE降解特性及菌群生长曲线。
环境因素对微生物群落降解PCE的影响。在保持与降解特性实验相应条件不变的前提下,分别研究不同温度(10、20、30 ℃)、不同pH(6、7、8)、不同PCE初始浓度(0.5、1、1.5、2、2.5 mg∙L−1)等条件对菌群降解PCE的影响。在相同的实验条件下,不接种菌液作对照,每组实验重复做3个平行样,取平均值。每隔24 h采样1次,测定培养基中残留PCE的浓度,采样结束后使用硅胶填缝密封盖上留下的针孔以防止PCE挥发。
不同共代谢基质对微生物群落降解PCE的影响。为了探索各种共代谢基质对降解菌群性能的影响,将培养所得菌液按5%接种量加入100 mL的无机盐培养液,PCE初始投加量设定为1 mg∙L−1,再分别加入甲醇、乙醇、葡萄糖、酵母浸膏、乳酸钠[25]。其中,葡萄糖以及酵母浸膏浓度为1 g∙L−1、甲醇浓度为0.6 g∙L−1、乙醇浓度为20 mg∙L−1、乳酸钠浓度为0.77 g∙L-1[26]。在30 ℃、30 r∙min−1条件下振荡培养,每24 h采样检测,并利用实验结果建立动力学模型。
-
实验中PCE浓度采用顶空气相色谱仪[27](Agilent 7820A,美国Agilent公司)及DB-624色谱柱测量。
实验中菌群浓度采用分光光度法[25]测定,取适量实验样品放入1 cm的比色皿中,利用紫外分光光度计测量其在600 nm处的吸光度(A600)。
实验中PCE降解菌群群落结构分析采用16S rDNA[28]来分析,按照柱式细菌基因组抽提试剂盒的使用操作说明,对混合培养体的菌液中的DNA进行提取[29],将纯化后的样品利用Illumina Mi Seq平台进行高通量测序。
-
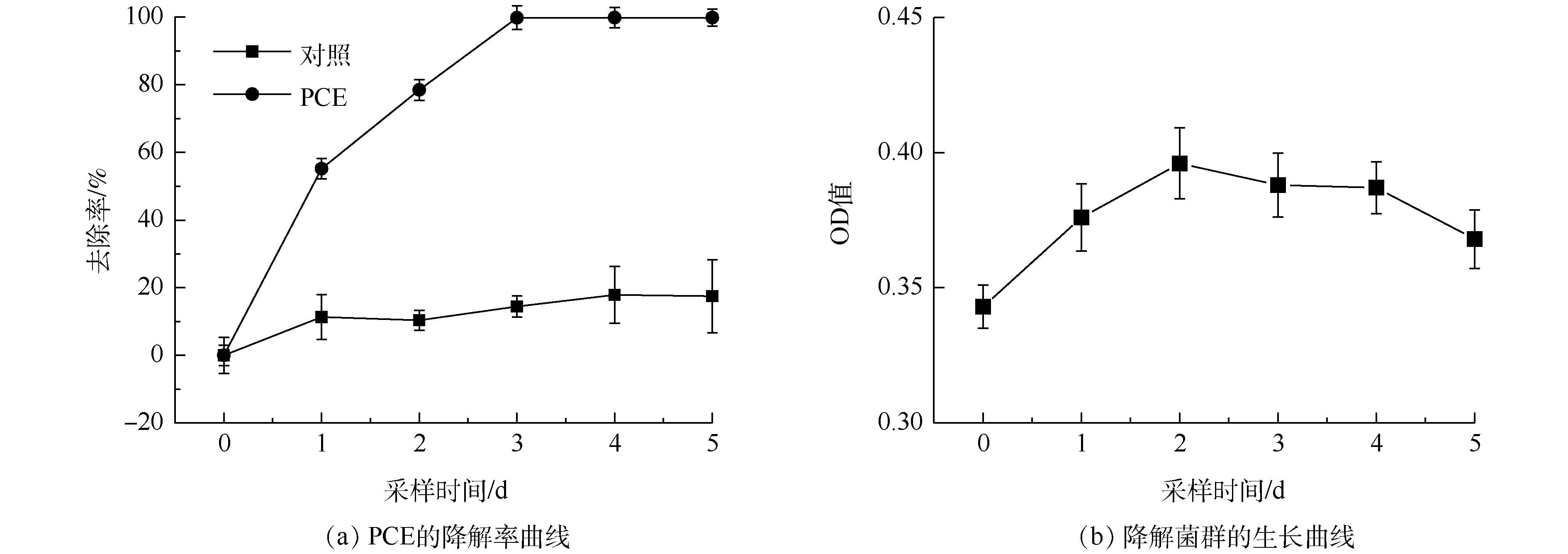
驯化期后PCE降解曲线及菌群生长曲线见图2。由图2(a)可知,PCE能得到高效降解并且去除率已明显高于90%。由图2(b)可知:降解初期(0~2 d),菌群在PCE存在条件下能以较快速度生长;随着采样时间的推移,中期(2~4 d)达到静止期,OD值缓慢下降;后期(4~5 d),由于PCE含量不足,菌群活性被抑制,OD值下降较快。筛选得到的菌群能够高效降解PCE,可以进行菌种鉴定以及环境因素影响实验。
-
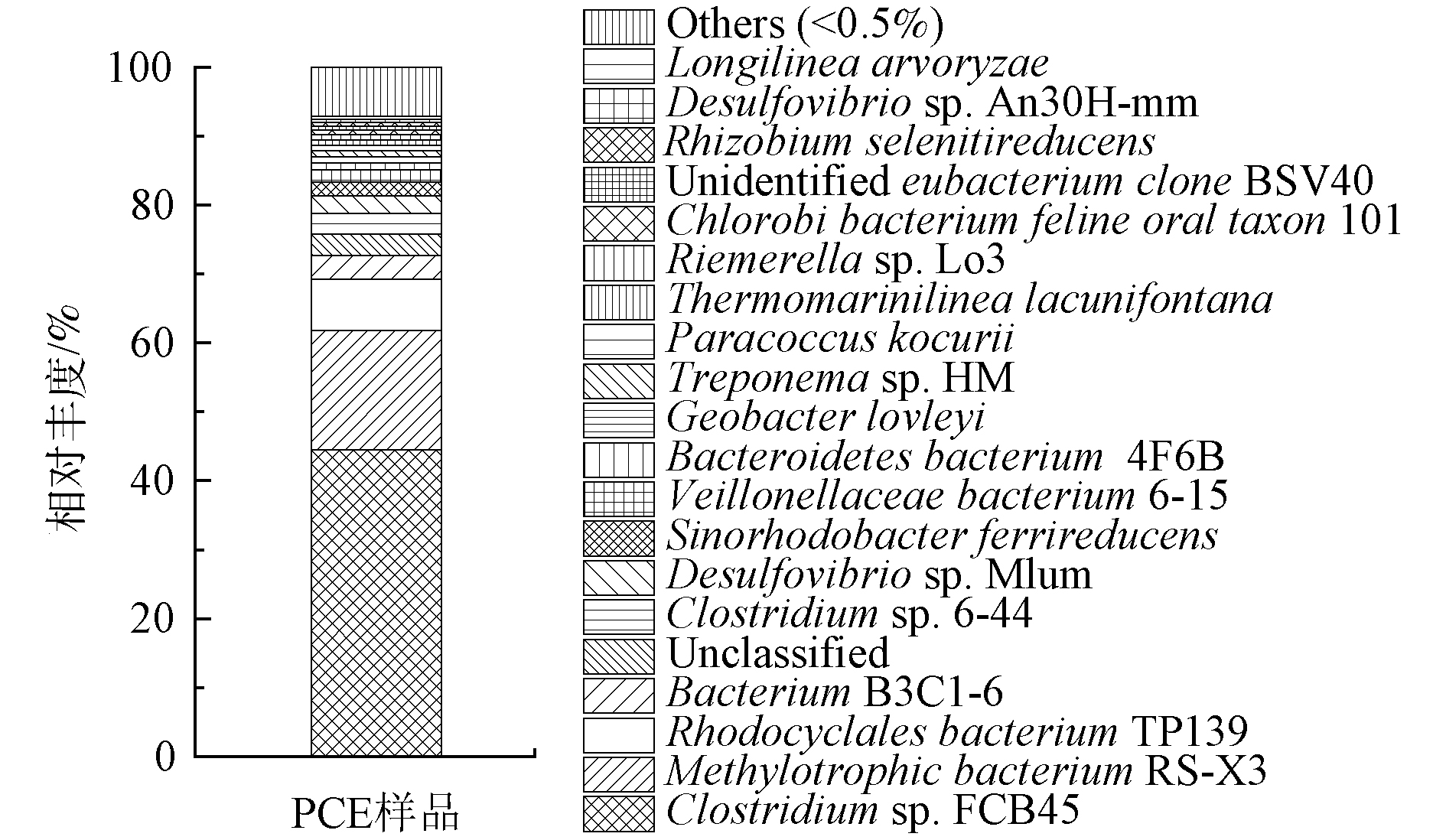
种水平下的样本群落结构组成分布见图3,菌种鉴定结果表明PCE的降解菌群群落结构复杂多样。该菌群中共有16个高于0.50%的种,分别为Clostridium sp. FCB45、Methylotrophic bacterium RS-X3、Rhodocyclales bacterium TP139、Bacterium B3C1-6、Clostridium sp. 6-44、Desulfovibrio sp. Mlhm、Sinorhodobacter ferrireducens、Veillonellaceae bacterium 6-15、Bacteroidetes bacterium 4F6B、Geobacter lovleyi、Treponema sp. HM、Paracoccus kocurii、Thermomarinilinea lacunifontana、Riemerella sp. Lo3、Chlorobi bacterium feline oral taxon 101及Rhizobium selenitireducens。其中,梭状芽孢杆菌(Clostridium sp. FCB45)含量最高,占总量的44.49%,成为优势菌种。这一结果证实了DAVID[12]在微生态研究中推测Clostridium属这种活性较高的梭状菌可以成为降解PCE的潜在微生物的结论。然而,因为这是由普通污水厂的厌氧污泥驯化而来的,故与LOFFLER等[30]在被PCE长期污染的沉积物中所观察到的Desulfuromonas和Dehalococcoides是PCE的优势降解菌有所不同。Methylotrophic bacterium RS-X3含量为17.34%,作为甲基营养菌不仅可以在氯化甲烷上生长[31],并且其被证实含有脱氯酶基因[32],因此,可推测在本研究中Methylotrophic bacterium RS-X3可以促进PCE的生物降解。而占总量7.39%的Rhodocyclales bacterium TP139作为能够利用多种有机化合物生长的多功能细菌的代表[33],首次在PCE降解菌群中被发现并检测到。
有研究表明,脱硫弧菌属(Desulfovibrio sp. Mlhm)可以参与几种氯代污染物的脱氯和硫酸盐还原,包括1, 2-二氯乙烷[34]、1-三氯乙烷[35]和氯仿[36],Treponema属(Treponema sp. HM)能够通过添加醋酸盐将五氯苯酚脱氯成氢气、二氧化碳和甲酸盐[37],Bacteroides属(Bacteroidetes bacterium 4F6B)可降解甲基叔丁基醚[38],Sinorhodobacter ferrireducens能利用肌醇、L-丙氨酸、4-羟基苯甲酸和L-脯氨酸作为碳源[39],Thermomarinilinea属(Thermomarinilinea lacunifontana)能在多种有机物存在时生长(包括明胶、甲壳素、谷氨酸等)[40]。这些菌株也在该菌群中被检测到,其含量分别为2.61%、0.85%、0.97%、1.99%和0.80%,其中Desulfovibrio、Treponema属为潜在PCE降解菌。
-
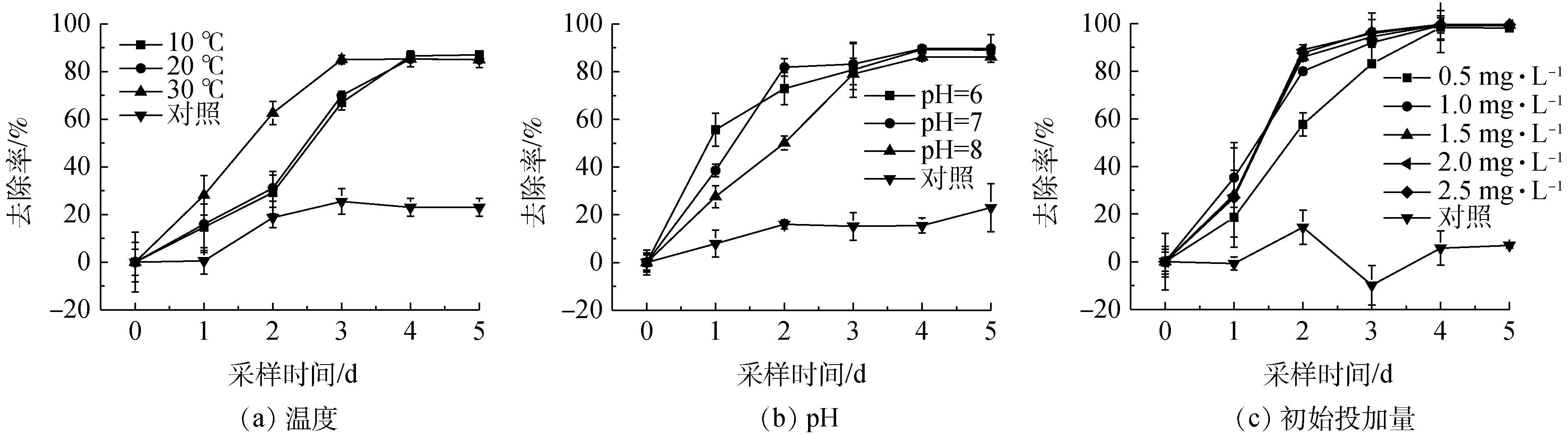
环境因素对PCE降解效果的影响见图4。由图4(a)可知温度对PCE降解率的影响不显著。数据显示3个温度梯度下去除率均高于80%,表明该菌群整体代谢活性较高,具有较宽的温度生态幅,适应不同温度的环境能力较强。在实验初期(0~3 d),菌群在10 ℃以及 20 ℃下对PCE的降解速率相比30 ℃较慢;在后期(4 d后),菌群在10 ℃和20 ℃时对PCE的降解率与其在30 ℃下的降解率相当。ZHANG等[41]也得出TCE去除率随温度的升高(从20 ℃上升到30 ℃)而增加的类似结论。SHARMA等[42]认为,低温下微生物需要更多的时间来矿化疏水性物质。因此,生物反应与化学反应都会减慢速率,而较高的温度会导致生物降解增加。一般地下水的平均温度约为15 ℃(我国西北地区冬季地下水水温仍处于10 ℃左右)[43-45],可以达到该菌群生长的适宜温度范围。
由图4(b)可知:菌群在降解PCE的过程中受非极端pH的影响不显著。在初始pH 6~8时,PCE的降解速率随着初始pH的变化呈现出一定的波动性,但在总体上体系中的微生物群落均能够实现PCE的有效降解。初始pH 7.0为PCE降解的最适值,因为弱酸以及弱碱性的条件不会对降解菌群活性产生抑制,所以在非极端pH的地下水环境中,此菌群也可以发挥作用。
由图4(c)可知:菌群在降解PCE的过程中受PCE初始浓度的影响不显著,但其降解速率存在一定波动性。在此PCE初始投加范围内,该菌群活性没有受到明显抑制,此浓度下的PCE毒性没有破坏菌群体内的酶、核酸以及DNA等的结构,所以菌群能正常进行新陈代谢,但当PCE初始浓度过低时,与酶结合的底物浓度偏低,会使微生物的活性降低,从而导致PCE降解速率下降[46]。
-
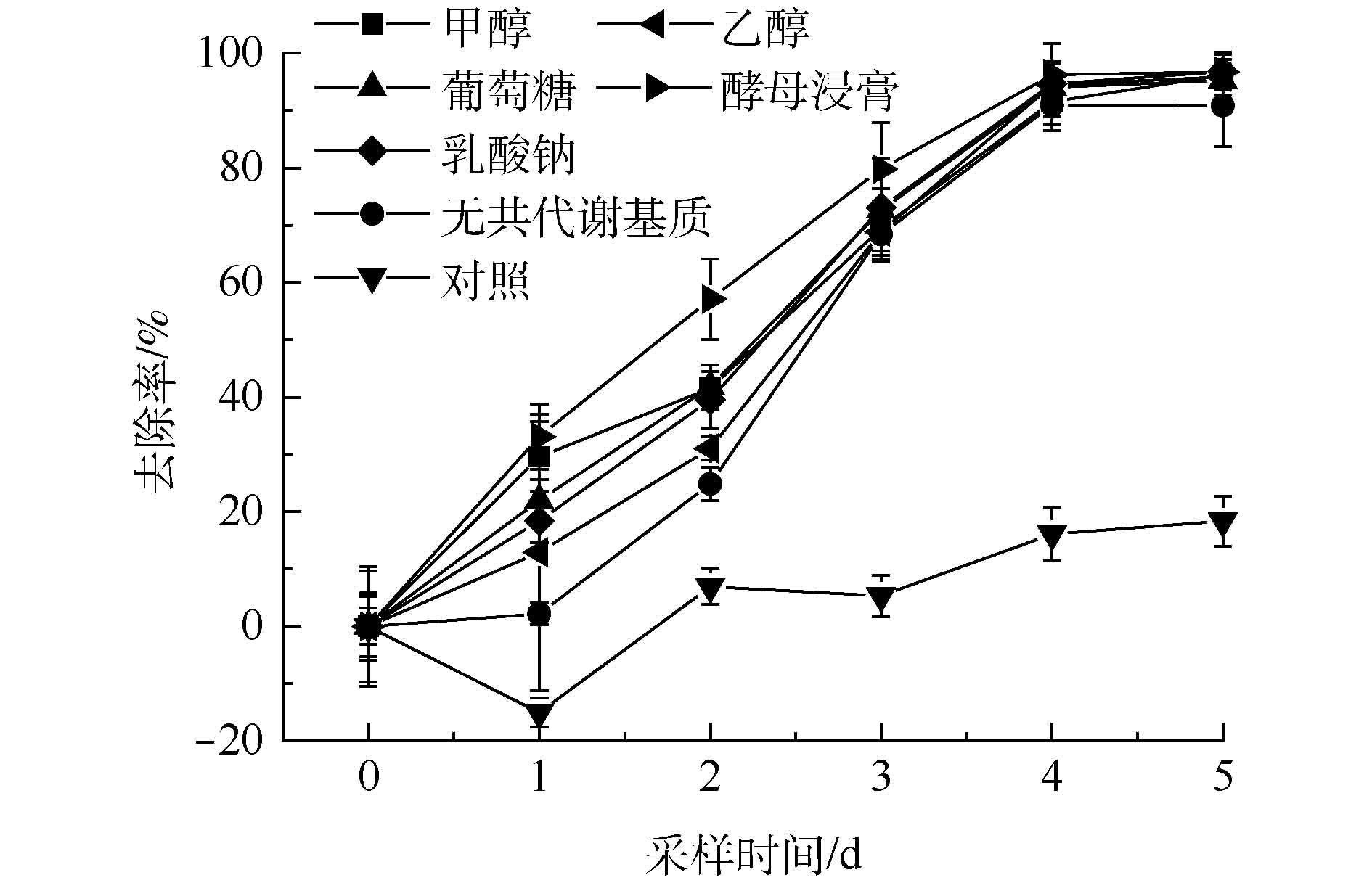
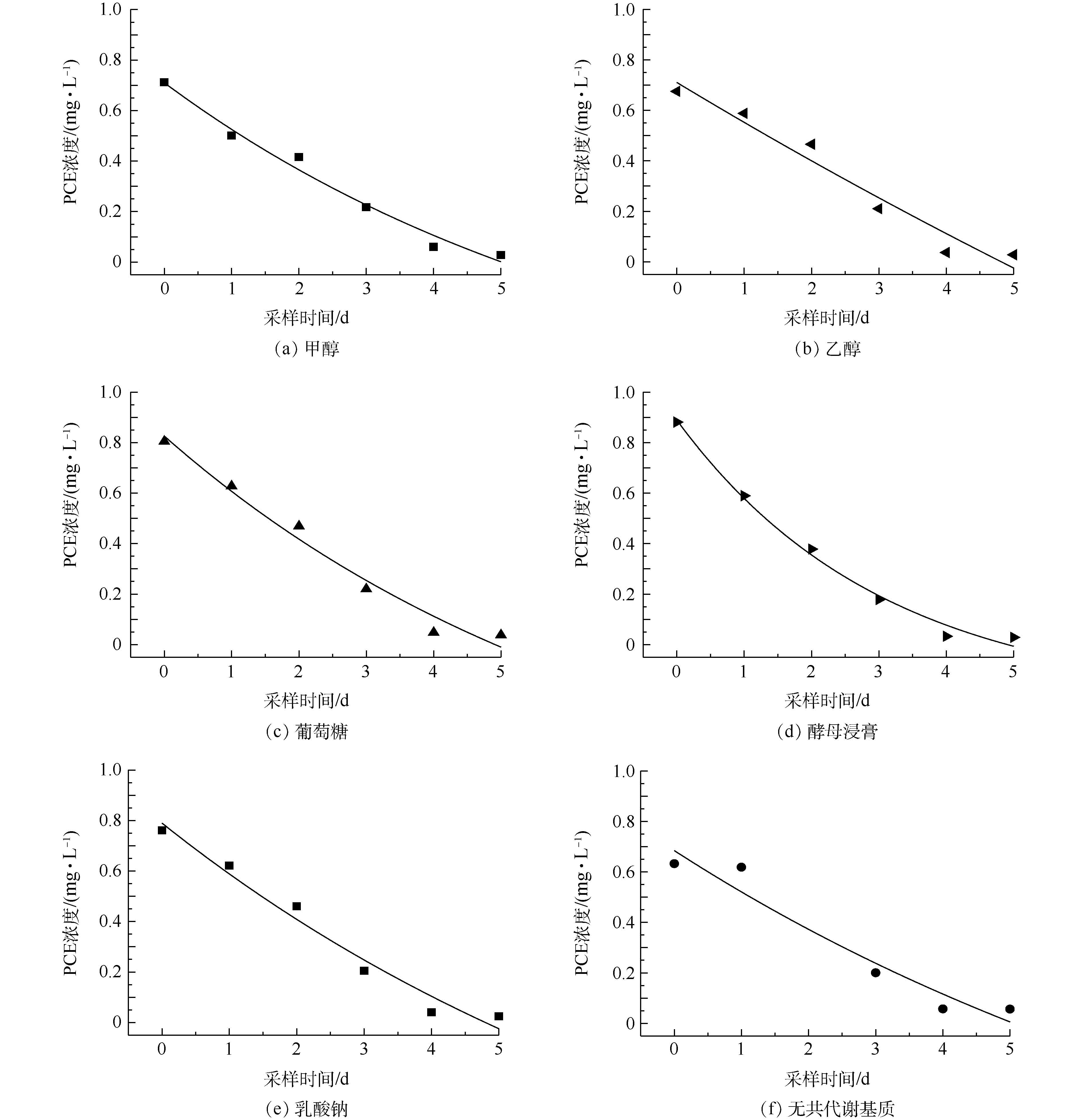
不同共代谢基质对PCE降解效果的影响见图5,其中,酵母浸膏作为共代谢基质时降解效果最好。为了比较不同共代谢基质对微生物脱氯能力的影响,需要建立动力学模型进行比较。一般情况下,反应的动力学方程见式(1),对应一级动力学模型[47]见式(2)。
式中:c为PCE浓度,mg·L−1;p为反应级数;k为反应速率常数,d−1;t为反应时间,d;c0为初始PCE浓度,mg·L−1;t0为初始反应时间,d。
PCE反应动力学模型见图6,根据一级反应动力学拟合方程得到的相关参数见表1。由图6和表1可知,共代谢基质强化的微生物降解过程全部符合一级反应动力学,R2均在0.928以上,除无共代谢对照组只有0.884外,整体拟合效果较好。根据表1进一步可得出,添加了酵母浸膏后实验的半衰期比不添加共代谢基质时减少了0.838 d,并且降解反应速率常数由0.327 d−1降至0.098 d−1,其他共代谢基质(除乙醇外)添加后降解反应速率常数均有提高。上述结果表明,这些共代谢基质的添加均提高了菌群的降解速率。添加不同共代谢基质后的PCE降解反应速率常数有以下关系:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。以酵母浸膏为共代谢基质时,降解反应速率常数最大为0.327 d−1,半衰期为1.571 d,大于其他共代谢基质,所以在此实验条件下,酵母浸膏为最佳的共代谢基质。这可能是因为酵母浸膏含有丰富的维生素、各种氨基酸及核酸降解物等,可以作为促进微生物生长的氮素营养源[22]。乙醇作为共代谢基质时四氯乙烯的降解反应速率常数最小,还小于没有共代谢条件下的降解速率,这可能是因为乙醇对该菌群产生了活性抑制。乙醇因为其特殊的理化性质,会对简单节杆菌中的细胞色素酶等产生抑制作用,使降解菌的降解效率降低[48],乙醇还会改变乳酸杆菌细胞膜的通透性从而影响菌体的代谢活力[49]。因此,可推断同为革兰氏阳性[50]菌的Clostridium sp. FCB45(优势菌种)会出现相似的活性抑制,从而影响PCE降解速率。
-
1)利用梯度驯化法获得可将PCE高效降解的菌群,此菌群可以在PCE长期选择压力下生存繁殖。菌种鉴定结果显示:在种水平上,梭状芽孢杆菌Clostridium sp. FCB45含量最高,成为群落中的优势菌种。该群落多样性高,组成复杂,群落稳定性高,易于管理。
2)当温度为30 ℃、pH为中性、PCE初始浓度为1 mg∙L−1和共代谢基质为酵母浸膏时,PCE降解效率最高可达96.75%。此群落可以在不同环境条件下(pH、温度等)表现出较高的降解率,该微生物群落有较宽的生态幅,在非极端环境条件下该群落均能发挥作用。
3)添加共代谢基质强化的微生物实验结果表明,反应模型均符合一级反应动力学,拟合度良好,降解反应速率常数由大到小顺序依次是:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。该菌群在利用酵母浸膏作为共代谢基质时,降解速率常数最大可达0.327 d−1。本研究中酵母浸膏最大程度地提高了四氯乙烯的降解速率。
共代谢基质强化微生物修复四氯乙烯污染地下水
Co-substrates enhanced bioremediation of groundwater contaminated by tetrachloroethylene
-
摘要: 针对微生物修复地下水中四氯乙烯 (tetrachloroethylene,PCE) 周期长的问题,通过添加共代谢基质强化微生物修复技术以提高修复速率。以某污水处理厂的厌氧活性污泥为菌种来源,采用振荡培养法进行PCE高效降解菌群的驯化和筛选,对微生物降解PCE的温度、初始pH和PCE初始浓度3种影响因素进行了条件优化;使用甲醇、乙醇、葡萄糖、酵母浸膏以及乳酸钠作为共代谢基质,研究了不同共代谢基质条件下微生物群落对PCE的降解规律,并建立了反应动力学模型。结果表明:在种水平上,梭状芽孢杆菌Clostridium sp. FCB45是优势菌种;PCE初始浓度为1 mg∙L−1,pH在中性,温度为30 ℃,共代谢基质为酵母浸膏时,微生物群落的降解效果最好,PCE降解率可高达96.75%,降解速率常数最高可达0.327 d−1;添加共代谢基质强化的微生物降解过程全部符合一级反应动力学模型。添加共代谢基质的微生物实验结果表明,添加共代谢基质可以有效缩短微生物修复周期,对污染地下水的原位生物修复具有一定的参考价值。Abstract: Aiming at the long remediation timeframe associated with bioremediation of tetrachloroethylene (PCE)-contaminated groundwater, the addition of co-substrates has been explored to improve the biodegradation rate and reduce the remediation duration. In this study, an acclimated microbial consortium for PCE biodegradation was enriched by the shaking cultivation method with a microbial source from anaerobic sludge collected from a wastewater treatment plant. PCE degradation efficiency was determined and the impacts of different environmental factors such as temperature, initial pH and initial concentration of tetrachloroethylene were optimized. In addition, the enhanced biodegradation efficiencies of PCE using different co-substrates, including methanol, ethanol, glucose, yeast extract and sodium lactate, were investigated, and the corresponding biodegradation kinetic models were also developed. Experimental results showed that Clostridium sp. FCB45 played a significant role in PCE biodegradation. The best PCE biodegradation effect occurred with the efficiency up to 96.75% at PCE initial concentration of 1 mg∙L−1, neutral pH, 30 ℃, and co-substrate of yeast extract, and the highest biodegradation rate constant was 0.327 d−1. The enhanced biodegradation using different co-substrates can all be described by the first-order reaction kinetics. It was concluded that the addition of co-substrates can effectively shorten the remediation timeframe, which provides a theoretical and experimental basis for in situ enhanced bioremediation of PCE-contaminated groundwater.
-
Key words:
- tetrachloroethylene (PCE) /
- bioremediation /
- co-substrates /
- contaminated groundwater
-
随着工农业的迅速发展,氯代烃类有机物作为生产原料和溶剂被人类广泛地应用在工业生产、农药、干洗和医疗等行业[1],造成了一系列环境问题。氯代烃类在环境中随着雨水、径流等渗滤到土壤中[2],被土壤吸附一部分后渗漏到地下含水层,导致地下水污染[3],其中地下水中四氯乙烯、三氯乙烯及四氯化碳等污染尤为普遍[4-6]。本研究中选取一种典型氯代烃PCE作为研究对象,该物质是在常温下易挥发、非易燃的重质非水溶相液体(dense non-aqueous phase liquids,DNAPLs),化学性质稳定,且有很强的生物毒性和潜在的生物累积性,并具有刺激性、致敏性、致突变性、致畸性、致癌性等特性,已被较多国家列为优先控制污染物[7]。一旦PCE通过各种途径进入地下环境,会下渗到地下水深层,严重污染地下水资源,对生态环境和人体健康产生极大的危害[8]。1999年北京市地下水有机污染调查结果表明,北京地区有2处氯代烃污染区域面积超过10 km2,主要污染物为TCE和PCE,最高浓度分别为487.6 μg∙L−1和63.74 μg∙L−1,其中PCE的检出率较高[9]。为了保护生态环境及促进可持续发展,地下水中氯代烃污染问题亟待解决,地下水水质保护和污染修复刻不容缓[10]。
考虑到微生物修复技术具有易于原位修复、处理成本低、无二次污染且可以实现无害化等优点,故进一步研究微生物群落对PCE的降解非常必要[11]。近年来,国内外研究人员对氯代烃的生物降解进行了大量探索和研究[12-19]。在厌氧条件下,氯代烯烃可以作为某些细菌的终端电子受体,通过厌氧微生物作用发生还原脱氯,生成次级产物,最终达到无害化的修复目的,而加入一些有机质进行共代谢可以提高其降解速率[12-14]。有研究[15]发现,将厌氧细菌Y51株和好氧性混合株P. pseudocalcaligenes KF707-D3株综合运用可以将难生物降解的PCE完全分解。实际上,单一的厌氧菌或好氧菌很难彻底快速降解PCE[16]。迄今为止,仅发现Dehalococcoides mccartyi属的菌株能使PCE完全脱氯[17],且该属菌株对碳源要求较高,一般需要醋酸盐作为碳源[18],生长条件较为苛刻。然而,多种常见微生物如脱硫单胞菌,硫磺菌等可以协同合作将PCE还原脱氯[19]。
目前,对微生物修复氯代烃的研究主要集中在单一好氧菌株以及厌氧菌株的运用。因此,有必要研究地下水环境中微生物群落降解氯代烃的特性,从而进一步探索提高氯代烃生物降解速率的可行方法。尽管有很多学者研究某类共代谢基质条件下微生物菌株是否能够成功脱氯,但很少有学者针对微生物群落在不同共代谢基质条件下的脱氯能力开展相关研究[20]。因此,根据现阶段氯代烃修复的研究经验,本研究选取一种典型氯代烃PCE,旨在评估模拟地下水环境下降解菌群的共代谢脱氯能力。本研究采用振荡培养法[21]来筛选并鉴定出PCE优势降解菌群,对环境因素开展实验并对其进行了条件优化,探索了不同共代谢基质条件下PCE降解的规律,建立了反应动力学模型,比较了不同共代谢基质条件下微生物的脱氯能力。
1. 材料与方法
1.1 实验原料
四氯乙烯(C2Cl4)和甲醇(CH3OH)为色谱纯,酵母浸膏和维生素B12为生物试剂,乙醇(CH3CH2OH)、三水合磷酸氢二钾(K2HPO4∙3H2O)、七水合硫酸亚铁(FeSO4∙7H2O)、一水合磷酸二氢钠(NaH2PO4∙H2O)、氯化铵(NH4Cl)、七水合硫酸镁(MgSO4∙7H2O)、七水合硫酸锰(MnSO4∙7H2O)、七水合硫酸锌(ZnSO4∙7H2O)、乳酸钠(dl-C3H5O3Na)、葡萄糖(C6H12O6)、六水合氯化钴(CoCl2∙6H2O)、一水合次氮基三乙酸三钠(N(CH2CO2Na)3∙H2O)均为分析纯。
1.2 实验装置
实验过程中使用的仪器设备:恒温振荡箱(MQL-621R,上海旻泉仪器有限公司)、厌氧培养箱(YQX-Ⅱ型,上海新苗医疗器械制造有限公司)、立式压力蒸汽灭菌锅(YM30型,上海三申医疗器械有限公司)、紫外可见分光光度计(TU-1810,北京普析通用仪器有限责任公司)、氮吹仪器(ANPEL DC12,上海安谱实验科技股份有限公司)、气相色谱仪(Agilent7820A,安捷伦科技有限公司)、Illumina Mi Seq平台(微基生物科技(上海)有限公司)。驯化实验采用厌氧瓶密封操作,实验装置见图1,可定期使用注射器采样。
1.3 实验方法
PCE降解菌群的驯化筛选。以南京某污水处理厂的厌氧活性污泥为菌种来源,采用图1的实验装置对厌氧活性污泥进行驯化培养,整个实验操作过程在厌氧培养箱中完成。实验配制无机盐培养基来模拟地下水[22],其组成成分为:K2HPO4∙3H2O 1.05 g∙L−1、NaH2PO4∙H2O 0.25 g∙L−1、NH4Cl 0.49 g∙L−1、N(CH2CO2Na)3∙H2O 0.03 g∙L−1、dl-C3H5O3Na 0.112 g∙L−1、MgSO4∙7H2O 0.05 g∙L−1、FeSO4∙7H2O 3 mg∙L−1、MnSO4∙7H2O 0.74 mg∙L−1、ZnSO4∙7H2O 0.74 mg∙L−1、CoCl2∙6H2O 0.25 mg∙L−1、维生素B12 0.05 mg∙L−1[23]。PCE降解菌群的驯化采用梯度驯化法[24],按PCE浓度由低到高进行,先将200 mL活性污泥接种到700 mL除氧灭菌后的无机盐培养基中(除非特殊说明,pH均在6.80~7.25),随后采用聚四氟乙烯瓶塞和铝卷曲盖密封血清瓶,并采用无菌注射器加入PCE溶液。PCE溶液浓度初次设定为0.5 mg∙L−1,然后放置于30 ℃、转速为30 r∙min−1的恒温振荡培养箱中进行培养驯化7 d,之后更新培养基并将浓度依次递增为1、2、3、4、5 mg∙L−1[22],每个阶段均培养7 d。
PCE降解特性研究。将100 mL无机盐培养基置于血清瓶中,所有培养基在使用前均利用氮气吹扫30 min,然后用高压灭菌锅在121 ℃下灭菌30 min,最后放入厌氧培养箱中冷却备用。将经过梯度驯化后获得的菌液按5%投加量接入含有100 mL无机盐培养基的血清瓶中,随后采用特氟隆表面橡胶隔膜(美国安捷伦公司)和铝卷曲盖密封血清瓶,PCE初始投加量设定为1 mg∙L−1,随后置于30 ℃、30 r∙min−1条件下恒温振荡器中培养。实验过程中每隔24 h采样1次,测定培养基中残留PCE的浓度以及吸光度,分析驯化所得菌群的PCE降解特性及菌群生长曲线。
环境因素对微生物群落降解PCE的影响。在保持与降解特性实验相应条件不变的前提下,分别研究不同温度(10、20、30 ℃)、不同pH(6、7、8)、不同PCE初始浓度(0.5、1、1.5、2、2.5 mg∙L−1)等条件对菌群降解PCE的影响。在相同的实验条件下,不接种菌液作对照,每组实验重复做3个平行样,取平均值。每隔24 h采样1次,测定培养基中残留PCE的浓度,采样结束后使用硅胶填缝密封盖上留下的针孔以防止PCE挥发。
不同共代谢基质对微生物群落降解PCE的影响。为了探索各种共代谢基质对降解菌群性能的影响,将培养所得菌液按5%接种量加入100 mL的无机盐培养液,PCE初始投加量设定为1 mg∙L−1,再分别加入甲醇、乙醇、葡萄糖、酵母浸膏、乳酸钠[25]。其中,葡萄糖以及酵母浸膏浓度为1 g∙L−1、甲醇浓度为0.6 g∙L−1、乙醇浓度为20 mg∙L−1、乳酸钠浓度为0.77 g∙L-1[26]。在30 ℃、30 r∙min−1条件下振荡培养,每24 h采样检测,并利用实验结果建立动力学模型。
1.4 分析方法
实验中PCE浓度采用顶空气相色谱仪[27](Agilent 7820A,美国Agilent公司)及DB-624色谱柱测量。
实验中菌群浓度采用分光光度法[25]测定,取适量实验样品放入1 cm的比色皿中,利用紫外分光光度计测量其在600 nm处的吸光度(A600)。
实验中PCE降解菌群群落结构分析采用16S rDNA[28]来分析,按照柱式细菌基因组抽提试剂盒的使用操作说明,对混合培养体的菌液中的DNA进行提取[29],将纯化后的样品利用Illumina Mi Seq平台进行高通量测序。
2. 结果与讨论
2.1 菌群对PCE降解特性研究
驯化期后PCE降解曲线及菌群生长曲线见图2。由图2(a)可知,PCE能得到高效降解并且去除率已明显高于90%。由图2(b)可知:降解初期(0~2 d),菌群在PCE存在条件下能以较快速度生长;随着采样时间的推移,中期(2~4 d)达到静止期,OD值缓慢下降;后期(4~5 d),由于PCE含量不足,菌群活性被抑制,OD值下降较快。筛选得到的菌群能够高效降解PCE,可以进行菌种鉴定以及环境因素影响实验。
2.2 PCE降解菌群的结构组成
种水平下的样本群落结构组成分布见图3,菌种鉴定结果表明PCE的降解菌群群落结构复杂多样。该菌群中共有16个高于0.50%的种,分别为Clostridium sp. FCB45、Methylotrophic bacterium RS-X3、Rhodocyclales bacterium TP139、Bacterium B3C1-6、Clostridium sp. 6-44、Desulfovibrio sp. Mlhm、Sinorhodobacter ferrireducens、Veillonellaceae bacterium 6-15、Bacteroidetes bacterium 4F6B、Geobacter lovleyi、Treponema sp. HM、Paracoccus kocurii、Thermomarinilinea lacunifontana、Riemerella sp. Lo3、Chlorobi bacterium feline oral taxon 101及Rhizobium selenitireducens。其中,梭状芽孢杆菌(Clostridium sp. FCB45)含量最高,占总量的44.49%,成为优势菌种。这一结果证实了DAVID[12]在微生态研究中推测Clostridium属这种活性较高的梭状菌可以成为降解PCE的潜在微生物的结论。然而,因为这是由普通污水厂的厌氧污泥驯化而来的,故与LOFFLER等[30]在被PCE长期污染的沉积物中所观察到的Desulfuromonas和Dehalococcoides是PCE的优势降解菌有所不同。Methylotrophic bacterium RS-X3含量为17.34%,作为甲基营养菌不仅可以在氯化甲烷上生长[31],并且其被证实含有脱氯酶基因[32],因此,可推测在本研究中Methylotrophic bacterium RS-X3可以促进PCE的生物降解。而占总量7.39%的Rhodocyclales bacterium TP139作为能够利用多种有机化合物生长的多功能细菌的代表[33],首次在PCE降解菌群中被发现并检测到。
有研究表明,脱硫弧菌属(Desulfovibrio sp. Mlhm)可以参与几种氯代污染物的脱氯和硫酸盐还原,包括1, 2-二氯乙烷[34]、1-三氯乙烷[35]和氯仿[36],Treponema属(Treponema sp. HM)能够通过添加醋酸盐将五氯苯酚脱氯成氢气、二氧化碳和甲酸盐[37],Bacteroides属(Bacteroidetes bacterium 4F6B)可降解甲基叔丁基醚[38],Sinorhodobacter ferrireducens能利用肌醇、L-丙氨酸、4-羟基苯甲酸和L-脯氨酸作为碳源[39],Thermomarinilinea属(Thermomarinilinea lacunifontana)能在多种有机物存在时生长(包括明胶、甲壳素、谷氨酸等)[40]。这些菌株也在该菌群中被检测到,其含量分别为2.61%、0.85%、0.97%、1.99%和0.80%,其中Desulfovibrio、Treponema属为潜在PCE降解菌。
2.3 环境因素对降解的影响
环境因素对PCE降解效果的影响见图4。由图4(a)可知温度对PCE降解率的影响不显著。数据显示3个温度梯度下去除率均高于80%,表明该菌群整体代谢活性较高,具有较宽的温度生态幅,适应不同温度的环境能力较强。在实验初期(0~3 d),菌群在10 ℃以及 20 ℃下对PCE的降解速率相比30 ℃较慢;在后期(4 d后),菌群在10 ℃和20 ℃时对PCE的降解率与其在30 ℃下的降解率相当。ZHANG等[41]也得出TCE去除率随温度的升高(从20 ℃上升到30 ℃)而增加的类似结论。SHARMA等[42]认为,低温下微生物需要更多的时间来矿化疏水性物质。因此,生物反应与化学反应都会减慢速率,而较高的温度会导致生物降解增加。一般地下水的平均温度约为15 ℃(我国西北地区冬季地下水水温仍处于10 ℃左右)[43-45],可以达到该菌群生长的适宜温度范围。
由图4(b)可知:菌群在降解PCE的过程中受非极端pH的影响不显著。在初始pH 6~8时,PCE的降解速率随着初始pH的变化呈现出一定的波动性,但在总体上体系中的微生物群落均能够实现PCE的有效降解。初始pH 7.0为PCE降解的最适值,因为弱酸以及弱碱性的条件不会对降解菌群活性产生抑制,所以在非极端pH的地下水环境中,此菌群也可以发挥作用。
由图4(c)可知:菌群在降解PCE的过程中受PCE初始浓度的影响不显著,但其降解速率存在一定波动性。在此PCE初始投加范围内,该菌群活性没有受到明显抑制,此浓度下的PCE毒性没有破坏菌群体内的酶、核酸以及DNA等的结构,所以菌群能正常进行新陈代谢,但当PCE初始浓度过低时,与酶结合的底物浓度偏低,会使微生物的活性降低,从而导致PCE降解速率下降[46]。
2.4 不同共代谢基质对降解的影响
不同共代谢基质对PCE降解效果的影响见图5,其中,酵母浸膏作为共代谢基质时降解效果最好。为了比较不同共代谢基质对微生物脱氯能力的影响,需要建立动力学模型进行比较。一般情况下,反应的动力学方程见式(1),对应一级动力学模型[47]见式(2)。
dc/dt=−kcp(1) c=c0e−k(t−t0)(2) 式中:c为PCE浓度,mg·L−1;p为反应级数;k为反应速率常数,d−1;t为反应时间,d;c0为初始PCE浓度,mg·L−1;t0为初始反应时间,d。
PCE反应动力学模型见图6,根据一级反应动力学拟合方程得到的相关参数见表1。由图6和表1可知,共代谢基质强化的微生物降解过程全部符合一级反应动力学,R2均在0.928以上,除无共代谢对照组只有0.884外,整体拟合效果较好。根据表1进一步可得出,添加了酵母浸膏后实验的半衰期比不添加共代谢基质时减少了0.838 d,并且降解反应速率常数由0.327 d−1降至0.098 d−1,其他共代谢基质(除乙醇外)添加后降解反应速率常数均有提高。上述结果表明,这些共代谢基质的添加均提高了菌群的降解速率。添加不同共代谢基质后的PCE降解反应速率常数有以下关系:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。以酵母浸膏为共代谢基质时,降解反应速率常数最大为0.327 d−1,半衰期为1.571 d,大于其他共代谢基质,所以在此实验条件下,酵母浸膏为最佳的共代谢基质。这可能是因为酵母浸膏含有丰富的维生素、各种氨基酸及核酸降解物等,可以作为促进微生物生长的氮素营养源[22]。乙醇作为共代谢基质时四氯乙烯的降解反应速率常数最小,还小于没有共代谢条件下的降解速率,这可能是因为乙醇对该菌群产生了活性抑制。乙醇因为其特殊的理化性质,会对简单节杆菌中的细胞色素酶等产生抑制作用,使降解菌的降解效率降低[48],乙醇还会改变乳酸杆菌细胞膜的通透性从而影响菌体的代谢活力[49]。因此,可推断同为革兰氏阳性[50]菌的Clostridium sp. FCB45(优势菌种)会出现相似的活性抑制,从而影响PCE降解速率。
表 1 不同共代谢基质对应的PCE的反应动力学模型方程及相关参数Table 1. Reaction kinetics equations and parameters of PCE degradation using different co-substrates共代谢基质 动力学模型 R2 反应速率常数k/d−1 半衰期t1/2/d 甲醇 c=1.39e−t7.02−0.682 
0.972 0.142 1.665 乙醇 c=4.38e−t27.23−3.67 
0.928 0.037 2.296 葡萄糖 c=1.62e−t6.875−0.792 
0.963 0.145 2.095 酵母浸膏 c=1.11e−t3.055−0.223 
0.988 0.327 1.571 乳酸钠 c=1.895e−t8.906−1.106 
0.955 0.112 2.161 无共代谢基质 c=1.746e−t10.155−1.061 
0.884 0.098 2.409 3. 结论
1)利用梯度驯化法获得可将PCE高效降解的菌群,此菌群可以在PCE长期选择压力下生存繁殖。菌种鉴定结果显示:在种水平上,梭状芽孢杆菌Clostridium sp. FCB45含量最高,成为群落中的优势菌种。该群落多样性高,组成复杂,群落稳定性高,易于管理。
2)当温度为30 ℃、pH为中性、PCE初始浓度为1 mg∙L−1和共代谢基质为酵母浸膏时,PCE降解效率最高可达96.75%。此群落可以在不同环境条件下(pH、温度等)表现出较高的降解率,该微生物群落有较宽的生态幅,在非极端环境条件下该群落均能发挥作用。
3)添加共代谢基质强化的微生物实验结果表明,反应模型均符合一级反应动力学,拟合度良好,降解反应速率常数由大到小顺序依次是:酵母浸膏>葡萄糖≈甲醇>乳酸钠>无共代谢基质>乙醇。该菌群在利用酵母浸膏作为共代谢基质时,降解速率常数最大可达0.327 d−1。本研究中酵母浸膏最大程度地提高了四氯乙烯的降解速率。
-
表 1 不同共代谢基质对应的PCE的反应动力学模型方程及相关参数
Table 1. Reaction kinetics equations and parameters of PCE degradation using different co-substrates
共代谢基质 动力学模型 R2 反应速率常数k/d−1 半衰期t1/2/d 甲醇 c=1.39e−t7.02−0.682 0.972 0.142 1.665 乙醇 c=4.38e−t27.23−3.67 0.928 0.037 2.296 葡萄糖 c=1.62e−t6.875−0.792 0.963 0.145 2.095 酵母浸膏 c=1.11e−t3.055−0.223 0.988 0.327 1.571 乳酸钠 c=1.895e−t8.906−1.106 0.955 0.112 2.161 无共代谢基质 c=1.746e−t10.155−1.061 0.884 0.098 2.409 -
[1] VOGEL M, NIJENHUIS I, LLOYD J, et al. Combined chemical and microbiological degradation of tetrachloroethene during the application of carbo-iron at a contaminated field site[J]. Science of the Total Environment, 2018, 628-629: 1027-1036. doi: 10.1016/j.scitotenv.2018.01.310 [2] 曹红. 污染场地有机污染物迁移转化规律及其含水层系统天然净化能力研究[D]. 济南: 山东科技大学, 2010. [3] 马长文. 地下水中四氯乙烯迁移归宿与修复技术研究[D]. 上海: 上海交通大学, 2007. [4] SATO C, YAO J. Simultaneous and sequential photosonolysis of TCE and PCE[J]. Journal of Environmental Engineering-Asce, 2006, 132(1): 32-41. doi: 10.1061/(ASCE)0733-9372(2006)132:1(32) [5] 方生, 陈秀玲. 地下水开发引起的环境问题与治理[J]. 南水北调与水利科技, 2001, 23(1): 8-11. [6] 吕倩, 魏洁云. 中国地下水污染现状及治理[J]. 生态经济, 2016, 32(10): 10-13. doi: 10.3969/j.issn.1671-4407.2016.10.003 [7] LUO Y S, HSIEH N H, SOLDATOW V Y, et al. Comparative analysis of metabolism of trichloroethylene and tetrachloroethylene among mouse tissues and strains[J]. Toxicology, 2018, 409: 33-43. doi: 10.1016/j.tox.2018.07.012 [8] MAHALINGAIAH S, WINTER M R, ASCHENGRAU A. Association of prenatal and early life exposure to tetrachloroethylene (PCE) with polycystic ovary syndrome and other reproductive disorders in the cape cod health study: A retrospective cohort study[J]. Reproductive Toxicology, 2016, 65: 87-94. doi: 10.1016/j.reprotox.2016.07.005 [9] 杨钦明. 四氯乙烯污染地下水的厌氧-好氧型生物反应格栅修复技术研究[D]. 天津: 天津大学, 2017. [10] 周友亚, 颜增光, 周光辉, 等. 制定场地土壤风险评价筛选值中关注污染物的预筛选方法[J]. 环境工程技术学报, 2011, 1(3): 264-269. doi: 10.3969/j.issn.1674-991X.2011.03.044 [11] WU M, LUO Q, LIU S, et al. Screening ornamental plants to identify potential Cd hyperaccumulators for bioremediation[J]. Ecotoxicology and Environmental Safety, 2018, 162: 35-41. doi: 10.1016/j.ecoenv.2018.06.049 [12] DAVID M M, CECILLON S, WARNE B M, et al. Microbial ecology of chlorinated solvent biodegradation[J]. Environmental Microbiology, 2015, 17(12): 4835-4850. doi: 10.1111/1462-2920.12413 [13] 宋震宇, 杨伟, 王文茜, 等. 氯代烃污染地下水修复技术研究进展[J]. 环境科学与管理, 2014, 39(4): 95-99. doi: 10.3969/j.issn.1673-1212.2014.04.024 [14] CHANG C H, YANG H Y, HUNG J M, et al. Simulation of combined anaerobic/aerobic bioremediation of tetrachloroethylene in groundwater by a column system[J]. International Biodeterioration & Biodegradation, 2017, 117: 150-157. [15] 米生权, 魏涛. 四氯乙烯污染现状及处理方法的研究进展[J]. 海峡预防医学杂志, 2006, 12(3): 21-23. doi: 10.3969/j.issn.1007-2705.2006.03.007 [16] 马长文, 仵彦卿, 孙承兴. 受氯代烃类污染的地下水环境修复研究进展[J]. 环境保护科学, 2007, 33(3): 23-25. doi: 10.3969/j.issn.1004-6216.2007.03.008 [17] LEE J, LEE T K. Development and characterization of PCE-to-ethene dechlorinating microcosms with contaminated river sediment[J]. Journal of Microbiology and Biotechnology, 2016, 26(1): 120-129. doi: 10.4014/jmb.1510.10026 [18] DING C, ALVAREZ C L, HE J. Growth of Dehalococcoides mccartyi species in an autotrophic consortium producing limited acetate[J]. Biodegradation, 2018, 29(5): 487-498. doi: 10.1007/s10532-018-9846-9 [19] MATTURRO B, FRASCADORE E, ROSSETTI S. High-throughput sequencing revealed novel Dehalococcoidia in dechlorinating microbial enrichments from PCB-contaminated marine sediments[J]. FEMS Microbiology Ecology, 2017, 93(11): 134. [20] 李烨. 不同厌氧环境中四氯乙烯生物降解研究[D]. 北京: 中国地质大学, 2006. [21] GULLOTTA F, DI M A, COLETTA M, et al. Co metabolism, sensing, and signaling[J]. Biofactors, 2012, 38(1): 1-13. doi: 10.1002/biof.v38.1 [22] 史敬华. 不同基质共代谢降解地下水中四氯乙烯的研究[D]. 北京: 中国地质大学, 2006. [23] HATZINGER P B, STREGER S H, BEGLEY J F. Enhancing aerobic biodegradation of 1,2-dibromoethane in groundwater using ethane or propane and inorganic nutrients[J]. Journal of Contaminant Hydrology, 2015, 172: 61-70. doi: 10.1016/j.jconhyd.2014.11.006 [24] 范平, 宋天顺, 覃彪, 等. 不同驯化方式对以苯酚为基质的微生物燃料电池产电性能的影响[J]. 环境工程学报, 2012, 6(11): 3867-3872. [25] 袁芳. 2,4-二硝基甲苯的微生物共代谢降解研究[D]. 南京: 南京理工大学, 2012. [26] 夏至. 纳米钯/铁/PVDF-g-(聚)丙烯酸催化还原剂制备及其脱氯性能研究[D]. 哈尔滨: 哈尔滨工业大学, 2013. [27] LI C, TANG L, PENG J, et al. Determination of trichloroethylene and tetrachloroethylene in Li river sediments by headspace gas chromatography[J]. The Administration and Technique of Environmental Monitoring, 2017, 29(5): 44-46. [28] SCHLOSS P D, WESTCOTT S L, RVABIN T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. doi: 10.1128/AEM.01541-09 [29] MAO Y P, XIA Y, ZHANG T. Characterization of Thauera-dominated hydrogen-oxidizing autotrophic denitrifying microbial communities by using high-throughput sequencing[J]. Bioresource Technology, 2013, 128: 703-710. doi: 10.1016/j.biortech.2012.10.106 [30] LOFFLER F E, SUN Q, LI J, et al. 16S rRNA gene-based detection of tetrachloroethene-dechlorinating Desulfuromonas and Dehalococcoides species[J]. Applied and Environmental Microbiology, 2000, 66(4): 1369-1374. doi: 10.1128/AEM.66.4.1369-1374.2000 [31] 晁红军, 宋修鹏, 孙继华, 等. 甲基营养菌的研究进展[J]. 微生物学通报, 2009, 36(11): 1727-1737. [32] CHAIGNAUD P, MAUCOURT B, WEIMAN M, et al. Genomic and transcriptomic analysis of growth-supporting dehalogenation of chlorinated methanes in Methylobacterium[J]. Frontiers in Microbiology, 2017, 8(9): 1600. [33] KITTICHOTIRAT W, GOOD N M, HALL R, et al. Genome sequence of Methyloversatilis universalis FAM5(T), a methylotrophic representative of the order Rhodocyclales[J]. Journal of Bacteriology, 2011, 193(17): 4541-4542. doi: 10.1128/JB.05331-11 [34] ZEMB O, LEE M, LOW A, et al. Reactive iron barriers: A niche enabling microbial dehalorespiration of 1,2-dichloroethane[J]. Applied Microbiology and Biotechnology, 2010, 88(1): 319-325. doi: 10.1007/s00253-010-2740-y [35] GROSTERN A, EDWARDS E A. A 1,1,1-trichloroethane-degrading anaerobic mixed microbial culture enhances biotransformation of mixtures of chlorinated ethenes and ethanes[J]. Applied and Environmental Microbiology, 2006, 72(12): 7849-7856. doi: 10.1128/AEM.01269-06 [36] ZHANG H, ZIV-EL M, RITTMANN B E, et al. Effect of dechlorination and sulfate reduction on the microbial community structure in denitrifying membrane-biofilm reactors[J]. Environmental Science & Technology, 2010, 44(13): 5159-5164. [37] TONG H, CHEN M, LI F, et al. Changes in the microbial community during repeated anaerobic microbial dechlorination of pentachlorophenol[J]. Biodegradation, 2017, 28(2/3): 219-230. [38] PRUDEN A, SUIDAN M T, VENOSA A D, et al. Biodegradation of methyl tert-butyl ether under various substrate conditions[J]. Environmental Science & Technology, 2001, 35(21): 4235-4241. [39] YANG G, CHEN M, ZHOU S, et al. Sinorhodobacter ferrireducens gen. nov., sp nov., a non-phototrophic iron-reducing bacterium closely related to phototrophic Rhodobacter species[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 2013, 104(5): 715-724. doi: 10.1007/s10482-013-9979-0 [40] NUNOURA T, HIRAI M, MIYAZAKI M, et al. Isolation and characterization of a thermophilic, obligately anaerobic and heterotrophic marine Chloroflexi bacterium from a Chloroflexi-dominated microbial community associated with a Japanese shallow hydrothermal system, and proposal for Thermomarinilinea lacunofontalis gen. nov., sp nov[J]. Microbes and Environments, 2013, 28(2): 228-235. doi: 10.1264/jsme2.ME12193 [41] ZHANG Y, HU M, LI P, et al. Trichloroethylene removal and bacterial variations in the up-flow anaerobic sludge blanket reactor in response to temperature shifts[J]. Applied Microbiology and Biotechnology, 2015, 99(14): 6091-6102. doi: 10.1007/s00253-015-6480-x [42] SHARMA P, SCHIEWER S. Assessment of crude oil biodegradation in arctic seashore sediments: Effects of temperature, salinity, and crude oil concentration[J]. Environmental Science and Pollution Research, 2016, 23(15): 14881-14888. doi: 10.1007/s11356-016-6601-9 [43] 隋淑梅, 尹志刚, 姜利国, 等. 考虑地下水温度的土壤吸附氨氮动力学行为研究[J]. 水资源与水工程学报, 2016, 27(3): 217-220. [44] 黄景锐. 西安市浅层地温场分布特征及其变化分析[D]. 西安: 长安大学, 2013. [45] 李志红. 银川平原浅层地温场和水化学特征及其影响因素研究[D]. 北京: 中国地质大学, 2014. [46] 周群英, 王士芬. 环境工程微生物学[M]. 北京: 高等教育出版社, 2008. [47] 陶亚奇, 蒋卓睿, 陈雪. 类Fenton试剂处理苯酚废水的影响因素及动力学研究[J]. 南京农业大学学报, 2012, 35(4): 126-129. [48] 宁静. 乙醇条件下简单节杆菌细胞性质的变化及其对物质跨细胞运输的影响[D]. 天津: 天津科技大学, 2013. [49] 朱敏. 乙醇胁迫对乳酸杆菌代谢活力及膜结构的影响[D]. 石河子: 石河子大学, 2015. [50] LEGARTH J H O F. Antibacterial composition or antibacterial ingredient useful for treating, alleviating and/or preventing growth of gram-positive bacteria including Clostridium bacteria or Streptococcus bacteria, comprises a seaweed material: WO2017186927-A1[P]. 2017-11-02. -




 下载:
下载: