|
[1]
|
BALAPURE K, BHATT N, MADAMWAR D.Mineralization of reactive azo dyes present in simulated textile wastewater using down flow microaerophilic fixed film bioreactor[J].Bioresource Technology,2015,175:1-7 10.1016/j.biortech.2014.10.040
|
|
[2]
|
RAWAT D, MISHRA V, SHARMA R S.Detoxification of azo dyes in the context of environmental processes[J].Chemosphere,2016,155:591-605 10.1016/j.chemosphere.2016.04.068
|
|
[3]
|
YU Z, WANG W, SONG L, et al.Acceleration comparison between Fe2+/H2O2 and Co2+/oxone for decolouration of azo dyes in homogeneous systems[J].Chemical Engineering Journal,2013,234:475-483 10.1016/j.cej.2013.08.013
|
|
[4]
|
DHAKA S, KUMAR R, KHAN M A, et al.Aqueous phase degradation of methyl paraben using UV-activated persulfate method[J].Chemical Engineering Journal,2017,321:11-19 10.1016/j.cej.2017.03.085
|
|
[5]
|
NASSERI S, MAHVI A H, SEYEDSALEHI M, et al.Degradation kinetics of tetracycline in aqueous solutions using peroxydisulfate activated by ultrasound irradiation: Effect of radical scavenger and water matrix[J].Journal of Molecular Liquids,2017,241:704-714 10.1016/j.molliq.2017.05.137
|
|
[6]
|
FRONTISTIS Z, ANTONOPOULOU M, KONSTANTINOU I, et al.Degradation of ethyl paraben by heat-activated persulfate oxidation:Statistical evaluation of operating factors and transformation pathways[J].Environmental Science & Pollution Research International,2017,24(2):1073-1084 10.1007/s11356-016-6974-9
|
|
[7]
|
ZHAO L, JI Y, KONG D, et al.Simultaneous removal of bisphenol A and phosphate in zero-valent iron activated persulfate oxidation process[J].Chemical Engineering Journal,2016,303:458-466 10.1016/j.cej.2016.06.016
|
|
[8]
|
NETA P, HUIE R E, ROSS A B.Rate constants for reactions of inorganic radicals in aqueous-solution[J].Journal of Physical & Chemical Reference Data,1988,17(3):1027-1284 10.1063/1.555808
|
|
[9]
|
LIN H, WU J, ZHANG H.Degradation of bisphenol A in aqueous solution by a novel electro/Fe3+/peroxydisulfate process[J].Separation & Purification Technology,2013,117(4):18-23 10.1016/j.seppur.2013.04.026
|
|
[10]
|
WEI X, GAO N, LI C, et al.Zero-valent iron (ZVI) activation of persulfate (PS) for oxidation of bentazon in water[J].Chemical Engineering Journal,2016,285:660-670 10.1016/j.cej.2015.08.120
|
|
[11]
|
金晓英, 李任超, 陈祖亮. 纳米零价铁活化过硫酸钠降解2,4-二氯苯酚[J]. 环境化学,2014,33(5):812-818 10.7524/j.issn.0254-6108.2014.05.007
|
|
[12]
|
杨世迎, 郑迪, 常书雅, 等. 基于零价铝的氧化/还原技术在水处理中的应用[J]. 化学进展,2016,28(5):754-762 10.7536/PC151047
|
|
[13]
|
JI Q, LI J, XIONG Z, et al.Enhanced reactivity of microscale Fe/Cu bimetallic particles (mFe/Cu) with persulfate (PS) for p-nitrophenol (PNP) removal in aqueous solution[J].Chemosphere,2016,172:10-20 10.1016/j.chemosphere.2016.12.128
|
|
[14]
|
于辉, 金春姬, 王鹏远, 等.Fe2+与Fe0活化过二硫酸盐降解活性艳蓝KN-R[J]. 环境科学研究,2015,28(1):88-95
|
|
[15]
|
DENG J, SHAO Y, GAO N, et al.Zero-valent iron/persulfate(Fe0/PS) oxidation acetaminophen in water[J].International Journal of Environmental Science and Technology,2014,11(4):881-890 10.1007/s13762-013-0284-2
|
|
[16]
|
LI H, WAN J, MA Y, et al.New insights into the role of zero-valent iron surface oxidation layers in persulfate oxidation of dibutyl phthalate solutions[J].Chemical Engineering Journal,2014,250:137-147 10.1016/j.cej.2014.03.092
|
|
[17]
|
RODRIGUEZ S, VASQUEZ L, COSTA D, et al.Oxidation of orange G by persulfate activated by Fe(II), Fe(III) and zero valent iron (ZVI)[J].Chemosphere,2014,101(3):86-92 10.1016/j.chemosphere.2013.12.037
|
|
[18]
|
ZHANG L, ZHANG L, LI D.Enhanced dark fermentative hydrogen production by zero-valent iron activated carbon micro-electrolysis[J].International Journal of Hydrogen Energy,2015,40(36):12201-12208 10.1016/j.ijhydene.2015.07.106
|
|
[19]
|
WANG L, QI Y, WANG D, et al.Advanced landfill leachate treatment using iron-carbon microelectrolysis-Fenton process: Process optimization and column experiments[J].Journal of Hazardous Materials,2016,318:460-467 10.1016/j.jhazmat.2016.07.033
|
|
[20]
|
任健, 马宏瑞, 马炜宁, 等.Fe/C微电解-Fenton氧化-混凝沉淀-生化法处理抗生素废水的试验研究[J]. 水处理技术,2011,37(3):84-87
|
|
[21]
|
廉菲, 刘畅, 李国光, 等. 高分子固体废物基活性炭对有机染料的吸附解吸行为研究[J]. 环境科学,2012,33(1):147-155
|
|
[22]
|
林朝萍, 宁寻安, 巫俊楫, 等. 废旧布袋活性炭深度处理印染废水尾水[J]. 环境工程学报,2016,10(12):6977-6982 10.12030/j.cjee.201507107
|
|
[23]
|
YANG Z, MA Y, LIU Y, et al.Degradation of organic pollutants in near-neutral pH solution by Fe-C micro-electrolysis system[J].Chemical Engineering Journal,2017,315:403-414 10.1016/j.cej.2017.01.042
|
|
[24]
|
ZHANG X B, DONG W Y, SUN F Y, et al.Degradation efficiency and mechanism of azo dye RR2 by a novel ozone aerated internal micro-electrolysis filter[J].Journal of Hazardous Materials,2014,276(9):77-87 10.1016/j.jhazmat.2014.05.010
|
|
[25]
|
杨德敏, 夏宏, 程方平, 等.Fe/C微电解耦合H2O2氧化处理页岩气钻井废水[J]. 环境工程学报,2016,10(11):6473-6478 10.12030/j.cjee.201506070
|
|
[26]
|
董洪梅, 孙云娜, 魏东洋, 等.Fe-C-H2O2 降解+溴联苯醚的试验研究[J]. 水处理技术,2013,39(8):52-56 10.3969/j.issn.1000-3770.2013.08.013
|
|
[27]
|
汪永红, 潘倩, 王丽燕, 等.Fe-C-H2O2协同催化氧化处理印染废水[J]. 生态环境学报,2010,26(6):1374-1377 10.3969/j.issn.1674-5906.2010.06.021
|
|
[28]
|
杨鑫, 杨世迎, 王雷雷, 等. 活性炭催化过二硫酸盐降解水中AO7[J]. 环境科学,2011,32(7):1960-1966
|
|
[29]
|
LEE Y C, LO S L, KUO J, et al.Promoted degradation of perfluorooctanic acid by persulfate when adding activated carbon[J].Journal of Hazardous Materials,2013,261:463-469 10.1016/j.jhazmat.2013.07.054
|
|
[30]
|
王宇轩, 王应军, 方明珠. 活性炭负载CuO催化过硫酸盐去除活性艳红X-3B染料[J]. 环境工程学报,2016,10(1):230-236
|
|
[31]
|
尹汉雄, 唐玉朝, 黄显怀, 等. 紫外光强化Fe(II)-EDTA活化过硫酸盐降解直接耐酸大红4BS[J]. 环境科学研究,2017,30(7):1105-1111
|
|
[32]
|
PENG L, LIU Z, WANG X, et al.Enhanced decolorization of methyl orange in aqueous solution using iron-carbon micro-electrolysis activation of sodium persulfate[J].Chemosphere,2017,180:100-107 10.1016/j.chemosphere.2017.04.019
|
|
[33]
|
高金龙, 马玉琳, 孟庆来, 等. 二价铁活化过硫酸盐降解土壤中十溴联苯醚[J]. 环境工程学报,2016,10(12):7339-7343 10.12030/j.cjee.201507210
|
|
[34]
|
孙大贵, 陶长元, 刘作华, 等. 活性炭-Fenton组合法去除水中PAEs的研究[J]. 环境科学,2007,28(12):2734-2739
|
|
[35]
|
AHMADI M, GHANBARI F, MORADI M.Photocatalysis assisted by peroxymonosulfate and persulfate for benzotriazole degradation: Effect of pH on sulfate and hydroxyl radicals[J].Water Science & Technology,2015,72(11):2095-2102 10.2166/wst.2015.437
|
|
[36]
|
DENG S, LI D, XUE Y, et al.Iron [Fe(0)]-rich substrate based on iron-carbon micro-electrolysis for phosphorus adsorption in aqueous solutions[J].Chemosphere,2017,168:1486-1493 10.1016/j.chemosphere.2016.11.043
|
|
[37]
|
王忠明, 黄天寅, 陈家斌, 等. 载银活性炭活化过硫酸钠降解酸性橙7[J]. 环境科学,2015,36(11):4127-4134 10.13227/j.hjkx.2015.11.024
|
|
[38]
|
杨世迎, 张翱, 任腾飞, 等. 炭基材料催化过氧化物降解水中有机污染物:表面作用机制[J]. 化学进展,2017,29(5):539-552 10.7536/PC170310
|
|
[39]
|
BOEHM H P.Chemical identification of surface groups[J].Advances in Catalysis,1966,16:179-274
|
|
[40]
|
LIU Y, ZHOU A, GAN Y, et al.Variability in carbon isotope fractionation of trichloroethene during degradation by persulfate activated with zero-valent iron: Effects of inorganic anions[J].Science of the Total Environment,2016,548-549:1-5 10.1016/j.scitotenv.2016.01.011
|
|
[41]
|
MA Z, YANG Y, JIANG Y, et al.Enhanced degradation of 2,4-dinitrotoluene in groundwater by persulfate activated using iron-carbon micro-electrolysis[J].Chemical Engineering Journal,2017,311:183-190 10.1016/j.cej.2016.11.083
|
|
[42]
|
ZOU H, JIANG L, LI M, et al.Effects of anions on micro-electrolysis of chlorobenzene in groundwater[J].Environmental Protection of Chemical Industry,2011,31(2):101-103 10.3969/j.issn.1006-1878.2011.02.002
|
|
[43]
|
YANG S Y, WANG P, YANG X, et al.Degradation efficiencies of azo dye acid orange 7 by the interaction of heat, UV and anions with common oxidants: Persulfate, peroxymonosulfate and hydrogen peroxide[J].Journal of Hazardous Materials,2010,179(1/2/3):552-558 10.1016/j.jhazmat.2010.03.039
|
|
[44]
|
TAN L, LIANG B, FANG Z, et al.Effect of humic acid and transition metal ions on the debromination of decabromodiphenyl by nano zero-valent iron: Kinetics and mechanisms[J].Journal of Nanoparticle Research,2014,16(12):1-13 10.1007/s11051-014-2786-3
|
|
[45]
|
WANG Y, CHEN S Y, YANG X, et al.Degradation of 2,2′,4,4′-tetrabromodiphenyl ether (BDE-47) by a nano zerovalent iron-activated persulfate process: The effect of metal ions[J].Chemical Engineering Journal,2017,317:613-622 10.1016/j.cej.2017.02.070
|
|
[46]
|
PU B, AMP Q S.Treatment of drilling wastewater by iron-carbon micro-electrolysis method[J].Environmental Protection of Oil & Gas Fields,2016,26(2):7-9
|





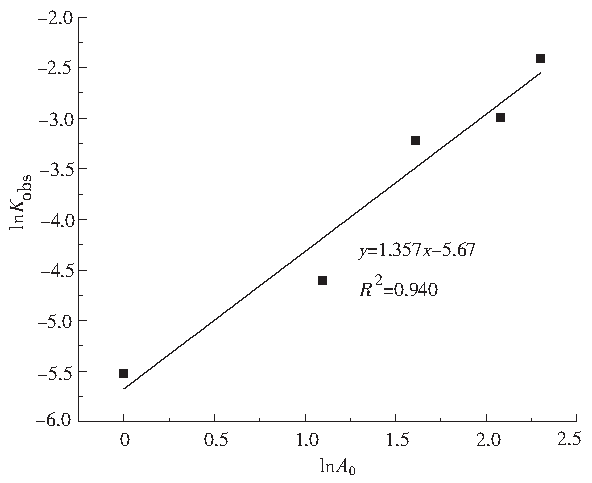



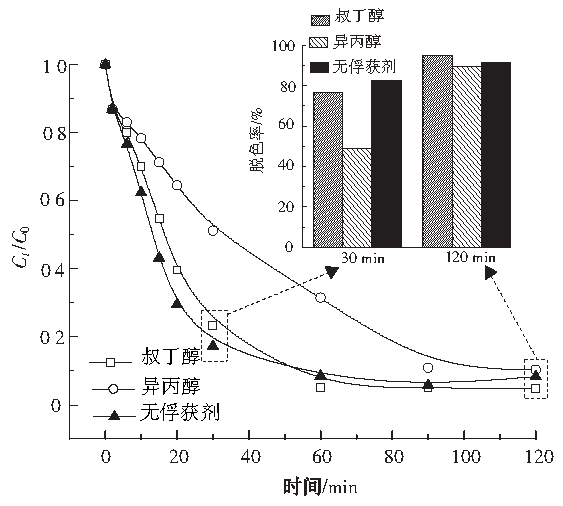






 百度学术
百度学术


 下载:
下载:
