畜禽废弃物厌氧消化过程的氨氮抑制及其应对措施研究进展
Research progress of ammonia inhibition and counter measures during anaerobic digestion of livestock wastes
-
摘要: 氨氮抑制是造成畜禽养殖废弃物厌氧消化处理效率低和运行稳定性差的主要因素之一。在总结国内外研究进展的基础上,简述了氨氮的来源及抑制阈值,剖析了氨氮抑制的机理及其影响因素,从氨氮的缓冲和微生物驯化2 个方面总结了氨氮抑制的应对措施。建议重点加强畜禽养殖废弃物厌氧消化过程中氨氮释放规律、“氨氮-VFAs-碳酸盐”三元缓冲体系的调控模式、氨氮抑制的微生物学机制等方面的研究,以期为提高畜禽养殖废弃物厌氧消化工程的处理效率和运行稳定性提供参考。Abstract: During the anaerobic digestion (AD) of livestock wastes,the accumulation of ammonia nitrogen has become a potential inhibitor for anaerobic digestion,resulting in the low efficiency and instability of the operation. Based on literature review,this study summarizes source and inhibition threshold value of ammonia nitrogen,analyzes the mechanism and factors of ammonia inhibition,and put forwards to counter measures for ammonia nitrogen inhibition according to the buffering to ammonia inhibition and the acclimation of microorganism. Hereon,the research about the characteristic of ammonia release,the control strategy based on ternary buffer system composed of ammonia-VFAs-carbonates and the microbiological mechanisms of ammonia inhibition during the AD treatment of livestock wastes should be intensified,aiming at providing technical support for improving the efficiency and stability of AD of livestock wastes in practice.
-
Key words:
- livestock wastes /
- anaerobic digestion /
- ammonia inhibition /
- methanogens /
- counter measures
-
近年来由于食品加工行业的发展,随之产生了大量有机物浓度较高且含盐量较高的废水. 由于高浓度盐分的存在,采用生化处理会造成微生物活性受到严重抑制,最终导致对废水中的有机物降解效率低下[1]. 好氧膜生物反应器(aerobic membrane bioreactor,MBR)技术相较于传统好氧工艺,能很好将污泥截留在系统中,从而提高处理效率. 此外,MBR能将污泥停留时间(sludge retention time, SRT)与水力停留时间(hydraulic retention time, HRT)分开控制,易于管理控制,因此近几年在高盐废水处理中受到普遍关注[2-3]. 然而在采用MBR工艺处理高盐废水过程中面临的主要问题是膜污染问题[4]. 膜污染是指混合液中的污泥絮体、胶体粒子或有机盐和无机盐类,与膜存在物理化学作用而在膜表面沉淀与积累,或由于膜孔的吸附而使膜孔堵塞,过滤性下降,从而导致膜通量与分离特性的不可逆的变化的现象[5]. 膜污染的表观现象是随着MBR的运行,系统拦截的污泥和过滤的水量增多,膜表面会堆积形成滤饼层以及凝胶层,从而造成跨膜压差(trans-membrane pressure,TMP)的增加,导致膜通量越来越低. 当TMP增加到一定值时,膜无法正常使用,需要进行物理和化学清洗,高频次的化学清洗会影响膜的寿命. 因此膜污染是膜生物反应器在运行过程种需要重点控制的对象,它不仅影响膜组件的产水率,还影响膜组件的使用寿命及设备的能耗[6].
目前关于MBR处理高盐废水的膜污染已有较多报道,李津[7]研究发现,MBR工艺处理高盐废水过程中微生物所分泌的大量溶解性微生物产物(soluble microbial products, SMP)和胞外聚合物(bound extracellular polymeric substances, BEPS)是造成膜污染的主要原因,用清水结合次氯酸钠溶液能有效清洗膜. 李彬等[8]针对MBR处理高盐废水时膜面污染物的特性进行了研究,发现随着MBR系统盐度的升高,污泥的性质发生了较大变化,污泥的悬浮性固体(SS)及挥发性悬浮固体(VSS)与SS的比值均发生了下降,SMP的含量略有上升,膜面的有机污染物主要成分为糖类、蛋白和腐殖酸等. 陈启伟[9]研究表明,较小的污泥粒径对膜通量是不利的,较小的粒径会加速浓差极化的形成,从而加速膜污染. 还有报道指出盐度的存在会增加膜表面的结垢倾向,加速膜污染的形成[10].
尽管关于高盐废水处理过程的膜污染问题及影响因素已有相关报道,然而膜污染问题及成因仍然是一个比较复杂的问题,且不同的水质和运行条件对膜污染和污泥性质产生的影响均不同. 因此,本研究针对连云港某营养食品加工企业生产的两种SO42-浓度分别为1.6%和2.6%的废水,采用两套中试规模好氧膜生物反应器(MBR)进行处理,通过对两系统的TMP和污泥性质以及膜阻分布情况进行监测,初步研究对比探讨不同硫酸盐浓度对活性污泥性质和膜污染的影响. 通过对MBR处理高盐废水中膜污染规律和污泥性质的研究,有利于MBR系统在处理高盐废水中的改造和膜清洗方案的选择,且对膜生物反应器的开发及工程化应用有一定的指导意义.
1. 实验部分(Experimental section)
1.1 实验装置
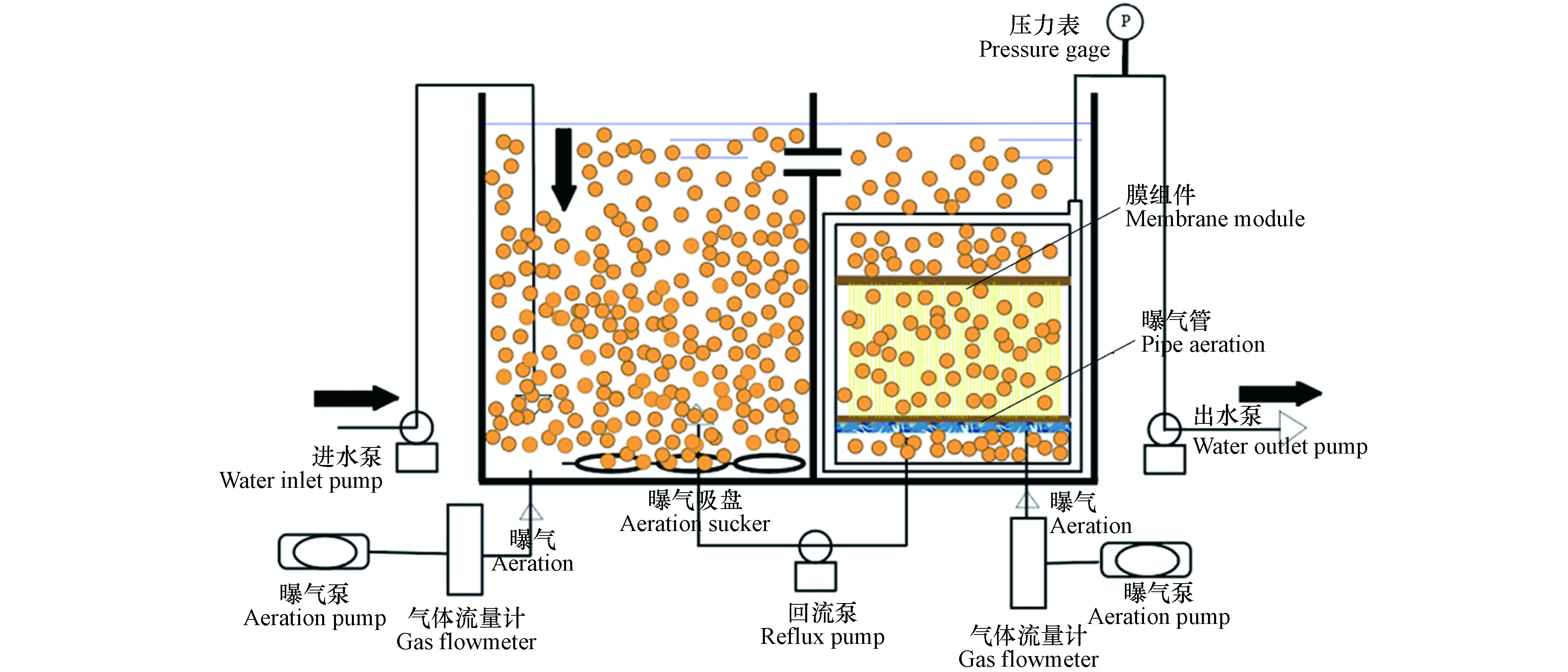
本研究采用MBR工艺,装置如图1所示.
装置主要由硝化池(O池)和MBR池组成,两池的有效容积都为44 L,整套反应器的总有效容积为88 L. 在O池和MBR出的底部装有纳米吸盘曝气装置,曝气装置分别用空气流量计控制,用以保持池内的溶解氧在2—4 mg·L−1,同时可以使池内的污泥混合液充分混合,防止污泥沉底堆积. MBR池的硝化液通过蠕动泵控制回流至O池,以控制两池污泥浓度相同,防止MBR池污泥经浓缩后浓度过高,影响两池的硝化性能. 污泥停留时间(sludge retention time,SRT)为44 d.
实验所用的膜组件为聚偏氟乙烯(PVDF,江苏诺莱智慧水务装备有限公司)的中空纤维膜,有效膜面积为0.43 m2,过滤方式采用负压抽吸. 膜组件底部设有射流曝气装置,在提供溶解氧的同时可以冲刷膜表面,缓解膜污染. 反应器的进出水均采用蠕动泵控制,出水的抽停比为9 min:1 min,跨膜压差(trans-membrane pressuredrop,TMP)采用压力表测定,当TMP超过30 kPa时,对膜组件进行清洗.
1.2 接种污泥与实验用水
本实验接种的污泥取自无锡市某餐厨废水处理厂的好氧生化污泥,所用废水为连云港某营养食品加工企业产生的废水,因生产工艺的不同,会产生不同
SO2−4 SO2−4 表 1 1.6%SO2−4 Table 1. The influent quality of 1.6%SO2−4 第1 天—第25天 第26天—第60天 第61天—第110天 pH 3.8—4.2 3.8—4.2 3.8—4.2 硫酸根/(mg·L−1) 16000—17800 17200—17900 17200—17900 COD/(mg·L−1) 5400—5600 5400—5600 7500—8100 TDS/(g·L−1) 27—30 27—30 27—30 电导率/(ms·cm−1) 25—30 28—30 28—30 TN/(mg·L−1) 20—25 180—200 320—350 TP/(mg·L−1) 5—10 8—10 8—10 氨氮/(mg·L−1) 15—20 15—20 15—20 Ca/(mg·L−1) 25—35 25—35 25—35 Mg/(mg·L−1) 5—15 5—15 5—15 Fe/(mg·L−1) 0.1—0.6 0.1—0.6 0.1—0.6 表 2 2.6%SO2−4 Table 2. The influent quality of 2.6%SO2−4 第1天—第40天 第41天—第50天 第51天—第110天 pH 3.7—3.9 3.5—4.1 3.6—4.2 硫酸根/(mg·L−1) 26800—28000 26800—28000 22600—23000 COD/(mg·L−1) 8000—8900 7000—7800 7500—8000 TDS/(g·L−1) 42—45 45—55 50—54 电导率/(ms·cm−1) 38—40 38—40 38—40 TN/(mg·L−1) 28—30 320—350 320—350 TP/(mg·L−1) 10—15 10—15 15—20 氨氮/(mg·L−1) 15—20 15—20 15—20 Ca/(mg·L−1) 35—45 35—45 35—45 Mg/(mg·L−1) 10—20 10—20 10—20 Fe/(mg·L−1) 0.2—0.8 0.2—0.8 0.2—0.8 两股废水中原水有机物较高,而TN较低,使得C/N过高,在运行了25 d后,
SO2−4 SO2−4 SO2−4 1.3 实验设计
同时运行两组实验MBR装置,一组进水
SO2−4 SO2−4 SO2−4 SO2−4 表 3 MBR反应器运行策略Table 3. Operating strategy of MBR reactorSO2−4
SO2−4 阶段
Stage天数/d
Days容积负荷/(kg·(m3·d)−1
COD)
VLRHRT /d SRT/d 1.6% 提盐驯化阶 1—20 0.5 10 不排泥 负荷提升阶段Ⅰ 21—40 0.6 8.5 44 负荷提升阶段Ⅱ 41—80 0.72 8.5—10.2 44 负荷提升阶段Ⅲ 81—110 1.0 7 44 2.6% 提盐驯化阶段 1—36 0.5 16 不排泥 负荷稳定阶段 37—110 0.5 16—22 44 注:进水 SO2−4 Note: The reactor with influent of 1.6% SO2−4 1.4 分析方法
MLSS、MLVSS采用国家环保总局规定的检测方法[11];溶解性微生物产物(SMP)和结合性胞外聚合物(BEPS)的提取参考陈康等[12]的方法;采用苯酚-硫酸法和Folin-酚法测定SMP和BEPs中的多糖和蛋白质含量,两者的总和即为SMP和BEPS的含量[13]. 采用激光粒径分析仪(BT-2003)测定污泥粒径及粒径分布. 膜阻力分布根据Darcy定律[14]:
Rt=Rm+Rc+Rf=ΔpμJ 式中,Rt时过滤时的总阻力(m−1),Rm是固有阻力(m−1),Rc是外部阻力(m−1),Rf是由不可逆吸附和膜孔堵塞引起的内部阻力(m−1),J是膜通量(L·(m2·h)−1),
Δp μ 2. 结果与讨论(Results and discussion)
2.1 运行效能比较
两套实验装置的主要运行数据如表4所示,进水
SO2−4 表 4 反应器运行数据Table 4. Reactor Operation DataSO2−4 SO2−4 阶段
Stage天数/d
Days容积负荷/
(kg·(m3·d)−1 COD)
VLR出水COD值/
(mg·L−1)
COD value of
effluentCOD去除率/%
COD removal
rate氨氮去除率/%
Ammonia
nitrogen
removal rateTN去除率/%
TN removal rateTP去除率/%
TP
removal
rate
1.6%提盐驯化阶 1—20 0.5 205—210 96.2 81.3 36.7 35.2 负荷提升阶段Ⅰ 21—40 0.6 135—145 97.4 57.6 88.4 57.5 负荷提升阶段Ⅱ 41—80 0.7 120—145 97.5 90.8 89.7 99.8 负荷提升阶段Ⅲ 81—110 1.0 180—190 97.2 92.5 89.5 100.0 2.6% 提盐驯化阶段 1—36 0.5 400—460 94.7 68.2 35.6 59.6 负荷稳定阶段 37—110 0.5 280—290 96.3 82.6 80.7 100.0 进入负荷提升/稳定阶段后,对两系统的进水C/N作了调整,通过添加尿素,补充有机氮源,控制C/N在25左右. 随后进水
SO2−4 SO2−4 SO2−4 SO2−4 SO2−4 综上,2.6%
SO2−4 SO2−4 2.2 膜运行性能比较
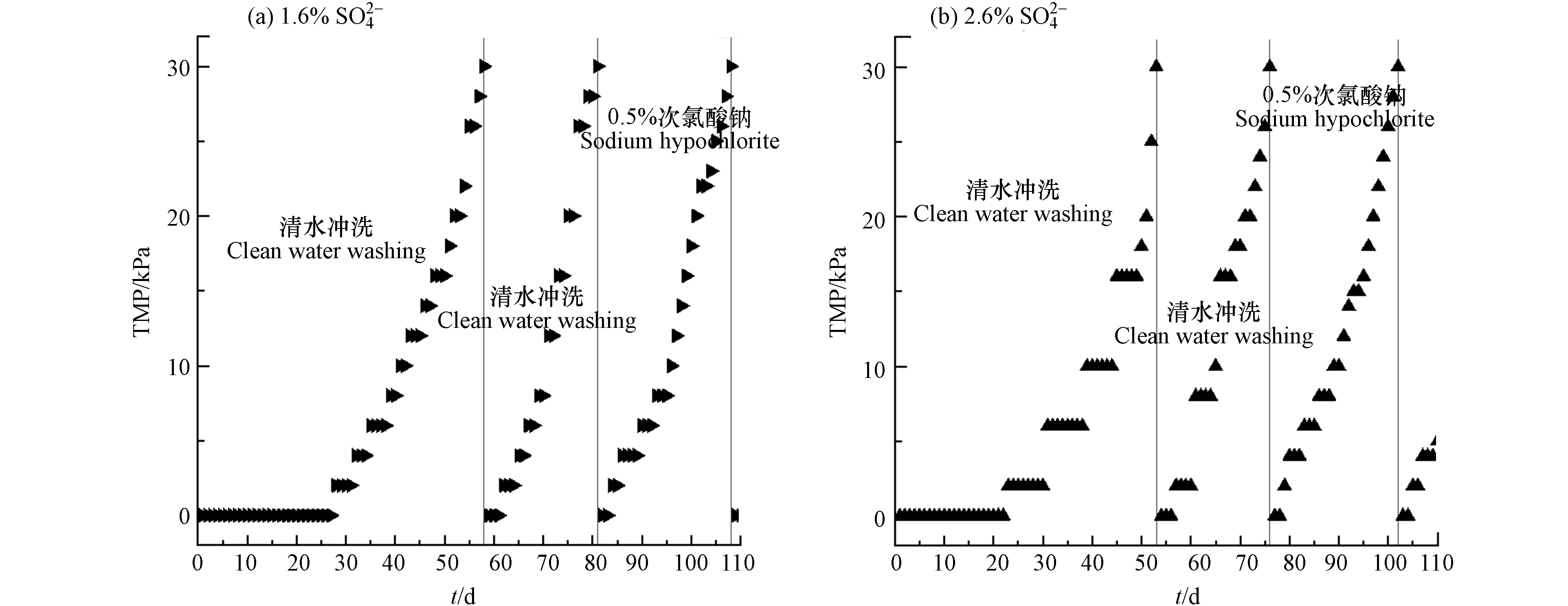
膜污染是衡量膜生物反应器稳定运行最重要的限制因素之一,频繁的膜清洗会减少膜的使用寿命,增加运行成本. 因此,进行膜污染的研究对于了解膜的运行性能至关重要. TMP可以用来表征膜污染的程度,随着反应器的运行,膜组件逐渐受到污染,TMP会随之增加. 图2为MBR在运行期间的TMP变化情况. 在110 d的运行时间里,进水
SO2−4 SO2−4 在整个运行过程中,进水
SO2−4 SO2−4 SO2−4 SO2−4 SO2−4 SO2−4 SO2−4 SO2−4 SO2−4 随后在第81天用0.5%NaClO对进水
SO2−4 SO2−4 2.3 污泥浓度比较
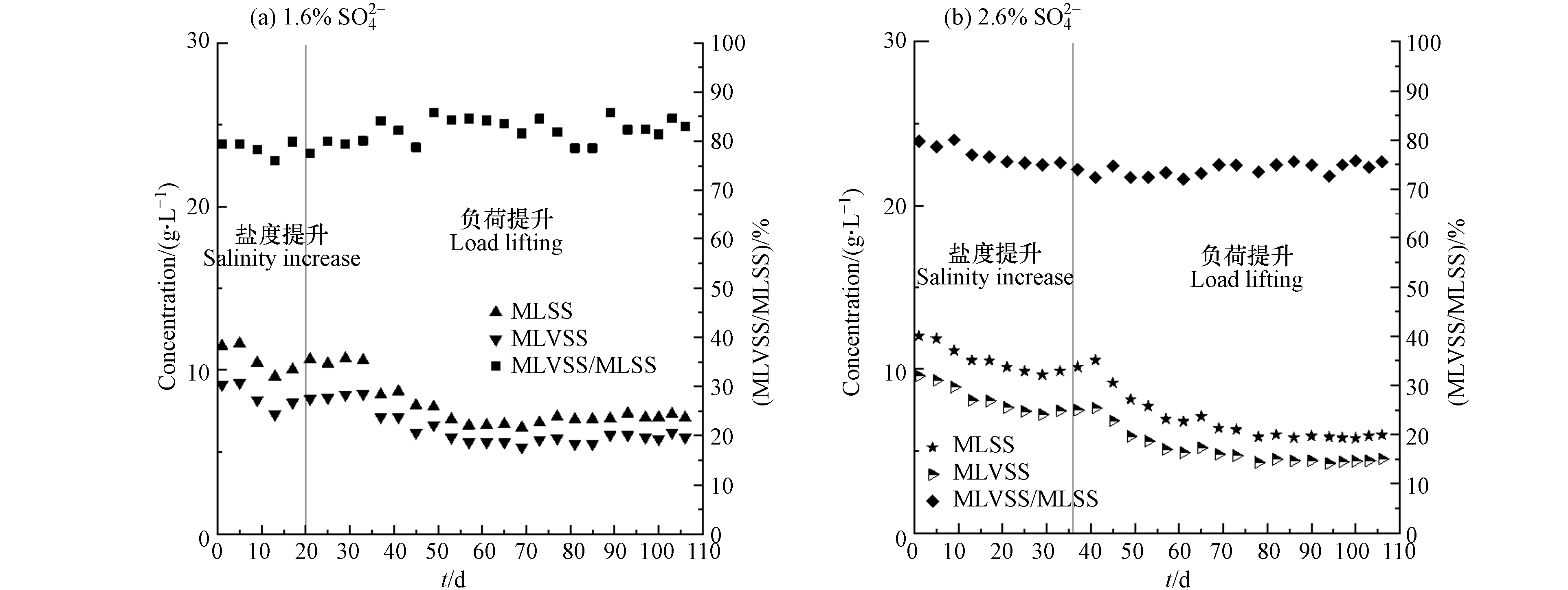
为了解盐度和负荷提升对活性污泥的影响情况,对两反应器MBR池中MLSS、MLVSS以及MLVSS/MLSS的变化情况进行了监测,结果如图3所示. 进水
SO2−4 SO2−4 可以看出两系统的MLSS、MLVSS和MLVSS/MLSS在提盐时期均呈现下降趋势,这是由于初始两系统内接种活性污泥盐度较低,随着体系内盐度的逐渐上升,部分活性污泥因为难以适应环境的改变而死亡[18-19],从而导致MLSS、MLVSS以及MLVSS/MLSS的整体下降.
随着活性污泥的逐渐驯化,耐盐微生物开始逐渐增殖,进水
SO2−4 SO2−4 SO2−4 SO2−4 目前关于污泥浓度和膜污染关系的研究中,不同学者之间有很大的差别. 研究结果的差异可能来源于不同的反应装置以及不同的污泥性质等,但普遍认为MLSS的变化对膜污染的影响与其范围有很大关系. Le等[22]研究表明,污泥浓度的增加会导致污泥粘度呈现指数形式的增加,从而加剧膜污染;而陆继来[23]在研究污泥浓度对膜污染的影响时,考察了4—10 g·L−1范围内污泥浓度变化对MBR装置TMP变化的影响,发现污泥浓度的升高,有助于保持膜通量,在高污泥浓度下,TMP的升高趋势更加平缓. 陈莉佳等[24]通过中试规模的反应装置,考察了MLSS在4—9 g·L−1和10—14 g·L−1范围内对膜TMP的影响,发现在较低污泥浓度下TMP上升速率很快,膜污染也更加严重,当污泥浓度升高时,TMP上升速率减小. 在本研究中,两套装置在前期接种的污泥浓度均较高,经过盐度驯化以及排泥后,污泥浓度有所降低,TMP增加逐渐加快,而2.6%
SO2−4 SO2−4 SO2−4 SO2−4 2.4 SMP和BEPS比较
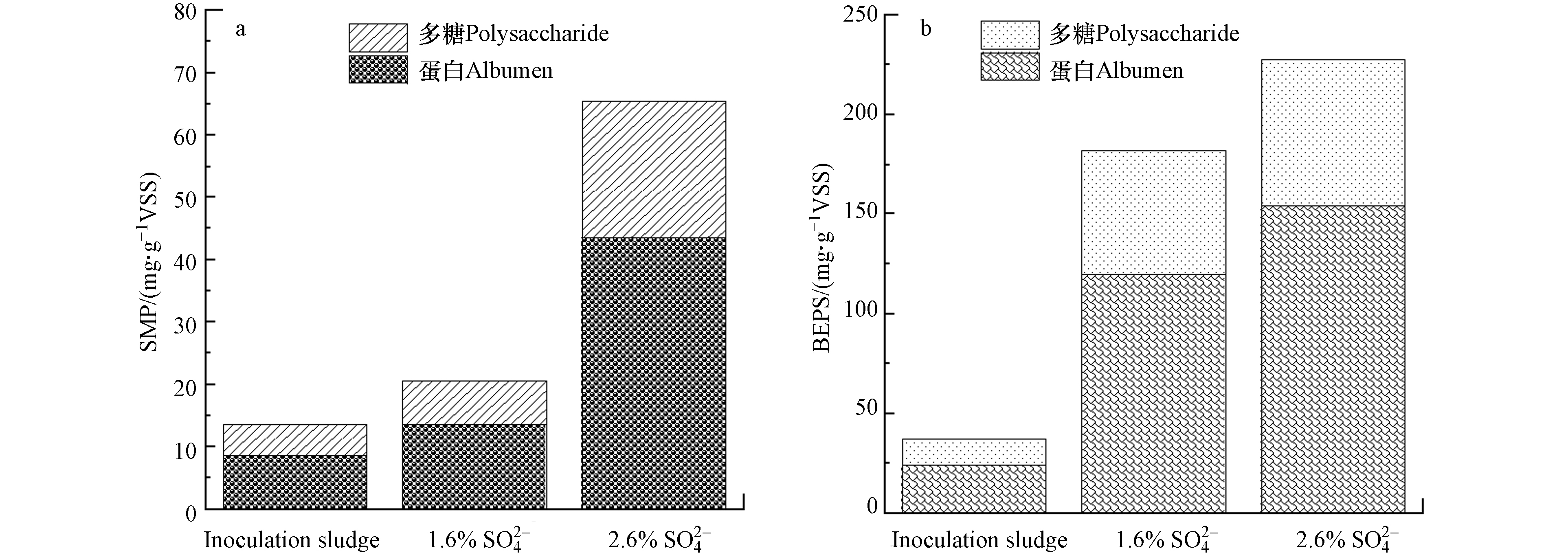
SMP是溶解性的微生物产物,在MBR运行过程中,其会被吸附到膜上或进入到膜孔中造成污染. BEPS是一种结合的细胞外聚合物,它聚集于微生物细胞表面,对微生物具有保护作用,BEPS的存在会使污泥的性质发生改变,从而影响过滤性能. SMP和BEPS主要由蛋白质和多糖构成,在MBR运行结束后,提取两反应器MBR池中成熟污泥的SMP和BEPS,并与接种时污泥的组分进行比较,结果如图4所示. 两反应器接种污泥时其SMP和BEPS浓度分别为13.5 mg·g−1VSS和36.9 mg·g−1VSS (图4a),经过长期的高盐环境驯化后,进水
SO2−4 SO2−4 SO2−4 很多研究表明膜污染主要来源于MBR系统中的SMP,其值越高膜污染程度越严重[26, 29-30]. Gao等[31]的报道中指出SMP是MBR中膜面污染物凝胶层的主要成分来源,同时SMP含量的升高会增加混合液的黏度,造成MBR通量下降,膜阻力上升[32]. 而BEPS也是引发膜污染的主要因素,大多数研究都已表明BEPS浓度与膜污染成正相关关系[33-34]. 例如Patsios等[35]发现,生物絮凝体的BEPS含量在MBR长期运行时会影响TMP跳跃期间的不可逆污染的增加率,对膜的过滤性能造成负面的影响. 从2.2节可知,尽管2.6%
SO2−4 SO2−4 2.5 污泥体积平均粒径比较
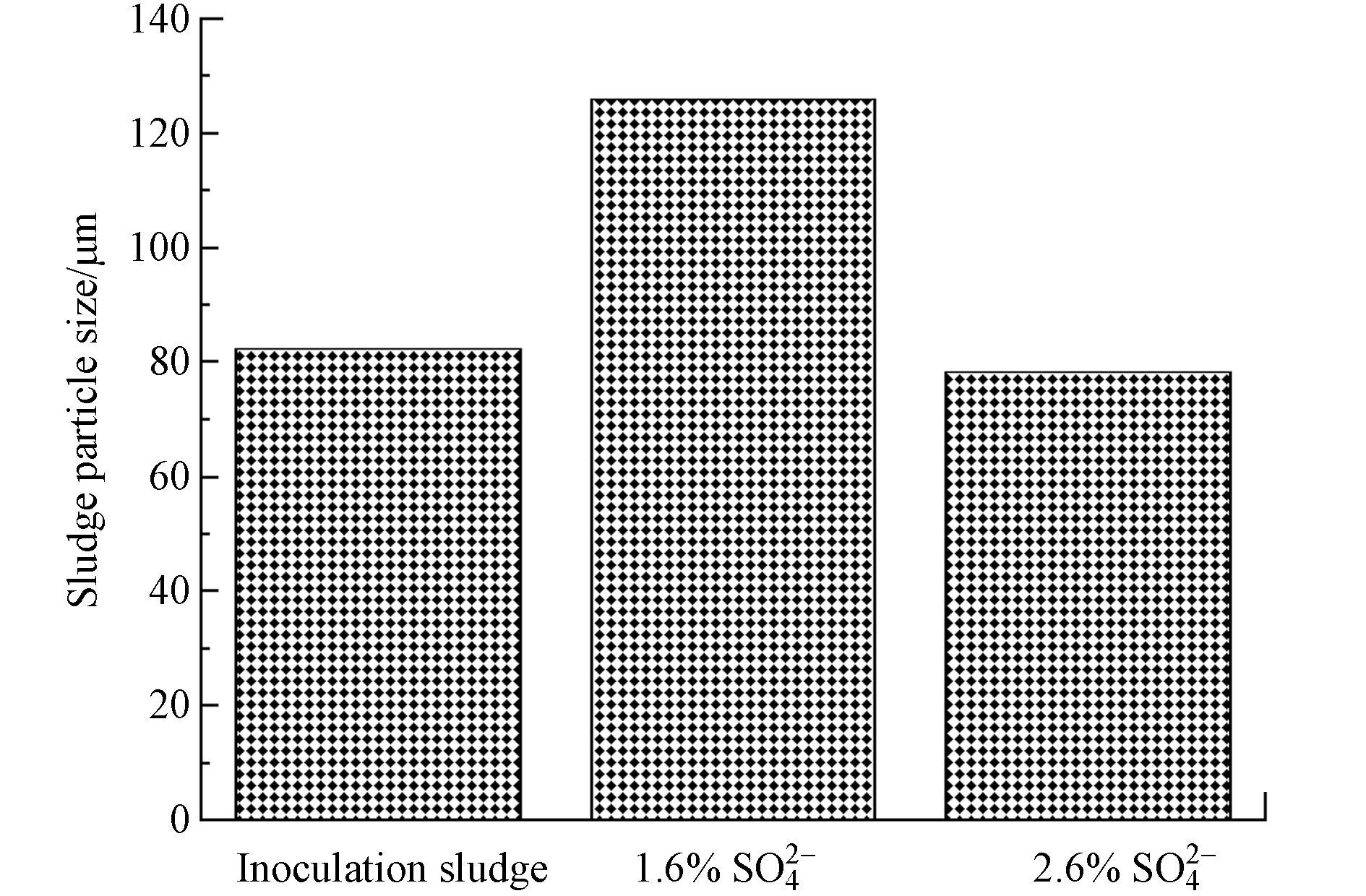
反应器中污泥体积平均粒径的变化如图5所示,两反应器初始接种污泥MBR池的体积平均径为82.3 µm,经过110 d的运行后,进水
SO2−4 SO2−4 SO2−4 SO2−4 SO2−4 很多研究表明,膜污染速度和污泥粒径有很大关系,污泥粒径越小,污泥越容易沉积在膜表面,膜污染速率越快[14, 37]. Shen等 [38]研究发现,导致膜污染的泥饼层中粒径较小的污泥絮体的比例更高,也就是说小絮体更容易附着在膜表面,导致膜污染. Lim等[39]研究发现,污泥粒径越小,越容易吸附或沉积在膜表面,甚至堵塞膜内部孔道,形成孔隙率低、密实的膜污染层,造成严重的膜污染. 在本研究中,2.6%
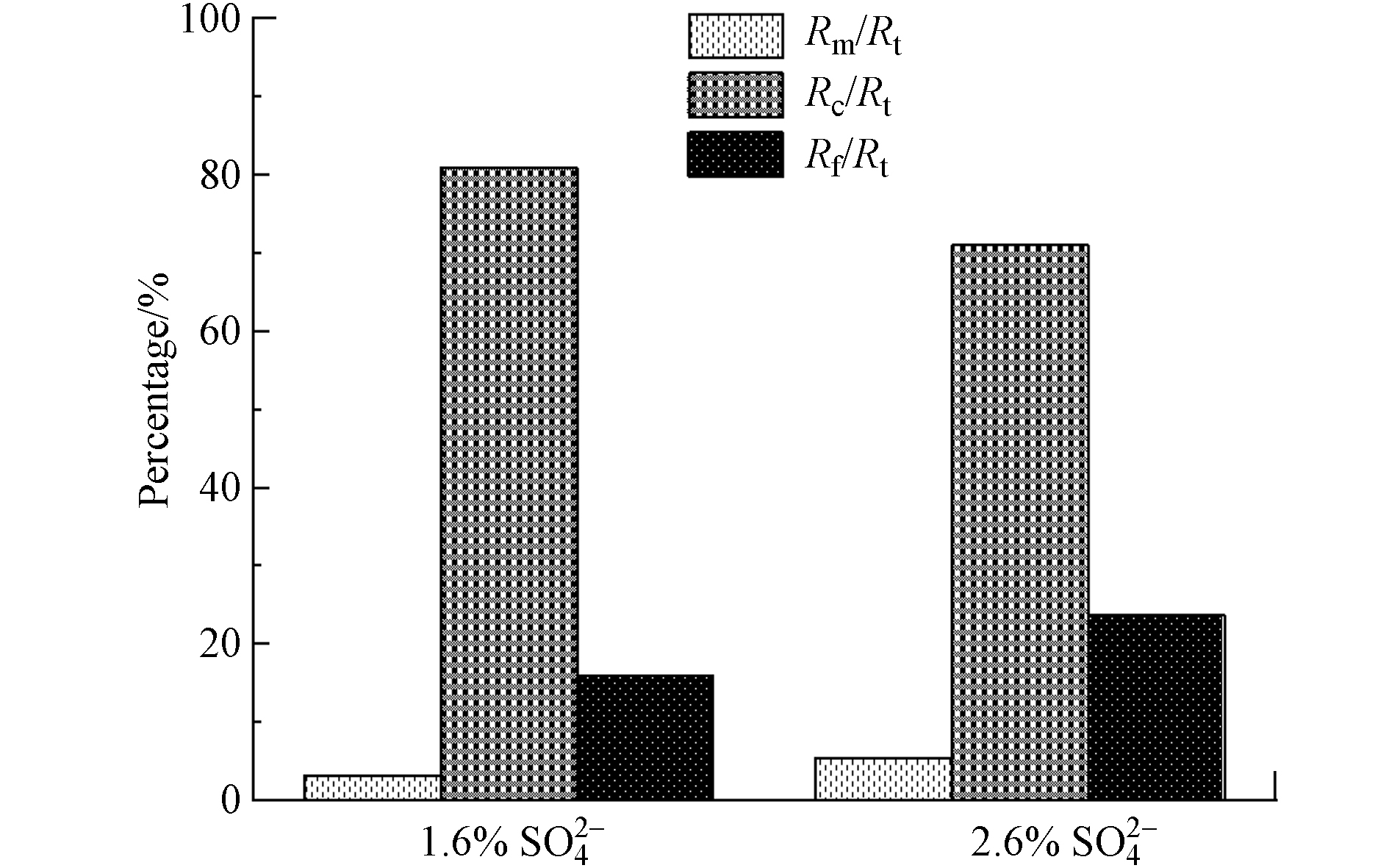
SO2−4 SO2−4 2.6 膜阻分布比较
膜阻力主要由三部分组成:膜固有阻力(Rm)、外部阻力(Rc)和不可逆吸附及膜孔堵塞引起的内部阻力(Rf)[12]. 膜固有阻力是指膜未使用之前的自身阻力. 外部阻力主要由泥饼层和凝胶层组成,通过物理清洗可以去除,而内部阻力需要通过化学方法才能去除. 为了探究在不同
SO2−4 第3次清洗时,进水
SO2−4 SO2−4 SO2−4 SO2−4 综上,进水
SO2−4 3. 结论(Conclusion)
1)经过长期的运行,进水
SO2−4 2)在MBR的运行过程中,进水
SO2−4 3)长期运行下,相比于进水 1.6% 系统,2.6%
SO2−4 SO2−4 4) 1.6%和2.6%
SO2−4 SO2−4 SO2−4 5)从膜阻力分布来看,两套装置的膜阻力都主要来源于外部阻力,且2.6%
SO2−4 SO2−4 -
[1] YUAN H, ZHU N.Progress in inhibition mechanisms and process control of intermediates and by-products in sewage sludge anaerobic digestion[J].Renewable & Sustainable Energy Reviews,2016,58:429-438 [2] 孙志岩, 张君枝, 刘翌晨, 等. 牛粪和玉米秸秆厌氧消化产甲烷潜力及动力学[J]. 环境工程学报,2016, 10(3):1468-1474 [3] YENIGüN O, DEMIREL B.Ammonia inhibition in anaerobic digestion: A review[J].Process Biochemistry,2013,48(5/6):901-911 10.1016/j.procbio.2013.04.012 [4] FUJISHIMA S, MIYAHARA T, NOIKE T.Effect of moisture content on anaerobic digestion of dewatered sludge: Ammonia inhibition to carbohydrate removal and methane production[J].Water Science & Technology,2000,41(3):119-127 [5] 郭建斌, 董仁杰, 程辉彩, 等. 温度与有机负荷对猪粪厌氧发酵过程的影响[J]. 农业工程学报,2011,27(12):217-222 10.3969/j.issn.1002-6819.2011.12.041 [6] 梅凯, 董红敏, 陶秀萍, 等. 水泡粪物料中固体和氨氮含量对厌氧消化产气特性的影响[J]. 中国农业气象, 2014, 35(6):622-627 10.3969/j.issn.1000-6362.2014.06.003 [7] ZHENG H, LI D, STANISLAUS M S, et al.Development of a bio-zeolite fixed-bed bioreactor for mitigating ammonia inhibition of anaerobic digestion with extremely high ammonium concentration livestock waste[J].Chemical Engineering Journal,2015, 280:106-114 10.1016/j.cej.2015.06.024 [8] HUANG W, ZHAO Z, YUAN T, et al.Effective ammonia recovery from swine excreta through dry anaerobic digestion followed by ammonia stripping at high total solids content[J].Biomass & Bioenergy,2016,90:139-147 [9] DENG L, CHEN C, ZHENG D, et al.Effect of temperature on continuous dry fermentation of swine manure[J].Journal of Environmental Management,2016,177:247-252 10.1016/j.jenvman.2016.04.029 [10] 丁福贵, 李欣, 张炳宏, 等. 进料浓度对猪粪批式和连续厌氧发酵产沼气的影响[J]. 中国沼气,2014,32(5):36-39 10.3969/j.issn.1000-1166.2014.05.008 [11] ZHAI N, ZHANG T, YIN D, et al.Effect of initial pH on anaerobic co-digestion of kitchen waste and cow manure[J].Waste Management,2015,38(1):126-131 10.1016/j.wasman.2014.12.027 [12] WANG X, YANG G, FENG Y, et al.Optimizing feeding composition and carbon-nitrogen ratios for improved methane yield during anaerobic co-digestion of dairy, chicken manure and wheat straw[J].Bioresource Technology,2012,120(8):78-83 10.1016/j.biortech.2012.06.058 [13] KAFLE G K, CHEN L.Comparison on batch anaerobic digestion of five different livestock manures and prediction of biochemical methane potential (BMP) using different statistical models[J].Waste Management,2016,48(1):492-502 10.1016/j.wasman.2015.10.021 [14] 王桂珍, 李兆君, 张树清, 等. 碳氮比对鸡粪堆肥中土霉素降解和堆肥参数的影响[J]. 中国农业科学,2013, 46(7):1399-1407 10.3864/j.issn.0578-1752.2013.07.010 [15] RICHARDS B K, CUMMINGS R J, WHITE T E, et al.Methods for kinetic analysis of methane fermentation in high solids biomass digesters[J].Biomass & Bioenergy,1991,1(2):65-73 [16] KAYHANIAN M.Ammonia inhibition in high-solids biogasification: An overview and practical solutions[J].Environmental Technology,1999,20(4):355-365 10.1080/09593332008616828 [17] SUNG S, LIU T.Ammonia inhibition on thermophilic anaerobic digestion[J].Chemosphere,2003,53(1):43-52 10.1016/S0045-6535(03)00434-X [18] PROCHAZKA J, DOLEJS P, MACA J, et al.Stability and inhibition of anaerobic processes caused by insufficiency or excess of ammonia nitrogen[J].Applied Microbiology & Biotechnology,2012,93(1):439-447 [19] HASHIMOTO A G.Ammonia inhibition of methanogenesis from cattle wastes[J].Agricultural Wastes,1986,17(4):241-261 10.1016/0141-4607(86)90133-2 [20] WEBB A R, HAWKES F R.The anaerobic digestion of poultry manure: Variation of gas yield with influent concentration and ammonium-nitrogen levels[J].Agricultural Wastes,1985,14(2):135-156 10.1016/S0141-4607(85)80025-1 [21] 陈闯,邓良伟,信欣,等. 上推流厌氧反应器连续干发酵猪粪产沼气试验研究[J]. 环境科学, 2012, 33(3):1033-1040 [22] HANSEN K H, ANGELIDAKI I, AHRING B K.Anaerobic digestion of swine manure: Inhibition by ammonia [J].Water Research,1998,32(1):5-12 10.1016/S0043-1354(97)00201-7 [23] MAHDY A, FOTIDIS I A, MANCINI E, et al.Ammonia tolerant inocula provide a good base for anaerobic digestion of microalgae in third generation biogas process[J].Bioresource Technology,2017,225:272-278 10.1016/j.biortech.2016.11.086 [24] HEJNFELT A, ANGELIDAKI I.Anaerobic digestion of slaughterhouse by-products[J].Biomass & Bioenergy,2009,33(8): 1046-1054 [25] CHEN Y, CHENG J J, CREAMER K S.Inhibition of anaerobic digestion process: A review[J].Bioresource Technology, 2008,99(10):4044-4064 10.1016/j.biortech.2007.01.057 [26] LISSENS G, VANDEVIVERE P, DE B L, et al.Solid waste digestors: Process performance and practice for municipal solid waste digestion[J].Water Science & Technology,2001,44(8):91-102 [27] ANGELIDAKI I, AHRING B K.Thermophilic anaerobic digestion of livestock waste:The effect of ammonia[J].Applied Microbiology & Biotechnology,1993,38(4):560-564 [28] WANG H, FOTIDIS I A, ANGELIDAKI I.Ammonia-LCFA synergetic co-inhibition effect in manure-based continuous biomethanation process[J].Bioresource Technology,2016,209:282-289 10.1016/j.biortech.2016.03.003 [29] NIELSEN H B, AHRING B K.Effect of tryptone and ammonia on the biogas process in continuously stirred tank reactors treating cattle manure[J].Environmental Technology,2007,28(8):905-914 10.1080/095933328086188485 [30] ANGELIDAKI I, AHRING B K.Anaerobic thermophilic digestion of manure at different ammonia loads: Effect of temperature[J].Water Research,1994,28(3):727-731 10.1016/0043-1354(94)90153-8 [31] 高文萱, 张克强, 梁军锋, 等. 氨胁迫对猪粪厌氧消化性能的影响[J]. 农业环境科学学报,2015,34(10):1997-2003 10.11654/jaes.2015.10.023 [32] NAKAKUBO R, M?LLER H B, NIELSEN A M, et al.Ammonia inhibition of methanogenesis and identification of process indicators during anaerobic digestion[J].Environmental Engineering Science,2008,25(10):1487-1496 10.1089/ees.2007.0282 [33] GARCIA M L, ANGENENT L T.Interaction between temperature and ammonia in mesophilic digesters for animal waste treatment[J].Water Research,2009,43(9):2373-2382 10.1016/j.watres.2009.02.036 [34] CHEN S, CAO W, BANKS C J, et al.Biogas production from undiluted chicken manure and maize silage: A study of ammonia inhibition in high solids anaerobic digestion[J].Bioresource Technology,2016,218:1215-1223 [35] HONG N, H FABIAN J, KATRIN S, et al.Mono-fermentation of chicken manure: Ammonia inhibition and recirculation of the digestate[J].Bioresource Technology,2015,178:238-246. [36] NIU Q, TAKEMURA Y, KUBOTA K, et al.Comparing mesophilic and thermophilic anaerobic digestion of chicken manure: Microbial community dynamics and process resilience[J].Waste Management,2015,43:114-122 10.1016/j.wasman.2015.05.012 [37] BUJOCZEK G, OLESZKIEWICZ J, SPARLING R, et al.High solid anaerobic digestion of chicken manure[J].Journal of Agricultural Engineering Research,2000,76(1):51-60 10.1006/jaer.2000.0529 [38] DALKILIC K, UGURLU A.Biogas production from chicken manure at different organic loading rates in a mesophilic-thermopilic two stage anaerobic system[J].Journal of Bioscience & Bioengineering,2015,120(3):315-322 [39] YAP S D, ASTALS S, JENSEN P D, et al.Indigenous microbial capability in solid manure residues to start-up solid-phase anaerobic digesters[J].Waste Management,2017,64:79-87 [40] SPROTT G D, PATEL G B.Ammonia toxicity in pure cultures of methanogenic bacteria[J].Systematic & Applied Microbiology, 1986,7(2):358-363 [41] GALLERT C, BAUER S, WINTER J.Effect of ammonia on the anaerobic degradation of protein by a mesophilic and thermophilic biowaste population[J].Applied Microbiology & Biotechnology,1998,50(4):495-501 [42] ELHADJ T B, ASTALS S, GALí A, et al.Ammonia influence in anaerobic digestion of OFMSW[J].Water Science & Technology, 2009,59(6):1153-1158 [43] LAY J J, LI Y Y, NOIKE T.The influence of pH and ammonia concentration on the methane production in high-solids digestion processes[J].Water Environment Research,1998,70(5):1075-1082 10.2175/106143098X123426 [44] LAY J J, LI Y Y, NOIKE T, et al.Analysis of environmental factors affecting methane production from high-solids organic waste[J].Water Science & Technology,1997,36(6/7):493-500 [45] WIEGANT W M, ZEEMAN G.The mechanism of ammonia inhibition in the thermophilic digestion of livestock wastes[J].Agricultural Wastes,1986,16(4):243-253 10.1016/0141-4607(86)90056-9 [46] KAYHANIAN M.Performance of a high-solids anaerobic digestion process under various ammonia concentrations[J].Journal of Chemical Technology & Biotechnology,2010,59(4):349-352 [47] KARAKASHEV D, BATSTONE D J, ANGELIDAKI I.Influence of environmental conditions on methanogenic compositions in anaerobic biogas reactors[J].Applied Environmental Microbiology,2005,71(1):331-338 10.1128/AEM.71.1.331-338.2005 [48] ZEEMAN G, WIEGANT W M, KOSTER-TREFFERS M E, et al.The influence of the total-ammonia concentration on the thermophilic digestion of cow manure[J].Agricultural Wastes,1985,14(1):19-35. 10.1016/S0141-4607(85)80014-7 [49] ANGENENT L T, SUNG S, RASKIN L.Methanogenic population dynamics during startup of a full-scale anaerobic sequencing batch reactor treating swine waste[J].Water Research,2002,36(18):4648-4654 10.1016/S0043-1354(02)00199-9 [50] NIU Q, KUBOTA K, QIAO W, et al.Effect of ammonia inhibition on microbial community dynamic and process functional resilience in mesophilic methane fermentation of chicken manure[J].Journal of Chemical Technology & Biotechnology,2015,90(12):2161-2169 [51] NIU Q, QIAO W, QIANG H, et al.Microbial community shifts and biogas conversion computation during steady, inhibited and recovered stages of thermophilic methane fermentation on chicken manure with a wide variation of ammonia[J].Bioresource Technology,2013,146(10):223-233 10.1016/j.biortech.2013.07.038 [52] ALSOULEMAN K, LINKE B, KLANG J, et al.Reorganisation of a mesophilic biogas microbiome as response to a stepwise increase of ammonium nitrogen induced by poultry manure supply[J].Bioresource Technology,2016,208:200-204 10.1016/j.biortech.2016.02.104 [53] FOTIDIS I A, KARAKASHEV D, KOTSOPOULOS T A, et al.Effect of ammonium and acetate on methanogenic pathway and methanogenic community composition[J].FEMS Microbiology Ecology,2013,83(1):38-48 10.1111/j.1574-6941.2012.01456.x [54] CALLI B, MERTOGLU B, INANC B, et al.Methanogenic diversity in anaerobic bioreactors under extremely high ammonia levels[J].Enzyme & Microbial Technology,2005,37(4):448-455 10.1016/j.enzmictec.2005.03.013 [55] POIRIER S, DESMOND-LE Q E, MADIGOU C, et al.Anaerobic digestion of biowaste under extreme ammonia concentration: Identification of key microbial phylotypes[J].Bioresource Technology,2016,207:92-101 10.1016/j.biortech.2016.01.124 [56] MOESTEDT J, M¨ULLER B, WESTERHOLM M, et al.Ammonia threshold for inhibition of anaerobic digestion of thin stillage and the importance of organic loading rate[J].Microbial Biotechnology,2015,9(2):180-194 10.1111/1751-7915.12330 [57] WANG H, FOTIDIS I A, ANGELIDAKI I.Ammonia effect on hydrogenotrophic methanogens and syntrophic acetate oxidizing bacteria[J].FEMS Microbiology Ecology,2015,91(11):1-8 10.1093/femsec/fiv130 [58] LIU L, ZHANG T, WAN H, et al.Anaerobic co-digestion of animal manure and wheat straw for optimized biogas production by the addition of magnetite and zeolite[J].Energy Conversion & Management,2015,97:132-139 [59] LINDORFER H, WALTENBERGER R, K?LLNER K, et al.New data on temperature optimum and temperature changes in energy crop digesters[J].Bioresource Technology,2008,99(15):7011-7019 10.1016/j.biortech.2008.01.034 [60] SHANMUGAM P, HORAN N J.Optimising the biogas production from leather fleshing waste by co-digestion with MSW[J].Bioresource Technology,2009,100(18):4117-4120 10.1016/j.biortech.2009.03.052 [61] WANG Y Y, ZHANG Y L, WANG J B, et al.Effects of volatile fatty acid concentrations on methane yield and methanogenic bacteria[J].Biomass & Bioenergy,2009,33(5):848-853 [62] GAO S, ZHAO M, CHEN Y, et al.Tolerance response to in situ ammonia stress in a pilot-scale anaerobic digestion reactor for alleviating ammonia inhibition[J].Bioresource Technology,2015,198:372-379 10.1016/j.biortech.2015.09.044 [63] 金仁村, 黄冠男, 马春, 等. 厌氧消化工艺的氨抑制现象[J]. 工业水处理,2010,30(4):9-12 10.3969/j.issn.1005-829X.2010.04.003 [64] KELLEHER B P, LEAHY J J, HENIHAN A M, et al.Advances in poultry litter disposal technology: A review[J].Bioresource Technology,2002,83(1):27-36 10.1016/S0960-8524(01)00133-X [65] CALLAGHAN F J, WASE D A J, THAYANITHY K, et al.Co-digestion of waste organic solids: Batch studies[J].Bioresource Technology,1999,67(2):117-122 10.1016/S0960-8524(98)00108-4 [66] ZESHAN, KARTHIKEYAN O P, VISVANATHAN C.Effect of C/N ratio and ammonia-N accumulation in a pilot-scale thermophilic dry anaerobic digester[J].Bioresource Technology,2012,113(2):294-302 10.1016/j.biortech.2012.02.028 [67] EBNER J H, LABATUT R A, LODGE J S, et al.Anaerobic co-digestion of commercial food waste and dairy manure: Characterizing biochemical parameters and synergistic effects[J].Waste Management,2016,52:286-294 10.1016/j.wasman.2016.03.046 [68] YANGINGOMEC C, OZTURK I.Effect of maize silage addition on biomethane recovery from mesophilic co-digestion of chicken and cattle manure to suppress ammonia inhibition[J].Energy Conversion & Management,2013,71(1):92-100 [69] 张彬, 蒋滔, 高立洪, 等. 猪粪与玉米秸秆混合中温发酵产气效果[J]. 环境工程学报,2014,8(11):4991-4997 [70] 冯亚君, 袁海荣, 张良, 等. 玉米秸与鸡粪混合厌氧消化产气性能与协同作用[J]. 环境工程学报,2013,7(4):1489-1494 [71] DAHUNSI S O, ORANUSI S, OWOLABI J B, et al.Mesophilic anaerobic co-digestion of poultry dropping and Carica papaya peels: Modelling and process parameter optimization study[J].Bioresource Technology,2016,216:587-600 10.1016/j.biortech.2016.05.118 [72] HASSAN M, DING W, SHI Z, et al.Methane enhancement through co-digestion of chicken manure and thermo-oxidative cleaved wheat straw with waste activated sludge: A C/N optimization case[J].Bioresource Technology,2016,211:534-541 10.1016/j.biortech.2016.03.148 [73] 杨安逸, 晏磊, 王彦杰, 等. 马铃薯渣与鸡粪混合原料厌氧发酵条件优化[J]. 可再生能源,2015,33(3):442-447 [74] WU S, NI P, LI J, et al.Integrated approach to sustain biogas production in anaerobic digestion of chicken manure under recycled utilization of liquid digestate: Dynamics of ammonium accumulation and mitigation control[J].Bioresource Technology,2016,205(1):75-81 10.1016/j.biortech.2016.01.021 [75] ABOUELENIEN F, FUJIWARA W, NAMBA Y, et al.Improved methane fermentation of chicken manure via ammonia removal by biogas recycle[J].Bioresource Technology,2010,101(16):6368-6373 10.1016/j.biortech.2010.03.071 [76] ROMERO-GüIZA M S, ASTALS S, CHIMENOS J M, et al.Improving anaerobic digestion of pig manure by adding in the same reactor a stabilizing agent formulated with low-grade magnesium oxide[J].Biomass & Bioenergy,2014,67(5):243-251 [77] HUANG H, HE L, LEI Z, et al.Contribution of precipitates formed in fermentation liquor to the enhanced biogasification of ammonia-rich swine manure by wheat-rice-stone addition[J].Bioresource Technology,2015,175:486-493 10.1016/j.biortech.2014.10.142 [78] MUMME J, SROCKE F, HEEG K, et al.Use of biochars in anaerobic digestion[J].Bioresource Technology,2014,164(7):189-197 10.1016/j.biortech.2014.05.008 [79] TIAN H, FOTIDIS I A, MANCINI E, et al.Different cultivation methods to acclimatise ammonia-tolerant methanogenic consortia[J].Bioresource Technology,2017,232:1-9 10.1016/j.biortech.2017.02.034 [80] KOSTER I W, LETTINGA G.Anaerobic digestion at extreme ammonia concentrations[J].Biological Wastes,1988,25(1):51-59 10.1016/0269-7483(88)90127-9 [81] CALLI B, MERTOGLU B, INANC B, et al.Effects of high free ammonia concentrations on the performances of anaerobic bioreactors[J].Process Biochemistry,2005,40(3):1285-1292 10.1016/j.procbio.2004.05.008 [82] Lü F, HAO L, GUAN D, et al.Synergetic stress of acids and ammonium on the shift in the methanogenic pathways during thermophilic anaerobic digestion of organics[J].Water Research,2013,47(7):2297-2306 [83] VRIEZE J D, HENNEBEL T, BOON N, et al.Methanosarcina: The rediscovered methanogen for heavy duty biomethanation[J].Bioresource Technology,2012,112(5):1-9 10.1016/j.biortech.2012.02.079 [84] WESTERHOLM M, LEVéEN L, SCHNüRER A.Bioaugmentation of syntrophic acetate-oxidizing culture in biogas reactors exposed to increasing levels of ammonia[J].Applied & Environmental Microbiology,2012,78(21):7619-7625 [85] LI Y, ZHANG Y, SUN Y, et al.The performance efficiency of bioaugmentation to prevent anaerobic digestion failure from ammonia and propionate inhibition[J].Bioresource Technology,2017,231:94-100 10.1016/j.biortech.2017.01.068 [86] TSAPEKOS P, KOUGIAS P G, VASILEIOU S A, et al.Bioaugmentation with hydrolytic microbes to improve the anaerobic biodegradability of lignocellulosic agricultural residues[J].Bioresource Technology,2017,234:350-359 10.1016/j.biortech.2017.03.043 [87] 万钦, 吴树彪, 郎乾乾, 等. 微量元素对沼气厌氧发酵的影响[J]. 农业工程学报,2013,29(10):1-11 [88] B?CK A.Selenium Proteins Containing Selenocysteine[M].Manhattan:John Wiley & Sons Inc.,2006:1930 [89] BANKS C J, YUE Z, YING J, et al.Trace element requirements for stable food waste digestion at elevated ammonia concentrations[J].Bioresource Technology,2012,104(1):127-135 10.1016/j.biortech.2011.10.068 [90] 李亚新, 董春娟, 徐明德. 厌氧消化过程中Fe、Co、Ni 对NH4+-N 的拮抗作用[J]. 城市环境与城市生态,2000,13(4):11-12 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 9074
- HTML全文浏览数: 8507
- PDF下载数: 757
- 施引文献: 0



 下载:
下载: