微量元素Fe、Ni对污泥厌氧消化优化调理
Enhancement of sludge anaerobic digestion by adding trace element Fe and Ni
-
摘要: 当今社会消耗了大量的化石能源,使得环境和能源问题十分突出。污泥厌氧消化产沼气是解决能源问题一种具有潜力的方法。然而,传统污泥厌氧消化存在效率低以及污泥停留时间长等问题,严重地阻碍了其优势的发挥。探究了添加不同浓度微量元素Fe和Ni对污泥厌氧消化产气和有机物去除的影响。结果表明,当FeCl2投加量小于400 mg·L-1时均能促进产气,FeCl2投加量为25 mg·L-1时,产气率取得最大值414.6 mL·g-1(VSadded),比对照组高28 mL·g-1(VSadded)。当NiCl2投加量小于5 mg·L-1时均能促进产气,在NiCl2投加量为5 mg·L-1时,产气率取得最大值389.5 mL·g-1(VSadded)。在最佳投加浓度下,添加Fe对产气的促进效果比添加Ni对产气的促进效果好。对有机物去除而言,当FeCl2投加浓度为25 mg·L-1时,有机物去除率轻微提升,而后随着FeCl2添加量的增加整体呈下降趋势,FeCl2最佳投加浓度为25 mg·L-1。有机物去除率随着NiCl2添加量的增加整体呈下降趋势。在水解产酸实验中,最优FeCl2投加条件下(25 mg·L-1)能使污泥溶解态化学需氧量和挥发性脂肪酸浓度分别提高15.3%和39.2%,为后续的产气提供了更好的基质条件。Abstract: The use of large amount of fossil energy has caused serious environment and energy problems. Sludge anaerobic digestion has been considered as a potential method to solve above problems. However, conventional sludge anaerobic digestion has some drawbacks such as low efficiency and long sludge retention time. This paper investigated effects of adding trace elements Fe and Ni on biogas production and organic matters removal during sludge anaerobic digestion. As for biogas production, results showed that when FeCl2 concentration was added below 400 mg·L-1, biogas production was higher than that of control. The highest biogas yield of 414.6 mL·g-1(VSadded) was obtained at the adding dosage of 25 mg·L-1, which was 28 mL·g-1(VSadded) higher than that of control. Cumulative biogas production increased with the increase of NiCl2 addition dosages in the range of 0~5 mg·L-1. The highest biogas yield of 389.5 mL·g-1(VSadded) were obtained at the NiCl2 adding dosage of 5 mg·L-1. At the optimal condition, the enhancement of biogas by adding FeCl2 was higher than that by adding NiCl2. As for organic matters removal, the volatile solids removal was slight improved by adding 25 mg·L-1 FeCl2 compared with control, and then decreased with the increase of FeCl2 addition dosage. The volatile solids removal was decreased with the increase of NiCl2 addition dosage compared with control. The best adding dosage of FeCl2 was 25 mg·L-1 during sludge anaerobic digestion based on biogas yield, volatile solids removal and cost. The soluble chemical oxygen demand and volatile fatty acids concentrations were improved by 15.3% and 39.2% with the addition of 25 mg·L-1 FeCl2, which provided a better substrate condition for biogas production.
-
Key words:
- sludge anaerobic digestion /
- trace elements /
- FeCl2 /
- NiCl2 /
- hydrolysis /
- acidification
-
目前,大量塑料废物被丢弃到环境中,引起了人们对其命运的担忧[1 − 5]. 为了解决塑料引起的污染问题[6 − 7],创造一个可持续发展的环境,寻找环境友好型替代品成为了近些年来的目标. 因此,以可生物降解塑料取代不可降解塑料成为了目前的发展趋势[8 − 10]. 可生物降解塑料指在自然界如土壤和/或沙土等条件下,和/或特定条件[11]如堆肥化条件下或厌氧消化条件下或水性培养液中,由自然界存在的微生物作用引起降解,并最终完全降解变成二氧化碳或甲烷、水及其所含元素的矿化无机盐以及新的生物质的塑料[12]. 目前主要的可生物降解塑料包括聚己内酯(PCL)、聚乳酸(PLA)、聚丁二酸丁二醇酯(PBS)、聚羟基丁酸酯(PHB)和聚己二酸/对苯二甲酸丁二醇酯(PBAT)等[13 − 15]. 近年来,可生物降解塑料被越来越多的市场所选择,包括包装、电子、汽车、农业、纺织品、组织工程和生物医学等行业[16 − 17]. 与其他生物降解塑料相比,PLA具有良好的机械强度[17]、耐用性和透明度,在替代传统聚合物材料方面发挥着先锋作用,开创了许多应用领域[17],如包装、纺织、医疗等行业[18]. PLA纤维的良好生物相容性[17]和降解性[19]使之可以成为手术衣、手术覆盖布、口罩、纱布、各种吸液材料以及其他生理卫生用品的原材料[20]. 目前,市面上已经出现了由PLA制成的纸尿裤、卫生巾等产品,这些产品具有透气排汗[21]、抑菌防螨[22]、卓越的弹性[22]等优点. 在过去20年中PLA引起了极大的关注. 2019,PLA全球产量估计约为19万吨[17]. 由于PLA在日常生活的多个领域具有广泛的适用性,预计其排放到环境中的废物在未来几年将呈增长趋势[29].
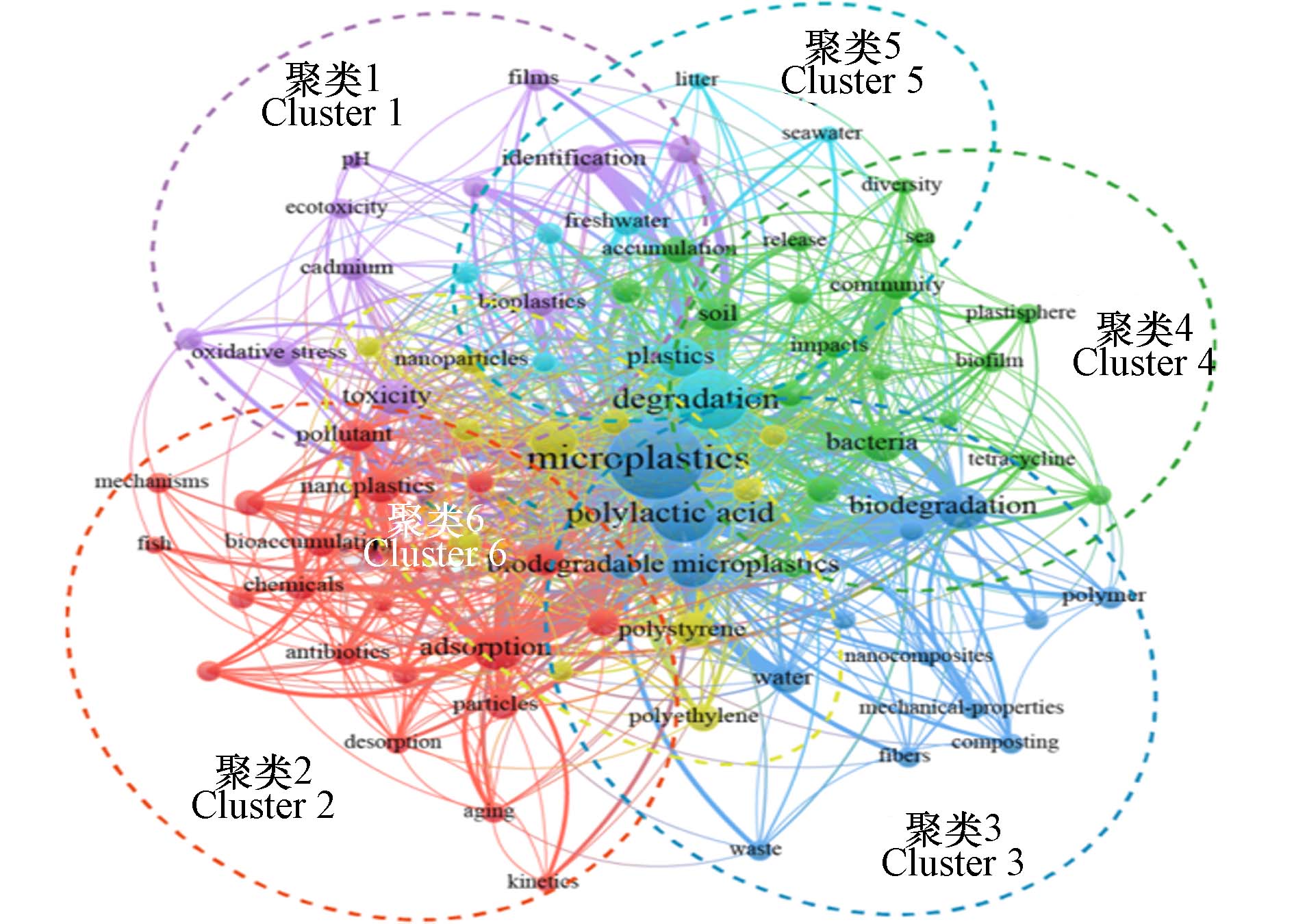
研究指出,降解过程中,可生物降解塑料会产生可降解微塑料(MPs)[23]. 如Sintim等[24]发现经过18周堆肥处理后PLA/聚羟基脂肪酸酯和PBAT的降解率分别大于99%和97%,还观察到了MPs和纳米塑料的产生. 更重要的是,在同一时间范围内,可降解塑料产生的MPs可能比来自传统塑料的更多,因为可降解塑料更容易被降解. Wei等[25]的一项研究表明,在不同水生环境中,PBAT比低密度聚乙烯更容易产生MPs. 由此可见,可生物降解塑料的应用并不能消除MPs,甚至比传统塑料有更大的MPs积累潜力,产生潜在的环境风险[24,26]. 本研究的文献来自于2023年2月15日搜索,通过Web of Science核心数据库进行,搜索关键词输入为“microplastics”和“polylactic acid”,共搜出159篇相关文献,表明此领域研究还较少. 时间框架被设定为包括数据库中所有可用的出版年份. 使用VOS viewer软件通过关键词对文献进行分析,得出关键词共现的网络映射(图1). 图1的节点代表关键词,关键词能够准确地反映出该领域内研究的热点. 其中,圆圈的大小表示关键字出现的频次,圆圈越大,代表该关键词出现的频次越高. 除“microplastics”和“polylactic acid”外,图中“degradation”所占圆圈最大,表明降解是该领域研究热点关键词. 相同颜色的节点表示同一聚类,同一聚类中的关键字都具有相似的研究主题. 根据图中形成的6个聚类可以将“聚乳酸”和“微塑料”领域研究热点与主题概括为“PLA的生态风险”、“PLA/老化PLA的吸附作用”、“PLA的降解”、“PLA与微生物的相互作用”、“PLA塑料”及“PLA对环境的影响”6个方面.
环境中的塑料,在各种生物或非生物的作用下,可降解成MPs[30 − 31],可能会对生态系统造成危害[32]. 因此,研究塑料,特别是可生物降解塑料在环境中释放二次MPs的情况具有重要意义. 故本文以PLA材质的纺织产品(无纺布:常用于纸尿裤、卫生巾的制作)和包装产品(塑料袋和吸管)为研究对象,通过4组实验,即PLA商品在静置、光老化、机械应力老化、光老化和机械应力共同作用下产生二次MPs的过程,记录PLA商品释放二次 MPs的情况,包括数量、形状、尺寸等. 分别讨论机械应力和光老化在产生二次MPs过程中的关键作用,对于理解可生物降解塑料PLA在环境中的风险具有重要意义.
1. 材料与方法(Materials and methods)
1.1 实验材料
实验使用的PLA塑料商品共6种,分别为PLA无纺布、PLA/PBAT塑料袋、PLA吸管和PLA/PBS吸管,其中无纺布分别为由PLA(99%)制成的亲水、疏水无纺布(薄和厚两种). 将PLA无纺布和塑料袋手工切割成50 mm×20 mm条带. 将塑料吸管手工切割成10 mm×10 mm的塑料块. 所有塑料在使用前均用超纯水清洗并干燥.
1.2 实验方法
为了比较环境中不同的老化因素对二次MPs形成的影响. 本文进行了4种环境条件(即静置、光老化、机械应力老化及机械应力和光老化共同作用)下PLA商品释放二次MPs的影响. 整个实验过程中,始终穿纯棉实验服,戴丁腈手套,在超净台操作完成.
(1)静置:将无纺布、塑料袋和塑料管(约0.1 g)加入到含有100 mL超纯水的锥形瓶中,静置1 d后收集样本. 将锥形瓶中的超纯水通过孔径0.22 μm混合纤维素滤膜,并冲洗样品上可能脱落并附着在塑料上的MPs颗粒,后将滤膜在自然条件下风干. 实验全程在室内避光处进行操作,室内温度为25 ℃. 混合纤维素滤膜孔径均匀、表面光滑、孔隙率高、无介质脱落,具有质地薄、阻力小和流速快等特点. 在本研究中,在检测样品前进行了质量控制,滤膜中未产生MPs.
(2)光老化:将无纺布、塑料袋和塑料吸管(约0.1 g)加入到含有100 mL超纯水的石英管中,放在光化学反应仪(上海比朗仪器制造有限公司,GHX-V)中进行照射. 光化学反应仪中光源为
1000 W汞灯,冷却水循环系统的温度保持在25 ℃. 经过预实验发现,照射0.5 h后,无纺布裂解成大量的纤维,如在此条件下进行实验,就会掩盖大量的小颗粒MPs,实验误差较大. 因此选择在照射5、10、20 min后收集无纺布样本,步骤与(1)一致. 而塑料袋和塑料吸管在照射72 h后,几乎裂解成小块塑料,因此在照射12、24、48 h后收集塑料袋和塑料吸管样品,步骤与(1)一致.(3)机械应力老化:将无纺布、塑料袋和塑料吸管(约0.1 g)加入到含有100 mL超纯水的锥形瓶中,在室温条件下将锥形瓶置于转速为150 r·min−1的气浴恒温振荡器(上海一恒科学仪器有限公司,THZ-98A)中,模拟初级塑料的机械应力老化. 振荡24 h后收集样品,步骤与(1)一致.
(4)光老化和机械应力老化共同作用:先将样品进行光老化,步骤与(2)一致,选择的无纺布照射时间为10 min,塑料吸管、塑料袋照射时间为24 h. 后进行机械应力老化,步骤与(3)一致,选择的振荡时间均为24 h,后收集样品,与步骤(1)一致.
对照组在相同的实验条件下进行,但没有塑料样品. 所有实验组准备3个平行样品.
1.3 二次微塑料的定量分析
为了表征不同初级可降解塑料材料降解过程中二次MPs的形成,使用全自动正置荧光显微镜(德国Carl Zeiss公司,Axio Imager. M2)表征粒径大于2 μm的二次MPs. 滤膜在室温干燥后,使用全自动正置荧光显微镜观察其表面的MPs,并采用五点法进行拍照,这意味着整个膜过滤区域选择5个相同大小的区域:上、中、下、左、右(图2),每个区域选择两个代表性区域放大10倍后,然后放大到20倍,分成4个象限拍摄一张照片,所以每个样本最终在20倍下得到40张照片. 后续使用Image J图形分析软件进一步分析MPs的数量、形状(纤维状、碎片状、颗粒状)和粒径.
1.4 数据处理
使用Image J(V1.8.0.112)软件分别对40张照片进行计数. 一张20倍镜显微镜下的照片大小为
0.66204 mm×0.55512 mm,40张照片的总面积为14.70 mm2,膜过滤面积为177 mm2,计算照片面积为过滤面积的8.3%. 因此,总的二次MPs数量即为Image J统计40张照片二次MPs数量的总和再除以8.3%. 实验结果舍弃偏离较大的数据,统计剩余样品的平均值. 根据结果中的Feret直径对试剂中的颗粒进行粒径分析. 二次MPs的类型通过圆度进行分类,即纤维(0.0-0.3 mm)、碎片(0.3-0.6 mm)和颗粒(0.6-1.0 mm).2. 结果与讨论(Results and discussion)
2.1 聚乳酸材料释放二次微塑料的行为研究
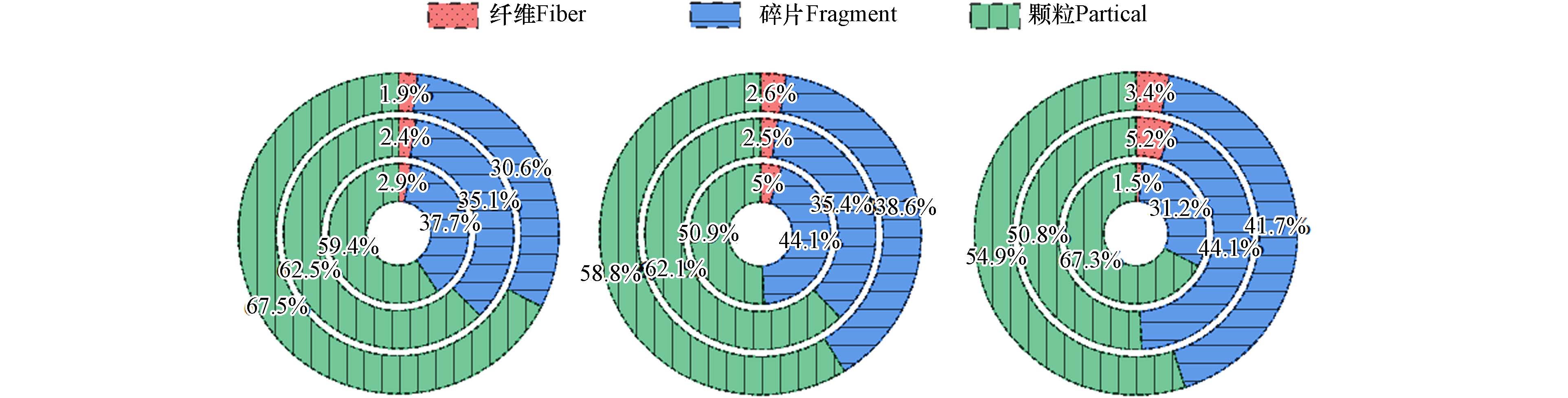
静置24 h后,6种PLA商品产生的二次MPs的类型和数量如图3所示. 在6种不同类型的PLA商品产生的二次MPs中均检测到了纤维、碎片和颗粒,其中,纤维占比最少. 疏水(薄)无纺布中脱落的纤维占比最高,亲水无纺布中仅能观察到少量的纤维,这是因为无纺布由纤维构成,而疏水(薄)无纺布中纤维比较稀疏,导致纤维脱落最多. 3种不同类型的无纺布均脱落了大量的二次MPs,从高到低依次为:疏水(厚)无纺布(
38801 颗粒/0.1 g)、疏水(薄)无纺布(38159 颗粒/0.1 g)、亲水无纺布(34869 颗粒/0.1 g),其数值之间无显著的差异. 3种塑料袋/塑料吸管释放的二次MPs的数量差异显著,从高到低依次为:PLA/PBAT塑料袋(24918 颗粒/0.1 g)、PLA/PBS吸管(6496 颗粒/0.1 g)、PLA吸管(154颗粒/0.1 g). 结果表明,被丢弃到环境中的可降解塑料产品,特别是由纤维制成的,在无任何自然因素作用下就可产生大量二次MPs. 以二次MPs污染最少的PLA吸管为例,年生产约为535亿支(2021年)的PLA吸管排放到水环境24 h后将平均释放约1.81×1015颗二次MPs. 而在实际生活中,释放的二次MPs数量可能更高,因为在塑料商品丢弃之前不可避免地会经历机械磨损、热老化等过程,使塑料产品变的更加脆弱. 此外,PLA/PBAT塑料袋和PLA/PBS吸管在完全静置下也可释放极高数量的MPs,尤其是PLA/PBAT塑料袋. 这表明单一可生物降解材料制成的日用品被释放到环境后,要比混合的可生物降解材料制成的日用品对环境的生态风险低.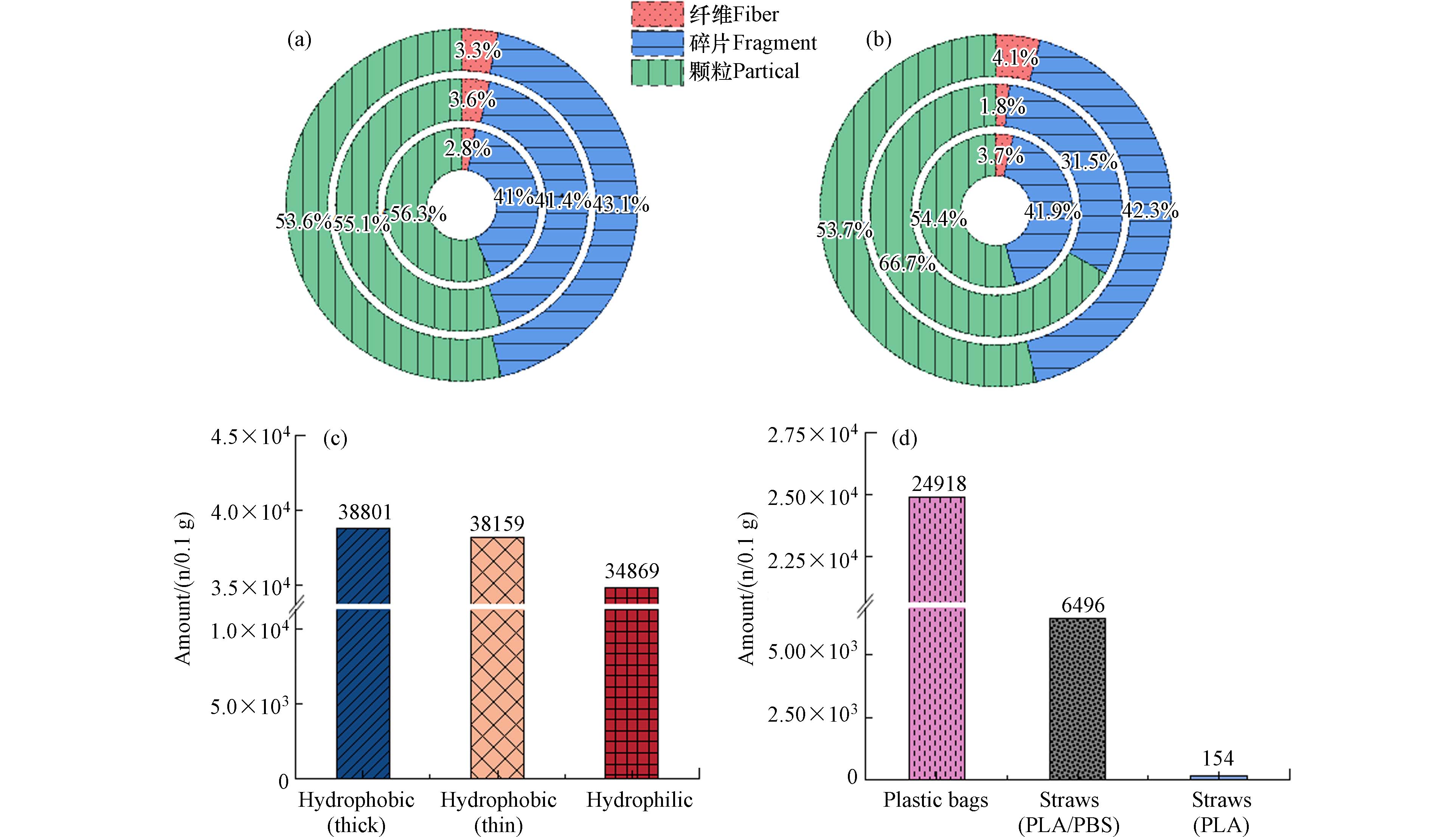 图 3 静置24 h后(a)(c)无纺布、(b)(d)塑料袋/塑料吸管中产生二次MPs的类型(由外到内:疏水(厚)、疏水(薄)、亲水无纺布;PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管)及数量Figure 3. Type (from outside to inside: hydrophobic thick, hydrophobic thin, hydrophilic; PLA/PBAT plastic bag, PLA/PBS straw, PLA straw) and number of secondary MPs shed in (a) (c) non-woven fabric, (b) (d) plastic bag/plastic straw after 24 h of resting
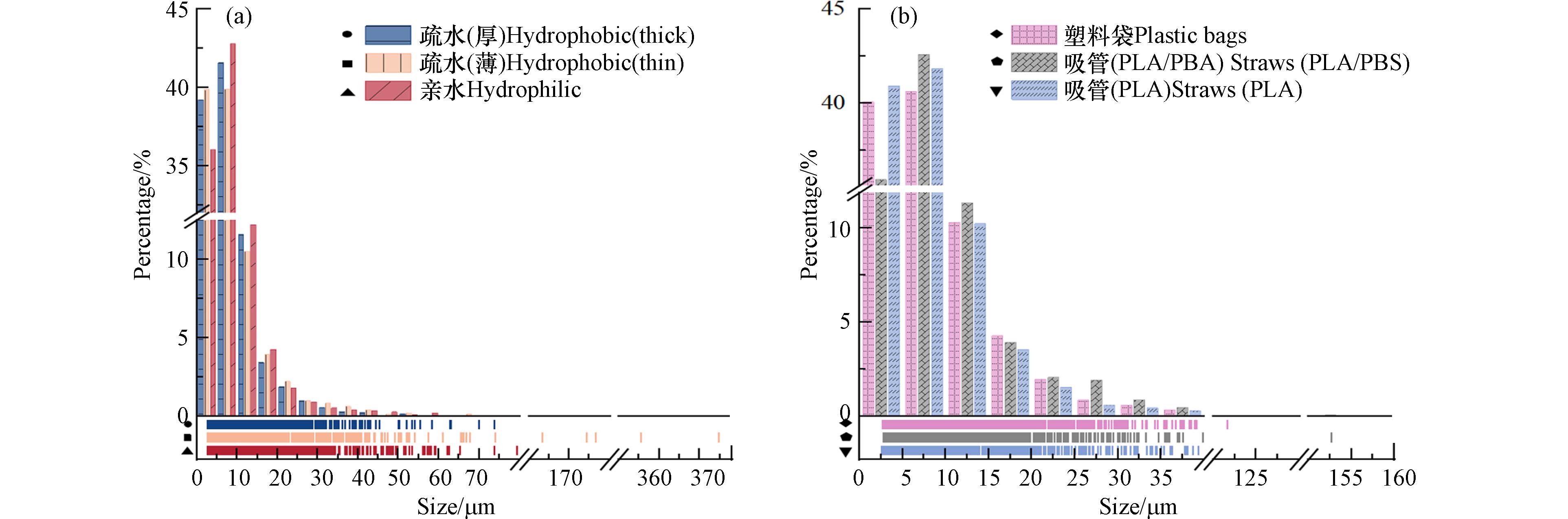
图 3 静置24 h后(a)(c)无纺布、(b)(d)塑料袋/塑料吸管中产生二次MPs的类型(由外到内:疏水(厚)、疏水(薄)、亲水无纺布;PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管)及数量Figure 3. Type (from outside to inside: hydrophobic thick, hydrophobic thin, hydrophilic; PLA/PBAT plastic bag, PLA/PBS straw, PLA straw) and number of secondary MPs shed in (a) (c) non-woven fabric, (b) (d) plastic bag/plastic straw after 24 h of resting无纺布产生的二次MPs粒径大多小于50 μm,尤其是粒径处于0-10 μm之间的分别占疏水(厚)、疏水(薄)、亲水无纺布的80.80%、79.67%和78.81%(图4a). 此外,有少数二次MPs粒径处于50-375 μm之间. 从图4可观察到粒径的分布情况,疏水(薄)无纺布在>60 μm的区域内有较为密集的线,表明疏水(薄)无纺布在静置过程中脱落了较大粒径的二次MPs,可能是由于产生了较多的纤维. 通过计算得到3种不同类型PLA无纺布释放二次MPs的粒径,从小到大依次为:疏水(厚)无纺布(7.72 μm) <亲水无纺布(8.26 μm)<疏水(薄)无纺布(8.61 μm). 静置24 h后,3种塑料袋/塑料吸管释放的大多数MPs的粒径范围在0-50 μm(图4b),尤其是粒径在0-10 μm区间的分别占PLA/PBAT塑料袋、PLA/PBS吸管和PLA吸管释放MPs的80.70%、78.53%、82.77%. 3种材料粒径占比均在5-10 μm范围内达到峰值,只有少数二次MPs的粒径在50-160 μm之间. 3种材料释放二次MPs的平均粒径,从小到大依次为:PLA吸管(7.45 μm)<PLA/PBAT塑料袋(7.98 μm)<PLA/PBS吸管(8.52 μm). 相较于无纺布,塑料袋/吸管在大粒径范围内几乎无MPs产生,表明塑料袋/吸管可以直接分解成非常小的MPs,而很少经历中间的大粒径MPs过程,这可能与塑料商品的材质相关. 无纺布主要由纤维组成,可脱落较大粒径的二次MPs纤维,而塑料袋/吸管脱落的二次MPs粒径偏小.
2.2 机械应力对聚乳酸塑料产品释放二次微塑料的影响
机械振荡24 h后,与静置样品一致,6种PLA商品产生的二次MPs中均检测到了纤维、碎片和颗粒的存在,且纤维的占比最少(图5a、5b). 相较于静置样品,无纺布经机械振荡后纤维占比减少而颗粒增多,推测在机械振荡过程中,样品受到了较大的机械应力,脱落下来的纤维逐渐被分解成颗粒. 6种PLA商品脱落的二次MPs数量顺序与静置样品是一致的,但在数值上大于静置样品. 振荡24 h后,疏水(厚)无纺布、疏水(薄)无纺布、亲水无纺布、PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管释放的二次MPs为静态条件下的150.00%、150.78%、128.08%、189.19%、264.21%、705.65%,这表明机械应力是推动二次MPs产生的一个重要途径,尤其对于吸管来说. 使用后的塑料产品往往会不可避免地进入水生环境,受到水流的机械作用,这可能会给环境带来更大的危害. 更重要的是,无纺布可用来制作卫生用品,如纸尿裤、尿不湿等产品,产生的二次MPs将与人体直接接触,塑料袋通常用来存放食品,产生的MPs可能通过食物链进入人体,而吸管产生的MPs可通过口腔直接进入人体. 因此,在使用这些产品的过程中,减少使用时间和磨损频率将有助于减少MPs和人体接触的可能性. 而实际生活中,塑料袋和吸管更可能在加热的环境下被人类使用. Liu等[27]的研究表明,热水(100 °C)浸泡并搅拌60 min后,分别从塑料包装、杯子、透明盒和膨胀盒中释放出(1.07±0.507)×106、(1.44±0.147)×106、(2.24±0.719)×106、(1.57±59.900)×106个·mL−1亚微米级微粒. 热老化后释放出更多的二次MPs,可能会对人体健康产生更大的威胁.
 图 5 振荡24 h后(a)(c)无纺布、(b)(d)塑料袋/塑料吸管产生二次MPs的类型(由外到内:疏水厚、疏水薄、亲水;PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管)及数量Figure 5. Type (from outside to inside: hydrophobic thick, hydrophobic thin, hydrophilic; PLA/PBAT plastic bag, PLA/PBS straw, PLA straw) and number of secondary MPs produced by (a)(c) non-woven fabric, (b)(d) plastic bag/plastic straw after 24 h of oscillation
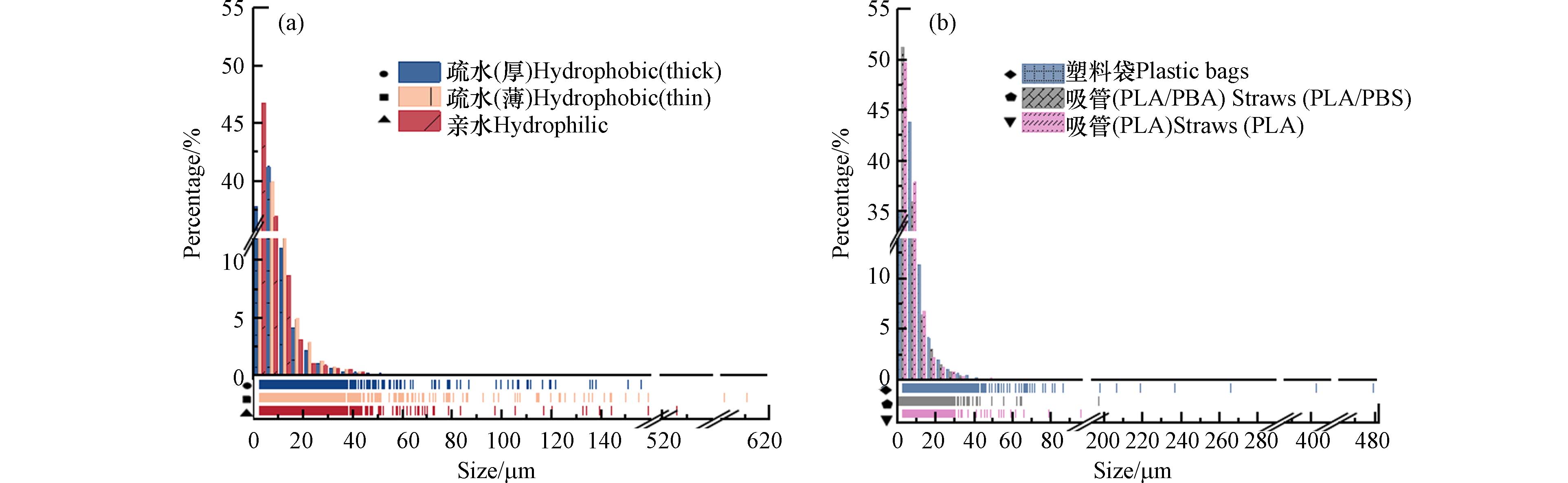
图 5 振荡24 h后(a)(c)无纺布、(b)(d)塑料袋/塑料吸管产生二次MPs的类型(由外到内:疏水厚、疏水薄、亲水;PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管)及数量Figure 5. Type (from outside to inside: hydrophobic thick, hydrophobic thin, hydrophilic; PLA/PBAT plastic bag, PLA/PBS straw, PLA straw) and number of secondary MPs produced by (a)(c) non-woven fabric, (b)(d) plastic bag/plastic straw after 24 h of oscillation与静置样品一致,无纺布在受到机械应力后产生的二次MPs大多数粒径在0-50 μm之间(图6a),少部分二次MPs粒径在50-610 μm之间. 粒径在0-10 μm之间的二次MPs分别占疏水(厚)、疏水(薄)、亲水无纺布的78.87%、75.82%和83.56%. 3种不同类型的PLA无纺布产生二次MPs的平均粒径,从小到大依次为:亲水无纺布(8.19 μm)<疏水(厚)无纺布(9.10 μm)<疏水(薄)无纺布(9.39 μm). 3种塑料袋/塑料吸管释放的MPs的粒径范围大都在1-50 μm(图6b),尤其是粒径在0-10 μm的分别占PLA/PBAT塑料袋、PLA/PBS吸管和PLA吸管释放二次MPs的78.94%,87.21%及87.65%. 此外,只有少数次生MPs的粒径在50-480 μm之间. 3种材料释放二次MPs的粒径,从小到大依次为:PLA/PBAT塑料袋(6.72 μm)<PLA吸管(7.30 μm)<PLA/PBS吸管(9.05 μm).
2.3 光老化对聚乳酸产生二次微塑料的影响
光照不同时间后,3种不同类型的PLA无纺布释放的次生MPs的类型如图7所示. 所有的二次MPs均由纤维、碎片和颗粒组成,且占比情况均为颗粒>碎片>纤维. 随着光照时间的增长,疏水无纺布产生的二次MPs中纤维的占比逐渐增加,而亲水无纺布在光照20 min后纤维的占比减少. 其他两种类型的MPs变化无明显规律.
光照不同时间后,无纺布产生的二次MPs数量的顺序与静置、振荡样品均一致(图8),即疏水(厚)无纺布>疏水(薄)无纺布>亲水无纺布. 二次MPs数量随着光照时间的延长而增加,说明老化程度随光照时间的延长而增加,这与之前的研究是一致的[28]. 从图8中可以看出,随着光照时间的延长,疏水(厚)和亲水无纺布释放二次MPs的速度都较为平缓,其二次MPs数量随着光照时间的延长大致呈线性增长. 当光照时长为10 min时,疏水(厚)和亲水无纺布的二次MPs释放量分别为光照5 min时的1.16、1.29倍,随着光照延长到20 min,其释放的二次MPs数量为10 min时的1.11倍、1.16倍,每个阶段增长速度较为平缓. 而对疏水(薄)无纺布来说,在光照10 min后产生的二次MPs数量显著增加,二次MPs释放量为光照5 min时的1.48倍,光照延长到20 min,其释放的二次MPs数值稍增,仅为10 min时的1.09倍,表明亲水无纺布受光照的影响更为敏感,在老化前期就会产生大量的二次MPs. 结果表明,当可生物降解无纺布进入环境后,光照后不可避免地会产生大量的二次MPs,且MPs释放量随着光照时间的延长而增大,表明释放到环境中的PLA无纺布在光照作用下可能产生更大的危害.
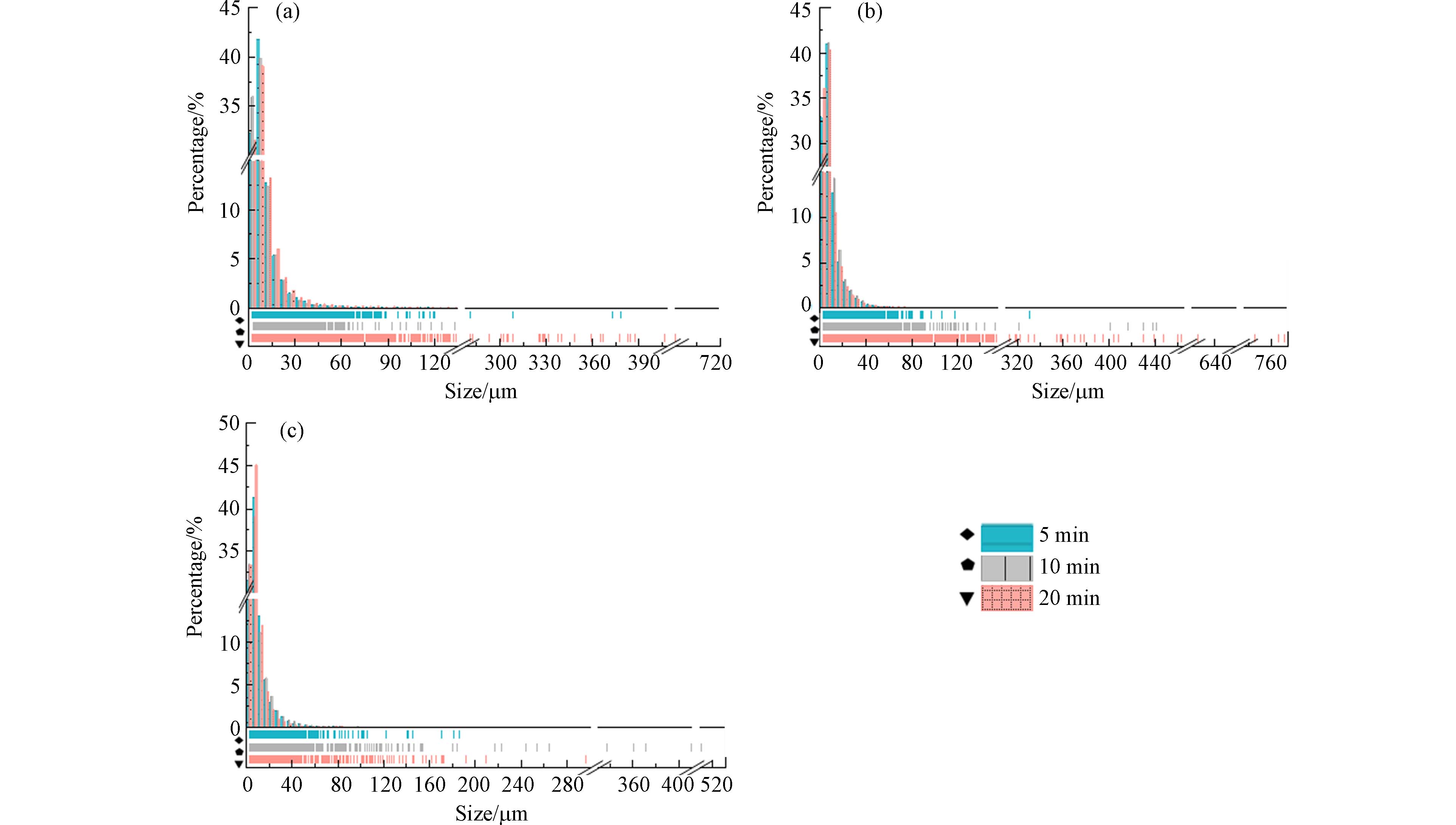
光照不同时间后,无纺布释放的二次MPs的粒径分布情况如图9所示. 整体看来,光照不同时间后无纺布产生的二次MPs粒径大多集中在0-60 μm,少数二次MPs的粒径大于60 μm. 光照5、10、20 min后,疏水(厚)无纺布释放的二次MPs粒径在0-10 μm区间的分别占74.05%、75.88%和70.30%,产生的二次MPs平均粒径分别为9.65、8.61、12.39 μm. 先前的研究表明,随光照时间的延长,塑料产品产生的二次MPs粒径会逐渐减小. 但本研究中,却未遵循此规律,分析原因可能是无纺布与其他塑料产品的结构不一样. 无纺布由粒径较大的纤维组成,而光照后,纤维的脱落的速度无明显规律. 对于疏水(厚)无纺布来说,光照5 min后仅能脱落一些黏结较弱的纤维,随着光照延长到10 min,老化程度加深,前一阶段产生的部分纤维裂解成为小颗粒,造成平均粒径的减小. 随着光照时间进一步增加到20 min,无纺布结构裂解,脱落大量的纤维导致粒径的增加.
疏水(薄)、亲水无纺布光照不同时间后产生的二次MPs的情况与疏水(厚)无纺布结果类似,即其平均粒径的变化与光照时长并无关系. 光照5、10、20 min后,疏水(薄)无纺布释放的二次MPs平均粒径不断增加,分别为9.30、10.78、12.58 μm. 这是因为疏水(薄)无纺布由许多松散的纤维组成,在光照条件下结构裂解导致纤维不断脱落,造成平均粒径的不断增加.
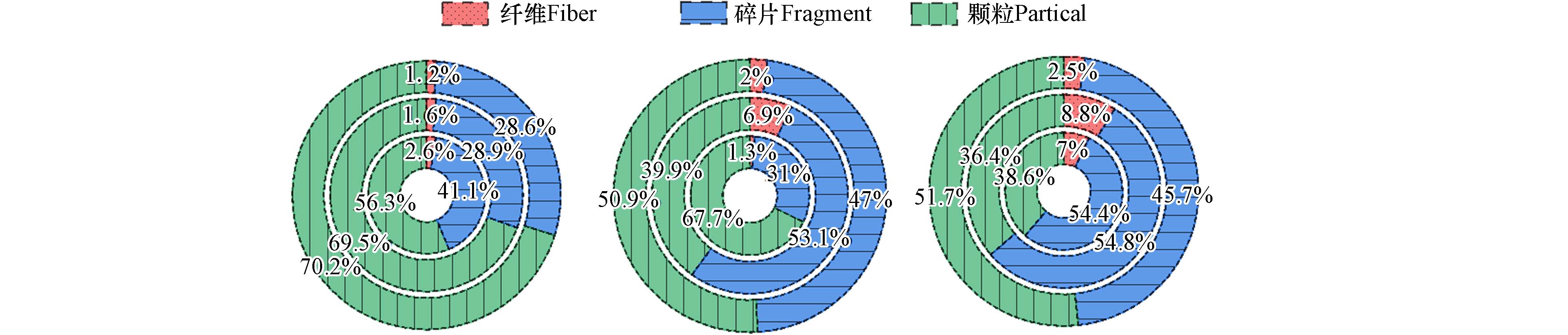
光照一定时间后,塑料袋/塑料吸管产生的二次MPs的类型如图10所示. 在二次MPs中均检测到了纤维、碎片和颗粒,光照12 h后,纤维占比最少(1.2%-2.6%),碎片次之(28.6%-41.1%),颗粒最多(56.3%-70.2%). 随着光照时间延长到48 h,纤维占比增加,特别是PLA/PBS和PLA吸管分别从1.6%、2.6%显著增加到8.8%、7.0%. 碎片占比也大幅度增加,而颗粒的占比明显减小.
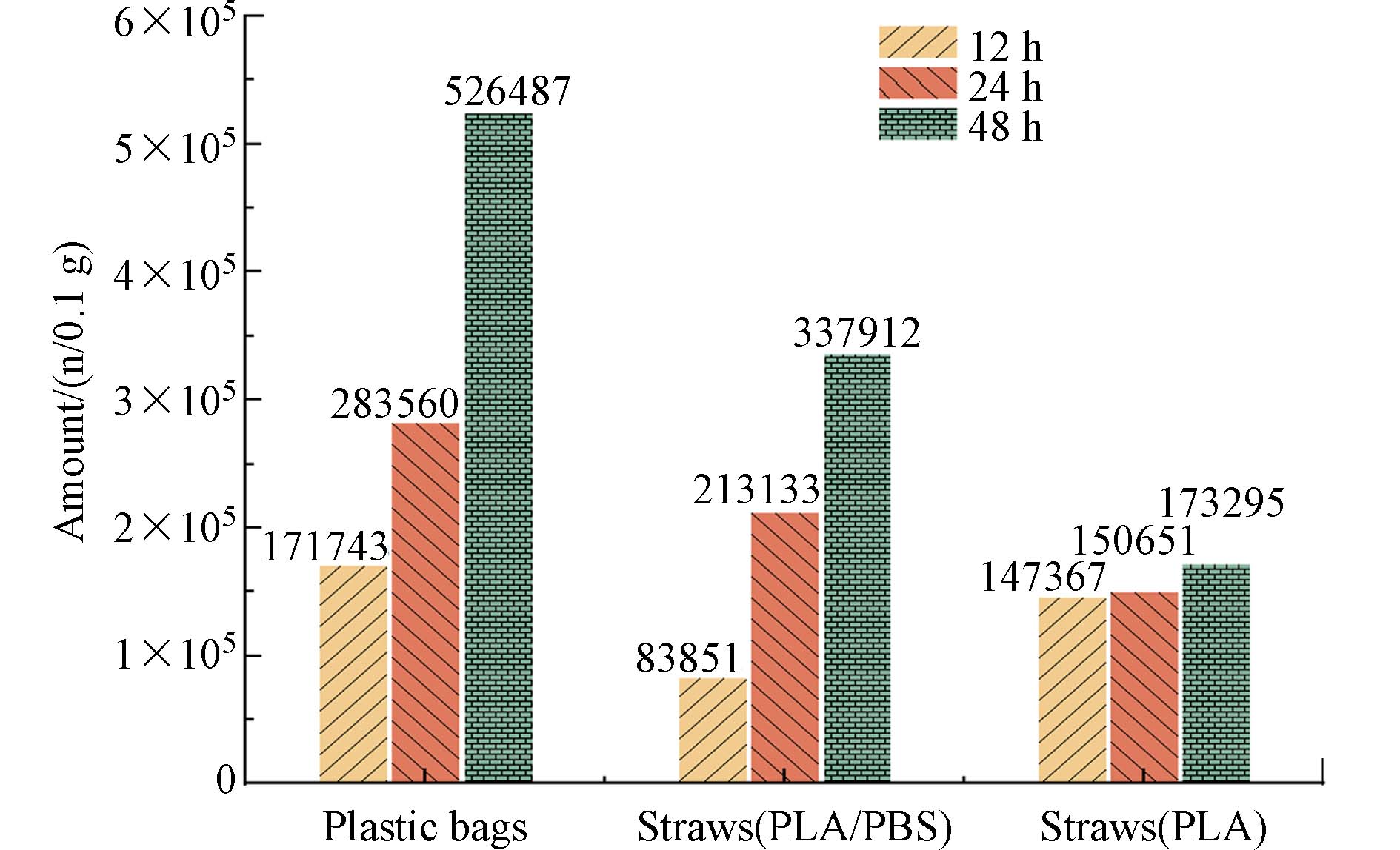
光照一定时间后,无论是塑料袋还是塑料吸管,产生的二次MPs颗粒数量均随时间的延长而增加(图11),且光照后混合塑料制品可释放出更多的二次MPs[30]. 从二次MPs产生的增长速率来看,PLA/PBAT塑料袋和PLA/PBS吸管产生的二次MPs数量随光照时间的延长,每一阶段增加的MPs数量都较多,PLA/PBAT塑料袋在光照12 h后产生的二次MPs颗粒数量为
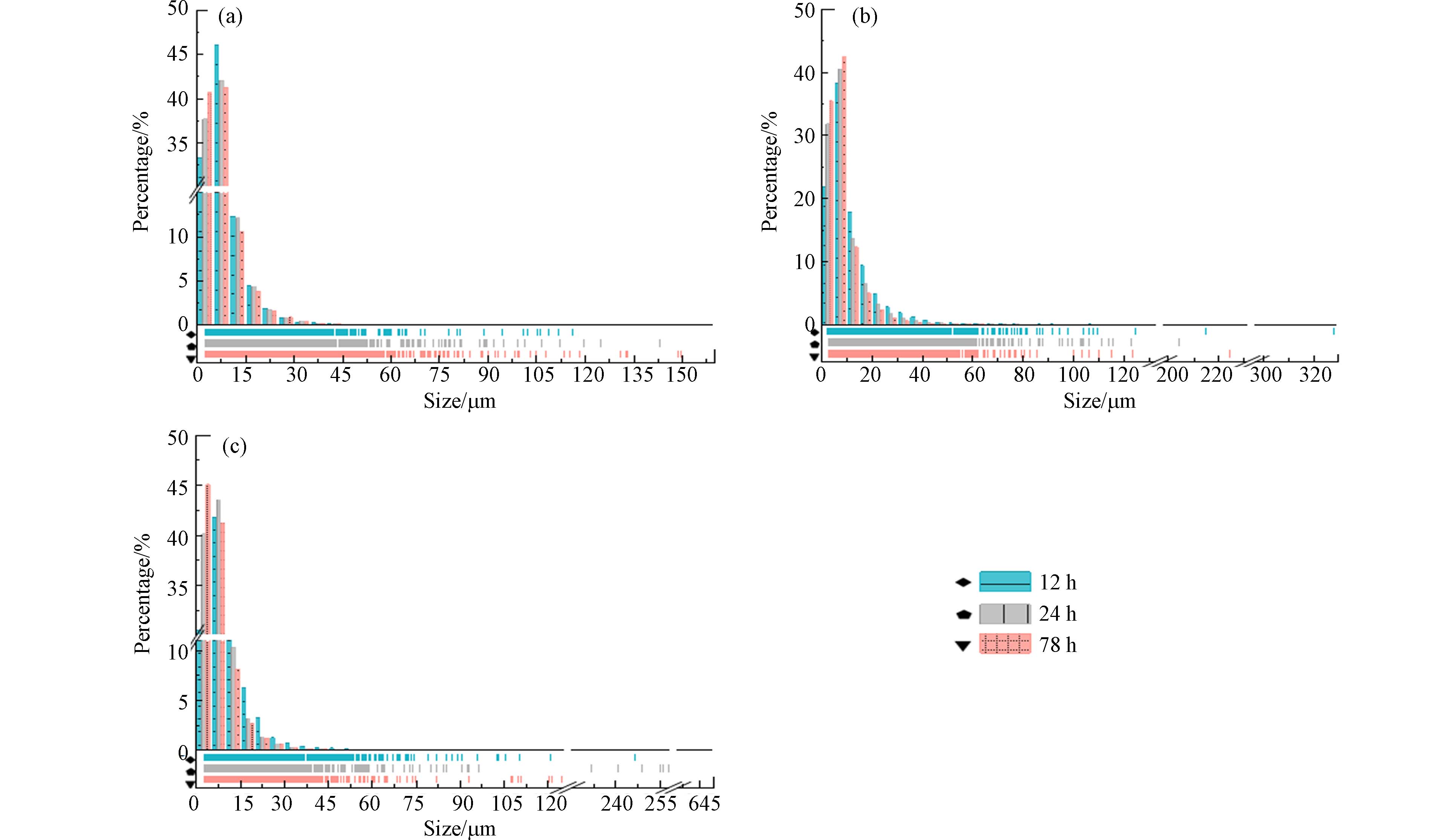
171743 颗/0.1 g,24 h后增加到了1.65倍,随着光照时间进一步延长到48 h,最终产生的二次MPs颗粒可以达到526487 颗/0.1 g,为12 h后的3.07倍. PLA/PBS吸管在光照24、48 h后产生的二次MPs数量分别为12 h后的2.51、4.03倍. 表明PLA/PBAT塑料袋和PLA/PBS吸管在三个光老化阶段中老化速度较为平缓,每个阶段都能产生大量的二次MPs颗粒. 而对PLA吸管来说,在光照12 h后产生的二次MPs数量为147367 颗粒/0.1g,光照24、48h后产生的二次MPs数量仅为12 h后的1.02、1.18倍,表明PLA吸管在光照的第一个阶段产生了大量的二次MPs,初期PLA吸管的老化程度较大,可能接近峰值,后两个老化阶段仅能脱落小部分的二次MPs. Tong等[28]的研究表明可生物降解塑料的降解速度并不比传统塑料快. 而Wei等[25]的研究发现在不同水生环境中,PBAT比低密度PE更容易产生MPs. 由此可见,关于可降解塑料释放二次MPs的研究至今还未得到一致的结果. 但很容易发现,无论是Tong或Wei等的研究还是本研究,几乎都很难统一塑料的规格,其在形状、厚度等方面均有差别,因此得出的结论也不尽相同. 但仅从数值上看,本研究的结果表明可降解塑料在环境中产生的二次MPs数量不容忽视.光照12 h、24 h和48 h后,塑料袋/塑料吸管产生的二次MPs粒径分布如图12所示. 可以发现,无论光照时间多长,大多数次生MPs的粒径都小于50 μm,尤其是粒径小于10 μm的占比最多. 且随着光照时间的延长,小粒径的MPs占比逐渐增加. 相较于光照12 h,PLA/PBAT塑料袋、PLA/PBS吸管和PLA吸管在光照48 h后产生的粒径小于10 μm的二次MPs颗粒分别增长了2.59%、17.87%和13.96%. 总体看来,延长光照时间增加了塑料袋/塑料吸管产生二次MPs小颗粒的比例,通过观察MPs的平均尺寸,可以进一步验证这一结果. 表1列出了光照不同时间后塑料袋/塑料吸管产生二次MPs的平均粒径. 随着光照时间的增长,塑料袋/塑料吸管产生的二次MPs粒径不断减小,表明随着光照时间的延长,塑料不断发生裂解,大颗粒MPs向小颗粒转变,导致平均粒径的不断减小. 而本研究中无纺布产生的二次MPs颗粒的平均粒径并未随着光照时间的延长而减小,这是由PLA/PBAT塑料袋和无纺布不同的结构导致的. 无纺布由许多纤维组成,老化后导致长纤维的脱落,使得其平均粒径的变化没有显著规律. 而PLA/PBAT塑料袋在老化过程中无较长的纤维脱落,因此塑料随着老化程度的不断增大,释放的大颗粒二次MPs逐渐裂解成小颗粒,导致粒径减小.
表 1 光照不同时间后塑料袋/塑料吸管脱落二次MPs的平均粒径(μm)Table 1. Average particle sizes of secondary MPs after plastic bag/plastic straw shedding under different lighting times (μm)类型Type 12 h 24 h 48 h 塑料袋 7.94 7.79 7.53 PLA/PBS吸管 11.43 9.21 8.12 PLA吸管 9.14 7.51 6.97 2.4 机械应力和光老化对聚乳酸产生二次微塑料的影响
图13揭示了光照和机械力的共同作用对二次MPs脱落的影响. 两种因素协同作用下,释放的二次MPs由纤维、碎片和颗粒组成,纤维占比最少,颗粒占比最多. 图13c显示了光照和振荡共同作用后,3种不同类型无纺布产生二次MPs的数量,从高到低依次为:疏水(厚)无纺布>疏水(薄)无纺布>亲水无纺布. 光照和振荡共同作用产生的二次MPs数量顺序与静置或光照条件下是一致的,但在数量上显著大于机械应力作用下产生二次MPs的数量,稍大于光照产生二次MPs数量,这说明光照后塑料制品可能变得脆弱,后在机械力的作用下更容易分解成MPs颗粒. 图13d显示了光照和振荡共同作用后,塑料袋/塑料吸管产生的二次MPs的数量,从高到低依次为:塑料袋>PLA/PBS吸管>PLA吸管. 与无纺布一致,光照和振荡共同作用产生的二次MPs数量顺序与静置或光照条件下是一致的,但在数量上显著大于振荡24 h后产生的二次MPs数量. PLA/PBAT塑料袋光照24 h产生的二次MPs数量为
283560 颗/0.1 g,而光照24 h再振荡24 h后,生产的二次MPs颗粒显著增加到了原来的2.12倍,而对塑料吸管来说,其增加幅度并不大,这说明机械力对PLA/PBAT塑料袋的分解有着重要的推动作用. 丢弃于环境中的无纺布,不可避免的会受到光照及机械力的共同作用,这可能会给环境带来更大的生态健康风险. 图 13 光照再振荡后(a)(c)无纺布、(b)(d)塑料袋/塑料吸管产生二次MPs的类型(由外到内:疏水厚、疏水薄、亲水;PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管)及数量Figure 13. Type (from outside to inside: hydrophobic thick, hydrophobic thin, hydrophilic; PLA/PBAT plastic bag, PLA/PBS straw, PLA straw) and number of secondary MPs produced by (a) (c) non-woven fabric, (b) (d) plastic bag/plastic straw after light re-shaking
图 13 光照再振荡后(a)(c)无纺布、(b)(d)塑料袋/塑料吸管产生二次MPs的类型(由外到内:疏水厚、疏水薄、亲水;PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管)及数量Figure 13. Type (from outside to inside: hydrophobic thick, hydrophobic thin, hydrophilic; PLA/PBAT plastic bag, PLA/PBS straw, PLA straw) and number of secondary MPs produced by (a) (c) non-woven fabric, (b) (d) plastic bag/plastic straw after light re-shaking图14显示了6种不同类型PLA商品在光照和振荡共同作用后产生二次MPs的粒径分布情况. 可以发现,无纺布产生的二次MPs粒径大多都小于50 μm(图14a),其中,粒径处于0-10 μm之间的分别占疏水(厚)、疏水(薄)、亲水无纺布的79.64%、71.23%和65.90%. 此外,有少数二次MPs粒径处于50-590 μm之间. 光照和机械力的共同作用后,3种不同类型的PLA无纺布产生二次MPs的粒径,从小到大依次为:疏水(厚)(8.34 μm)<疏水(薄)(11.63 μm)<亲水(14.10 μm). 塑料袋/塑料吸管在光照和振荡共同作用后产生的二次MPs粒径大多都小于40 μm(图14a),其中,粒径处于0-10 μm之间的分别占PLA/PBAT塑料袋、PLA/PBS吸管、PLA吸管所产生的二次MPs的74.89%、77.61%和86.83%. 此外,有少数二次MPs粒径处于50-370 μm之间.
光照和机械力的共同作用后,3种不同类型的塑料袋/塑料吸管产生二次MPs的粒径,从小到大依次为:PLA吸管(6.92 μm)<PLA/PBS吸管(8.62 μm)<PLA/PBAT塑料袋(9.05 μm). 相比于光照24 h后的样品,在光照和机械力的共同作用下,3种塑料袋/塑料吸管的平均粒径均减小,表明光照后脱落的二次MPs颗粒,在机械力的作用下可以进一步分解为小粒径的MPs颗粒. 因此,释放到环境中的塑料受到的机械力不容忽视,该作用力可能进一步推动塑料颗粒裂解成更小粒径的MPs甚至纳米塑料.
3. 结论(Conclusion)
(1)水环境中,PLA商品静置24 h后就可产生大量二次MPs碎片或颗粒,且无纺布样品脱落的MPs数量远高于塑料袋/塑料管,这可能是因为无纺布由纤维组成,易脱落. PLA/PBAT塑料袋、PLA/PBS吸管产生的二次MPs数量远大于PLA吸管,表明PLA中添加的其他物质可能会加剧二次MPs的释放.
(2)在机械应力的作用下,所有PLA商品产生的二次MPs数量均高于静置条件下,表明机械应力降解有可能是产生二次MPs的重要降解途径.
(3)光老化后,所有塑料产生的二次MPs数量都随着时间的推移而增加,疏水(厚)无纺布和PLA/PBAT塑料袋产生二次MPs的数量最多. 随着光照时间的延长,塑料袋/塑料吸管产生的二次MPs粒径逐渐减小,且颗粒状二次MPs占比逐渐下降.
(4)光照和机械应力的共同作用,更加推动了PLA商品产生二次MPs的可能性,表明光照后塑料制品可能变得脆弱,后在机械力的作用下更容易分解成MPs颗粒.
-
[1] YANG G,ZHANG G,WANG H.Current state of sludge production, management, treatment and disposal in China[J]. Water Research, 2015,78:60-73 [2] YANG G,ZHANG P,ZHANG G,et al.Degradation properties of protein and carbohydrate during sludge anaerobic digestion[J]. Bioresource Technology, 2015,192:126-130 [3] ZHANG C,SU H,BAEYENS J,et al.Reviewing the anaerobic digestion of food waste for biogas production[J]. Renewable and Sustainable Energy Reviews, 2014,38:383-392 [4] YU B,LOU Z,ZHANG D,et al.Variations of organic matters and microbial community in thermophilic anaerobic digestion of waste activated sludge with the addition of ferric salts[J]. Bioresource Technology, 2015,179:291-298 [5] FENG Y,ZHANG Y,QUAN X,et al.Enhanced anaerobic digestion of waste activated sludge digestion by the addition of zero valent iron[J]. Water Research, 2014,52:242-250 [6] TAN J,WANG J,XUE J,et al.Methane production and microbial community analysis in the goethite facilitated anaerobic reactors using algal biomass[J]. Fuel, 2015,145:196-201 [7] ZHANG W,ZHANG L,LI A. Enhanced anaerobic digestion of food waste by trace metal elements supplementation and reduced metals dosage by green chelating agent[S, S]-EDDS via improving metals bioavailability[J]. Water Research, 2015,84:266-277 [8] ORTNER M,RAMEDER M,RACHBAUER L,et al.Bioavailability of essential trace elements and their impact on anaerobic digestion of slaughterhouse waste[J]. Biochemical Engineering Journal, 2015,99:107-113 [9] BASU S,OLESZKIEWICZ J,SPARLING R.Effect of sulfidogenic and methanogenic inhibitors on reductive dehalogenation of 2-chlorophenol[J]. Environmental Technology, 2005,26(12):1383-1392 [10] American Public Health Association,American Water Works Association,Water Environment Federation.Standard methods for the examination of water and wastewater[S]. Washington D C,USA,2005 [11] FACCHIN V,CAVINATO C,FATONE F,et al.Effect of trace element supplementation on the mesophilic anaerobic digestion of foodwaste in batch trials:The influence of inoculum origin[J]. Biochemical Engineering Journal, 2013,70:71-77 [12] FERMOSO F,BARTACEK J,JANSEN S,et al.Metal supplementation to UASB bioreactors:From cell-metal interactions to full-scale application[J]. Science of the Total Environment, 2009,407(12):3652-3667 [13] 陈才键,韩正昌. PTA废水厌氧消化的微量元素需求[J]. 工业用水与废水, 1998(4):19-22 [14] 时昌波.铁氧化物强化纤维素类生物质产甲烷研究[D].合肥:合肥工业大学,2014 [15] DEMIREL B,SCHERER P. Trace element requirements of agricultural biogas digesters during biological conversion of renewable biomass to methane[J]. Biomass and Bioenergy, 2011,35(3):992-998 [16] HAN K, LEVENSPIEL O. Extended Monod kinetics for substrate, product, and cell inhibition[J]. Biotechnology and Bioengineering, 1988,32(4):430-447 [17] 农丽薇,徐龙君,谢金连,等.微量Co和Ni对稻草厌氧消化的影响[J]. 环境科学研究, 2008,21(2):163-167 [18] ABBOTT T, ESKICIOGLU C. Effects of metal salt addition on odor and process stability during the anaerobic digestion of municipal waste sludge[J]. Waste Management, 2015,46:449-458 [19] FEKI E, KHOUFI S, LOUKIL S,et al. Improvement of anaerobic digestion of waste-activated sludge by using H2O2 oxidation, electrolysis, electro-oxidation and thermo-alkaline pretreatments[J]. Environmental Science and Pollution Research, 2015,22(19):14717-14726 [20] KIM M, GOMEC C, AHN Y,et al. Hydrolysis and acidogenesis of particulate organic material in mesophilic and thermophilic anaerobic digestion[J]. Environmental Technology, 2003,24(9):1183-1190 期刊类型引用(7)
1. 裴立影,朱红霞,袁思腾,陈正涛,马宏瑞,郭昌梓. 铁磷比对厌氧消化系统中蓝铁矿生成的影响. 陕西科技大学学报. 2023(01): 29-37 .  百度学术
百度学术
2. 肖丽君,马向伟,王永生,都的箭,吴晴,熊蒂程. 化学强化初沉污泥厌氧消化产甲烷潜力研究. 中国沼气. 2022(01): 18-23 .  百度学术
百度学术
3. 杜海霞,区恒煜,张蕾,吴艳霞,吴俊,黄紫旖,文蕾,郑尹怀. 给水污泥提高剩余污泥消化稳定性及处理水水质. 科技创新与应用. 2020(20): 1-4+8 .  百度学术
百度学术
4. 方楠,赵燕肖,习彦花,刘敬,梁文华,程辉彩,张丽萍. 金属离子对青霉素菌渣厌氧发酵产气模型分析. 中国环境科学. 2020(07): 3020-3028 .  百度学术
百度学术
5. 刘亚利,杨灿,康晓荣,钟婷婷,张锺一. 微量元素Ni添加在厌氧消化中的研究进展. 应用化工. 2019(02): 458-461 .  百度学术
百度学术
6. 王晨,许立峰,董丁硕,曹勇,范文瑞,张林义,岳正波,彭书传,王进. 褐铁矿与固体含量对牛粪秸秆混合厌氧干式发酵的影响. 环境工程学报. 2018(09): 2609-2616 .  本站查看
本站查看
7. 刘亚利,钟婷婷,刘鹏飞,余紫薇,杨灿. 投加不同形态的铁对厌氧消化的影响和作用机理. 应用化工. 2018(10): 2264-2267 .  百度学术
百度学术
其他类型引用(17)
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 2517
- HTML全文浏览数: 2098
- PDF下载数: 397
- 施引文献: 24





 下载:
下载: