BiVO4联合H2O2或K2S2O8光催化降解布洛芬
Photocatalytic degradation of ibuprofen via BiVO4 combined with H2O2 or K2S2O8
-
摘要: 以水热法制备了BiVO4光催化剂,并用X射线衍射和扫描电镜对其进行表征。在模拟太阳光照射下,以布洛芬为目标污染物,考察了BiVO4联合H2O2或K2S2O8工艺对布洛芬的光催化降解效果,得出了H2O2或K2S2O8的最佳投加量。通过淬灭实验,研究了光催化联合体系降解布洛芬的机制。X射线衍射谱图表明所合成的BiVO4光催化剂为纯的单斜晶相,扫描电镜结果表明制备的粉末形貌单一,且呈现微球状。加入H2O2或K2S2O8后,一定程度上促进了BiVO4光催化降解布洛芬的效率,H2O2和K2S2O8的最佳投加量分别为3.0 mmol·L-1和1.5 g·L-1。BiVO4/H2O2/hν体系和BiVO4/K2S2O8/hν体系降解水中布洛芬主要是基于·OH自由基的氧化作用。通过对比2个体系中·OH和O2·-对布洛芬降解速率的贡献,发现K2S2O8对BiVO4光催化体系的促进作用远远大于H2O2对该体系的促进作用。Abstract: A BiVO4 photocatalyst was prepared by a hydrothermal process and was characterized using X-ray diffraction (XRD) and scanning electron microscopy (SEM).The photocatalytic degradation of ibuprofen (IBU) by BiVO4 in the presence of H2O2 or K2S2O8 under simulated solar irradiation was examined,and the optimum dosages of H2O2 and K2S2O8 were determined.The photocatalytic degradation mechanism of IBU was studied through quenching experiments.XRD analysis indicated that the prepared photocatalyst corresponded to phase-pure monoclinic scheelite BiVO4.The SEM micrographs indicated that the prepared BiVO4 samples consisted of microspheres.The experimental results showed that both H2O2 and K2S2O8 promote the photocatalytic degradation of IBU to some extent,and the optimum dosages of H2O2 and K2S2O8 were 3.0 mmol·L-1 and 1.5 g·L-1,respectively.The degradation mechanism of IBU in the two processes is mainly ascribed to ·OH oxidation.A comparison of the contribution of ·OH and O2·- in the two systems to the degradation rate of IBU showed that the BiVO4 photocatalytic activity in the presence of K2S2O8 was considerably better than that in the presence of H2O2.
-
甲醛(HCHO)是一种典型室内空气污染物,主要来源于油漆、家具及建筑装修材料等[1]。2004年,甲醛已被国际癌症研究机构(IARC)列为人类致癌物(Ⅰ类)[2]。一般来说,人类的大部分时间是在室内度过的,难免会接触甲醛,而甲醛会引起过敏、恶心、肿瘤等各种健康问题。因此,有效去除室内空气中的甲醛是保护人类健康的迫切需要。目前,催化氧化甲醛技术,因具有高效、节能、环境友好等优点而备受关注[3]。因此,开发一种能在室温条件下将甲醛完全转化为CO2和H2O的高效催化剂,已成为目前面临的最大挑战。
目前,用于消除甲醛的催化材料主要分为过渡金属氧化物和贵金属催化剂。现已证明,能有效氧化甲醛的过渡金属氧化物及其复合物有MnOx、Co3O4和CeO2。如3D-Co3O4在130 ℃时甲醛的转化率达到了100%[4]。不同晶型结构MnOx催化剂完全氧化甲醛的温度为80~150 ℃[5]。MnOx-CeO2催化剂完全氧化甲醛的温度为100 ℃[6]。但是,多数过渡金属氧化物及其复合物在低温(<100 ℃)条件下对甲醛去除率仍然不高。近年来,多项研究表明,负载型贵金属催化剂在室温下完全氧化甲醛的性能表现优异。ZHANG等[7]报道,催化剂Pt/TiO2中碱金属(Li+、Na+和K+)的加入可以促进和稳定Pt高度分散,改善了催化剂的性能,2% Na-1% Pt/TiO2在15 ℃将甲醛完全氧化。在Au/CeO2催化剂作用下,甲醛可以在28 ℃被完全氧化[8]。与Pt系和Au系催化剂相比,Pd系催化剂价格低廉,其在室温下氧化甲醛的性能受到广泛关注。ZHANG等[9]报道,催化剂2% Na-1% Pd/TiO2中Na与Pd的强相互作用,有利于带负电荷Pd物种的形成,进而促进O2的吸附,该催化剂在25 ℃条件下甲醛的转化率接近100%。1% Pd/CeO2催化剂在22 ℃时能将甲醛完全氧化[10]。尽管如此,仍然需要开发高效、低Pd含量的催化剂,以降低其成本。
鉴于碱金属Na+能够促进贵金属的高度分数、改变贵金属的电荷效应,本研究选择Na+作为贵金属Pd的助催化剂,以γ-Al2O3作为载体,制备了系列Pd质量分数为0.5%的Pd-x% Na/Al2O3(x%表示Na的质量分数,分别为0、1%、2%和4%)催化剂,并对催化剂的物理化学性质进行了表征。
1. 实验部分
1.1 催化剂制备
以γ-Al2O3(购自国药集团化学试剂有限公司)为载体,采用共浸渍法制备了不同Na含量的负载型Pd催化剂。首先,将γ-Al2O3分散在20 mL蒸馏水中,在磁力搅拌下,将20 mL含有一定量Pd(NO3)2和NaNO3溶液缓慢加入γ-Al2O3悬浮液中;室温下连续搅拌24 h后,升温至80 ℃,在搅拌条件下蒸去多余水分;最后,样品在100 ℃干燥12 h,400 ℃焙烧4 h,升温速率为5 ℃·min−1。所得样品Pd质量分数均为0.5%,Na质量分数分别为0、1%、2%、4%,分别命名为Pd/Al2O3、Pd-1% Na/Al2O3、Pd-2% Na/Al2O3和Pd-4% Na/Al2O3。采用同样方法制备了Na质量分数为2%的2% Na/Al2O3催化剂。
1.2 催化剂表征
采用ASAP2020HD88比表面积仪测定催化剂的比表面积。测试前,所有样品在250 ℃抽真空脱气处理4 h。用BET方法计算比表面积,用BJH方法计算催化剂的孔容和孔径。
X射线衍射(XRD)在Panalytical Empyrean X射线衍射仪上进行,衍射源为Cu-Kα辐射(λ= 0.154 056 nm),加速电压为40 kV,外加电流为30 mA,扫描速率为2(°)·min−1,扫描角度为10.0°~80.0°。
程序升温还原(H2-TPR)设备由热导检测器(TCD)和程序升温2个单元组成。测试前,在石英管反应器中装入50 mg催化剂,然后通入体积分数为10% H2/N2气(60 mL·min−1),以10 ℃·min−1的速率加热升温,从25 ℃加热至350 ℃。
氧程序升温脱附(O2-TPD)测试与H2-TPR在同一仪器上进行。60 mg样品先在体积分数为10% H2/N2(40 mL·min−1)的气氛下,350 ℃还原30 min,升温速率为10 ℃·min−1;再用He(40 mL·min−1)在200 ℃吹扫30 min后,He气氛条件下降温到50 ℃,切换为20 mL·min−1的体积分数为21% O2/N2,在50 ℃下进行O2吸附1 h;最后,在He(40 mL·min−1)气氛中以10 ℃·min−1的速率从50 ℃升温到450 ℃。
X射线光电子能谱(XPS)是在Thermo Scientific K-Alpha仪器上进行的,激发光源为MgKα(1 653.6 eV)。
1.3 催化性能测试
甲醛的催化氧化反应在微型固定床反应器内进行,反应条件为常压和环境温度(25±1)℃。首先,将50 mg催化剂(40~60目)填充在石英管(内径3 mm)中,用体积分数为10% H2/N2气(40 mL·min−1)在350 ℃下还原30 min。将多聚甲醛置于恒温水浴中,用体积分数为21% O2/N2气(30 mL·min−1)带出分解的甲醛,形成含甲醛的反应气体,反应气体中HCHO的体积分数为0.025%,反应气体流量为30 mL·min−1,质量空速(WHSV)为36 000 mL·(g·h)−1。反应1 h后,反应尾气通过配有甲烷转化炉和氢火焰离子化检测器(FID)的气相色谱仪进行在线检测。由于生成的含碳物种中仅有CO2,因此,甲醛转化率可由式(1)计算。
η=C[CO2]outC[HCHO]in×100% (1) 式中:η为HCHO转化率;
C[CO2]out 为反应尾气中CO2的浓度;C[HCHO]in为入口气体中甲醛的浓度。2. 结果与讨论
2.1 BET分析
Pd-x% Na/Al2O3(x=0、1、2和4)催化剂和γ-Al2O3的SBET、孔容和孔径数据见表1。催化剂的SBET和孔容由大到小的顺序为:γ-Al2O3>Pd/Al2O3>Pd-1% Na/Al2O3>Pd-2% Na/Al2O3>Pd-4% Na/Al2O3。样品孔径由小到大顺序为:γ-Al2O3<Pd/Al2O3<Pd-1% Na/Al2O3<Pd-2% Na/Al2O3<Pd-4% Na/Al2O3。由此可知,Pd和Na粒子覆盖在γ-Al2O3表面上,并堵塞部分微孔,进而导致SBET和孔容减小[9]。
表 1 Pd-x% Na/Al2O3(x=0、1、2和4)催化剂和γ-Al2O3的结构性质Table 1. Textural properities of Pd-x% Na/Al2O3(x=0, 1, 2 and 4)catalysts and γ-Al2O3样品 SBET/(m2·g−1) 孔容/(cm3·g−1) 孔径/nm γ-Al2O3 208.85 0.526 6.46 Pd/Al2O3 204.99 0.513 6.61 Pd-1% Na/Al2O3 185.52 0.509 8.11 Pd-2% Na/Al2O3 168.74 0.504 8.57 Pd-4% Na/Al2O3 153.29 0.480 9.06 2.2 XRD分析
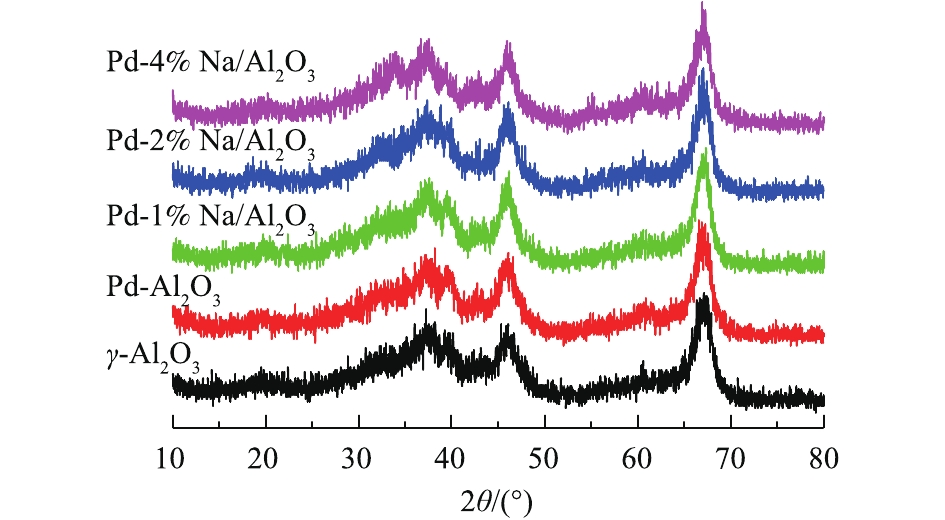
图1为Pd-x% Na/Al2O3(x=0、1、2和4)催化剂和γ-Al2O3的XRD图。所有催化剂都有4个特征衍射峰,分别在2θ=37.3°、42.6°、45.7°和67.1°处,归属于γ-Al2O3[11]。在Pd/Al2O3和Pd-Na/Al2O3的XRD图谱中没有Pd、Na或Pd-Na合金的衍射特征峰,说明这些物质粒径小、含量低、分散度高,难以检测到。
2.3 H2-TPR分析
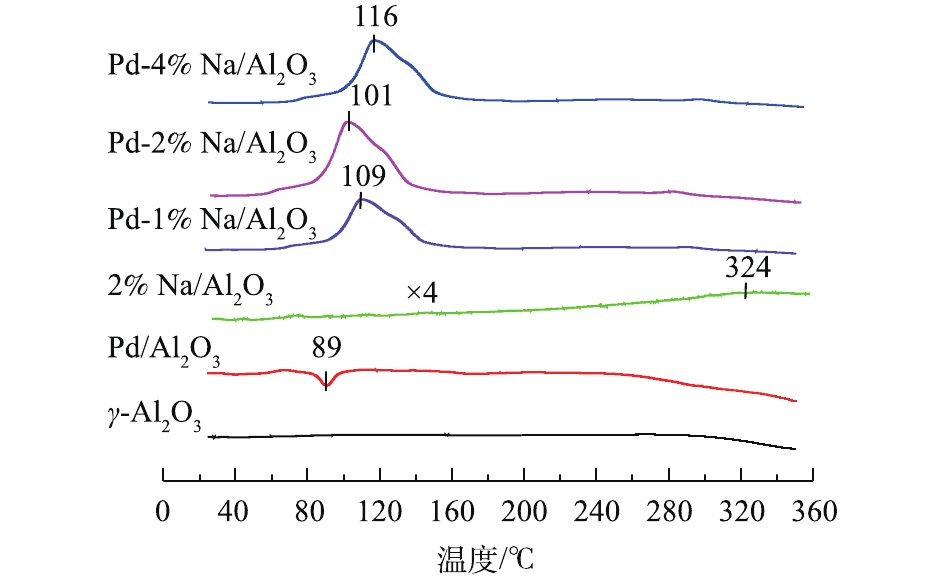
Pd-x% Na/Al2O3(x=0、1、2和4)催化剂和γ-Al2O3的H2-TPR结果见图2。可以看出,γ-Al2O3在25~350 ℃基本没有还原峰。Pd/Al2O3催化剂除了在89 ℃出现1个负峰外,没有PdO物种的还原峰。根据已有研究[12],在进行TPR测试之前,分散在载体Al2O3上的PdO物种可能在20 ℃以下已被H2还原。89 ℃的负峰归属于β-PdH分解产生H2脱附[13]。众所周知,金属Pd0大微晶在室温下可将H2解离成氢原子形成β-PdH,催化剂表面高度分散的Pd能够显著抑制β-PdH的形成[14]。由此说明,Pd/Al2O3催化剂表面上有较大的金属Pd0微晶生成。样品2% Na/Al2O3在324 ℃出现了一个弱的耗氢峰,可归属为Na物种的还原[9, 15]。
Pd-1% Na/Al2O3、Pd-2% Na/Al2O3和Pd-4% Na/Al2O3 3种催化剂H2脱附峰消失,在60~150 ℃出现了一个强的H2还原峰,归属于PdO和Na物种的还原。据报道[9],由于Pd与Na物种之间存在很强的相互作用,Na物种可以稳定Pd物种,Pd物种的存在可以促进Na物种的还原。同时,3种催化剂的还原性与Na含量密切相关,Pd-2% Na/Al2O3的低温还原性最好,其还原温度比Pd-1% Na/Al2O3和Pd-4% Na/Al2O3分别低了8 ℃和15 ℃。研究[16-17]表明,催化剂的还原性与其氧空位有关,还原性较好的催化剂可能产生更多的氧空位。因此,Pd-2% Na/Al2O3可以产生更多的氧空位,从而在甲醛催化氧化过程中起到关键作用。这一结果与O2-TPD(见图3)的分析结果一致。
2.4 O2-TPD分析
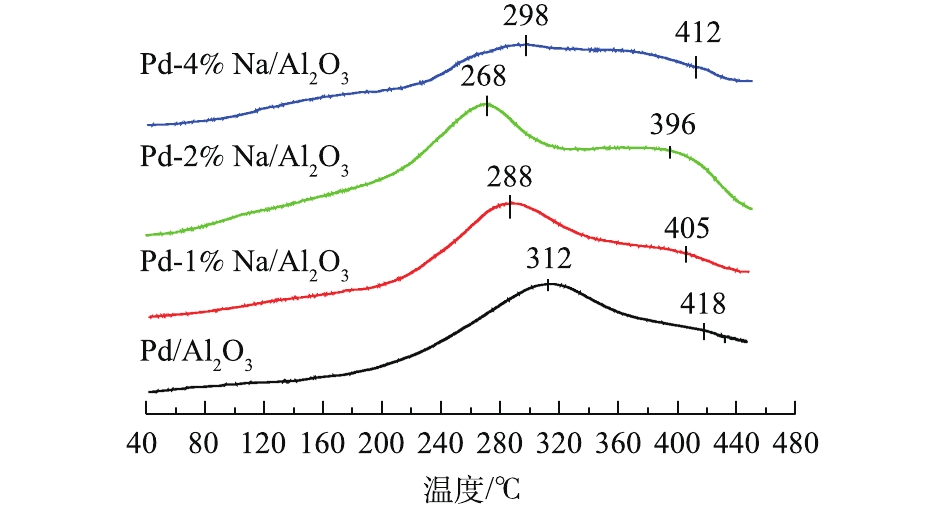
图3为Pd-x% Na/Al2O3(x=0、1、2和4)催化剂的O2-TPD图。催化剂表面活性氧如
O−2 和O−的脱附温度在350 ℃以下,而晶格氧(O2-)的脱附温度在350 ℃以上。一般来说,较低温度对应的O2脱附峰表明样品容易产生表面活性氧物种,有利于在氧化反应中提供较高的催化活性[18-19]。Pd/Al2O3催化剂在312 ℃和418 ℃的脱附峰分别归属于表面活性氧物种和晶格氧的脱附。添加Na后,Pd-1% Na/Al2O3、Pd-2% Na/Al2O3和Pd-4% Na/Al2O3催化剂的O2脱附峰较Pd/Al2O3的脱附峰向低温方向移动,特别是Pd-2% Na/Al2O3催化剂的O2脱附温度最低,为268 ℃,并且O2脱附峰的信号最强。由此可知,Pd-2% Na/Al2O3催化剂表面具有丰富的表面活性氧,这是催化剂具有优异催化活性不可缺少的。MA等[18]和BAI等[4]在研究中也得出了同样结论。MA等[18]发现,介孔催化剂Au/Co3O4-CeO2(7:3)具有丰富的表面活性氧,其甲醛氧化活性较高。BAI等[4]研究发现,3D-Co3O4的催化剂因表面有丰富的活性氧,容易参与甲醛的催化氧化反应,其催化活性高。2.5 XPS分析
图4为Pd/Al2O3和Pd-2% Na/Al2O3催化剂的XPS谱图。如图4(a)所示,Pd/Al2O3在335.5 eV和336.5 eV时出现2个Pd3d5/2峰。BUERES等[20]发现,Pd0在Pd/AC、Pd/CNF和Pd/HSAG催化剂中的特征峰约在334.7~335.7 eV。NUTT等[21]报道了Pd0的特征峰在335.3 eV。HUANG等[22]将336.5 eV时的结合能归属于Pd氧化物。因此,本研究将335.5 eV和336.5 eV的特征峰分别归属于Pd0和Pd氧化物。Pd-2% Na/Al2O3的Pd3d5/2的峰向低结合能转移(334.6 eV和336.0 eV),表明Na作为给电子体,通过与Pd的强相互作用,导致部分带负电荷Pd物种的形成,而带负电荷的Pd又将负电荷转移给氧的反键π*轨道,进而促进了O2的吸附[23-24]。
Pd/Al2O3催化剂的Al2p谱图在74.9 eV处出现1个峰,Pd-2% Na/Al2O3的峰出现了0.4 eV的轻微负迁移,说明Na与Al2O3之间存在相互作用。此结论与ONISHI等[25]的研究结论一致。ONISHI等[25]报道了沉积在TiO2上的Na与表面氧原子间存在强烈的协同作用,导致电荷向TiO2转移。
O 1s在529.0~531.0 eV的结合能归属于表面晶格氧,位于高结合能(531.5~533.0 eV)的肩峰归属于表面吸附氧或表面羟基[26]。样品Pd/Al2O3和Pd-2% Na/Al2O3中的表面吸附氧分别占8.70%和9.45%,表明Pd-2% Na/Al2O3催化剂中存在较多的表面活性氧物种,这与O2-TPD的结论一致(图3)。由图4(c)可知,Pd-2% Na/Al2O3的结合能比Pd/Al2O3低,较低的结合能是由于负电荷的增加造成的[27]。
催化剂的Na1s的XPS谱如图4(d)所示。在1 072.6 eV处的峰归属于Na+,表明Na物种已负载在Al2O3上。
2.6 催化剂的催化氧化性能评价
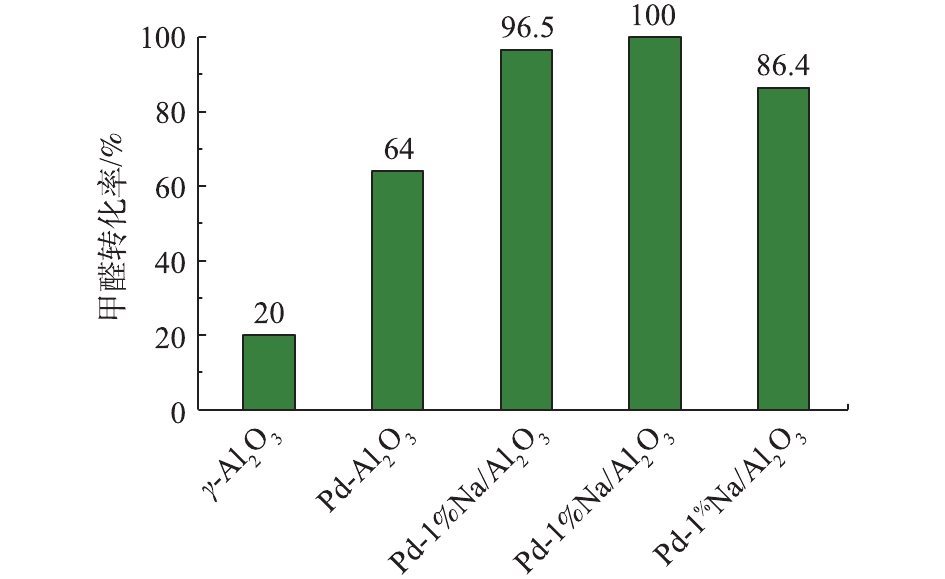
γ-Al2O3、Pd/Al2O3、Pd-1% Na/Al2O3、Pd-2% Na/Al2O3和Pd-4% Na/Al2O3催化剂在25 ℃催化氧化甲醛性能评价见图5,反应条件:反应气体中甲醛的体积分数为0.025%,WHSV=36 000 mL·(g·h)−1。可以看出,γ-Al2O3催化氧化甲醛的活性最差,25 ℃时甲醛转化率只有20.0%。负载Pd后,Pd/Al2O3催化剂催化活性提高至64.0%。同时负载Pd-Na后,Pd-1% Na/Al2O3的甲醛转化率提高至96.5%;Pd-2% Na/Al2O3的催化活性最好,甲醛转化率达到了100%,可以实现甲醛的完全氧化;而Pd-4% Na/Al2O3的甲醛转化率却降至86.4%,原因可能是Na粒子堵塞了部分微孔,覆盖了活性位Pd,使活性位减少。另外,随着Na含量增加到4%,由H2-TPR(图2)可知,催化剂Pd-4% Na/Al2O3耗氢峰的中心出现在116 ℃,相比催化剂Pd-2% Na/Al2O3,向高温偏移了15 ℃;O2-TPD(图3)中表面活性氧的脱附峰向高温方向偏移了。由此可见,Na含量增加到4%时,不利于改善催化剂的低温还原性能以及表面活性氧的脱附。甲醛转化率与Na的负载量密切相关,Na适宜负载量即质量分数为2%。
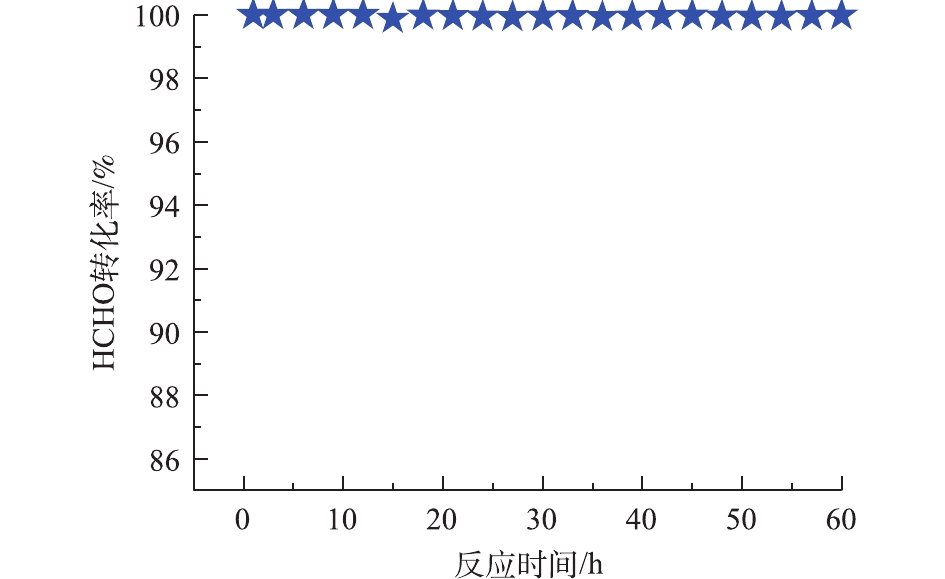
Pd-2% Na/Al2O3催化氧化甲醛的稳定性测试条件与催化氧化性能相同,间隔3 h采集数据计算HCHO转化率,结果如图6所示。连续使用60 h后,甲醛的转化率仍维持在99.0%以上,说明Pd-2% Na/Al2O3具有良好的催化稳定性。
众所周知,采用碱改性是提高催化剂的催化氧化活性的有效措施。ZHANG等[7]研究发现,碱金属物种通过促进表面OH−的形成,OH−与甲酸盐在室温下的反应,进而改变了催化氧化甲醛的途径,从而大大提高了催化剂的性能。何德东等[28]也报道了在Pt/MORn-H6催化剂中添加Na+可以提高氧化甲醛的催化活性。同时,ZHANG等[9]也发现,Na+对Pd/TiO2催化剂的催化活性有显著促进作用。除Na外,K对催化剂催化氧化甲醛的性能也能起到促进作用。引入K+离子后,催化剂表面OH−物种的存在明显提高了Ag/Co3O4催化剂的催化氧化甲醛的性能,Ag与Co的协同作用促使催化剂表面形成了更多的表面活性氧,进而Ag/Co3O4具有较高的催化氧化甲醛活性[29]。在本研究中,将Na引入到Pd/Al2O3催化体系中显著提高了催化氧化甲醛的催化活性,这是由于Na与Pd之间的强协同作用,使得催化剂具有良好的低温还原性和丰富的表面活性氧物种。因此,Pd-2% Na/Al2O3催化剂具有优异的催化活性和良好的稳定性。
3. 结论
1)采用共浸渍法制备了一系列不同Na含量的Pd-1% Na/Al2O3、Pd-2% Na/Al2O3、Pd-4% Na/Al2O3催化剂,并在室温下测试了催化氧化甲醛的性能。其中,Pd-2% Na/Al2O3催化剂在25 ℃下可完全将甲醛氧化成CO2和H2O。
2) Pd与Na之间的强协同作用使得Pd-2% Na/Al2O3催化剂具有良好的低温还原性和丰富的表面活性氧,这对甲醛在Pd-2% Na/Al2O3催化剂上的完全氧化起着至关重要的作用。Pd-2% Na/Al2O3催化剂具有良好的稳定性,连续使用60 h后,甲醛的转化率仍维持在99.0%以上。
3)该催化剂在室温下对甲醛的去除率高,活性稳定性好。因此,它在催化氧化甲醛反应中具有广阔的应用空间。
-
[1] BUSER H.R.,POIGER T.,MÜLLER M.D.Occurrence and environmental behavior of the chiral pharmaceutical drug ibuprofen in surface waters and in wastewater.Environmental Science & Technology,1999,33(15):2529-2535 [2] WEIGEL S.,BERGER U.,JENSEN E.,et al.Determination of selected pharmaceuticals and caffeine in sewage and seawater from Tromsφ/Norway with emphasis on ibuprofen and its metabolites.Chemosphere,2004,56(6):583-592 [3] SCHEYTT T.J.,MERSMANN P.,HEBERER T.Mobility of pharmaceuticals carbamazepine,diclofenac,ibuprofen,and propyphenazone in miscible-displacement experiments.Journal of Contaminant Hydrology,2006,83(1/2):53-69 [4] TERNES T.A.,BONERZ M.,HERRMANN N.,et al.Irrigation of treated wastewater in Braunschweig,Germany:An option to remove pharmaceuticals and musk fragrances.Chemosphere,2007,66(5):894-904 [5] SANTOS J.L.,APARICIO I.,ALONSO E.Occurrence and risk assessment of pharmaceutically active compounds in wastewater treatment plants.A case study:Seville city (Spain).Environment International,2007,33(4):596-601 [6] CARBALLA M.,OMIL F.,LEMA J.M.,et al.Behavior of pharmaceuticals,cosmetics and hormones in a sewage treatment plant.Water Research,2004,38(12):2918-2926 [7] GOLET E.M.,STREHLER A.,ALDER A.C.,et al.Determination of fluoroquinolone antibacterial agents in sewage sludge and sludge-treated soil using accelerated solvent extraction followed by solid-phase extraction.Analytical Chemistry,2002,74(21):5455-5462 [8] KIMURA K.,HARA H.,WATANABE Y.Elimination of selected acidic pharmaceuticals from municipal wastewater by an activated sludge system and membrane bioreactors.Environmental Science & Technology,2007,41(10):3708-3714 [9] VIENO N.M.,TUHKANEN T.,KRONBERG L.Seasonal variation in the occurrence of pharmaceuticals in effluents from a sewage treatment plant and in the recipient water.Environmental Science & Technology,2005,39(21):8220-8226. [10] KOCAMEMI B.A.,ÇEÇEN F.Cometabolic degradation of TCE in enriched nitrifying batch systems.Journal of Hazardous Materials,2005,125(1/2/3):260-265 [11] TRAN N.H.,URASE T.,KUSAKABE O.The characteristics of enriched nitrifier culture in the degradation of selected pharmaceutically active compounds.Journal of Hazardous Materials,2009,171(1/2/3):1051-1057 [12] MÉNDEZ-ARRIAGA F.,ESPLUGAS S.,GIMÉNEZ J.Photocatalytic degradation of non-steroidal anti-inflammatory drugs with TiO2 and simulated solar irradiation.Water Research,2008,42(3):585-594 [13] MÉNDEZ-ARRIAGA F.,GIMENEZ J.,ESPLUGAS S.Photolysis and TiO2 photocatalytic treatment of naproxen:Degradation,mineralization,intermediates and toxicity.Journal of Advanced Oxidation Technologies,2008,11(3):435-444 [14] ACHILLEOS A.,HAPESHI E.,XEKOUKOULOTAKIS N.P.,et al.Factors affecting diclofenac decomposition in water by UV-A/TiO2 photocatalysis.Chemical Engineering Journal,2010,161(1/2):53-59 [15] NOH T.H.,KIM D.W.,SEO S.W.,et al.Facile hydrothermal synthesis of InVO4 microspheres and their visible-light photocatalytic activities.Materials Letters,2012,72:98-100 [16] ZHANG Chuan,ZHU Yongfa.Synthesis of square Bi2WO6 nanoplates as high-activity visible-light-driven photocatalysts.Chemistry of Materials,2005,17(13):3537-3545 [17] LONG Mingce,CAI Weimin,KISCH H.Photoelectrochemical properties of nanocrystalline Aurivillius phase Bi2MoO6 film under visible light irradiation.Chemical Physics Letters,2008,461(1/2/3):102-105 [18] KOHTANI S.,TOMOHIRO M.,TOKUMURA K.,et al.Photooxidation reactions of polycyclic aromatic hydrocarbons over pure and Ag-loaded BiVO4 photocatalysts.Applied Catalysis B:Environmental,2005,58(3/4):265-272 [19] ZHANG Xi,AI Zhihui,JIA Falong,et al.Selective synthesis and visible-light photocatalytic activities of BiVO4 with different crystalline phases.Materials Chemistry and Physics,2007,103(1):162-167 [20] ZHOU Lin,WANG Wenzhong,LIU Shengwei,et al.A sonochemical route to visible-light-driven high-activity BiVO4 photocatalyst.Journal of Molecular Catalysis A:Chemical,2006,252(1/2):120-124 [21] YU Jianqiang,ZHANG Yan,KUDO A.Synthesis and photocatalytic performances of BiVO4 by ammonia co-precipitation process.Journal of Solid State Chemistry,2009,182(2):223-228 [22] SOBANA N.,SWAMINATHAN M.The effect of operational parameters on the photocatalytic degradation of acid red 18 by ZnO.Separation and Purification Technology,2007,56(1):101-107 [23] YU Jianqiang,KUDO A.Hydrothermal synthesis of nanofibrous bismuth vanadate.Chemistry Letters,2005,34(6):850-851 [24] ZHOU Lin,WANG Wenzhong,LIU Shengwei,et al.A sonochemical route to visible-light-driven high-activity BiVO4 photocatalyst.Journal of Molecular Catalysis A:Chemical,2006,252(1/2):120-124 [25] ELMOLLA E.S.,CHAUDHURI M.Photocatalytic degradation of amoxicillin,ampicillin and cloxacillin antibiotics in aqueous solution using UV/TiO2 and UV/H2O2/TiO2 photocatalysis.Desalination,2010,252(1/2/3):46-52 [26] ZHU Zhenfeng,ZHANG Lian,LI Junqi,et al.Synthesis and photocatalytic behavior of BiVO4 with decahedral structure.Ceramics International,2013,39(7):7461-7465 [27] CHEN T.F.,DOONG R.A.,LEI Wengang.Photocatalytic degradation of parathion in aqueous TiO2 dispersion:The effect of hydrogen peroxide and light intensity.Water Science and Technology,1998,37(8):187-194 [28] DURÁN A.,MONTEAGUDO J.M.,MOHEDANO M.Neural networks simulation of photo-Fenton degradation of Reactive Blue 4.Applied Catalysis B:Environmental,2006,65(1/2):127-134 [29] DHANANJEYAN M.R.,FINE E.,KIWI J.Synthetic polymer delivery system.:Sustained release of persulfate during the photo-oxidation of an azo-dye.Journal of Photochemistry and Photobiology A:Chemistry,2000,136(1/2):125-131 [30] MALATO S.,BLANCO J.,RICHTER C.,et al.Enhancement of the rate of solar photocatalytic mineralization of organic pollutants by inorganic oxidizing species.Applied Catalysis B:Environmental,1998,17(4):347-356 [31] MURUGANANDHAM M.,SWAMINATHAN M.Solar photocatalytic degradation of a reactive azo dye in TiO2-suspension.Solar Energy Materials and Solar Cells,2004,81(4):439-457 [32] LEE Y.C.,LO S.L.,CHIUEH P.T.,et al.Efficient decomposition of perfluorocarboxylic acids in aqueous solution using microwave-induced persulfate.Water Research,2009,43(11):2811-2816 [33] XU Xiangrong,LI Xiangzhong.Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion.Separation and Purification Technology,2010,72(1):105-111 [34] ZHANG Nan,LIU Guoguang,LIU Haijin,et al.Diclofenac photodegradation under simulated sunlight:Effect of different forms of nitrogen and Kinetics.Journal of Hazardous Materials,2011,192(1):411-418 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2894
- HTML全文浏览数: 2474
- PDF下载数: 470
- 施引文献: 0



 DownLoad:
DownLoad: