铝易拉罐/Fe (Ⅱ)/O2体系降解对氨基苯胂酸的机理
Mechanism of degradation of p-arsanilic acid in aluminum beverage cans (AlBCs)/Fe(Ⅱ)/O2 system
-
摘要: 对氨基苯胂酸是一种常见的有机胂化合物,常作为饲料添加剂用于畜牧业。研究了在酸性条件下(pH2体系降解水中的对氨基苯胂酸的机理。通过对各种实验参数如pH值、Fe(Ⅱ)的浓度、羟基自由基清除剂和气体氛围等条件的考察,发现:在酸性条件下,零价铝发生电子转移,体系中的溶解氧和水得电子生成过氧化氢,在外加Fe(Ⅱ)的条件下,促进了芬顿反应的发生,产生强氧化性的物质(·OH),实现对对氨基苯胂酸的氧化降解。Abstract: The p-arsanilic acid is a common organic arsenic compound often used as a additive in livestock feed. In this study,we investigated the mechanism of p-arsanilic acid degradation utilizing an Al beverage cans (AlBCs)/Fe(Ⅱ)/O2 system under acidic conditions (pHp-arsanilic acid degradation. Under acidic conditions,zero-valent aluminum underwent electron transfer,and synchronously,the dissolved oxygen and H2O produce electron-generated H2O2. In the presence of Fe(Ⅱ),the Fenton reaction was promoted,and the strongly oxidizing species (·OH) generated degraded the p-arsanilic acid.
-
Key words:
- p-arsanilic acid /
- Al beverage cans /
- Fenton reaction
-
人造高分子聚合物塑料由于其延展性好、种类多样、成本低、经久耐用,被广泛应用于工业、农业、医药、市政等多个领域,同时给全球环境带来了巨大的塑料污染问题。 在全球范围内,只有18%的塑料垃圾被回收,24%被焚烧,其余大部分塑料垃圾被填埋或丢弃在土壤环境中,造成污染,危害生态环境[1]。 释放到环境中的塑料由于物理、化学和生物作用发生老化和降解,最终形成微塑料。2004年科学家首次提出“微塑料”概念[2],后来被定义为“直径或长度小于5 mm的塑料颗粒、碎片或纤维”[3]。
已有研究表明微塑料在环境中具有丰度高、传输距离长、分布广泛的特性。 近年来,微塑料不仅大量出现在海水及海洋沉积物中,而且在极地冰川和高原湖泊中也被检测出[4-5]。 随着微塑料相关研究的不断深入开展,研究人员发现微塑料会随着食物链不断迁移、累积,最终可能对人类健康造成威胁[6]。 微塑料污染问题已引起人们的特别关注,成为近年来环境污染最重要的主题之一[7-8]。但目前人们对微塑料在河口海岸区域的分布特征及生物效应认识还不充分。 本文围绕微塑料在全球范围内不同地理位置(包括大西洋、太平洋、欧洲、亚洲、非洲等)河口海岸区域内不同环境介质(表层水和沉积物)中的丰度、类型、尺寸等分布特征,以及微塑料在河口海岸区域的生物摄入、生物毒性、微生物效应等方面进行了综述,并对未来的研究重点进行了展望。
1. 微塑料的环境分布特点(Occurrence and distribution of microplastics)
微塑料污染问题是全球范围内问题,研究表明在世界范围内的河口海岸环境中已检测到微塑料的赋存[9-27](表1),无论是发达国家还是发展中国家,甚至无人居住的北极海洋区域[28]以及深海底部[29],微塑料都有被检测到,最高浓度可以达到172000—519000个·m−3[21],主要种类为聚乙烯、聚丙烯、聚对苯二甲酸乙二醇酯、聚酰胺、聚苯乙烯,主要形状包括纤维状和碎片状。
表 1 河口海岸环境中微塑料分布特点Table 1. Characteristics of microplastics in estuarine and coastal environments研究区域Study area 样本来源Sample source 微塑料种类Microplastic type 微塑料尺寸Microplastic size 微塑料丰度Microplastic abundance 微塑料形状Microplastic shape 参考文献Reference 新南威尔士州海港 沉积物 聚对苯二甲酸乙二醇酯、尼龙 0.1—3 mm 83—350 particles·kg−1 球粒、纤维 [18] 德国莱茵河和梅因河地区 沉积物 聚乙烯、聚丙烯、聚苯乙烯 0.063—5 mm 4000 particles·kg−1 碎片 [25] 阿尔及利亚安纳巴湾 沉积物 聚乙烯、聚丙烯、聚对苯二甲酸乙二醇酯、聚苯乙烯 纤维状:(2.16 ± 0.34) mm薄膜状:(2.14 ± 0.19 )mm泡沫状:(1.87 ± 0.16 )mm碎片状:(1.82 ± 0.16 )mm颗粒状:(0.81 ± 0.06) mm (649.33 ± 184.02) particles·kg−1 纤维、碎片、薄膜、泡沫、颗粒 [10] 西北太平洋 表层水 聚乙烯、聚丙烯、聚酯、聚苯乙烯、聚乙烯-聚丙烯共混物、聚对苯二甲酸乙二醇酯、聚酰胺 0.3—5 mm 2.7 × 103—2.2 × 105 items·km−2 碎片、颗粒、纤维、线、膜、泡沫 [16] 太平洋东北部、不列颠哥伦比亚海岸 表层水 — (606 ± 221) μm 8—9180 particles·m−3 纤维、碎片 [27] 阿拉伯海湾 表层水 聚乙烯、聚丙烯、聚对苯二甲酸乙二醇酯 1—5 mm 4.38×106—1.36×106 items·km−2 纤维 [23] 孟加拉湾 表层水 聚乙烯、聚丙烯 — (2.04 ± 2.26) items·m−2 碎片 [9] 印度南安达曼海滩 沉积物 聚丙烯、聚苯乙烯、聚氯乙烯、聚丁二烯 500—1000 μm (414.35±87.4) particles·kg−1 碎片、纤维 [12] 印度普杜切里海滩 沉积物 聚丙烯、聚乙烯、聚苯乙烯、聚氨酯 300 μm—1 mm (720.30 ± 191.60) particles·kg−1 碎片 [19] 韩国南部海岸 表层水 油漆 — (195 ± 114) particles·L−1 颗粒 [26] 越南城市河流 表层水 聚乙烯、聚丙烯、聚对苯二甲酸乙二醇酯 50—250 μm 172000—519000 items·m−3 纤维、碎片 [21] 南沙群岛 表层水 聚氯乙烯、聚酰胺、聚乙烯 < 0.5 mm 1733 items·m−3 微珠 [17] 珠江口 表层水 聚酰胺、玻璃纸 < 0.5 mm 8902 items·m−3 薄膜、碎片 [15] 中国胶州湾 表层水 聚对苯二甲酸乙二醇酯、聚丙烯、聚乙烯、聚酰胺、聚氯乙烯 < 4 mm 20—120 items·m−3 纤维 [14] 沉积物 聚对苯二甲酸乙二醇酯、聚丙烯、聚乙烯、聚酰胺、聚氯乙烯、聚苯乙烯 < 4 mm 7—25 items·kg−1 纤维 [14] 黄河近河口 表层水 聚乙烯、聚丙烯、聚苯乙烯 < 0.2 mm 旱季:930 item·L−1、雨季:497 item·L−1 纤维 [13] 北黄海表层 表层水 聚乙烯 < 1 mm (545 ± 282) items·m−3 薄膜、纤维 [20] 椒江河口、瓯江河口、闽江河口 表层水 聚乙烯、聚丙烯 0.5—5 mm (955.6 ± 848.7) items·m−3、(680.0 ± 284.6) items·m−3、(1245.8 ±531.5) items·m−3 纤维、颗粒 [24] 南海北部 表层水 聚乙烯 1—1.9 mm 0.26—0.84 items·m−3 纤维 [11] 渤海 表层水 聚乙烯、聚丙烯、聚苯乙烯 0.005—23.5 cm (0.33±0.34) particles·m−3 碎片、纤维、薄膜 [22] 微塑料在河口海岸区域的分布具有明显的地域性。毗邻大西洋和太平洋的河口海岸环境中微塑料的丰度更高,粒径更小。这种分布特征可能和全球大洋环流作用有关。 在欧洲毗邻大西洋的区域,例如德国莱茵河和梅因河地区,其沉积物中微塑料丰度达到4000颗·kg−1[25],最小粒径为63 μm[25];在太平洋地区,包括太平洋东北部以及不列颠哥伦比亚海岸,其表层水中微塑料丰度可以达到9180 颗· m−3[27];靠近太平洋及南海的南亚地区,比如越南城市河流,其表层水中微塑料的丰度更是高达172000—519000个·m−3 [21],粒径最小达到50 μm [21];然而,在非洲毗邻地中海区域,如阿尔及利亚安纳巴湾,其沉积物中微塑料丰度远低于欧洲、太平洋地区以及南亚地区,为(649.33 ± 184.02)颗·kg−1 [10],最小粒径也较大,为810 μm [10](表1)。
微塑料在河口海岸的赋存丰度表现出表层水高于沉积物的特征。 例如,世界范围内,微塑料在河口海岸沉积物中最高丰度为4000 颗·kg−1 [25],而在表层水中最高丰度可以达到172000—519000 颗· m−3[21]; 同时,在中国胶州湾沉积物中检测到的微塑料丰度为7—25 颗·kg−1 [14],而其在表层水中丰度较高,为20—120 颗· m−3[14]。
也有研究表明,微塑料在水环境中的分布会受到降水量的影响,例如在长江口及其邻近海域的分布受流域降水量影响,洪季微塑料含量明显高于枯季含量[30],而在黄河近河口,旱季微塑料浓度明显高于雨季[13]。
此外,微塑料的分布可能受到人类活动影响。例如中国珠江口[31]、加拿大安大略湖区[32]、德国莱茵河区[25]和仁川地区[33]是人口聚居地区,这些地区环境中微塑料主要以聚乙烯和聚苯乙烯为主。聚乙烯和聚苯乙烯主要应用于饮料包装、塑料袋或一次性餐具等生活垃圾,而北极极地地区的微塑料主要来自各地的垃圾在全球大洋环流作用下的漂流[34],各种形式微塑料含量相对平均。
微塑料在中国的分布呈现出部分中国本土化特征。 河口海岸区域如长江口[35]、渤海海岸[36]、东海象山港海域[[37]、南海北部湾海域[38]的微塑料污染相对严重,在水体和沉积物中都检测到较高浓度的微塑料,这些微塑料的来源和人类工业活动密切相关。 在城市水系如台州椒江、温州瓯江、福州闽江、珠江、雅鲁藏布江、怒江[24, 39-41]同样检测到了一定浓度的微塑料。长江口潮滩沉积物中微塑料检测结果显示的平均丰度为(3.42±1.31)颗·g−1,其中纤维状占主要部分[42]。 长江口潮滩沉积物中微塑料丰度在1月达到最高值[42]。
2. 微塑料在河口海岸环境中的归趋:生物膜的影响(Fate of microplastics in estuarine and coastal environments: effects of biofilms)
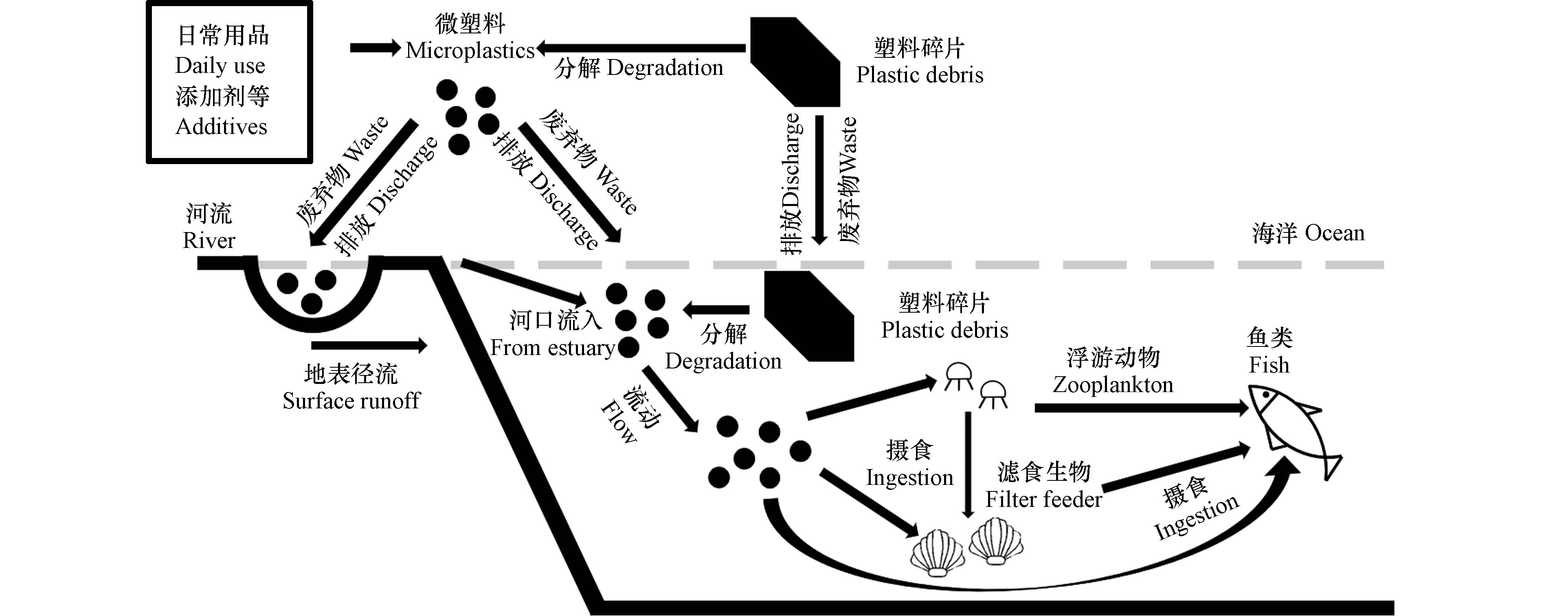
河口海岸区域汇聚了全球44%以上的人口,人类活动对近岸海域造成的环境压力也在不断增大。2015年全球塑料生产量已达到2.69亿吨,其中得到有效回收利用的塑料为750万吨,至2020年全球塑料生产量已达到3.67亿吨[43],更多的塑料会进入环境中。 粒径小于5 mm的微塑料粒径较小,化学稳定性高,被排入水环境中难以被自然降解,可在水环境中存在数百至千年。微塑料进入环境后,在地表径流或洋流作用下,最终在河口海岸及海洋中赋存(图1)。
微塑料可以成为微生物或海洋藻类的生长附着载体,进入海洋环境后的微塑料一周就可以形成附着牢固的生物膜。 表面生物膜的形成对微塑料的环境行为和归趋有重要影响。 微塑料被微生物或藻类附着形成生物膜后,亲水性显著性增强,密度增大,从水体表面向水底下沉,导致微塑料在海底不断沉积积聚[44]。 海洋中与日俱增的塑料垃圾威胁到海洋生物的生存并逐漸造成经济损失。 微塑料被微生物或藻类附着形成生物膜后极易被海洋生物摄入体内[45]。微塑料随着海洋生物的摄食直接进入生物体内,被摄入后微塑料会随着纤毛运动转移至消化系统中的消化腺以及初级、次级消化道。 此外,微塑料随着海洋生物通过鳃部过滤海水黏附在海洋生物鳃部的微绒毛上,之后通过胞吞作用直接被海洋生物摄入到体内。 低级海洋生物对微塑料的摄入表明微塑料进入海洋食物网是从最底层开始的,进而在食物链中进行传递富集。
3. 微塑料的载体效应:污染物富集及生物入侵(Vector effects of microplastics: pollutant enrichment and biological invasion)
微塑料进入环境后,其自身含有的化学添加剂,如抗紫外线剂、色素、阻燃剂、增塑剂等,会随着微塑料与海水接触释放到海水当中。 同时微塑料颗粒较小,拥有较大的比表面积,能够作为被动采样装置不断吸附各种污染物。 吸附实验表明,聚丙烯颗粒暴露6 d后,颗粒内多氯联苯(PCBs)和1,1-双(对氯苯基)-2,2-二氯乙烯(DDE)的质量比显著性增大[46]。 因此海洋中的微塑料既会成为污染物的来源,又会成为有毒污染物的传播载体。 原生的微塑料颗粒特别适合作为有机污染物或者增塑剂等的载体,毒性显著性强于滞留颗粒[47]。实验证明,聚氯乙烯和聚乙烯可以吸附和释放出二氯二苯三氯乙烷(DDT),苯丙氨酸(Phe),全氟辛酸以及邻苯二甲酸二(2-乙基)己酯(DEHP)[48]。 同时微塑料的结晶程度和表面特征会对污染物在不同密度微塑料中的扩散系数产生影响,进而影响其对污染物的吸附容量[49]。此外,微塑料为细菌、病毒、真菌、藻类等生物定殖形成生物膜提供了较为理想的局部生态环境。 研究表明,微塑料表面生物膜能够促进重金属在微塑料碎片上的积累[50]。 以Pb(Ⅱ)为例,生物膜不仅提升了微塑料吸附Pb(Ⅱ)的能力,并且增强了微塑料和Pb(Ⅱ)的联合毒性[51]。通过微塑料颗粒与铬的联合暴露实验发现,微塑料颗粒的存在使鱼类对高浓度铬的摄入能力显著性上升,铬与微塑料之间存在着明显的相互作用[52]。从牡蛎中分离出的微塑料表面吸附有微量金属铬、锰、镍、铜、锌、镉和铅,同时,微塑料的体内浓度与四种微量金属(镉、铬、铜和铅)的体内浓度之间存在相关性,这表明微塑料与微量金属之间存在潜在的体内相互作用[53]。 微塑料暴露会增加可吸附铜离子对条纹鲮脂鲤的毒性[54],造成红鳌螯虾脂质代谢紊乱[55]。
塑料碎片表面生物膜的形成会进一步促进其他小型生物附着到塑料表面,形成复杂的塑料生态圈。 海水中漂浮的塑料碎片为一些小型海洋生物提供了附着的载体,包括海藻、海草、苔藓虫、藤壶类、多毛纲蠕虫、水螅类和软体动物等易于附着的物种,其中一些物种甚至有一定攻击性[56]。 塑料碎片随着大洋环流不断流动,成为这些海洋生物迁徙的载体,依附于塑料碎片表面的海洋生物也同时随着塑料碎片的流动迁徙到不同的生态环境中[56-57]。 随着微塑料的迁移流动,微塑料表面吸附的海洋生物迁徙至其他纬度地区的机会大大增加,造成附着物种的远距离随机扩散和生物入侵,严重影响生物分布的规律以及干扰本地物种的生态平衡,危害海洋生态系统健康与安全[57],对生态环境带来不可估量的长远影响[56]。 海洋生物的附着迁徙一直是外来物种入侵的主要途径, 微塑料的载体效应引起的生物入侵问题亟须更多深入研究。
4. 海洋生物对微塑料的摄入:海洋生物体内微塑料丰度(Ingestion and accumulation of microplastics in marine organisms)
微塑料在海洋生物体内被广泛检测到[58-72](表2),表明微塑料可能随着食物链进入人类体内。海洋浮游动物是最容易受微塑料摄入影响的生物。 浮游动物可以摄入微塑料,虽然部分微塑料颗粒可以通过粪便等方式被排泄出,但大部分微塑料难以通过自身净化能力被排出而保留在体内[58]。海洋环境中的悬食浮游生物[58]和腐生生物随着摄食浮游动物和粪便,可能摄入这些排出的微塑料颗粒;而底栖生物具有生物扰动能力,可以使表层水与沉积层之间不断形成循环,微塑料颗粒也可能随着循环沉降到海底沉积层并随之被底栖生物摄入[69]。
表 2 海洋生物体内微塑料丰度Table 2. Ingestion and accumulation of microplastics in marine organisms调查物种Investigated species 国家Country 区域Region 微塑料丰度Microplastic abundance 参考文献Reference 鱼类 印度 东南沿海 0.1—5.3 items·individuals−1 [61] 鱼类 澳大利亚 悉尼港 0.2—4.6 items·individuals−1 [66] 鱼类 西班牙 巴利阿里群岛 2.47—4.89 items·individuals−1 [67] 鱼类 美国 东海岸 1.8—110 items·individuals−1 [62] 鱼类 哥斯达黎加 太平洋沿岸 32—42 items·individuals−1 [64] 鱼类 南非 南非沿海 2.8—4.6 items·individuals−1 [59] 鱼类 英国 英吉利海峡海域 3.89 items·individuals−1 [72] 贝类 土耳其 土耳其海岸 0.69 items·individuals−1 [63] 贝类 土耳其 黑海 1.69—4 items·individuals−1 [60] 贝类 法国、比利时、荷兰 沿岸海域 (0.2 ± 0.3) items·g -1 [68] 贝类 中国 东部沿海 2.1—10.5 items·g -1 [69] 贝类 伊朗 波斯湾 0.2—21.0 items·g -1 [65] 浮游动物 韩国 南部海域 雨季前:0.016 items·individuals−1雨季后:0.004 items·individuals−1 [70] 浮游动物 中国 渤海 8月:0.117 items·individuals−111月:0.056 items·individuals−1 [58] 浮游动物 加拿大 太平洋东北海域 0.029 items·individuals−1 [71] 磷虾 加拿大 太平洋东北海域 0.059 items·individuals−1 [71] 肺线虫 法国、比利时、荷兰 沿岸海域 (1.2 ± 2.8) items·g -1 [68] 这些生物对微塑料的摄入意味着微塑料的累积可能是从食物链的最底端开始[70-71]。 人类常食用的鱼类等水产品同样无法避免微塑料污染,美国东海岸鱼类体内微塑料丰度最高可达每条110颗[61-64, 66-67]。 中国作为水产品消费大国,微塑料污染情况不容乐观,贝类、牡蛎等滤食性生物体内的微塑料含量相对较高[68-69]。通过对中国21种海水鱼体内的微塑料丰度进行研究发现最高丰度可达到每条鱼7.2颗[73].
随着营养级的提高,微塑料在海洋生物体内浓度呈现一定正相关。 位于底层的浮游动物,每17—34只个体体内会检测到1个微塑料碎片[71],软体动物如紫贻贝,线虫等生物的体内微塑料丰度达每克组织有1.2—4.0个微塑料[68]。 而位于更高营养级的鱼类,其摄入微塑料的数量及形式都远远高于低营养级生物,在人们常食用的金枪鱼等鱼类中,一只鱼体内可以有高达110个微塑料碎片的存在(每条1.8—110颗)[62]。
5. 微塑料暴露对海洋生物的毒性效应(Toxicity of microplastics on marine organisms)
研究证实微塑料能够被生物摄入并在生物体内富集。实验室微塑料暴露会对各种海洋、潮滩生物产生各种毒性效应(表3)。
表 3 微塑料暴露对海洋生物的毒性效应Table 3. Toxicities of microplastic exposure on marine organisms物种Species 物种拉丁名Latin name of species 微塑料种类Microplastic type 尺寸Size 暴露浓度Exposure concentration 毒性效应Toxicity 参考文献Reference 大黄鱼 Large yellow croaker 聚苯乙烯 100 μm — 肠道菌群结构发生改变,肠道呈现不健康状态 [75] 杜氏双边鱼 Pisces duobula latera 聚对苯二甲酸乙二醇酯 2 mm 0.025、0.055、0.083、 0.1 mg·L−1 生长缓慢、存活率下降 [95] 眼斑双锯鱼 Ocellaris Amphiprius 聚乙烯 180—212 mm 0.04、0.2、0.4、 2 mg·L−1 摄食行为发生改变 [84] 云纹石斑鱼 Clouded grouper 聚苯乙烯 20—100 μm 2.0、20 mg·g−1 造成肝脏脂质代谢紊乱 [86] 三刺鱼 Tres lapides 聚乙烯 球状27—32 μm纤维状500 μm 100 000 particles·L−1 微塑料在肠道和鳃中滞留 [76] 罗非鱼 Tilapia mossambica 聚苯乙烯 0.3、 5、70—90 μm 0.1 mg·L−1 造成神经毒性和氧化应激、影响肝脏代谢 [88] 尖齿胡鲶 Clarias gariepinus 聚氯乙烯 (95.41 ± 4.23) μm 0.5%、1.5%、3.0% of diet 造成氧化应激和肝脏损伤 [89] 尖齿胡鲶 Clarias gariepinus 聚氯乙烯 (95.41 ± 4.23) μm 0.50%、1.50%、3.0% of diet 造成神经毒性和氧化应激 [89] 突唇白鲑 Salmonium album labiis arrogantibus 聚苯乙烯 90 mm 7.5、30 particles·mL−1 子代未获得遗传适应性 [92] 白鲷 Culptor albus 聚苯乙烯 500—1000 μm 4241 particles·m−3 摄食行为改变 [85] 光鱾 Light 聚苯乙烯 8 μm 0.001、 0.01 g·d−1 造成肠道损伤 [77] 褐鳟 Brown trout 聚乙烯,聚对苯二甲酸乙二醇酯,聚苯乙烯 3000 μm 2.8 mg·L−1 造成遗传毒性 [91] 虹鳟 Rainbow trouba 聚苯乙烯 220 nm 50 mg·L−1 造成细胞毒性和基因毒性 [96] 黑头软口鲦 Pimephales promelas 轮胎橡胶颗粒 38—355 μm 300、1900、 6000 mg·L−1 被摄食并在消化道内积累 [65] 条纹鲮脂鲤 Prochilodus lineatus 聚乙烯 10—90 μm 0.02 mg·L−1 增加可吸附铜离子对条纹鲮脂鲤的毒性 [54] 泥鳅 Loach 聚氯乙烯 < 10 μm 50 mg·L−1 造成肝脏损伤 [90] 贻贝 Mytilus edulis 高密度聚乙烯 0—80 μm 2.5 g·L−1 影响免疫和溶酶体膜稳定性 [80] 太平洋牡蛎 Crassostrea gigas 聚苯乙烯 2 、 6 μm 0.023 mg·L−1 影响生长发育和生殖细胞质量 [97] 日本新糠虾 Neomysis Japonia 聚苯乙烯 5 μm 10 mg·mL−1 降低摄食率、改变捕食行为 [86] 丰年虾 Met shrimps 聚苯乙烯 1、 3、 6、10 μm 1 、1000 particles·mL−1 乙酰胆碱酯酶(AChE)活性被显著抑制 [81] 白虾 White shrimp 聚苯乙烯 44 μm 50 μg·mL−1 肠道微生物活性发生改变 [98] 红鳌螯虾 Cherax quadricarinatus 聚苯乙烯 200 μm 0、0.5、5 mg·L−1 造成脂质代谢紊乱 [55] 中华绒鳌蟹 Eriocheir sinensis 聚苯乙烯 5 μm 0、0.04、 0.4、4、40 g·L−1 肠道菌群组成和多样性发生改变 [82] 沙蚕 Arenicola marina 聚苯乙烯 400—1300 μm 0、1、10、100 g·L−1 影响摄食活跃性和生长 [48] 海胆 Tripneustes gratilla 聚乙烯 25—32 μm 1—300 particles·mL−1 生物放大效应 [79] 桡足类 Calanus helgolandicus 聚苯乙烯 20 μm 75 particles·mL−1 摄食量、死亡率、卵形态等发生改变 [78] (1)微塑料会在海洋生物的胃部、肠道等消化系统的绒毛上聚集并且产生毒性效应。 通过对大型海洋生物如鱼类、鲸类等的消化器官消解检测,证实微塑料会在其消化系统中富集[74-77]。 3种常见的食用鱼类,大西洋鲱鱼、沙丁鱼和欧洲鳀鱼的胃部都有微塑料被检测到[72]。 海洋生物在摄入微塑料后,易导致消化道堵塞,摄食能力受到影响,进而影响其生存。桡足类动物摄入微塑料后,随着时间推移,摄食量下降,生物质碳持续降低,对其自身的生长发育产生负面影响[78]。 摄入微塑料后,海胆幼虫能够在数小时内将胃部的聚乙烯颗粒排出。相比之下,环境浓度的微塑料颗粒对海胆等无脊椎动物幼虫产生的威胁有限[79]。 微塑料进入消化系统后会引起消化系统细胞发生一些重要的组织学变化,并且引发炎症反应、粒细胞血症的形成和溶酶体失稳,这些症状会随着暴露时间延长而增强[80]。 此外,微塑料会造成丰年虾乙酰胆碱酯酶(AChE)活性被显著抑制[81]。
(2)微塑料暴露会造成海洋生物肠道微生物的活性和群落结构改变,例如造成鳌蟹的肠道菌群组成和多样性发生改变[82],白虾肠道中微生物活性发生改变[72],以及大黄鱼肠道菌群变化,肠道呈现不健康状态[75]。此外,也有实验通过将微塑料暴露在河口水样中,检测到微塑料表面会形成生物膜,且证明微塑料自身类型会影响生物膜群落结构[83]。
(3)微塑料暴露会对生物造成神经毒性,改变生物的行为。例如,微塑料暴露可以对罗非鱼和尖齿胡鲶造成神经毒性,使眼斑双锯鱼[84]和白鲷[85]的摄食行为产生变化,降低日本新糠虾的摄食率,使其捕食行为减弱[86],以及降低斑马鱼的游泳能力,减少其游泳速度和距离[87]。
(4)微塑料暴露会对生物造成肝脏毒性。例如,微塑料暴露可以造成云纹石斑鱼肝脏脂质代谢紊乱[86],影响罗非鱼的肝脏代谢[88],造成尖齿胡鲶[89]和泥鳅[90]肝脏损伤。 微塑料暴露会引起罗非鱼[88]和尖齿胡鲶[89]产生氧化应激。
(5)微塑料颗粒对生物的繁殖能力有着负作用。 微塑料暴露对褐鳟可以造成遗传毒性[91],导致突唇白鲑的子代无法获得遗传适应性[92]。 经聚苯乙烯微塑料颗粒暴露过后,桡足动物的产卵率、卵的大小和孵化率都受到抑制作用[78]。 通过冲刷暴露方式,发现微塑料暴露后的成年太平洋牡蛎与正常情况下生长的太平洋牡蛎相比较,产生的配子和受孕率都会大大降低;且经过微塑料暴露的亲本产生的幼体牡蛎生长速率较正常牡蛎缓慢,证实了微塑料对于太平洋牡蛎的繁殖能力及其子代的生长发育存在一定的不利影响[83]。 微塑料颗粒增大海胆异常胚胎发育的机率为58.1%—66.5%,其中在海滩滞留的微塑料颗粒毒性要小于原生微塑料颗粒[47]。此外,微塑料暴露会干扰斑马鱼的生殖功能,虽然不会对其产生继代影响[93],但是会增加亲代体内的氧化应激,甚至造成雄性斑马鱼生殖器官出现明显细胞凋亡[94]。
6. 结论及展望(Conclusion and prospect)
我国是一个拥有1.8万公里海岸线的海洋大国,微塑料污染的研究对我国河口海岸区域环境保护与生态毒性效应评估有着重要意义,同时,微塑料生物效应的研究对我国物种多样性资源的保护及水产养殖行业的发展有着重要意义[99]。 目前关于河口海岸环境中微塑料的赋存特征及生物效应研究,国内外学者已取得重要成果,包括检测到河口海岸区域水体和沉积物中微塑料的分布,观察到微塑料在海洋生物体内的富集现象,以及掌握了微塑料表面形成生物膜的证据,对研究微塑料的生物降解提供了新的思路,使人们对微塑料在河口海岸区域的污染现状有了更深刻的认识。 但目前关于微塑料生物效应的研究以实验室高浓度下微塑料暴露研究为主,且在微塑料对生物体的复合毒性效应方面认识不充分,亟待开展环境生物样品中微塑料污染,如微塑料进入生物的途径、进入生物体内后的组织分布及毒性效应等,以及开展微塑料复合毒性效应研究,如微塑料和其他有机污染物或重金属污染物复合污染的生物毒性效应研究。 微塑料进入海洋生物体后,可能进入食物链,经过食物链传递及生物放大效应,最终可能进入人体并对人类健康造成影响。 但目前人们对微塑料在食物链中的累积、传递相关认识还不充分,亟需开展微塑料通过海洋生物食物链对人类健康可能造成的风险相关研究。 此外,目前微塑料的环境研究主要集中于近岸海域水体及内陆水系和沉积物,针对我国河口海岸区域重要的土地资源潮滩区域研究较少,亟需时间尺度上对微塑料的长期变化监测。
因此在后续研究中,建议重点研究:(1)环境生物样品中微塑料污染途径及毒性效应研究。 实验室内的研究结果与自然环境存在偏差,从真实环境中进行样本获取,研究微塑料在生物体内的分布特征、微塑料进入生物体的途径和机制、以及微塑料造成生物毒性的机制,能够提高人们对微塑料危害的认识;(2)微塑料复合毒性效应研究。 微塑料由于尺寸小,且对有机污染物和重金属具有一定程度的吸附作用,能够作为其他污染物的良好“载体”,可能对生物造成复合毒性效应,产生除微塑料本身颗粒物效应外新的毒性效应。研究微塑料的复合毒性效应及机制能够加深人们对微塑料生物毒性的认知;(3)微塑料的食物链累积、传递效应研究。现有研究已充分表明微塑料可以进入生物体内,并在生物体内造成积累,但是并不清楚其是否可以通过食物链传递最终对人类健康造成影响。 研究微塑料的食物链效应能够使人们充分认识微塑料污染对人类健康可能造成的风险;(4)我国河口海岸区域重要土地资源潮滩区域微塑料的长期变化研究。 目前缺乏对环境中微塑料污染长期监测的数据,开展重要土地资源潮滩区域微塑料的长期变化研究可以掌握微塑料环境分布的动态过程,能够为研究环境中微塑料的归趋、以及开展微塑料污染精准治理提供重要参考。
-
[1] DUTTA P K,PEHKONEN S O,SHARMA V K,et al. Photocatalytic oxidation of arsenic(Ⅲ):Evidence of hydroxyl radicals[J]. Environmental Science & Technology,2005,39(6):1827-1834 [2] 李优平,王玉霞,段晋明,等. 硫酸钛混凝去除无机砷(Ⅲ)的效能[J]. 环境工程学报,2015,9(6):2875-2879 [3] ADAK A,MANGALGIRI K P,LEE J,et al. UV irradiation and UV-H2O2 advanced oxidation of the roxarsone and nitarsone organoarsenicals[J]. Water Research,2015,70:74-85 [4] JIANG Bo,GUO Jianbo,WANG Zhaohui,et al. A green approach towards simultaneous remediations of chromium(Ⅵ)and arsenic(Ⅲ) in aqueous solution[J]. Chemical Engineering Journal,2014,262:1144-1151 [5] NACHMAN K E,RABER G,FRANCESCONI K A,et al. Arsenic species in poultry feather meal[J]. Science of the Total Environment,2012,417-418:183-188 [6] WANG Fumin,CHEN Zhangliu,ZHANG Lu,et al. Arsenic uptake and accumulation in rice (Oryza sativa L.)at different growth stages following soil incorporation of roxarsone and arsanilic acid[J]. Plant and Soil,2006,285(1/2):359-367 [7] ZHU Xiangdong,WANG Yujun,LIU Cun,et al. Kinetics,intermediates and acute toxicity of arsanilic acid photolysis[J]. Chemosphere,2014,107:274-281 [8] CZAPLICKA M,BRATEK L,JAWOREK K,et al. Photo-oxidation of p-arsanilic acid in acidic solutions:Kinetics and the identification of by-products and reaction pathways[J]. Chemical Engineering Journal,2014,243:364-371 [9] GARBARINO J R,BEDNAR A J,RUTHERFORD D W,et al. Environmental fate of roxarsone in poultry litter. I. Degradation of roxarsone during composting[J]. Environmental Science & Technology,2003,37(8):1509-1514 [10] DATTA R,SARKAR D,SHARMA S,et al. Arsenic biogeochemistry and human health risk assessment in organo-arsenical pesticide-applied acidic and alkaline soils:An incubation study[J]. Science of the Total Environment,2006,372(1):39-48 [11] ZHENG Shan,JIANG Wenjun,CAI Yong,et al. Adsorption and photocatalytic degradation of aromatic organoarsenic compounds in TiO2 suspension[J]. Catalysis Today,2014,224:83-88 [12] HU Ping,LIU Yukun,JIANG Bo,et al. High-efficiency simultaneous oxidation of organoarsenic and immobilization of arsenic in Fenton enhanced plasma system[J]. Industrial & Engineering Chemistry Research,2015,54(33):8277-8286 [13] WU C C,HUS L C,CHIANG P N,et al. Oxidative removal of arsenite by Fe(Ⅱ)-and polyoxometalate (POM)-amended zero-valent aluminum (ZVAl)under oxic conditions[J]. Water Research,2013,47(7):2583-2591 [14] LEE J,KIM J,CHOI W. Oxidation on zerovalent iron promoted by polyoxometalate as an electron shuttle[J]. Environmental Science & Technology,2007,41(9):3335-3340 [15] BOKARE A D,CHOI W. Zero-valent aluminum for oxidative degradation of aqueous organic pollutants[J]. Environmental Science & Technology,2009,43(18):7130-7135 [16] 廖玉海. 无机阴离子P4O136-和SO42-对零价铁降解污染物活性的影响[D]. 武汉:华中师范大学,2014 [17] 曹贝佩. 零价铝/氧界面活性氧的原位生成及其对水中对乙酰氨基酚的去除作用[D]. 杭州:浙江工业大学,2012 [18] MARTIN R B. The chemistry of aluminum as related to biology and medicine[J]. Clinical Chemistry,1986,32(10):1797-1806 [19] VANCE G F,STEVENSON F J,SIKRA F J. Environmental chemistry of aluminum-organic complexes[M]//SPOSITO G. The Environmental Chemistry of Aluminum. 2nd ed. New York:CRC Lewis Publishers,1995 [20] CHEN Wanru,HUANG C H. Surface adsorption of organoarsenic roxarsone and arsanilic acid on iron and aluminum oxides[J]. Journal of Hazardous Materials,2012,227-228:378-385 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2528
- HTML全文浏览数: 2086
- PDF下载数: 414
- 施引文献: 0



 DownLoad:
DownLoad: