微生物燃料电池降解邻苯二甲酸酯及同步产电特性
Phthalic acid esters degradation and electricity generation using microbial fuel cell
-
摘要: 构建双室微生物燃料电池(MFC)装置,研究了分别以乙酸钠(NaAc)作单一燃料和乙酸钠+邻苯二甲酸酯(PAEs)作混合燃料条件下,MFC的产电性能及其对邻苯二甲酸酯的去除效果。结果显示,微生物燃料电池对邻苯二甲酸酯类废水的化学需氧量(COD)的总去除率可达89%~94%,对邻苯二甲酸酯的去除率均在70%以上。以2 g·L-1 NaAc+10 mg·L-1 PAEs作混合燃料时,MFC获得最大(面积)功率密度58.78 mW·m-2,电池内阻213.50 Ω。实验结果表明,MFC能够利用高浓度邻苯二甲酸酯作燃料,在实现高效降解的同时稳定地向外输出电能,这为环境激素类难降解有机物的高效低耗处理提供了一种新的研究思路。Abstract: A two-chambered microbial fuel cell was designed,and its capability of electricity production and simultaneous phthalate biodegradation using sodium acetate and sodium acetate+phthalate fuels was examined. The results showed that at the end of the electricity generation cycle,the chemical oxygen demand decreased from 89% to 94%,and the phthalate degradation efficiencies exceeded 70%. When using 2 g·L-1 sodium acetate+10 mg·L-1 phthalate as the fuel,the maximal power density of the fuel cell was 58.78 mW·m-2,and the corresponding inner resistance was 213.50 Ω. These results imply that the designed microbial fuel cell can treat phthalate while generating energy,providing a new method for the bioremediation of environmental hormone-disrupting refractory organic matter.
-
Key words:
- microbial fuel cell /
- phthalic acid esters /
- polarization curves /
- removal rates
-
我国铅锌工业总规模大,常年位于世界第一,仅2018年,精Zn产量达5.68×106 t,约占全球总量的40%,我国Zn冶炼主流工艺为“焙烧—浸出—电积”,其生产过程中产生大量含Zn、Cd和As等的冶炼废渣,统计表明,平均生产1 t Zn,产生0.96 t废渣[1],废渣历史积存量和年新增量大,难以得到有效的消纳利用,通常采用无害化填埋、堆置储存等方式进行处置。在长期的堆置过程中,受风蚀、淋溶和浸蚀等作用影响,废渣中的重金属释放,对周边人群健康和土壤、地下水等生态环境造成严重威胁[2]。
稳定化是废渣常见的无害化处理方式,通过加入稳定剂降低重金属的迁移性,而稳定剂的选择是关键。目前,常用稳定剂一般包括有机、无机和生物质型3种[3]。其中,无机型药剂因对重金属稳定效果好而广被应用[4-6],其对重金属主要是通过化学键合、物理包容、吸附或形成惰性沉淀物等作用进行稳定[7-8]。目前,研究应用多以含硫、磷、铁、钙、镁等药剂为主[7-11],但多集中在Zn、Pb等个别污染指标,而针对废渣中As、Cd等其他多污染物共存的系统化研究还较为欠缺,特别是个别稳定剂对废渣中As反而存在活化作用则较少关注,受介质类型、污染程度、稳定剂种类、投加量、配伍等因素的影响,不同药剂实际稳定化效果还须进行综合比对和考证。
本研究以湖南某大型冶炼企业渣场堆存的铅锌冶炼废渣为研究对象,采用Na2S·9H2O、(NH4)2HPO4、Na3PO4·12H2O、CaO、MgO为稳定化药剂,并进行了药剂配伍研究,以水浸提法[12]模拟废渣堆存过程的浸蚀淋溶影响,考察了不同药剂对Zn、Cd、Cu、As的综合稳定化效果及其对环境的影响,以期为国内铅锌冶炼废渣的无害化处置提供参考。
1. 材料与方法
1.1 供试材料
本研究所用工业废渣取自湖南某大型冶炼企业典型渣堆场。将堆场上性状明显类似的废渣进行现场机械开挖和预混,运至具防渗结构的预存场进行自然风干、人工除杂、混匀、磨碎后,过4 mm筛,取筛下物于小型卧式搅拌机中再次混匀后,用于稳定化实验。
废渣污染特性如表1所示,与《污水综合排放标准》(GB 8978-1996) [13]1级最高允许排放浓度相比,废渣H2O浸出Zn、Cd和Cu超标,分别超标6.60、10.10、1.76倍,废渣pH为2.40,呈强酸性。
表 1 供试废渣污染特性Table 1. Pollution characteristics of waste slag供试废渣 总量/(mg·kg−1) H2O浸出/(mg·L−1) GB 8978-1996 I级/(mg·L−1) Zn 4 631 38 5.0 Cd 2 188 1.11 0.1 Cu 1 572 5.51 2.0 As 1 442 0.25 0.5 Pd 4 752 0.02 1.0 Cr 106 0.05 1.5 稳定化药剂包括Na2S·9H2O、(NH4)2HPO4、Na3PO4·12H2O、CaO、MgO,均为分析纯。
1.2 实验方法与分析方法
称量1 000.00 g(干质量)废渣置于敞口玻璃容器中,将Na2S·9H2O、(NH4)2HPO4和Na3PO4·12H2O 分别配成200 mL的水剂,按废渣Zn、Cd、Cu、As等的理论水浸出量计算药剂添加量,药剂与元素浸出摩尔比设计为2∶1、4∶1、8∶1、16∶1,对应药剂投加质量分数如表2所示,边加药剂边充分混匀搅拌,搅拌时间20 min,CaO和MgO按粉剂添加,根据前期Zn、Cd稳定化实验结果,3种药剂复配配方按质量比Na2S·9H2O∶(NH4)2HPO4∶Na3PO4·12H2O=2∶1∶3进行药剂配伍,设置空白对照(CK),每处理设3次重复,控制水∶渣(质量比)=1:4左右,室温养护7 d后,进行废渣pH、毒性浸出测试。
表 2 稳定化实验设计Table 2. Design of heavy metals stabilization experiment% 实验处理 Na2S·9H2O (NH4)2HPO4 Na3PO4·12H2O CaO MgO 1 0.30 — — — — 2 0.60 — — — — 3 1.21 — — — — 4 2.42 — — — — 5 — 0.16 — — — 6 — 0.32 — — — 7 — 0.64 — — — 8 — 1.28 — — — 9 — — 0.46 — — 10 — — 0.92 — — 11 — — 1.84 — — 12 — — 3.68 — — 13 — — — 0.40 — 14 — — — 0.60 — 15 — — — 1.00 — 16 — — — — 0.40 17 — — — — 0.60 18 — — — — 1.00 19 0.60 — — 0.40 — 20 1.21 — — 0.40 — 21 2.42 — — 0.40 — 22 — 0.32 — 0.40 — 23 — 0.64 — 0.40 — 24 — 1.28 — 0.40 — 25 0.40 0.20 0.60 — — 26 0.80 0.40 1.20 — — 27 1.60 0.80 2.40 — — 空白对照 — — — — — 注:“—”表示未添加,配伍药剂添加时先加CaO。 使用酸度计(pHs-3C型,上海仪电科学仪器股份有限公司)测定供试废渣的pH,测定方法采用《固体废物 腐蚀性测定 玻璃电极法》(GB/T 15555.12-1995)[14];重金属总量测试的前处理采用石墨炉三酸(体积比为HNO3∶HF∶HClO4=3∶2∶2)消解法;毒性浸出采用水浸法[12];消解液和水浸出液中重金属含量采用电感耦合等离子体发射光谱仪(ICP-MS 7500,美国Agilent公司)测定。
修复效果评估根据式(1)~式(3)进行计算。
η(M)=(C0−Ct)/C0×100% (1) η(Zn,Cd)=(η(Zn)+η(Cd))/2 (2) η=(η(Zn)+η(Cd)+η(Cu)+η(As))/4 (3) 式中:η(M)为M元素的稳定率;C0、Ct分别为废渣在稳定化前和稳定化后的元素水浸出浓度,mg·L−1;η(Zn, Cd)为Zn和Cd这2种重金属的稳定率均值;η为Zn、Cd、Cu、As 4种元素的综合稳定率均值。
2. 结果与讨论
2.1 单一稳定剂
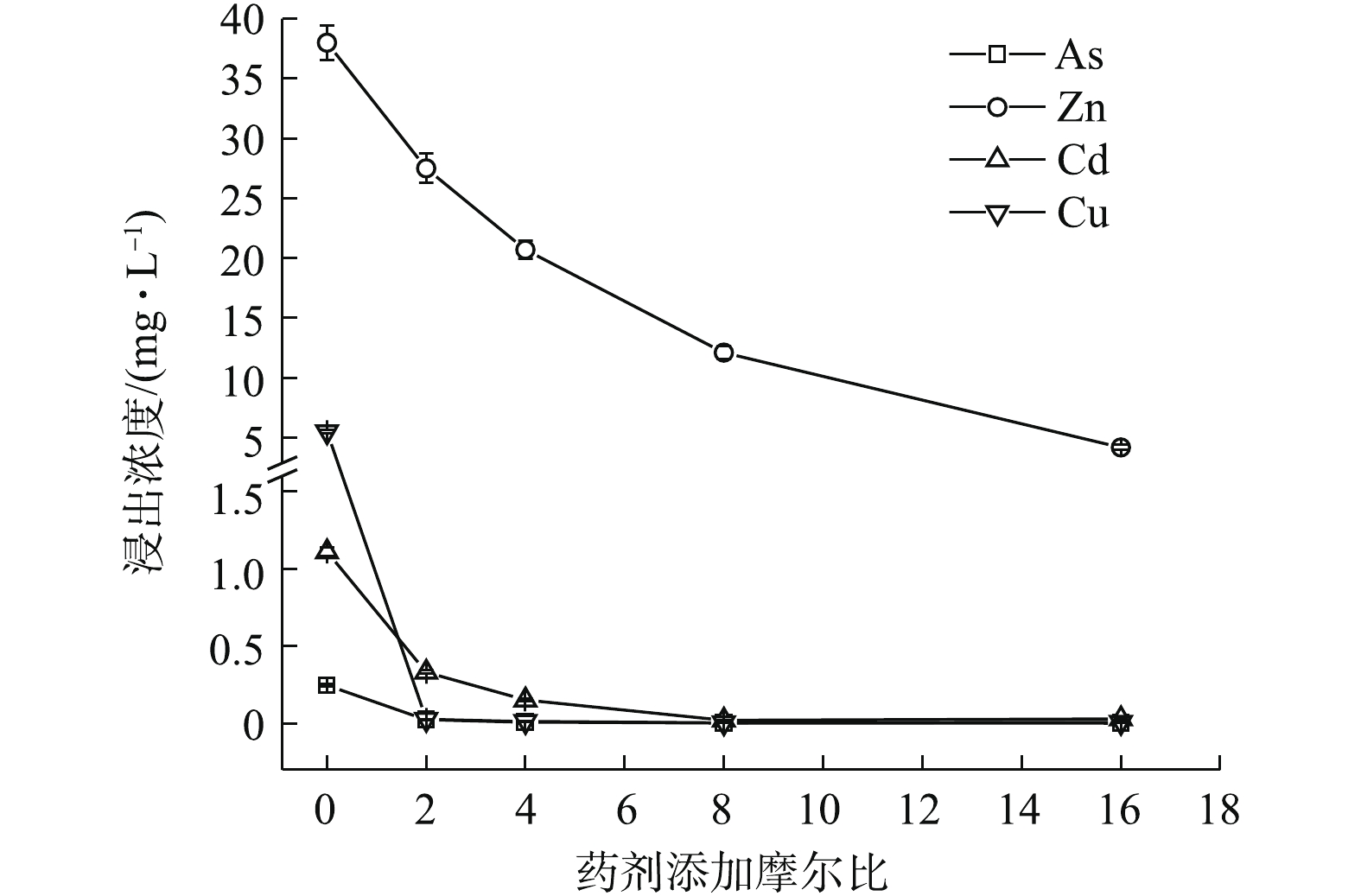
Na2S·9H2O、(NH4)2HPO4、Na3PO4·12H2O均能明显降低4种金属元素的水浸出浓度(图1~图3)。如图1所示,随Na2S·9H2O投加量的增加,各金属元素浸出均呈降低的趋势,Zn、Cd和Cu的稳定率分别为27.63%~88.97%、70.08%~98.05%、99.52%~99.85%。其中,药剂与4种金属元素浸出总量的摩尔比为8 (投加1.21%)时,Cd的浸出浓度由CK的1.11 mg·L−1降至0.02 mg·L−1,达到GB 8978-1996中Cd (0.1 mg·L−1)限标;摩尔比16(投加2.42%)时,Zn浸出才达标,由CK的38 mg·L−1降至4.19 mg·L−1,此时η(Zn)为88.97%、η(Cd)为97.35%,η(Zn, Cd)为93.16%,Na2S·9H2O对3种重金属稳定效果突出,总体稳定效应大小依次为Cu>Cd>Zn,这与其提供的S2-与Zn2+、Cd2+和Cu2+形成金属硫化物沉淀有关[15]。这种难溶物溶解度很低,形成沉淀的先后顺序一般为CuS>CdS>ZnS[16],随投加量的增加,其水解过程中产生的OH−也有利于重金属的稳定。此外,各处理使As浸出降低了90.24%~99.11%,说明其与As形成的惰性沉淀物在应对水浸滤风险能力方面也很显著,但在稳定化过程中有少许H2S逸出。
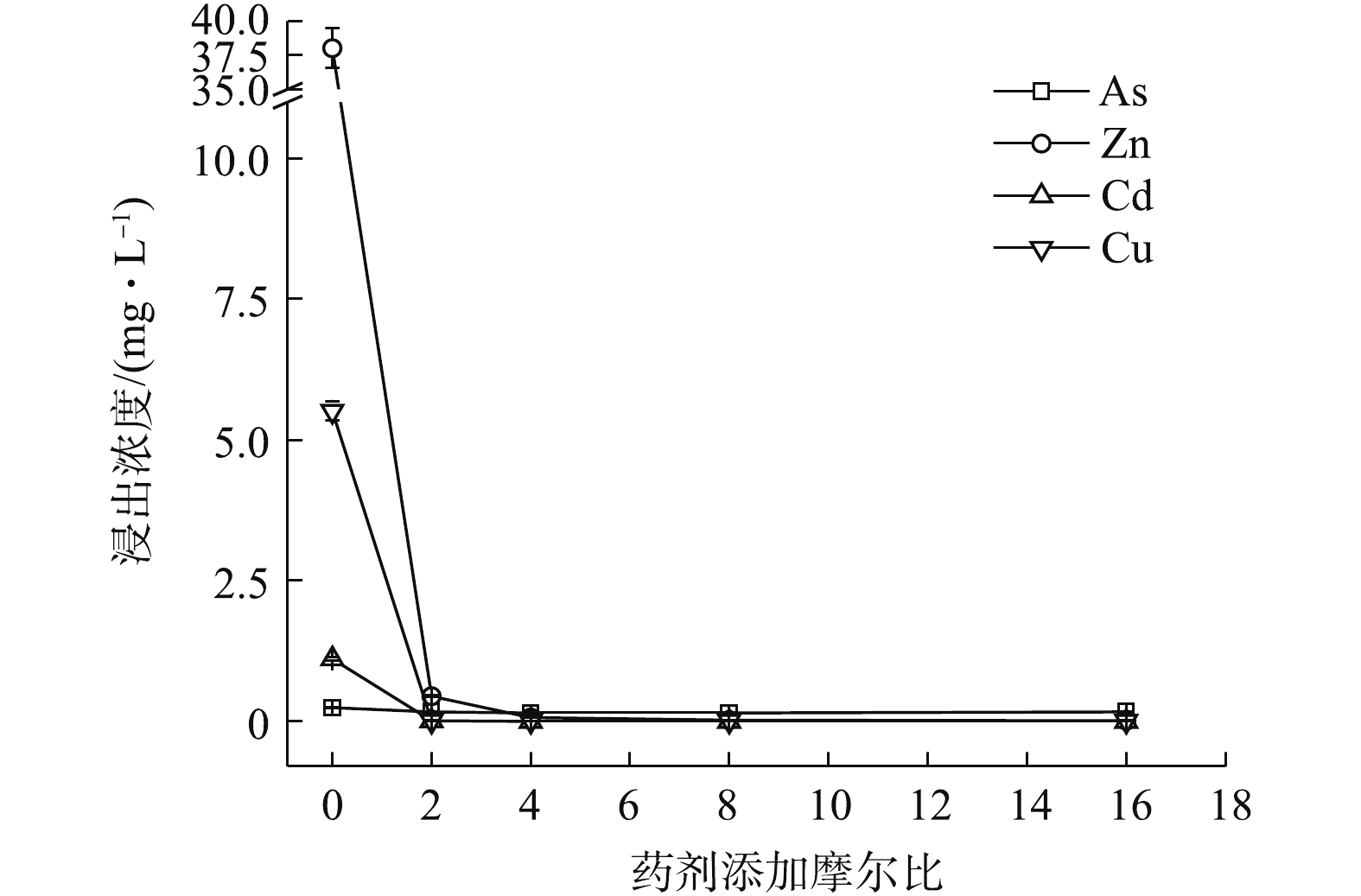
(NH4)2HPO4可明显降低重金属的水浸出毒性。如图2所示,随(NH4)2HPO4投加量的增加,Zn、Cd和Cu浸出浓度均呈不断降低的趋势,稳定率分别为59.52%~99.46%、57.97~99.23%、98.85~99.93%,而As浸出则呈现先降低后回升的趋势,药剂摩尔比≥8后,As浸出浓度开始升高并被活化,药剂摩尔比升高至16时,As浸出浓度被活化1.74倍,浓度为0.68 mg·L−1,超出0.5 mg·L−1限标的36%,药剂摩尔比为4时,As浸出降至最低0.016 mg·L−1,η(As)高达93.52%,但此时Zn和Cd浸出分别降至8.47 mg·L−1和0.23 mg·L−1,并未达标。直到药剂摩尔比为8(投加量为0.64%)时,才使以上4种金属元素均达标,Zn和Cd分别降至0.224 mg·L−1和0.01 mg·L−1,η(Zn)和η(Cd)分别为99.41%和99.08%,η(Zn, Cd)为99.25%,4种元素综合稳定率η达到最高值,为87.42%。因此,0.64%的(NH4)2HPO4投加量综合稳定效果最好,但须控制投加剂量,以免高量添加对As过度活化。
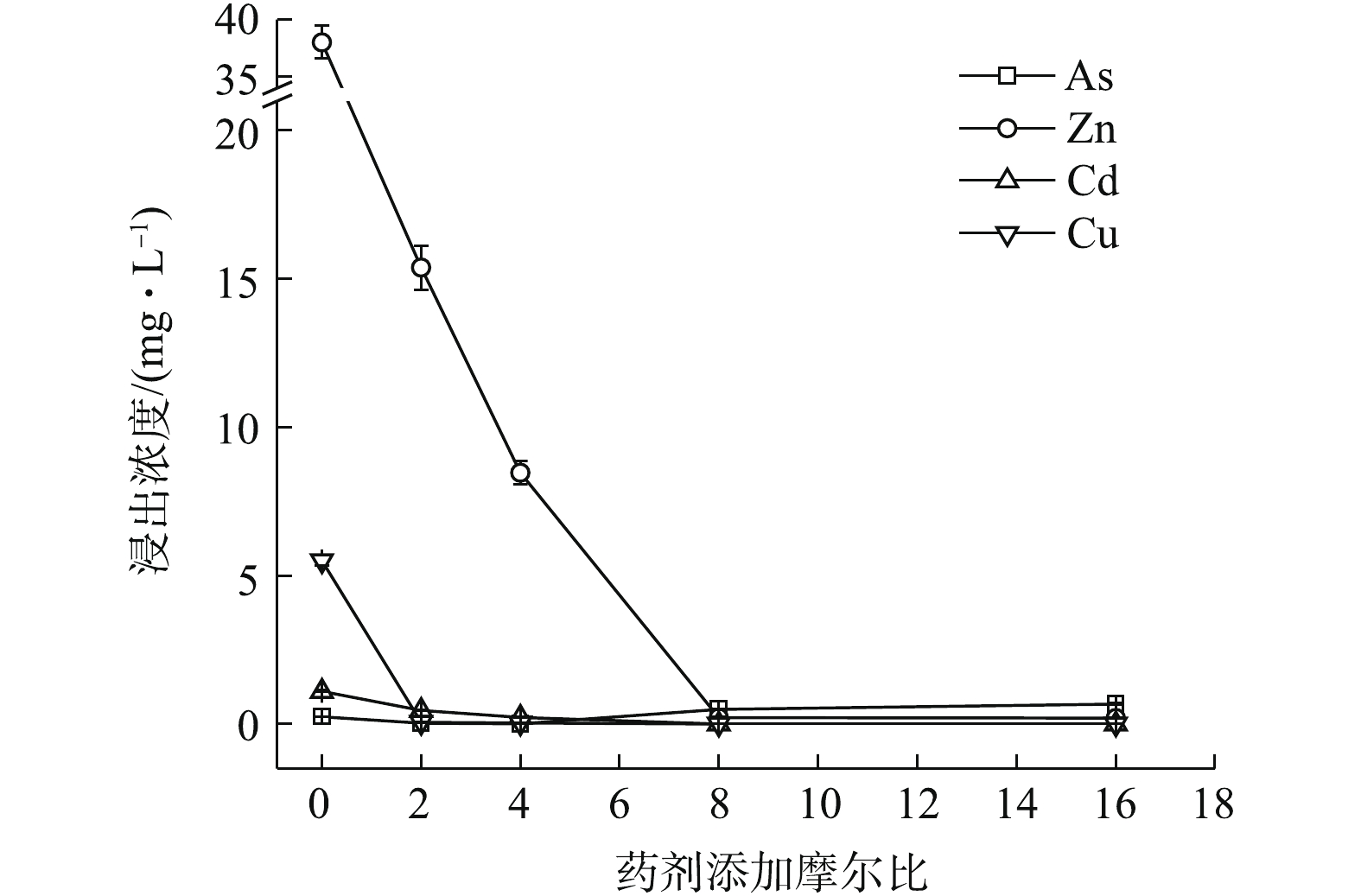
如图3所示,Na3PO4·12H2O稳定化效果突出,最低药剂摩尔比为2 (投加量为0.46%)时,可使4种元素均能达标,Zn、Cd、Cu和As浸出分别降至0.446、0.014、0.004、0.169 mg·L−1,稳定率分别为98.83%、98.70%、99.93%、31.58%,4元素综合稳定率η可达82.26%。其中,η(Zn)和η(Cd)分别为98.83%和98.70%,η(Zn, Cd)为98.76%,稳定率均高于同摩尔比条件下的(NH4)2HPO4(η(Zn) 59.52%,η(Cd) 57.97%,η(Zn, Cd) 58.94%)和Na2S·9H2O(η(Zn)27.63%,η(Cd) 70.08%,η(Zn, Cd) 48.85%),在Na3PO4·12H2O的各处理组中,η(As)均可稳定在34.92%左右。磷酸盐对Cd、Cu等的固定主要是通过与金属发生表面络合吸附和共沉淀等作用所致[8],对Zn主要以诱导或直接吸附[8]以及少量溶解性无定形沉淀反应[17]为主,并可促进Zn的可氧化态向残渣态转变[18]。而P与As化学性质相似,一般认为,
PO3−4 和HPO2−4 会与AsO3−4 形成竞争吸附,使As的流动性增强,但本研究采用单一Na3PO4·12H2O处理强酸性废渣,并未对As产生明显的活化作用,其具体原因尚须进一步的深入研究。由图1~图3可知,对Zn的稳定化效果顺序依次为Na3PO4·12H2O>(NH4)2HPO4>Na2S·9H2O,对Cd和Cu的稳定化效果依次为Na3PO4·12H2O>Na2S·9H2O>(NH4)2HPO4,对As的稳定化效果依次为Na2S·9H2O>(0.16~0.32)% (NH4)2HPO4>Na3PO4·12H2O。其中,(NH4)2HPO4易对As产生活化作用,从药剂投加量角度来看,使4种金属元素同时达标的综合稳定效应依次为0.46% Na3PO4·12H2O(摩尔比为2,η=82.26%)>0.64% (NH4)2HPO4(摩尔比为8,η=87.42%)>2.42% Na2S·9H2O (摩尔比为16,η=96.36%),因此,Na3PO4·12H2O对Zn和Cd稳定效果均最为突出,对As活化效果不明显,且低剂量添加不易导致溶解P过量,因此,在3种药剂中,Na3PO4·12H2O最适合单独处理强酸性废渣。
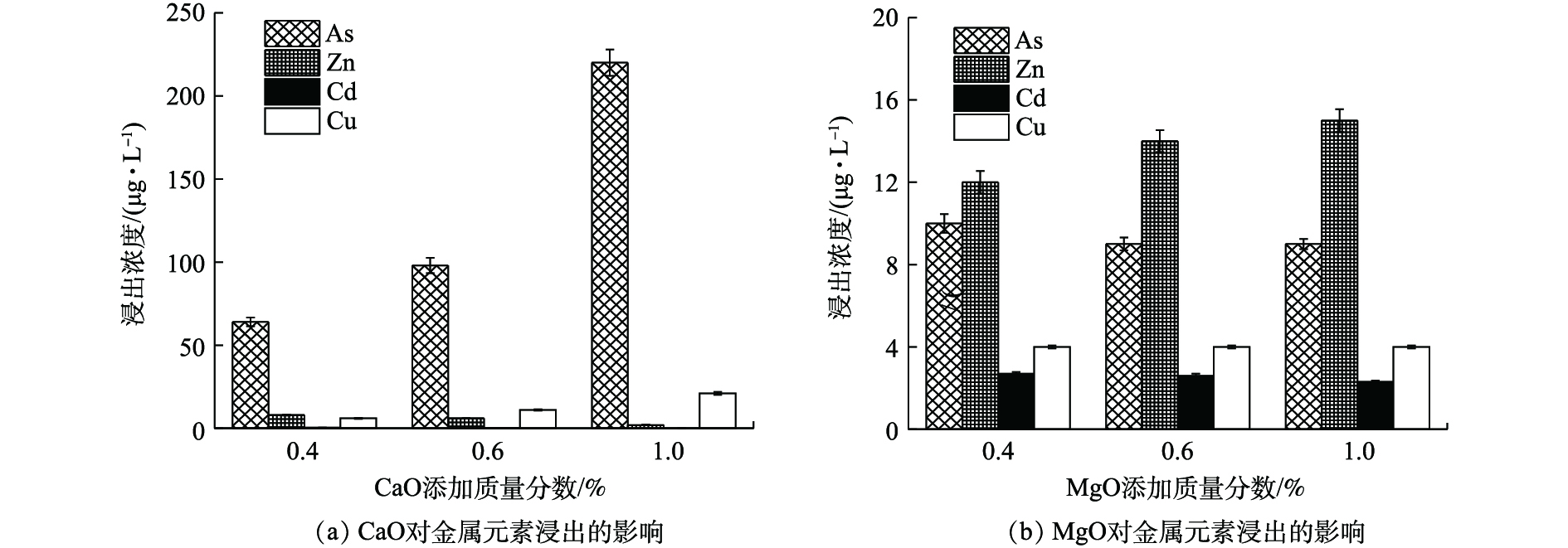
如图4(a)所示,(0.4~1)% CaO处理后,废渣中Zn、Cd、Cu、As的浸出浓度分别降至<10、<0.50、<25、<220 μg·L−1,远低于GB 8978-1996最高限值。其中,Zn、Cd、Cu稳定率均高于96%,这与CaO提高废渣pH、重金属氢氧化物沉淀增多、黏土物质等对重金属吸附性增强[19]、提供的钙离子与金属离子发生同晶替代[20]等作用有关。η(As)则为10.93%~74.09%,低量CaO更有利于As的稳定,CaO对As的稳定作用主要与强氧化性和适当pH条件下易形成CaHAsO4和Ca3(AsO4)2沉淀[21]有关。但本研究表明,当CaO≤1%,随CaO量的增加,As浸出浓度逐渐升高,这可能由于随着OH−浓度增高,负电荷对As的竞争吸附作用逐渐加强,最终导致As的迁移性有所增强[22]。
如图4(b)所示,MgO使废渣中Zn、Cd、Cu、As的浸出浓度分别降至≤15、<3、<5、≤10 μg·L−1,η均高于98%,其中η(As)均高于95%,明显优于CaO,这可能与MgO比表面积大,表面具有镁氧基(Mg―O)活泼反应基团,对重金属的吸附、沉淀等作用更强有关[23]。
由图4可知,CaO、MgO均可作为高效稳定剂,Ca2+、Mg2+虽均会与砷酸根离子形成复杂的络合沉淀物,但CaO的添加会使As浸出反升,4种元素综合稳定效应为0.4% MgO(η=98.90%)>0.4% CaO(η=93.48%)。
2.2 无机-无机组合处理
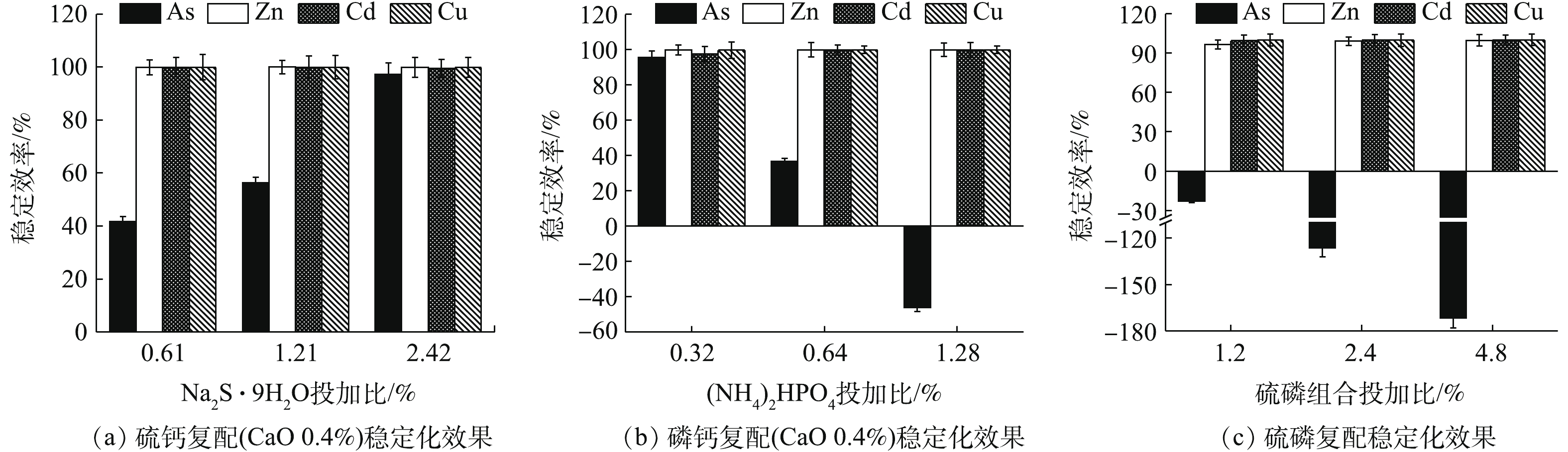
硫钙、磷钙和硫磷组合处理结果如图5所示。各类组合对废渣中的Zn、Cd和Cu的稳定化效果均较为明显,稳定率均高于95%,硫化物的添加有助于As的稳定,磷酸盐过量则对As的稳定化效果产生一定的拮抗作用。由图5(a)可知,0.4% CaO与3种不同投加比的Na2S·9H2O组合处理后,4种元素浸出浓度均达标,Zn、Cd和Cu的稳定率均高于99%,Zn浸出浓度均低于0.07 mg·L−1,Cd和Cu浸出浓度均低于0.01 mg·L−1,随Na2S·9H2O投加量的增加,η(As)明显增强。与单一Na2S·9H2O相比,各处理的硫钙组合均提高了Zn和Cd的稳定效果,其中,η(Zn)从45.53%~88.97%升至99.80%以上,说明CaO的加入有助于增强阳离子金属的稳定效果,协同增效作用明显,但同时一定程度上降低了As的稳定效果,η(As)从96.36%~99.11%降至41.70%~97.17%。在Na2S·9H2O组合比为0.61%和1.21%时,As的稳定化效果反而不如2种药剂单独使用时的效果,不仅未达到协同稳定As的效应,反而弱化了As的稳定效果,这与王浩等[3]的研究结果类似。但CaO与最高投加比(2.42%)Na2S·9H2O组合时,稳定As的能力依次为Na2S·9H2O>硫钙组合>CaO,组合处理对4种元素的综合稳定率η高达99.08%,这也说明硫钙组合稳定As的效果优于CaO,究其原因主要为2个方面:一方面,低量CaO利于降低As的浸出;另一方面,存在碱性条件使As流动性增强的风险[24-25],而硫钙组合对As的稳定化水平则随Na2S·9H2O投加量的增加而增强,在控制低剂量CaO防止因过量而活化As的同时,可使As2S3等更稳定的沉淀作用逐渐占优,As的稳定性增强。综上所述,硫钙组合有利于增强单一Na2S·9H2O对Zn的稳定效果,高剂量时对As的稳定效果优于单一CaO,且对4种元素的综合稳定效果均强于单一处理时的效果,组合处理中先加CaO也大大减少了H2S的逸出,有助于环境友好性,因此,与CaO和Na2S·9H2O单一处理相比,硫钙组合更占优势。
由图5(b)可知,低剂量的0.4% CaO+0.32% (NH4)2HPO4使4种金属元素的稳定率均高于95%,η高达98.13%,优于单一CaO(η 93.48%)和单一(NH4)2HPO4(η 87.42%),与单一(NH4)2HPO4相比,组合处理进一步降低了Zn和As的浸出浓度,但随着组合处理中(NH4)2HPO4投加量的增加,η(As)明显降低,甚至为负值,0.4% CaO+1.28% (NH4)2HPO4处理组的η(As)降为−46.15%。磷钙组合主要弱化了单一(NH4)2HPO4对As的活化作用,CaO与低量(NH4)2HPO4组合更有助于4种金属元素的综合稳定。
考虑到Na2S·9H2O和磷酸盐分别对As和Zn稳定能力强的特点,硫磷复配后的稳定化效果如图5(c)所示。在投加1.2%~4.8%复配剂后,Zn、Cd和Cu的稳定率均高于96%,但As均被活化,η(As)为−171.66%~−23.08%,其中,控制药剂投加量为1.2%,4种金属元素均达标,η仅为68.07%,2.4%和4.8%处理后As浸出超标。硫磷组合剂对As活化性较强,须控制投加量≤1.2%。
3. 结论
1)单一硫化物和磷酸盐对重金属的稳定化结果表明,3种药剂中Na3PO4·12H2O对重金属的稳定效果最好,Na2S·9H2O对As的稳定效果最好,(NH4)2HPO4易对As产生活化作用,从药剂投加量角度考虑,与GB 8978-1996最高允许排放浓度相比,达标稳定4种金属元素综合稳定化效应次序依次为0.46% Na3PO4·12H2O(η 82.26%)>0.64% (NH4)2HPO4(η 87.42%)>2.42% Na2S·9H2O(η 96.36%),Na3PO4·12H2O最优。
2)单一钙基、镁基和无机配伍对重金属的稳定化结果表明,单一MgO(投加比0.4%时,η(Zn) 99.97%,η(Cd) 99.76%)或CaO处理即可使之达标,硫钙组合提高了单一Na2S·9H2O对Zn、Cd的稳定化水平,η(Zn)从45.53%~88.97%升至99.80%以上,0.4% CaO与2.42% Na2S·9H2O的组合对As稳定效果优于单一CaO,对4种金属元素η高达99.08%,优于单一处理;磷钙和磷硫配伍中磷酸盐过量易活化As。各处理满足4种金属元素均达标的综合稳定效应大小顺序依次为0.4% MgO>0.4% CaO>(0.4% CaO+0.61% Na2S·9H2O)>(0.4% CaO+0.32% (NH4)2HPO4)>1.2% (Na2S·9H2O∶(NH4)2HPO4∶Na3PO4·12H2O=2∶1∶3)。
3) MgO、Na3PO4·12H2O、硫钙组合为优选稳定剂,CaO过量和组合剂中磷酸盐过量均不利于As的同时稳定。
-
[1] AELTERMAN P, RABAEY K, PHAM H T, et al. Continuous electricity generation at high voltages and currents using stacked microbial fuel cells[J]. Environmental Science & Technology, 2006, 40(10):3388-3394 [2] LOGAN B E, HAMELERS B, ROZENDAL R, et al. Microbial fuel cells:Methodology and technology[J]. Environmental Science & Technology, 2006, 40(17):5181-5192 [3] RABAEY K, VERSTRAETE W. Microbial fuel cells:Novel biotechnology for energy generation[J]. Trends in Biotechnology, 2005, 23(6):291-298 [4] ZHOU Minghua, CHI Meiling, LUO Jianmei, et al. An overview of electrode materials in microbial fuel cells[J]. Journal of Power Sources, 2011, 196(10):4427-4435 [5] 梁吉虎, 高自良, 于建生. 关于微生物燃料电池底物的研究进展[J]. 氨基酸和生物资源, 2010, 34(3):20-25 [6] LOGAN B E, REGAN J M. Microbial fuel cells:Challenges and applications[J]. Environmental Science & Technology, 2006, 40(17):5172-5180 [7] SUN Min, SHENG Guoping, MU Zhexuan, et al. Manipulating the hydrogen production from acetate in a microbial electrolysis cell-microbial fuel cell-coupled system[J]. Journal of Power Sources, 2009, 191(2):338-343 [8] CATAL T, LI Kaichang, BERMEK H, et al. Electricity production from twelve monosaccharides using microbial fuel cells[J]. Journal of Power Sources, 2008, 175(1):196-200 [9] REN Zhiyong, WARD T E, REGAN J M. Electricity production from cellulose in a microbial fuel cell using a defined binary culture[J]. Environmental Science & Technology, 2007, 41(13):4781-4786 [10] 骆海萍, 刘广立, 张仁铎, 等. 以苯酚为燃料的微生物燃料电池产电特性[J]. 环境科学学报, 2008, 28(7):1279-1283 [11] SUN Jian, HU Yongyou, BI Zhe, et al. Simultaneous decolorization of azo dye and bioelectricity generation using a microfiltration membrane air-cathode single-chamber microbial fuel cell[J]. Bioresource Technology, 2009, 100(13):3185-3192 [12] LU Na, ZHOU Shungui, ZHUANG Li, et al. Electricity generation from starch processing wastewater using microbial fuel cell technology[J]. Biochemical Engineering Journal, 2009, 43(3):246-251 [13] JADHAV G S, GHANGREKAR M M. Performance of microbial fuel cell subjected to variation in pH, temperature, external load and substrate concentration[J]. Bioresource Technology, 2009, 100(2):717-723 [14] MOHAN S V, SARAVANAN R, VEER RAGHAVULU S, et al. Bioelectricity production from wastewater treatment in dual chambered microbial fuel cell (MFC)using selectively enriched mixed microflora:Effect of catholyte[J]. Bioresource Technology, 2008, 99(3):596-603 [15] STAPLES C A, PETERSON D R, PARKERTON T F, et al. The environmental fate of phthalate esters:A literature review[J]. Chemosphere, 1997, 35(4):667-749 [16] 庞金梅, 池宝亮, 段亚利. 苯二甲酸酯的微生物降解与转化[J]. 环境科学, 1994, 15(3):88-90 [17] BAUER M J, HERRMANN R. Estimation of the environmental contamination by phthalic acid esters leaching from household wastes[J]. Science of the Total Environment, 1997, 208(1/2):49-57 [18] GU Jidong, LI J, WANG Y Y. Biochemical pathway and degradation of phthalate ester isomers by bacteria[J]. Water Science and Technology, 2005, 52(8):241-248 [19] FATOKI O S, OGUNFOWOKAN A O. Determination of phthalate ester plasticizers in the aquatic environment of southwestern Nigeria[J]. Environment International, 1993, 19(6):619-623 [20] WANG Yingying, FAN Yanzhen, GU Jidong. Dimethyl phthalate ester degradation by two planktonic and immobilized bacterial consortia[J]. International Biodeterioration & Biodegradation, 2004, 53(2):93-101 [21] PETERSEN J H, BREINDAHL T. Plasticizers in total diet samples, baby food and infant formulae[J]. Food Additives & Contaminants, 2000, 17(2):133-141 [22] 叶常明. 环境中的邻苯二甲酸酯[J]. 环境科学进展, 1993, 1(2):36-47 [23] WANG Jianlong, LIU Ping, QIAN Yi. Microbial degradation of di-n-butyl phthalate[J]. Chemosphere, 1995, 31(9):4051-4056 [24] CHANG B V, YANG C M, CHENG C H, et al. Biodegradation of phthalate esters by two bacteria strains[J]. Chemosphere, 2004, 55(4):533-538 [25] ALATRISTE-MONDRAGON F, IRANPOUR R, AHRING B K. Toxicity of di-(2-ethylhexyl)phthalate on the anaerobic digestion of wastewater sludge[J]. Water Research, 2003, 37(6):1260-1269 [26] GAVALA H N, ALATRISTE-MONDRAGON F, IRANPOUR R, et al. Biodegradation of phthalate esters during the mesophilic anaerobic digestion of sludge[J]. Chemosphere, 2003, 52(4):673-682 [27] 谢珊, 欧阳科, 黎丽华. 膜在微生物燃料电池分隔材料中应用的研究进展[J]. 水处理技术, 2011, 37(8):15-18 [28] 李登兰, 洪义国, 许玫英, 等. 微生物燃料电池构造研究进展[J]. 应用与环境生物学报, 2008, 14(1):147-152 [29] 孔晓英, 孙永明, 李连华, 等. 阳极材料对微生物燃料电池性能影响的研究[J]. 太阳能学报, 2011, 32(5):746-749 [30] WANG Zhiwei, MA Jinxing, XU Yinlun, et al. Power production from different types of sewage sludge using microbial fuel cells:A comparative study with energetic and microbiological perspectives[J]. Journal of Power Sources, 2013, 235:280-288 [31] PADAKI M, ISLOOR A M, ISMAIL A F, et al. Synthesis, characterization and desalination study of novel PSAB and mPSAB blend membranes with polysulfone (PSf)[J]. Desalination, 2012, 295:35-42 [32] LOVLEY D R, PHILLIPS E J P. Novel mode of microbial energy metabolism:Organic carbon oxidation coupled to dissimilatory reduction of iron or manganese[J]. Applied and Environmental Microbiology, 1988, 54(6):1472-1480 [33] 梁鹏, 范明志, 曹效鑫, 等. 微生物燃料电池表观内阻的构成和测量[J]. 环境科学, 2007, 28(8):1894-1898 [34] LOGAN B E. Microbial Fuel Cells[M]. Hoboken:Wiley-Interscience, 2008 [35] 林兴桃, 王小逸, 陈明, 等. 固相萃取高效液相色谱法测定水中邻苯二甲酸酯类环境激素[J]. 环境科学研究, 2004, 17(5):71-74 [36] LIU Zhihua, LI Xiaoming, JIA Bin, et al. Production of electricity from surplus sludge using a single chamber floating-cathode microbial fuel cell[J]. Water Science and Technology, 2009, 60(9):2399-2404 [37] 骆海萍, 刘广立, 张仁铎, 等. 高浓度苯酚的MFC降解及产电性能[J]. 环境科学学报, 2008, 28(11):2181-2185 [38] LUO Haiping, LIU Gangli, ZHANG Renduo, et al. Phenol degradation in microbial fuel cells[J]. Chemical Engineering Journal, 2009, 147(2/3):259-264 [39] ZHANG Cuiping, LI Mingchen, LIU Guangli, et al. Pyridine degradation in the microbial fuel cells[J]. Journal of Hazardous Materials, 2009, 172(1):465-471 [40] LUO Yong, LIU Guangli, ZHANG Renduo, et al. Power generation from furfural using the microbial fuel cell[J]. Journal of Power Sources, 2010, 195(1):190-194 [41] NEUFELD R, GREENFIELD J, RIEDER B. Temperature, cyanide and phenolic nitrification inhibition[J]. Water Research, 1986, 20(5):633-642 [42] RAMANAVICIUS A, RAMANAVICIENE A. Hemoproteins in design of biofuel cells[J]. Fuel Cells, 2009, 9(1):25-36 [43] 骆海萍, 张翠萍, 宋海红, 等. 降解苯的微生物燃料电池产电性能研究[J]. 中山大学学报(自然科学版), 2010, 49(1):113-118 [44] 武晨, 张嘉琪, 王晓丽, 等. 以苯胺和葡萄糖为燃料的微生物燃料电池的产电特性研究[J]. 环境科学学报, 2011, 31(6):1227-1232 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2204
- HTML全文浏览数: 1656
- PDF下载数: 403
- 施引文献: 0



 DownLoad:
DownLoad: