铁电极活化过硫酸盐对金橙G的降解
Degradation of iron electrode as sodium persulfate activator for orange G
-
摘要: 研究了铁电极活化过硫酸盐(EC/PDS)产生的具有强氧化性的硫酸根自由基(SO4-·)对溶液中金橙G(orange G,OG)的氧化降解行为。重点考察了电流强度、PDS投加量、金橙G初始浓度、溶液初始pH值以及共存阴离子对金橙G降解速率的影响。实验结果表明:相比单独絮凝(EC)和投加过硫酸盐(PDS),EC/PDS体系能够有效地去除金橙G;金橙G的去除效率随着电流强度的增大而增大,随着PDS投加量的增大而增大,随着金橙G初始浓度增大而减小;较低的溶液pH值更利于OG的降解。水中共存阴离子对金橙G的降解存在着不同程度的抑制作用:PO43- > CO32- > Cl-。此外,通过加入不同的淬灭剂(甲醇和叔丁醇),确定了体系中主要存在的自由基。Abstract: The paper deals with the degradation of orange G(OG) in aqueous solutions by electrochemically activated peroxydisulfate(EC/PDS)oxidation. These processes are based on the generation of sulfate radicals(SO4-·), which are strong oxidizing species.The effects of current intensity, PDS dosage, initial OG concentrations, initial pH of solution and coexisting anions in solution were studied. The results show that EC/PDS system can degrade OG more effectively than EC and PDS alone. The degradation rate of OG increases with the increase of the current intensity and the dosage of PDS, the degradation rate of OG decreases with the increase of the initial OG concentrations. Low initial pH are favorable for OG degradation. Coexisting anions exhibit different degrees of inhibition effects, the degree of inhibition abiding from strong to weak by the following order:PO43- > CO32- > Cl-. Furthermore, the main radicals are determined by adding different scavengers (methanol and tert-butanol).
-
Key words:
- EC/PDS /
- radicals /
- orange G /
- degradation
-
四溴双酚A(TBBPA)是一种溴代阻燃剂,由于其具有高阻燃性和低廉价格等特点,广泛应用于电子电器产品、家具、油漆、纺织品等日用品中. TBBPA在生产和使用过程中可通过多种途径进入环境. 研究表明,TBBPA具有持久性有机污染物的特征,具有生物累积性、高度亲脂性和难分解性,具有内分泌干扰效应、细胞和神经毒性、免疫毒性等,会对生态系统和人类健康构成严重的威胁[1-4]. TBBPA微溶于水且容易在土壤中聚集,土壤是TBBPA最重要的归宿之一. 近年来,如何有效降解和去除土壤中TBBPA的研究备受关注 .
目前,土壤有机污染物修复技术包括物理修复[5]、生物修复[6-8]和化学修复[9-10],其中化学修复因其低投资、高效率、实施周期短的优点应用广泛. 过硫酸盐(PS)高级氧化技术是最常用的一种化学氧化修复技术,该技术的关键是通过热[11]、紫外光[12]和通过添加过渡金属[13]等方式活化PS. 热活化PS体系中虽然操作简单,但能耗较高,不适用大规模的处理. 在过渡金属活化PS中,亚铁离子(Fe2+)和铁离子(Fe3+)由于含量丰富、环境友好、价格低廉而被广泛用于PS活化,然而Fe2+活化PS技术仍然有一些缺陷,过量的Fe2+会抑制PS的活化,Fe3+还原为Fe2+的速率较慢,难以控制氧化体系中的量[14].
为了提高PS活化性能,本文以典型溴代阻燃剂TBBPA为目标污染物,考虑将Fe2+活化与热活化结合,采用Fe2+耦合热活化PS处理土壤中TBBPA,考察温度、Fe2+初始浓度、PS浓度、初始pH、无机阴离子和其他金属离子对Fe2+/热/PS体系降解TBBPA的影响,以寻求土壤体系中TBBPA降解的最佳反应条件,为土壤中持久性有机污染物的修复提供依据.
1. 材料与方法(Materials and methods)
1.1 实验试剂
TBBPA购于上海麦克林生化科技有限公司,甲醇购于美国迈瑞达科技公司,过硫酸钠、五水合硫酸铜、七水合硫酸锌和六水合硫酸镍购于天津津科精细化工研究所,氯化钠、碳酸氢钠、氢氧化钠和七水合硫酸亚铁购于国药集团化学试剂有限公司,浓硫酸购于北京化工厂. 以上药品除甲醇为色谱纯外,其余药品均为分析纯. 实验溶液配制用水为去离子水,高效液相仪器用水为哇哈哈纯净水.
1.2 实验仪器
LC-20AT 高效液相色谱仪(日本Shimadzu公司);Optima-XPN PN-100 高速离心机(BECKMANCOULTER公司);S400-B多参数pH测试仪(梅特勒-托利多仪器有限公司);FD-A10N-50冷冻干燥机(北京博医康实验仪器有限公司);HH-1-5L恒温水浴锅(江苏科析仪器有限公司);旋转蒸发仪(上海申生科技有限公司);SHA-2恒温振荡器(常州菲普实验仪器厂).
1.3 土壤的采集
供试土壤采自安徽省合肥市瑶海区某农田(117°21'53.424"E, 31°51'23.886"N),采集深度0—20 cm. 去除碎石、树枝杂质,经室内自然干燥,研磨后过60目筛网,储存于棕色玻璃瓶中密封保存. 经检验,土壤中无TBBPA检出. 该土壤基本理化性质见表1.
表 1 土壤基本理化性质Table 1. Basic physicochemical properties of soilpH 孔隙比 Porosity ratio 饱和度/% Saturation 颗粒成分组成/% Particle composition <0.005 mm 0.005—0.075 mm 0.075—0.25 mm 0.25—0.5 mm 7.10 1.50 95.1 13.3 17.7 47.7 21.3 1.4 污染土制备
TBBPA配制:精确称取0.250 g TBBPA粉末溶解于500 mL甲醇中,TBBPA浓度为500 mg·L−1.
TBBPA污染土:称取500 g未污染的土壤于2 L烧杯中,加入200 mL甲醇,玻璃棒搅拌均匀后,取30 mL TBBPA(500 mg·L−1)缓缓倒入烧杯中,边搅拌使之充分混匀,接着加甲醇直至液体浸没土壤表面,用玻璃棒搅拌20—30 min,使TBBPA在土壤中均匀混合,置于通风橱中自然风干、老化2周后备用(测定TBBPA约20 mg·kg−1).
1.5 实验方法
实验选用过硫酸钠(PS)氧化剂,过渡金属离子选用Fe2+,无机阴离子选用Cl−、
HCO−3 表 2 单因素实验参数变量Table 2. One-way experimental parameter variables单因素名称 Single factor name 参数变量 Parameter variable 温度/℃ 25 35 45 55 65 PS浓度/(mmol·L−1) 15 25 50 70 100 Fe2+浓度/(mmol·L−1) 15 25 50 70 100 初始pH 3.0 5.0 7.0 9.0 — PS与无机阴离子浓度摩尔比 1:0.1 1:1 1:2 — — Fe2+与其他金属离子浓度摩尔比 1:0.1 1:1 1:2 — — 称取2.000 g TBBPA污染土壤于30 mL棕色玻璃瓶中,加入2 mL去离子水和2 mL 25 mmol·L−1的硫酸亚铁溶液,再加入2 mL 50 mmol·L−1的PS储备溶液,使用1 mol·L−1稀硫酸和氢氧化钠溶液调节初始pH为3.0,随即用橡胶塞密封,置于温度55 ℃的恒温振荡器中(转速200 r·min−1)12 h. 预定时间间隔(0.05、0.25、0.5、1、2、4、6、8、12 h)取出放入冰水中(5 min)并加入0.2 mL甲醇,随后将样品放入-20 ℃的冰箱中冷冻4 h后放入冷冻干燥机中冷冻干燥48 h,经预处理,测定土壤中TBBPA浓度.
1.6 土壤样品的预处理
将10 mL甲醇溶剂加入待测棕色玻璃瓶中,置于25 ℃恒温振荡器中振荡8 h后,在剩余土壤中加入10 mL甲醇超声辅助萃取,萃取1 h,转移至离心管分离土壤与上清液. 随后,将离心管中的上清液经滤纸自然过滤转移至茄形烧瓶中,利用旋转蒸发仪将烧瓶中的萃取液旋转蒸发至1 mL,再用甲醇溶液重复多次提取至5 mL容量瓶,定容到刻度线,摇晃均匀,将容量瓶中的液体通过孔隙为0.22 μm的有机滤膜过滤,收集1.5 mL滤液于棕色进样瓶瓶中,用HPLC进行定量分析.
1.7 分析方法
(1) TBBPA的测定
本实验采用高效液相色谱仪(HPLC)测定土壤中的TBBPA. HPLC分析条件为:Zorbax Eclipse XDB-C18色谱柱(5 μm,250 mm×4.6 mm),流动相为甲醇:超纯水=85:15,检测波长为230 nm,流速为1.0 mL·min−1,进样体积为10 μL,柱温35 ℃. 对标样进行定性分析,TBBPA在该分析条件下的保留时间为(5.5±0.2) min[10].
(2) 数据分析方法
降解率W计算公式如下所示(公式1),采用准一级反应动力学和二级反应动力学模型(公式2、3)对TBBPA降解进行分析拟合.
W=(1−CtC0)×100% (1) lnCtC0=−kt (2) 1Ct−1C0=kt (3) 式中,t为反应时间(h),C0与Ct分别表示0 h和t h时TBBPA的浓度(mg·kg−1),k为拟合得到的反应动力学常数(h−1).
2. 结果与讨论(Results and discussion)
2.1 Fe2+耦合热活化PS降解TBBPA
比较了加热、热/Fe2+、热/PS、Fe2+/PS和Fe2+/热/PS体系对土壤中TBBPA降解效果的影响(图1),TBBPA在加热、热/Fe2+、热/PS和Fe2+/PS体系中12 h内的降解率分别为25.0%、32.0%、47.3%和89.9%. 由图可以看出,升高温度对土壤中TBBPA有一定的影响;在热/Fe2+的体系下,TBBPA降解速率小;热/PS和Fe2+/PS体系下TBBPA降解速率有进一步提升,原因主要是热和Fe2+都能活化PS产生较多的
SO·−4 2.2 TBBPA在Fe2+/热/PS体系中降解的影响因素
(1) 温度
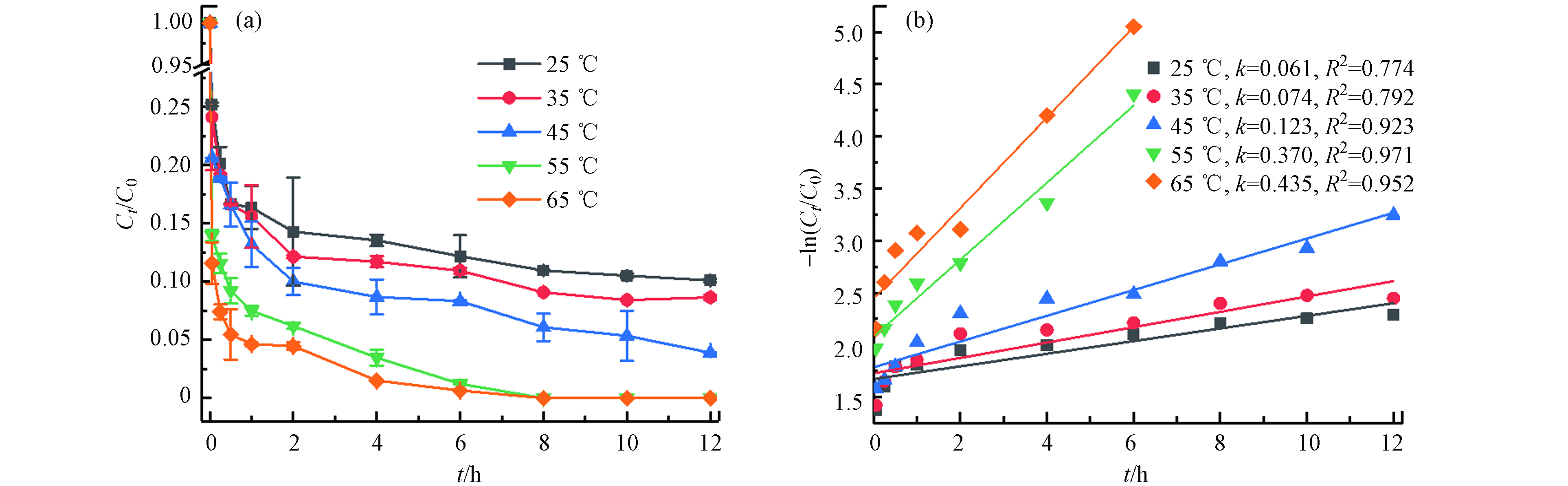
不同温度(25 ℃、35 ℃、45 ℃、55 ℃、65 ℃)对TBBPA在Fe2+/热/PS体系中降解的影响(如图2). 结果表明,TBBPA的降解效率随温度的升高而显著增加,在12 h内25 ℃、35 ℃、45 ℃时TBBPA的降解率分别为89.91%、91.35%、96.10%,55 ℃和65 ℃时降解率则在8 h已经达到100%. 这是由于在Fe2+活化过硫酸盐产生
SO·−4 SO·−4 SO·−4 Fe2++S2O2−8→Fe3++SO2−4+SO•−4 (4) S2O2−8+heat→2SO•−4 (5) (2) Fe2+初始浓度
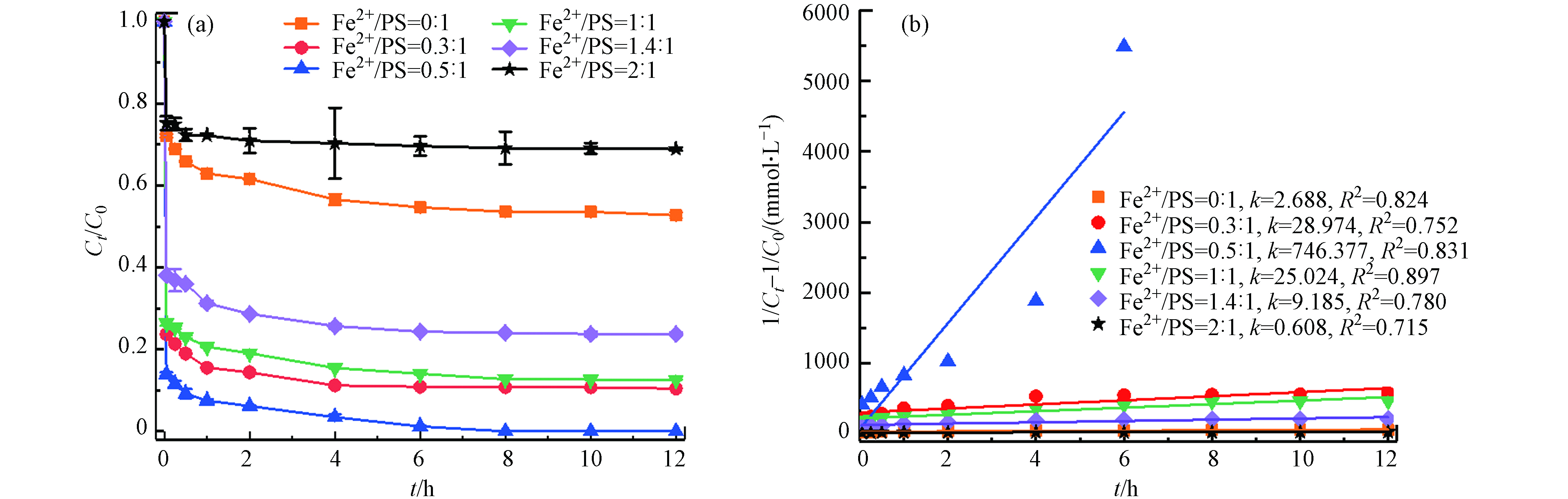
在温度55 ℃、PS浓度为50 mmol·L−1、pH=3的条件下,考察不同初始Fe2+浓度(0、15、25、50、 70、100 mmol·L−1)对土壤中TBBPA降解的影响. 如图3所示,未投加Fe2+时,此时反应仅是热活化反应降解,12 h内TBBPA降解率为47.3%,当Fe2+与PS摩尔比从0.3:1增加到0.5:1,TBBPA降解率从89.6%增加到100%;而继续增大Fe2+与PS摩尔比至2:1,TBBPA的降解效率开始下降,反应结束时仅有31.1%. 由图3(b)可以看出,TBBPA的降解较好拟合二级反应动力学,降解速率常数先增大,然后逐渐减小. 可见,添加Fe2+能够有效活化PS降解土壤中的TBBPA,在Fe2+浓度一定范围内,适当提高Fe2+浓度,能加速TBBPA的降解,在Fe2+与PS摩尔比为0.5:1,降解率最大,随着Fe2+浓度增加,过量的Fe2+也能分解
SO·−4 Fe2++SO•−4→Fe3++SO2−4 (6) (3) PS浓度
在温度55 ℃、Fe2+浓度为25 mmol·L−1、pH=3的条件下,考察不同PS浓度(15、25、50、70、100 mmol·L−1)对土壤中TBBPA降解的影响. 如图4所示,随着PS浓度的增加,12 h内TBBPA的去除效率从50.1%提高到100%,降解速率常数也从0.014 h−1增至1.135 h−1;TBBPA完全去除所需的时间随PS浓度的增大而缩短,PS浓度50 mmol·L−1、70 mmol·L−1和100 mmol·L−1降解率达到100%的时间分别为8 h、6 h和4 h. 由此可见,增加PS浓度对TBBPA的降解有促进作用. 有研究表明,过量的PS会抑制污染物的降解[18],因为是过量
S2O2−8 SO·−4 SO·−4 SO•−4+S2O2−8→•S2O2−8+SO2−4 (7) SO•−4+SO•−4→S2O2−8 (8) (4) 初始pH值
在温度55 ℃,Fe2+与PS最佳摩尔比0.5:1条件下,进一步研究了不同初始pH值(3.0、5.0、7.0和9.0)对Fe2+耦合热活化PS体系降解TBBPA的影响. 如图5所示,当初始pH分别为3.0、5.0、7.0和9.0时,反应12 h后,TBBP降解率分别为100%、99.62%、99.68%和99.66%,随着pH从3增加到9,反应速率常数从0.370 h−1减小到0.316 h−1,酸性条件下的降解率略高于中性和碱性条件,初始pH为5.0、7.0和9.0时降解效率之间相差不大. 出现这种趋势的原因是,在酸性条件下存在一定的酸催化效应(公式9、10)[19];硫酸亚铁溶液和过硫酸盐溶液自身呈酸性;两者在反应开始前3 min时较为迅速,PS很容易氧化Fe2+成为Fe3+,Fe3+水解也会使pH值降低. 总体来说,Fe2+耦合热活化PS体系具有良好的pH适应性,pH=3.0时最为合适.
S2O2−8+H+→HS2O−8 (9) HS2O−8→SO2−4+SO•−4+H+ (10) 2.3 无机阴离子在Fe2+/热/PS体系中的影响
在场地土壤和地下水的复杂系统中,可能存在无机阴离子对过硫酸盐降解污染物的过程产生一定制约[20]. 因此我们选取氯化钠和碳酸氢钠分别作为Cl−和
HCO−3 HCO−3 (1) Cl−
在最佳反应条件下(温度55 ℃、Fe2+浓度25 mmol·L−1、PS浓度50 mmol·L−1、pH=3),不同浓度的Cl−(0、5、50、100 mmol·L−1)对TBBPA降解的影响(如图6). 反应至4 h时,TBBPA的降解率分别为96.5%、96.2%、98.4%和99.4%;反应至12 h时,降解率分别为100%、99.7%、100%和100%,随着Cl−浓度从0 mmol·L−1增加至100 mmol·L−1,TBBPA完全去除所需时间缩短了2 h. 由图6(b)所示,反应符合准一级动力学模型,其对应的反应动力学常数分别为0.369 h−1、0.367 h−1、0.491 h−1和0.707 h−1. 当Cl−浓度较低时,Cl−与
SO·−4 SO•−4+Cl−→Cl•+SO2−4 (11) (2)
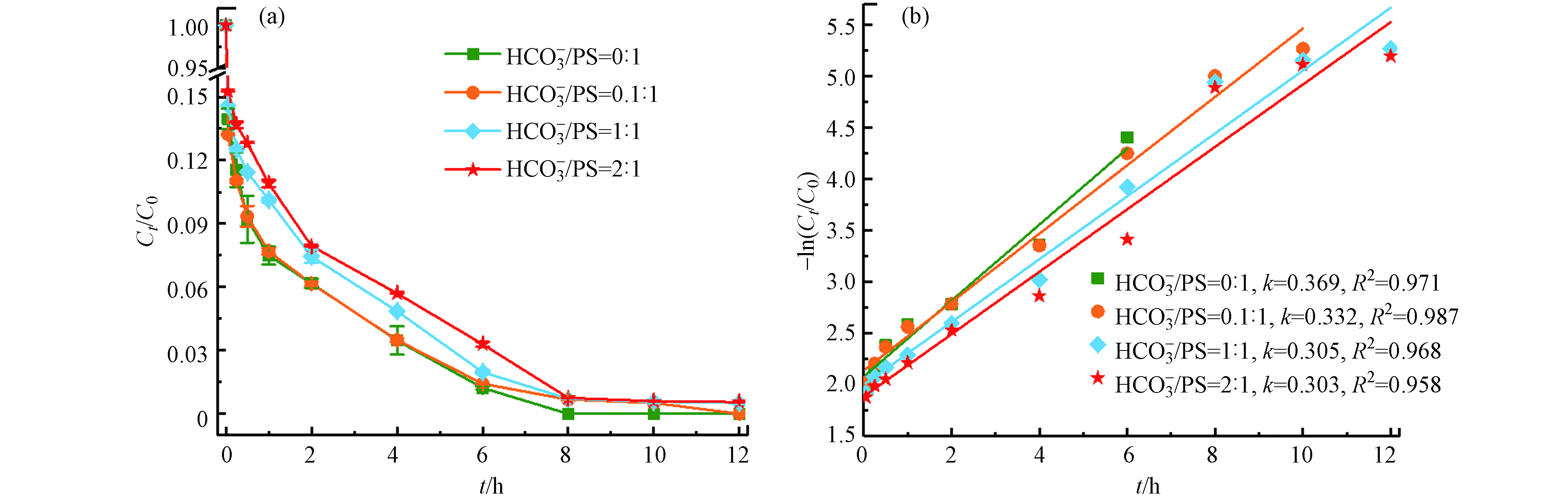
HCO−3 在最佳反应条件下(温度55 ℃、Fe2+浓度25 mmol·L−1、PS浓度50 mmol·L−1、pH=3),不同浓度的
HCO−3 随着
HCO−3 HCO−3 HCO−3 CO2−3 SO⋅−4 HCO⋅3 CO⋅−3 HCO−3 HCO−3→CO2−3+H+ (12) SO⋅−4+HCO−3→SO2−4+HCO⋅3 (13) SO⋅−4+CO2−3→SO2−4+CO⋅−3 (14) 2.4 金属离子Cu2+、Zn2+、Ni2+对Fe2+/热/PS体系催化活性的影响
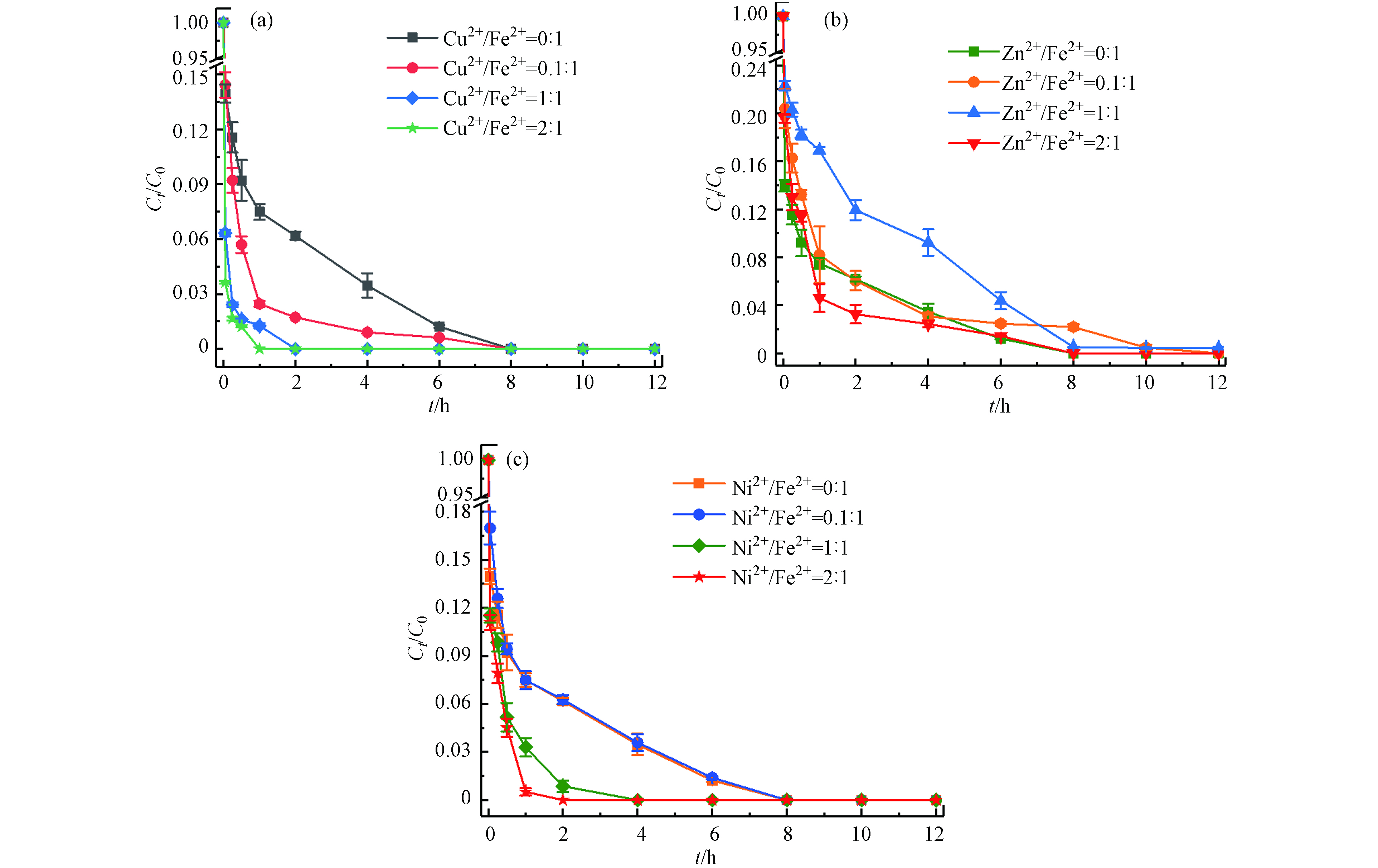
土壤中存在着大量的金属矿物,多种金属的存在也是影响应用的重要因素[23-24]. 本文选择土壤中的几种过渡金属(Cu2+、Zn2+、Ni2+)考察其对Fe2+/热/PS体系降解土壤中TBBPA的影响. 在体系最佳反应条件下(温度55 ℃、Fe2+浓度25 mmol·L−1、PS浓度50 mmol·L−1、pH=3),分别加入M2+/Fe2+摩尔比为0:1、0.1:1、1:1、2:1(M=Cu、Zn、Ni)的过渡金属离子,反应12 h后计算TBBPA降解效率. 结果如图8所示,Cu2+对Fe2+/热/PS体系表现出较好的促进作用,且随着Cu2+浓度的增大,TBBPA完全去除所需的时间从8 h(Cu2+/Fe2+摩尔比0:1)缩短到1 h(Cu2+/Fe2+摩尔比2:1);当增加Ni2+与Fe2+的摩尔比时,Ni2+显现出的促进作用由弱变强;而逐渐增大Zn2+与Fe2+的摩尔比时,对反应速率的影响出现由抑制转变成促进的双重作用. 这可能与M2+/M3+的氧化还原电位有关,△Ep(Cu2+/Cu3+)<△Ep(Ni2+/Ni3+)<△Ep(Zn2+/Zn3+),电位越低意味着催化剂越容易得到电子,有利于PS的活化[25];同时由于金属离子的氧化性Cu2+>Ni2+>Fe2+>Zn2+,Cu2+和Ni2+则更容易促使PS产生更多
SO⋅−4 3. 结论(Conclusion)
(1)Fe2+耦合热活化过硫酸盐的方法能高效降解土壤中TBBPA. Fe2+耦合热活化过硫酸盐降解土壤中TBBPA相比于单一热活化和Fe2+活化方式,降解率分别提升52.7%和10.1%.
(2)对Fe2+耦合热活化PS降解TBBPA的影响因素研究表明,TBBPA的降解率随着温度的增加而升高;增大亚铁离子浓度,TBBPA的降解速率呈现出先增加后降低的趋势,Fe2+与PS的最佳摩尔比为0.5:1;增大PS浓度能够显著提高TBBPA的降解率,缩短TBBPA去除时间;Fe2+耦合热活化PS体系具有较宽的pH应用范围且在酸性条件下更有利于降解. 最优条件:温度55 ℃、Fe2+浓度25 mmol·L−1、PS浓度50 mmol·L−1、pH=3.
(3)较高浓度的Cl-对Fe2+/热/PS体系中TBBPA的降解起促进作用,而HCO3-在研究浓度范围内均呈现抑制作用;Cu2+和Ni2+促进Fe2+/热/PS体系对TBBPA的降解,而随着Zn2+浓度的增加,TBBPA的降解速率呈现出先减小后增大的变化.
-
[1] 张斌, 刘金海, 冯晓辉. 印染废水污染现状及其处理技术的发展[J]. 科技信息, 2011(5):376-377 [2] SZYGUŁA A, GUIBAL E, RUIZ M, et al. The removal of sulphonated azo-dyes by coagulation with chitosan[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2008, 330(2/3):219-226 [3] RAMAKRISHNA K R, VIRARAGHAVAN T. Dye removal using low cost adsorbents[J]. Water Science and Technology, 1997, 36(2/3):189-196 [4] MAJEWSKA-NOWAK K, WINNICKI T, WIS'NIEWSKI J. Effect of flow conditions on ultrafiltration efficiency of dye solutions and textile effluents[J]. Desalination, 1989, 71(2):127-135 [5] XU Xiangrong, LI Xiangzhong. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion[J]. Separation and Purification Technology, 2010, 72(1):105-111 [6] LIANG Chenju, BRUELL C J, MARLEY M C, et al. Persulfate oxidation for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate-thiosulfate redox couple[J]. Chemosphere, 2004, 55(9):1213-1223 [7] JOHNSON R L, TRATNYEK P G, JOHNSON R O B. Persulfate persistence under thermal activation conditions[J]. Environmental Science & Technology, 2008, 42(24):9350-9356 [8] FANG Jingyun, SHANG C. Bromate formation from bromide oxidation by the UV/persulfate process[J]. Environmental Science & Technology, 2012, 46(16):8976-8983 [9] ANIPSITAKIS G P, DIONYSIOU D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13):3705-3712 [10] 杨梅梅, 周少奇, 刘聃, 等. 活性炭催化过硫酸钠降解金橙G动力学[J]. 环境科学, 2013, 34(3):962-967 [11] 占昌朝, 陈义, 严平, 等. 微波促进Fe@MCM-48催化K2S2O8降解甲基橙废水[J]. 环境工程学报, 2015, 9(7):3134-3140 [12] HOUSE D A. Kinetics and mechanism of oxidations by peroxydisulfate[J]. Chemical Reviews, 1962, 62(3):185-203 [13] ZUO Zhihua, CAI Zhongli, KATSUMURA Y, et al. Reinvestigation of the acid-base equilibrium of the (bi)carbonate radical and pH dependence of its reactivity with inorganic reactants[J]. Radiation Physics and Chemistry, 1999, 55(1):15-23 [14] MILLERO F J, SOTOLONGO S, IZAGUIRRE M. The oxidation kinetics of Fe(Ⅱ)in seawater[J]. Geochimica et Cosmochimica Acta, 1987, 51(4):793-801 [15] SMITH R M, MARTELL A E. Critical Stability Constants[M]. New York:Plenum Press, 1974 [16] NETA P, HUIE R E, ROSS A B. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(3):1027-1284 [17] STUMM W, MORGAN J J. Aquatic Chemistry:Chemical Equilibria and Rates in Natural Waters[M]. New York:John Wiley & Sons, 1996 [18] GAO Shanshan, DU Mao'an, TIAN Jiayu, et al. Effects of chloride ions on electro-coagulation-flotation process with aluminum electrodes for algae removal[J]. Journal of Hazardous Materials, 2010, 182(1/2/3):827-834 [19] BUXTON G V, GREENSTOCK C L, HELMAN W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(2):513-886 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2810
- HTML全文浏览数: 2131
- PDF下载数: 467
- 施引文献: 0



 DownLoad:
DownLoad: