储存控制条件对尿液氮磷的影响
Effects of storage and control conditions for urine on nitrogen and phosphorus content
-
摘要: 尿液源分离技术是现阶段国际研究热点,但其收集贮存过程中的尿素水解与磷沉淀问题影响该技术的推广应用。为了考察新鲜尿液的储存变化,对稀释、酸化和稀释酸化等储存控制条件对尿液尿素水解过程中pH、氨氮和磷酸盐的影响进行了研究。结果表明:稀释储存时,尿素会发生水解,pH值升高至9.19~9.25,氨氮量会升高,磷酸盐会减少20%~36%,而稀释因子1增加到6,沉淀减少了450~650 mg。初始酸化储存时,在初始pH小于4.00条件下,尿素水解会受到控制,磷沉淀损失会减少。稀释酸化储存时,在pH小于3.00及稀释因子2或3的条件下,尿素水解会受抑制且不发生磷沉淀。Abstract: Urine source-separation technology has been a hot international research topic,but the development of the technology is restricted by urea hydrolysis and phosphorus precipitation problems when urine is collected and transported.In order to investigate the stock changes of fresh urine,the effect of different storage and control conditions,which include dilution,acidification,and diluted acidification,on pH,ammonia nitrogen,and phosphorus for urea hydrolysis were studied.The results showed that under the conditions of the diluted storage,the pH value increased from 9.19 to 9.25 and ammonia nitrogen increased while the urea hydrolyzes,but phosphate decreased from 20% to 36%.When the dilution factor was increased from 1 to 6,the amount of precipitation decreased from 450 to 650 mg.When the initial pH value is less than 4.00,acidification storage of urine can control urea hydrolysis.When the pH value is less than 3.00 and dilution factor is 2 or 3,diluted acidification can inhibit the hydrolysis process and relieve the problem of spontaneous precipitation in urine.
-
Key words:
- acidification /
- dilution /
- phosphorus precipitation /
- urine storage /
- urea hydrolysis
-
土霉素(oxytetracycline, OTC)是常见的四环素类抗生素,广泛用作抗菌剂。土霉素进入生物体后,约50%~80%无法被吸收,被排出体外。抗生素释放到水环境中,一方面不容易被清除,另一方面容易诱变耐药基因,由此造成严重的水体污染,进而影响了人类的身体健康[1]。因此水体中土霉素的去除研究十分必要。
吸附法广泛用于难降解污染物(如重金属离子、抗生素类、氯代酚类、染料等)的去除。活性炭(AC)具有孔隙多、比表面积大的表面特征,在废水处理领域中主要用于处理重金属、染料、有机物以及净化饮用水等方面[2-3]。但AC价格高,粉末状的AC从溶液中分离回收困难,在吸附过程中常常有质量损失。
磁性材料具有特殊性,可以在外磁场的存在下将固体材料从溶液中分离出来,近10年来受到重视。但直接用磁性材料如Fe3O4作吸附剂,吸附能力差。将活性炭赋予磁性,在保证其基本吸附性能的基础上,能够实现简单分离,解决了AC在使用过程中固液分离困难以及不易回收的问题,在废水处理中的应用范围更加广泛[4-6]。课题组采用共沉淀法制备了磁性活性炭(MAC),在表征的基础上,研究了其对阳离子染料、氯代酚和硝基酚的吸附性能,发现MAC有较大的吸附量,且可以再生使用,同时具有好的固水分离性能[7-8]。本文利用盐酸土霉素(OTC-HCl)作为目标物,研究MAC对OTC-HCl的吸附和解吸特征,并用吸附模型对实验结果进行了拟合,所得结果为其进一步应用提供参考。
1. 材料与方法
1.1 原料、试剂与仪器
原料:粉末活性炭(AC,200目)。试剂:FeSO4、FeCl3、NaCl、Na2SO4、CaCl2、盐酸土霉素(OTC-HCl,化学纯)、聚乙二醇,实验所用化学试剂未特殊指明均为分析纯,实验过程中所用水均为蒸馏水。仪器:恒温振荡器(SHZ-82,常州国华电器有限公司)、紫外-可见分光光度计(752,上海舜宇恒平仪器有限公司)、精密酸度计(PHS-3C,上海仪电科学仪器)。
1.2 实验方法
采用文献中的方法[8],称取1.6 g AC和0.04 g聚乙二醇,放于水中,搅拌15 min。随后加入2.03 g FeCl3和1.39 g FeSO4,继续搅拌30 min。随后滴加pH=12.5的氨水溶液,直至溶液的pH为11,陈化30 min,恒温水浴50 ℃。反应结束后,用磁铁分离产物,蒸馏水洗涤60 ℃干燥,制得MAC。
表征结果说明,MAC中磁性材料γ-Fe2O3为主要成分,AC约为50%;MAC的饱和磁化强度为5.20 emu·g–1,表面积为1.13 ×103 m2·g−1,MAC的等电点pH为7.09,MAC呈现无规则的颗粒状结构且颗粒尺寸不均匀,大多数微粒尺寸小于1 μm。
采用静态法进行实验,将0.015 g MAC放入50 mL锥形瓶中,加入一定质量浓度的OTC-HCl溶液10 mL,在恒温振荡器进行吸附。一定时间后,采用磁铁分离,取上清液,用分光光度法测定OTC-HCl的浓度,根据吸附前后溶液的浓度差计算。吸附温度分别控制在293、303和313 K。土霉素的测定采用紫外分光光度法,测定波长为269 nm。依据吸收定律,吸光度与OTC的质量浓度在一定范围内呈线性关系。
按固液比为1.5 g·L–1加入MAC和500 mg·L–1 OTC-HCl溶液,于303 K恒温振荡器中吸附600 min,取出锥形瓶,进行磁铁分离,测定上清液中OTC-HCl的浓度,计算qe。固液分离后的OTC-HCl-MAC用蒸馏水洗涤数次后干燥,然后用0.01 mol·L–1 NaOH溶液作为解吸液脱附(固液比为1.5 g·L–1),计算解吸率(D,吸附质解吸后进行溶液的量与解吸前吸附剂上的量比值)。将解吸后的MAC用蒸馏水洗涤干燥,进行新一轮的再生实验,计算再生率(再生率为再吸附时单位质量吸附剂的吸附量与第1次吸附时的吸附量比值)。
2. 结果与讨论
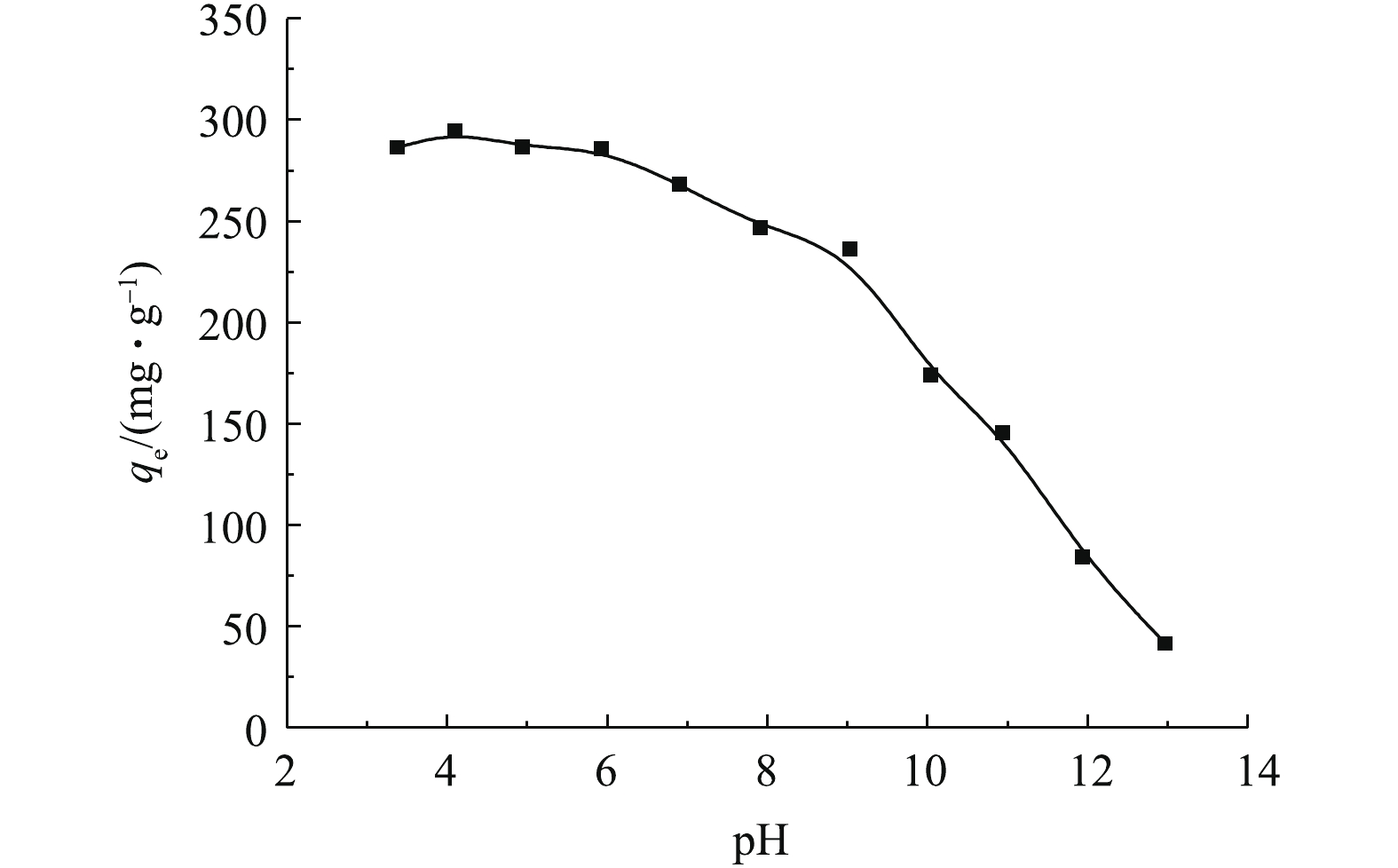
2.1 溶液pH对吸附效果的影响
溶液pH不仅影响吸附剂表面的性质,也影响吸附质的存在状态。溶液pH对MAC吸附OTC-HCl的结果如图1所示(C0=500 mg·L−1, t=600 min, T=303 K)。由图1可知,在pH为3~6时,吸附量变化不大,pH超过6时,吸附量逐渐减小。由于OTC-HCl溶液的初始pH为3.40,因此后续实验可以不调pH。
土霉素是一种两性物质,具有多种极性基团,包括氨基和羟基,有两级离解常数(pKa1=3.53, pKa2=9.58)[9]。在pH<3.53时,OTC主要以正离子状态存在;在3.53<pH<9.58时,OTC以两性分子存在;在pH>9.58时,主要以负离子的形式存在。MAC的等电点为7.09,当溶液pH小于7.09时,吸附剂表面带正电,故当溶液pH<3.3时,吸附剂和吸附质之间产生静电排斥,影响吸附作用的进行。当3.53<pH<7.09时,土霉素主要以两性分子状态存在,MAC表面带正电荷,两性的OTC与MAC可能通过静电引力、氢键作用力和范德华力结合,此时OTC-HCl易吸附在MAC表面。当溶液pH>7.09时,OTC与MAC之间形成静电斥力,故MAC对OTC-HCl的吸附能力逐渐降低。
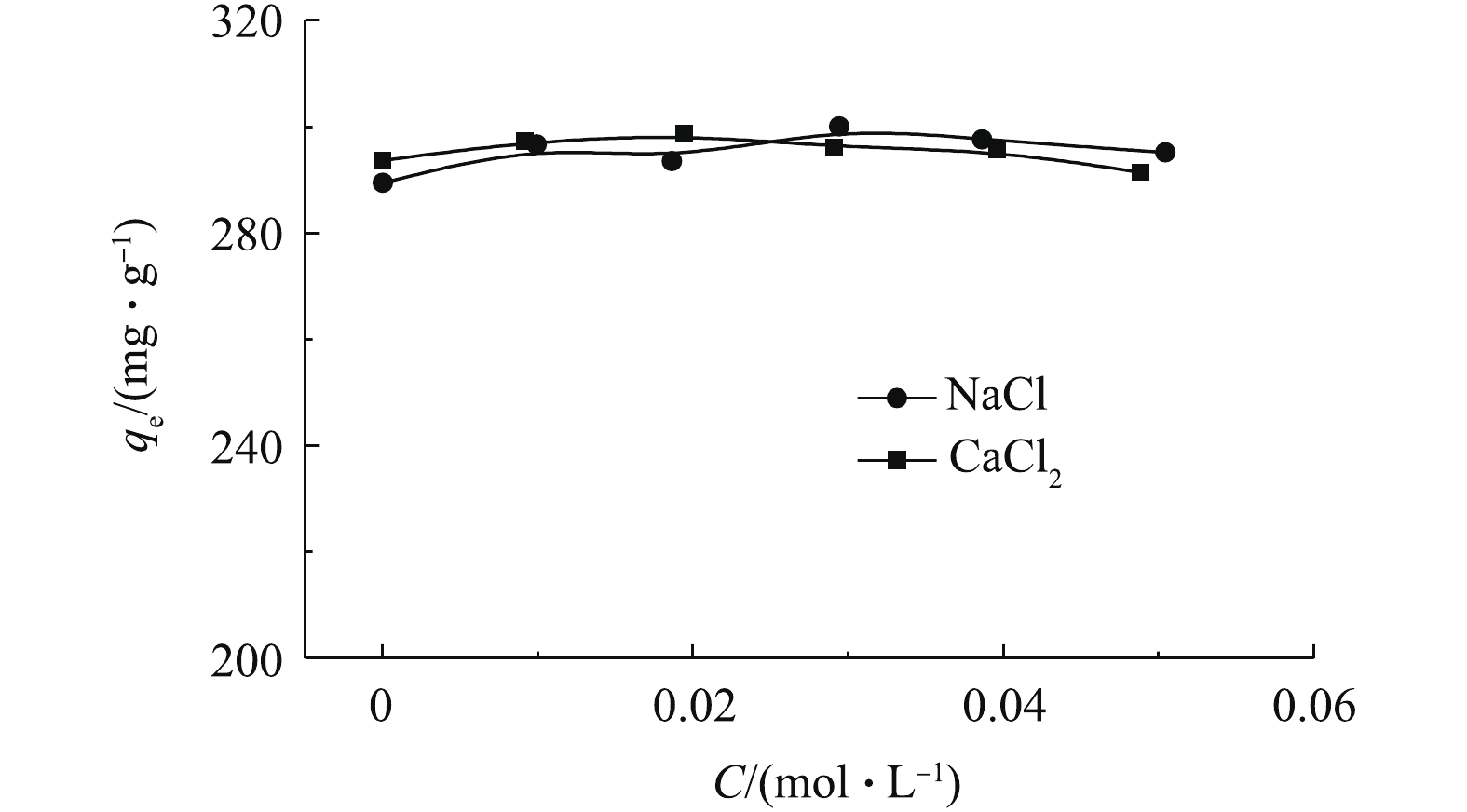
2.2 溶液盐度对吸附效果的影响
实际废水中常常含有盐类,因此,研究盐浓度对吸附的影响十分必要。不同浓度的NaCl和CaCl2对吸附的影响如图2所示(C0=500 mg·L−1, t=600 min,T=303 K)。可以看出,不同浓度的NaCl和CaCl2对吸附量的影响很小,说明无机盐离子的存在对吸附过程基本无影响,也说明离子交换作用不是主要的吸附机理。采用Mag@ZnO-Co3O4对土霉素进行吸附,得出的结论[10]与本研究一致。
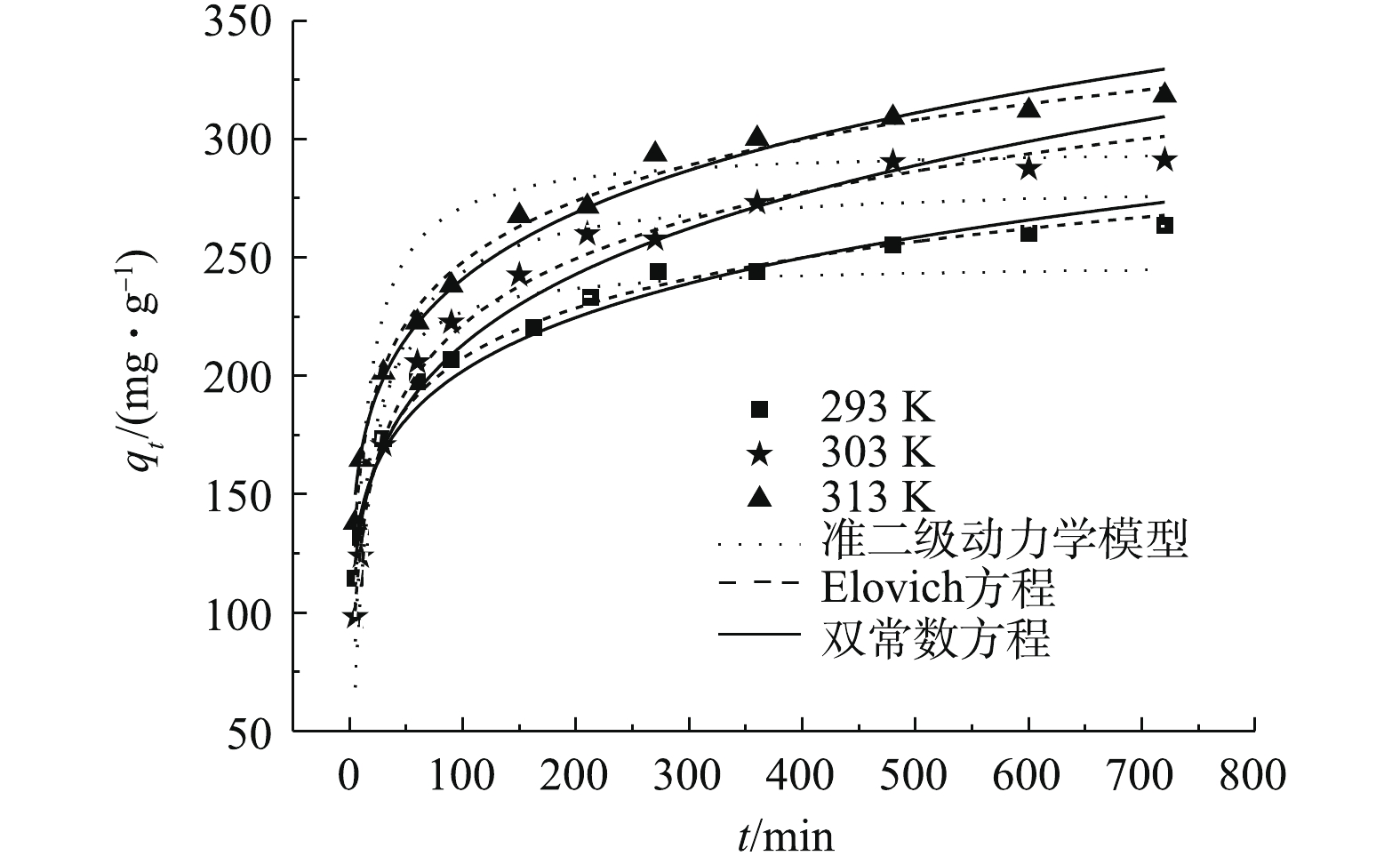
2.3 吸附时间的影响
接触时间对吸附的影响如图3所示(注:C0=500 mg·L−1)。可以看出,随着温度的增加,MAC对OTC-HCl吸附量逐渐变大,说明该吸附过程是一个吸热反应。在同一温度下,随着时间的增加,吸附量迅速变大,然后增加幅度变小,最后趋于平衡。平衡时间超过600 min,说明存在着内扩散的作用。在同样条件下,磁性氧化铁对OTC-HCl几乎没有结合能力。
采用常见的3种动力学模型(见表1)对动力学结果进行非线性拟合分析,结果见表2,拟合曲线见图3。
表 1 吸附动力学模型和吸附等温线模型Table 1. Expression of selected kinetic models and isotherm models模型名称 方程式 符号说明 准二级动力学模型 
k2为准二级速率常数 Elovich方程 
A和B为常数 双常数方程 lnqt = lnA+Kslnt A为常数,Ks为吸附速率系数 Langmuir模型 
qm为单分子层理论饱和吸附量; KL为与结合能有关的常数 Temkin模型 
A和B是方程参数 Koble-Corrigan模型 
A和B为方程参数 Toth模型 
qm为最大吸附量;bT为Langmuir平衡常数;nT是参数 表 2 MAC对OTC-HCl的动力学模型拟合结果Table 2. Fitted results of OTC-HCl adsorption onto MAC with kinetic models模型 T/K qe(exp)/(mg·g−1) qe(theo)/(mg·g−1) k2/(g·(mg·min)−1) R2 误差 准二级动力学模型 293 263 248±6 (4.43±0.92)×10−4 0.893 2.64×103 303 291 282±8 (2.27±0.44)×10−4 0.933 2.88×103 313 318 296±10 (3.61±0.93)×10−4 0.839 5.87×103 方程 T/K A B R2 误差 Elovich方程 293 66.6±3.6 30.6±0.7 0.994 152 303 35.7±5.6 40.4±1.1 0.991 365 313 76.2±4.6 37.3±0.9 0.993 242 方程 T/K A Ks R2 误差 双常数方程 293 99.7±5.1 0.153±0.009 0.970 740 303 89.2±7.2 0.189±0.015 0.955 1.91×103 313 116±5 0.159±0.007 0.983 613 表中误差按式(1)计算。
误差=∑(q−qc)2 (1) 式中:q为实验结果;qc为理论计算结果。
根据表2的结果,可决系数R2由大到小依次为Elovich方程>双常数方程>准二级动力学模型,误差则依次变大,由图3可看出,Elovich方程的拟合曲线与实验曲线最接近,因此,Elovich方程更好地预测吸附动力学过程。
由t1/2值(吸附量达到平衡吸附量一半时需要的时间)可以计算扩散系数。假定吸附剂为均匀球形颗粒,孔隙扩散系数[7,11-12]可按式(2)计算。
Dp=0.03r20t1/2 (2) 式中:Dp为扩散系数,cm2·s−1;r0为吸附剂直径,cm;t1/2为单位吸附量过半时的吸附时间,s。
由Elovich方程计算出的t1/2,可得温度为293、303、313 K时OTC-HCl在MAC表面的扩散系数,其数值分别为6.00×10−13、3.30×10−13、5.43×10−13 cm2·s−1。所得扩散系数的数量级为10−13,孔隙扩散过程对吸附的影响较大,可以影响吸附速率及平衡时间。
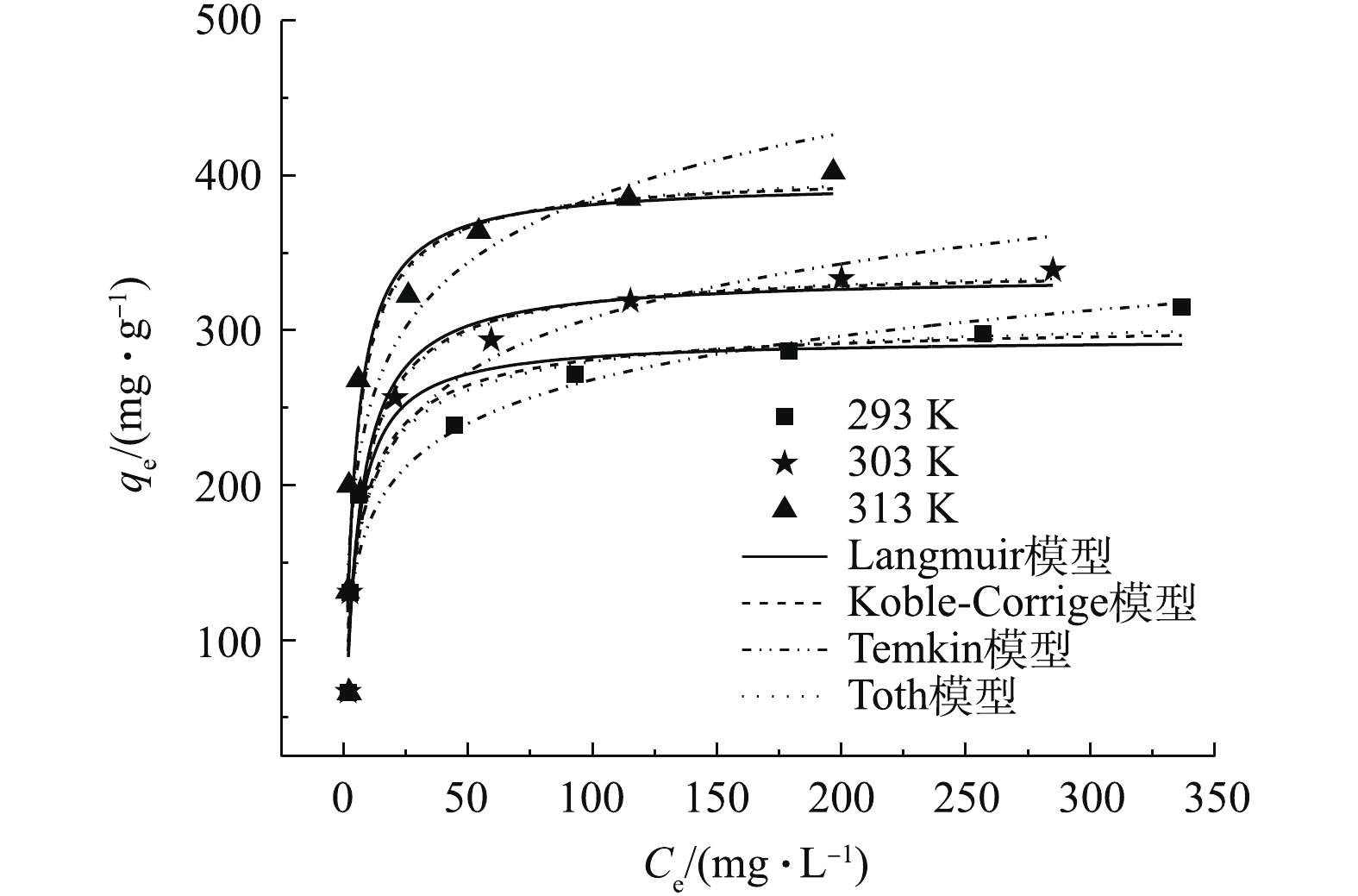
2.4 OTC-HCl浓度的影响
不同OTC-HCl平衡浓度的影响如图4所示。可以看出,在浓度较低时,随着浓度的增加,吸附量迅速变大,随后吸附量增加缓慢,最终趋于平衡。这是因为在浓度低时,MAC具有较多的活性位点,易结合OTC-HCl,随浓度的增加,吸附量增加幅度较大;随着OTC-HCl浓度的增加,单位吸附量缓慢增加,趋势逐渐平缓,是因为MAC的吸附位点被逐渐饱和,吸附逐渐达到饱和状态。由图4还可看出,温度升高有利于吸附。
采用常见的4种吸附等温线模型(方程式见表1)对不同温度下的结果进行拟合,结果见表3,拟合曲线见图4。可以看出,Langmuir模型的R2较大,误差较小,说明该模型可以较好地预测平衡吸附过程。该吸附过程主要是单分子层的吸附过程。另外,qm与实验所得qe接近,且qm和qe均随着温度升高变大,说明该吸附过程是一个吸热反应。Temkin模型适用于多相表面吸附,可以看出,该模型的拟合结果较差,不适合用来描述吸附过程。Koble-Corrigan模型是Langmuir和Freundlich模型的结合形式,拟合所得R2较大,误差较小,可以用于描述其吸附过程。其n值为0.791~0.925,B值为0.204~0.281,MAC吸附OTC-HCl包含单分子和多分子层吸附共存的过程。Toth模型克服Langmuir模型对高浓度和Freundlich模型对低浓度的限制,适应多种类型等温线的拟合。根据表3的拟合结果,发现Toth模型得到的最大吸附量与实验值接近,误差最小,且图4中Toth的拟合曲线与实验曲线最接近,说明Toth模型预测平衡吸附过程最好,也说明该吸附过程含有不均匀表面的吸附。由于在同一条件下,由Toth模型和Koble-Corrigan模型得到的R2值和误差非常接近,因此再者的拟合曲线几乎重叠。
表 3 MAC吸附OTC-HCl的吸附等温线拟合结果Table 3. Fitted results of OTC-HCl adsorption onto MAC with isotherm models模型 T/K KL/(L·mg−1) qe(exp)/(mg·g−1) qm(theo)/(mg·g−1) R2 误差 Langmuir 293 0.239±0.051 315 294±11 0.935 3.03×103 303 0.118±0.025 338 335±9 0.976 1.46×103 313 0.262±0.077 402 396±27 0.872 1.18×104 模型 T/K A B R2 误差 Temkin 293 80.7±17.6 40.7±4.3 0.925 3.49×103 303 76.2±18.6 50.3±4.9 0.936 3.92×103 313 108±31 60.3±9.8 0.841 1.47×104 T/K A B n R2 误差 Koble-Corrigan 293 86.3±33.4 0.281±0.096 0.791±0.299 0.925 2.94×103 303 69.7±17.5 0.204±0.047 0.918±0.164 0.973 1.40×103 313 111±56 0.275±0.123 0.925±0.461 0.847 1.18×104 模型 T/K qm(theo)/(mg·g−1) bT nT R2 误差 Toth 293 317±40 0..419±0.424 1.52±0.78 0.929 2.79×103 303 345±19 0.225±0.082 1.18±0.30 0.974 1.35×103 313 406±64 0.304±0.272 1.15±0.82 0.848 1.17×104 2.5 吸附剂的解吸及再吸附性能
吸附剂循环利用可以回收吸附质,也可以提高吸附剂的效率[13-14]。采用0.01 mol·L−1 NaOH溶液作为解吸剂,3次解吸率分别为62.2%、54.2%和47.7%,再生率分别为85.4%、76.0%和75.8%。结果说明MAC有一定的解吸及重复使用性能。
一次解吸时间对解吸率的影响结果如图5所示。可以看出,解吸开始时,解吸速率快,5 min解吸率就达到了26.3%;随后变缓,在480 min时,实现了解吸基本平衡,解吸率达到62.2%。解吸率及再生率下降的原因主要是部分HCl-OTC进入吸附剂孔内部,或与吸附剂结合牢固,不易解吸下来。使用多次后,采用外部磁场仍很容易进行分离,说明磁性稳定。
采用表1的动力学方程对图5的结果进行拟合分析,拟合曲线见图5。拟合结果如下:准二级动力学模型,解吸率=60.7±1.3,k2=(1.88±0.32)×10−3,R2=0.935,误差=88.4;Elovich方程,A=16.1±1.7,B=7.71±0.36,R2=0.978,误差=294;双常数方程,A=12.5±1.1,Ks=0.141±0.020,R2=0.892,误差=16.1。
根据R2、误差和拟合曲线与实验值的比较,准二级动力学模型和Elovich方程可以预测解吸动力学,且Elovich方程的R2值最大,误差最小,且该模型主要描述离子交换过程。OTC-HCl-MAC的解吸过程很可能是离子交换的过程。
采用MAC吸附对氯苯酚和对硝基苯酚,也可用NaOH溶液进行再生,解吸过程可用准二级动力学模型和Elovich方程预测,但准二级动力学模型更准确[7],这与本研究的结果有区别。阳离子表面活性剂改性树叶对2,4-二氯苯酚有较好的吸附能力,用75%乙醇溶液解吸,准二级动力学模型可拟合解吸结果[15],这也与本研究的结果有差别。
3. 结论
1)溶液pH影响MAC对OTC-HCl的吸附量,共存盐的影响小,升温有利于吸附。
2) MAC对OTC-HCl的吸附过程符合Langmuir模型和Elovich动力学模型,推测该过程是单分子层的非均相扩散过程。
3)吸附OTC-HCl后的MAC有一定的解吸再生性能,MAC可用于水体中此类污染物的去除。
-
[1] TRIGER A.,PIC J.S.,CABASSUD C.Determination of struvite crystallization mechanisms in urine using turbidity measurement.Water Research,2012,46(18):6084-6094 [2] MIHELCIC J.R.,FRY L.M.,SHAW R.Global potential of phosphorus recovery from human urine and feces.Chemosphere,2011,84(6):832-839 [3] CORDELL D.,DRANGERT J.O.,WHITE S.The story of phosphorus:Global food security and food for thought.Global Environmental Change,2009,19(2):292-305 [4] LIENERT J.,LARSEN T.A.High acceptance of urine source separation in seven European countries:A review.Environmental Science & Technology,2010,44(2):556-566 [5] 张健,高世宝,章菁,等.生态排水的理念与实践.中国给水排水,2008,24(2):10-14 ZHANG Jian,GAO Shibao,ZHANG Jing,et al.Concept and application demonstration for ecological sanitation.China Water & Wastewater,2008,24(2):10-14(in Chinese) [6] MAURER M.,PRONK W.,LARSEN T.A.Treatment processes for source separated urine.Water Research,2006,40(17):3151-3166 [7] 郑向勇,叶海仁,程天行,等.源分离尿液处理技术的研究进展.水处理技术,2012,38(12):16-20 ZHENG Xiangyong,YE Hairen,CHENG Tianxing,et al.Progress on the treatment of source separated urine.Technology of Water Treatment,2012,38(12):16-20(in Chinese) [8] HELLSTRÖM D.,JOHANNSON E.,GRENNBERG K.Storage of human urine:Acidification as a method to inhibit decomposition of urea.Ecological Engineering,1999,12(3/4):253-269 [9] UDERT K.M.,LARSEN T.A.,GUJER W.Estimating the precipitation potential in urine-collecting systems.Water Research,2003,37(11):2667-2677 [10] KABDAŞLI I.,TÜNAY O.,IŞLEK C.,et al.Nitrogen recovery by urea hydrolysis and struvite precipitation from anthropogenic urine.Water Science and Technology,2006,53(12):305-312 [11] UDERT K.M.,LARSEN T.A.,GUJER W.Fate of major compounds in source-separated urine.Water Science and Technology,2006,54(11/12):413-420 [12] 郝晓地,宋虹苇,赵靖.尿液分离与源头控制卫生排水系统.中国给水排水,2005,21(6):24-27 HAO Xiaodi,SONG Hongwei,ZHAO Jing.Urine separation and source control for sanitary sewage drainage system.China Water & Wastewater,2005,21(6):24-27(in Chinese) [13] 董良飞,蒋健钗,UDERT K.M.,等.尿液源头分离系统中的沉淀研究.环境工程学报,2008,2(7):964-968 DONG Liangfei,JIANG Jianchai,UDERT K.M.,et al.Study on the precipitation in source-separating urine system.Chinese Journal of Environmental Engineering,2008,2(7):964-968(in Chinese) [14] ETTER B.,TILLEY E.,KHADKA R.,et al.Low-cost struvite production using source-separated urine in Nepal.Water Research,2011,45(2):852-862 [15] FITTSCHEN I.,HAHN H.H.Characterization of the municipal wastewaterpart human urine and a preliminary comparison with liquid cattle excretion.Water Science and Technology,1998,38(6):9-16 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 1905
- HTML全文浏览数: 1510
- PDF下载数: 566
- 施引文献: 0




 下载:
下载: