Abstract
Sludge carbon adsorbent was made by the improved ZnCl2 chemical activation,EDS and the nitrogen adsorption tests were used to characterize the sludge carbon adsorbents,and it wus used to remove the mercury in simulated flue gas. The results indicated that Hg vapor adsorption of sludge carbon adsorbents included physical adsorption and chemical adsorption, in the two adsorption mechanisms physical adsorption was main. When the concentration of mercury was increased, saturated adsorption capacity of sludge carbon adsorbent for mercury was increased. When the reaction temperature was increased, the mercury adsorption process of sludge carbon adsorbent was decreased. When the reaction temperature was 125℃, concentration of mercury was 60.4 μg/m3, the saturated adsorption capacity of sludge carbon adsorbent and selected activated carbon was 81.2 μg/g and 53.8 μg/g, the adsorption of mercury by sludge carbon adsorbent was better than that of selected activated carbon.
高炉煤气是炼铁行业的主要副产物,是钢铁企业重要的二次能源,已成为钢铁企业节能降耗及达标排放的关键[1-3]。高炉煤气气量大,每炼1 t铁可生产1 700~2 500 m3高炉煤气。目前,我国高炉煤气的产量高达2.33×109~2.67 ×109 m3·d−1,为将其净化并后续应用,主要采用重力除尘器联用袋式除尘器以去除颗粒物。在其经余压发电后送往高炉热风炉、轧钢加热炉、煤气发电等用户单元作为燃料使用,但未经脱硫净化处理的高炉煤气在燃烧后会产生SO2。这使得烟气的SO2质量浓度无法满足国家超低排放限值50 mg·m−3,故亟待治理[4]。
高炉煤气成分与高炉所用燃料、所炼生铁的品种和冶炼工艺有关[5-6],主要成分包括CO、CO2、N2、O2、H2,以及少量硫化物。其中,硫化物包括羰基硫(carbonyl sulfide,COS)、H2S、二硫化碳(CS2)、硫醇、硫醚和噻吩等,以COS、H2S为主。COS约占总硫的80%。H2S易与碱性物质发生中和反应而去除,而有机硫COS相对比较稳定,用常规方法难以直接脱除。这亦成为高炉煤气精脱硫技术的主要对象和技术突破点[7-8]。
高炉煤气精脱硫是一项正研发试用中的新兴技术。目前,高炉煤气脱硫主要工艺路线为:高炉煤气→ 重力除尘→
重力除尘→ 袋式除尘→
袋式除尘→ 有机硫水解转化→
有机硫水解转化→ 余压透平发电系统(blast furnace top gas recovery turbine unit,TRT)→
余压透平发电系统(blast furnace top gas recovery turbine unit,TRT)→ 干法或湿法脱除硫化氢→
干法或湿法脱除硫化氢→ 管网。此工艺包含水解和H2S脱除两段工序。工艺尚存在投资高、水解催化剂技术不成熟、使用寿命短等问题;在有机硫水解转化后高炉煤气中H2S增多,H2S处于高温高压环境中并溶于煤气冷凝水,会形成氢硫酸并对TRT设施和附属管道带来腐蚀作用[4]。脱硫设备阻力会提高TRT背压,从而影响TRT的发电量[9-10]。
管网。此工艺包含水解和H2S脱除两段工序。工艺尚存在投资高、水解催化剂技术不成熟、使用寿命短等问题;在有机硫水解转化后高炉煤气中H2S增多,H2S处于高温高压环境中并溶于煤气冷凝水,会形成氢硫酸并对TRT设施和附属管道带来腐蚀作用[4]。脱硫设备阻力会提高TRT背压,从而影响TRT的发电量[9-10]。
为简化脱硫工艺、解决脱硫系统对除尘系统和TRT的发电量影响、反应器和附属管道的腐蚀等问题,本研究提出一种电化学协同增效湿法吸收精脱硫工艺:高炉煤气→ 重力除尘→
重力除尘→ 袋式除尘→
袋式除尘→ 余压透平发电系统(TRT)→
余压透平发电系统(TRT)→ 电化学协同湿法吸收脱硫→
电化学协同湿法吸收脱硫→ 管网。基于电化学协同湿法吸收精脱硫工艺方法,得到复合吸收剂(Na2CO3+EDTA+EDTA-2Na)的最佳组分配比、脱硫性能规律及机理,以期为高炉煤气精脱硫技术发展及关键工艺参数的确定提供参考。
管网。基于电化学协同湿法吸收精脱硫工艺方法,得到复合吸收剂(Na2CO3+EDTA+EDTA-2Na)的最佳组分配比、脱硫性能规律及机理,以期为高炉煤气精脱硫技术发展及关键工艺参数的确定提供参考。
1. 实验部分
1.1 实验材料及装置
1.1.1 实验材料
实验所用原料气为模拟高炉煤气的标气配气,其中各组分的参数见表1。
1.1.2 实验系统及装置
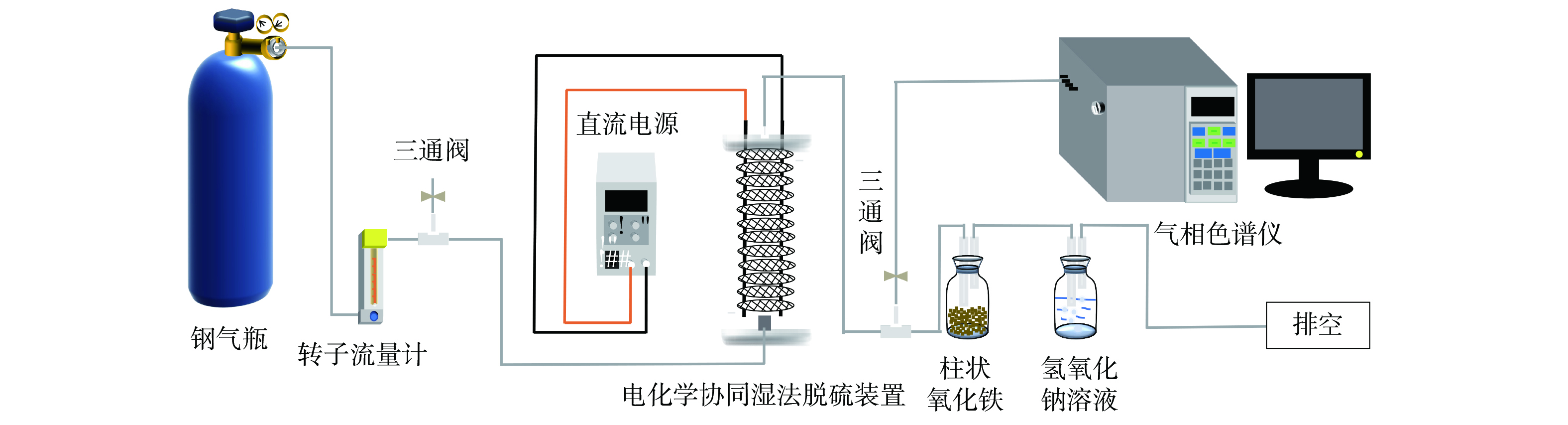
实验系统主要由配气系统、电化学协同湿法吸收装置、尾气吸收瓶和气体分析检测系统组成(图1)。电化学协同湿法吸收装置的主体为Φ65 mm圆柱形石英玻璃管。石英玻璃壳体外部下端设有进气口(配气进入反应装置的压力为0.04 MPa)、出液口,上端设有出气口、进液口。系统中内置有长度60 cm、直径2 mm的惰性阴极柱、阳极柱浸泡于吸收液中,吸收液液位高度为45.20 cm,且外加电源的负极和正极分别与其相连接。阳极柱和阴极柱分别与涂有贵金属钌铱的金属钛网和金属钛网镶嵌链接。两种钛网相互交错,构成层式塔状结构以增加COS与电极接触面积和接触时间。吸收装置压降为3.5~4.0 kPa。气体分析检测采用GC9790Ⅱ气相色谱仪(浙江福立,FPD检测器)。
1.2 电化学协同湿法吸收精脱硫方法的机理
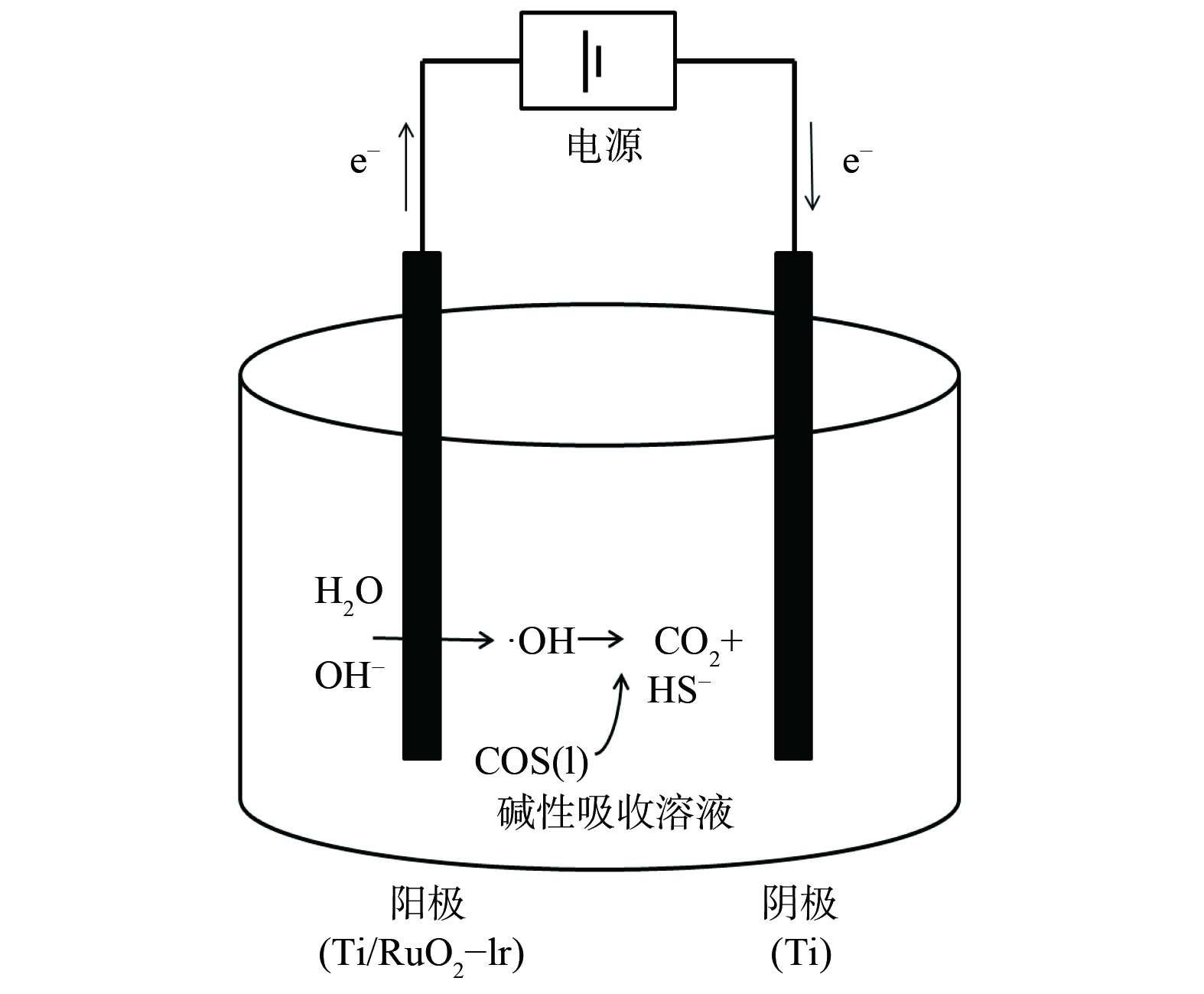
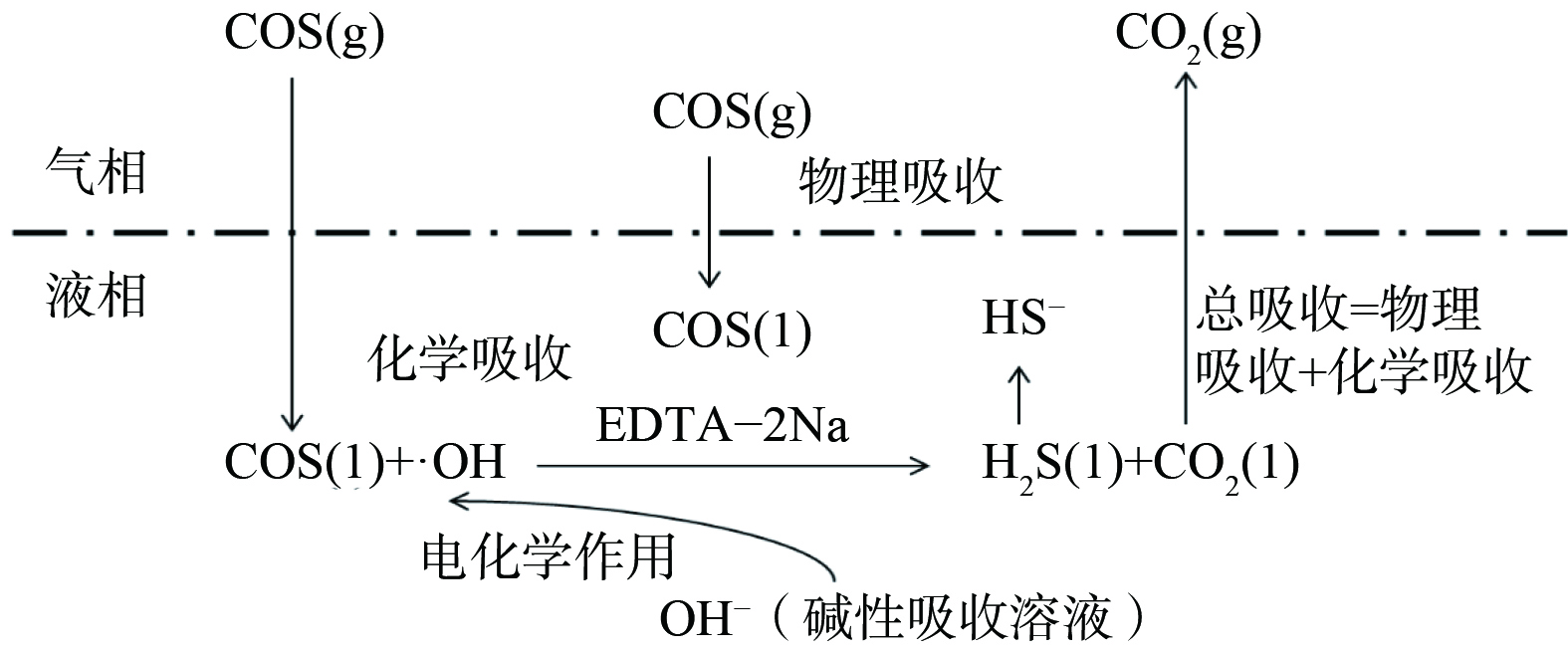
电化学较常规碱性介质脱除COS方法提高了反应速率和脱除率。电化学催化氧化脱硫机理如图2所示,该方法借助电化学电极催化活性,在阳极电极界面附近直接或间接产生具有更高氧化能力的⋅OH 等活性物质,并利用这些活性物质打开C==S、分解COS,将COS催化氧化为CO2和HS−,从而提高了有机硫的去除效率[11]。
等活性物质,并利用这些活性物质打开C==S、分解COS,将COS催化氧化为CO2和HS−,从而提高了有机硫的去除效率[11]。
2. 结果与讨论
2.1 不同EDTA-2Na物质的量比例对COS脱除效果的影响
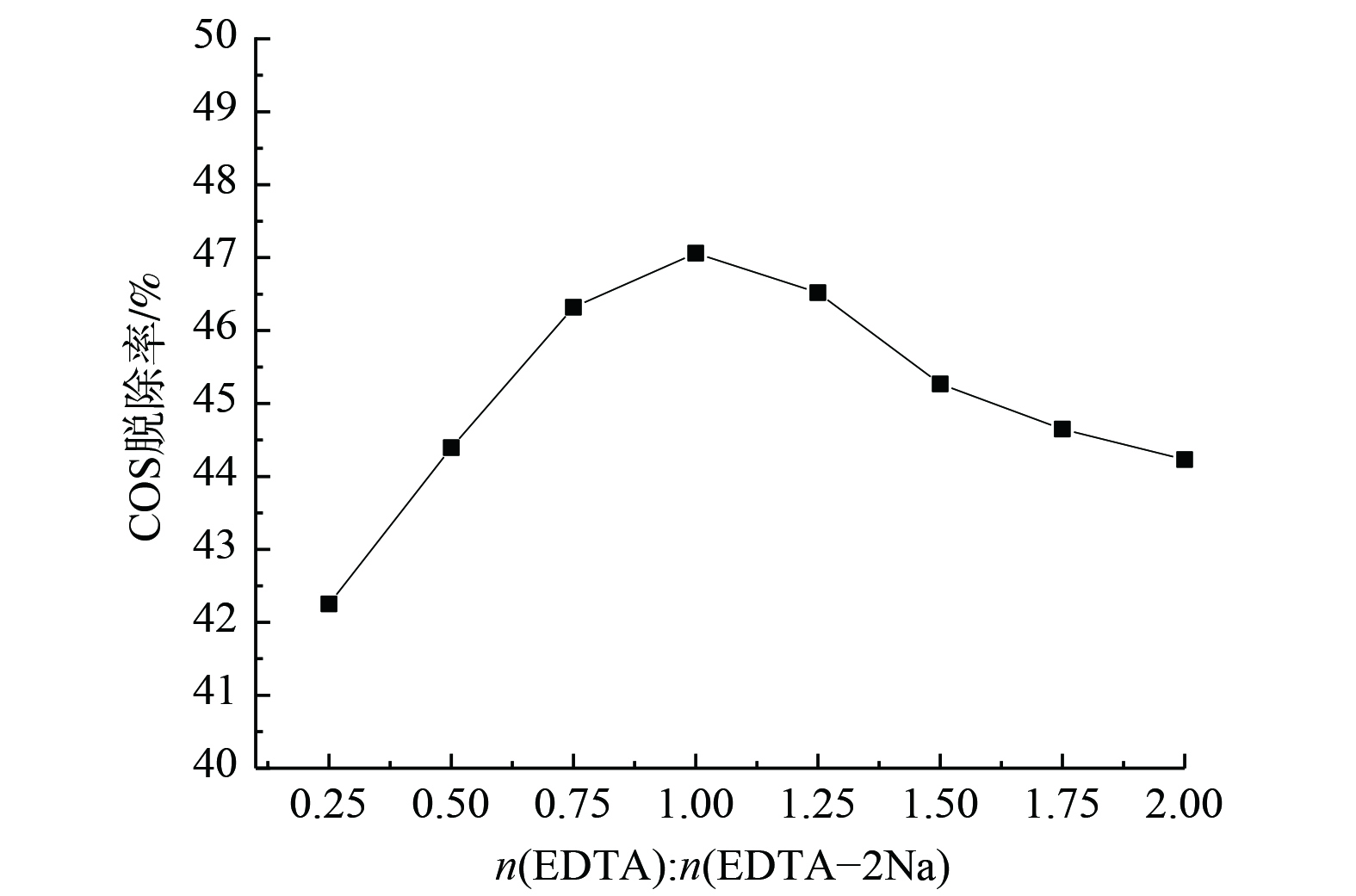
当吸收剂中Na2CO3与(EDTA+EDTA-2Na)质量分数均为5%时,EDTA与EDTA-2Na的不同配比对COS脱除效率的影响如图3所示。随着两者比值的增加,COS脱除效率呈先增大后减小的趋势。只有当比值接近等物质的量时,脱硫效率方可达到最佳。这是由于EDTA、EDTA-2Na在溶解后会形成酸碱共轭体系,其反应机理为:在溶液中EDTA与Na2CO3反应生成EDTA-2Na,碱性介质促进了COS更大程度地水解生成H2S。而加入EDTA溶液还可提高通气时硫化氢溶液的稳定性,之后由于EDTA酸性介于碳酸和氢硫酸之间,EDTA-2Na与已吸收的H2S(以氢硫酸形式存在)反应,同时EDTA得以再生[12-13]。因此,只有当EDTA与EDTA-2Na物质的量之比为1时,二者才能起到协同作用以增强液相中碳酸钠对COS的去除效果。
2.2 吸收剂各组分浓度及配比对COS脱除效果的影响
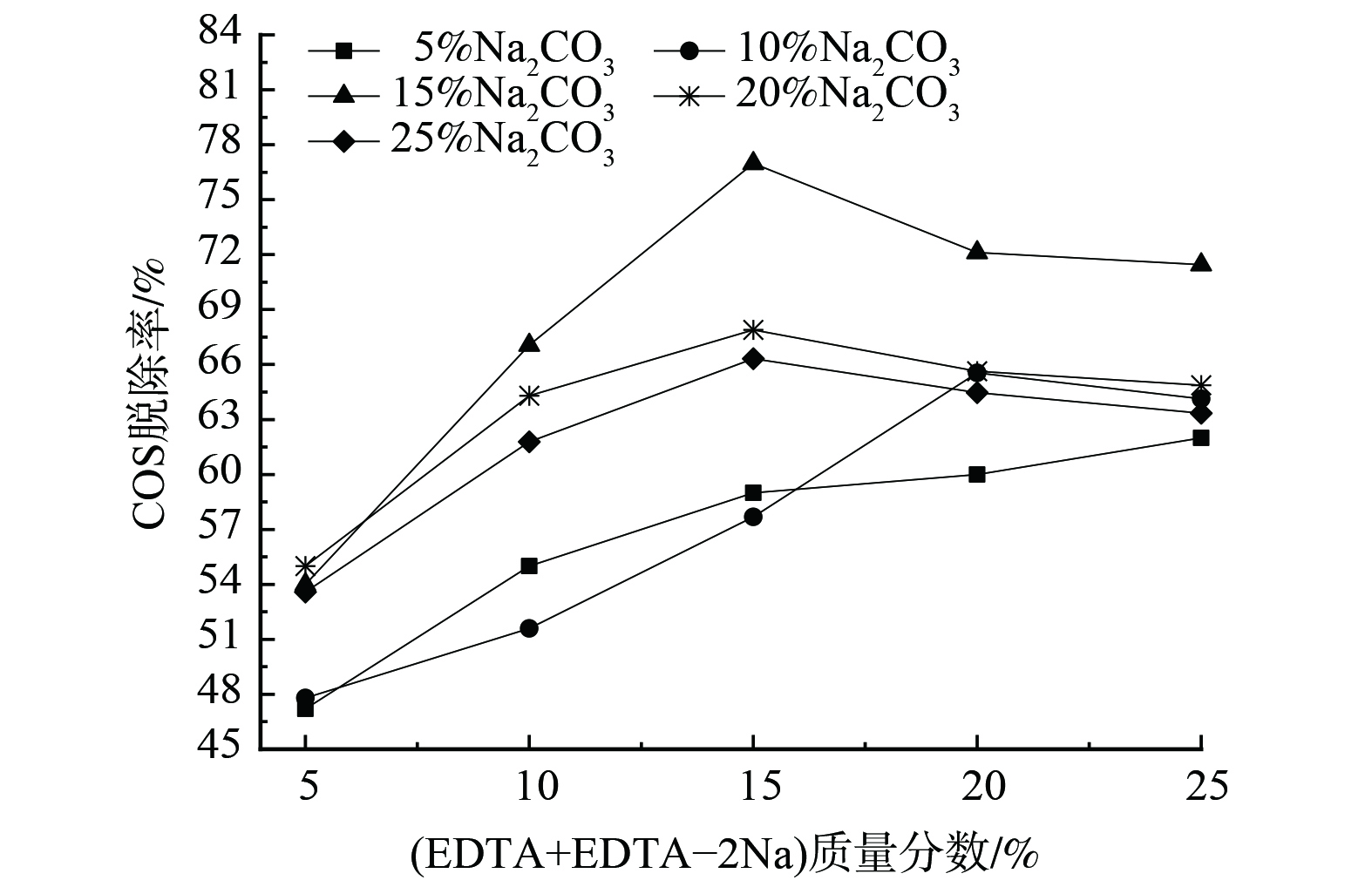
当n(EDTA):n(EDTA-2Na)=1:1时,调整吸收剂中Na2CO3或(EDTA+EDTA-2Na)的质量分数,其脱硫性能如图4和图5所示。
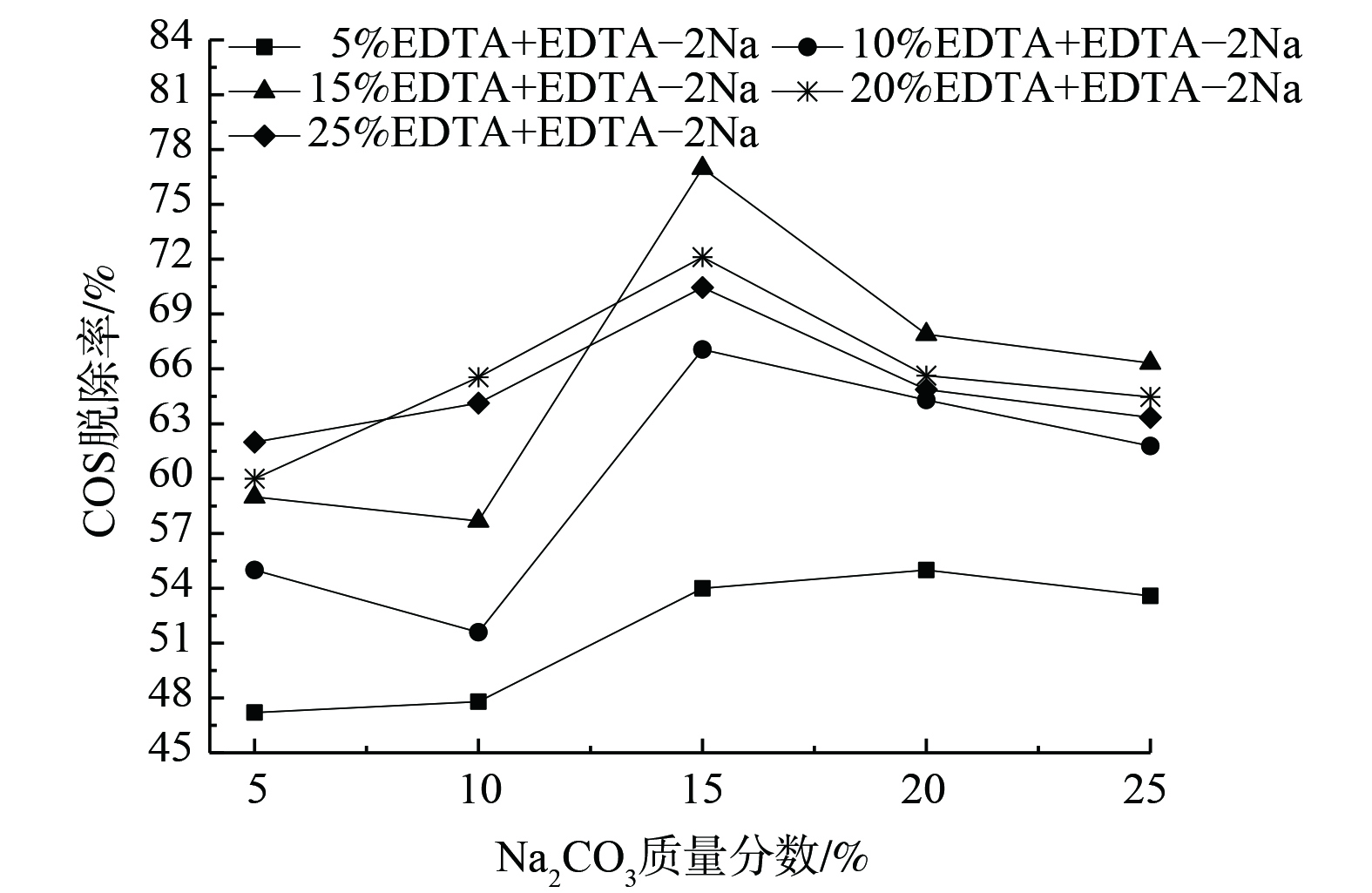
图4表明,随着Na2CO3质量分数的增加,COS脱除效率呈先增加后减少趋势。在15% Na2CO3处达到最佳,为76.98%,且EDTA+EDTA-2Na质量分数越大越有利于复配吸收剂对COS的脱除。Na2CO3质量分数的增加可有效增加COS在吸收剂中的溶解度,使得催化作用增强,COS的水解速率升高。但加入过多Na2CO3时,水解生成的H2S会同时与Na2CO3反应生成NaHS。在长时间运行后,NaHS在碱液中积累会导致脱硫黏度增大。并且,煤气中的CO2会与Na2CO3反应,生成NaHCO3等副产物,从而造成脱硫液物理性质的改变并增加碱耗[14]。
图5表明,复配吸收剂中EDTA+EDTA-2Na质量分数为5%~15%。COS脱除率逐渐增加,并在15%(EDTA+EDTA-2Na)处达到最佳。当其增至20%、25%时,其脱硫效率反而降低,但降幅变缓;且Na2CO3浓度越高,COS脱除效率越好。EDTA和EDTA-2Na的加入增强了液相碳酸钠吸收COS的活性,提高了对煤气中COS的吸收率。然而,EDTA+EDTA-2Na含量的增加使复配溶液的黏度增大,不利于气液传质过程,从而导致脱硫效率降低[15]。综上所述,复合吸收液的最佳配比为15% Na2CO3+15%(EDTA+EDTA-2Na)。
2.3 温度对COS脱除效果的影响
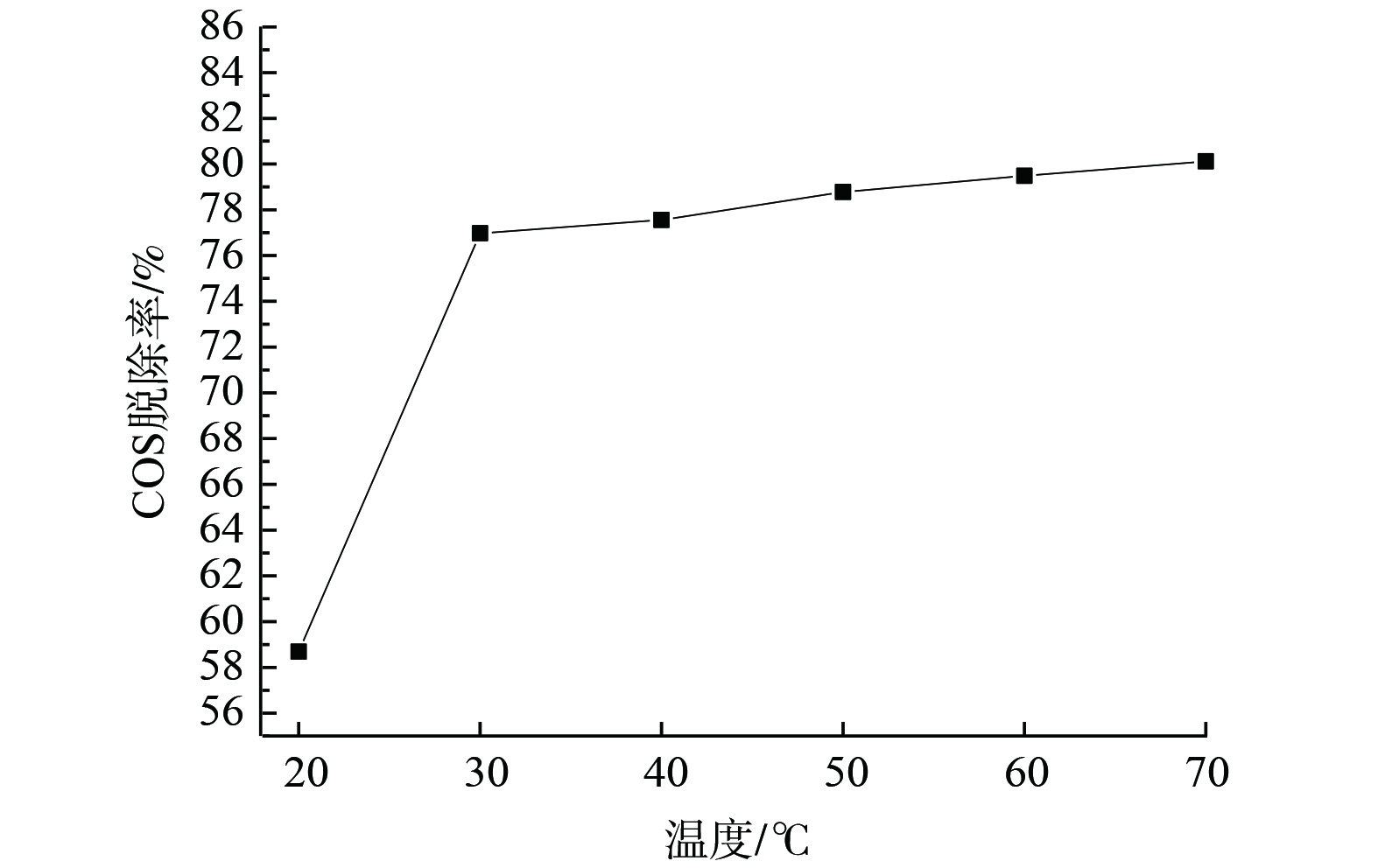
在反应时间30 min、空塔气速0.25 cm·s−1工作电压3 V及电流密度2.5 A·mm−2的实验条件下,复合吸收剂配比为15%Na2CO3+15%(EDTA+EDTA-2Na)(n(EDTA)∶n(EDTA-2Na)=1∶1)时,改变温度,系统脱硫性能变化如图6所示。当吸收液温度由20 ℃升至30 ℃,其COS脱除效率从58.69%升至76.98%,提升了18.29%。当吸收液温度增至30 ℃后,其脱除效率基本保持平稳。温度升高、吸收液黏度降低有利于气体在吸收液中的传质扩散,从而促使C==S键发生水解氢化反应[15-16];另外,升高吸收液温度,阳极电极电势的数值会降低,使得溶液中通过电量增大、电解溶液中的液相电阻值减小,这不仅增大了液相传质的作用,还补偿了因反应物浓度降低而引起的浓度极化,且有利于电化学氧化过程中活性离子的生成,故更易发生氧化反应,最终提高了COS的脱除性能。然而,高炉煤气中的硫化物与配方吸收剂中的活性组分反应为放热反应,因此,当温度升至一定程度后,反应开始朝着不利于吸收的方向进行并导致了脱硫效率增幅变缓。
2.4 空塔气速对脱除COS效果的影响
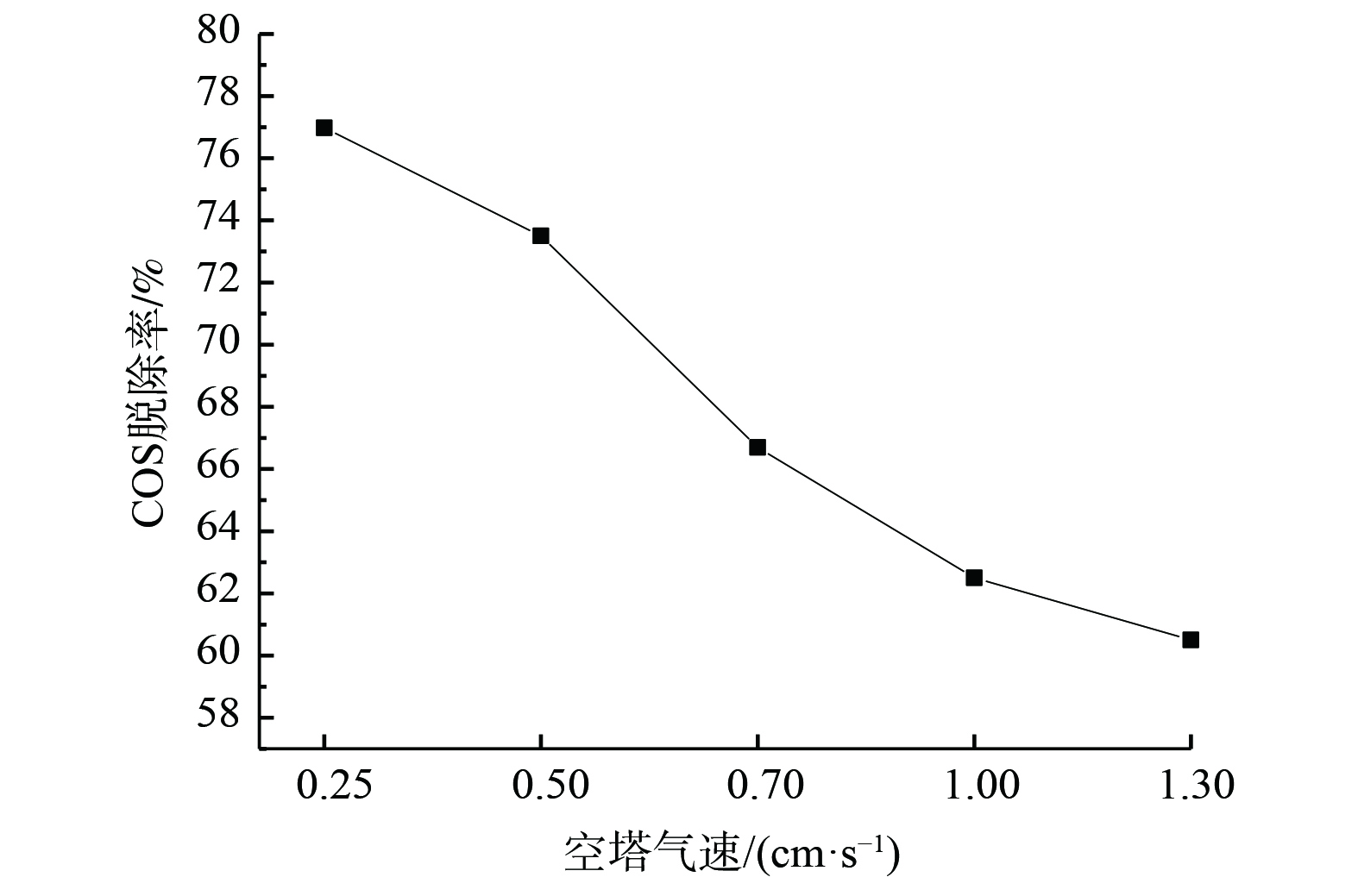
在反应时间30 min、温度30 ℃、工作电压3 V及电流密度2.5 A·mm−2的实验条件下,复合吸收剂配比为15%Na2CO3+15%(EDTA+EDTA-2Na)(n(EDTA)∶n(EDTA-2Na)=1∶1)时,改变空塔气速,其脱硫性能变化如图7所示。空塔气速与脱除效率呈反比关系。当空塔气速0.25 cm·s−1时,效率达到76.98%。然而,随着空塔气速的增大,系统脱硫效率不断降低。在原料气组分不变的前提下,增大气速意味着增大了溶剂酸气负荷,从而导致溶剂中有效活性组分浓度降低、气液接触时间缩短[17-18],并使吸收推动力减弱、较多COS未反应排出,最终脱硫效果变差。
2.5 工作电压、电流密度对脱除COS效果的影响
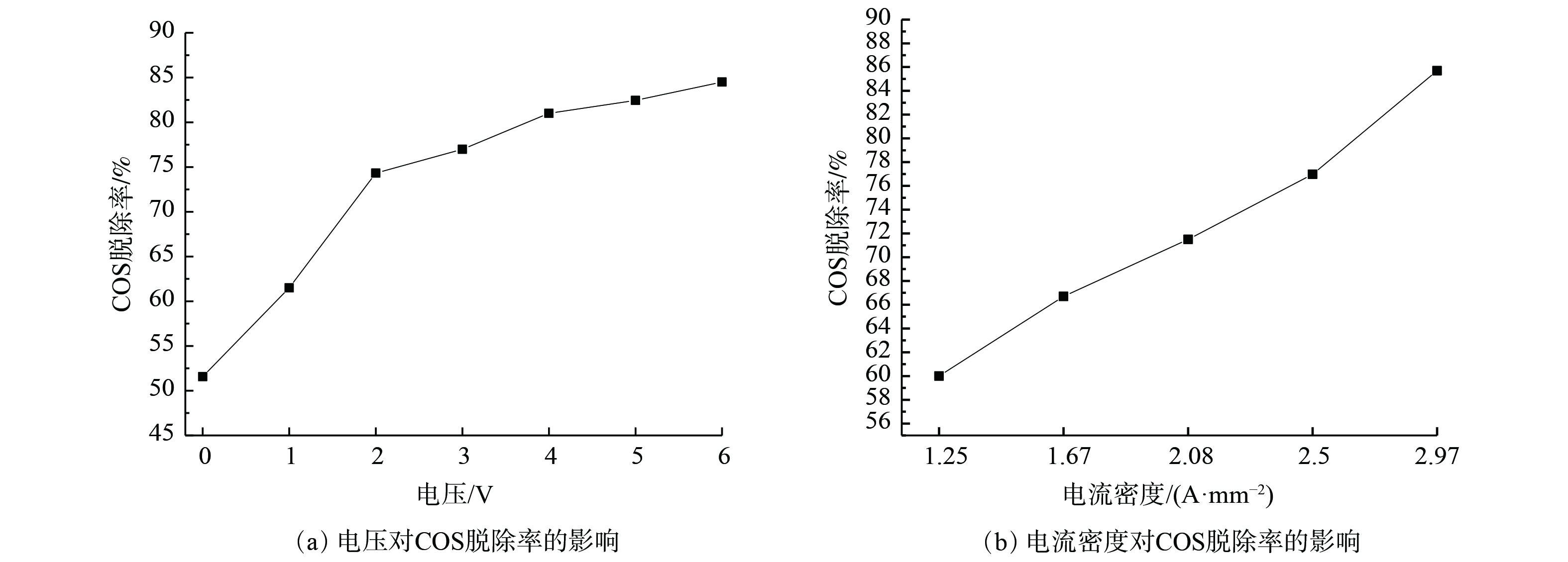
在反应时间30 min、温度30 ℃、空塔气速0.25 cm·s−1实验条件下,复合吸收剂配比为15%Na2CO3+15%(EDTA+EDTA-2Na)(n(EDTA)∶n(EDTA-2Na)=1∶1)时,调整工作电压及电流密度,其脱硫性能变化如图8所示。
图8(a)表明,当电压为0时,脱除效率为51.18%。随着电压增大至6 V,脱硫效率增至84.20%。这表明与零电压情况相比,施加工作电压使脱硫率提高了约1.6倍;工作电压升高,则在单位时间内注入反应器的能量增加,促进了活性氧的生成,并增强了电极的反应能力,故有利于提高硫化物的氧化程度,使得脱硫效率逐步提高[19-20]。当电压增至6 V时,反应过程消耗电功率0.35 W。考虑资源、能量消耗因素,故选工作电压3 V为宜。图8(b)表明,COS的脱除效率随电流密度增加呈上升趋势。在电流密度增大过程中,电解溶液中的电化学反应加剧,在电极表面发生的电化学反应速度增大,使得在一定时间内脱硫率逐步增大[21-23]。电催化反应电位随所设电流的提高而逐渐增大。当电流密度大于2.5 A·mm−2时,电解电压大于3 V,使得反应所需电功率增加。因此,仅通过增加电流密度的方式提高对COS脱除效率并无实际意义,工作电流密度以2.5 A·mm−2为宜。
2.6 脱硫产物检测
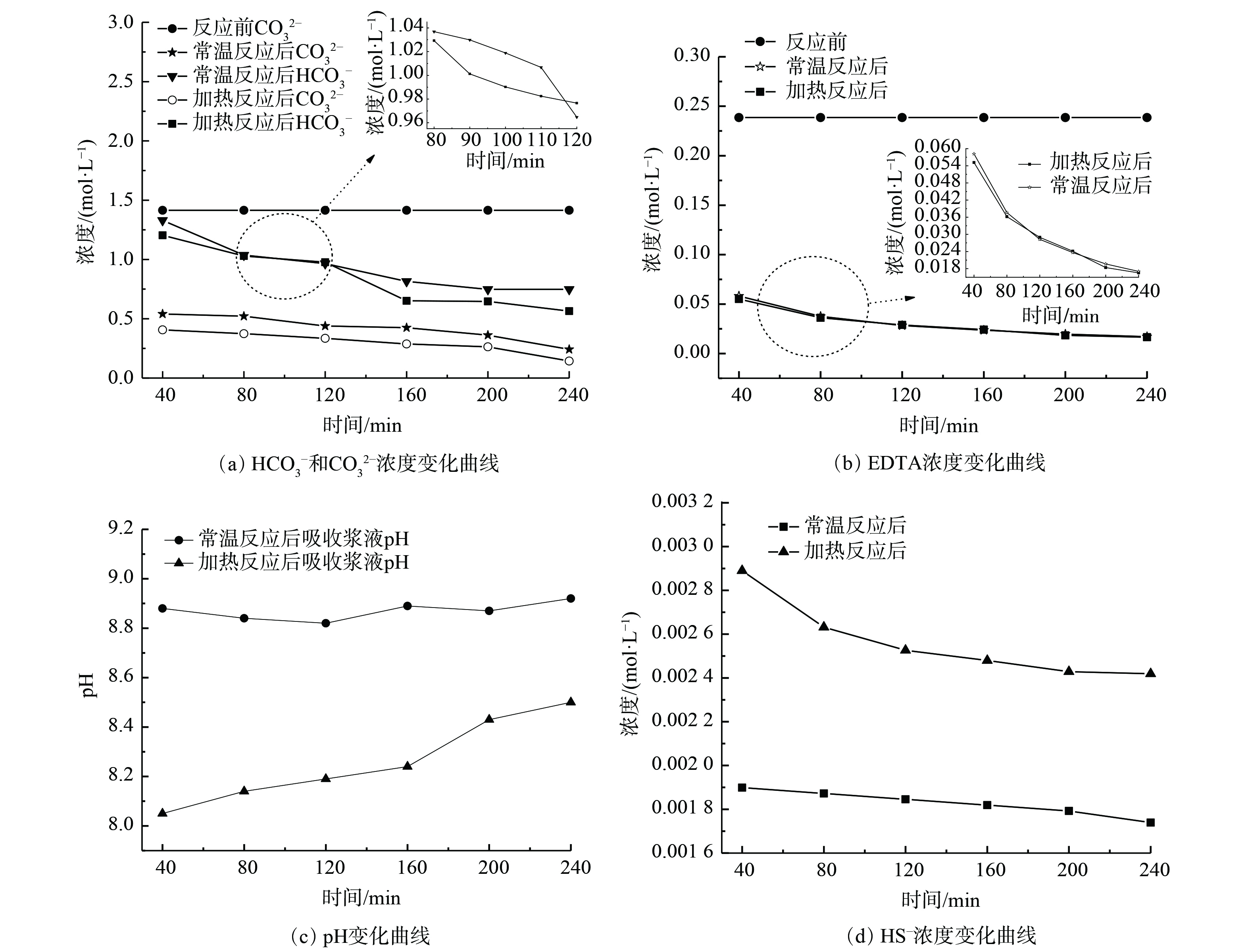
为进一步研究电化学脱硫反应的作用机理,在进口COS质量浓度为280 mg·m−3、空塔气速0.25 cm·s−1、工作电压3 V的工况下,复合吸收剂配比为15% Na2CO3+15%(EDTA+EDTA-2Na)(n(EDTA)∶n(EDTA-2Na)=1∶1)时,分析反应温度为常温20 ℃与加热至30 ℃时脱硫液反应前后产物的离子成分及浓度变化规律,结果如图9所示。
图9(a)表明,CO2−3、HCO−3 浓度随时间递增逐渐减少,且在加热情况下吸收剂中HCO−3、CO2−3
浓度随时间递增逐渐减少,且在加热情况下吸收剂中HCO−3、CO2−3 浓度较常温更低。这说明Na2CO3与EDTA的反应导致了CO2−3、HCO−3
浓度较常温更低。这说明Na2CO3与EDTA的反应导致了CO2−3、HCO−3 浓度降低。图9(b)表明,吸收剂脱除COS会消耗EDTA。随着反应进行,EDTA减少,且浓度降幅平缓。这说明EDTA与EDTA-2Na按照物质的量1∶1添加可形成酸碱共轭体系,并发生Na2CO3与EDTA间的反应生成了EDTA-2Na;之后EDTA-2Na与H2S反应生成Na2S和NaHS,同时EDTA得以再生,故在反应时间段内其浓度减幅平缓。图9(c)表明,反应消耗Na2CO3,且加热条件下比常温消耗碱多,故加热反应后pH较平常低。然而,随着反应的推进,在加热情况下CO2−3
浓度降低。图9(b)表明,吸收剂脱除COS会消耗EDTA。随着反应进行,EDTA减少,且浓度降幅平缓。这说明EDTA与EDTA-2Na按照物质的量1∶1添加可形成酸碱共轭体系,并发生Na2CO3与EDTA间的反应生成了EDTA-2Na;之后EDTA-2Na与H2S反应生成Na2S和NaHS,同时EDTA得以再生,故在反应时间段内其浓度减幅平缓。图9(c)表明,反应消耗Na2CO3,且加热条件下比常温消耗碱多,故加热反应后pH较平常低。然而,随着反应的推进,在加热情况下CO2−3 水解程度深、碱性增强,且pH增加较快。这说明脱硫反应可保持在碱性介质中进行。图9(d)表明,随着反应时间延长,由于吸收剂中碱性物质消耗较多,COS的水解和氧化程度减弱,HS−
水解程度深、碱性增强,且pH增加较快。这说明脱硫反应可保持在碱性介质中进行。图9(d)表明,随着反应时间延长,由于吸收剂中碱性物质消耗较多,COS的水解和氧化程度减弱,HS− 浓度逐渐降低。然而,加热条件下的电化学协同作用较常温情况下更强,生成的高活性自由基会促进COS的水解和氧化,更利于脱硫液对COS的吸收,且生成的H2S以HS−
浓度逐渐降低。然而,加热条件下的电化学协同作用较常温情况下更强,生成的高活性自由基会促进COS的水解和氧化,更利于脱硫液对COS的吸收,且生成的H2S以HS− 形式存在于吸收剂中,故在加热情况下吸收剂中HS−
形式存在于吸收剂中,故在加热情况下吸收剂中HS− 浓度更高。
浓度更高。
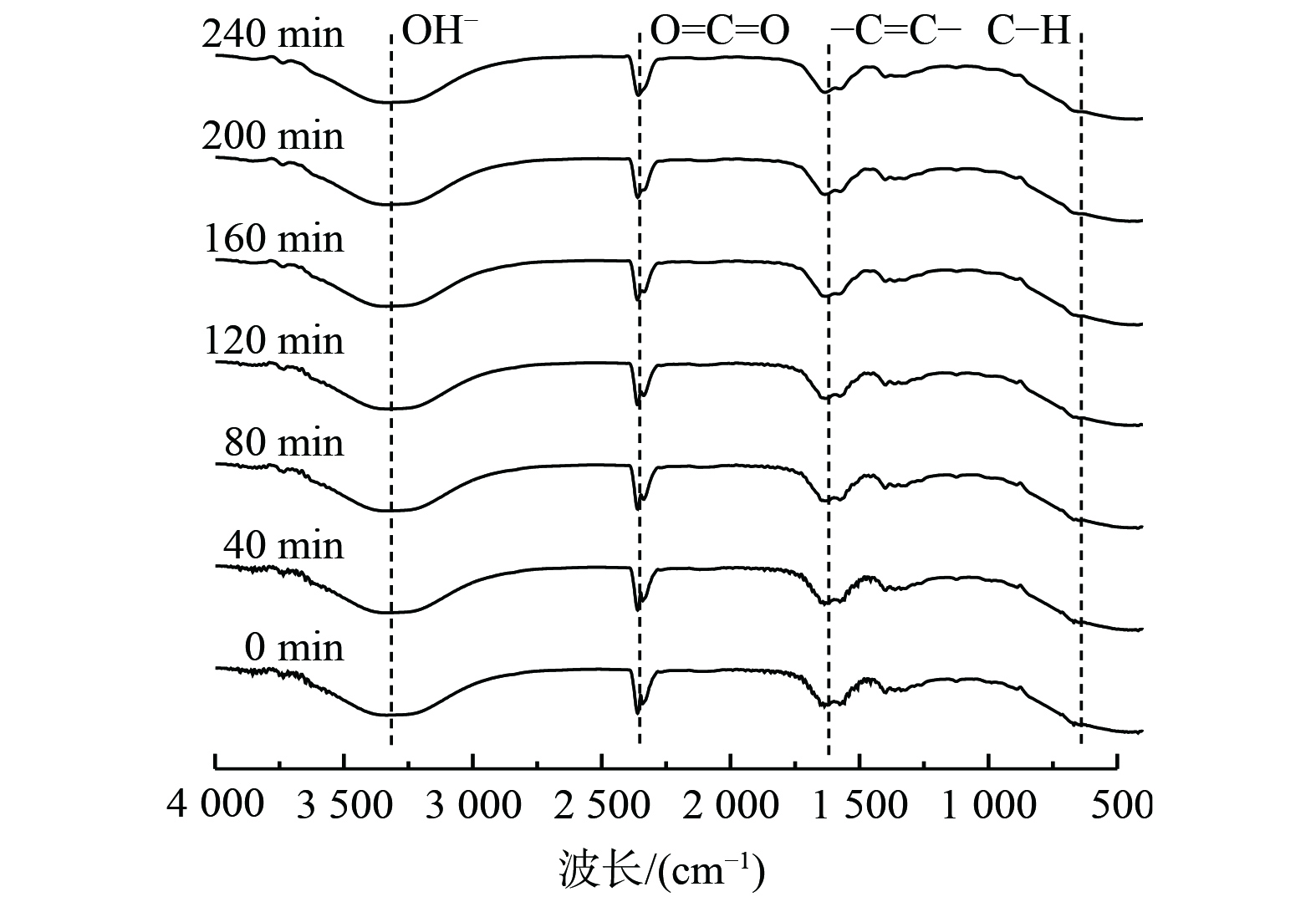
2.7 脱硫前后脱硫液表征分析
采用红外光谱检测方法,对0~240 min反应过程前后的脱硫液进行分析,结果如图10所示。反应前后脱硫液的红外特征峰的吸光度大小、位置、面积一致,无新峰。这表明脱硫溶液在脱硫前后有较好的稳定性。在3 750~3 000 cm−1附近出现O—H伸缩振动区。这表明阴阳极柱附近反应生成大量OH− 。在碱性介质中,阳极OH−
。在碱性介质中,阳极OH− 表面首先失去大量电荷,短暂形成高活性的自由基⋅OH
表面首先失去大量电荷,短暂形成高活性的自由基⋅OH ,与COS发生断键反应[24]。
,与COS发生断键反应[24]。
2.8 电化学协同湿法脱硫反应过程
图11表明,整个脱硫过程包括混合溶液对COS的吸收和转化。气相中的COS通过脱硫液物理吸收作用进入液相后,在电催化作用的碱性介质中下,与水发生水解反应生成CO2和H2S。当CO2进入气相后,H2S以HS− 离子和少量分子的形式存在与液相中。
离子和少量分子的形式存在与液相中。
通过2.6和2.7分析可得脱硫过程的反应式为式(1)~式(4)。
3. 结论
1)在反应温度30 ℃、空塔气速0.25 cm·s−1、工作电压3 V及电流密度2.5 A·mm−2条件下,配比为15%Na2CO3+15% (EDTA+EDTA-2Na)(n (EDTA): n (EDTA-2Na)=1:1)的复合脱硫剂具有较好的电化学协同脱硫性能。在该实验条件下,其COS脱除效率可达76.98%。同时,等物质量的EDTA和EDTA-2Na在溶解后形成酸碱共轭体系,能增强液相碳酸钠吸收COS的活性,进而提高COS的脱除率。
2)在Na2CO3、EDTA和EDTA-2Na三者共同作用下,COS在复合吸收剂中被催化水解为HS−和HCO−3 ,有效避免了副产物的产生,且溶剂具有良好稳定性,有一定应用前景。
,有效避免了副产物的产生,且溶剂具有良好稳定性,有一定应用前景。
3)复合吸收剂借助电催化电极材料的催化活性,利用吸收液碱性环境,在电极柱附近产生具有更高氧化能力的活性氧(如⋅OH、O⋅ 等),可促进COS催化转化,并提高了COS的脱除效率。
等),可促进COS催化转化,并提高了COS的脱除效率。















 DownLoad:
DownLoad: