-
传统生物脱氮技术具有曝气能耗高、碳源消耗量大、污泥产量高,且易产生温室气体CO2等不足[1] 。随着上世纪90年代厌氧氨氧化(anaerobic ammonium oxidation,anammox)作为新的短流程脱氮途径被证实,基于anammox反应的新型生物脱氮技术迅速成为国内外研究热点[2] 。该反应即在缺氧/无氧条件下,以氨为电子供体,亚硝酸盐为电子受体,产生氮气和少量硝酸盐的生物反应。相比于传统脱氮技术,anammox具有节省60%以上曝气量、节约100%碳源、极大降低污泥产量和减排温室气体等优势[3]。
目前,anammox主要用于污泥消化液和高NH4+-N工业水的处理,在世界范围内已有较多应用案例,其技术经济优势已得到证明[4-5] 。除了污泥消化液和工业废水等侧流处理外,近5年来,已有研究者开始将anammox应用于城市污水主流程的研发[6-7] 。亚硝化(partial nitrification,PN)-anammox (PN-A)工艺可实现污水自养生物脱氮,在城市污水主流程中已有较多研究,可分为单级工艺和两级工艺[8] 。但在城市污水低温和低基质条件下,亚硝酸盐氧化菌(nitrite oxidizing bacteria, NOB)生长速率大于氨氧化菌(ammonia oxidizing bacteria, AOB),污水中游离氨和游离的亚硝酸盐无法有效抑制NOB生长繁殖。因此,AOB很难竞争过NOB,这会导致亚硝酸盐积累不足,较难实现长期稳定的anammox反应,故很难维持其在工程应用中的稳定性和高效性[9-10] 。2013年彭永臻院士团队首次提出短程反硝化(partial denitrification,PD)-anammox(PD-A)工艺。该工艺通过部分反硝化实现相对稳定的亚硝酸盐积累。但短程反硝化反应仍需消耗碳源,增加外碳源来实现PD将增加运行成本。为了将进水中的可生物降解碳源充分应用于PD,彭院士团队也采用“厌氧-好氧-缺氧”模式(AOA)实现内碳源短程反硝化-anammox,其原理是聚糖菌(glycogen accumulating organisms,GAOs)和聚磷菌(phosphorus accumulating organisms,PAOs)在厌氧区能将COD贮存为内碳源,进而在缺氧区发生PD而产生NO2−-N[11] 。但内源反硝化反应速率较慢[12] ,会导致缺氧区的体积增大,且PD相对于PN来说,对曝气量及碳源需求更高。
PN-A和PD-A耦合工艺可将NOB和厌氧氨氧化菌(anaerobic ammonium oxidation bacteria, AnAOB)产生的部分NO3−-N还原成NO2−-N继续进行anammox反应,降低对NOB控制的要求,同时也能充分利用亚硝化节约能耗的特点,可为主流程脱氮提供一种高效、低耗的解决方案。目前,基于PN-A和PD-A耦合工艺的多途径脱氮研究报道较少,本研究以实际市政污水为处理对象,在厌氧-好氧-缺氧推流式反应器的缺氧区植入高性能纤维束填料,以在主流程实现PN-A和PD-A等多途径高效脱氮,依据市政污水进水水质变化,通过优化外回流比、曝气量等运行参数进行污染物负荷的合理分配,从而实现主流程anammox耦合多途径稳定高效脱氮,以期为anammox的工艺优化及工程应用提供参考。
-
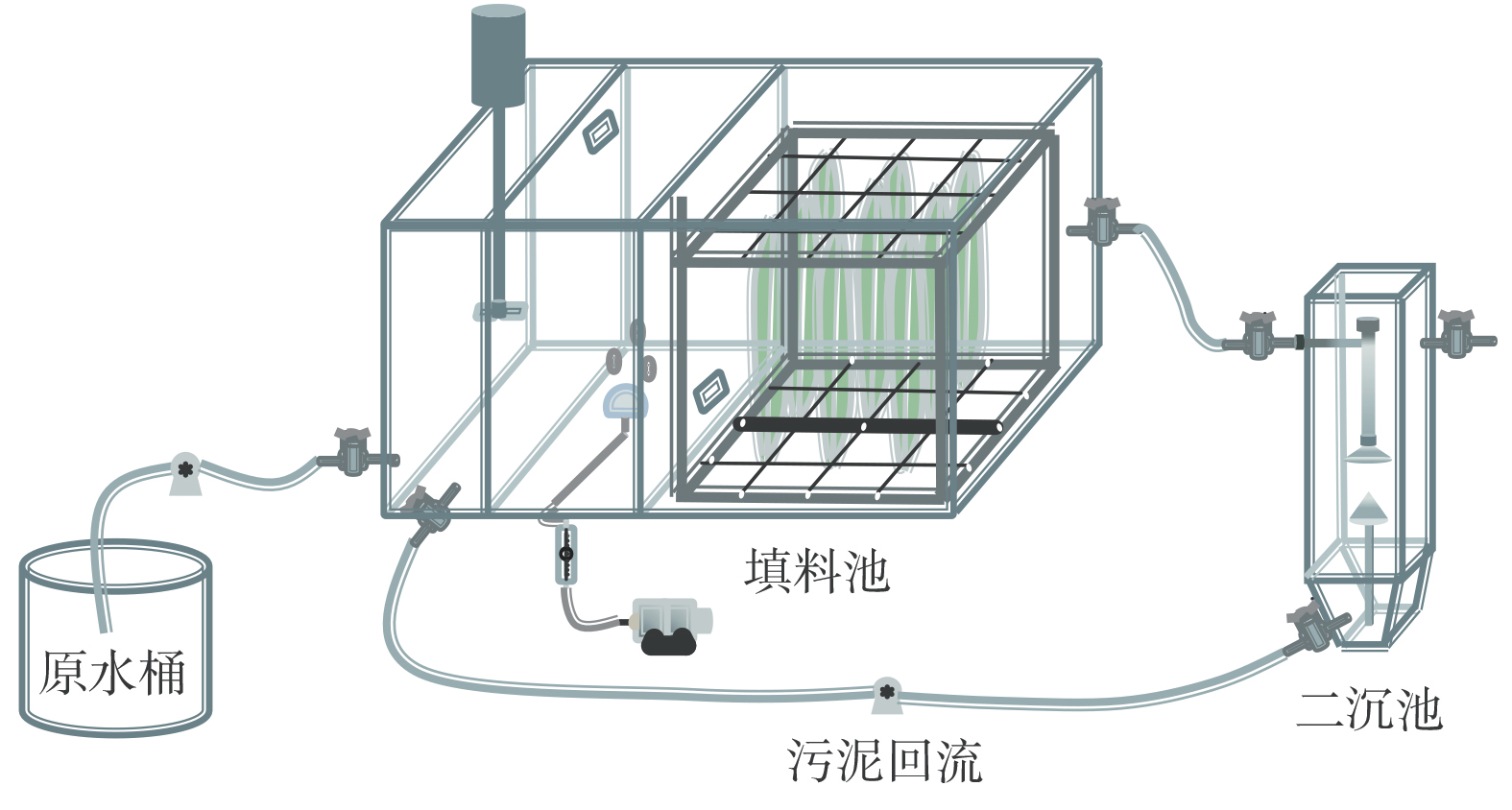
反应器主体由有机玻璃制成,有效体积为50 L,各区域的体积比为1:4:6。厌氧池设置搅拌混合,好氧池通过空气泵可连续曝气,缺氧池则在反应器短程硝化驯化启动后增加束状纤维填料(填充比为25%),以截留AnAOB,通过控制曝停比来维持填料表面的生物膜厚度及活性污泥混合。反应装置如图1所示。
反应器共运行164 d,分为3个阶段。阶段I(第1~59天)短程硝化驯化阶段;阶段II(第60~90天)AnAOB驯化阶段;阶段III(第91~164天)稳定运行阶段。阶段I采用提高好氧池曝气量(0.3~0.7 mL·min−1),控制好氧池DO<1.5 mg·L−1,并调节外回流比进行AOB驯化;阶段II通过降低好氧池曝气量(0.7~0.4 mL·min−1),提高缺氧池曝停比(30 s/50 s~30 s/30 s)的方式使得NH4+-N污染物更多由anammox途径去除,进行AnAOB活性驯化;阶段III则为稳定运行阶段,观察反应器应对进水水质波动的稳定性。运行条件如表1所示。
-
进水取自北京市通州区某污水处理厂的进水 (生活污水) 。运行期间进水水质指标为:COD 62~250 mg·L−1、NH4+-N 22~54 mg·L−1、NO2−-N 0~0.8 mg·L−1、NO3−-N 0.6~1.8 mg·L−1、pH 7.4~7.8。
实验运行期间共接种2次污泥。第一次为反应器刚启动时,接种水厂好氧池活性污泥,接种后污泥质量浓度为3 260 mg·L−1;第二次是第59天时,在缺氧区增设束状纤维填料的同时接种AnAOB颗粒污泥,接种量为3 L,原种泥污泥质量浓度为5 862 mg·L−1。
-
常规检测指标(COD、NH4+-N、NO2−-N、NO3−-N、MLSS)均采用国标法。NH4+-N、NO2−-N、NO3−-N的质量浓度总和用总无机氮 (total inorganic nitrogen,TIN) 表示。DO和pH采用Multi 3 630 IDS WTW(德国)测定。每个实验阶段均留存污泥样品,置于-20 ℃环境中冷冻贮存,统一进行高通量测序。AnAOB代谢活性实验方法参考文献[13]进行测定。
-
在反应器运行过程中,NH4+-N、COD、TIN及好氧池亚硝氮积累率(nitrite accumulation ratio,NAR)的变化情况如图2所示。在短程硝化驯化阶段(第1~59天),反应器进水COD和NH4+-N质量浓度分别由120 mg·L−1上升至250 mg·L−1、30 mg·L−1上升至45 mg·L−1。为应对进水负荷增大带来的冲击并强化AOB的活性,提高反应器外回流比和好氧池曝气量,好氧池DO由0.2 mg·L−1提升至1.5 mg·L−1。反应器COD降低了70%~80%,NH4+-N去除率由30%增至80%,好氧池NAR为(60±10)%,这说明NOB活性成功被抑制,这与好氧池低DO控制与反应器缺氧/好氧分区有关。
首先通过控制低DO(0.2 mg·L−1)条件,使得NOB活性受到抑制,NAR较高为65%。然而,同时NH4+-N去除量仅为(3±1) mg·L−1,AOB活性亦受到抑制,在进水负荷不断提高的条件下,短程硝化反应会成为anammox反应的限速步骤[14],需要提高AOB活性。在AOB、NOB活性均受抑制及进水负荷不断升高的条件下,提高污泥回流比有助于增强活性污泥抗冲击负荷能力。同时,基于低DO条件下AOB相较于NOB表现出更佳的氧亲和能力[15],逐步提高好氧池曝气量并维持低DO条件,可有利于AOB优先利用溶解氧,而比NOB增长优势更明显。随着曝气量逐步提高至0.7 mL·min−1,污泥回流比升高至150%,好氧池DO上升至1.5 mg·L−1, NH4+-N去除量上升至(12±1) mg·L−1,AOB活性亦升高。同时,NAR能稳定维持在50%,NOB活性仍受到抑制。本研究将好氧池DO控制为1.5 mg·L−1,这明显高于短程硝化控制DO阈值(0.5~1 mg·L−1),但仍能维持较高NAR。这可能是由于本研究采取厌氧-好氧-缺氧推流式反应器,在后端设置缺氧区能提供瞬时缺氧环境,从而有助于抑制NOB酶活性而对AOB影响不大。同时,在缺氧环境进入好氧环境后,AOB能优于NOB优势增长[16-17]。这与文献[18-19] 报道的较高缺氧时间/好氧时间(T缺氧/T好氧)可促进亚硝酸盐累积一致。因此,本研究中反应器缺氧区与好氧分区体积比为7:4及低DO条件有助于NOB的抑制。在驯化阶段末期,出水COD和NH4+-N质量浓度分别为(38±2) mg·L−1和8 mg·L−1,且AOB有较好的活性,能满足后端AnAOB启动条件。
第II阶段(第60~90天),在缺氧区投加填料并接种AnAOB种泥,通过降低好氧池曝气量,提高缺氧池曝停比进行anammox启动驯化。该阶段反应器进水C/N与上一阶段相同,驯化期间COD稳定降低了80%,NH4+-N去除率则上升至90%,同时TIN去除率上升至70%~80%,出水TIN为(11±2) mg·L−1 ,低于上一阶段出水TIN(17±3) mg·L−1。这可能是反应器接种了AnAOB之后,发生了部分anammox反应,使得在与上一阶段相同C/N条件下,NH4+-N及TIN去除率均上升。然而,驯化期间NAR下降至20%~40%,这可能是由于通过降低好氧池曝气量,提高缺氧池曝停比,维持缺氧池DO为0.3~0.5 mg·L−1,可为缺氧池提供了合适anammox驯化启动条件。在缺氧池中,NH4+-N可被AOB及AnAOB去除,从而提高了NH4+-N去除率,使得缺氧池出水剩余NH4+-N质量浓度小于5 mg·L−1。低剩余NH4+-N质量浓度会减弱AOB与NOB对O2的竞争,以及AnAOB与NOB对NO2−-N的竞争,从而有助于NOB活性的表达[20]。文献[21-22]表明在剩余NH4+-N质量浓度小于5 mg·L−1时,出现了NOB的增长,使得推流式反应器中NAR下降。
第III阶段(第91~164天),为减少好氧池NAR下降带来的不利影响,该阶段通过降低好氧池曝气量,来增加缺氧池中进水NH4+-N质量浓度。结果表明:该阶段好氧池NAR维持在20%~40%,进水C/N由4.5:1降至2:1,NH4+-N去除率>95%,TIN去除率维持在80%~85%,出水TIN小于6 mg·L−1。在传统硝化反硝化脱氮工艺中,该C/N条件下较难实现出水TN达标(一般C/N大于5时,反硝化作用发挥比较明显)[23]。这表明该反应体系的AnAOB在总氮脱除中发挥了重要作用,使得出水TIN较低。这也说明本反应器在应对低C/N废水及NAR下降的情况下,对TIN仍有较稳定地去除,可实现出水TIN小于6 mg·L−1。
-
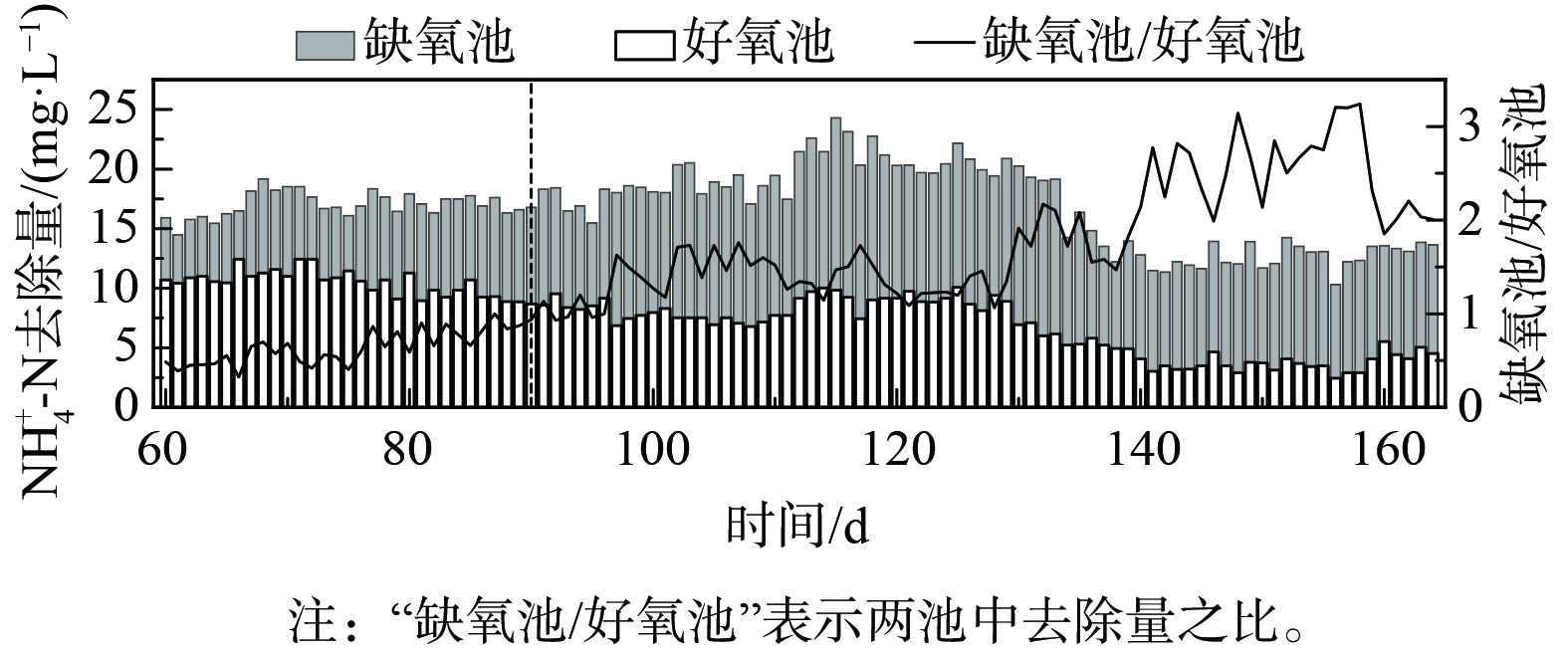
反应器于第59天接种了AnAOB种泥。由于填料具有良好的吸附作用使得AnAOB在缺氧区富集和停留。为降低NAR下降带来的不利影响,增加AnAOB富集区的进水基质,通过降低好氧池的曝气量、提高缺氧池曝停比的方式进行好氧池/缺氧池NH4+-N去除负荷分配,结果使得缺氧池NH4+-N去除量与好氧池NH4+-N去除绝对量比值由0.5提高至3,结果如图3所示。图2(c)表明,驯化期间(第60~90天)至稳定运行期间(第91~164天)工艺进水C/N不断下降,但出水TIN却由(11±2) mg·L−1降至小于6 mg·L−1,并能维持稳定运行。这可能是由于缺氧池束状纤维填料富集并停留AnAOB,通过增加缺氧池NH4+-N负荷,让更多进水NH4+-N经由anammox途径去除,从而获得在较低C/N的进水基质条件下的高效脱氮。
-
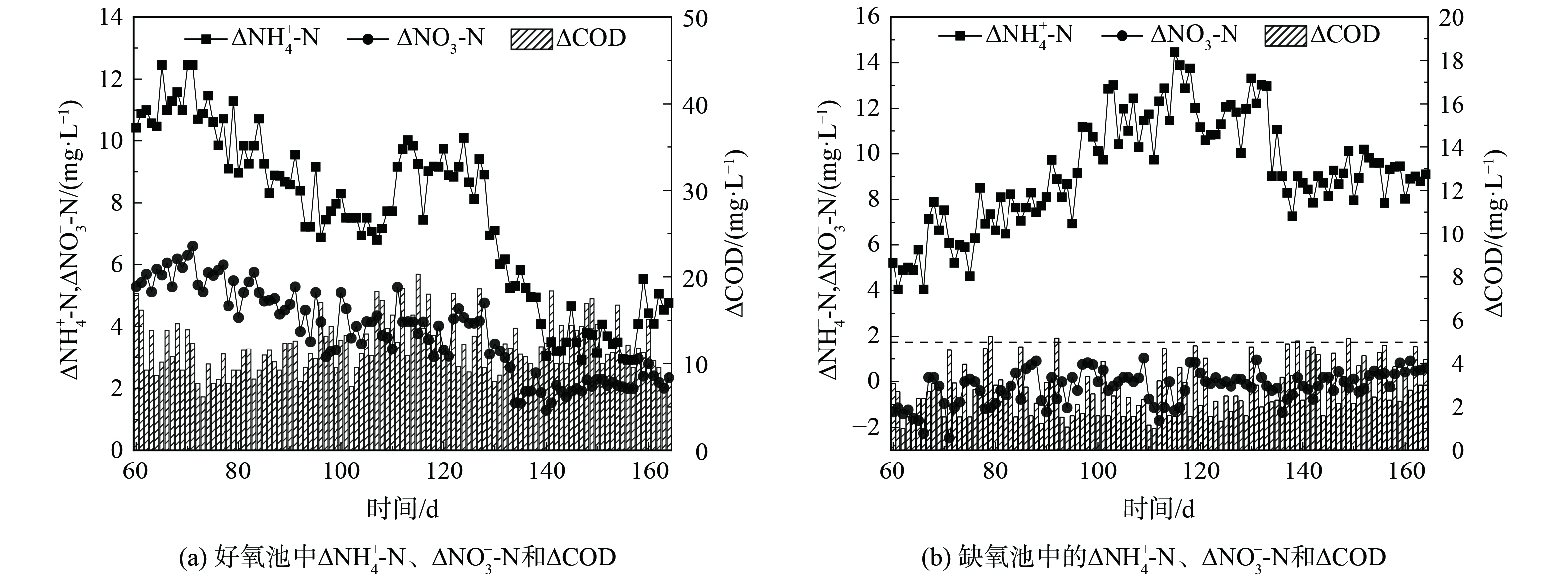
在该反应体系中,NH4+-N主要由好氧池及缺氧池去除。好氧池与缺氧池NH4+-N去除量、NO3−-N生成量及COD降低量如图4所示。
图4(a)表明,好氧池COD去除量维持在(15±5) mg·L−1,可生化性有机物在好氧池中进一步去除,可减弱缺氧池中有机物对AnAOB的影响。在驯化期间不断降低好氧池曝气量,使得好氧池NH4+-N去除量由(12±1) mg·L−1降至(5±1) mg·L−1。同时,NO3−-N生成量由(5±2) mg·L−1降至(2±1) mg·L−1,通过降低好氧池的NH4+-N去除量减弱了NAR下降带来体系中NO3−-N质量浓度升高的影响,使更多的NH4+-N进入缺氧池。实验期间通过调节曝停比将体系中DO维持在0.3~0.5 mg·L−1,缺氧池的NH4+-N去除量由驯化期间(6±2) mg·L−1上升至稳定运行期(13±1) mg·L−1,而缺氧池NO3−-N生成量始终低于0.5 mg·L−1,低于anammox反应生成NO3−-N的理论生成量0.6~1.5 mg·L−1[24]。这说明体系中存在一定反硝化反应[25],但是该反应区∆COD<5 mg·L−1,远低于传统反硝化脱氮所需碳源理论值[23]。因此,在缺氧池中可能存在anammox和反硝化2种脱氮途径。因此,通过优化NH4+-N负荷分配,可提高缺氧池NH4+-N去除量,让更多的NH4+-N经由anammox途径去除,可在更低C/N条件下,减少NO3−-N生成量,从而形成低TIN出水。
-
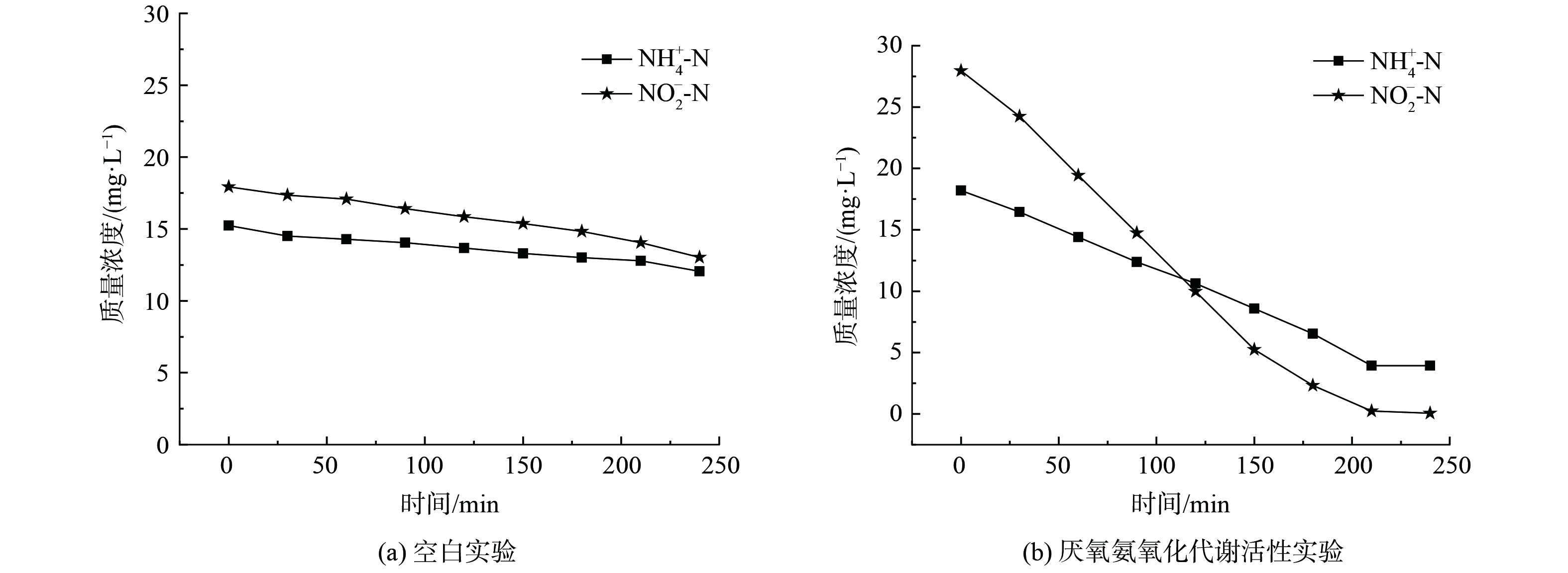
为分析缺氧池污泥中anammox代谢活性,在稳定运行期取缺氧池污泥进行批次实验,同时取2份等量缺氧池污泥做空白实验。空白实验即分别观察NH4+-N与NO2−-N随时间的变化情况,方法与anammox代谢活性实验相同[13] 。 NH4+-N和NO2−-N随时间变化情况如图5所示。
图5(a)表明NH4+-N与NO2−-N质量浓度在240 min时分别下降了3.2 mg·L−1和4.9 mg·L−1,这可能是由于污泥自身吸附作用导致的。而图5(b)表明NH4+-N与NO2−-N质量浓度均随时间以更快速率下降,在240 min时分别下降14 mg·L−1和28 mg·L−1,其中ΔNO2−-N/ΔNH4+-N=2,高于anammox反应的理论值1.32。这说明体系中anammox具有较高的代谢活性,且同时存在反硝化反应,较直接地证明主流程中anammox在氮去除中发挥的重要作用。
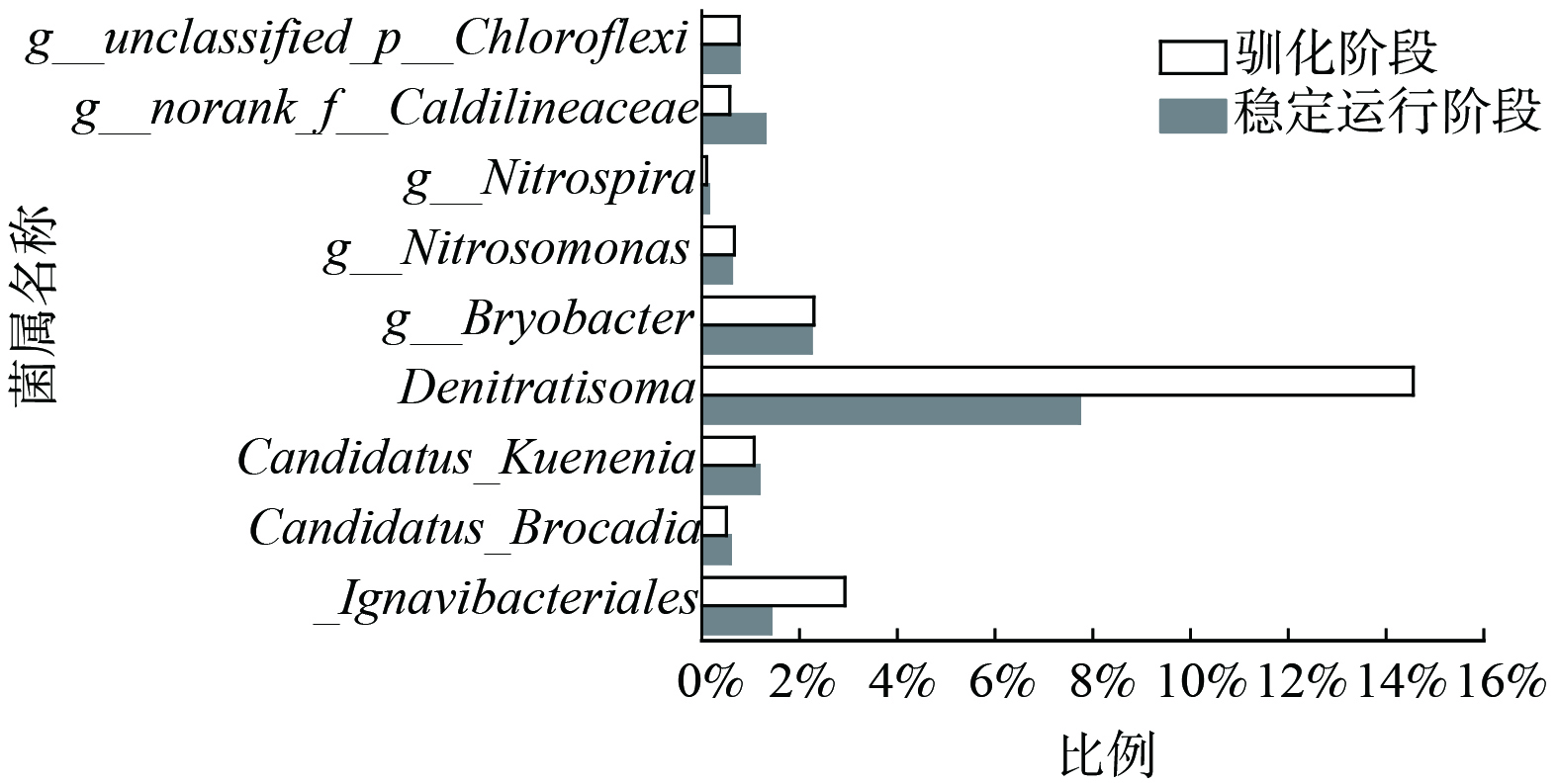
除上述对缺氧池中anammox代谢活性分析外,本实验也对缺氧池中微生物群落结构进行解析。图6为驯化阶段(第78天)和稳定运行阶段(第132天)基于属水平的高通量测序结果。
高通量测序结果表明,被检测到的AnAOB菌属主要为Candidatus Kuenenia和Candidatus Brocadia,这与文献[26]所报道的市政污水主流程工艺中所发现的AnAOB菌属相一致。在驯化阶段及稳定运行阶段中AnAOB菌属的相对丰度分别为1.6%和1.8%,稳定运行阶段该菌属的相对丰度有所上升,这主要得益于增大缺氧池进水NH4+-N负荷的调控手段,使AnAOB可利用的基质增加,从而提高该菌属的相对丰度。这说明在稳定运行阶段,该系统在低C/N条件下仍能实现稳定低TIN出水的主要原因是大部分NH4+-N经由anammox反应去除。
然而,体系中主要的反硝化菌属Denitratisoma的相对丰度由驯化期间的15%下降至稳定运行期间7.7%。这可能是由于缺氧池中COD变化量小于5 mg·L−1(如图4(b)),无法满足反硝化的需求,使得Denitratisoma相对丰度降低。根据Candidatus Kuenenia和Candidatus Brocadia相对丰度升高,Denitratisoma相对丰度降低。这说明AnAOB相对于反硝化菌能优势竞争NO2−-N[27]。而低COD去除量易使反硝化菌还原NO3−-N至NO2−-N阶段,减弱NO2−-N进一步还原[25]。这说明在缺氧池有短程反硝化反应发生[28-29],通过短程反硝化反应产生NO2−-N,被AnAOB优势竞争,最终使得NO3−-N生成量低于PN-A反应的理论值。
另外,Nitrosomonas是被检测到的AOB菌属,Nitrospira是被检测到的NOB菌属。在这2个阶段中,Nitrosomonas相对分度分别为0.67%和0.61%,Nitrospira的相对丰度则分别为0.1%与0.14%,Nitrosomonas相对丰度有所降低,Nitrospira的相对丰度有所升高,这易导致NAR下降。但总体而言,Nitrospira的相对丰度始终低于Nitrosomonas相对丰度,NOB活性仍然受到抑制。这说明体系中可能发生短程硝化作用从而产生NO2−-N。反应体系中缺氧池DO较低(0.3~0.5 mg·L−1),使AOB能优势竞争DO而抑制NOB,为厌氧氨氧化反应提供NO2−-N。
上述结果说明,在缺氧池的DO为0.3~0.5 mg·L−1条件下,Nitrosomonas、Denitratisoma、Candidatus Kuenenia和Candidatus Brocadia等优势菌属得以共存,缺氧池存在anammox以及反硝化等多种脱氮途径,使得NO3−-N生成量较低。
-
1) 反应器中缺氧区和好氧区的体积比为7:4,好氧池DO约1.5 mg·L−1,能实现短程硝化(NAR为50%),同时通过调控缺氧池NH4+-N负荷和低溶解氧条件,DO为0.3~0.5 mg·L−1,可使该工艺在低C/N进水条件下,实现TIN去除率为80%~85%。
2) 在稳定运行阶段,缺氧池∆NH4+-N为(13±1) mg·L−1,∆COD<5 mg·L−1,∆NO3−-N<0.5 mg·L−1。这表明缺氧池存在anammox及反硝化反应,且anammox在主流程工艺中发挥了重要作用。
3) 在缺氧段检测到AnAOB菌属Candidatus Kuenenia和Candidatus Brocadia作为优势种群存在,从微观角度可以证明主流程anammox反应的宏观效能。同时,检测到的反硝化菌属Denitratisoma等进一步表明该工艺中可能存在anammox、短程硝化和反硝化等多种脱氮途径,有利于在低碳氮比条件下实现TIN的深度脱除。




 下载:
下载: