-
石化行业作为推动国家能源发展的支柱产业,为国计民生提供了资源和能源保障。产业链由石油开采、油气炼制、石油化工等组成,工艺流程复杂,产生的废水组成复杂、有机物浓度高、毒性大且可生化性低。单一处理工艺难以达标排放,多用物化法进行预处理,厌氧/好氧等生物工艺进行二级处理。生物法作为石化废水二级处理中的核心单元,用于处理隔油气浮环节出水中的有机物、氮和磷等污染物。目前石化厂多采用组合工艺,典型代表为A2O工艺。A2O工艺通过厌氧段、缺氧段和好氧段逐步实现污染物的降解[1]。但生物法也有局限性,如微生物本身易受到有毒化学物质和高盐度的影响,降低处理效率[2]。因此如何减弱石化废水带给微生物的冲击,提高微生物的处理效果,成为了近年来的研究热点。
厌氧膜生物反应器(anaerobic membrane bioreactor, AnMBR)凭借其在生物处理、资源回收等方面的优势而广泛应用于工业废水处理中[3]。AnMBR将膜过滤和厌氧发酵有效结合,实现了HRT与SRT的完全分离[4],与普通厌氧消化相比,膜能过滤部分难降解污染物,处理难降解石化废水时仍有较好的COD去除效果。而胞外聚合物(extracellular polymeric substances, EPS)和溶解性微生物产物(soluble microbial products, SMP)会聚集在膜上形成膜污染,降低膜重复利用性并提高清洗成本,制约其工程化应用。目前研究多集中在膜污染的抑制上。与板式膜相比,中空纤维膜自身比表面积更大,沼气冲刷还能促进高分子化合物脱落,有效缓解膜污染[5]。电化学强化厌氧膜生物反应器(anaerobic electro-assisted membrane bioreactor, AnEMBR)在近些年受到了关注,此工艺利用阴极膜组件与负电性的EPS和SMP之间的静电排斥作用减缓膜污染的发生[6],电化学体系还有利于增强微生物代谢,提高生物处理效果[7],为处理难降解的石化废水提供了可能性。YANG等[8]利用碳纳米管(carbon nanotubes, CNTs)制备CNTs-HFMs膜并将其用于AnEMBR处理模拟废水,结果表明,加电组COD去除率大于95%,对照组的COD去除率均小于95%,加电组的最高甲烷产量高于对照组111.12 mL·(g·d)−1,加电组产甲烷菌含量较对照组提高近2倍;膜污染方面,加电组膜组件在进行3次水力清洗循环后,跨膜压差(trans-membrane pressure, TMP)仍能恢复到35 kPa,对照组只能恢复到50 kPa和60 kPa,说明加电组有效缓解不可逆膜污染。杜磊等[9]使用真空抽滤交联技术将CNTs负载于聚偏氟乙烯(polyvinylidene fluoride, PVDF)膜表面制备的CNT-PVDF膜,具有良好的抗污染性能。这说明CNTs具有良好的应用前景,可为导电膜的规模化生产和应用提供技术支持。此外,石化废水中常含有NH4+,仅依靠厌氧工艺难以使NH4+达标。因此,在厌氧工艺后需选择合适的好氧工艺,进行NH4+的降解。基于悬浮生物载体的生物膜与活性污泥复合工艺(integrated free-floating biofilm and activated sludge, IFFAS)因兼具了生物膜法和活性污泥法的优点而备受关注。借助悬浮载体与活性污泥的流态化接触在填料表面形成一定厚度的生物膜。生物膜外部的好氧区能进行硝化以及有机物的去除,内部由于氧扩散的限制形成缺氧区以及厌氧区,发生反硝化,从而使IFFAS具备实现同步硝化反硝化(simultaneous nitrification and denitrification, SND)的可能性[10]。LIU等[11]通过双单元的IFFAS工艺实现了59.9%~65.9%的TN去除率,与对照组相比提高了12.3%~13.5%。LIU等[12]制备了新型载体处理模拟废水,在精准的溶解氧(dissolved oxygen, DO)控制下去除了80.2%的TN。以上结果为AnEMBR-IFFAS耦合工艺处理石化废水提供了理论和技术支持。雷士雅等[13]构建了电化学辅助厌氧消化反应器 (bioelectrochemical-assisted anaerobic digestion reactor, BEAD) 处理石化废水强化COD的去除,BEAD的COD去除率为85%,出水COD稳定在(360±24) mg·L−1,而普通厌氧消化对COD的去除率小于60%。与BEAD相比,AnEMBR除了能够将石化废水中复杂的有机物转化为小分子的挥发性脂肪酸等物质,便于后续IFFAS中的微生物进行利用外,还可以通过膜组件截留部分COD提高COD去除效率并保持反应器内较高的污泥浓度。此外,AnEMBR还能通过收集甲烷气体实现能源回收,IFFAS构建同步硝化反硝化实现NH4+-N和TN的同时去除。
本研究构建实验室规模AnEMBR-IFFAS耦合工艺,考察此工艺在不同进水有机强度、HRT等条件下对石化废水中耗氧有机污染物(以COD计)、NH4+-N等污染物的处理效果,优化工艺参数,并探究生物群落组成,以期为工艺工程化应用提供参考。
-
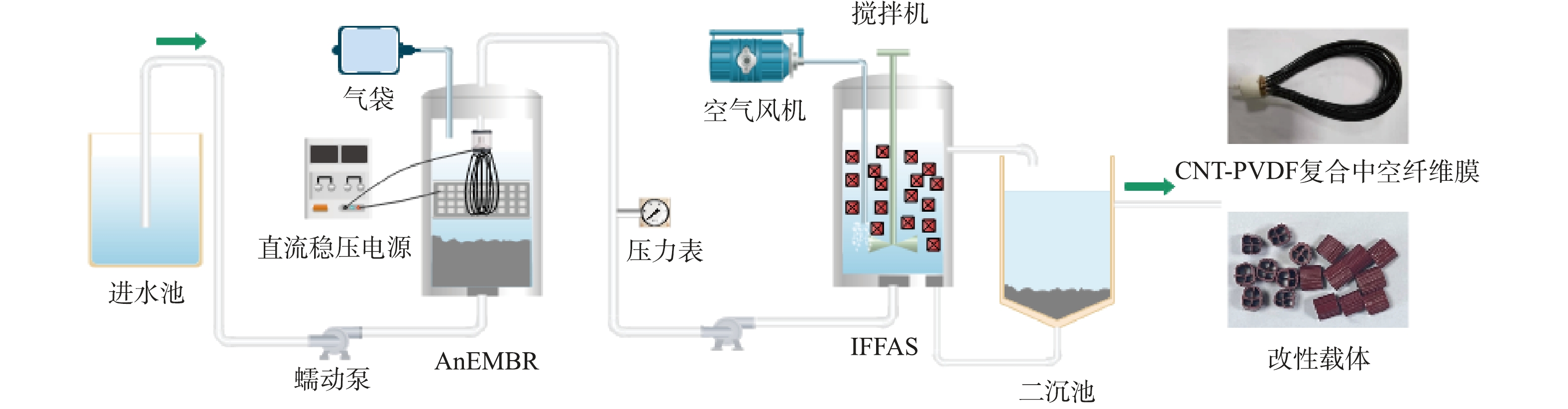
工艺流程如图1所示,电化学强化厌氧膜生物反应器(AnEMBR)与基于悬浮生物载体的生物膜-活性污泥复合工艺(IFFAS)顺次相接。AnEMBR(有效体积2 L)内置膜组件(膜面积约为0.05 m2),施加电压−1.2 V,以钛网为对电极(150 mm×200 mm),外部连接直流稳压电源。AnEMBR出水流入IFFAS(有效体积2 L),IFFAS出水流入二沉池,剩余污泥回流至IFFAS。IFFAS内装有填充比约为30%的新型生物亲和型载体。AnEMBR中初始污泥质量浓度(MLVSS)为5 500 mg·L−1,IFFAS中初始污泥质量浓度(MLVSS)为1 500 mg·L−1。膜组件为CNT-PVDF复合中空纤维膜,参照杜磊等[9]的方法进行制备。亲和型改性载体通过物理共混和螺杆挤出技术制备[12]。
-
正式运行条件如表1所示。提前进行挂膜启动工作,进水为模拟废水,并用NaHCO3调节进水pH为7~8。挂膜成功后正式开始实验。鉴于实际废水的耗氧有机污染物浓度(以COD计)较高,正式实验的实际进水采用不同稀释比例(用自来水稀释)的混合废水,并额外投加NH4Cl,使废水在不同的COD下,NH4+-N质量浓度均维持在50 mg·L−1左右,以考察C/N对脱氮效果的影响。处理目标为《石油化学工业污染物排放标准》(GB 31571-2015),其中COD<60 mg·L−1、NH4+-N<8 mg·L−1、TN<40 mg·L−1。
-
挂膜启动采用的模拟废水的主要物质为:0.94 g·L−1 C6H12O6、0.096 g·L−1 NH4Cl、0.022 g·L−1 KH2PO4、0.05 g·L−1 NaCl、0.075 g·L−1 NaHCO3、0.075 g·L−1 MgSO4·7H2O、0.025 g·L−1 CaCl2、0.01 g·L−1 FeSO4·7H2O以及2 mL·L−1的微量元素溶液。实际石化废水的水质分析为:4 654 mg·L−1 TOC、4 124 mg·L−1 BOD5、14 040 mg·L−1 COD、16.5 mg·L−1 NH4+-N、28.8 mg·L−1 TN、39.3 mg·L−1 TP。由于实验所用混合废水仅添加NH4Cl作为外加氮源并且实际废水中并未检测到有机氮,参考相关文献[14],TN的质量浓度视为NH4+-N、NO2−-N和NO3−-N三者质量浓度的总和。AnEMBR内污泥取自大连市夏家河污水处理厂二沉池,IFFAS内污泥取自大连市凌水污水处理厂二沉池。
-
COD、NH4+-N、NO2−-N等水质指标测定采用标准方法[15];NO3−-N采用水杨酸-浓硫酸法[16]测定;TMP用压力表读数记录;CH4和CO2采用气相色谱法测定;pH采用梅特勒pH计测定;DO采用奥豪斯ST400D型便携式溶解氧仪测定;EPS采用甲醇-氢氧化钠法[13]提取,利用控温式荧光光谱仪(Cary Eclipse, Agilent, 马来西亚)进行3D-EEM分析;蛋白质采用考马斯亮蓝显色法[17]测定;多糖采用苯酚-硫酸法[18]测定。
-
通过16S rRNA高通量测序法分析耦合工艺的微生物群落组成。运行结束后在AnEMBR悬浮污泥、AnEMBR膜组件附着污泥、IFFAS悬浮污泥和IFFAS载体生物膜上各取10 mL污泥样品,首先利用试剂盒对样品进行DNA提取,再使用细菌引物341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC)对细菌16s的V3~V4区域进行扩增。另取AnEMBR悬浮污泥和AnEMBR膜组件附着污泥的10 ml污泥样品,利用试剂盒对样品进行DNA提取,再使用古菌引物对古菌16s的V3~V4区域进行2轮扩增(第1轮: 340F(CCCTAYGGGGYGCASCAG)和1000R(GGCCATGCACYWCYTCTC), 第2轮: 349F(GYGCASCAGKCGMGAAW)和806R(GGACTACVSGGGTATCTAAT)),最后在 Miseq测序平台上进行高通量测序。
-
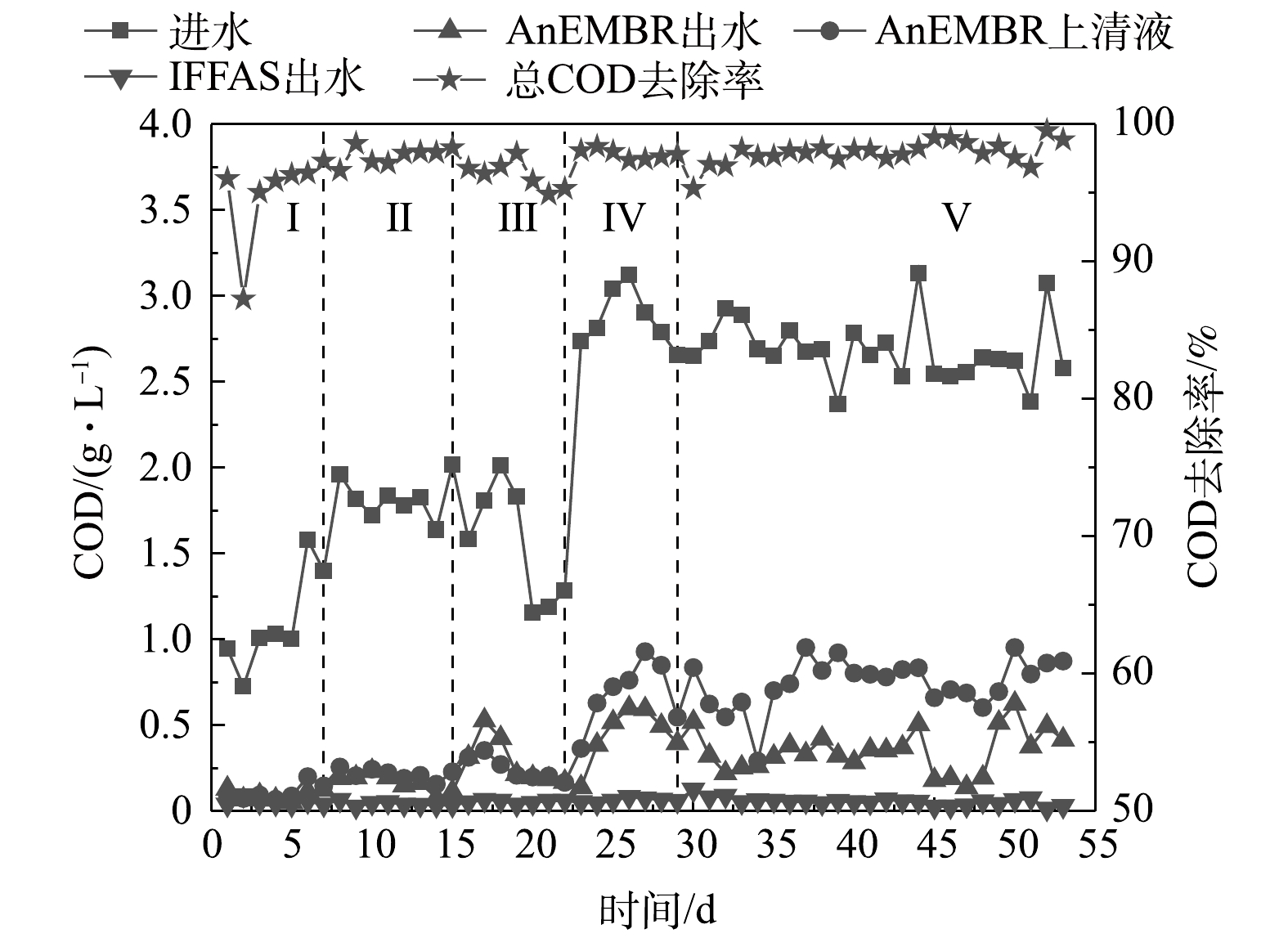
耦合工艺对耗氧有机污染物(以COD计)的去除分为3步:AnEMBR厌氧生物降解、膜分离作用和IFFAS好氧生物降解。图2为运行期间的COD去除情况,表2为COD去除率计算分析结果。阶段Ⅰ和阶段Ⅱ仅靠AnEMBR中的微生物就能去除89.3%的COD,膜分离的COD去除率为2.2%,IFFAS的COD去除率为5.5%。在缩短HRT后(阶段Ⅲ),厌氧生物降解(84.1%)和膜分离(0.2%)的去除率略有下降,IFFAS的COD去除率(14.6%)提高。进水COD升到2 800 mg·L−1(阶段Ⅳ)后,各环节的COD去除率为76.2%、8.4%和13.3%。虽然COD去除率得到提高,但出水COD也略有增加。当HRT回升至24 h(阶段Ⅴ)后,各环节的COD去除率为72.0%、15.2%和10.9%,出水COD稳定达标。当进水COD较低时,COD的去除集中在AnEMBR阶段;当进水COD较高时,AnEMBR的生物去除效果有限,阴极膜的阻隔效果以及IFFAS对COD的去除效果提高,使系统在面临不同浓度的废水时均能实现良好的COD去除效果。整个运行周期的COD去除率不断提高,维持在95%以上,其中阶段Ⅴ的COD平均去除率(97.9%)最高。阶段I~Ⅴ的出水COD平均值为50.24、41.50、54.71、62.33和52.11 mg·L−1,说明AnEMBR- IFFAS系统对石化废水具有较强的有机污染物去除能力。除阶段Ⅳ外,其他阶段均达到了《石油化工行业污染物排放标准》(GB 31571-2015)(COD<60 mg·L−1)。在本实验构建的含有微生物存在的电化学系统中,电活性微生物会在阳极氧化部分有机污染物,而阴极膜组件表面附着的部分产甲烷菌可以利用外电路传来的电子和CO2产甲烷。此外,阴极表面的微生物对污染物降解也有一定促进作用。另一方面,污泥回流保证了IFFAS内部较高的污泥浓度,能增强污泥-生物膜之间的交互作用,达到良好的有机污染物降解效果[19]。
-
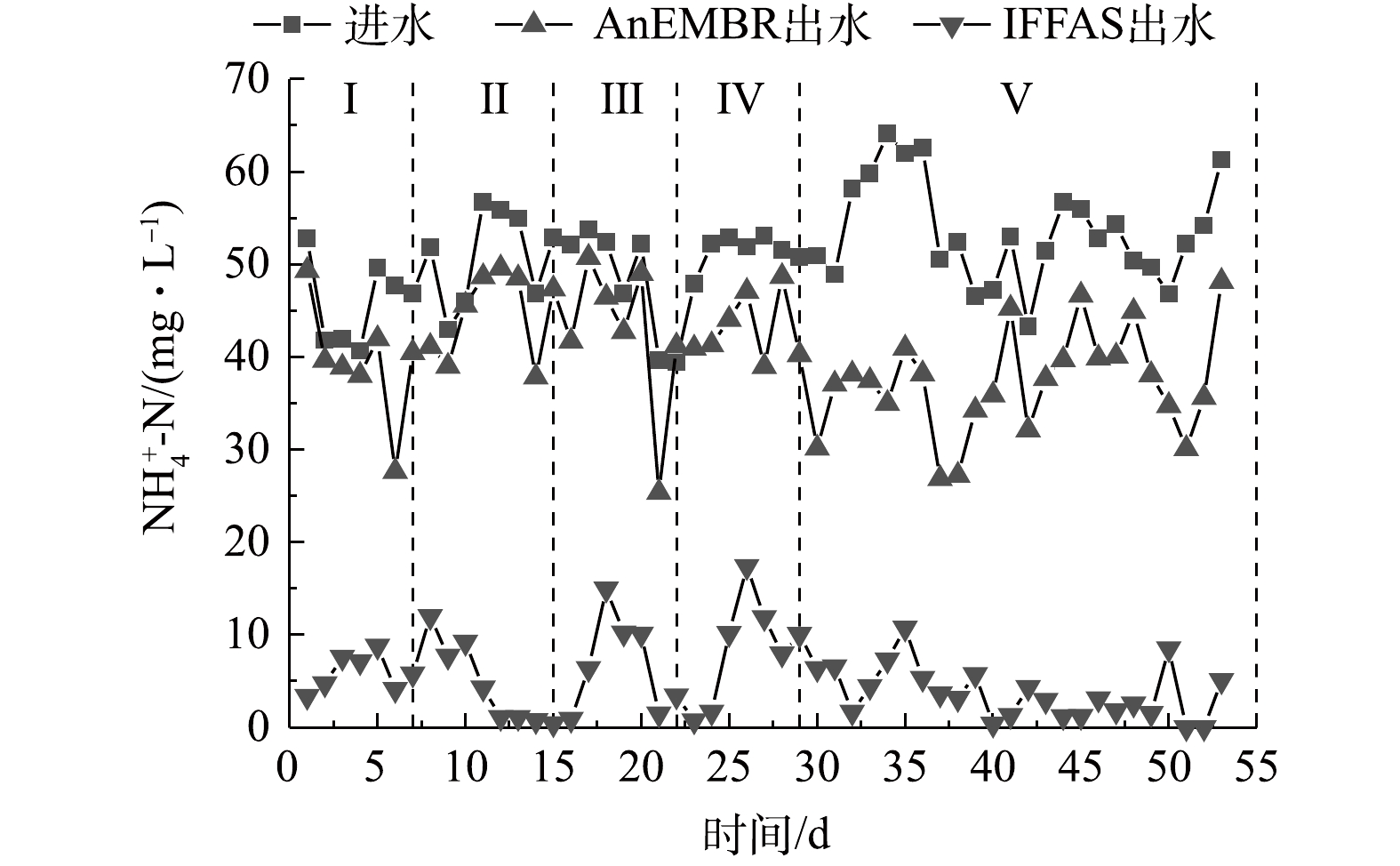
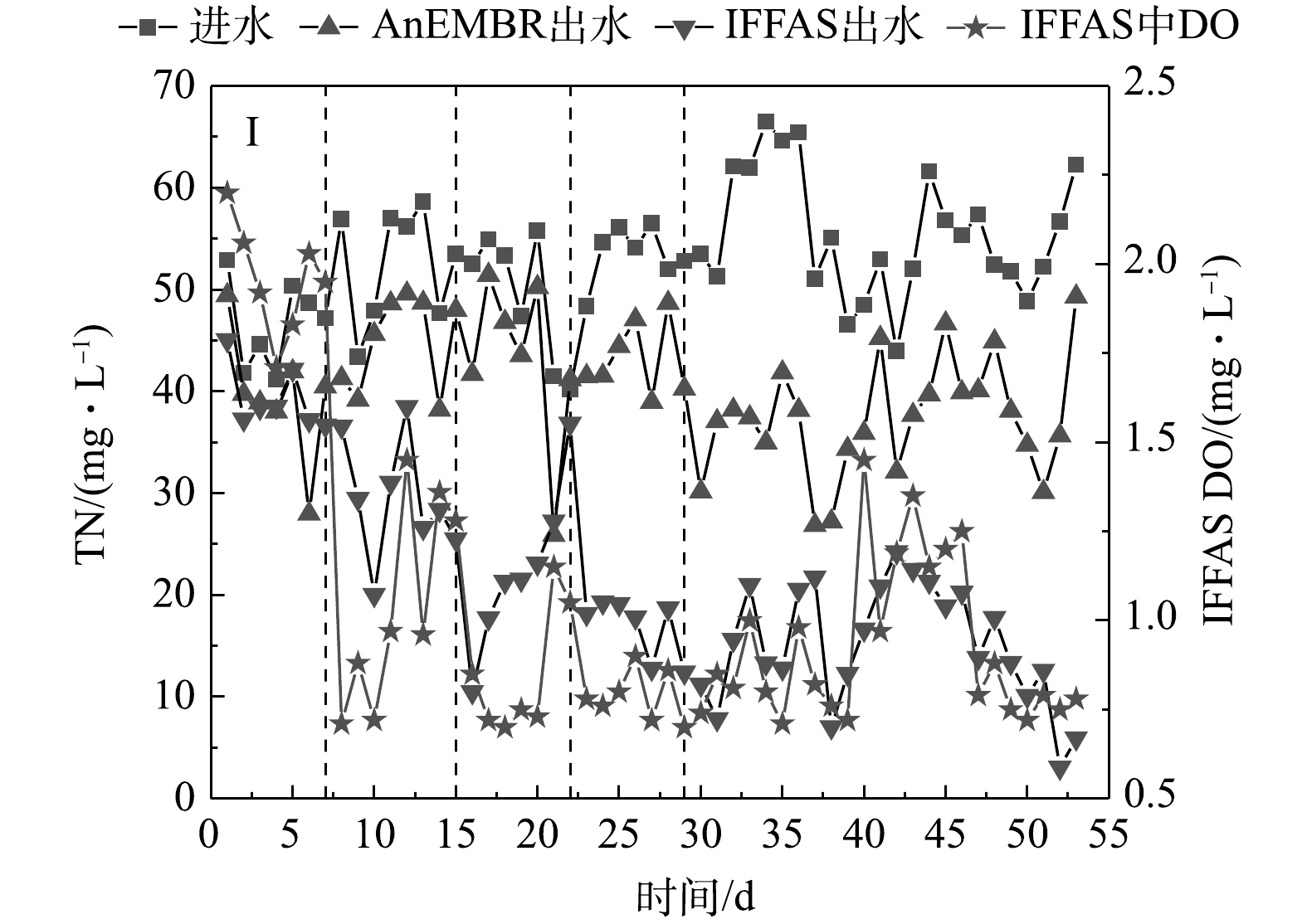
图3和图4分别反映了NH4+-N和TN的去除效果。依靠IFFAS载体上形成的好氧-缺氧体系和悬浮污泥中的局部好氧区和局部厌氧区实现同步硝化反硝化来降解NH4+-N和TN。而AnEMBR内部厌氧,硝化效果较差,其对NH4+-N和TN的去除贡献率较低。阶段I~Ⅴ中AnEMBR的 NH4+-N去除率为13.8%、12.2%、12.5%、16.3%和30.1%;阶段I~Ⅴ中AnEMBR的TN去除率为15.0 %、14.4%、13.5%、19.0%和32.3%。阶段Ⅰ的出水NH4+-N平均质量浓度为5.93 mg·L−1,TN平均质量浓度为39.13 mg·L−1。分析原因,一方面IFFAS内部DO质量浓度约为2.0 mg·L−1,生物膜内部反硝化效果较差;另一方面IFFAS的低C/N(2.4:1)无法使得反硝化充分进行。阶段Ⅱ提高IFFAS的 C/N(3.7:1)并将DO下调至1 mg·L−1左右,NH4+-N和TN去除率均有所提高,出水平均质量浓度分别为4.58 mg·L−1和29.50 mg·L−1。阶段Ⅲ的C/N(6.7:1)再次提高,各环节HRT缩短至18 h,出水NH4+-N和TN平均质量浓度分别为6.78 mg·L−1和22.60 mg·L−1。阶段Ⅳ提高C/N至10.3:1,出水NH4+-N和TN平均质量浓度分别为8.56 mg·L−1和16.89 mg·L−1。出水NH4+-N超标(8 mg·L−1),由此判断C/N不宜过高。分析原因,高C/N促进反硝化作用,但过高会使好氧异养菌大量增殖与硝化细菌竞争O2,抑制硝化作用。阶段Ⅴ提高HRT并降低C/N至9.7:1,此时NH4+-N和TN平均去除率可达到93.1%和72.2%,出水平均质量浓度分别为3.70 mg·L−1和15.19 mg·L−1。由图4可见,TN的去除与IFFAS的DO的变化趋势相似,当DO提高时(1.0~1.5 mg·L−1)TN去除效果降低,若DO大于2.0 mg·L−1,则无明显的去除效果。当DO在0.7~1.0 mg·L−1时,出水TN浓度较低且稳定达标,这说明若想实现TN的稳定去除,可使DO维持在较低水平(0.7~1.0 mg·L−1)。总体上看,适宜条件下(AnEMBR HRT=24 h,IFFAS HRT=24 h ,IFFAS C/N=9.7:1)工艺出水NH4+-N和TN能稳定达到《石油化学工业污染物排放标准》(GB 31571-2015),即NH4+-N<8 mg·L−1,TN<40 mg·L−1。
-
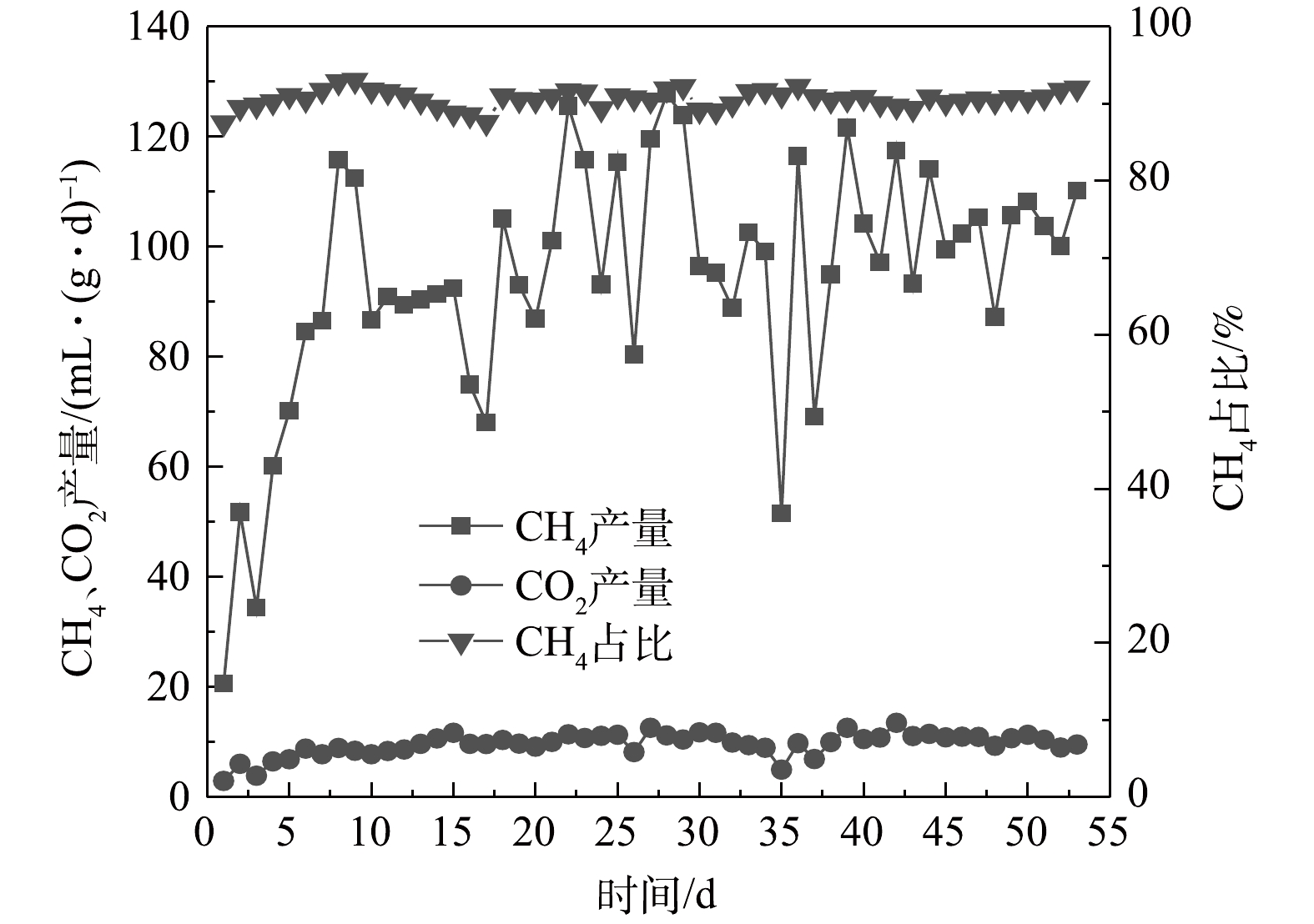
图5为CH4和CO2的每日产量。气体产量随进水COD的升高而升高。起初,产甲烷菌处于适应阶段,产气量较低,仅有20.61 mL·(g·d)−1。随着时间推移,进水COD提高,产甲烷量升高,日产量最高可达127.72 mL·(g·d)−1。运行周期内AnEMBR中的CH4气体平均占比为90.7%。KATURI等[20]发现AnEMBR系统中所发生的产甲烷过程多为氢型产甲烷过程,能有效富集氢型产甲烷菌,促进甲烷生成,这与后续的古菌群落分析结果一致。CHENG等[21]研究表明在电化学系统或微生物电解池(microbial electrolysis cell, MEC)中使用含有产甲烷菌的生物阴极可以通过电产甲烷过程直接生产甲烷(式(1)),比传统的厌氧消化产甲烷效果更好。
-
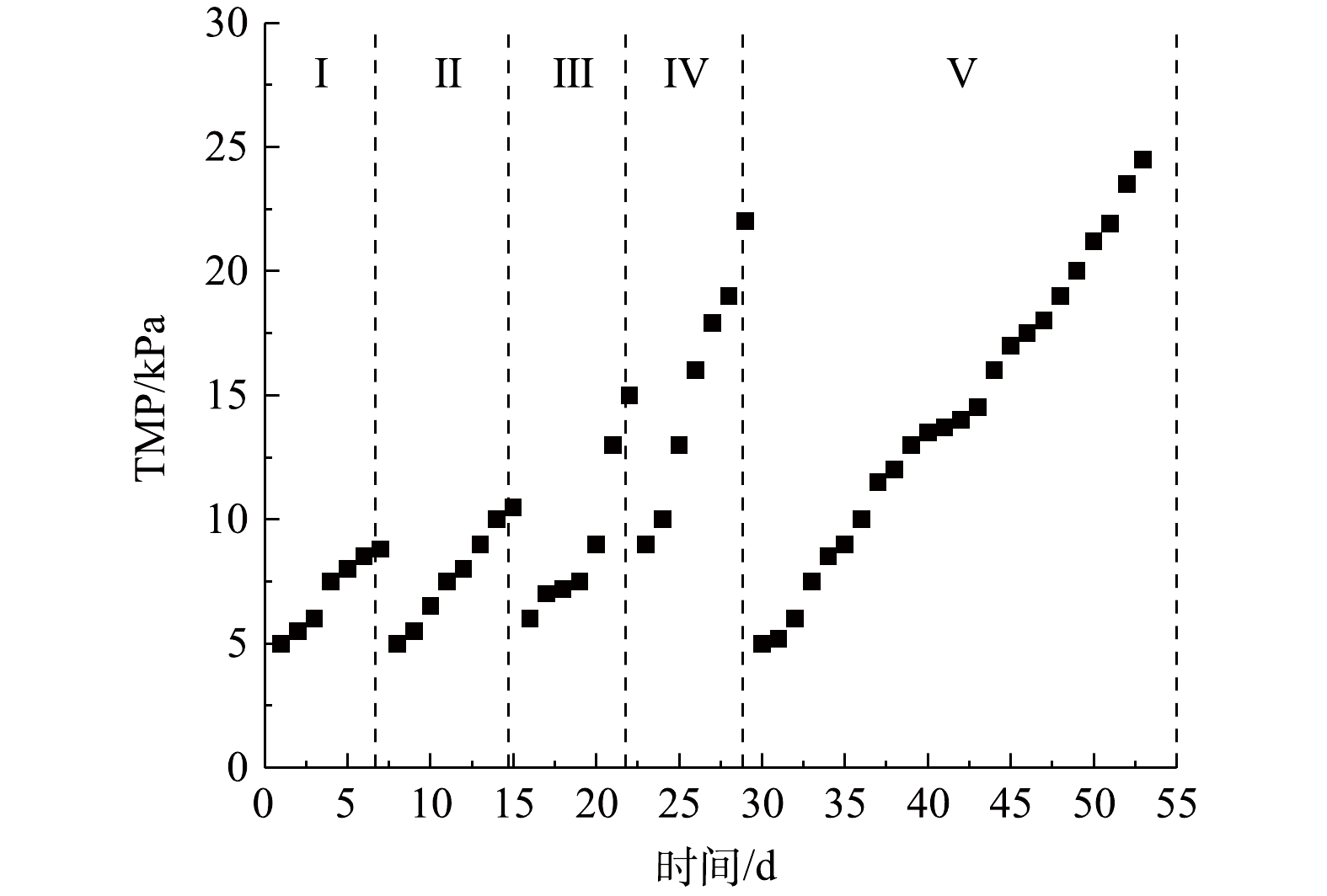
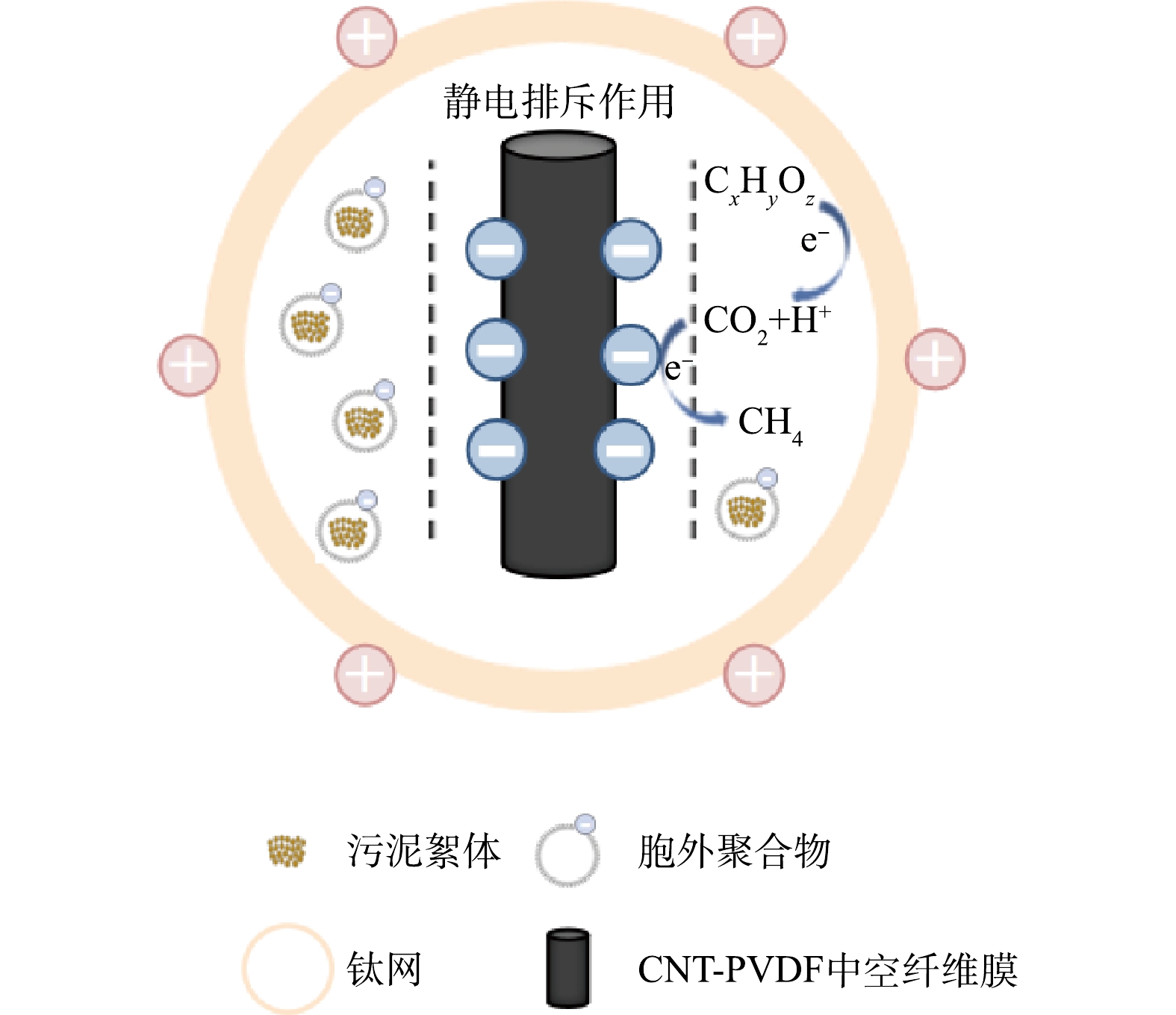
TMP可用来评估膜污染进程,AnEMBR中的TMP检测结果如图6所示。可以发现,随着COD的增加和HRT的缩短,TMP的增长速率加快,但每次水力清洗后的初始TMP差别不明显,表明膜组件没有出现严重的不可逆膜污染现象。每一阶段的TMP平均增长速率分别为:0.63、0.79、1.5、2.2和0.85 kPa·d−1。可以发现当HRT为24 h时(阶段Ⅰ、Ⅱ和Ⅴ),进水COD的提高,会加快TMP增长。当进水COD变化不大,提高HRT时(阶段Ⅳ和Ⅴ),TMP增长速率会明显下降。WANG等[22]构建了电化学膜生物反应器(electrochemicalmembrane bioreactor, EMBR)系统,并通过TMP变化和激光扫描共聚焦显微镜(confocal laser scanning microscope, CLSM)分析证明了施加外部电压能减少污泥沉积并减缓膜污染的发生。图7为膜污染缓解机理示意图。可见,施加负电压可使膜组件呈负电性,静电排斥作用会阻止带负电荷的EPS等靠近膜组件,抑制不可逆膜污染发生。此外膜表面发生的产甲烷反应,有利于冲刷污染层,对减缓膜污染具有部分贡献。
-
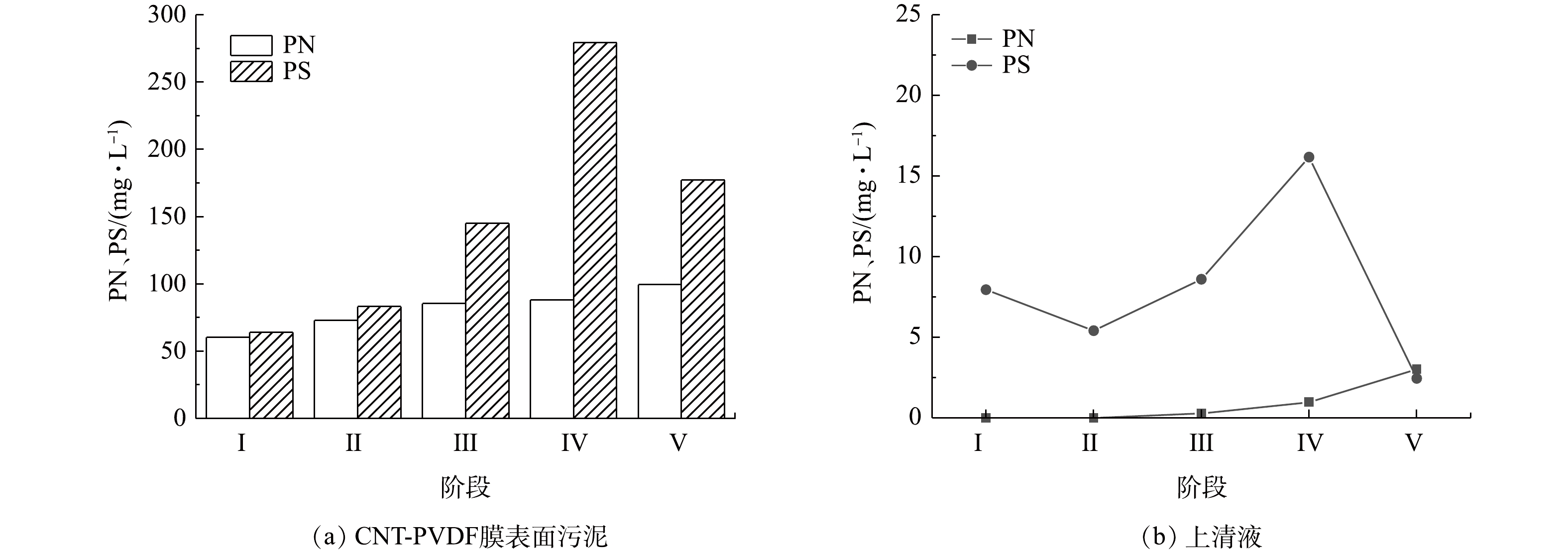
1) EPS浓度。胞外聚合物(EPS)的主要成分蛋白质(PN)和多糖(PS),能影响污泥絮体的絮凝性和表面带电性等[23],是膜污染的主要因素。测定了各阶段膜组件表面污泥以及上清液环境中的EPS含量,如图8所示。可以发现,EPS随着HRT的减少而升高,随着进水COD浓度的升高而升高。当进水浓度提升或HRT缩短时,多糖的增长速度更快,使PN/PS呈下降趋势,能够降低微生物絮凝物的疏水性与表面密度,从而使其不易粘附在膜表面,抑制膜污染[24]。但由图8可见,每个阶段的膜污染程度随时间的延长逐渐提高。这说明进水COD的提高以及HRT的缩短对膜污染的影响更大。上清液的EPS浓度始终维持在较低的水平,说明电负性环境减弱了EPS在上清液的聚集,抑制EPS向膜组件靠近。
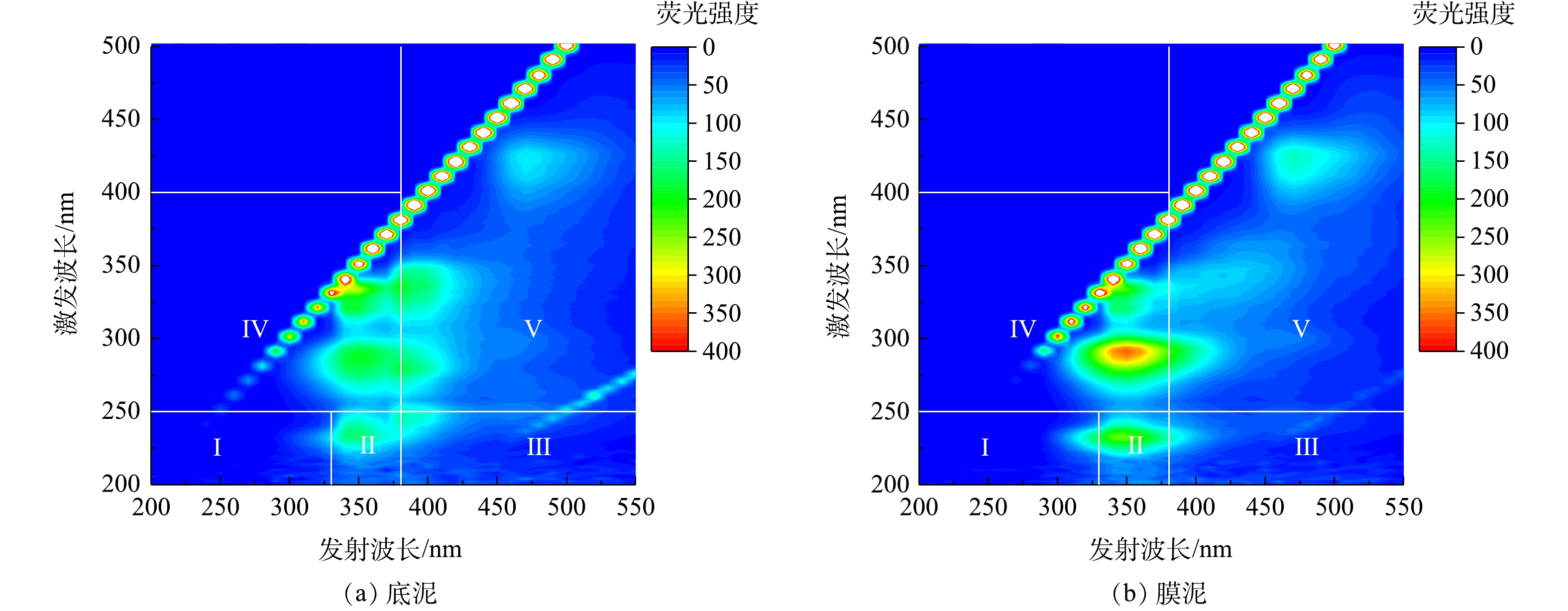
2)对EPS的定性3D-EEM分析。运行结束后对AnEMBR膜表面污泥和底部污泥的EPS样品进行3D-EEM分析,结果如图9所示。将三维光谱图划分为5个区域,每个区域相应的荧光代表物质为:Ⅰ区为类酪氨酸(λex/λem为(200~250) nm/(200~330) nm)、Ⅱ区为类色氨酸(λex/λem为(200~250) nm/(330~380) nm)、Ⅲ区为类富里酸( λex/λem为(200~250) nm/(380~500) nm)、Ⅳ区为类溶解性代谢产物(λex/λem为(250~400) nm/(200~380) nm)和Ⅴ区类腐殖酸(λex/λem为(250~400) nm/(380~500) nm)[25]。可以发现,在电化学作用下,不同区域的EPS在种类和含量上存在一定的差异。EPS的荧光峰主要集中在Ⅱ、Ⅳ、Ⅴ区域。荧光强度越高,代表该物质含量越高。从荧光峰强度来看,膜表面污泥样品的整体荧光峰强度更高,代表其EPS含量更高。其中荧光峰强度最高的是Ⅳ区域,其次是Ⅱ区域,这些区域包含色氨酸类蛋白质及其他类蛋白物质,是造成膜污染的主要因素之一。蛋白质是两性电解质,含有氨基和羧基等基团,本身电性与体系pH和自身等电点相关。以上结果表明,与底泥相比,施加阴极电压未有效抑制该类污染物的分泌。与Ⅱ、Ⅳ区域相比,膜表面污泥较底部污泥在Ⅴ区域的荧光强度增幅最小,该区域主要物质是腐殖酸,其主要基团是羧基和羰基,易被带负电荷的膜组件排斥,不易富集在负电环境中[8]。以上结果说明,电化学系统的介入,一方面可以改变EPS的组成且减弱其粘附性能,另一方面有利于减缓类腐殖酸物质污染物造成的膜污染效应。
-
在实验结束后,对AnEMBR底部污泥(A)、AnEMBR膜组件表面污泥(B)、IFFAS悬浮污泥(C)和IFFAS载体生物膜(D)的微生物样品进行16S rRNA高通量测序,分析微生物组成。
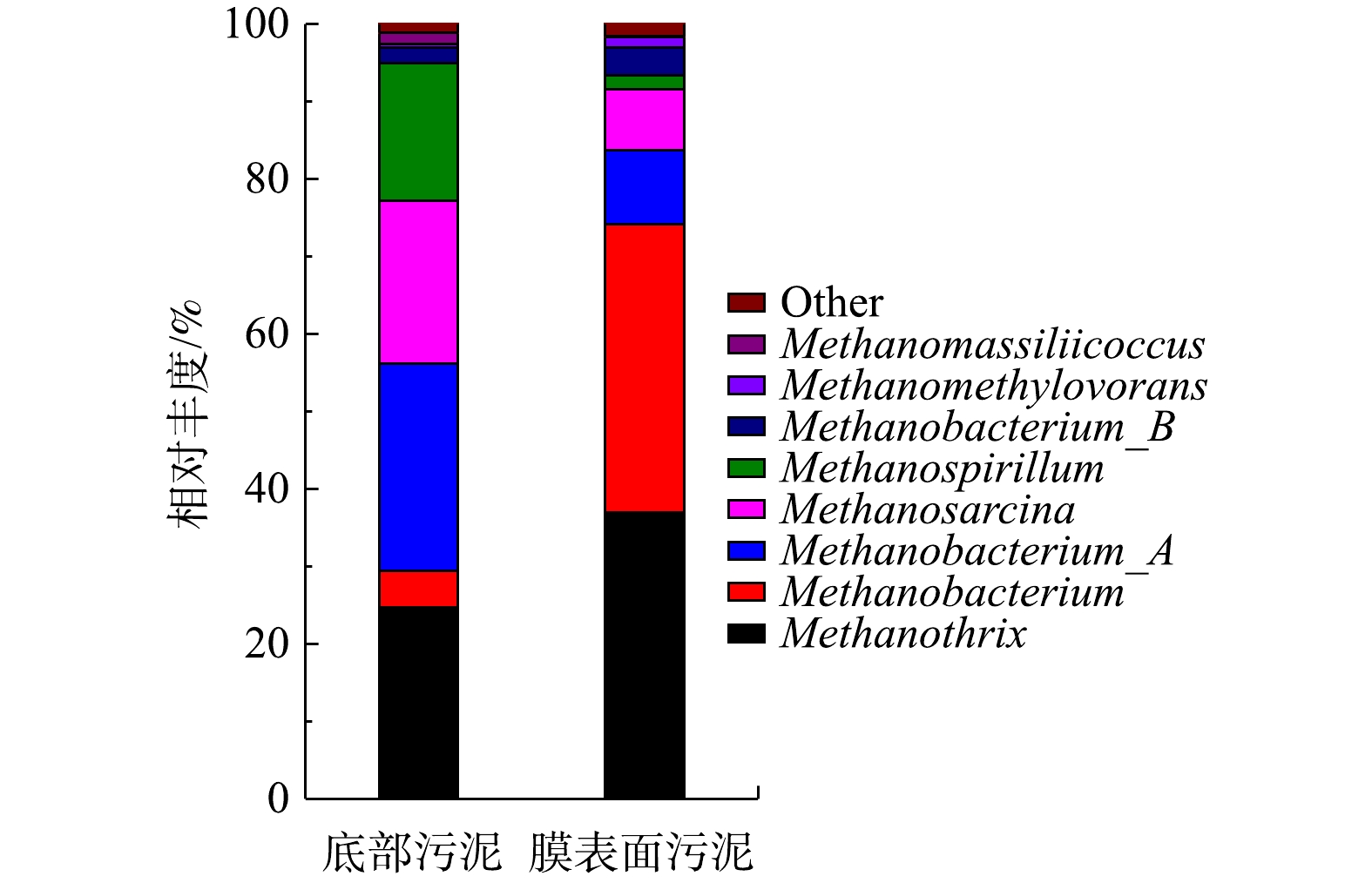
1) AnEMBR古菌群落分析。如图10所示,主要古菌属有6个,分别为Methanobacterium、Methanothrix、Methanosarcina、Methanospirillum、Methanomethylovorans、Methanomassiliicoccus。膜上富集了大量的Methanobacterium (50.43%)和Methanothrix (36.92%)。其中Methanobacterium (甲烷杆菌)是可以利用多种底物(甲醇、H2和CO2等)的氢型产甲烷菌[26-27],在底泥和膜泥中占比最高,是电化学系统中的优势菌群。Methanothrix (甲烷丝菌)为乙酸型产甲烷菌,能够将乙酸转化为甲烷[28],AnEMBR中的VFA的主要成分是乙酸,为其提供了碳源。Methanosarcina(甲烷八叠球菌)是利用乙酸、H2和CO2或甲基化合物产甲烷的多营养型产甲烷菌[29],在底泥(21.07%)和膜泥(7.83%)中也有一定富集。Methanospirillum(甲烷螺菌)可利用H2和CO2等产甲烷[30],在底泥(17.71%)中有较高占比,而膜泥(1.80%)中含量较低。体系还存在少量的Methanomethylovorans(底泥0.52%, 膜泥1.34%)和Methanomassiliicoccus(底泥1.45%, 膜泥0.06%)2种甲基营养型产甲烷菌[31-32]。
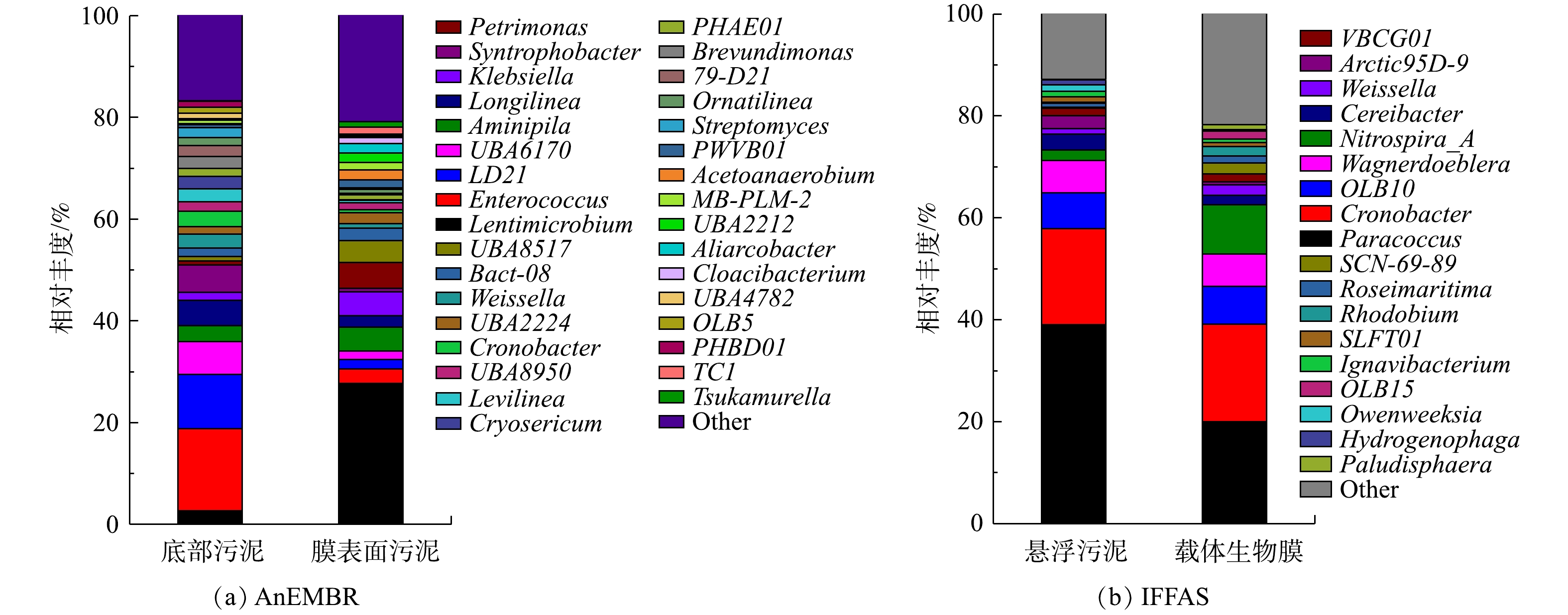
2)AnEMBR细菌群落分析。如图11(a)所示,底泥富集了Enterococcus(16.13%)、LD21(10.62%)、UBA6170(6.43%)、Syntrophobacter(5.37%)等菌属。膜泥富集了Lentimicrobium(27.72%)、Petrimonas(5.15%)等菌属。其中Lentimicrobium是一类能够进行胞外电子传递的发酵细菌,与产甲烷过程密切相关[33],在膜上相对丰度最高。Aminipila是一类严格的厌氧细菌通过发酵产生乙酸盐和丁酸盐[34],在底泥和膜泥的丰度相近。Petrimonas是一类利用NO2−等作为电子受体的厌氧发酵细菌,常见于微生物燃料电池[35-36]。Longilinea 、Tsukamurella 等菌属对有机物的降解也有一定贡献。此外,AnEMBR中的许多菌属与产甲烷过程密切相关。Clostridium(底泥0.54%, 膜泥0.14%)、Pseudomonas(底泥0.44%, 膜泥0.33%)、Syntrophomonas(底泥0.17%, 膜泥0.15%)、Syntrophobacter(底泥5.37%, 膜泥0.64%)、Smithella(底泥0.79%, 膜泥0.70%)和Thauera(底泥0.086%, 膜泥 0.85%)是AnEMBR中主要的产甲烷共生菌,能与部分产甲烷古菌进行互营代谢合作,促进产甲烷作用[37-38]。
3) IFFAS细菌群落分析。IFFAS的群落分布如图11(b)所示。Paracoccus菌属常见的好氧或兼性厌氧菌属,该菌属下部分细菌能够以NO3−、NO2−作为电子受体进行厌氧生长[39],在生物膜(19.98%)与悬浮污泥(39.02%)中的含量最高。Nitrospira菌属为自养硝化菌属,能够将亚硝氮转化为硝氮[12],其在生物膜(9.59%)上的含量明显高于在悬浮污泥(2.10%)中的含量,说明悬浮载体成功富集了硝化细菌。Rhodobium菌属在悬浮污泥和生物膜上的含量分别为0.14%和1.92%,是反硝化菌目Rhizobiales的成员[12]。Ignavibacterium菌属是亚硝酸盐还原细菌[40],在生物膜(含量0.71%)和悬浮污泥(含量1.04%)上均有富集。
-
1)工艺稳定运行时(AnEMBR HRT=24 h,IFFAS HRT=24 h,IFFAS C/N=9.7:1)能够实现平均97.9% COD、93.1% NH4+-N和72.2% TN的同时去除。2)AnEMBR的不可逆膜污染程度较轻,同时可回收CH4,日产量最高为127.72 mL·(g·d)−1。3) AnEMBR中富集了以氢型产甲烷菌Methanobacterium为主的产甲烷古菌。IFFAS中富集了Nitrospira、Rhodobium、Ignavibacterium等脱氮功能菌。




 下载:
下载: