有机磷酸酯(organophosphate esters, OPEs)是现代工业领域中不可或缺的一类功能性助剂,是阻燃剂和增塑剂的主要成分,可以有效提高产品的阻燃性和可塑性,因此被广泛应用到建材、纺织、电子以及石油化工等领域[1-2]。目前,随着溴系阻燃剂的限制使用[3],作为其优良替代品,OPEs逐渐占据国内外市场,需求量不断增大。我国作为世界上最大的阻燃剂和增塑剂的进出口国之一,OPEs的消费量在2013年就已经达到了3.0×105 t,并以每年15%的速度持续增长[4-5]。由于OPEs主要是通过物理方式添加到产品中,因此在生产、使用和处理过程中极易通过产品的挥发、磨损以及泄露而渗透到周围环境介质中,从而致使环境污染。由于OPEs物理化学性质多样(表1),可存在于不同环境介质中,例如水体[6]、灰尘[7]、沉积物[8]、空气[9],甚至在水生生物、哺乳动物以及人体中也检测到了OPEs的存在[10-11]。已有研究表明,部分OPEs对鱼类、鸟类甚至人类都具有致癌[12]、抑制神经[13]等毒性,表明OPEs仍然会对生态环境和生物带来不容小觑的威胁。我国是世界水产养殖大国,养殖水产品总量约占全世界的70%以上,水产品出口量居世界首位。目前,河口和近岸海域是我国渔业资源和养殖产业发展的重要区域,同时也是经济和商业活动发达的地区[14]。近年来,随着我国沿海经济和社会的快速发展,导致近海养殖环境状况不容乐观,养殖环境污染风险不断增加,对养殖生态系统造成危害,并通过食物网的生物富集和生物放大作用危害人体健康。
表1 常见有机磷酸酯(OPEs)的基本信息
Table 1 Basic information about common organophosphate esters (OPEs)
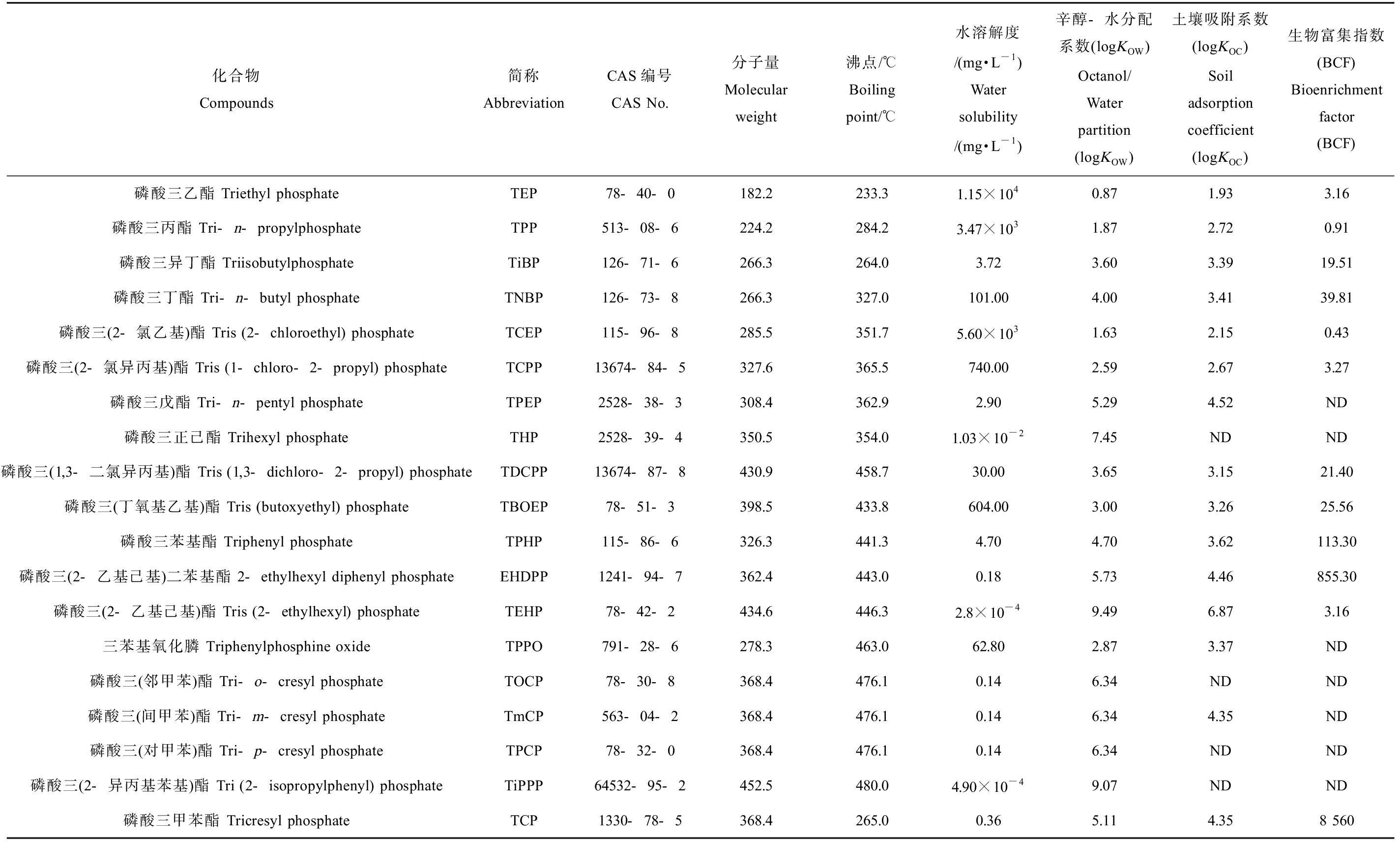
化合物Compounds简称AbbreviationCAS编号CAS No.分子量Molecularweight沸点/℃Boilingpoint/℃水溶解度/(mg·L-1)Water solubility/(mg·L-1)辛醇-水分配系数(logKOW)Octanol/Water partition (logKOW)土壤吸附系数(logKOC)Soiladsorption coefficient(logKOC)生物富集指数(BCF)Bioenrichment factor(BCF)磷酸三乙酯 Triethyl phosphateTEP78-40-0182.2233.31.15×1040.871.933.16磷酸三丙酯 Tri-n-propylphosphateTPP513-08-6224.2284.23.47×1031.872.720.91磷酸三异丁酯 TriisobutylphosphateTiBP126-71-6266.3264.03.723.603.3919.51磷酸三丁酯 Tri-n-butyl phosphateTNBP126-73-8266.3327.0101.004.003.4139.81磷酸三(2-氯乙基)酯 Tris (2-chloroethyl) phosphateTCEP115-96-8285.5351.75.60×1031.632.150.43磷酸三(2-氯异丙基)酯 Tris (1-chloro-2-propyl) phosphateTCPP13674-84-5327.6365.5740.002.592.673.27磷酸三戊酯 Tri-n-pentyl phosphateTPEP2528-38-3308.4362.92.905.294.52ND磷酸三正己酯 Trihexyl phosphateTHP2528-39-4350.5354.01.03×10-27.45NDND磷酸三(1,3-二氯异丙基)酯 Tris (1,3-dichloro-2-propyl) phosphateTDCPP13674-87-8430.9458.730.003.653.1521.40磷酸三(丁氧基乙基)酯 Tris (butoxyethyl) phosphateTBOEP78-51-3398.5433.8604.003.003.2625.56磷酸三苯基酯 Triphenyl phosphateTPHP115-86-6326.3441.34.704.703.62113.30磷酸三(2-乙基己基)二苯基酯 2-ethylhexyl diphenyl phosphateEHDPP1241-94-7362.4443.00.185.734.46855.30磷酸三(2-乙基己基)酯 Tris (2-ethylhexyl) phosphateTEHP78-42-2434.6446.32.8×10-49.496.873.16三苯基氧化膦 Triphenylphosphine oxideTPPO791-28-6278.3463.062.802.873.37ND磷酸三(邻甲苯)酯 Tri-o-cresyl phosphateTOCP78-30-8368.4476.10.146.34NDND磷酸三(间甲苯)酯 Tri-m-cresyl phosphateTmCP563-04-2368.4476.10.146.344.35ND磷酸三(对甲苯)酯 Tri-p-cresyl phosphateTPCP78-32-0368.4476.10.146.34NDND磷酸三(2-异丙基苯基)酯 Tri (2-isopropylphenyl) phosphateTiPPP64532-95-2452.5480.04.90×10-49.07NDND磷酸三甲苯酯 Tricresyl phosphateTCP1330-78-5368.4265.00.365.114.358 560
注:ND表示无数据。
Note: ND indicates no data.
1 有机磷酸酯在近海养殖生态系统中的污染特征(Characteristics of OPEs in offshore aquaculture ecosystems)
1.1 有机磷酸酯在养殖水体中的污染特征(Characteristics of organophosphate esters in aquaculture water)
由于OPEs是通过物理方式添加至产品中,在生产、使用和处理时极易通过浸泡、磨损等方式渗透至周围环境中[12],且OPEs性质差别较大,极性相对较大的OPEs会溶于水,并通过雨水冲刷、地表径流以及大气干/湿沉降等途径进入到湖泊、河流、井水和海洋环境中,此外养殖活动中使用的浮球等塑料制品也可能会导致养殖水体受到污染。一些难降解的OPEs可长期存在于水环境中,对水产养殖、居民日常生活用水甚至饮用水造成有害影响。表2列举了国内外重要水域及生物体中OPEs的残留赋存状况。
表2 不同介质中OPEs的浓度水平
Table 2 OPEs pollution level in different media

介质Media年份Year研究区域Study area类型TypeOPEs浓度Concentration of OPEs参考文献References水体Waterng·L-12011—2012中国珠江Pearl River, China河流River1 080~3 120[98]2013中国环渤海河流Rivers around Bohai Sea, China河流River9.6~1 549[17]2013—2014中国北京城市地表水Urban surface water in Beijing, China河流、湖泊River, lake3.24~10 945[22]2017中国海河Haihe River, China河流River23.98~824.72[99]-中国梅梁湾Meiliang Bay, China湖泊(淡水养殖)Lakes (Freshwater farming)1 000~2 700[100]2012中国南海The South China Sea近岸养殖海域Offshore aquaculture area1.25~147[19]2013日本东京湾Tokyo Bay, Japan近岸海洋Offshore waters107~284[19]2013美国旧金山湾San Francisco Bay, USA近岸海洋Offshore waters170~5 100[23]2013—2018北冰洋(加拿大境内区域)Arctic Ocean (area in Canada)近岸养殖海域Offshore aquaculture area0.017~306[101]2015中国黄海和渤海The Yellow Sea and Bohai Sea 近岸养殖海域Offshore aquaculture area8.12~98.04[18]2016欧洲海水养殖场European aquaculture近岸养殖海域Offshore aquaculture area0.43~867[20]2019中国粤港澳大湾区Greater Bay Area, China近岸养殖海域Offshore aquaculture area32.7~1 032.7[102]2019中国杭州湾Hangzhou Bay, China近岸养殖海域Offshore aquaculture area0.51~885.03[103]2019中国象山港Xiangshan Bay, China近岸养殖海域Offshore aquaculture area3.97~1 068.17[104]2020中国钦州湾Qinzhou Bay, China近岸养殖海域Offshore aquaculture area150~885[15]2014北大西洋和北极the North Atlantic and the Arctic远洋海域Off-lying sea0.348~839.6[105]沉积物Sedimentng·g-1 (以干质量计Based on dry mass)2014—2015欧洲阿迪杰河流域Adige River Basin, Europe河流沉积物River sediment11.5~549[8]2014—2015欧洲埃弗罗塔斯流域Evrotas River Basin, Europe河流沉积物River sediment0.31~31[8]2016中国太湖Taihu Lake, China湖泊(淡水养殖)沉积物Lakes (Freshwater farming) sediment8.12~420[21]2010中国珠江口Pearl River Estuary, China近岸养殖海域沉积物Offshore aquaculture area sediment12~322[27]2013—2018北冰洋(加拿大境内区域)Arctic Ocean (area in Canada)近岸养殖海域沉积物Offshore aquaculture area sediment0.12~57[101]2014—2017中国渤海湾Bohai Bay, China近岸养殖海域沉积物Offshore aquaculture area sediment1.66~28.7[24]2015中国渤海莱州湾Laizhou Bay of Bohai Sea, China近岸养殖海域沉积物Offshore aquaculture area sediment6.65~41.5[25]

续表2介质Media年份Year研究区域Study area类型TypeOPEs浓度Concentration of OPEs参考文献References2015中国北部湾养殖场Mariculture farms of the Beibu Gulf, China近岸养殖海域沉积物Offshore aquaculture area sediment4.35~22.1[16]2019中国杭州湾Hangzhou Bay, China近岸养殖海域沉积物Offshore aquaculture area sediment2.93~37.81[103]2019中国象山港Xiangshan Bay, China近岸养殖海域沉积物Offshore aquaculture area sediment0.39~65.51[104]2020中国钦州湾Qinzhou Bay, China近岸养殖海域沉积物Offshore aquaculture area sediment
我国钦州湾是一个半封闭港湾,特殊的地理位置使其成为一个重要的海水养殖区,受当地工业和人类活动的影响,钦州湾近年来OPEs被频繁检出,海水中OPEs浓度范围为150~885 ng·L-1,且主要以磷酸三(2-氯异丙基)酯(TCPP)、磷酸三(1,3-二氯异丙基)酯(TDCPP)和磷酸三(2-氯乙基)酯(TCEP)为主,其高浓度区域均集中在工业区和港口区附近[15]。Zhang等[16]对中国北部湾海水养殖基地OPEs的分布进行了研究,OPEs的浓度范围为32.9~227 ng·L-1,且开阔海域中(32.9~71.3 ng·L-1)OPEs浓度低于养殖池塘区域(47.1~227 ng·L-1),主要检出物为氯代类OPEs (主要为TCEP和TCPP)。Wang等[17]报道了中国华北地区40条汇入渤海的河流中OPEs的浓度和组成,OPEs浓度范围为9.6~1 549 ng·L-1,平均浓度为300 ng·L-1,其中氯代类OPEs的含量最高,TCPP、TCEP和TDCPP 3种氯代类OPEs占总浓度的69%~99%。该研究表明40条河流每年往渤海海域输送约16 t的OPEs,大量污染物的流入会对渤海湾养殖环境和水生生物造成不利的影响。渤海和黄海是我国重要的养殖海域,Zhong等[18]于2017年对该海域中的OPEs进行了研究,OPEs的浓度范围为8.12~98.04 ng·L-1,主要以TCPP、TCEP和三苯基氧化膦(TPPO)为主,并且发现该海域OPEs的分布受到了海洋水文因素的影响,如黄海冷水团、长江冲淡水、台湾暖流以及苏北沿岸流等。Lai等[19]研究分析了中国珠江三角洲、南海、黄河口以及日本的东京湾水环境中OPEs的污染水平,检出浓度分别为14.9~1 790、1.25~147、253~1 720和107~284 ng·L-1,与上述其他研究不同,该区域检测率最高的OPEs单质是磷酸三乙酯(TEP),其次为TPPO和TCEP,造成这种差别的原因可能与采样地点的地理位置有关。我国近岸海域中OPEs的浓度与欧洲养殖海域类似,如葡萄牙(547±437) ng·L-1和英国(275±34.9) ng·L-1[20];普遍低于我国太湖梅梁湾(1 000~2 700 ng·L-1)[21]、环渤海河流(9.6~1 549 ng·L-1)[17]以及被北京城市地表水(3.24~10 945 ng·L-1)等[22]淡水区域,也低于世界其他近岸海域,如美国的旧金山湾(170~5 100 ng·L-1)[23],但组成与其他水体中相似,均以氯代类OPEs为主(图1)。此外,近海养殖环境中OPEs的浓度普遍高于远洋海域,由于OPEs在水产养殖中并没有直接的应用,因此对于养殖区而言,受到OPEs的污染大多是来自于养殖区域周边的工业废水、生活污水的排放,以及地表径流带来的污染物[2],且由于OPEs具有难以降解的特性,会随着河流和地表径流进入到湖泊、河口和近岸海域中,最终可能会影响到养殖活动。数据表明OPEs对我国海洋环境造成的污染已经非常普遍,然而对于一些特殊的近岸环境,如近岸养殖海域以及国家级保护区等区域,其受到OPEs的污染状况、空间分布、时间变化以及潜在来源等信息仍值得更多的关注。
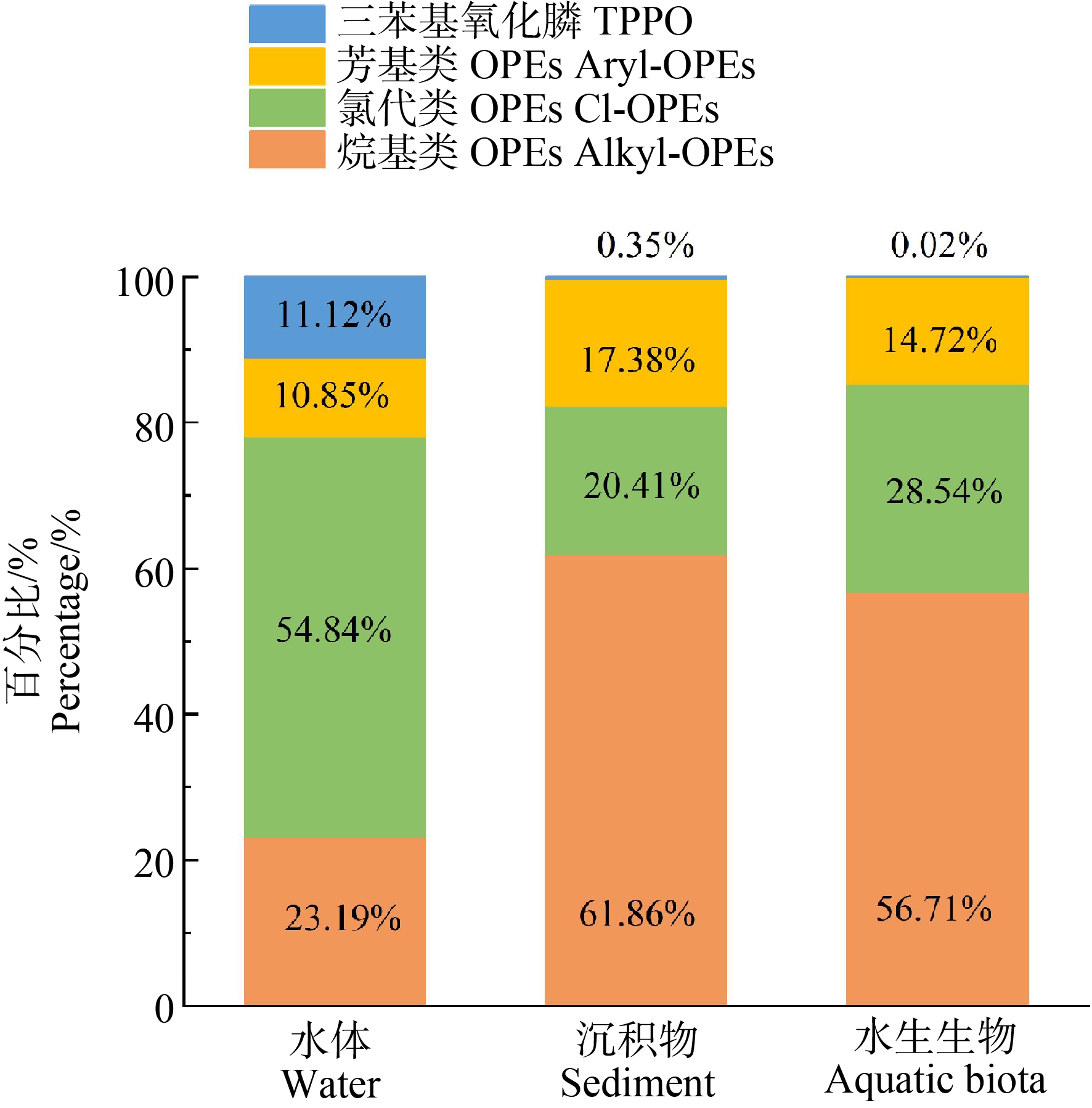
图1 水体、沉积物及水生生物中OPEs的化学组成
Fig. 1 Chemical composition of OPEs in water, sediment and aquatic biota
1.2 有机磷酸酯在沉积物中的污染特征(Characteristics of OPEs in sediments)
受自身性质的影响,OPEs会根据水溶性和极性而溶解或者吸附在不同的环境介质中,脂溶性较大的OPEs容易沉降到水环境底部与沉积物相结合,从而使得不同海域水环境中的沉积物遭受不同程度的污染,沉积物中OPEs大量聚集会对底栖生物造成不良影响。
Chen等[24]在2014—2017年期间对渤海湾西北部区域沉积物中的OPEs进行了的研究,发现OPEs的浓度水平在1.66~28.7 ng·g-1 (以干质量计)之间,其中占比最高的是TCPP,在2017年的占比高达84%。此外,OPEs也显现出了季节性和时间性的变化:TEP表现出夏季高于春秋两季的趋势,而TCEP和磷酸三(丁氧基乙基)酯(TBOEP)则与之相反,在夏季的浓度最低;而对于时间变化,由于近些年来的工业发展,加大了OPEs的使用量从而使其浓度在2014—2016年期间迅速增加。Wang等[25]调查了中国渤海莱州湾附近的黄河口和海水养殖区沉积物中OPEs的赋存状况,研究发现黄河口(11.8~102 ng·g-1 (以干质量计))附近的OPEs浓度高于海水养殖区(6.65~41.5 ng·g-1 (以干质量计)),莱州湾海水养殖区沉积物中OPEs主要以TCPP、TCEP、磷酸三苯基酯(TPHP)和TDCPP为主,其中TCPP和TCEP的含量最高,分别占总量的16%~40%和7.6%~53%。Zhang等[16]对中国北部湾海水养殖场沉积物中的OPEs进行了研究,在池塘中检测到的OPEs浓度范围分别为4.35~22.1 ng·g-1 (以干质量计),TCPP和TCEP是所有OPEs中检出浓度最高的2种物质。中国钦州湾沉积物中OPEs的含量为<定量限(LOQ)~32.2 ng·g-1 (以干质量计),且以TCPP、TCEP和磷酸三丁酯(TNBP)为主[15]。珠江三角洲地区是我国重要的海水养殖区域之一,也一直是研究人员重点研究的区域,该区域由珠江、北江、东江和西江4条河流汇集而成,是我国最发达的地区之一[26]。研究发现珠江口(12~322 ng·g-1 (以干质量计))中OPEs的浓度高于西江(8.3~48 ng·g-1 (以干质量计))和东江(1.52~293 ng·g-1 (以干质量计)),略低于北江(48~470 ng·g-1 (以干质量计))和珠江(62~577 ng·g-1 (以干质量计))[27]。此外,研究人员发现TCEP和磷酸三(2-乙基己基)酯(TEHP)是珠江口沉积物中占比最高的2种OPEs,这可能归结于TCEP在该地区的大量应用、TEHP较高的土壤吸附系数(logKOC=6.87)以及低水溶性(25 ℃时溶解度为0.6 mg·L-1)[28]。Ma等[29]在北太平洋和北冰洋沉积物中仅检测到了0.16~4.57 ng·g-1的OPEs,远低于我国和其他区域的研究结果,但TCEP仍然占据了主导地位,这表明氯代类OPEs在沉积物中的污染在世界范围内已经普遍存在。Aznar-Alemany等[20]报道了欧洲8个国家海水养殖区沉积物中的OPEs,范围为0.04~92.8 ng·g-1 (以干质量计),高于我国大部分养殖海域。受自身物理化学性质的影响,使得一些疏水性强的OPEs(如TEHP及TPHP)更倾向于吸附在沉积物中,而溶解度较大的TCEP(25 ℃时的溶解度为7 000 mg·L-1)在沉积物中的大量检出则说明可能不仅与其自身的性质有关[30],目前关于OPEs浓度与沉积物之间的关系尚不明确,因此需要开展更深入的研究。
1.3 有机磷酸酯在水生生物中的污染特征(Characteristics of OPEs in aquatic organisms)
OPEs最初被认为是一种对环境和生物都比较“友好”的添加剂,然而随着研究的不断开展,OPEs在越来越多的介质中被发现,尤其是在生物体中,已有研究证实在水生动物、鸟类和哺乳动物体内,甚至在人体毛发、血液、尿液及母乳中均检测到OPEs的残留。同时,研究表明,OPEs可通过食物网传递且具有生物放大作用,严重影响人体健康。因此,OPEs对生物种群的影响得到各国学者及政府的高度重视[10-11]。
近年来,关于水生生物体内OPEs残留的报道逐渐增加,主要覆盖了淡水、湖泊及海洋等养殖区域以及不同层次营养级。对于低营养级水生生物而言,太湖梅梁湾蓝藻(Cyanobacteria)等浮游生物中OPEs的浓度为(100±23) ng·g-1 (以湿质量计),主要以磷酸三异丁酯(TiBP)为主[31],通过比较发现,太湖浮游生物体内OPEs的浓度远高于南极的藻类样品(平均值为0.25 ng·g-1(以湿质量计))[32],主要原因可能是受人类及工业活动的影响,使得太湖水环境中生物体的污染程度高于南极地区。而太湖梅梁湾无脊椎动物体内OPEs的含量为(17.1±11) ng·g-1 (以湿质量计),主要以TCPP、TDCPP和TEHP为主[31]。另一项关于太湖竺山湾水生生物的调查结果表明,无脊椎动物体内的OPEs含量范围为2.0~21 ng·g-1 (以湿质量计),TDCPP和TEHP同样是生物体内含量较多的OPEs[33]。Bekele等[34]对我国莱州湾无脊椎动物采集并进行检测分析,结果显示OPEs浓度为21.1~2 840 ng·g-1 (以脂质质量计),主要以烷基类OPEs(如TEHP、TNBP等)为主。Zhang等[16]调查了中国北部湾海水养殖场中虾、蟹和贝类体内的OPEs,发现所有生物样品体内OPEs浓度范围为5.13~36.9 ng·g-1 (以湿质量计),且未发现物种之间的OPEs浓度具有显著性差异;此外,该研究发现,生物中OPEs的组成与该区域养殖池塘中水和沉积物中的结果类似,TCPP和TCEP同样是含量最高的OPEs。Ding等[35]对中国南海水生生物中OPEs进行了研究,浓度分别为:浮游植物(922±112) ng·g-1 (以干质量计)、浮游动物(660±246) ng·g-1 (以干质量计)、牡蛎(309±60) ng·g-1 (以干质量计)、蟹(225±19.6) ng·g-1 (以干质量计)、珊瑚(202±39.1) ng·g-1 (以干质量计)、鱼类(58.2±68.2) ng·g-1 (以干质量计),占比较高的几种OPEs为TCPP、TBOEP、TDCPP和TCEP。象山港是我国海水养殖历史悠久、水产资源丰富的区域之一,李雨琦等[36]测定了象山港鱼体内OPEs的含量,浓度范围为3.95~10.91 ng·g-1 (以湿质量计),检出浓度最高的为TPPO、TiBP和TCPP。Zhang等[37]对珠三角地区鱼类体内的OPEs进行了测定,浓度范围为未检出(ND)~6.41 ng·g-1 (以脂质质量计),主要以TNBP、TCEP和TCPP为主。太湖竺山湾和梅梁湾鱼类体内OPEs浓度分别为1.8~15.7 ng·g-1 (以湿质量计)和(9.8±6.2) ng·g-1 (以湿质量计),且竺山湾和梅梁湾鱼类均以TCPP、TPHP、TDCPP和TCEP为主[31, 33]。欧洲地中海鱼类样品体内OPEs含量为0.38~73.4 ng·g-1 (以湿质量计) [38];菲律宾马尼拉湾鱼体内OPEs的含量范围为110~1 900 ng·g-1 (以脂质质量计) [39]。在更高营养级的水生生物体内也发现了OPEs的存在,例如Aznar-Alemany等[40]在印度洋海豚肌肉组织中检测到了1 630~31 861 ng·g-1 (以脂质质量计)的OPEs,其中占比最高的为TBOEP (占比为(82±28)%);Garcia-Garin等[41]则在北大西洋的鲸鱼体内检测到浓度为31.9~10 232 ng·g-1 (以脂质质量计)的OPEs,占比最高的则为TNBP。
数据表明,不同地区、不同种类及营养级之间,生物体内OPEs含量和组成有所不同,其中,烷基类OPEs和氯代类OPEs仍是大部分生物体内含量较高的OPEs。相较于淡水水生生物,海洋水生生物体内的OPEs含量相对较高。然而,目前已有研究大多针对淡水生态系统,因此,有必要加强对海洋生物体内OPEs污染特征的研究。
1.4 有机磷酸酯在水生生物体内的富集及放大特征(Bioenrichment and bioamplification of OPEs in aquatic organisms)
1.4.1 有机磷酸酯的生物富集特征(Bioenrichment characteristics of OPEs)
OPEs在生物体内的大量检出,表明其可通过食物链或食物网传递,最终对生态系统和人类健康造成威胁。为了更直观地描述生物体对化合物的蓄积作用,研究人员引入了生物富集因子(BCF或BAF),其代表生物体与环境之间的浓度之比,当BCF或BAF>5 000(或logBCF/logBAF>3.7)时表明具有潜在的生物富集性[10, 42]。Wang等[43]对OPEs在典型水生生物体内富集的实验结果表明,7种OPEs (TCEP、磷酸三丙酯(TPP)、TNBP、TPHP、TDCPP、磷酸三对苯甲酯(TPCP))在成年斑马鱼(Danio rerio)体内的BCF值在低浓度(1/150 半数致死浓度(LC50))及高浓度(1/30 LC50)暴露下分别为0.7~364 L·kg-1 (以湿质量计)和0.5~291 L·kg-1 (以湿质量计),该结果表明,斑马鱼在低浓度暴露下的BCF高于高浓度暴露,且在logKOW与BCF值之间发现了较为显著的正向相关关系,OPEs的理化性质尤其是化合物的疏水性是决定其BCF的关键指标;此外,该研究还发现TPHP和TCP比其他几种OPEs的生物富集性更强。Arukwe等[44]以大西洋鲑鱼(Salmo salar)为对象,研究了TCEP和TBOEP在3个浓度梯度(0.04、0.2和1 mg·L-1)暴露下的生物富集效应,结果表明TBOEP的BCF值随浓度升高而增加,这与在斑马鱼中的结果相反[43];TCEP在3个浓度梯度下的BCF则分别为(0.31±0.06) L·kg-1 (以鲜质量计)、(0.16±0.03) L·kg-1 (以鲜质量计)和(0.34±0.04) L·kg-1 (以鲜质量计),在中等浓度暴露下的生物富集效应比低浓度和高浓度暴露下低。Wang等[43]和Tang等[45]通过对斑马鱼和鲤鱼(Cyprinus carpio)的暴露实验均发现脂质含量同样是决定有机污染物在生物体内富集的重要因素,然而亦有研究表明脂质含量与BCF并无显著的相关性[11],不同生物之间的生物转化和代谢使得其对有机污染物的BCF值也会有所不同[42]。生物体内不同组织对不同有机污染物的蓄积能力也有所不同;例如Wang等[43]对斑马鱼的研究发现,肝脏对OPEs具有较强的蓄积能力,主要以烷基类OPEs (TPP、TBOEP和TNBP)及TCEP为主,而肌肉则对TDCPP具有较强的蓄积能力;然而,Tang等[45]对鲤鱼体内OPEs生物富集的研究指出,鲤鱼体内除血清外的各组织对OPEs的蓄积能力并无明显差异。除室内暴露实验外,研究人员还通过野外实验对不同养殖区的水生生物样品体内OPEs的蓄积状况进行了研究。Choo等[46]采集了韩国洛东江中的鲫鱼(Carassius auratus)样品,发现OPEs在鲫鱼体内的BCF为16 000~18 300 L·kg-1 (以湿质量计),且肝脏组织对TEP、TNBP、TCPP及TDCPP的蓄积能力要强于肌肉、性腺等组织。Bekele等[34]研究了我国莱州湾水生生物对OPEs的富集作用,结果表明,莱州湾无脊椎动物和鱼类体内OPEs的logBAF分别为2.4~2.9和2.5~3.5,沉积物富集因子(logBSAF)则分别为0.1~0.5和0.3~0.7;此外,该研究还在logBAF与logKOW之间发现了显著性的相关关系,这与室内暴露实验结果相似,而logBSAF与logKOW的相关关系则呈现出先上升后下降的趋势,表明中等疏水性的OPEs在底栖动物体内更容易富集。同时,我国南海食物网中OPEs的logBAF的范围为3.06~4.26,表明疏水性是决定生物富集的重要因素[35]。室内暴露实验以及野外实验均表明OPEs具有生物富集性,不同OPEs和生物以及各组织间的富集性均有差异,且富集性受环境浓度、脂质含量、疏水性、代谢及转化等多种因素的影响。然而目前关于OPEs在生物体内的富集机制尚未明确,因此,亟待加强关于生物富集,尤其是在海洋及复杂生态系统中的OPEs富集特征相关研究。
1.4.2 有机磷酸酯的生物放大效应(Bioamplification of OPEs)
生物放大效应是指有机污染物在生物体内积累并传递至更高营养级的潜在能力,常用生物放大因子(TMF)来表示[47]。Zhao等[31]对OPEs在我国太湖梅梁湾食物网中(浮游生物、无脊椎动物和鱼类)的营养传递进行了调查研究,9种OPEs (TEP、TCEP、TCPP、TiBP、TDCPP、TNBP、TPHP和磷酸三甲苯酯(TCP))的浓度随营养级的增加均表现出了营养稀释效应,但具有统计学意义的只有TCPP (P=0.022, TMF=0.55)、TDCPP (P=0.029, TMF=0.39)和TCP(P=0.021, TMF=0.42),表明疏水性强的化合物具有随营养级增加而稀释的趋势。Wang等[33]对我国太湖食物网中OPEs的传递进行了研究,发现仅有磷酸三(2-乙基己基)二苯基酯(EHDPP)在太湖竺山湾食物网中具有生物放大效应(P<0.05, TMF=3.61),这可能是由于EHDPP在高营养级鱼类体内难以代谢以及其自身具有较高疏水性的原因。此外,竺山湾生物体中的氯代类OPEs并未表现出显著的生物放大效应,化合物性质、生物的生活习性,以及体内的生物转化等因素均可能对生物放大效应造成影响。Liu等[48]在华南地区一个由无脊椎动物和鱼类构成的淡水食物网中研究了OPEs的生物放大效应,结果显示TNBP (TMF=0.57)和TPHP (TMF=0.62)同样表现出了营养稀释效应。Brandsma等[30]报道了OPEs在荷兰斯凯尔特河河口底栖食物网、中上层食物网以及总食物网(底栖食物网和中上层食物网)中的传递,只有TCEP (P<0.05, TMF=2.6)、TCPP (P<0.05, TMF=2.2)和TBOEP (P<0.05, TMF=3.5)在底栖食物网中观察到了生物放大效应,在其他OPEs及食物网中并未发现较为显著的生物放大效应。研究人员分析了我国南海底栖食物网、中上层食物网以及总食物网(底栖食物网和中上层食物网)中OPEs的传递,在3种食物网中,TCEP、TCPP、TDCPP、TNBP均表现出了营养稀释效应(P<0.05, TMF<1);磷酸三戊酯(TPTP) (P<0.05, TMF=1.7)则在底栖食物网中产生了生物放大作用,这可能是由于其在浮游生物和珊瑚体内的生物转化能力较差;此外,该研究还发现地理位置同样也会对生物放大效应有影响,热带食物网中OPEs的生物放大效应普遍低于温带和寒带[35]。Bekele等[34]对我国莱州湾食物网中OPEs传递的研究发现,OPEs的TMF范围为1.06~2.52,烷基类、氯代类和芳基类OPEs的TMF分别为1.06~2.52、1.17~1.84和1.75~2.03,且发现疏水性强的OPEs其TMF也普遍较高,这与太湖的研究结果相似[31]。Kim等[39]对OPEs在菲律宾马尼拉湾食物网中的传递进行了研究,虽然并没有具体计算TMF值,但其研究结果依旧可以表明TPHP在该食物网中产生了生物放大效应。Fu等[32]的对南极食物网的研究表明TCEP、TCPP和TPHP具有生物放大效应,TMF分别为5.20、2.92和2.74。
综上所述,OPEs在淡水和海洋食物网中均表现出了生物放大效应,表明其可以随食物链或者食物网传递,且其生物放大特性大多与其自身疏水性有关。然而目前关于OPEs在海洋和淡水食物网传递的研究仍较少,其生物放大机制仍不够明确,且有些OPEs的生物放大效应在不同水环境、食物网中的结果截然不同。因此后续应开展更为系统的实验,并考虑多重因素对生物放大效应的影响,例如总有机碳含量(TOC)、地理位置、污染水平和水体自身净化等环境因素,以及OPEs在生物的脂质含量、生化反应、生物代谢等。
2 有机磷酸酯在水环境中的迁移转化行为(Metabolic transformation behavior of OPEs)
2.1 水/光降解(Hydrolysis and photolysis)
OPEs的毒理学数据表明其会对环境和生物造成不同程度的威胁,因此近年来关于OPEs的迁移转化也得到了广泛的研究,目前比较有代表性的降解方式为水解、光解以及生物降解[49]。表3总结了OPEs在不同条件下的降解半衰期信息。
表3 OPEs的降解半衰期
Table 3 Half-life of degradation information for OPEs
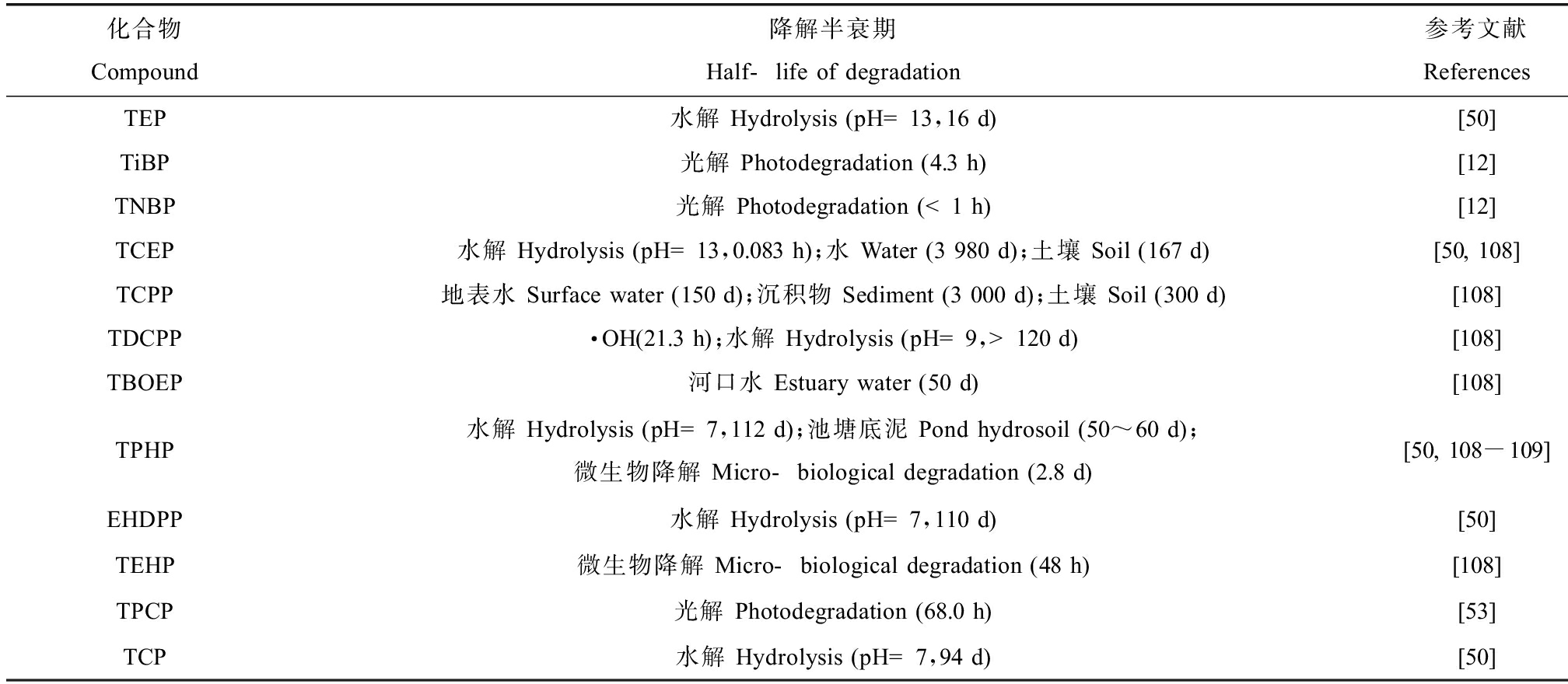
化合物Compound降解半衰期Half-life of degradation参考文献ReferencesTEP水解 Hydrolysis (pH=13,16 d)[50]TiBP光解 Photodegradation (4.3 h)[12]TNBP光解 Photodegradation (<1 h)[12]TCEP水解 Hydrolysis (pH=13,0.083 h);水 Water (3 980 d);土壤 Soil (167 d)[50, 108]TCPP地表水 Surface water (150 d);沉积物 Sediment (3 000 d);土壤 Soil (300 d)[108]TDCPP·OH(21.3 h);水解 Hydrolysis (pH=9,>120 d)[108]TBOEP河口水 Estuary water (50 d)[108]TPHP水解 Hydrolysis (pH=7,112 d);池塘底泥 Pond hydrosoil (50~60 d);微生物降解 Micro-biological degradation (2.8 d)[50, 108-109]EHDPP水解 Hydrolysis (pH=7,110 d)[50]TEHP微生物降解 Micro-biological degradation (48 h)[108]TPCP光解 Photodegradation (68.0 h)[53]TCP水解 Hydrolysis (pH=7,94 d)[50]
Su等[50]对16种OPEs在不同pH下的水解及降解动力学进行了研究,结果表明当pH为7、9和11时,大部分OPEs都未得到明显的降解,而当pH=13时,除TNBP和TEHP外的大多数OPEs均产生了水解反应,降解动力学实验结果表明烷基类OPEs最稳定,其次为氯代类OPEs,最后为芳基类OPEs。此外,当pH=13时,氯代类OPEs如TCPP、TDCPP和TCEP均得到水解,半衰期分别为11、0.44和0.083 d,降解速率要高于烷基类OPEs和芳基类OPEs;而对于芳基类OPEs而言,实验结果表明随着碳原子数量的增加,其水解速率会相应减慢。Fang等[51]对包括TDCPP、TCEP、TCPP和TEP在内的多种OPEs在pH和金属氧化物催化条件下的水解情况,结果显示在pH为中性时,大多数OPEs的水解速率缓慢,但在金属氧化物的催化下可使得半衰期缩短为不到10 d。此外,随着pH的升高,OPEs的水解速率也相应加快,这与Su等[50]的研究结果相似。光降解是水环境中有机污染物的重要转化方式,近年来备受研究人员的瞩目。Cristale等[52]对9种OPEs在河水和腐殖质中的光降解现象进行了研究,发现OPEs在光照下显现出光敏特性,光敏化作用产生的活性氧化物促进其光解作用;腐殖质会降低OPEs的光解效率,而水体中的无机成分则会加速OPEs的光解。此外,研究发现芳基OPEs的光解效率要高于烷基类OPEs和氯代类OPEs,在长期暴露下除TCEP外的大多数OPEs的光解效果均较为显著。Sun等[53]探究了Fe3+、NO2-和腐殖质对TPCP光解的影响,研究结果表明TPCP具有较为显著的光解现象,其半衰期为8.75 h。此外,实验结果表明Fe3+、NO2-对TPCP的光解具有促进作用,而腐殖质抑制了TPCP的光解,这与Cristale等[52]的研究结果相似。艾锐等[54]以TDCPP为对象,研究了紫外光光强、反应时间以及H2O2浓度对其光解的影响,结果表明紫外光光强对TDCPP的光解影响最大,且发现取代基越多、含氯原子个数越多的OPEs光解速率越慢。
OPEs的水解和光解研究表明其在自然条件下能够发生降解,但降解时间较长,速率较慢,无法应用于实际,且对于海水养殖环境而言,养殖活动使得水体中富含大量的腐殖质,极有可能影响到OPEs在养殖水环境的降解。
2.2 微生物降解(Microbial degradation)
由于污染物的微生物降解产生的二次污染较小,近年来备受关注。目前关于氯代类OPEs的微生物降解的研究主要由日本学者Takahashi的团队完成,该团队以TCEP或TDCPP作为唯一磷原子,成功富集得到了可以降解氯代类OPEs的混合菌种并于2008年进行了首次报道,该团队随后通过实验将菌种鉴定为TCM1和TDK1[55-56]。由于TCEP和TDCPP被TCM1和TDK1降解后的产物仍具有毒性,又筛选出了Xanthobacter autotrophicus strain GJ10和Arthrobacter sp. strain PY1 2种菌株,利用其与TCM1和TDK1的协同作用降低降解过程中产生的毒副产物[57-58]。
目前有关于非氯代类OPEs微生物降解的研究主要聚焦于TNBP和TPHP等OPEs。例如,Berne等[59]在被TNBP污染土壤中成功分离出了Serratia odorifera菌株,该菌株在生长阶段的8 h内能够将TNBP从2 mmol·L-1降解至0.6 mmol·L-1;此外,该实验结果表明该菌株的生长温度为4~37 ℃。Kulkarni等[60]同样在受污染的土壤中成功分离到了可用于TNBP降解的Klebsiella pneumoniae S3菌株,该菌株能够在48 h内将浓度为的TNBP (1 000 mg·L-1)降解为磷酸二丁酯(DNBP)。虽然Serratia odorifera和Klebsiella pneumoniae S3菌株不能利用TNBP作为其生长的唯一磷源或碳源,但仍可考虑将其作为土壤或者养殖水环境沉积物中TNBP降解菌株的备选。Wei等[61]研究了Brevibacillus brevis菌株对水体中TPHP的降解作用,结果表明投菌量、温度和pH对该菌株对TPHP的降解效率有影响,当投菌量为2 g·L-1,温度为30 ℃,pH=7时,降解率可达92.1%且降解产物的毒性较低。因此,该菌株可用于污染水体中TPHP的降解的备选菌株。此外,Vila-Costa等[62]发现海水中的Flavobacteria等菌株可以有效降解水体中的OPEs,该发现对OPEs在海水中的降解具有重要意义。
2.3 生物代谢(Biological metabolism)
探究有机污染物在生物体内的代谢和转化可以有助于研究人员了解其在生物体的命运和潜在毒性。Wang等[63]探究了TPHP在成年斑马鱼(Danio rerio)大脑、鳃、肠道、肝脏和肌肉组织中的代谢和转化,结果表明磷酸二苯酯(DPHP)在肝脏和肠道中的含量最高,是其母体TPHP的3.0倍~3.5倍。研究人员在对TNBP、TDCPP和TPHP在斑马鱼(Danio rerio)体内的代谢和转化的研究中发现,OPEs在斑马鱼体内可通过酯键断裂(或水解)、醚键断裂、氧化羟基化、脱氯以及与葡萄糖酸偶联等途径被转化,3种OPEs的代谢产物(DNBP、磷酸二(1,3-二氯-2-丙基)酯(BDCPP)和DPHP)主要分布于肝脏和肠道中,表明消化系统是OPEs在斑马鱼体内的代谢和转化的重要场所;该研究表明斑马鱼可以通过鳃将代谢产物排除体外,以此证明OPEs的代谢产物不会在鱼体内长期积累,然而与此同时带来的是水中磷酸二酯类代谢产物浓度的升高[43]。Tang等[45]对OPEs在鲤鱼(Cyprinus carpio)体内的代谢和转化进行了研究,同样在肝脏和肠道中发现的代谢产物的浓度高于鳃、肌肉等组织。Hou等[64]的一项研究发现,鲫鱼(Carassius auratus)和泥鳅(Misgurnus anguillicaudatus)肝脏是OPEs代谢产物浓度最高的组织,并且发现肾脏可能会通过代谢作用将代谢产物从体内排出。Su等[65]发现OPEs在鸡肝细胞中被代谢转化为DPHP、羟基化TPHP以及二羟基化TPHP异构体;Sasaki等[66]在对TNBP在大鼠肝粒细胞中的代谢转化进行了研究,发现TNBP会被氧化为羟基化TNBP,并进一步转化为二羟基化TNBP或DNBP;Van den Eede等[67]对OPEs在人体肝脏中的代谢进行了研究,结果表明TPHP、TBOEP、TCPP和TDCPP均通过氧化作用形成了多种代谢产物。以上研究表明OPEs在生物体内存在代谢和转化行为,然而目前的研究大多是针对于个别OPEs在体内组织尤其是几种重要组织中的研究,且有关于代谢产物对生态系统以及生物体的毒副作用研究较少,因此相关研究仍值得进行。
3 有机磷酸酯对水生生物的毒性效应(Toxic effects of OPEs on aquatic organisms)
3.1 有机磷酸酯对浮游生物的毒性效应(Toxic effects of OPEs on plankton)
随着OPEs在环境及生物体中检出的报道增多,关于OPEs毒理信息的研究也逐渐成为了研究人员关注的焦点。对于水生生态系统而言,其毒性效应的研究对象主要是以于浮游生物、鱼类以及底栖动物为主。表4总结了OPEs对不同生物体的毒性效应。
表4 OPEs的毒性效应研究总结
Table 4 Summary of toxicity effects of OPE

化合物Compound研究物种及毒性效应Biological and toxic effectsTEP基因毒性与致突变性 Genetic toxicity and mutagenicity:大肠杆菌(Escherichia coli)[110]、人胚胎肝L02细胞(Human embryo liver L02 cell)[111]TNBP急性毒性 Acute toxicity:青海弧菌Q67(Vibrio qinghaiensis sp.-Q67)[112]、大型溞(Daphnia magna)[113];基因毒性与致突变性 Genetic toxicity and mutagenicity:大肠杆菌(Escherichia coli)[110]、人胚胎肝L02细胞(Human embryo liver L02 cell)[111];内分泌干扰性 Endocrine disrupting:三角褐指藻(Phaeodactylum tricornutum)[71]TCEP急性毒性 Acute toxicity:大型溞(Daphnia magna)[113];神经毒性 Neurotoxicity:斑马鱼(Danio rerio)[114]、小鼠(Mice)[115];基因毒性与致突变性 Genetic toxicity and mutagenicity:A549细胞(A549 cell)[116];生殖与发育毒性 Reproductive and developmental toxicity:斑马鱼(Danio rerio)[114];内分泌干扰性 Endocrine disrupting:斑马鱼(Danio rerio)[117]TCPP急性毒性 Acute toxicity:大型溞(Daphnia magna)[113]、斑马鱼(Danio rerio)[77];神经毒性 Neurotoxicity:斑马鱼(Danio rerio)[114];基因毒性与致突变性 Genetic toxicity and mutagenicity:HepG2/C3A细胞(HepG2/C3A cell)[118];内分泌干扰性 Endocrine disrupting:斑马鱼(Danio rerio)[117]TDCPP急性毒性 Acute toxicity:大型溞(Daphnia magna)[113]、斑马鱼(Danio rerio)[119];生殖与发育毒性 Reproductive and developmental toxicity:斑马鱼(Danio rerio)[120]、斜生栅藻(Scenedesmus obliquus)[70];神经毒性 Neurotoxicity:中国稀有鮈鲫(Gobiocypris rarus)[121]、斑马鱼(Danio rerio)[122]、贻贝(Mytilus galloprovincialis)[84];脏器毒性 Viscera toxicity:中国稀有鮈鲫(Gobiocypris rarus)[123];基因毒性与致突变性 Genetic toxicity and mutagenicity:斑马鱼(Danio rerio)[124];内分泌干扰性 Endocrine disrupting:斑马鱼(Danio rerio)[125]、人类(Human)[126]TBOEP生殖与发育毒性 Reproductive and developmental toxicity:斑马鱼(Danio rerio)[127]、大型溞(Daphnia magna)[128];脏器毒性 Viscera toxicity:中国稀有鮈鲫(Gobiocypris rarus)[123];基因毒性与致突变性 Genetic toxicity and mutagenicity:中国稀有鮈鲫(Gobiocypris rarus)[129];内分泌干扰性 Endocrine disrupting:大型溞(Daphnia magna)[74]TPHP急性毒性 Acute toxicity:青海弧菌Q67(Vibrio qinghaiensis sp.-Q67)[112]、大型溞(Daphnia magna)[113, 130];生殖与发育毒性 Reproductive and developmental toxicity:大型溞(Daphnia magna)[76];神经毒性 Neurotoxicity:斑马鱼(Danio rerio)[114];脏器毒性 Viscera toxicity:斑马鱼(Danio rerio)[123]、中国稀有鮈鲫(Gobiocypris rarus)[123];基因毒性与致突变性 Genetic toxicity and mutagenicity:斑马鱼(Danio rerio)[131];内分泌干扰性 Endocrine disrupting:大型溞(Daphnia magna)[128]、小球藻(Chlorella vulgaris)[68]EHDPP急性毒性 Acute toxicity:大型溞(Daphnia magna)[113];生殖与发育毒性 Reproductive and developmental toxicity:斑马鱼(Danio rerio)[123];内分泌干扰性 Endocrine disrupting:中国稀有鮈鲫(Gobiocypris rarus)[132]TEHP急性毒性 Acute toxicity:大型溞(Daphnia magna)[113]TOCP神经毒性 Neurotoxicity:母鸡(Hen)[133]TiPPP脏器毒性 Viscera toxicity:斑马鱼(Danio rerio)[134]
Wang等[68]探究了TPHP对小球藻(Chlorella vulgaris)和斜生栅藻(Scenedesmus obliquus)的毒性效应,发现TPHP对小球藻和斜生栅藻的生长过程均产生了抑制作用,小球藻的生长趋势在第5天时恢复正常,而斜生栅藻则仅在THPH浓度为10 mg·L-1时受到了显著的抑制作用。Liu等[69]和Wang等[70]分别研究了TDCPP对三角褐指藻(Phaeodactylum tricornutum)和斜生栅藻(Scenedesmus obliquus)的毒性效应,表明当TDCPP浓度范围为2~10 mg·L-1时会显著抑制三角褐指藻和斜生栅藻的生长,且随着TDCPP浓度的升高,抑制效应更加明显。此外,研究发现三角褐指藻暴露于TDCPP的96 h-半数有效浓度(EC50)为3.71 mg·L-1;当暴露于4 mg·L-1时,TDCPP会抑制光合作用从而导致体内活性氧化物(ROS)的增加,进而导致脂质过氧化能力增强并且产生膜破坏作用,最终造成三角褐指藻的死亡[69]。在另一项研究中,研究人员通过暴露实验得到三角褐指藻暴露于TNBP的72 h-EC50为0.219 mg·L-1,毒性略高于TDCPP[71];此外,该研究还证实ROS同样是导致三角褐指藻生长遭受抑制以及个体死亡的主要原因[71-72]。大型溞(Daphnia magna)作为一类标准的模式生物,常用来评价有机污染物对甲壳类生物的毒性效应。不同OPEs对大型溞表现出的急性毒效应也有所不同,如作为氯代类OPEs的TCPP的24 h-EC50为186~1 000 mg·L-1,而同为氯代类OPEs的TDCPP的24 h-EC50则为3.8~4.6 mg·L-1,远低于TCPP;TNBP(烷基类OPEs)的24 h-EC50则为5.8~35 mg·L-1[73]。暴露时间的长短也会影响OPEs对大型溞的急性毒性效应,例如,TNBP的6 h-EC50为52~93 mg·L-1,24 h-EC50则为2.8~35 mg·L-1[73];TBOEP的24 h-LC50为84 mg·L-1,48 h-LC50则为75 mg·L-1[74],这表明OPEs的毒性效应会随暴露时间的增加而变大。Yuan等[75]探究了TPHP对大型溞的急性毒性、生长毒性以及生殖毒性,发现大型溞暴露于TPHP的48 h-LC50为3.19 mg·L-1;此外,TPHP还影响了大型溞体内与生长发育相关的多个基因的表达从而对大型溞产生了发育毒性以及生殖毒性。Li等[76]发现当暴露于浓度为(6.5±1.4) mg·L-1的TDCPP时,大型溞体内的29个基因表达在第28天时显著被抑制,表明TDCPP对大型溞的生长及繁殖造成了影响。Giraudo等[74]研究了TBOEP对大型溞的毒性效应,发现当暴露浓度为0.01 mg·L-1且暴露时长为21 d时,TBOEP会诱导大型溞产生氧化应激反应并对内分泌造成干扰。此外,该研究还发现TBOEP对大型溞的毒性效应还会对其后代有影响,例如参与生殖和发育的卵黄原蛋白(vtg1和vtg2)、蜕皮激素受体(ecr)、激素核受体(hr3)以及血红蛋白编码(dhb2)基因在F1和F2代中的表达均显著低于F0代,这表明TBOEP对大型溞产生了发育及生殖毒性[74]。
综合来看,OPEs会对藻类、大型溞等浮游生物产生急性毒性、内分泌干扰、发育及生殖等毒性,长期暴露可能会对生态系统造成不利影响。目前,有关于OPEs对浮游生物的毒性研究仍然较少,尤其是多种化合物对浮游生物的联合毒性效应,以及OPEs对其他藻类及动物的毒性信息,且毒性效应的相关机制仍不够清晰。因此,需要通过更全面和完善的实验,才能使研究人员更清晰地了解OPEs对浮游生物的毒性效应,以保障生态系统的健康。
3.2 有机磷酸酯对鱼类的毒性效应(Toxic effects of OPEs on fish)
鱼类作为人类消费量最多的水生生物,近年来有关于OPEs对其产成的毒性效应也得到了大量的研究。不同种类的OPEs对不同鱼类造成的急性毒效应有所不同,例如对于TPCP而言,虹鳟鱼(Oncorhynchus mykiss)的96 h-LC50为0.26~0.75 mg·L-1,青鳉鱼(Oryzias latipes)的96 h-LC50为4.9~6.7 mg·L-1;美洲原银汉鱼(Menidia beryllina)的96 h-LC50则为8 700 mg·L-1[73],美洲原银汉鱼和虹鳟鱼的96 h-LC50值相差了4个数量级,表明同一种OPEs对不同种类的生物造成的毒性具有较大的差异。斑马鱼(Danio rerio)作为国际公认的标准实验生物,其受不同种类OPEs的毒性效应同样受到了研究人员的关注,皮天星等[77]在对TCPP对斑马鱼的毒性研究中发现TCPP对斑马鱼成鱼和胚胎均具有毒性,其成鱼的96 h-LC50为47.06 mg·L-1,对胚胎的96 h-LC50仅为26.01 mg·L-1,该结果显示斑马鱼胚胎受TCPP的影响更大。此外,其他关于OPEs对斑马鱼毒性效应的几项研究表明,TNBP的96 h-LC50为11.4 mg·L-1;TDCPP的96 h-LC50为2.32~13.13 mg·L-1;TPCP的96 h-LC50为>1.0 mg·L-1[73],该数据说明不同种类OPEs对斑马鱼造成的毒性也具有一定差别。
Wang等[78]在TDCPP对斑马鱼(Danio rerio)的甲状腺内分泌和神经毒性的研究中发现,当F0代雌性斑马鱼和F1代斑马鱼分别长期暴露于浓度为0.02 mg·L-1和0.1 mg·L-1的TDCPP下,其甲状腺素分泌水平会显著降低,表明TDCPP会对鱼类的甲状腺内分泌产生干扰作用;此外,TDCPP还会对斑马鱼的多巴胺分泌具有抑制作用从而对鱼类产生神经毒性。Zhang等[79]通过研究TDCPP对鲫鱼(Carassius auratus)生长发育的影响发现,当暴露在0.005 mg·L-1或者0.05 mg·L-1的生长环境时,TDCPP会显著抑制鲫鱼体内生长激素、生长激素受体的产生以及生长因子的表达;分子对接、双荧光素酶报告基因检测实验以及体外实验的结果表明TDCPP会与生长激素释放激素受体蛋白结合,干扰生长激素释放激素对生长激素表达的刺激,导致垂体细胞中信使核糖核酸(mRNA)的水平降低从而抑制鲫鱼的生长发育。Li等[80]报道了磷酸三苯基酯(TPHP)对日本青鳉鱼(Oryzias latipes)性腺发育和生殖行为的影响,在TPHP (浓度为1.43 mg·L-1)暴露下,TPHP会对雄鱼体内的内源性雄性激素的分泌水平产生抑制作用并阻断雄激素受体的结合,从而对青鳉鱼的性腺发育造成影响,使得雄鱼具有变为双性别的危险。此外,实验表明TPHP还使得雄鱼体内17β-雌二醇(17β-E2)分泌增多从而降低青鳉鱼的交配次数和成功率,可能会威胁到野生鱼类的种群稳定性[80]。Hong等[81]研究了TPHP对稀有鮈鲫(Gobiocypris rarus)产生的神经毒性影响,发现当TPHP的暴露浓度为0.1 mg·L-1时,TPHP会促进鮈鲫体内炎症细胞因子的表达从而诱导血脑屏障(BBB)渗透压的增加,进而抑制Claudin-5a和Occludin的基因表达水平;长期暴露也使得鮈鲫脑部的神经元中的树突树枝状化水平显著降低,这将会直接影响到鮈鲫的学习和记忆能力。
总体来讲,不同化合物对不同鱼类造成的毒性效应存在显著的差异。目前,有关于OPEs对鱼类的毒性效应主要集中于氯代类OPEs (TDCPP、TCPP和TCEP)以及烷基类OPEs (如TNBP)等,且研究对象的种类也较少。OPEs的理化性质、生物发育程度、实验暴露浓度以及生物体内的代谢和转化等因素均可能对生物产生不同的毒性效应。在后续开展实验时应考虑以上因素对毒性效应的影响,并对毒性效应的机制开展更为系统的研究。
3.3 有机磷酸酯对底栖动物的毒性效应(Toxic effects of OPEs on zoobenthos)
数据表明沉积物中有机污染物会高于水体中,且化学组成更为复杂[82],因此可能会对底栖动物造成更大的威胁。然而,目前有关于OPEs对底栖动物的毒性研究却相对较少。贻贝(Mytilus galloprovincialis)是海洋环境污染监测中常用的模式生物[83],Sánchez-Marín等[84]探究了TDCPP对贻贝的毒性效应,虽然TDCPP在贻贝体内很快就会被代谢和排出,但在长期暴露下仍会对贻贝产生毒性效应。当暴露浓度为0.01 mg·L-1,第7天时观察到贻贝体内与神经递质分泌相关的乙酰胆碱酯酶(AchE)和受体型酪氨酸蛋白磷酸酶N2 (PTPRN2)显著降低,这表明TDCPP对贻贝产生了神经毒性[84]。关于TCPP对贻贝毒性效应的一项研究指出,在10 nmol·L-1和10 nmol·L-1浓度的暴露下均使得贻贝体内ROS的生成能力显著增强从而诱发了氧化应激反应,进而加快了细胞的死亡速度,且发现毒性效应随着暴露浓度的升高而增强;此外,贻贝血细胞中G型溶菌酶(GLYZ)和C型溶菌酶(GLYZ)基因表达水平的降低表明TCPP在2种暴露浓度下均对贻贝的免疫系统造成了破坏[85]。Li等[86]研究了TDCPP及其代谢产物BDCPP对亚洲淡水蛤(Corbicula fluminea)的毒性效应,发现生物体内的Ⅰ期和Ⅱ期生物转化和多异种抗性系统被TDCPP和BDCPP激活从而对生物体产生保护,然而在代谢过程中体内产生了大量的ROS,造成体内细胞的大量凋亡;相比于BDCPP,TDCPP对生物体的毒性效应更强。以上数据证明了氯代类OPEs对底栖动物的毒性效应,而非氯代类OPEs同样被证明对底栖动物具有一定影响。近期一项关于非氯代类OPEs对亚洲淡水蛤毒性效应的研究表明TBOEP和TNBP均对生物体具有一定影响[87]。其具体表现为:成年亚洲淡水蛤暴露于0.02、0.2和2 mg·L-1 OPEs,暴露时长为28 d时,TBOEP和TNBP触发了亚洲淡水蛤对外源物质的防御系统从而导致其虹吸效应的降低,虽然降低趋势并不显著,但仍有可能对生物体造成影响;此外,该研究还发现TBOEP和TNBP会造成亚洲淡水蛤的氧化应激反应,并能够激活生物体的多异种抗性系统[87]。Yan等[88]研究了TNBP和TDCPP对亚洲淡水蛤的毒性效应,分别于0.02、0.2和2 mg·L-1下暴露30 d,发现在浓度为2 mg·L-1时,TNBP和TDCPP均造成了生物体的细胞死亡并引起基因毒性且发现毒性效应与暴露浓度呈正相关;此外,该研究的结果显示在相同浓度的暴露下,氯代类OPEs的毒性效应要远高于非氯代类OPEs。
以上研究及数据表明OPEs对水生生物的存在某些毒性效应,例如急性毒性[73]、内分泌干扰性[89]、神经毒性[81]和生殖与发育毒性[79]等。然而,目前的研究大多只针围绕于某些OPEs开展,例如TCPP、TDCPP、TNBP以及TBOEP等,且实验生物、暴露浓度以及实验条件等不够统一,实验系统性不够完善,这可能会导致数据之间的存在较大差异。此外,考虑到生态环境的复杂性以及生物物种的多样性,不同的生物可能会生存于不同的环境中,且生物对有机污染物的蓄积和代谢能力也有所不同,还可能会受到多种OPEs及其代谢产物以及其他污染物的联合毒性、加和效应和协同效应[90],因此有必要围绕OPEs对生物的毒性效应开展更为深入和系统的研究,以保障生态环境的健康和水生生物的安全。
4 有机磷酸酯在近岸海洋生态系统的风险评估研究现状(Risk assessment of OPEs in coastal marine ecosystems)
4.1 生态风险评估(Ecological risk assessment)
OPEs作为溴代阻燃剂的替代品,一直以高效、环保和低毒性的特性被人们熟知,关于其生态毒性的研究报道也相对较少,然而随着OPEs在越来越多的环境和生物体中被检测到,它的毒性也慢慢被研究和发现。有研究表明OPEs具有神经毒性、致癌性、致畸性、生殖毒性、基因毒性和内分泌干扰等毒性效应[2]。此外,由于OPEs极易渗透到周围的环境中且在自然条件下难以降解[1],可长期存在于环境中,长期接触或者暴露在较高浓度OPEs的环境下,可能会对环境、生物体和人体健康造成不可估量的影响。
生态风险评估主要是利用生态环境学以及毒理学来评价污染物对生态环境的危害[91],通过生态风险评估,可以直观有效地了解到环境中受有害污染的影响程度以及对环境内生物群的危害,更好为生态环境的保护、开发和利用提供科学有力的支持。目前对于OPEs的风险评估主要运用的是风险商(risk quotient, RQ)法,且该方法已经运用到邻苯二甲酸酯(PAEs)、多环芳烃(PAHs)、有机氯(OCPs)以及多氯联苯(PCBs)等有机污染物的生态风险评估中。Chen等[24]评估了OPEs对渤海海水在中等和高等暴露情形下的生态风险,结果显示在中等和高等暴露下TCEP、TCPP和TBOEP等大多数OPEs的生态风险均较低(RQ<0.1),而TPHP和EHDPP则表现出了中等风险(0.1

图2 水环境中OPEs的生态风险
注:(a) 北京城市地表水,(b) 梅梁湾,(c) 南海,(d) 黄河口,(e) 珠江三角洲,(f) 渤海和黄海,(g) 钦州湾,(h) 杭州湾,(i) 象山港,(j) 渤海,(k) 东海和黄海,(l) 胶州湾,(m) 北冰洋(加拿大境内区域),(n) 北大西洋和北极,(o) 旧金山湾,(p) 东京湾。
Fig. 2 Ecological risks of OPEs in aquatic environments
Note: (a) Urban surface water in Beijing, (b) Meiliang Bay, (c) South China Sea, (d) Yellow River Estuary, (e) Pearl River Delta, (f) Bohai Sea and Yellow Sea, (g) Qinzhou Bay, (h) Hangzhou Bay, (i) Xiangshan Bay, (j) Bohai Sea, (k) East China Sea and Yellow Sea, (l) Jiaozhou Bay, (m) Arctic Ocean (area in Canada), (n) the North Atlantic and Arctic, (o) San Francisco Bay, (p) Tokyo Bay.
4.2 人体健康风险(Health risk)
OPEs在水、沉积物、灰尘、空气以及生物体不断地被检出,表明OPEs已经与人类的生活和身体健康的联系越来越密切,人类会通过皮肤接触、灰尘的吸入以及饮食暴露在这些污染中,长期暴露下可能会对人类健康造成不良的影响[12]。随着全球水产品消费量的增长,有关于水产品中OPEs给人类带来的健康问题也开始得到人们的重视,水产品中OPEs对人体产生的健康风险通常是通过日均摄入量(average daily dose, ADD)或者人体健康危险商(hazard quotients, HQ)模型来评价[10, 16]。Bekele等[95]从我国北方莱州湾采集了10种野生海洋鱼类,测定了鱼体内OPEs含量,并通过危险商模型估算出人类通过食用该区域野生海鱼的健康风险较低。Ding等[96]研究了中国东部某城市市场水产品中OPEs的赋存情况,并同时评估了OPEs对儿童和成人的健康风险,结果显示当地居民通过食用鱼产生的健康风险不大,表明该城市市场中的鱼类在食用方面是安全可靠的,然而对于儿童来说,风险却要高于成年人,因此尤其需要关注OPEs对于儿童的暴露情形。Zhao等[97]根据中国居民的食品消费市场,对市场上包括谷类、蔬菜类、水产品等在内的9个食品类别分别进行了OPEs的测定并对它们的食用健康风险进行了评价,发现人类通过水产品摄入OPEs的量(4.0%)远低于谷类(52.2%)和蔬菜类(11.7%),但是所有类别的食品都没有发现对人体健康的危害。Zhang等[16]从中国北部湾养殖场采集了南美白对虾(Litopenaenus vannamei)、拟穴青蟹(Scylla Paramamosain)和近江牡蛎(Crassostrea rivularis Gould)的样品,没有观测到这几个物种体内OPEs的食用风险。虽然就目前的研究结果来看,人类通过饮食摄入OPEs的风险较低,但是随着OPEs生产和使用量的增加,人类摄入OPEs的量预计也将会增加;此外,OPEs进入人体内后会产生代谢产物,其代谢产物给人体带来的健康风险也不容忽视,因此需要长期对OPEs可能会给人类带来的威胁进行跟踪调查和研究[10]。
5 总结(Summary and outlook)
作为现代工业不可或缺的一种重要产品,随着社会、工业和经济的发展,OPEs的大量应用使其在我们的生态环境中的残留量也随之增大,对我们的生态环境和健康已经造成了威胁。本文对我国近海养殖系统中水、沉积物以及生物体中OPEs的赋存状况、生物蓄积特征、迁移转化、生态风险和健康风险进行了梳理和分析。我国近海岸海水中OPEs的浓度虽然普遍低于其他国家和地区以及其他类型水体,但仍普遍存在OPEs的污染,且均以氯代类OPEs为主(如TDCPP、TCPP和TCEP);沉积物中OPEs同样也处于较低浓度水平,主要以TCEP和TPHP为主。对于生物而言,研究发现有些OPEs会在生物体内富集并随食物链传递,且富集和生物放大效应受多种因素的影响,例如疏水性、脂质含量、环境浓度等。尽管OPEs浓度较小,但由于其在环境中难以自然降解,且缺乏有效的降解途径,导致其残留周期较长,容易在环境中长期存在并富集,并对生态环境和生物产生毒性效应。因此,需要对其在环境和生物体内的赋存状况及风险进行持续关注。
虽然OPEs对生态环境以及人体健康并未表现出较大的风险,但是OPEs对环境尤其是海水养殖环境污染已经发展成为较为普遍的现象。目前有关我国和世界范围内近岸海洋生态系统中的OPEs已有大量报道,却仍然以较为基础的研究为主。作为一类重要的自然生态系统,海洋生态系统中生物种群丰富、环境更为复杂。因此,OPEs在生态环境中的行为也成为了研究的难点,而相关的研究内容也需要更加系统和深入,例如:(1)对我国典型的近海养殖环境中的OPEs进行更为系统的研究,了解OPEs在海水、沉积物、水生生物体内的赋存状况、季节变化以及迁移转化行为,并对近岸海域中OPEs的影响因素进行分析研究,如温度、pH等环境因素以及工业、养殖、航运等人类活动;(2)考虑到OPEs对环境和水生生物的影响,其对海洋生态系统中的毒性和风险仍然值得研究,然而目前有关于OPEs的毒理学数据仍然不足以对其在环境中造成的风险进行较为系统和完善的评价,因此需要更深入地研究OPEs的毒理信息,以保障生态环境和水生生物的安全;(3)OPEs通过食物网的富集及生物放大效应的研究较少,尤其是对于较为复杂的生态系统和食物网,相关作用机制也尚不明确,现阶段的研究无法对其获得清晰明确的理解,因此应考虑更多样本以及更为系统的实验来更好地了解其相关的机制,从而更科学地保障生态系统的健康;(4)受自然降解、微生物降解以及生物体内生化反应的作用,OPEs可能会在环境和生物体内被降解从而产生代谢产物,因此同样需要对环境及生物体内的OPEs代谢产物进行较为系统的研究,以弥补这一领域的不足。
[1] van der Veen I, de Boer J. Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis [J]. Chemosphere, 2012, 88(10): 1119-1153
[2] Chen M H, Ma W L. A review on the occurrence of organophosphate flame retardants in the aquatic environment in China and implications for risk assessment [J]. Science of the Total Environment, 2021, 783: 147064
[3] Li Y Y, Lin T, Hu L M, et al. Time trends of polybrominated diphenyl ethers in East China Seas: Response to the booming of PBDE pollution industry in China [J]. Environment International, 2016, 92-93: 507-514
[4] 张月. 国内外阻燃剂市场分析[J]. 精细与专用化学品, 2014, 22(8): 20-24
Zhang Y. Global market analysis of flame retardant [J]. Fine and Specialty Chemicals, 2014, 22(8): 20-24 (in Chinese)
[5] 欧育湘. 我国有机磷阻燃剂产业的分析与展望[J]. 化工进展, 2011, 30(1): 210-215
Ou Y X. Developments of organic phosphorus flame retardant industry in China [J]. Chemical Industry and Engineering Progress, 2011, 30(1): 210-215 (in Chinese)
[6] Bollmann U E, Möller A, Xie Z Y, et al. Occurrence and fate of organophosphorus flame retardants and plasticizers in coastal and marine surface waters [J]. Water Research, 2012, 46(2): 531-538
[7] Ali N, Ali L, Mehdi T, et al. Levels and profiles of organochlorines and flame retardants in car and house dust from Kuwait and Pakistan: Implication for human exposure via dust ingestion [J]. Environment International, 2013, 55: 62-70
[8] Giulivo M, Capri E, Kalogianni E, et al. Occurrence of halogenated and organophosphate flame retardants in sediment and fish samples from three European River Basins [J]. The Science of the Total Environment, 2017, 586: 782-791
[9] Möller A, Xie Z Y, Caba A, et al. Organophosphorus flame retardants and plasticizers in the atmosphere of the North Sea [J]. Environmental Pollution, 2011, 159(12): 3660-3665
[10] Pantelaki I, Voutsa D. Occurrence, analysis and risk assessment of organophosphate esters (OPEs) in biota: A review [J]. Marine Pollution Bulletin, 2020, 160: 111547
[11] Hou R, Xu Y P, Wang Z J. Review of OPFRs in animals and humans: Absorption, bioaccumulation, metabolism, and internal exposure research [J]. Chemosphere, 2016, 153: 78-90
[12] Wei G L, Li D Q, Zhuo M N, et al. Organophosphorus flame retardants and plasticizers: Sources, occurrence, toxicity and human exposure [J]. Environmental Pollution, 2015, 196: 29-46
[13] Dishaw L V, Powers C M, Ryde I T, et al. Is the PentaBDE replacement, tris (1, 3-dichloro-2-propyl) phosphate (TDCPP), a developmental neurotoxicant? Studies in PC12 cells [J]. Toxicology and Applied Pharmacology, 2011, 256(3): 281-289
[14] 刘艳芬, 张士华, 左明, 等. 东营市近海水产养殖现状及可持续利用对策[J]. 中国渔业经济, 2020, 38(5): 109-115
Liu Y F, Zhang S H, Zuo M, et al. Current situation and suggestions to sustainable development of the aquaculture shallow beach in Dongying City [J]. Chinese Fisheries Economics, 2020, 38(5): 109-115 (in Chinese)
[15] Zhang L, Lu L, Zhu W J, et al. Organophosphorus flame retardants (OPFRs) in the seawater and sediments of the Qinzhou Bay, Northern Beibu Gulf: Occurrence, distribution, and ecological risks [J]. Marine Pollution Bulletin, 2021, 168: 112368
[16] Zhang R J, Yu K F, Li A, et al. Occurrence, phase distribution, and bioaccumulation of organophosphate esters (OPEs) in mariculture farms of the Beibu Gulf, China: A health risk assessment through seafood consumption [J]. Environmental Pollution, 2020, 263(Pt B): 114426
[17] Wang R M, Tang J H, Xie Z Y, et al. Occurrence and spatial distribution of organophosphate ester flame retardants and plasticizers in 40 rivers draining into the Bohai Sea, North China [J]. Environmental Pollution, 2015, 198: 172-178
[18] Zhong M Y, Tang J H, Mi L J, et al. Occurrence and spatial distribution of organophosphorus flame retardants and plasticizers in the Bohai and Yellow Seas, China [J]. Marine Pollution Bulletin, 2017, 121(1-2): 331-338
[19] Lai N L S, Kwok K Y, Wang X H, et al. Assessment of organophosphorus flame retardants and plasticizers in aquatic environments of China (Pearl River Delta, South China Sea, Yellow River Estuary) and Japan (Tokyo Bay) [J]. Journal of Hazardous Materials, 2019, 371: 288-294
[20] Aznar-Alemany  , Aminot Y, Vilà-Cano J, et al. Halogenated and organophosphorus flame retardants in European aquaculture samples [J]. The Science of the Total Environment, 2018, 612: 492-500
, Aminot Y, Vilà-Cano J, et al. Halogenated and organophosphorus flame retardants in European aquaculture samples [J]. The Science of the Total Environment, 2018, 612: 492-500
[21] Liu Y H, Song N H, Guo R X, et al. Occurrence and partitioning behavior of organophosphate esters in surface water and sediment of a shallow Chinese freshwater lake (Taihu Lake): Implication for eco-toxicity risk [J]. Chemosphere, 2018, 202: 255-263
[22] Shi Y L, Gao L H, Li W H, et al. Occurrence, distribution and seasonal variation of organophosphate flame retardants and plasticizers in urban surface water in Beijing, China [J]. Environmental Pollution, 2016, 209: 1-10
[23] Sutton R, Chen D, Sun J, et al. Characterization of brominated, chlorinated, and phosphate flame retardants in San Francisco Bay, an urban estuary [J]. The Science of the Total Environment, 2019, 652: 212-223
[24] Chen M Q, Gan Z W, Qu B, et al. Temporal and seasonal variation and ecological risk evaluation of flame retardants in seawater and sediments from Bohai Bay near Tianjin, China during 2014 to 2017 [J]. Marine Pollution Bulletin, 2019, 146: 874-883
[25] Wang Y, Wu X W, Zhang Q N, et al. Organophosphate esters in sediment cores from coastal Laizhou Bay of the Bohai Sea, China [J]. The Science of the Total Environment, 2017, 607-608: 103-108
[26] Zeng X Y, Xu L, Liu J, et al. Occurrence and distribution of organophosphorus flame retardants/plasticizers and synthetic musks in sediments from source water in the Pearl River Delta, China [J]. Environmental Toxicology and Chemistry, 2018, 37(4): 975-982
[27] Wang X, Zhu Q Q, Yan X T, et al. A review of organophosphate flame retardants and plasticizers in the environment: Analysis, occurrence and risk assessment [J]. The Science of the Total Environment, 2020, 731: 139071
[28] Tan X X, Luo X J, Zheng X B, et al. Distribution of organophosphorus flame retardants in sediments from the Pearl River Delta in South China [J]. The Science of the Total Environment, 2016, 544: 77-84
[29] Ma Y X, Xie Z Y, Lohmann R, et al. Organophosphate ester flame retardants and plasticizers in ocean sediments from the North Pacific to the Arctic Ocean [J]. Environmental Science &Technology, 2017, 51(7): 3809-3815
[30] Brandsma S H, Leonards P E, Leslie H A, et al. Tracing organophosphorus and brominated flame retardants and plasticizers in an estuarine food web [J]. The Science of the Total Environment, 2015, 505: 22-31
[31] Zhao H Q, Zhao F R, Liu J X, et al. Trophic transfer of organophosphorus flame retardants in a lake food web [J]. Environmental Pollution, 2018, 242(Pt B): 1887-1893
[32] Fu J, Fu K H, Gao K, et al. Occurrence and trophic magnification of organophosphate esters in an Antarctic ecosystem: Insights into the shift from legacy to emerging pollutants [J]. Journal of Hazardous Materials, 2020, 396: 122742
[33] Wang X L, Zhong W J, Xiao B W, et al. Bioavailability and biomagnification of organophosphate esters in the food web of Taihu Lake, China: Impacts of chemical properties and metabolism [J]. Environment International, 2019, 125: 25-32
[34] Bekele T G, Zhao H X, Wang Q Z, et al. Bioaccumulation and trophic transfer of emerging organophosphate flame retardants in the marine food webs of Laizhou Bay, North China [J]. Environmental Science &Technology, 2019, 53(22): 13417-13426
[35] Ding Y, Han M W, Wu Z Q, et al. Bioaccumulation and trophic transfer of organophosphate esters in tropical marine food web, South China Sea [J]. Environment International, 2020, 143: 105919
[36] 李雨琦, 李玮, 张蓉蓉, 等. QuEChERS-气相色谱串联质谱法测定海水鱼体中有机磷阻燃剂[J]. 分析试验室, 2020, 39(8): 869-874
Li Y Q, Li W, Zhang R R, et al. Determination of organophosphorus flame retardants in marine fish by QuEChERS-gas chromatography tandem mass spectrometry [J]. Chinese Journal of Analysis Laboratory, 2020, 39(8): 869-874 (in Chinese)
[37] Zhang Y, Zheng X B, Wei L F, et al. The distribution and accumulation of phosphate flame retardants (PFRs) in water environment [J]. The Science of the Total Environment, 2018, 630: 164-170
[38] Sala B, Giménez J, Fernández-Arribas J, et al. Organophosphate ester plasticizers in edible fish from the Mediterranean Sea: Marine pollution and human exposure [J]. Environmental Pollution, 2022, 292(Pt B): 118377
[39] Kim J W, Isobe T, Chang K H, et al. Levels and distribution of organophosphorus flame retardants and plasticizers in fishes from Manila Bay, the Philippines [J]. Environmental Pollution, 2011, 159(12): 3653-3659
[40] Aznar-Alemany  , Sala B, Plön S, et al. Halogenated and organophosphorus flame retardants in cetaceans from the southwestern Indian Ocean [J]. Chemosphere, 2019, 226: 791-799
, Sala B, Plön S, et al. Halogenated and organophosphorus flame retardants in cetaceans from the southwestern Indian Ocean [J]. Chemosphere, 2019, 226: 791-799
[41] Garcia-Garin O, Sala B, Aguilar A, et al. Organophosphate contaminants in North Atlantic fin whales [J]. The Science of the Total Environment, 2020, 721: 137768
[42] 张丽, 张少峰, 于硕. 水环境中的有机磷阻燃剂及其生物富集和生物转化研究进展[J]. 生态毒理学报, 2021, 16(3): 78-94
Zhang L, Zhang S F, Yu S. Organophosphorus flame retardants in aquatic environment: A review on occurrence, bioaccumulation and metabolism [J]. Asian Journal of Ecotoxicology, 2021, 16(3): 78-94 (in Chinese)
[43] Wang G W, Shi H H, Du Z K, et al. Bioaccumulation mechanism of organophosphate esters in adult zebrafish (Danio rerio) [J]. Environmental Pollution, 2017, 229: 177-187
[44] Arukwe A, Carteny C C, Eggen T, et al. Novel aspects of uptake patterns, metabolite formation and toxicological responses in Salmon exposed to the organophosphate esters-tris(2-butoxyethyl)- and tris(2-chloroethyl) phosphate [J]. Aquatic Toxicology, 2018, 196: 146-153
[45] Tang B, Poma G, Bastiaensen M, et al. Bioconcentration and biotransformation of organophosphorus flame retardants (PFRs) in common carp (Cyprinus carpio) [J]. Environment International, 2019, 126: 512-522
[46] Choo G, Cho H S, Park K, et al. Tissue-specific distribution and bioaccumulation potential of organophosphate flame retardants in crucian carp [J]. Environmental Pollution, 2018, 239: 161-168
[47] 罗孝俊, 麦碧娴. 新型持久性有机污染物的生物富集[M]. 北京: 科学出版社, 2017: 3-4
[48] Liu Y E, Luo X J, Zapata Corella P, et al. Organophosphorus flame retardants in a typical freshwater food web: Bioaccumulation factors, tissue distribution, and trophic transfer [J]. Environmental Pollution, 2019, 255(Pt 2): 113286
[49] 刘佳. 有机磷酸酯阻燃剂污染现状及降解过程研究进展[J]. 应用化工, 2018, 47(12): 2705-2710, 2714
Liu J. Review of contamination status and degradation processes of organophosphate ester (OPE) flame retardants [J]. Applied Chemical Industry, 2018, 47(12): 2705-2710, 2714 (in Chinese)
[50] Su G Y, Letcher R J, Yu H X. Organophosphate flame retardants and plasticizers in aqueous solution: PH-dependent hydrolysis, kinetics, and pathways [J]. Environmental Science &Technology, 2016, 50(15): 8103-8111
[51] Fang Y D, Kim E, Strathmann T J. Mineral- and base-catalyzed hydrolysis of organophosphate flame retardants: Potential major fate-controlling sink in soil and aquatic environments [J]. Environmental Science &Technology, 2018, 52(4): 1997-2006
[52] Cristale J, Dantas R F, Luca A D, et al. Role of oxygen and DOM in sunlight induced photodegradation of organophosphorous flame retardants in river water [J]. Journal of Hazardous Materials, 2017, 323(Pt A): 242-249
[53] Sun S B, Jiang J Q, Zhao H X, et al. Photochemical reaction of tricresyl phosphate (TCP) in aqueous solution: Influencing factors and photolysis products [J]. Chemosphere, 2020, 241: 124971
[54] 艾锐, 阮新潮, 曾庆福. UV/H2O2降解水体中磷酸三(1,3-二氯-2-丙基)酯的研究[J]. 湖北农业科学, 2014, 53(5): 1044-1047
Ai R, Ruan X C, Zeng Q F. Photodegradation of tris(1,3-dichloro-2-propyl) phosphate in aqueous solution by UV/H2O2 [J]. Hubei Agricultural Sciences, 2014, 53(5): 1044-1047 (in Chinese)
[55] Takahashi S, Kawashima K, Kawasaki M, et al. Enrichment and characterization of chlorinated organophosphate ester-degrading mixed bacterial cultures [J]. Journal of Bioscience and Bioengineering, 2008, 106(1): 27-32
[56] Takahashi S, Satake I, Konuma I, et al. Isolation and identification of persistent chlorinated organophosphorus flame retardant-degrading bacteria [J]. Applied and Environmental Microbiology, 2010, 76(15): 5292-5296
[57] Takahashi S, Obana Y, Okada S, et al. Complete detoxification of tris(1,3-dichloro-2-propyl) phosphate by mixed two bacteria, Sphingobium sp. strain TCM1 and Arthrobacter sp. strain PY1 [J]. Journal of Bioscience and Bioengineering, 2012, 113(1): 79-83
[58] Takahashi S, Miura K, Abe K, et al. Complete detoxification of tris(2-chloroethyl) phosphate by two bacterial strains: Sphingobium sp. strain TCM1 and Xanthobacter autotrophicus strain GJ10 [J]. Journal of Bioscience and Bioengineering, 2012, 114(3): 306-311
[59] Berne C, Montjarret B, Guountti Y, et al. Tributyl phosphate degradation by Serratia odorifera [J]. Biotechnology Letters, 2004, 26(8): 681-686
[60] Kulkarni S V, Markad V L, Melo J S, et al. Biodegradation of tributyl phosphate using Klebsiella pneumoniae sp. S3 [J]. Applied Microbiology and Biotechnology, 2014, 98(2): 919-929
[61] Wei K, Yin H, Peng H, et al. Bioremediation of triphenyl phosphate in river water microcosms: Proteome alteration of Brevibacillus brevis and cytotoxicity assessments [J]. The Science of the Total Environment, 2019, 649: 563-570
[62] Vila-Costa M, Sebastián M, Pizarro M, et al. Microbial consumption of organophosphate esters in seawater under phosphorus limited conditions [J]. Scientific Reports, 2019, 9(1): 233
[63] Wang G W, Du Z K, Chen H Y, et al. Tissue-specific accumulation, depuration, and transformation of triphenyl phosphate (TPHP) in adult zebrafish (Danio rerio) [J]. Environmental Science &Technology, 2016, 50(24): 13555-13564
[64] Hou R, Liu C, Gao X Z, et al. Accumulation and distribution of organophosphate flame retardants (PFRs) and their di-alkyl phosphates (DAPs) metabolites in different freshwater fish from locations around Beijing, China [J]. Environmental Pollution, 2017, 229: 548-556
[65] Su G Y, Crump D, Letcher R J, et al. Rapid in vitro metabolism of the flame retardant triphenyl phosphate and effects on cytotoxicity and mRNA expression in chicken embryonic hepatocytes [J]. Environmental Science &Technology, 2014, 48(22): 13511-13519
[66] Sasaki K, Suzuki T, Takeda M, et al. Metabolism of phosphoric acid triesters by rat liver homogenate [J]. Bulletin of Environmental Contamination and Toxicology, 1984, 33(3): 281-288
[67] Van den Eede N, Maho W, Erratico C, et al. First insights in the metabolism of phosphate flame retardants and plasticizers using human liver fractions [J]. Toxicology Letters, 2013, 223(1): 9-15
[68] Wang L, Huang X L, Lim D J, et al. Uptake and toxic effects of triphenyl phosphate on freshwater microalgae Chlorella vulgaris and Scenedesmus obliquus: Insights from untargeted metabolomics [J]. The Science of the Total Environment, 2019, 650(Pt 1): 1239-1249
[69] Liu Q, Tang X X, Jian X Y, et al. Toxic effect and mechanism of tris (1,3-dichloro-2-propyl)phosphate (TDCPP) on the marine alga Phaeodactylum tricornutum [J]. Chemosphere, 2020, 252: 126467
[70] Wang L, Huang X L, Laserna A K C, et al. Metabolomics reveals that tris(1,3-dichloro-2-propyl)phosphate (TDCPP) causes disruption of membrane lipids in microalga Scenedesmus obliquus [J]. The Science of the Total Environment, 2020, 708: 134498
[71] Liu Q, Tang X X, Wang Y, et al. ROS changes are responsible for tributyl phosphate (TBP)-induced toxicity in the alga Phaeodactylum tricornutum [J]. Aquatic Toxicology, 2019, 208: 168-178
[72] Song H, Fan X J, Liu G F, et al. Inhibitory effects of tributyl phosphate on algal growth, photosynthesis, and fatty acid synthesis in the marine diatom Phaeodactylum tricornutum [J]. Environmental Science and Pollution Research International, 2016, 23(23): 24009-24018
[73] Verbruggen E M J, Rila J P, Traas T P, et al. Environmental risk limits for several phosphate esters, with possible application as flame retardant. RIVM report 601501024 [R]. Bilthoven: RIVM, 2006: 10-50
[74] Giraudo M, Dubé M, Lépine M, et al. Multigenerational effects evaluation of the flame retardant tris(2-butoxyethyl) phosphate (TBOEP) using Daphnia magna [J]. Aquatic Toxicology, 2017, 190: 142-149
[75] Yuan S L, Li H, Dang Y, et al. Effects of triphenyl phosphate on growth, reproduction and transcription of genes of Daphnia magna [J]. Aquatic Toxicology, 2018, 195: 58-66
[76] Li H, Su G Y, Zou M, et al. Effects of tris(1,3-dichloro-2-propyl) phosphate on growth, reproduction, and gene transcription of Daphnia magna at environmentally relevant concentrations [J]. Environmental Science &Technology, 2015, 49(21): 12975-12983
[77] 皮天星, 蔡磊明, 蒋金花, 等. 新型阻燃剂TCPP对斑马鱼的毒性研究[J]. 生态毒理学报, 2016, 11(2): 247-256
Pi T X, Cai L M, Jiang J H, et al. Toxicity effects of a new flame retardant tris(2-chloroisopropyl) phosphate to zebrafish (Danio rerio) [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 247-256 (in Chinese)
[78] Wang Q W, Lai N L S, Wang X F, et al. Bioconcentration and transfer of the organophorous flame retardant 1,3-dichloro-2-propyl phosphate causes thyroid endocrine disruption and developmental neurotoxicity in zebrafish larvae [J]. Environmental Science &Technology, 2015, 49(8): 5123-5132
[79] Zhang Y K, Yi X E, Huang K, et al. Tris(1,3-dichloro-2-propyl)phosphate reduces growth hormone expression via binding to growth hormone releasing hormone receptors and inhibits the growth of crucian carp [J]. Environmental Science &Technology, 2021, 55(12): 8108-8118
[80] Li Y, Wang C, Zhao F R, et al. Environmentally relevant concentrations of the organophosphorus flame retardant triphenyl phosphate impaired testicular development and reproductive behaviors in Japanese medaka (Oryzias latipes) [J]. Environmental Science &Technology Letters, 2018, 5(11): 649-654
[81] Hong X S, Chen R, Hou R, et al. Triphenyl phosphate (TPHP)-induced neurotoxicity in adult male Chinese rare minnows (Gobiocypris rarus) [J]. Environmental Science &Technology, 2018, 52(20): 11895-11903
[82] Wang L Y, Gu Y Y, Zhang Z M, et al. Contaminant occurrence, mobility and ecological risk assessment of phthalate esters in the sediment-water system of the Hangzhou Bay [J]. Science of the Total Environment, 2021, 770: 144705
[83] Beyer J, Green N W, Brooks S, et al. Blue mussels (Mytilus edulis spp.) as sentinel organisms in coastal pollution monitoring: A review [J]. Marine Environmental Research, 2017, 130: 338-365
[84] Sánchez-Marín P, Vidal-Li án L, Fernández-González L E, et al. Proteomic analysis and biochemical alterations in marine mussel gills after exposure to the organophosphate flame retardant TDCPP [J]. Aquatic Toxicology, 2021, 230: 105688
án L, Fernández-González L E, et al. Proteomic analysis and biochemical alterations in marine mussel gills after exposure to the organophosphate flame retardant TDCPP [J]. Aquatic Toxicology, 2021, 230: 105688
[85] Wu H F, Zhong M Y, Lu Z, et al. Biological effects of tris (1-chloro-2-propyl) phosphate (TCPP) on immunity in mussel Mytilus galloprovincialis [J]. Environmental Toxicology and Pharmacology, 2018, 61: 102-106
[86] Li D D, Wang P F, Wang X, et al. Elucidating multilevel toxicity response differences between tris(1,3-dichloro-2-propyl) phosphate and its primary metabolite in Corbicula fluminea [J]. The Science of the Total Environment, 2020, 749: 142049
[87] Yan S H, Wu H M, Qin J H, et al. Halogen-free organophosphorus flame retardants caused oxidative stress and multixenobiotic resistance in Asian freshwater clams (Corbicula fluminea) [J]. Environmental Pollution, 2017, 225: 559-568
[88] Yan S H, Wang Q, Yang L H, et al. Comparison of the toxicity effects of tris(1,3-dichloro-2-propyl)phosphate (TDCIPP) with tributyl phosphate (TNBP) reveals the mechanism of the apoptosis pathway in Asian freshwater clams (Corbicula fluminea) [J]. Environmental Science &Technology, 2020, 54(11): 6850-6858
[89] Kim S, Jung J, Lee I, et al. Thyroid disruption by triphenyl phosphate, an organophosphate flame retardant, in zebrafish (Danio rerio) embryos/larvae, and in GH3 and FRTL-5 cell lines [J]. Aquatic Toxicology, 2015, 160: 188-196
[90] Lin K D. Joint acute toxicity of tributyl phosphate and triphenyl phosphate to Daphnia magna [J]. Environmental Chemistry Letters, 2009, 7(4): 309-312
[91] Paluselli A, Kim S K. Horizontal and vertical distribution of phthalates acid ester (PAEs) in seawater and sediment of East China Sea and Korean South Sea: Traces of plastic debris? [J]. Marine Pollution Bulletin, 2020, 151: 110831
[92] Wu T T, Mao L L, Liu X T, et al. Seasonal occurrence, allocation and ecological risk of organophosphate esters in a typical urbanized semi-closed bay [J]. Environmental Pollution, 2021, 290: 118074
[93] Fang L D, Liu A F, Zheng M G, et al. Occurrence and distribution of organophosphate flame retardants in seawater and sediment from coastal areas of the East China and Yellow Seas [J]. Environmental Pollution, 2022, 302: 119017
[94] Luo Q, Wu Z P, Wang C C, et al. Seasonal variation, source identification, and risk assessment of organophosphate ester flame retardants and plasticizers in surficial sediments from Liao River Estuary wetland, China [J]. Marine Pollution Bulletin, 2021, 173(Pt A): 112947
[95] Bekele T G, Zhao H X, Wang Q Z. Tissue distribution and bioaccumulation of organophosphate esters in wild marine fish from Laizhou Bay, North China: Implications of human exposure via fish consumption [J]. Journal of Hazardous Materials, 2021, 401: 123410
[96] Ding J J, Deng T Q, Xu M M, et al. Residuals of organophosphate esters in foodstuffs and implication for human exposure [J]. Environmental Pollution, 2018, 233: 986-991
[97] Zhao L M, Jian K, Su H J, et al. Organophosphate esters (OPEs) in Chinese foodstuffs: Dietary intake estimation via a market basket method, and suspect screening using high-resolution mass spectrometry [J]. Environment International, 2019, 128: 343-352
[98] Wang X W, He Y Q, Lin L, et al. Application of fully automatic hollow fiber liquid phase microextraction to assess the distribution of organophosphate esters in the Pearl River Estuaries [J]. The Science of the Total Environment, 2014, 470-471: 263-269
[99] Niu Z G, Zhang Z Z, Li J F, et al. Threats of organophosphate esters (OPEs) in surface water to ecological system in Haihe River of China based on species sensitivity distribution model and assessment factor model [J]. Environmental Science and Pollution Research International, 2019, 26(11): 10854-10866
[100] Yan X J, He H, Peng Y, et al. Determination of organophosphorus flame retardants in surface water by solid phase extraction coupled with gas chromatography-mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2012, 40(11): 1693-1697
[101] Sühring R, Diamond M L, Bernstein S, et al. Organophosphate esters in the Canadian Arctic Ocean [J]. Environmental Science &Technology, 2021, 55(1): 304-312
[102] Gao X Z, Lin Y Y, Li J Y, et al. Spatial pattern analysis reveals multiple sources of organophosphorus flame retardants in coastal waters [J]. Journal of Hazardous Materials, 2021, 417: 125882
[103] Dou W K, Zhang Z M, Huang W, et al. Contaminant occurrence, spatiotemporal variation, and ecological risk of organophosphorus flame retardants (OPFRs) in Hangzhou Bay and East China Sea ecosystem [J]. Chemosphere, 2022, 303: 135032
[104] Zhang Z M, Dou W K, Zhang X Q, et al. Organophosphate esters in the mariculture ecosystem: Environmental occurrence and risk assessments [J]. Journal of Hazardous Materials, 2022, 436: 129219
[105] Li J, Xie Z Y, Mi W Y, et al. Organophosphate esters in air, snow, and seawater in the North Atlantic and the Arctic [J]. Environmental Science &Technology, 2017, 51(12): 6887-6896
[106] Ma Y Q, Cui K Y, Zeng F, et al. Microwave-assisted extraction combined with gel permeation chromatography and silica gel cleanup followed by gas chromatography-mass spectrometry for the determination of organophosphorus flame retardants and plasticizers in biological samples [J]. Analytica Chimica Acta, 2013, 786: 47-53
[107] Castro  , Pocurull E, Borrull F. Determination of organophosphate ester flame retardants and plasticisers in fish samples by QuEChERs followed by gas chromatography-tandem mass spectrometry. Exposure and risk assessment through fish consumption [J]. Journal of Chromatography A, 2020, 1626: 461356
, Pocurull E, Borrull F. Determination of organophosphate ester flame retardants and plasticisers in fish samples by QuEChERs followed by gas chromatography-tandem mass spectrometry. Exposure and risk assessment through fish consumption [J]. Journal of Chromatography A, 2020, 1626: 461356
[108] 高小中, 许宜平, 王子健. 有机磷酸酯阻燃剂的环境暴露与迁移转化研究进展[J]. 生态毒理学报, 2015, 10(2): 56-68
Gao X Z, Xu Y P, Wang Z J. Progress in environment exposure, transport and transform of organophosphorus flame retardants [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 56-68 (in Chinese)
[109] Jurgens S S, Helmus R, Waaijers S L, et al. Mineralisation and primary biodegradation of aromatic organophosphorus flame retardants in activated sludge [J]. Chemosphere, 2014, 111: 238-242
[110] Krivoshiev B V, Dardenne F, Blust R, et al. Elucidating toxicological mechanisms of current flame retardants using a bacterial gene profiling assay [J]. Toxicology in Vitro, 2015, 29(8): 2124-2132
[111] Li F, Cao L L, Li X H, et al. Affinities of organophosphate flame retardants to tumor suppressor gene p53: An integrated in vitro and in silico study [J]. Toxicology Letters, 2015, 232(2): 533-541
[112] 姜丹, 周建国, 李娜, 等. 有机磷酸酯对青海弧菌Q67毒性的构效关系[J]. 生态毒理学报, 2014, 9(1): 71-80
Jiang D, Zhou J G, Li N, et al. Quantitative structure-activity relationships between acute toxicity of organophosphates and Vibrio qinghaiensis sp.-Q67 [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 71-80 (in Chinese)
[113] Cristale J, García Vázquez A, Barata C, et al. Priority and emerging flame retardants in rivers: Occurrence in water and sediment, Daphnia magna toxicity and risk assessment [J]. Environment International, 2013, 59: 232-243
[114] Li R W, Wang H Q, Mi C, et al. The adverse effect of TCIPP and TCEP on neurodevelopment of zebrafish embryos/larvae [J]. Chemosphere, 2019, 220: 811-817
[115] Wang C Q, Chen Z H, Lu Y M, et al. Neurotoxicity and related mechanisms of flame retardant TCEP exposure in mice [J]. Toxicology Mechanisms and Methods, 2020, 30(7): 490-496
[116] Yu X L, Yin H, Peng H, et al. OPFRs and BFRs induced A549 cell apoptosis by caspase-dependent mitochondrial pathway [J]. Chemosphere, 2019, 221: 693-702
[117] Liu X S, Ji K, Choi K. Endocrine disruption potentials of organophosphate flame retardants and related mechanisms in H295R and MVLN cell lines and in zebrafish [J]. Aquatic Toxicology, 2012, 114-115: 173-181
[118] Zhang J K, Abdallah M A, Williams T D, et al. Gene expression and metabolic responses of HepG2/C3A cells exposed to flame retardants and dust extracts at concentrations relevant to indoor environmental exposures [J]. Chemosphere, 2016, 144: 1996-2003
[119] Liu C S, Wang Q W, Liang K, et al. Effects of tris(1,3-dichloro-2-propyl) phosphate and triphenyl phosphate on receptor-associated mRNA expression in zebrafish embryos/larvae [J]. Aquatic Toxicology, 2013, 128-129: 147-157
[120] Zhu Y, Ma X F, Su G Y, et al. Environmentally relevant concentrations of the flame retardant tris(1,3-dichloro-2-propyl) phosphate inhibit growth of female zebrafish and decrease fecundity [J]. Environmental Science &Technology, 2015, 49(24): 14579-14587
[121] Yuan L L, Li J S, Zha J M, et al. Targeting neurotrophic factors and their receptors, but not cholinesterase or neurotransmitter, in the neurotoxicity of TDCPP in Chinese rare minnow adults (Gobiocypris rarus) [J]. Environmental Pollution, 2016, 208: 670-677
[122] Wang Q W, Lam J C, Man Y C, et al. Bioconcentration, metabolism and neurotoxicity of the organophorous flame retardant 1,3-dichloro 2-propyl phosphate (TDCPP) to zebrafish [J]. Aquatic Toxicology, 2015, 158: 108-115
[123] Alzualde A, Behl M, Sipes N S, et al. Toxicity profiling of flame retardants in zebrafish embryos using a battery of assays for developmental toxicity, neurotoxicity, cardiotoxicity and hepatotoxicity toward human relevance [J]. Neurotoxicology and Teratology, 2018, 70: 40-50
[124] Dasgupta S, Vliet S M F, Cheng V, et al. Complex interplay among nuclear receptor ligands, cytosine methylation, and the metabolome in driving tris(1,3-dichloro-2-propyl)phosphate-induced epiboly defects in zebrafish [J]. Environmental Science &Technology, 2019, 53(17): 10497-10505
[125] Wang Q W, Liang K, Liu J F, et al. Exposure of zebrafish embryos/larvae to TDCPP alters concentrations of thyroid hormones and transcriptions of genes involved in the hypothalamic-pituitary-thyroid axis [J]. Aquatic Toxicology, 2013, 126: 207-213
[126] Li Y, Fu Y R, Hu K Q, et al. Positive correlation between human exposure to organophosphate esters and gastrointestinal cancer in patients from Wuhan, China [J]. Ecotoxicology and Environmental Safety, 2020, 196: 110548
[127] Kwon B, Shin H, Moon H B, et al. Effects of tris(2-butoxyethyl) phosphate exposure on endocrine systems and reproduction of zebrafish (Danio rerio) [J]. Environmental Pollution, 2016, 214: 568-574
[128] Giraudo M, Douville M, Houde M. Chronic toxicity evaluation of the flame retardant tris (2-butoxyethyl) phosphate (TBOEP) using Daphnia magna transcriptomic response [J]. Chemosphere, 2015, 132: 159-165
[129] Hong X S, Chen R, Yuan L L, et al. Global microRNA and isomiR expression associated with liver metabolism is induced by organophosphorus flame retardant exposure in male Chinese rare minnow (Gobiocypris rarus) [J]. The Science of the Total Environment, 2019, 649: 829-838
[130] Pang L, Liu J F, Yin Y G, et al. Evaluating the sorption of organophosphate esters to different sourced humic acids and its effects on the toxicity to Daphnia magna [J]. Environmental Toxicology and Chemistry, 2013, 32(12): 2755-2761
[131] Du Z K, Zhang Y, Wang G W, et al. TPhP exposure disturbs carbohydrate metabolism, lipid metabolism, and the DNA damage repair system in zebrafish liver [J]. Scientific Reports, 2016, 6: 21827
[132] Li Y, Kang Q Y, Chen R C, et al. 2-ethylhexyl diphenyl phosphate and its hydroxylated metabolites are anti-androgenic and cause adverse reproductive outcomes in male Japanese medaka (Oryzias latipes) [J]. Environmental Science &Technology, 2020, 54(14): 8919-8925
[133] 周贵珍, 曾涛, 张利平, 等. 磷酸三邻甲苯酯对母鸡中枢神经组织ATP含量的影响[J]. 环境与职业医学, 2009, 26(1): 20-23
Zhou G Z, Zeng T, Zhang L P, et al. Effects of tri-o-cresyl phosphate (TOCP)on ATP concentration in hen’s central nervous tissues [J]. Journal of Environmental &Occupational Medicine, 2009, 26(1): 20-23 (in Chinese)
[134] McGee S P, Konstantinov A, Stapleton H M, et al. Aryl phosphate esters within a major PentaBDE replacement product induce cardiotoxicity in developing zebrafish embryos: Potential role of the aryl hydrocarbon receptor [J]. Toxicological Sciences, 2013, 133(1): 144-156