溴代阻燃剂(brominated flame retardants, BFRs)是一类人工合成的并具有优异阻燃性能的化合物,被广泛用于塑料、家具、汽车、建筑材料和纺织业等行业[1]。目前广泛使用的多溴联苯醚(PBDEs)和六溴环十二烷(HBCD)等传统的BFRs,由于具有较大的毒性和生态风险[2],已被列入《斯德哥尔摩公约》中受管控的持久性有机污染物(POPs)名单[3]。由此,新型溴代阻燃剂(novel BFRs, NBFRs)开始逐步替代传统的BFRs在全球范围内投入使用。表1列出了目前使用较为广泛的NBFRs的一些基本信息[4]。近年来,中国已经成为NBFRs的生产和使用大国,产量约占全球总产量的1/3,且逐年增加[5],十溴二苯乙烷(DBDPE)在中国2006年的产量是12 000 t,同时以每年85%的速度在增长,中国潍坊NBFRs生产企业每年生产六溴苯(HBB)和五溴甲苯(PBT)约600 t[5]。2019年,全球卤化阻燃剂共使用约72万t,根据相关部门的市场研究,中国已成为亚洲阻燃剂消耗量最大的国家,其中电子领域中阻燃剂的使用在过去4年中增幅最大[6]。由于大部分的NBFRs属于添加型阻燃剂,不与材料形成化学键,随着生产、使用和废弃排放容易释放到环境中,并造成环境污染。因此,NBFRs对生态环境和人类健康都存在潜在威胁,需要进一步关注研究。
表1 常见新型溴代阻燃剂(NBFRs)的部分理化性质
Table 1 Physicochemical properties of common novel brominated flame retardants (NBFRs)
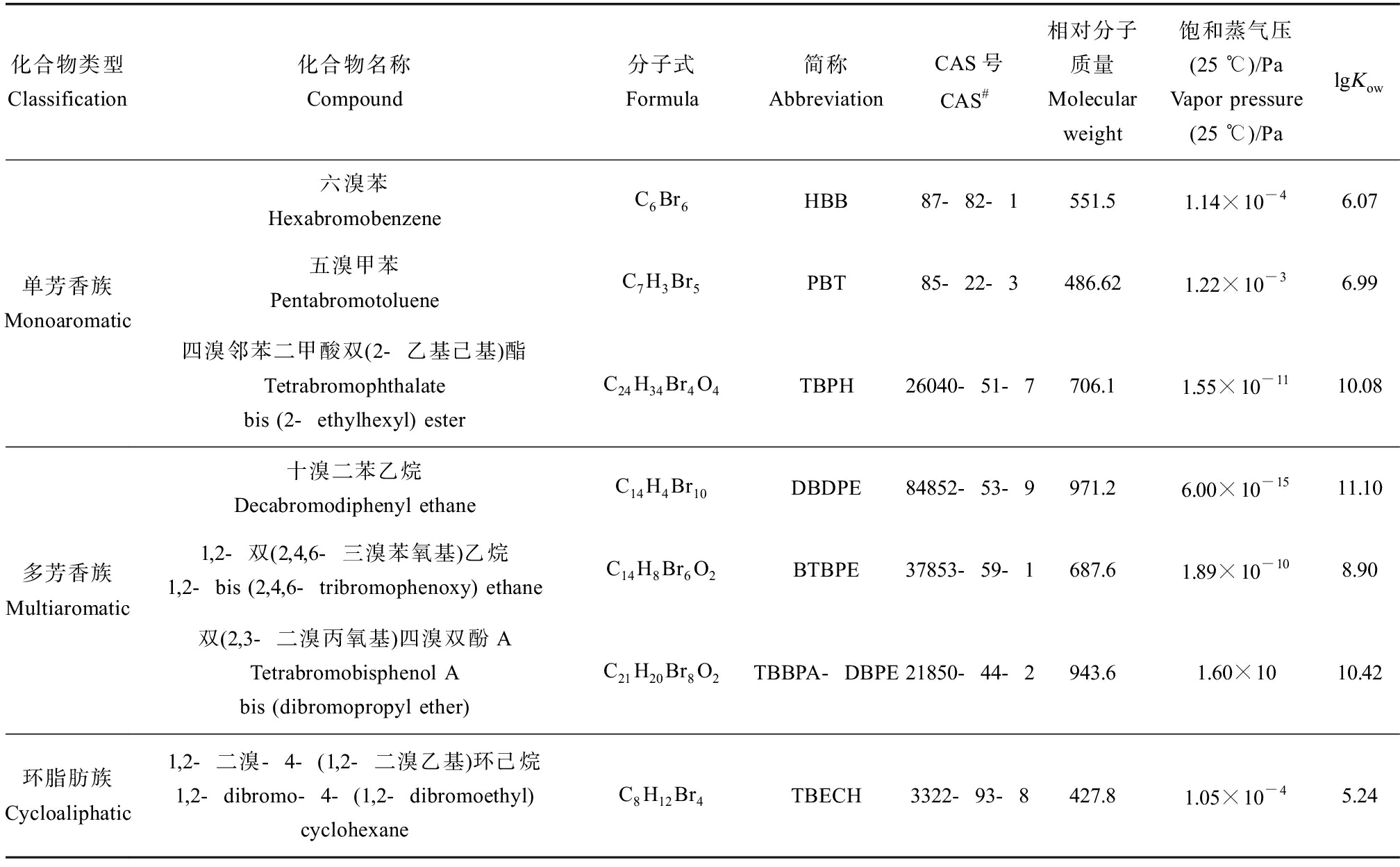
化合物类型Classification化合物名称Compound分子式Formula简称AbbreviationCAS号CAS#相对分子质量Molecular weight饱和蒸气压(25 ℃)/PaVapor pressure (25 ℃)/Pa lgKow单芳香族Monoaromatic六溴苯HexabromobenzeneC6Br6HBB87-82-1551.51.14×10-46.07五溴甲苯PentabromotolueneC7H3Br5PBT85-22-3486.621.22×10-36.99四溴邻苯二甲酸双(2-乙基己基)酯Tetrabromophthalate bis (2-ethylhexyl) esterC24H34Br4O4TBPH26040-51-7706.11.55×10-1110.08多芳香族Multiaromatic十溴二苯乙烷Decabromodiphenyl ethaneC14H4Br10DBDPE84852-53-9971.26.00×10-1511.101,2-双(2,4,6-三溴苯氧基)乙烷1,2-bis (2,4,6-tribromophenoxy) ethaneC14H8Br6O2BTBPE37853-59-1687.61.89×10-108.90双(2,3-二溴丙氧基)四溴双酚ATetrabromobisphenol A bis (dibromopropyl ether)C21H20Br8O2TBBPA-DBPE21850-44-2943.61.60×1010.42环脂肪族Cycloaliphatic1,2-二溴-4-(1,2-二溴乙基)环己烷1,2-dibromo-4-(1,2-dibromoethyl) cyclohexaneC8H12Br4TBECH3322-93-8427.81.05×10-45.24
注:数据来源https://pubchem.ncbi.nlm.nih.gov/。
Note: Data from https://pubchem.ncbi.nlm.nih.gov/.
目前研究表明,几乎所有的环境介质(大气[7]、灰尘[8-9]、水体[10-11]、沉积物[12-13]和土壤[14]等)和大量的生物样品(如鸟类、鱼类和家禽等)[15-16],甚至是人体样品(如血清、母乳等[17-18])中都检测到了NBFRs的存在。由于大多数的NBFRs的饱和蒸气压很低,且易被颗粒物吸附,故其在气相中的浓度较低,而在大气颗粒物和灰尘中的含量较高,如DBDPE在空气中的浓度为pg·m-3水平,而在灰尘样品中的浓度可达μg·g-1水平[1, 19]。中国黑龙江省住宅区空气中DBDPE平均浓度为11 pg·m-3[20],中国太湖北岸的空气中DBDPE的平均浓度为23 pg·m-3[21],在空气中NBFRs的分布主要呈现从农村到城市逐渐升高的趋势。由于NBFRs具有较高的正辛醇-水分配系数(Kow),沉积物中浓度远高于水体中浓度。目前在全球范围内水体沉积物中检出NBFRs浓度较高的区域是中国东江三角洲区域(247 ng·g-1(干质量))和南非埃瑟克维尼市(171 ng·g-1(干质量))[13]。NBFRs在水体中的分布呈现从近岸到远海逐渐降低的趋势,可能是由于人类活动的排放使得近岸水域NBFRs浓度普遍偏高。中国广东省东江水体中DBDPE的浓度为13 pg·L-1[22]。HBB在中国渤海区域检出浓度为1.23~9.43 ng·L-1[10],高于新加坡沿岸海域(nd~0.965 ng·L-1)[23]、新加坡城市水体(0.0039~0.49 ng·L-1)[24]、五大湖水体(nd~0.70 pg·L-1),而在远洋中检出浓度更低,大西洋和太平洋水体中浓度为nd~0.02 pg·L-1[1]。此外,有研究者在北极大气和海水中检测到了2,3-二溴丙基-2,4,6-三溴苯醚(DPTE)、HBB和PBT的存在,表明它们与被禁止使用的PBDEs具有相似的远程大气传输能力[25]。
作为一类新型的有机污染物,NBFRs的生态毒性效应也受到了研究者的广泛关注。目前研究表明,大部分NBFRs对生物不会产生急性毒性,但NBFRs会产生一定程度的肝脏毒性、内分泌毒性和发育毒性等,对水生生物和人类健康均存在一定程度的影响[1],更加详细的毒性数据和生态风险评估也有待进一步研究。由于NBFRs具有较强的亲脂性,这使得多数NBFRs具有生物富集和生物放大效应,造成潜在的生态风险。即使NBFRs在环境中存在的浓度较低,但由于生物放大等作用依然可能会引发生物体内的氧化损伤[26],干扰生物体内一些酶和激素的正常表达过程[27],从而影响生物的生长、代谢、发育和繁殖等过程[1]。本文主要总结了NBFRs的几种毒性效应包括急性毒性、肝脏毒性、内分泌干扰毒性和发育毒性等,并总结了NBFRs在环境中的生物积累、富集和生物放大效应的研究结果,为评估NBFRs的毒性和生态风险提供参考。
1 急性毒性(Acute toxicity)
急性毒性是指机体一次接触或24 h内多次甚至连续接触某一化学物后,在短期内所引起的毒效应,包括死亡效应[28]。急性毒性测试通常以受试生物的死亡作为毒性终点,为初步确定NBFRs的安全使用剂量和环境风险,目前研究多使用NBFRs对生物的半数致死剂量(half lethal dose, LD50)与半数致死浓度(LC50)和半数效应剂量(median effective dose, ED50)与半数效应浓度(EC50)等指标来进行探究[1]。其中LD50指引起一群个体50%死亡所需剂量,LC50指能引起一群个体50%死亡所需的浓度,一般以mg·m-3(空气)和mg·L-1(水)来表示;ED50指外源化学物质引起机体某项生物效应发生50%改变所需的剂量,如果以该污染物在环境介质中的浓度来表示,则为EC50[1]。Scanlan等[29]研究得到,四溴邻苯二甲酸双(2-乙基己基)酯(TBPH)能够产生急性毒性,对大型溞48 h的LC50为0.91 mg·L-1(表2)。Usenko等[30]研究得到2,3,4,5-四溴苯甲酸2-乙基己酯(TBB)、HBB和TBPH对斑马鱼胚胎的LC50值分别为7、10.7和>20 mg·L-1。Harju等[31]的研究表明,给大鼠腹腔注射HBB诱导肝脏生化效应,观察到的最低作用剂量或浓度(lowest observed effect level, LOAEL)为150 mg·kg-1 (以体质量计);2,3,4,5,6-五溴乙苯(PBEB)在兔体内进行急性毒性试验,LD50>8 g·kg-1;大鼠连续91 d口服浓度剂量为0.003~40 mg·kg-1·d-1的PBT后,没有产生急性毒性效应,LOAEL为0.35 mg·kg-1·d-1。现有报道对DBDPE急性毒性研究较多,Dong等[32]发现DBDPE(1 mg·L-1,96 h)对斑马鱼没有产生急性毒性,分别口服和皮肤接触浓度>5 000 mg·kg-1和>2 000 mg·kg-1的DBDPE对兔子也没有产生急性毒性[33]。Hardy等[34]的研究中使用110 mg·L-1的DBDPE对大型溞、藻类和鱼类进行处理没有观察到明显的急性毒性。而在Nakari和Huhtala[35]的研究中,DBDPE对大型溞,24 h的EC50值为19 μg·L-1,Hardy等[34]在研究中说明这一结果差异可能的原因在于Nakari和Huhtala[35]的实验中使用了含有甲苯助溶剂的DBDPE溶液,并使用未知数量的二甲基亚砜(DMSO)进行稀释,甲苯和DMSO的存在可能会使大型溞出现中毒反应。
表2 常见新型溴代阻燃剂急性毒性
Table 2 Acute toxicity of NBFRs
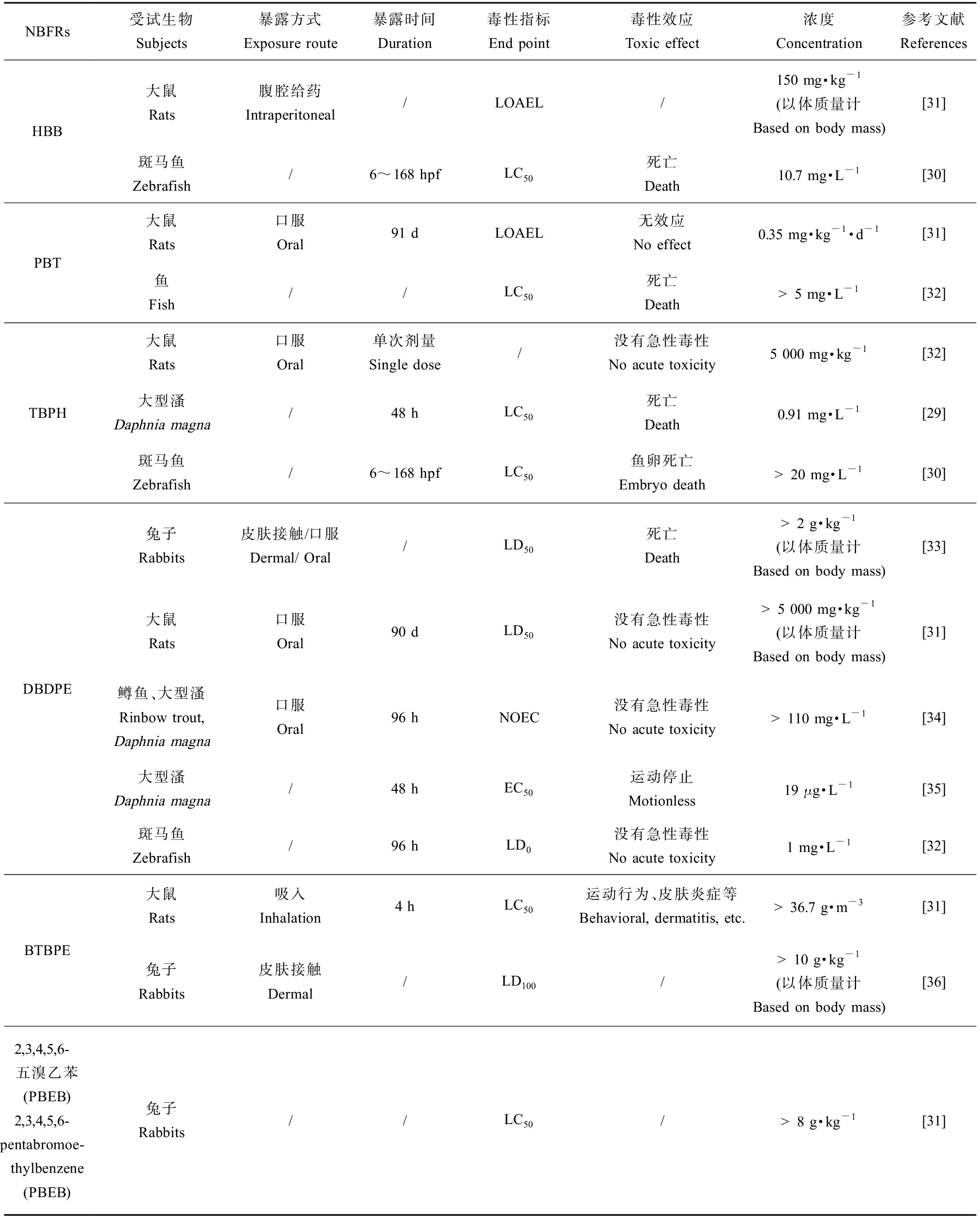
NBFRs受试生物Subjects暴露方式Exposure route暴露时间Duration毒性指标End point毒性效应Toxic effect浓度Concentration参考文献ReferencesHBB大鼠Rats腹腔给药Intraperitoneal/LOAEL/150 mg·kg-1(以体质量计 Based on body mass)[31]斑马鱼Zebrafish/6~168 hpfLC50死亡Death10.7 mg·L-1[30]PBT大鼠Rats口服Oral91 dLOAEL无效应No effect0.35 mg·kg-1·d-1[31]鱼Fish//LC50死亡Death>5 mg·L-1[32]TBPH大鼠Rats口服Oral单次剂量Single dose/没有急性毒性No acute toxicity5 000 mg·kg-1[32]大型溞Daphnia magna/48 hLC50死亡Death0.91 mg·L-1[29]斑马鱼Zebrafish/6~168 hpfLC50鱼卵死亡Embryo death>20 mg·L-1[30]DBDPE兔子Rabbits皮肤接触/口服Dermal/ Oral/LD50死亡Death>2 g·kg-1(以体质量计 Based on body mass)[33]大鼠Rats口服Oral90 dLD50没有急性毒性No acute toxicity>5 000 mg·kg-1(以体质量计 Based on body mass)[31]鳟鱼、大型溞Rinbow trout, Daphnia magna口服Oral96 hNOEC没有急性毒性No acute toxicity>110 mg·L-1[34]大型溞Daphnia magna/48 hEC50运动停止Motionless19 μg·L-1[35]斑马鱼Zebrafish/96 hLD0没有急性毒性No acute toxicity1 mg·L-1[32]BTBPE大鼠Rats吸入Inhalation4 hLC50运动行为、皮肤炎症等Behavioral, dermatitis, etc.>36.7 g·m-3[31]兔子Rabbits皮肤接触Dermal/LD100/>10 g·kg-1(以体质量计 Based on body mass)[36]2,3,4,5,6-五溴乙苯(PBEB) 2,3,4,5,6-pentabromoe-thylbenzene (PBEB)兔子Rabbits//LC50/>8 g·kg-1[31]
注:LD0为最大非致死剂量,LD100为绝对致死剂量,NOEC为最大无影响浓度;LOAEL为观察到的最低作用剂量或浓度。
Note: LD0 refers to maximum non-lethal dose, LD100 refers to absolute lethal dose, NOEC refer to no observed effect concentration, and LOAEL refer to no observable adverse effect level.
目前对于NBFRs的急性毒性研究还不够充分,首先不同种类的NBFRs对于生物的急性毒性产生情况并不相同,如DBDPE、1,2-双(2,4,6-三溴苯氧基)乙烷(BTBPE)等可能对模式生物不会产生急性毒性,但也发现如TBPH及其衍生物等对大型溞存在急性毒性,这可能与NBFRs的亲脂性有较大关系,延长暴露时间可能会使得NBFRs产生较为明显的毒性效应。其次,目前NBFRs的急性毒性研究集中在少部分模式生物上,缺少更高级的生物种类如哺乳动物的研究,后续还需要进一步扩大NBFRs的急性毒性测试生物范围,为NBFRs对人体的实际风险提供参考。最后,在实际环境中,水环境体系的pH、溶解有机质水平和水体温度等原因都可能会影响NBFRs的生物毒性,因此在实际的湖泊、河流和海洋等环境中NBFRs的急性毒性还需要进一步探究,来更加准确地确定NBFRs的生态风险。
2 肝脏毒性(Hepatotoxicity)
研究证实,NBFRs的暴露会使生物肝脏细胞内产生活性氧物种(ROS),从而诱发氧化应激效应。Szymańska[37]在研究中发现,在小鼠体内注射HBB致死剂量的20%~90%时,虽然不能够观察到小鼠肝脏细胞的明显毒性病理学变化,但短时间内肝脏中谷胱甘肽(GSH)水平降低。Feng等[26]的研究表明,5、10和100 mg·kg-1的DBDPE均能够使淡水金鱼(Carassius auratus)肝脏细胞中GSH水平明显降低,可能是由于DBDPE使得淡水金鱼肝脏细胞发生严重的氧化应激效应,从而使得GSH合成过程受阻。Egloff等[38]的研究结果表明,当BTBPE浓度为>0.03 μmol·L-1和0.1 μmol·L-1时,鸡胚胎肝细胞中细胞色素P450-1A4/5(CYP1A4/5)的mRNA表达水平分别提高了115倍和18倍,严重影响了肝细胞的代谢活动。Nakari和Huhtala[35]的研究结果表明,DBDPE的浓度变化会影响虹鳟鱼和褐鳟鱼肝细胞中7-乙氧基异吩恶唑脱乙基酶(EROD)活性,虹鳟鱼EROD活性在DBDPE暴露浓度为12.5 μg·L-1时达到峰值,之后活性开始显著下降,25 μg·L-1时降低至0;而褐鳟鱼EROD活性随DBDPE浓度升高而持续降低,在25 μg·L-1时降低至0。目前对于NBFRs的肝脏毒性研究较为全面,结果表明NBFRs暴露会通过以下几种方式产生肝脏毒性:触发肝脏细胞氧化应激现象、诱导合成细胞色素P450酶的mRNA的过量表达影响相关肝脏基因的表达、改变肝脏细胞内相应的酶活性等。以上研究证实了NBFRs对生物存在一定的肝脏毒性效应(表3)。
表3 常见新型溴代阻燃剂肝脏毒性
Table 3 Hepatotoxicity of NBFRs

NBFRs受试生物Subjects暴露方式Exposure route暴露时间Duration毒性指标End point浓度Concentration参考文献ReferencesHBBBalb/C小鼠Balb/C mice口服Oral72 h肝脏细胞GSH水平Liver glutathione levels致死剂量的20%~90%20%~90% of lethal doses[37]DBDPE淡水金鱼Carassius auratus腹腔注射Injected intraperitoneally30 d肝脏细胞GSH水平Liver glutathione levels5、10、100 mg·kg-1[26]虹鳟鱼Rainbow trout褐鳟鱼Brown trout口服Oral8 dEROD活性EROD activity0~50 μg·L-1[35]BTBPE鸡胚胎肝细胞Chicken embryonic hepatocyte/36 hCYP1A4/50.03、0.1 μmol·L-1[38]
3 内分泌干扰毒性(Endocrine disrupting toxicity)
由于部分NBFRs分子结构与多种生物激素分子类似,NBFRs具有内分泌干扰作用和雌(雄)激素效应[39]。在酵母雌(雄)激素筛选研究中发现,TBB(0.91 μmol·L-1)能够引起酵母62%抗雌激素作用,TBPH(425 μmol·L-1)能够引起74%的抗雄激素作用。在人体正常乳腺细胞的研究中,TBPH对抗雄激素的活性和抗糖皮质激素类药物的活性IC50值分别为0.1 μmol·L-1和0.3 μmol·L-1 [27]。Jin等[40]将斑马鱼暴露在高浓度的DBDPE沉积物中(1 000.0 μg·kg-1(以干质量计))后,受精后48 h没有出现死亡、畸形等现象,但受精后120 h的斑马鱼游泳距离明显短于对照组,同时通过对2组神经相关基因的表达水平、AChE活性和细胞凋亡情况进行测定发现,斑马鱼的神经毒性效应较小。Sun等[41]的研究结果表明,给Balb/C小鼠喂食含有5、20、100和200 mg·kg-1·d-1含有DBDPE的玉米油,小鼠体内促甲状腺激素(TSH)水平升高,血清游离三碘甲腺原氨酸(FT3)、总三碘甲腺原氨酸(TT3)、游离甲状腺素(FT4)和总甲状腺激素(TT4)降低,说明DBDPE虽然对小鼠不能产生急性毒性效应但会干扰鼠类体内甲状腺相关激素的分泌,由此可能会导致血糖问题等一系列生理不良反应。Smythe等[42]也发现了类似的毒性效应,DBDPE能够抑制肝细胞内3,3,5,5-四碘氨酸形成3,3,5-三碘氨酸的过程,是被发现的首个能够抑制碘甲状腺氨酸脱碘酶(DIO)活性的非羟基化污染物。在Egloff等[38]的实验中,使用CEH(原代鸡胚胎细胞)和鸡卵2种受试生物进行测试,BTBPE能够使碘甲腺原氨酸脱碘酶Ⅲ(DIO3)mRNA显著表达并提高CYP1A4/5 mRNA表达水平,这可能与肝脏对类甲状腺激素化合物的轻微反应有关[38]。另一项研究中,14.5 μmol·L-1的BTBPE能够使酵母菌株β-半乳糖苷酶的生成降低12.2%,12.1 μmol·L-1的BTBPE能够抑制酵母发光强度的31%,说明BTBPE具有抗雌激素的作用,具有一定的生态风险[43]。Curran等[44]的研究表明,在大鼠的饮食中添加梯度浓度的TBECH(0~5 000 mg·kg-1),饲喂28 d后检测到雌性大鼠血清中三碘甲状腺原氨酸(T3)、四碘甲状腺原氨酸(T4)水平升高,而雄性大鼠激素水平无明显变化。Marteinson和Fernie[45]将β-TBECH按0.239 ng·g-1·d-1的浓度添加到红隼的食物中,使得红隼的雄激素依赖行为增加,同时提高了雄性红隼的交配能力和攻击性。Larsson等[46]研究发现,在人肝癌细胞中观察到4-(1,2-二溴乙基)-1,2-二溴环己烷(TBECH)与雄激素受体(AR)能够紧密结合,半抑制浓度(IC50)为163 nmol·L-1;在AR活化试验中观察到相关的雄激素活性,IC50为42.7 nmol·L-1,结果表明TBECH可以激活人的AR。而在另一项研究中,结构不同的TBECH激活人类AR的能力并不相同,TBECH-γ和TBECH-δ激活AR的能力比TBECH-α和TBECH-β更强[47]。大部分NBFRs不会对生物产生急性毒性效应,但由于具有与内分泌激素较为相似的分子结构,在生物体内易产生内分泌干扰效应,如抗雌、雄激素作用、抑制各类内分泌激素的分泌过程、抑制DIO活性、与AR紧密结合并激活人体AR并具有不同的激活能力等影响(表4)。
表4 常见新型溴代阻燃剂内分泌干扰毒性
Table 4 Endocrine disrupting toxicity of NBFRs

NBFRs受试生物Subjects暴露方式Exposure route暴露时间Duration毒性指标End point毒性效应Toxicity effect浓度Concentration参考文献ReferencesDBDPE斑马鱼Zebrafish沉积物Sediment48 hpf游泳距离Free-swimming distance无No effect62.5~1 000 μg·kg-1[40]斑马鱼Zebrafish沉积物Sediment120 hpf游泳距离Free-swimming distance距离减短Distance was shortened62.5~1 000 μg·kg-1[40]Balb/C小鼠Balb/C mice口服Oral30 d激素水平Hormone levelsTSH升高;FT3、TT3、FT4、TT4降低TSH: ↑;FT3, TT3, FT4, TT4:↓5、20、100、200 mg·kg-1·d-1[41]BTBPE酵母菌Yeast//酶生成量;发光强度β-galactosidase production, yeast luminescence酶生成量降低12.2%发光强度降低31%β-galactosidase production reduce by 12.2%, yeast luminescence inhibit by 31%14.5 μmol·L-112.1 μmol·L-1[43]CEH/鸡胚CEH/Eggs添加/注射Expose/ Inject36 hDIO3 mRNA表达水平Expression level of the gene encoding DIO3抑制DIO3表达CYP1A4/5增加Inhibition of DIO3 expression, CYP1A4/5 increase0.051、0.36、3.2 mg·mL-1[38]TBECHF344大鼠F344 rats饮食口服Oral28 d激素水平Hormone levels雌性:T3、T4增加雄性:无效应Female: T3, T4 increase;Male: No effect1 250 mg·kg-1[44]美国红隼(猎鹰)American kestrels (Falco sparverius)口服82 d生物行为Biologic behavior雄激素依赖行为增加Increased androgen dependent behavior0.239 ng·g-1·d-1[45]
目前的研究表明,NBFRs会通过影响生物体内激素水平、基因表达水平等方式对受试生物产生毒性效应,从而对生物的运动能力等产生干扰,但由于更高营养级的生物体内各激素、腺体之间的信号传递等过程较为复杂,NBFRs的内分泌干扰毒性在不同的生物体中的产生机制、作用方式等仍不够清晰明确,有待进一步研究。
4 发育毒性(Developmental toxicity)
传统的PBDEs已被证实具有发育毒性,BDE-47会引发斑马鱼的发育异常,包括孵化延迟和生长减少、身体背侧弯曲异常以及一些心脏缺陷等[48],除BDE-47外其他同系物如BDE-28、BDE-99和BDE-100也能够导致斑马鱼的发育异常[49]。此外,研究发现TBBPA[50]和HBCD[30]也能够引发斑马鱼的行为和发育异常。目前的研究表明,部分NBFRs也具有与传统BFRs类似的发育毒性效应(表5)。Wang等[51]的研究表明,1 μmol·L-1的TBECH会影响斑马鱼幼鱼的运动能力,抑制游泳行为,对其游泳距离和速度均有影响;10 μmol·L-1的TBECH能够降低斑马鱼胚胎的孵化成功率(72 hpf:59%;96 hpf:73%),同时也降低了斑马鱼胚幼鱼心率,并导致形态学异常。Nakari和Huhtala[35]的研究表明,暴露在25 μg·L-1的DBDPE中能够使斑马鱼卵的孵化成功比例降低至空白对照组的60%,而12.5 μg·L-1对斑马鱼卵孵化成功比例几乎没有影响;但12.5 μg·L-1和25 μg·L-1的DBDPE均能够使得斑马鱼幼鱼的死亡率高于空白对照组。Usenko等[30]的研究结果表明,TBBPA、HBB等NBFRs能够引起斑马鱼胚胎的死亡,其中TBBPA的LC50最低(1.45 mg·L-1),毒性最强,其衍生物2,2-双[4-(2-羟基乙氧基)-3,5-二溴苯基]丙烷(TBBPA-OHEE)毒性相似,LC50为2.2 mg·L-1;而TBPH和二溴新戊二醇(DBNPG)2种NBFRs不会导致斑马鱼胚胎的死亡,LC50>20 mg·L-1。虽然部分NBFRs已经被证实具有生物发育毒性,能够降低斑马鱼胚胎孵化率提高幼鱼死亡率,但研究集中在斑马鱼及其幼体中,更广泛的发育毒性研究还需要进一步关注。
表5 常见新型溴代阻燃剂发育毒性
Table 5 Developmental toxicity of NBFRs

NBFRs受试生物Subjects暴露方式Exposure route暴露时间Duration毒性指标End point浓度Concentration参考文献ReferencesDBDPE斑马鱼Zebrafish//鱼卵孵化成功率降低至60%Hatching rate reduce to 60%25 μg·L-1[35]TBECH斑马鱼Zebrafish幼鱼暴露Zebrafish larvae exposed72/96 hpf胚胎孵化成功率: 59%/73%Hatching rate: 59%/ 73%10 μmol·L-1[51]斑马鱼Zebrafish幼鱼暴露Zebrafish larvae exposed6 dpf游泳速度和距离降低Free swimming distance diminished0.01~1 μmol·L-1[51]
虽然部分NBFRs已经被证实具有生物发育毒性,能够降低斑马鱼胚胎孵化率提高幼鱼死亡率,但目前已经研究的NBFRs种类仍较少,如HBB、PBT等目前使用量逐渐增多的NBFRs发育毒性数据仍不够全面,不能够完整评价NBFRs作为BFRs的替代品所可能会出现的潜在生态毒性风险。同时,现有发育毒性的相关研究多集中在斑马鱼及其幼体中,更广泛的发育毒性如哺乳动物中的研究还需要进一步开展。
5 生态风险评价(Ecological risk assessment)
由于NBFRs水溶性差、脂溶性强的特性,导致其易进入生物体内并积累,使得NBFRs在一定程度上存在生物积累效应,导致潜在的生态风险。生物富集(bioconcentration),是指生物机体从环境中蓄积某种元素或难分解的化合物,使生物体内该物质的浓度超过在环境中浓度的现象。生物放大(biomagnification)是指在食物链中,某种元素或难分解的化学物随营养级的提高而富集系数逐渐增高的现象。生物积累(bioaccumulation)是指同一生物随着其生长发育期的延长或随着其年龄增长,环境中某元素或难分解化学物的富集系数也不断增大的现象,是生物富集和生物放大共同作用的结果[28]。分别使用生物富集系数(BCF)、生物放大系数(BMF)和生物积累系数(BAF)来体现。
目前研究结果表明,NBFRs的生物积累、富集和放大效应与NBFRs的种类、生物种类、研究区域等有关。He等[22]在中国东江区域采样研究得到,DBDPE在东江3种鱼类中BAF为6.1~7.1,说明在该流域DBDPE在3种鱼类中存在生物积累效应。Wu等[52]在中国广东省清远市龙塘镇电子废物回收站附近的池塘中进行采样,每年约有170万t电子废物在该地区拆解,池塘中BTBPE的BAF值为3.32~6.08,存在生物积累效应。Mo等[53]在中国南方某电子废物回收站附近采样得到,饵料鱼/翠鸟体内BTBPE的BMF为1.90~3.60,能够说明翠鸟对BTBPE具有生物放大作用,但DBDPE在饵料鱼/翠鸟的食物链中BMF为0.10~0.77,不存在生物放大作用。在加拿大温尼伯湖的食物网中测得的BTBPE在3条碧古鱼的食物链中均具有生物放大效应,碧古鱼/白亚口鱼(walleye/white suckers)、碧古鱼/白鲑鱼(walleye/white fish)和碧古鱼/金目鱼(walleye/goldeye)的BMF分别为2.5、2.4和1.1,但在该湖其他的食物链中BTBPE的BMF值<1,没有发现生物放大现象[54]。Hou等[55]发现中国南海西沙群岛的珊瑚礁水域中一个包含29种生物的食物网中有11种NBFRs都具有生物放大作用,BAFs为无脊椎动物2.28~3.41,鱼类3.23~3.71;营养级放大因子(TMF)为1.53~5.32。以上结果表明,NBFRs能够在食物链和食物网中进行传递和富集,使得其环境存在愈加广泛,存在一定程度的生态风险。
为考察NBFRs对生态环境和人类健康的风险,常使用风险商(RQ)来评价物质的生态风险水平,RQ为环境浓度(MEC)和预测无效应浓度(PNEC)的比值,RQ可分为几个等级:RQ<1.0表示无显著风险;1.0≤RQ<10表示没有潜在的不良反应;10≤RQ<100表示显著的不良反应;RQ≥100表示应预期潜在的不良反应。部分NBFRs的RQ值如表6所示,其中化合物的PNEC值由实验获得或使用LC50/1000或EC50/1000,大部分NBFRs的RQ值都远<1,生态风险较低,如BTBPE,RQ值通过MEC(5.22 ng·L-1)和PNEC(0.53 μg·L-1)比值计算得到为0.01;RQ最高的是TBPH(8.97),其中MEC值为13 900 ng·g-1 (以干质量计),PNEC(沉积物)值为1.55 mg·kg-1 (以干质量计)。Hou等[56]对全球范围内NBFRs的RQ值进行了估算,不同区域NBFRs的RQ值变化较大,呈现一定程度的区域特性,如在NBFRs浓度较高的工业区沉积物中,几种NBFRs的RQ值均>1.0。现有的RQ值显示,作为传统溴代阻燃剂的替代品NBFRs的生态风险较低,但由于其亲脂性能够在食物链和食物网中产生生物积累和放大效应,因此评判其潜在的生态风险和危害还需要更多的毒性数据。
表6 常见新型溴代阻燃剂的在水体和沉积物中的PNECs和RQ值
Table 6 PNECs and RQ of NBFRs

NBFRs受试生物SubjectsEC50/LC50PNECs(水体)PNECs (Water)PNECs(沉积物)PNECs (Sediment)MECRQ参考文献ReferencesHBB斑马鱼ZebrafishLC50:10.7 mg·L-110.7 μg·L-11.55 mg·kg-1(以干质量计 Based on dry mass)9.43 ng·L-10.006[57]TBPH大型溞Daphnia magnaLC50:0.91 mg·L-10.91 μg·L-11.55 mg·kg-1(以干质量计 Based on dry mass)黑虫LumbriculusvariegatusNOEC/≥127 mg·kg-1(以干质量计 Based on dry mass)13.9 μg·g-18.97[29][58]DBDPE大型溞Daphnia magnaEC50:19 μg·L-10.0019 μg·L-1/10.8 pg·L-10.0057[35]溪流摇蚊ChironomusripariusNOEC/100 mg·kg-1(以干质量计 Based on dry mass)247 ng·g-10.0247[34]BTBPE//0.53 μg·L-1/5.22 ng·L-10.01[1]TBBPA-DBPE斑马鱼ZebrafishEC50:100 mg·L-1100 μg·L-1(淡水 Freshwater)10 μg·L-1(海水 Seawater)927 μg·g-1(淡水 Freshwater)92.7 μg·g-1(海水 Seawater)4.53 μg·g-10.0049[56]PBEB/NOEC:20.1 μg·L-10.201 μg·L-1(淡水 Freshwater)0.0201 μg·L-1(海水 Seawater)1.55 μg·g-1(淡水 Freshwater)0.155 μg·g-1(海水 Seawater)32 pg·L-10.00016[56]
注:MEC表示环境浓度,RQ表示风险商,PNECs表示预测无效应浓度,其值是参考Xiong等[1]和Hou等[56]的研究计算结果。
Note: MEC refers to measured environmental concentration, RQ refers to risk quotient; PNECs refers to predicted no effect concentration, and the value of PNECs refers to Xiong[1] and Hou[56]’s research and calculation results.
6 结论与展望(Conclusion and prospects)
随着NBFRs被越来越多地生产和使用,导致其在各个环境介质以及生物体内都有检出。与传统BFRs相同的是,NBFRs同样具有远距离迁移的能力。NBFRs会对生物体产生急性或者慢性毒性效应,如肝脏毒性、内分泌干扰毒性和发育毒性等。同时,NBFRs具有一定的生物累积效应,并能随着食物链产生生物积累、富集和放大效应,对生态环境和人类健康存在潜在的风险。然而,目前对NBFRs的毒性研究数据仍不够充分,不同的研究会得出相反的结论,而且目前的研究多集中在实验室的简单体系,暴露浓度较高,因此未来的研究需要考虑实验方法的标准化和可靠性,并进行低浓度的NBFRs暴露实验研究,同时兼顾环境的复杂性和污染的多样性。对于NBFRs急性毒性的研究,还应进一步补充开展在更高营养级的生物如哺乳动物中的急性毒性研究,并探究在实际环境介质中的急性毒性情况;内分泌干扰毒性的作用机制目前尚不明确,也有待进一步探究;发育毒性多集中在某一2种NBFRs中,毒性数据不够全面,需要进一步补充。
由于NBFRs具有高Kow值、低挥发性等特性,导致其容易被吸附和迁移到土壤、沉积物和有机质等固体介质中,进而影响其生物有效性。此外,NBFRs也可以发生光降解、生物降解等转化过程,这些过程都会影响NBFRs的毒性效应,但这方面的研究结果缺乏。总之,虽然目前已有较多关于NBFRs毒性的研究,但是其致毒机制和在实际环境中的毒性效应仍需进一步研究,也需关注NBFRs在不同食物链中的生物富集、积累和放大效应带来的生态风险。
[1] Xiong P, Yan X T, Zhu Q Q, et al. A review of environmental occurrence, fate, and toxicity of novel brominated flame retardants [J]. Environmental Science &Technology, 2019, 53(23): 13551-13569
[2] 李晨光. 几种卤代有机污染物在液/固和气/固非均相体系中的光化学转化行为研究[D]. 南京: 南京大学, 2020: 3-4
[3] Sharkey M, Harrad S, Abou-Elwafa Abdallah M, et al. Phasing-out of legacy brominated flame retardants: The UNEP Stockholm Convention and other legislative action worldwide [J]. Environment International, 2020, 144: 106041
[4] 童艺, 程伊雪, 吴冠履, 等. 新型溴系阻燃剂环境污染现状研究进展[J]. 环境化学, 2021, 40(1): 83-101
Tong Y, Cheng Y X, Wu G L, et al. Current research progress on environmental pollution of novel brominated flame retardant [J]. Environmental Chemistry, 2021, 40(1): 83-101 (in Chinese)
[5] Ali N, Shahzad K, Rashid M I, et al. Currently used organophosphate and brominated flame retardants in the environment of China and other developing countries (2000-2016) [J]. Environmental Science and Pollution Research International, 2017, 24(23): 18721-18741
[6] Clariant Plastics &Coatings (Deutschland) GmbH. Flame Retardants-online. Global Flame Retardants Market by Chemistry [EB/OL]. [2022-04-01]. http://www.flameretardants-online.com/flame-retardants/market
[7] Tian M, Chen S J, Wang J, et al. Brominated flame retardants in the atmosphere of E-waste and rural sites in Southern China: Seasonal variation, temperature dependence, and gas-particle partitioning [J]. Environmental Science &Technology, 2011, 45(20): 8819-8825
[8] Zhang W W, Wang P, Zhu Y, et al. Brominated flame retardants in atmospheric fine particles in the Beijing-Tianjin-Hebei Region, China: Spatial and temporal distribution and human exposure assessment [J]. Ecotoxicology and Environmental Safety, 2019, 171: 181-189
[9] Nyholm J R, Grabic R, Arp H P, et al. Environmental occurrence of emerging and legacy brominated flame retardants near suspected sources in Norway [J]. The Science of the Total Environment, 2013, 443: 307-314
[10] Wang Y, Wu X W, Zhao H X, et al. Characterization of PBDEs and novel brominated flame retardants in seawater near a coastal mariculture area of the Bohai Sea, China [J]. The Science of the Total Environment, 2017, 580: 1446-1452
[11] Venier M, Dove A, Romanak K, et al. Flame retardants and legacy chemicals in Great Lakes’ water [J]. Environmental Science &Technology, 2014, 48(16): 9563-9572
[12] La Guardia M J, Hale R C, Newman B. Brominated flame-retardants in Sub-Saharan Africa: Burdens in inland and coastal sediments in the eThekwini metropolitan municipality, South Africa [J]. Environmental Science &Technology, 2013, 47(17): 9643-9650
[13] Shi T, Chen S J, Luo X J, et al. Occurrence of brominated flame retardants other than polybrominated diphenyl ethers in environmental and biota samples from Southern China [J]. Chemosphere, 2009, 74(7): 910-916
[14] Yang R Q, Wei H, Guo J H, et al. Emerging brominated flame retardants in the sediment of the Great Lakes [J]. Environmental Science &Technology, 2012, 46(6): 3119-3126
[15] McGrath T J, Morrison P D, Ball A S, et al. Concentrations of legacy and novel brominated flame retardants in indoor dust in Melbourne, Australia: An assessment of human exposure [J]. Environment International, 2018, 113: 191-201
[16] Hassan Y, Shoeib T. Levels of polybrominated diphenyl ethers and novel flame retardants in microenvironment dust from Egypt: An assessment of human exposure [J]. The Science of the Total Environment, 2015, 505: 47-55
[17] Venkatesan A K, Halden R U. Brominated flame retardants in U.S. biosolids from the EPA national sewage sludge survey and chemical persistence in outdoor soil mesocosms [J]. Water Research, 2014, 55: 133-142
[18] Besis A, Christia C, Poma G, et al. Legacy and novel brominated flame retardants in interior car dust-Implications for human exposure [J]. Environmental Pollution, 2017, 230: 871-881
[19] Li C G, Zuo J L, Liang S J, et al. Photodegradation of decabromodiphenyl ethane (DBDPE) adsorbed on silica gel in aqueous solution: Kinetics, products, and theoretical calculations [J]. Chemical Engineering Journal, 2019, 375: 121918
[20] Qi H, Li W L, Liu L Y, et al. Brominated flame retardants in the urban atmosphere of Northeast China: Concentrations, temperature dependence and gas-particle partitioning [J]. The Science of the Total Environment, 2014, 491-492: 60-66
[21] Qiu X H, Zhu T, Hu J X. Polybrominated diphenyl ethers (PBDEs) and other flame retardants in the atmosphere and water from Taihu Lake, East China [J]. Chemosphere, 2010, 80(10): 1207-1212
[22] He M J, Luo X J, Chen M Y, et al. Bioaccumulation of polybrominated diphenyl ethers and decabromodiphenyl ethane in fish from a river system in a highly industrialized area, South China [J]. Science of the Total Environment, 2012, 419: 109-115
[23] Zhang H, Bayen S, Kelly B C. Multi-residue analysis of legacy POPs and emerging organic contaminants in Singapore’s coastal waters using gas chromatography-triple quadrupole tandem mass spectrometry [J]. Science of the Total Environment, 2015, 523: 219-232
[24] Wang Q, Kelly B C. Occurrence and distribution of halogenated flame retardants in an urban watershed: Comparison to polychlorinated biphenyls and organochlorine pesticides [J]. Environmental Pollution, 2017, 231: 252-261
[25] Möller A, Xie Z Y, Sturm R, et al. Polybrominated diphenyl ethers (PBDEs) and alternative brominated flame retardants in air and seawater of the European Arctic [J]. Environmental Pollution, 2011, 159(6): 1577-1583
[26] Feng M B, Li Y, Qu R J, et al. Oxidative stress biomarkers in freshwater fish Carassius auratus exposed to decabromodiphenyl ether and ethane, or their mixture [J]. Ecotoxicology, 2013, 22(7): 1101-1110
[27] ![]() L P, et al. Comparison of in vitro hormone activities of novel flame retardants TBB, TBPH and their metabolites TBBA and TBMEPH using reporter gene assays [J]. Chemosphere, 2016, 160: 244-251
L P, et al. Comparison of in vitro hormone activities of novel flame retardants TBB, TBPH and their metabolites TBBA and TBMEPH using reporter gene assays [J]. Chemosphere, 2016, 160: 244-251
[28] 孟紫强. 生态毒理学[M]. 北京: 高等教育出版社, 2009: 75-76, 150
[29] Scanlan L D, Loguinov A V, Teng Q, et al. Gene transcription, metabolite and lipid profiling in eco-indicator Daphnia magna indicate diverse mechanisms of toxicity by legacy and emerging flame-retardants [J]. Environmental Science &Technology, 2015, 49(12): 7400-7410
[30] Usenko C Y, Abel E L, Hopkins A, et al. Evaluation of common use brominated flame retardant (BFR) toxicity using a zebrafish embryo model [J]. Toxics, 2016, 4(3): 21
[31] Harju M, Heimstad E S, Herzke D, et al. Emerging “new” brominated flame retardants in flame retarded products and the environment [R].Horten: Norwegian Pollution Control Authority, 2009
[32] Dong L Y, Wang S T, Qu J Z, et al. New understanding of novel brominated flame retardants (NBFRs): Neuro(endocrine) toxicity [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111570
[33] Hardy M L, Margitich D, Ackerman L, et al. The subchronic oral toxicity of ethane, 1,2-bis(pentabromophenyl) (Saytex 8010) in rats [J]. International Journal of Toxicology, 2002, 21(3): 165-170
[34] Hardy M L, Krueger H O, Blankinship A S, et al. Studies and evaluation of the potential toxicity of decabromodiphenyl ethane to five aquatic and sediment organisms [J]. Ecotoxicology and Environmental Safety, 2012, 75(1): 73-79
[35] Nakari T, Huhtala S. In vivo and in vitro toxicity of decabromodiphenyl ethane, a flame retardant [J]. Environmental Toxicology, 2010, 25(4): 333-338
[36] National Institute for Occupational Safety and Health (NIOSH). Registry of Toxic Effects of Chemical Substances (RTECS) [DB]. [2022-04-01]. URL: http://www.cdc.gov/niosh/rtecs/
[37] Szymańska J A. Hepatotoxicity of brominated benzenes: Relationship between chemical structure and hepatotoxic effects in acute intoxication of mice [J]. Archives of Toxicology, 1997, 72(2): 97-103
[38] Egloff C, Crump D, Chiu S, et al. In vitro and in ovo effects of four brominated flame retardants on toxicity and hepatic mRNA expression in chicken embryos [J]. Toxicology Letters, 2011, 207(1): 25-33
[39] Marteinson Sarah C, Letcher Robert J, Fernie Kimberly J. Exposure to the androgenic brominated flame retardant 1,2-dibromo-4-(1,2-dibromoethyl)-cyclohexane alters reproductive and aggressive behaviors in birds [J]. Environmental Toxicology and Chemistry, 2015, 34(10): 2395-2402
[40] Jin M Q, Zhang D, Zhang Y, et al. Neurological responses of embryo-larval zebrafish to short-term sediment exposure to decabromodiphenylethane [J]. Journal of Zhejiang University-Science B, 2018, 19(5): 400-408
[41] Sun R B, Shang S, Zhang W, et al. Endocrine disruption activity of 30-day dietary exposure to decabromodiphenyl ethane in Balb/C mouse [J]. Biomedical and Environmental Sciences, 2018, 31(1): 12-22
[42] Smythe T A, Butt C M, Stapleton H M, et al. Impacts of unregulated novel brominated flame retardants on human liver thyroid deiodination and sulfotransferation [J]. Environmental Science &Technology, 2017, 51(12): 7245-7253
[43] Ezechiáš M, Svobodová K, Cajthaml T. Hormonal activities of new brominated flame retardants [J]. Chemosphere, 2012, 87(7): 820-824
[44] Curran I H, Liston V, Nunnikhoven A, et al. Toxicologic effects of 28-day dietary exposure to the flame retardant 1,2-dibromo-4-(1,2-dibromoethyl)-cyclohexane (TBECH) in F344 rats [J]. Toxicology, 2017, 377: 1-13
[45] Marteinson S C, Fernie K J. Is the current-use flame retardant, DBE-DBCH, a potential obesogen? Effects on body mass, fat content and associated behaviors in American kestrels [J]. Ecotoxicology and Environmental Safety, 2019, 169: 770-777
[46] Larsson A, Eriksson L A, Andersson P L, et al. Identification of the brominated flame retardant 1,2-dibromo-4-(1,2-dibromoethyl)cyclohexane as an androgen agonist [J]. Journal of Medicinal Chemistry, 2006, 49(25): 7366-7372
[47] Khalaf H, Larsson A, Berg H, et al. Diastereomers of the brominated flame retardant 1,2-dibromo-4-(1,2 dibromoethyl)cyclohexane induce androgen receptor activation in the HepG2 hepatocellular carcinoma cell line and the LNCap prostate cancer cell line [J]. Environmental Health Perspectives, 2009, 117(12): 1853-1859
[48] Lema S C, Schultz I R, Scholz N L, et al. Neural defects and cardiac arrhythmia in fish larvae following embryonic exposure to 2,2’,4,4’-tetrabromodiphenyl ether (PBDE 47) [J]. Aquatic Toxicology, 2007, 82(4): 296-307
[49] Usenko Crystal Y, Robinson Eleanor M, Sascha U, et al. PBDE developmental effects on embryonic zebrafish [J]. Environmental Toxicology and Chemistry, 2011, 30(8): 1865-1872
[50] Wu S M, Ji G X, Liu J N, et al. TBBPA induces developmental toxicity, oxidative stress, and apoptosis in embryos and zebrafish larvae (Danio rerio) [J]. Environmental Toxicology, 2016, 31(10): 1241-1249
[51] Wang X, Wei L, Wang Y, et al. Evaluation of development, locomotor behavior, oxidative stress, immune responses and apoptosis in developing zebrafish (Danio rerio) exposed to TBECH (tetrabromoethylcyclohexane) [J]. Comparative Biochemistry and Physiology Toxicology &Pharmacology, 2019, 217: 106-113
[52] Wu J P, Guan Y T, Zhang Y, et al. Several current-use, non-PBDE brominated flame retardants are highly bioaccumulative: Evidence from field determined bioaccumulation factors [J]. Environment International, 2011, 37(1): 210-215
[53] Mo L, Wu J P, Luo X J, et al. Bioaccumulation of polybrominated diphenyl ethers, decabromodiphenyl ethane, and 1,2-bis(2,4,6-tribromophenoxy) ethane flame retardants in kingfishers (Alcedo atthis) from an electronic waste-recycling site in South China [J]. Environmental Toxicology and Chemistry, 2012, 31(9): 2153-2158
[54] Law K, Halldorson T, Danell R, et al. Bioaccumulation and trophic transfer of some brominated flame retardants in a Lake Winnipeg (Canada) food web [J]. Environmental Toxicology and Chemistry, 2006, 25(8): 2177-2186
[55] Hou R, Huang Q Y, Pan Y F, et al. Novel brominated flame retardants (NBFRs) in a tropical marine food web from the South China Sea: The influence of hydrophobicity and biotransformation on structure-related trophodynamics [J]. Environmental Science &Technology, 2022, 56(5): 3147-3158
[56] Hou R, Lin L, Li H X, et al. Occurrence, bioaccumulation, fate, and risk assessment of novel brominated flame retardants (NBFRs) in aquatic environments - A critical review [J]. Water Research, 2021, 198: 117168
[57] European Chemicals Bureau. European Union Risk Assessment Report: Diphenyl Ether, Pentabromo Derivative (Pentabromodiphenyl Ether) [R]. Luxembourg: European Chemicals Bureau, European Commission, 2001
[58] European Chemicals Bureau. European Union Risk Assessment Report: Diphenyl Ether, Octabromo Derivative [R]. Luxembourg: European Chemicals Bureau, European Commission, 2003