现代农业中,使用农药的种类和数量越来越多。农药是把“双刃剑”,它能解放农业生产力、减少农产品产量损失,但滥用农药会造成环境污染、人畜中毒等严重后果,人们通过皮肤接触、饮食摄入和呼吸暴露于农药[1]。农药对生物具有多种毒性,主要包括生殖毒性、内分泌干扰毒性和神经系统毒性等,对人类健康造成严重威胁。长期低剂量接触有机磷农药会降低男性精子存活率,影响受精能力及精液的染色质结构[2]。
毒死蜱是一种广谱有机磷农药,在世界范围内广泛使用,其半衰期较长,能够长时间存在于土壤和水中[3]。毒死蜱可以损伤神经系统、生殖系统和免疫系统等,现有研究表明其可导致雄性大鼠精子数量减少、生存能力降低,睾酮等生殖激素水平明显降低[4]。长期暴露于毒死蜱会导致各种生殖系统缺陷,比如男性生殖系统功能退化和不育[5]。Vahabi Barzi等[6]的研究表明,毒死蜱损伤小鼠生殖系统,诱导胚胎发育中的细胞凋亡,进而导致流产。毒死蜱暴露后,诱导GC-1细胞活性氧(ROS)水平升高,并导致细胞凋亡[7]。三唑类杀菌剂是一类具有独特1,2,4-三唑环结构的杀菌剂,在农业生产中应用非常广泛[8]。苯醚甲环唑作为三唑类中应用广泛的农药之一,更易进入环境中造成污染,对人体健康产生威胁。长期暴露于苯醚甲环唑降低海洋青鳉鱼下一代的繁殖力和生存力[9]。Li等[10]的研究结果表明,苯醚甲环唑诱导小鼠巨噬细胞核溶解,提高细胞凋亡率。苯醚甲环唑暴露后,显著降低大鼠睾丸内精子数量,诱导组织结构改变和DNA损伤[11]。此外,苯醚甲环唑诱导SH-SY5Y细胞DNA损伤,提高细胞凋亡率[12]。已有研究报道单一农药以及农药和金属物质混用对生物的毒性作用,鲜有报道研究多种农药联合暴露的生殖毒性作用。
精子的产生是一个复杂而连续的过程,包括精原细胞增殖、精母细胞减数分裂和精子细胞向精子的分化,其中,精原细胞在精子产生中起着至关重要的作用,在维持正常精子数量方面具有重要的生理意义[13-14]。目前的研究表明,毒死蜱和苯醚甲环唑在单独暴露时具有明显的生殖毒性,但关于毒死蜱和苯醚甲环唑联合暴露生殖毒性效应与机制的研究较少。因此,以小鼠精原细胞GC-1为模型,通过对不同浓度农药进行细胞活力检测,测定毒死蜱和苯醚甲环唑单独和联合暴露后其ROS、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)和丙二醛(MDA)等氧化应激指标水平,并验证凋亡相关蛋白的表达情况,从而研究毒死蜱和苯醚甲环唑单独和联合暴露对GC-1细胞的毒性作用,为评估这2种农药对生殖系统的毒性作用提供依据。
1 材料与方法(Materials and methods)
1.1 材料
毒死蜱(chlorpyrifos, CPF)标准品(CAS: 2921-88-2,纯度≥99.6%,Dr. Ehrenstorfer GmbH,德国),苯醚甲环唑(difenoconazole, DFC)标准品(CAS: 119446-68-3,纯度≥99.5%,Dr. Ehrenstorfer GmbH,德国),小鼠精原细胞GC-1(实验室原有),DMEM高糖培养基(Hyclone,美国),胎牛血清(GIBCO,美国),0.25%胰蛋白酶(中科迈晨(北京)科技有限公司,中国),青链霉素联合液(Hyclone,美国),二甲基亚砜(DMSO,AppliChem,德国),Celltiter-Glo(Promega,美国),ROS、MDA和GSH检测试剂盒(南京建成生物工程研究所,中国),线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司,中国),PE偶联Annexin V细胞凋亡检测试剂盒(BD Bioscience,美国);PARP一抗(CST:9532),Cleaved-PARP一抗(CST:94885),Caspase3一抗(CST:9662),Cleaved-Caspase3一抗(CST:9664),Bax一抗(武汉塞维尔,GB11690),β-Tublin一抗(CST:2128)。
1.2 细胞培养与染毒
GC-1细胞用含有10%胎牛血清、1%青链霉素联合液的DMEM完全培养基,于37 ℃、5% CO2细胞恒温培养箱中培养。在细胞密度为90%时进行传代培养,隔天换液,保证细胞处于对数生长期。根据Wang等[15]的研究,后续实验的浓度基于毒死蜱和苯醚甲环唑2种药物的半抑制浓度(IC50)设置。
1.3 细胞活力检测
将毒死蜱、苯醚甲环唑2种标准品用DMSO溶解配制成浓度为500 mmol·L-1的储备液,于-20 ℃保存。调整对数期细胞密度接种至96孔板,待细胞密度达到80%时,将农药储备液用DMEM完全培养基稀释至0、0.195、0.039、0.078、0.156、0.313、0.625、1.25、2.50和5.00 mmol·L-1,并将不同浓度毒死蜱、苯醚甲环唑按每孔100 μL加入至96孔板中继续培养。暴露24 h后,每孔加入50 μL Celltiter-Glo试剂,在15 min内通过酶标仪检测其发光度,确定IC50,并检测0、12、24、36和48 h的细胞生存率,得到相应的剂量-时间效应结果。
1.4 ROS含量检测
采用DCFH-DA荧光探针法检测细胞内ROS含量。取对数生长期细胞,加入2种药物的单独和联合组合于T25细胞培养瓶中,DMSO溶剂作为对照。刺激细胞24 h后,按照ROS测试盒说明书加入DCFH-DA,37 ℃孵育30 min,然后加入胰酶细胞消化,加入培养基终止消化后离心,PBS清洗,收集细胞沉淀用PBS重悬,用酶标仪检测细胞内ROS。
1.5 氧化应激指标检测
取对数生长期的细胞,加入2种药物的单独和联合组合,对照组为DMSO溶剂。刺激细胞24 h。除去多余培养基,洗涤1次,充分裂解细胞。12 000 r·min-1、4 ℃离心5 min,取上清液待测。按照MDA检测试剂盒说明书配制MDA检测工作液,向每组样品中加入适量MDA检测工作液,沸水浴加热15 min。冷却至室温后,1 000 r·min-1离心10 min,取上清液测定532 nm处的吸光度值,通过计算得出样品中MDA的含量。按照SOD检测试剂盒说明书配制酶工作液以及反应启动工作液,向每组样品中加入适量工作液和缓冲液,充分震荡混匀,37 ℃孵育30 min,立即测定450 nm处吸光度值,计算得到样品中SOD的活性。按照GSH检测试剂盒说明书配制总谷胱甘肽检测工作液以及GSH清除试剂工作液,向每组样品中加入适量工作液,充分混匀,25 ℃孵育5 min。然后向混合反应体系加入50 μL 0.5 mg·mL-1 NADPH溶液终止反应,充分混匀后立即测定412 nm处的吸光度值,每5 min测定一次,共测定5次,历时25 min,分别计算总谷胱甘肽和氧化型谷胱甘肽(GSSG)的含量,然后计算GSH的含量。
1.6 细胞线粒体膜电位检测
取对数生长期细胞,加入2种药物的单独和联合组合,对照组为DMSO溶剂。刺激细胞24 h后,除去多余培养基并用PBS清洗,加入胰酶消化细胞,收集细胞并重悬。然后按照试剂盒说明书配制JC-1染色工作液和染色缓冲液,每组加入0.5 mL染色工作液后混匀放入细胞培养箱中37 ℃孵育20 min;取出后600 g离心5 min,弃上清液并用染色缓冲液洗涤2次;0.5 mL染色缓冲液重悬细胞后用流式细胞仪进行检测。
1.7 细胞凋亡检测
取对数生长期细胞,加入2种药物的单独和联合组合,对照组为DMSO溶剂。刺激细胞24 h后,消化离心收集细胞,加入1 mL PBS缓冲溶液重悬细胞,再次离心完成后加入1 mL试剂盒缓冲液重悬细胞。所有样品管取300 μL至流式管中,每支流式管中加入2 μL 7-AAD和PE试剂,100 μL稀释后的缓冲液,室温下避光染色5~15 min,在1 h内用流式细胞仪进行检测。
1.8 Western blot分析
常规收集各处理组的细胞提取总蛋白,用BCA法测定蛋白浓度。定量后将蛋白样品置于金属浴中100 ℃煮沸10 min,蛋白样品进行聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳至溴酚蓝接近分离胶底部时停止;转膜前,用甲醇激活PVDF膜,将蛋白质由聚丙烯酰胺凝胶转移至0.20 μm PVDF膜;结束后采用5%脱脂奶粉封闭PVDF膜,室温孵育2 h;封闭结束后,用TBST快速洗膜3次,每次5~10 min;按照抗体说明书,配制适当浓度的一抗孵育液,4 ℃孵育过夜;TBST洗膜3次,每次5~10 min,然后放于合适浓度的二抗孵育液中室温孵育1 h,TBST再次洗膜3次,每次5~10 min;清洗好的PVDF膜上滴加适量发光显迹液,暴露于化学发光成像分析系统中检测蛋白的表达。利用Image J软件分析灰度值,确定蛋白的相对表达量。
1.9 统计学分析
使用SPSS 23.0进行统计学分析,实验数据以Mean±SD表示,多组间均数的比较采用单因素方差分析,多个实验组与一个对照组均数的比较用Dunnett法,P<0.05为差异有统计学意义。
2 结果(Results)
2.1 细胞活力检测
为评估毒死蜱、苯醚甲环唑单独暴露以及2种药物联合暴露对GC-1细胞的影响,通过Cell titer检测细胞暴露于农药后的细胞活力。结果显示,随着药物浓度的增加,细胞活力随之下降(图1(a)~(b))。计算得到毒死蜱、苯醚甲环唑对GC-1细胞的IC50分别为158.5 μmol·L-1和89.57 μmol·L-1。后续实验使用浓度为毒死蜱200 μmol·L-1,苯醚甲环唑120 μmol·L-1;联合组为毒死蜱200 μmol·L-1+苯醚甲环唑120 μmol·L-1。正常的GC-1细胞呈上皮样细胞状,暴露于不同浓度的毒死蜱和苯醚甲环唑24 h后,随着染毒浓度的增加细胞形态逐渐呈不规则状,出现圆形、回缩和细胞体积变小等变化。且在毒死蜱和苯醚甲环唑联合暴露组中,细胞形态改变情况更为显著(图1(c))。此外,研究毒死蜱、苯醚甲环唑2种药物单独和联合暴露对细胞活力影响与时间的效应关系可知,随着时间的增加,每组细胞活力都有增长,但与对照组细胞相比其生长明显受到抑制(图1(d)~(f))。
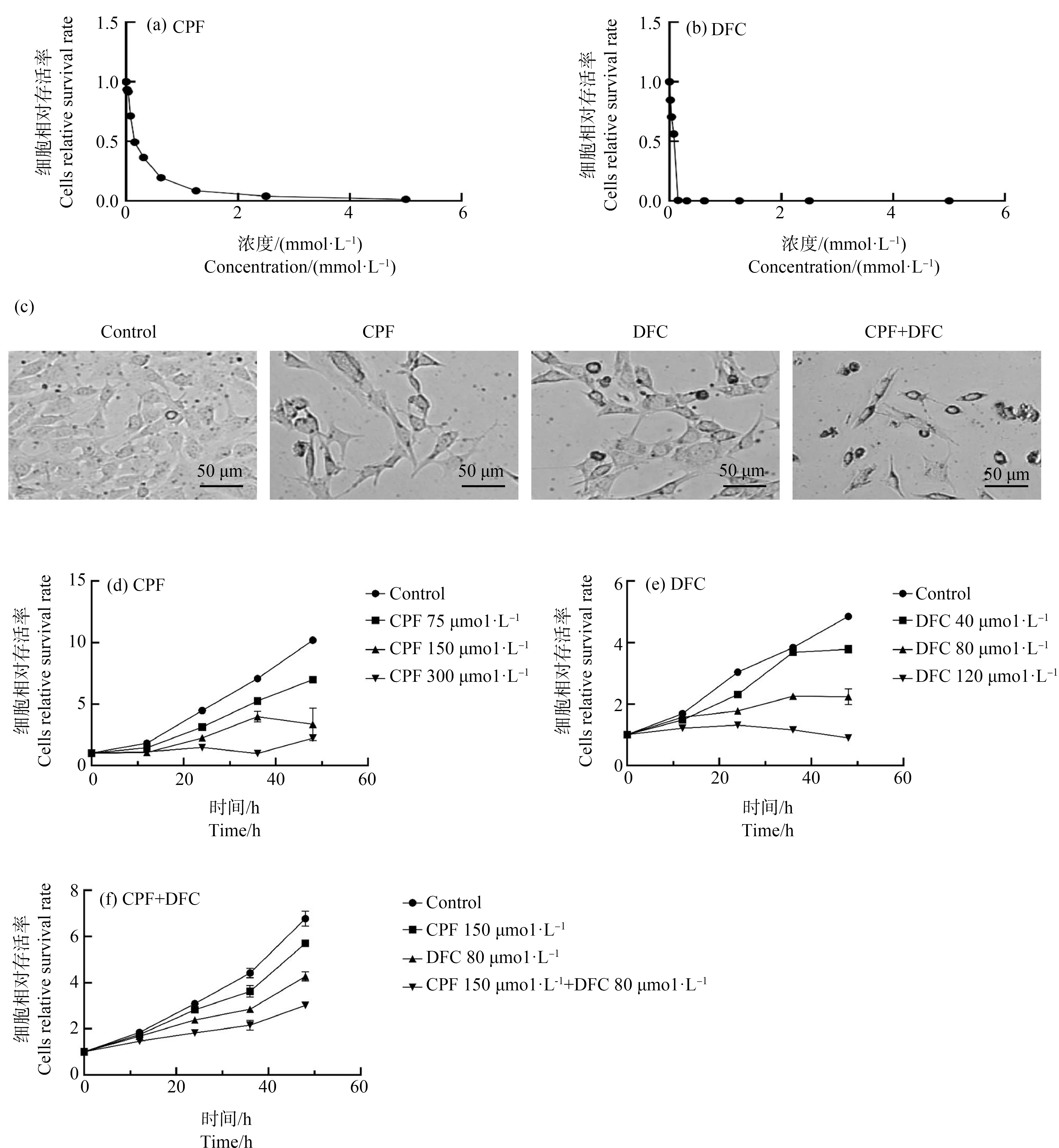
图1 不同浓度毒死蜱(CPF)和苯醚甲环唑(DFC)对细胞活力的影响
注:(a) 不同浓度毒死蜱对GC-1细胞活力的影响;
(b) 不同浓度苯醚甲环唑对GC-1细胞活力的影响;(c) 毒死蜱、苯醚甲环唑单独和联合暴露下的细胞形态(50 μm);(d) 不同浓度毒死蜱
(0、75、150和300 μmol·L-1)暴露与GC-1细胞活力的时间效应曲线;(e) 不同浓度苯醚甲环唑(0、40、80和120 μmol·L-1)
暴露与GC-1细胞活力的时间效应曲线;(f) 毒死蜱、苯醚甲环唑联合暴露与GC-1细胞活力的时间效应曲线。
Fig. 1 Effects of chlorpyrifos (CPF) and difenoconazole (DFC) at different concentrations on cell viability
Note: (a) Effects of chlorpyrifos at different concentrations on cell viability of GC-1 cells; (b) Effects of difenoconazole at different concentrations
on cell viability of GC-1 cells; (c) Cell morphology in groups exposed to different concentrations of chlorpyrifos and difenoconazole (50 μm);
(d) Effects of chlorpyrifos at different concentrations (0, 75, 150 and 300 μmol·L-1) on cell viability of GC-1 cells after 0, 12, 24, 36 and 48 h
exposure; (e) Effects of difenoconazole at different concentrations (0, 40, 80 and 120 μmol·L-1) on cell viability of GC-1 cells after 0, 12, 24, 36
and 48 h exposure; (f) Effects of chlorpyrifos and difenoconazole on cell viability of GC-1 cells after 0, 12, 24, 36 and 48 h exposure.
2.2 毒死蜱、苯醚甲环唑单独和联合暴露对GC-1细胞氧化应激水平的影响
研究表明,细胞中ROS的积累是由于ROS产生能力增加或其清除能力下降所致。在本研究中,GC-1细胞经毒死蜱、苯醚甲环唑单独和联合暴露24 h后,通过检测MDA含量、ROS生成、GSH和SOD活性来分析氧化应激水平。结果表明,与对照组相比,毒死蜱、苯醚甲环唑单独和联合暴露后细胞ROS水平升高,并且与单独暴露组相比,联合暴露组细胞内ROS水平显著升高(图2(a)),表明毒死蜱、苯醚甲环唑单独和联合暴露后可以引起GC-1细胞产生ROS。与对照组相比,单独暴露组细胞SOD和GSH活性低于对照组,MDA含量升高。与单独暴露组相比,联合暴露组细胞SOD和GSH活性显著降低,细胞内MDA含量显著升高(图2(b)~(d))。
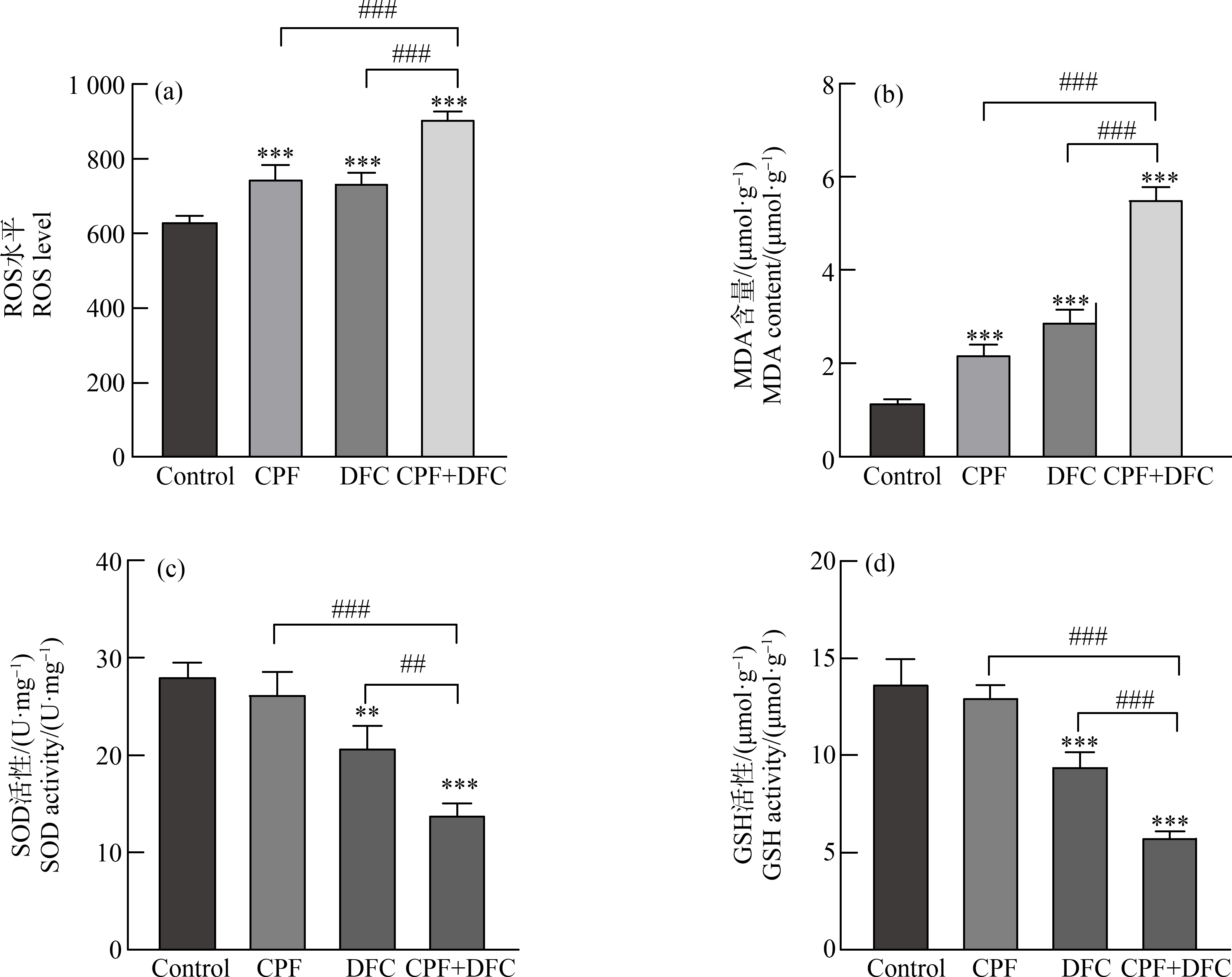
图2 毒死蜱和苯醚甲环唑联合暴露对GC-1细胞氧化应激水平的影响
注:(a) 活性氧(ROS)水平,(b) 丙二醛(MDA)含量,(c) 超氧化物歧化酶(SOD)活性,(d) 还原型谷胱甘肽(GSH)活性;数据表示为平均值±标准误差,
n=3;**P<0.01、***P<0.001,与对照组相比;## P<0.01、### P<0.001,与联合暴露组相比。
Fig. 2 Effect of combined chlorpyrifos and difenoconazole exposure on oxidative stress levels in GC-1 cells
Note: (a) Reactive oxygen species (ROS) level, (b) Malondialdehyde (MDA) content, (c) Superoxide dismutase (SOD) activity, (d)
Glutathione (GSH) activity; all data were expressed as mean±S.E.M, n=3; **P<0.01, ***P<0.001,
compared with DMSO control; ## P<0.01、### P<0.001, compared with the combined exposure group.
2.3 毒死蜱、苯醚甲环唑单独和联合暴露对GC-1细胞线粒体膜电位的影响
通过JC-1探针与流式细胞仪检测毒死蜱和苯醚甲环唑联合暴露对GC-1细胞线粒体膜电位的影响,对照组中高电位/低电位的比率为61.5,毒死蜱组为11.05,苯醚甲环唑组为5.21,联合暴露组为2.95,与对照组相比,毒死蜱、苯醚甲环唑单独和联合暴露诱导GC-1细胞线粒体膜电位下降,而且与单独暴露组相比,联合暴露组细胞线粒体膜电位显著下降(图3)。

图3 毒死蜱和苯醚甲环唑联合暴露对GC-1细胞线粒体膜电位的影响
注:***P<0.001,与对照组相比;### P<0.001,与联合暴露组相比。
Fig. 3 Effect of combined chlorpyrifos and difenoconazole exposure on the mitochondrial membrane potential of GC-1 cells
Note: ***P<0.001, compared with DMSO control; ### P<0.001, compared with the combined exposure group.
2.4 毒死蜱、苯醚甲环唑单独和联合暴露诱导GC-1细胞凋亡
毒死蜱、苯醚甲环唑单独和联合暴露GC-1细胞24 h,经Annexin V-PE双染色、流式细胞仪检测可知,与对照组相比,毒死蜱和苯醚甲环唑单独暴露均能诱导GC-1细胞凋亡,毒死蜱暴露后细胞凋亡率为23.0%,苯醚甲环唑暴露后细胞凋亡率为25.0%,而联合组的凋亡率显著升高,为37.7%(图4)。与单独暴露组相比,联合暴露组细胞凋亡率显著提高,可见毒死蜱和苯醚甲环唑联合暴露明显诱导GC-1细胞发生凋亡。
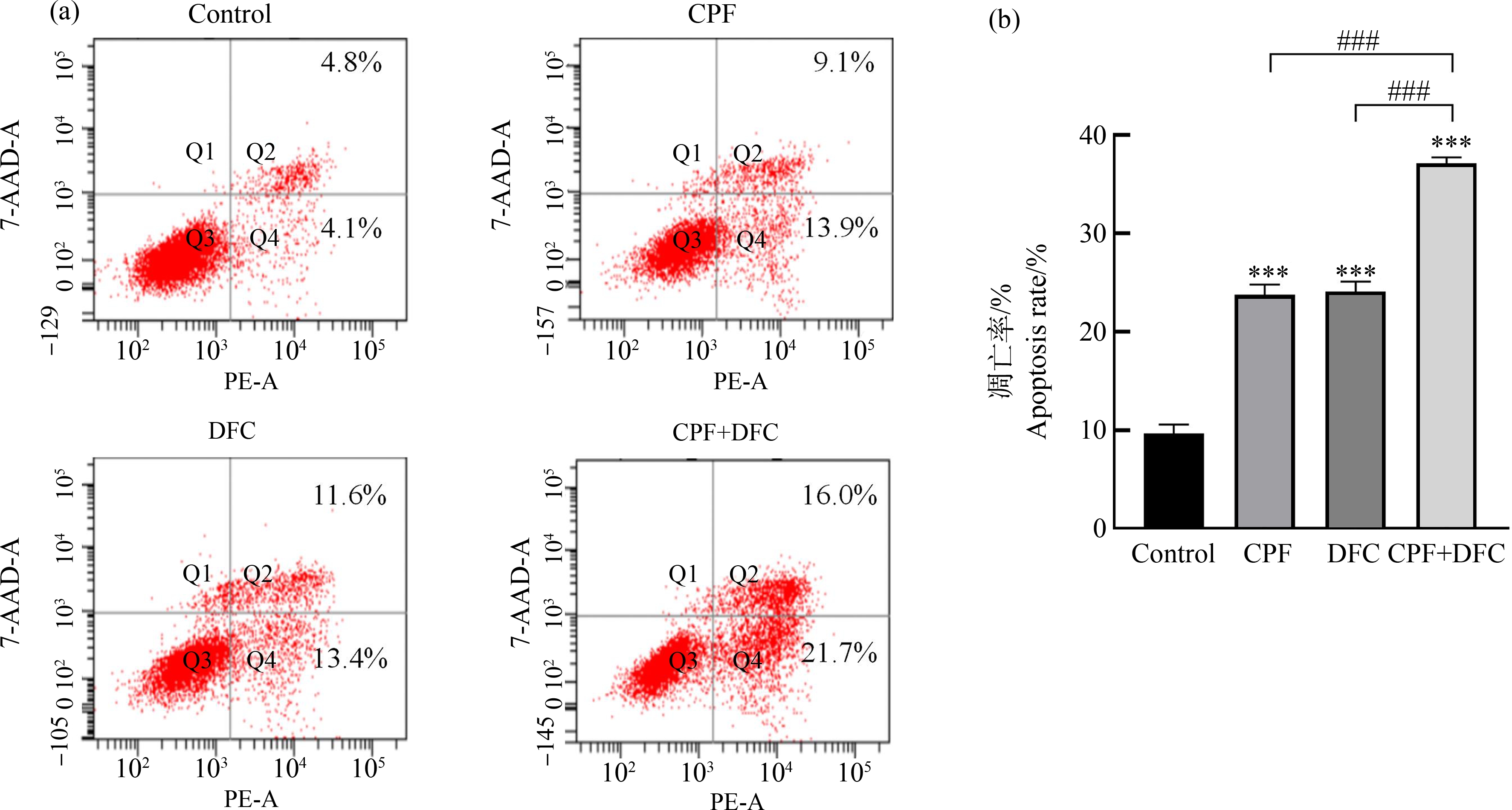
图4 毒死蜱和苯醚甲环唑联合暴露对GC-1细胞凋亡率的影响
注:(a) 与对照组相比,毒死蜱、苯醚甲环唑单独和联合暴露对GC-1细胞凋亡的影响,(b) 各处理组凋亡率;数据表示为平均值±标准误差,
n=3;***P<0.001,与对照组相比;### P<0.001,与联合暴露组相比。
Fig. 4 Effect of combined chlorpyrifos and difenoconazole exposure on the apoptosis rate of GC-1 cells
Note: (a) Compared with DMSO control, the effects of chlorpyrifos and difenoconazole on apoptosis of GC-1 cells; (b) The apoptosis rate of each
treatment group; all data were expressed as mean±S.E.M, n=3; ***P<0.001, compared with DMSO control; ### P<0.001,
compared with the combined exposure group.
2.5 凋亡相关蛋白检测
为进一步验证毒死蜱和苯醚甲环唑联合暴露对GC-1细胞凋亡通路的影响,通过Western blot验证单独及联合处理后相关蛋白Cleaved-PARP、Cleaved-Caspase3和Bax的表达情况。结果表明,与对照组相比,单独和联合暴露组Cleaved-PARP、Cleaved-Caspase3蛋白的表达上升,同时促凋亡蛋白Bax的表达明显增加。与单独暴露组相比,联合暴露组Cleaved-PARP、Cleaved-Caspase3和Bax蛋白的表达明显上升(图5),以上结果表明毒死蜱和苯醚甲环唑联合暴露诱导GC-1细胞凋亡蛋白表达提高。
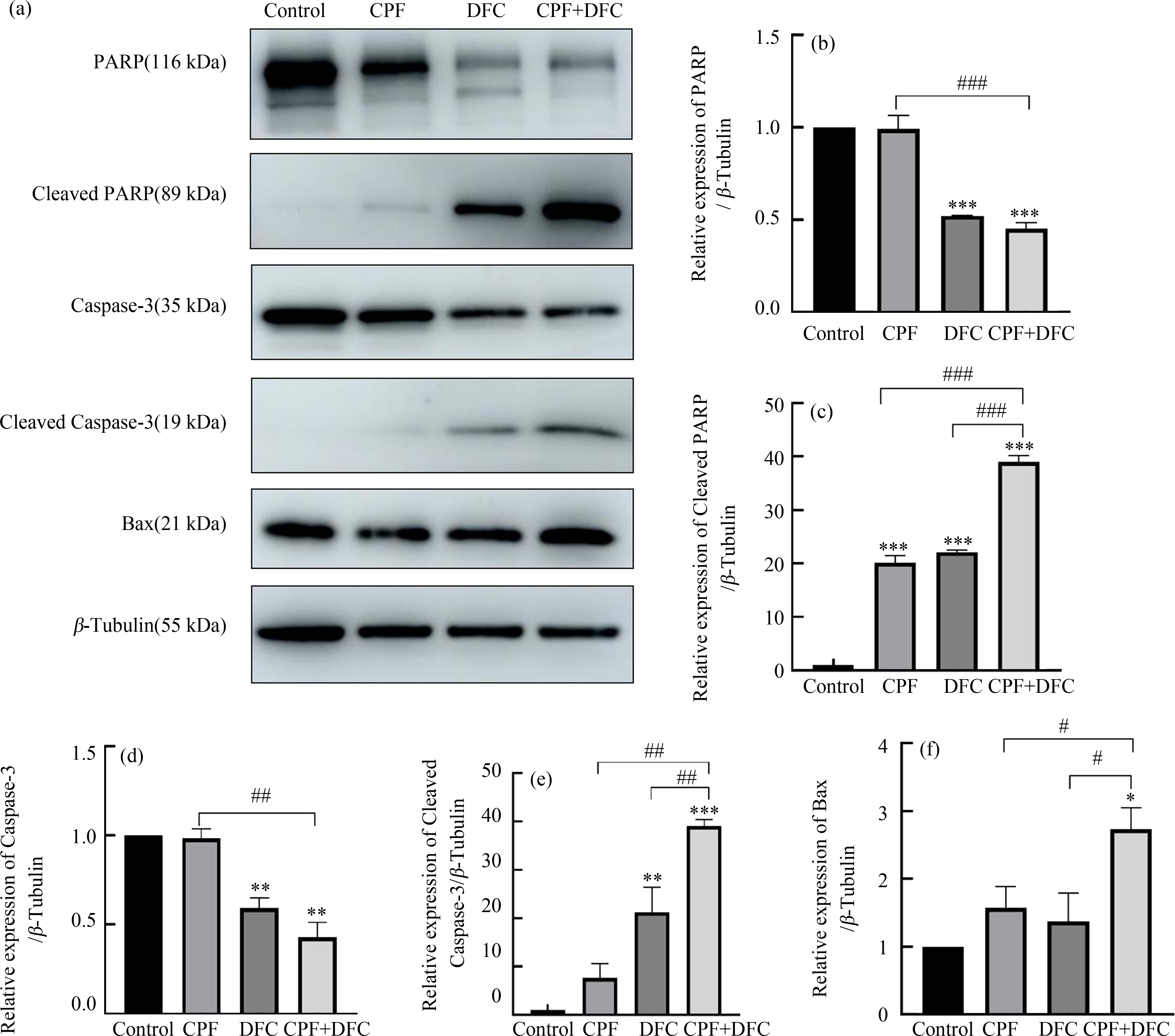
图5 毒死蜱和苯醚甲环唑联合暴露对GC-1细胞凋亡相关蛋白表达水平的影响
注:(a) PARP、Cleaved-PARP、Caspase3、Cleaved-Caspase3和Bax蛋白条带图,
(b) PARP定量分析图,(c) Cleaved-PARP定量分析图,(d) Caspase3定量分析图,(e) Cleaved-Caspase3定量分析图,
(f) Bax蛋白定量分析图;*P<0.05、**P<0.01、***P<0.001,与对照组相比;# P<0.05、## P<0.01、### P<0.001,与联合暴露组相比。
Fig. 5 Effect of combined chlorpyrifos and difenoconazole exposure on the expression levels
of apoptosis-related proteins in GC-1 cells
Note: The expressions of apoptosis-related proteins of PARP, Cleaved-PARP, Caspase3, Cleaved-Caspase3 and Bax, (b)~(f) Relative protein
expression levels of (b) PARP, (c) Cleaved-PARP, (d) Caspase3, (e) Cleaved-Caspase3 and (f) Bax normalized to β-Tublin; *P<0.05,
**P<0.01, ***P<0.001, compared with DMSO control; # P<0.05, ## P<0.01, ### P<0.001, compared with the combined exposure group.
3 讨论(Discussion)
毒死蜱效力持久,是目前世界上农业生产中使用最为广泛的有机磷农药[3,16]。苯醚甲环唑作为一种典型的三唑类杀菌剂在农业生产中广泛使用,已有报道其会对人类健康尤其是男性生殖系统产生不良影响。作为雄性生殖系统中最重要的器官,睾丸的主要作用是分泌和合成雄激素,生成精子[17]。精子发生是一个从精原细胞到精母细胞再到精子细胞的有序发展过程,包括细胞增殖、分化和凋亡等协调有序的过程。精原细胞在维持正常的精子发生和精子数量方面起着重要的作用。细胞凋亡是一种进化保守的细胞程序性死亡机制,在精子发生中起重要作用。在男性生殖细胞的发育过程中,约有75%的生殖细胞通过凋亡调节生殖细胞与支持细胞的数量和比例[18-19]。有研究表明,细胞凋亡主要影响精原细胞而不是精母细胞,生殖细胞的凋亡可能是自发发生的,也可能由某些物理刺激、化学试剂等引发的[20]。例如,乙草胺作为一种除草剂,可以造成大鼠DNA损伤以及诱导小鼠精原细胞GC-1凋亡[17]。本研究以小鼠精原细胞GC-1为暴露模型,研究毒死蜱和苯醚甲环唑联合暴露对GC-1细胞的毒性效应与机制,以期为农药暴露对人类生殖系统的毒性作用研究提供一定的理论依据。
本研究通过Cell titer法检测GC-1细胞暴露于0~500 mmol·L-1毒死蜱和苯醚甲环唑24 h后所受的毒性影响,结果表明随着暴露浓度的增加,细胞活力呈剂量依赖性降低。2种药物对GC-1细胞的IC50分别为毒死蜱158.5 μmol·L-1,苯醚甲环唑89.57 μmol·L-1。调整浓度为毒死蜱200 μmol·L-1,苯醚甲环唑120 μmol·L-1,联合组为毒死蜱200 μmol·L-1+苯醚甲环唑120 μmol·L-1进行后续实验。研究毒死蜱和苯醚甲环唑联合暴露0、12、24、36和48 h后对GC-1细胞活力的影响,结果表明,与对照组相比,随着药物浓度的增加,细胞活力受到抑制,而且细胞活力有良好的时间-剂量对应关系。
在正常生理条件下,生物体内ROS的产生和清除始终处于相对平衡的状态,但当农药等外源物质在体内积累到一定程度时,会产生大量ROS。这些有害物质的产生会导致抗氧化防御的改变,从而导致氧化应激[21]。抗氧化防御机制能够清除多余ROS并且预防组织因氧化应激产生的损伤,产生抗氧化酶(SOD、CAT等)和非酶类抗氧化物质(GSH等)。其中,抗氧化酶通过清除过量ROS来保证自由基的正常代谢,使其恢复动态平衡[22]。在生物体内,ROS处于一种动态平衡状态,在细胞增殖和存活的信号转导中起着关键作用,其也被认为是一种重要的凋亡信号,对农药的毒性研究具有重要意义[23]。大量研究数据表明,氧化应激可以由化学物质诱导,并在生殖毒性中发挥重要作用。例如,邻苯二甲酸二乙己酯(DEHP)可显著增加小鼠GC-1细胞中MDA含量,抑制GSH和SOD活性[24]。已有研究发现毒死蜱暴露会增加小鼠大脑中的氧化应激,苯醚甲环唑诱导人肝癌细胞HepG2中ROS产生,并诱导其凋亡[25-26]。为了进一步探讨氧化应激在毒死蜱和苯醚甲环唑联合暴露诱导的GC-1细胞损伤中的作用机制,我们研究了不同剂量毒死蜱、苯醚甲环唑单独以及联合暴露对GC-1细胞ROS生成和MDA水平的影响。结果表明,与对照组相比,所有处理组细胞中ROS和MDA含量都显著增加,且毒死蜱和苯醚甲环唑的联合暴露组中的ROS和MDA含量明显高于单独暴露组,表明ROS浓度增加,毒死蜱和苯醚甲环唑联合暴露对GC-1细胞生存产生了不良影响。而通过对GC-1细胞的抗氧化能力检测发现,与对照组相比,所有处理组细胞中SOD和GSH活性都降低,且联合暴露组中的SOD和GSH活性明显低于单独暴露组,进一步表明联合暴露组的抗氧化应激水平低于对照组和单独暴露组。当细胞内ROS升高和SOD、GSH活性下降时,会进一步加重细胞内的氧化应激损伤,本研究结果表明,毒死蜱和苯醚甲环唑联合暴露可明显增加GC-1细胞ROS和MDA的生成,降低细胞内SOD和GSH活性,降低抗氧化能力,导致GC-1细胞氧化损伤,充分说明毒死蜱和苯醚甲环唑联合暴露后显著诱导GC-1细胞发生氧化应激效应,也从细胞水平说明了氧化应激效应可能是毒死蜱和苯醚甲环唑对GC-1细胞产生毒性的诱因。
线粒体作为精子细胞主要的供能细胞器,在维持细胞正常的生理活动中起重要作用,而线粒体膜电位下降会导致线粒体功能异常进而影响精子细胞的活力,是精子细胞发生凋亡的早期信号。Jiang等[27]的研究表明,毒死蜱暴露诱导猪卵母细胞氧化应激和线粒体功能损伤,进而导致细胞凋亡。Wang等[28]研究报道苯醚甲环唑通过ROS相关的Caspase途径诱导HepG2细胞毒性和凋亡。本研究结果表明,与单独暴露组相比,毒死蜱和苯醚甲环唑联合暴露导致GC-1细胞线粒体膜电位显著降低。同时检测细胞凋亡率发现,与单独暴露组相比,联合暴露组细胞凋亡率明显上升。细胞凋亡是一种主动的死亡过程,受外源性途径和内源性途径控制,其中涉及线粒体的内源性途径是凋亡的重要途径之一[29]。通过激活半胱天冬氨酸蛋白酶(Caspase)导致线粒体膜通透性增加、染色质凝聚和DNA断裂,从而使细胞核固缩、碎裂并促进凋亡小体的形成[30]。Bcl-2蛋白家族与线粒体凋亡途径密切相关,根据Bcl-2蛋白家族在细胞凋亡过程中的作用不同,其可以分为2种类型,一种是促凋亡蛋白,如Bax,另一种是抗凋亡蛋白,如Bcl-2[31]。有研究表明通过增加Bax/Bcl-2的比值来提高Caspase3的活性从而诱导细胞凋亡[32]。GC-1细胞暴露于浓度为200 mg·mL-1的镍纳米粒子后Bax和Caspase3表达增强[33]。在本研究中,与对照组相比,毒死蜱和苯醚甲环唑联合暴露后,GC-1细胞内促凋亡蛋白Bax以及相应的效应蛋白如Cleaved PARP、Cleaved Caspase3的表达升高。
综上所述,毒死蜱、苯醚甲环唑单独和联合暴露均能降低GC-1细胞活力,并诱导细胞氧化应激,降低细胞的抗氧化能力,降低线粒体膜电位,提高GC-1细胞凋亡率,且升高细胞内Cleaved PARP、Cleaved Caspase3和Bax等蛋白的表达水平从而诱导细胞凋亡,并且相比于单独暴露,2种农药联合暴露对GC-1细胞的毒性效应更强。但是农药联合暴露诱导细胞凋亡的作用机制复杂,需要进一步通过基因测序和动物实验探究其农药效应靶点、凋亡调控通路,为评估农药联合毒性机制提供科学依据。
[1] Jankulovska M S, Velkoska-Markovska L, Petanovska-Ilievska B, et al. Application of high performance liquid chromatography for determination of metalaxyl, acetamiprid and azoxystrobine in tomato samples [J]. Journal of Analytical Chemistry, 2019, 74(4): 339-344
[2] Ubaid Ur Rahman H, Asghar W, Nazir W, et al. A comprehensive review on chlorpyrifos toxicity with special reference to endocrine disruption: Evidence of mechanisms, exposures and mitigation strategies [J]. The Science of the Total Environment, 2021, 755(Pt 2): 142649
[3] Burke R D, Todd S W, Lumsden E, et al. Developmental neurotoxicity of the organophosphorus insecticide chlorpyrifos: From clinical findings to preclinical models and potential mechanisms [J]. Journal of Neurochemistry, 2017, 142(Suppl 2): 162-177
[4] Alaa-Eldin E A, El-Shafei D A, Abouhashem N S. Individual and combined effect of chlorpyrifos and cypermethrin on reproductive system of adult male Albino rats [J]. Environmental Science and Pollution Research International, 2017, 24(2): 1532-1543
[5] Li J W, Pang G F, Ren F Z, et al. Chlorpyrifos-induced reproductive toxicity in rats could be partly relieved under high-fat diet [J]. Chemosphere, 2019, 229: 94-102
[6] Vahabi Barzi N, Eftekhari Z, Doroud D, et al. Maternal exposure during organogenesis to chlorpyrifos insecticide induce apoptosis process [J]. The Journal of Maternal-Fetal & Neonatal Medicine: the Official Journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstetricians, 2020: 1-8
[7] Chen R, Cui Y, Zhang X L, et al. Chlorpyrifos induction of testicular-cell apoptosis through generation of reactive oxygen species and phosphorylation of AMPK [J]. Journal of Agricultural and Food Chemistry, 2018, 66(47): 12455-12470
[8] Pitombeira de Figueirêdo L, Daam M A, Mainardi G, et al. The use of gene expression to unravel the single and mixture toxicity of abamectin and difenoconazole on survival and reproduction of the springtail Folsomia candida [J]. Environmental Pollution, 2019, 244: 342-350
[9] Dong X C, Zhang L M, Chen M, et al. Exposure to difenoconazole inhibits reproductive ability in male marine medaka (Oryzias melastigma) [J]. Journal of Environmental Sciences, 2018, 63: 126-132
[10] Li R R, Liu B, Xu W P, et al. DNA damage and cell apoptosis induced by fungicide difenoconazole in mouse mononuclear macrophage RAW264.7 [J]. Environmental Toxicology, 2022, 37(3): 650-659
[11] Khwanes S A, Mohamed R A, Ibrahim K A, et al. Ginger reserves testicular spermatogenesis and steroidogenesis in difenoconazole-intoxicated rats by conducting oxidative stress, apoptosis and proliferation [J]. Andrologia, 2022, 54(1): e14241
[12] Wang X, Ni H F, Xu W P, et al. Difenoconazole induces oxidative DNA damage and mitochondria mediated apoptosis in SH-SY5Y cells [J]. Chemosphere, 2021, 283: 131160
[13] Chen J X, Xu L L, Mei J H, et al. Involvement of neuropathy target esterase in tri-ortho-cresyl phosphate-induced testicular spermatogenesis failure and growth inhibition of spermatogonial stem cells in mice [J]. Toxicology Letters, 2012, 211(1): 54-61
[14] Yang D, Zhang M J, Gan Y, et al. Involvement of oxidative stress in ZnO NPs-induced apoptosis and autophagy of mouse GC-1 spg cells [J]. Ecotoxicology and Environmental Safety, 2020, 202: 110960
[15] Wang L Q, Wang L X, Shi X, et al. Chlorpyrifos induces the apoptosis and necroptosis of L8824 cells through the ROS/PTEN/PI3K/AKT axis [J]. Journal of Hazardous Materials, 2020, 398: 122905
[16] 张叶翠, 李翎, 胡晨阳, 等. 毒死蜱生殖毒性与神经毒性研究进展[J]. 中国职业医学, 2019, 46(5): 628-632
Zhang Y C, Li L, Hu C Y, et al. Advances of the reproductive toxicity and neurotoxicity of chlorpyrifos [J]. China Occupational Medicine, 2019, 46(5): 628-632 (in Chinese)
[17] 蒋青桃, 宋仙平, 张锋, 等. 乙草胺对雄性小鼠GC-1精原细胞的毒性研究[J]. 职业与健康, 2020, 36(21): 2920-2926
Jiang Q T, Song X P, Zhang F, et al. Toxicity of acetochlor on GC-1 spermatogonia cells of male mice [J]. Occupation and Health, 2020, 36(21): 2920-2926 (in Chinese)
[18] Shaha C, Tripathi R, Mishra D P. Male germ cell apoptosis: Regulation and biology [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2010, 365(1546): 1501-1515
[19] Correia S, Cardoso H J, Cavaco J E, et al. Oestrogens as apoptosis regulators in mammalian testis: Angels or devils? [J]. Expert Reviews in Molecular Medicine, 2015, 17: e2
[20] 吴震. IRE1信号通路在镉诱导小鼠精原细胞凋亡中的作用[D]. 合肥: 安徽医科大学, 2021: 7-8
Wu Z. The role of IRE1 signaling pathway in cadmium-induced apoptosis of mouse spermatogonia [D]. Hefei: Anhui Medical University, 2021: 7-8 (in Chinese)
[21] Howell Ⅲ G E, Mulligan C, Young D, et al. Exposure to chlorpyrifos increases neutral lipid accumulation with accompanying increased de novo lipogenesis and decreased triglyceride secretion in McArdle-RH7777 hepatoma cells [J]. Toxicology in Vitro, 2016, 32: 181-189
[22] Wang L X, Zheng M M, Zhang S P, et al. Roles of mtDNA damage and disordered Ca2+ homeostasis in the joint toxicities of cadmium and BDE209 [J]. Ecotoxicology and Environmental Safety, 2019, 186: 109767
[23] Hu X, Yang T, Li C, et al. Human fetal hepatocyte line, L-02, exhibits good liver function in vitro and in an acute liver failure model [J]. Transplantation Proceedings, 2013, 45(2): 695-700
[24] Gan Y, Yang D, Yang S, et al. Di-2-ethylhexyl phthalate (DEHP) induces apoptosis and autophagy of mouse GC-1 spg cells [J]. Environmental Toxicology, 2020, 35(2): 292-299
[25] 包凌玲. 苯醚甲环唑诱导HepG2细胞毒性及其与CYP3A4相互作用机制研究[D]. 杭州: 浙江大学, 2015: 33-34
Bao L L. Investigation of difenoconazole-induced HepG2 cell apoptosis and the molecular mechanism of its interactions with CYP3A4 [D]. Hangzhou: Zhejiang University, 2015: 33-34 (in Chinese)
[26] de Felice A, Greco A, Calamandrei G, et al. Prenatal exposure to the organophosphate insecticide chlorpyrifos enhances brain oxidative stress and prostaglandin E2 synthesis in a mouse model of idiopathic autism [J]. Journal of Neuroinflammation, 2016, 13(1): 149
[27] Jiang Y, He Y J, Li W H, et al. Exposure to chlorpyrifos leads to spindle disorganization and mitochondrial dysfunction of porcine oocytes during in vitro maturation [J]. Theriogenology, 2021, 173: 249-260
[28] Wang T C, Ma M M, Chen C, et al. Three widely used pesticides and their mixtures induced cytotoxicity and apoptosis through the ROS-related caspase pathway in HepG2 cells [J]. Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association, 2021, 152: 112162
[29] Cavalcante G C, Schaan A P, Cabral G F, et al. A cell’s fate: An overview of the molecular biology and genetics of apoptosis [J]. International Journal of Molecular Sciences, 2019, 20(17): E4133
[30] 仝琳鸽, 秦燕. Ghrelin在细胞凋亡和焦亡中的作用[J]. 生理科学进展, 2021, 52(6): 420-424
Tong L G, Qin Y. Effect of Ghrelin on apoptosis and pyroptosis [J]. Progress in Physiological Sciences, 2021, 52(6): 420-424 (in Chinese)
[31] Popgeorgiev N, Jabbour L, Gillet G. Subcellular localization and dynamics of the bcl-2 family of proteins [J]. Frontiers in Cell and Developmental Biology, 2018, 6: 13
[32] Fan Z Y, Guo C C, Zhang Y H, et al. Hongjingtian injection inhibits proliferation and migration and promotes apoptosis in high glucose-induced vascular smooth muscle cells [J]. Drug Design, Development and Therapy, 2019, 13: 4115-4126
[33] Wu Y Y, Ma J, Sun Y F, et al. Effect and mechanism of PI3K/AKT/mTOR signaling pathway in the apoptosis of GC-1 cells induced by nickel nanoparticles [J]. Chemosphere, 2020, 255: 126913