成釉器细胞包括内釉上皮细胞、星网状细胞、中间层细胞、外釉上皮细胞及成釉细胞,它们在功能上相互诱导、相互协同,在牙齿发育过程中发挥分泌基质、促进无机离子沉积、诱导晶体成核与矿化等作用,是形成牙体主要硬组织结构——牙釉质的关键细胞群[1]。釉质晶体的成核与生长是一个受到釉质基质pH影响的过程,离不开成釉器细胞对胞内外酸碱状态的精密调控,涉及多种离子转运体。其中,溶质载体家族4(solute carrier 4, SLC4)的阴离子交换体2(anion exchanger 2, AE2)位于成釉细胞外侧基底部,可交换Cl-与![]() 以调控釉质基质与成釉细胞内的酸碱状态,在釉质矿化过程中发挥重要作用[2-3]。
以调控釉质基质与成釉细胞内的酸碱状态,在釉质矿化过程中发挥重要作用[2-3]。
干扰上述牙源性细胞生理功能及成釉过程的各种因素,都有可能影响牙齿的正常发育,产生不良后果。目前认为,牙胚发育过程中持续过量地氟摄入是导致釉质发育障碍引起氟斑牙发生的根本原因,但具体发病机制尚不完全清楚[4]。自由基学说提出,高生物活性的氟化物对成釉细胞抗氧化防御系统的破坏是导致“氟斑牙”呈现釉基质蛋白滞留与釉质矿化不全的关键机制之一[5-8]。而值得注意的是,在我国西南部“燃煤型氟斑牙”病区环境中常合并高硫煤系分布,敞炉燃煤致居室内空气污染易出现超国家限量浓度的SO2与含氟烟气并存的情况。早前有相关研究就该现象进行了动物实验研究,发现相较于二者单独染毒,同时接触大剂量氟化物与SO2烟气时大鼠氟斑牙患病程度更严重,提示SO2对氟致氟斑牙的过程可能起到加强作用[9];再有,SO2与氟化物共同暴露时将对雄性大鼠肾及睾丸组织产生更严重的损伤[10-11],更加说明SO2的存在将使氟化物产生更复杂的毒性效应。但以上研究均未就SO2在“氟硫联合”过程中发挥毒作用所涉及的可能机制进行讨论。而除了对呼吸系统造成损害外,SO2还可影响多脏器的生理功能,是一种具有多种毒作用的全身性毒物。SO2经呼吸道吸收入血后在血液微碱性的环境中即转变为其衍生物——亚硫酸盐和亚硫酸氢盐(物质的量比约为3∶1),以其衍生物的形式随血液循环至全身,对体内组织细胞产生毒作用[12]。降低体内抗氧化物质水平、削弱体内抗氧化防御系统是SO2发挥毒作用的关键环节[13]。因此,本研究以氧化应激为切入点,探讨SO2体内衍生物对大鼠切牙组织抗氧化防御系统及成釉器细胞丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号转导通路关键蛋白与AE2蛋白表达的影响,探究其对牙齿发育相关生理过程的潜在毒性及可能机制,为后续深入“氟硫联合”过程中SO2毒作用的毒理学研究提供实验资料。
1 材料与方法(Materials and methods)
1.1 实验动物分组及处理
本研究采用SPF级雄性4周龄Wistar大鼠,体质量100~120 g,购于长沙市天勤生物技术有限公司,动物许可证编号:SCXK(湘)2019-0013。适应性饲养1周后按体质量随机分5组,即高、中、低二氧化硫衍生物混合液染毒组、生理盐水对照组、高剂量二氧化硫衍生物混合液+抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine, NAC)拮抗组,染毒剂量分别为100 mg·kg-1·d-1(1/10LD50)、50 mg·kg-1·d-1(1/20LD50)和25 mg·kg-1·d-1(1/40LD50),对照组予0.9%氯化钠注射液,高剂量+NAC组每次腹腔注射前30 min予200 mg·kg-1 NAC水溶液灌胃,后与高剂量染毒组进行相同操作,各染毒组均于每日上午9:00行腹腔注射一次,给药容积为2 mL·kg-1,连续4周。饲养期间动物自由饮水、摄食,环境温度为(22±2) ℃,光照明暗各12 h,相对湿度为(50±10)%。末次给药后禁食24 h,取相应生物样本进行实验。
1.2 主要试剂
亚硫酸钠(Na2SO3)、亚硫酸氢钠(NaHSO3)分析纯,购自美国Sigma公司,N-乙酰半胱氨酸购自美国Sigma公司,超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、丙二醛(malondialdehyde, MDA)、还原型谷胱甘肽(reduced glutathione, GSH)检测试剂盒购自南京建成生物有限公司,大鼠活性氧簇(reactive oxygen species, ROS)Elisa测定试剂盒购自上海江莱生物科技有限公司,AE2兔抗大鼠多克隆抗体购自美国Invitrogen公司,p38 MAPK兔抗大鼠单克隆抗体、p-p38 MAPK兔抗大鼠单克隆抗体、SAPK/JNK兔抗大鼠多克隆抗体、p-SAPK/JNK兔抗大鼠单克隆抗体、ERK1/2兔抗大鼠多克隆抗体、p-ERK1/2兔抗大鼠多克隆抗体购自美国Cell Signaling Technology公司,Histone H3兔抗大鼠单克隆抗体购自美国Santa Cruz公司,辣根过氧化物酶标记的山羊抗兔IgG二抗购自北京爱必信生物技术有限公司。
二氧化硫体内衍生物混合液的制备。取适量亚硫酸钠与亚硫酸氢钠,以3∶1的物质的量比溶于0.9%生理盐水,每日新鲜配制。
1.3 大鼠切牙组织氧化应激相关指标测定
完整分离大鼠双侧下颌骨及切牙组织,取其中一侧用纱布仔细去除包绕的肌肉及结缔组织后置液氮中研磨成骨粉,并于组织破碎仪中进一步粉碎。取适量骨粉按1∶9的质量体积比加入预冷的0.9%生理盐水制成10%组织匀浆,蛋白含量的测定采用BCA法。按不同测定指标的样品前处理要求离心后取上清液,依试剂盒说明书检测切牙组织中MDA、GSH水平及SOD、GSH-Px活性。
1.4 切牙组织ROS水平测定
骨粉的制备同1.3,取适量骨粉按1∶9的质量体积比加入预冷的PBS(0.01 mol·L-1, pH=7.4),冰上充分研磨混匀制成切牙组织匀浆液,5 000×g,离心10 min,取上清液按照试剂盒说明书测定切牙组织ROS水平。
1.5 Western blot法测定大鼠成釉器细胞MAPKs/AP-1信号通路相关蛋白及AE2蛋白表达水平
取前述待用的另一侧大鼠切牙组织,参考Houari等[14]的处理方法,仔细拨开包绕切牙根部的下颌骨,分离出成釉细胞组织,用含PMSF的RIPA裂解液4 ℃匀浆,冰上裂解15 min提取总蛋白,用BCA试剂盒进行蛋白定量,分子量为30~160 kD与12~60 kD的蛋白分别选用8%或12% SDS-PAGE分离胶进行电泳分离,转膜后5%脱脂牛奶室温封闭1 h,磷酸化蛋白用5% BSA封闭液封闭1 h,分别加入适量AE2抗体(1∶1 000)、p38 MAPK抗体(1∶1 000)、p-p38 MAPK抗体(1∶1 000)、SAPK/JNK抗体(1∶1 000)、p-SAPK/JNK抗体(1∶1 000)、ERK1/2抗体(1∶1 000)、p-ERK1/2抗体(1∶1 000)及β-actin抗体(1∶2 000) 4 ℃摇床孵育过夜,TBST洗膜10 min共3次,1∶4 000倍稀释二抗室温孵育2 h,TBST洗膜10 min共3次,ECL显色液显影,凝胶成像系统扫描并检测蛋白条带密度。
1.6 统计学分析
数据用均数±标准差![]() 表示。统计学分析采用SPSS 22.0软件进行,多组间统计量的比较先进行方差齐性检验和单因素方差分析(one way-ANOVA)。组间两两比较方差齐时用Bonferroni法,方差不齐时用Dunnett’s-t检验,均采用双侧检验,P<0.05表示差异有统计学意义。
表示。统计学分析采用SPSS 22.0软件进行,多组间统计量的比较先进行方差齐性检验和单因素方差分析(one way-ANOVA)。组间两两比较方差齐时用Bonferroni法,方差不齐时用Dunnett’s-t检验,均采用双侧检验,P<0.05表示差异有统计学意义。
2 结果(Results)
2.1 二氧化硫体内衍生物混合液对大鼠切牙组织抗氧化防御系统的影响
与对照组比较,中、高剂量组大鼠切牙组织SOD、GSH-Px活性和GSH水平下降,差异具有统计学意义(P<0.05);MDA、ROS水平升高(P<0.05)。与高剂量组比较,高剂量+NAC组SOD和GSH-Px活性升高,GSH水平上升,MDA、ROS含量下降,差异有统计学意义(P<0.05),如表1所示。
表1 二氧化硫体内衍生物对大鼠切牙组织抗氧化防御系统相关指标的影响![]()
Table 1 Effects of sulfur dioxide derivatives on indexes of antioxidant defense system
of rat incisor tissue ![]() n=6)
n=6)

组别Groups SOD活性/(U·mg-1) SOD activity/(U·mg-1) GSH-Px活性/(U·mg-1) GSH-Px activity/(U·mg-1)GSH水平/(μmol·g-1)Level of GSH/(μmol·g-1)MDA水平/(nmol·mg-1)Level of MDA/(nmol·mg-1)ROS水平/(U·mL-1)Level of ROS/(U·mL-1)对照 Control150.21±11.15128.93±6.64 49.47±4.343.49±0.9129.31±2.26低剂量(25 mg·kg-1·d-1)Low-dose (25 mg·kg-1·d-1)133.76±11.91126.31±6.53 48.74±3.99 3.06±0.99 29.47±2.37中剂量(50 mg·kg-1·d-1)Medium-dose (50 mg·kg-1·d-1) 92.18±11.83a86.89±5.01a 35.57±4.27a10.18±0.92a 38.91±2.32a高剂量(100 mg·kg-1·d-1)High-dose (100 mg·kg-1·d-1)62.78±8.90a65.99±4.86a 18.56±3.63a17.25±1.18a 50.48±2.94a高剂量(100 mg·kg-1·d-1)+NAC (200 mg·kg-1·d-1)High-dose (100 mg·kg-1·d-1)+NAC (200 mg·kg-1·d-1)161.48±19.46b133.25±8.71b46.67±5.55b3.38±1.13b 31.46±4.19b
注:SOD表示超氧化物歧化酶,GSH-Px表示谷胱甘肽过氧化物酶,GSH表示还原型谷胱甘肽,MDA表示丙二醛,ROS表示活性氧簇;NAC表示N-乙酰半胱氨酸;a与对照组比较,P<0.05;b与高剂量组(100 mg·kg-1)比较,P<0.05。
Note: SOD stands for superoxide dismutase; GSH-Px stands for glutathione peroxidase; GSH stands for reduced glutathione; MDA stands for malondialdehyde; ROS stands for reactive oxygen species; NAC stands for N-acetylcysteine; a P<0.05 vs control group; b P<0.05 vs high-dose group (100 mg·kg-1).
2.2 二氧化硫体内衍生物对大鼠成釉器细胞MAPKs/AP-1信号通路相关蛋白表达的影响
如图1所示,低、中、高剂量组及高剂量+NAC组大鼠成釉器细胞p-p38 MAPK/p38 MAPK及p-ERK/ERK改变较对照组均无显著差异。而低剂量组大鼠成釉器细胞JNK磷酸化水平改变较对照组无显著差异,中、高剂量组磷酸化JNK/JNK水平较对照组升高,差异有统计学意义(P<0.05),且经趋势性检验,JNK磷酸化水平升高趋势表现出二氧化硫衍生物染毒剂量依赖性(F=158.58,P<0.05)。与高剂量组比较,高剂量+NAC组磷酸化JNK/JNK水平显著降低(P<0.05),差异有统计学意义。

图1 二氧化硫体内衍生物对大鼠切牙成釉器细胞MAPKs信号通路关键蛋白表达的影响
注:(a)MAPKs信号通路关键蛋白蛋白免疫印迹条带;(b)成釉器细胞MAPKs信号通路关键蛋白相对表达水平;A对照组,
B高剂量组,C中剂量组,D低剂量组,E高剂量+NAC组;与对照组比较,# P<0.05;与高剂量组比较,*P<0.05;n=3。
Fig. 1 Effects of sulfur dioxide derivatives on expression of key proteins in MAPKs signaling pathway
of rat incisor enamel organ cells
Note: (a) Immunoblotting bands of key proteins in MAPKs signaling pathway; (b) Relative expression of key proteins in MAPKs
signaling pathway; A means control group, B means high-dose group, C means medium-dose group, D means low-dose group,
and E means high dose+NAC group; # P<0.05 vs control group; *P<0.05 vs high-dose group; n=3.
如图2所示,与对照组比较,中、高剂量组大鼠成釉器细胞胞浆中c-Fos、c-Jun蛋白水平较对照组明显下降(P<0.05),核内c-Fos、c-Jun蛋白水平明显上升(P<0.05),提示高剂量组AP-1蛋白发生核转位。而高剂量+NAC组AP-1蛋白核转位较高剂量组显著减少(P<0.05),差异有统计学意义。低剂量组较对照组核内c-Fos蛋白水平升高,但总体AP-1蛋白核浆分布改变无明显差异。
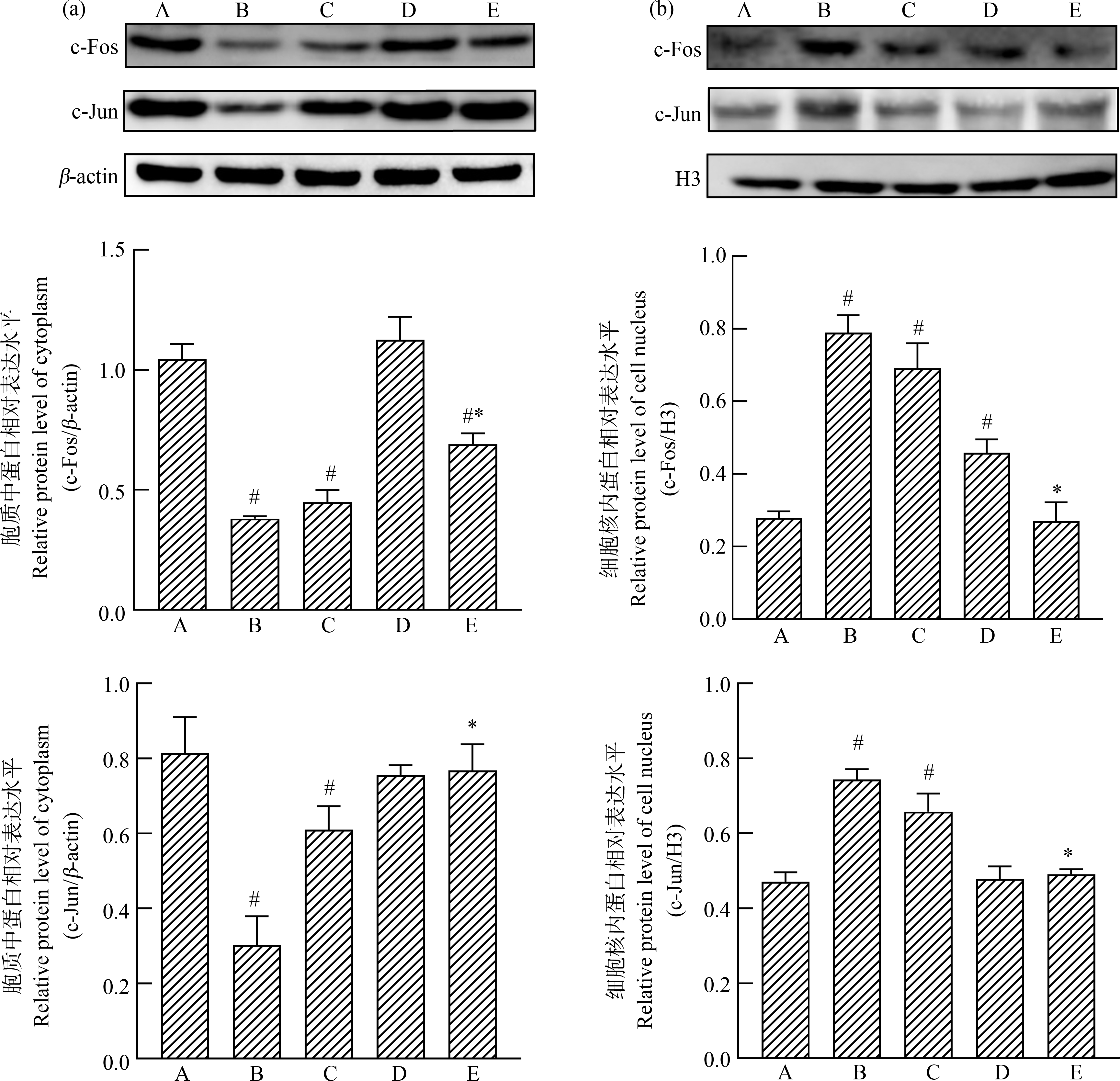
图2 二氧化硫体内衍生物对大鼠切牙成釉器细胞胞质及胞核中c-Fos与c-Jun蛋白表达的影响
注:(a)胞质中c-Fos与c-Jun蛋白相对表达水平;(b)胞核中c-Fos与c-Jun蛋白相对表达水平;A对照组,B高剂量组,C中剂量组,
D低剂量组,E高剂量+NAC组;与对照组比较,# P<0.05;与高剂量组比较,*P<0.05;n=3。
Fig. 2 Effects of sulfur dioxide derivatives on expression of c-Fos and c-Jun protein in cytoplasm
and nucleus of rat incisor enamel organ cells
Note: (a) Relative expression of c-Fos and c-Jun protein in cytoplasm; (b) Relative expression of c-Fos and c-Jun protein in nucleus;
A means control group, B means high-dose group, C means medium-dose group, D means low-dose group, and E means high
dose+NAC group; # P<0.05 vs control group; *P<0.05 vs high-dose group; n=3.
2.3 二氧化硫体内衍生物对大鼠成釉器细胞AE2蛋白表达水平的影响
如图3所示,中、高剂量组AE2蛋白表达较对照组升高,差异有统计学意义(P<0.05),且经趋势性检验,升高趋势表现出二氧化硫衍生物染毒剂量依赖性(F=530.167,P<0.05)。与高剂量组比较,高剂量+NAC组AE2蛋白表达水平显著降低(P<0.05),差异有统计学意义。
3 讨论(Discussion)
机体内抗氧化防御系统主要由抗氧化酶类和抗氧化剂构成,它们之间相互协同、相互代偿共同发挥维持机体氧化与抗氧化动态平衡的作用。体内氧化与抗氧化之间的平衡状态被打破可诱导产生各种自由基引起组织氧化损伤,导致细胞功能异常甚至凋亡,从而对多种脏器造成损害[15]。已有多项研究表明,二氧化硫及其衍生物可引起大、小鼠脑、肺、心、肝、脾、肾、胃、肠和睾丸等组织抗氧化物质含量减少,SOD、GSH-Px和过氧化氢酶(catalase, CAT)等抗氧化酶活性改变,脂质过氧化产物含量增加[16-19]。可见,降低体内抗氧化物质水平、削弱体内抗氧化防御系统是二氧化硫及其衍生物发挥毒作用的关键环节之一。基于此,本研究通过亚急性腹腔注射二氧化硫体内衍生物构建动物染毒模型,观察二氧化硫衍生物对大鼠切牙组织抗氧化防御系统的影响。结果显示,相较于对照组,中、高剂量染毒组大鼠切牙组织GSH含量、SOD活性和GSH-Px活性下降,同时,脂质过氧化产物MDA、ROS水平显著上升,而预先给予活性氧抑制剂NAC再予高剂量二氧化硫衍生物时,大鼠切牙组织抗氧化防御系统各项指标均较单独施予高剂量二氧化硫衍生物而言有了明显改善,表明二氧化硫体内衍生物可引起切牙组织细胞抗氧化防御系统紊乱,活性氧自由基蓄积,这与其他学者在大鼠心、肝、肺和肾等主要脏器组织中观察到的结果类似。
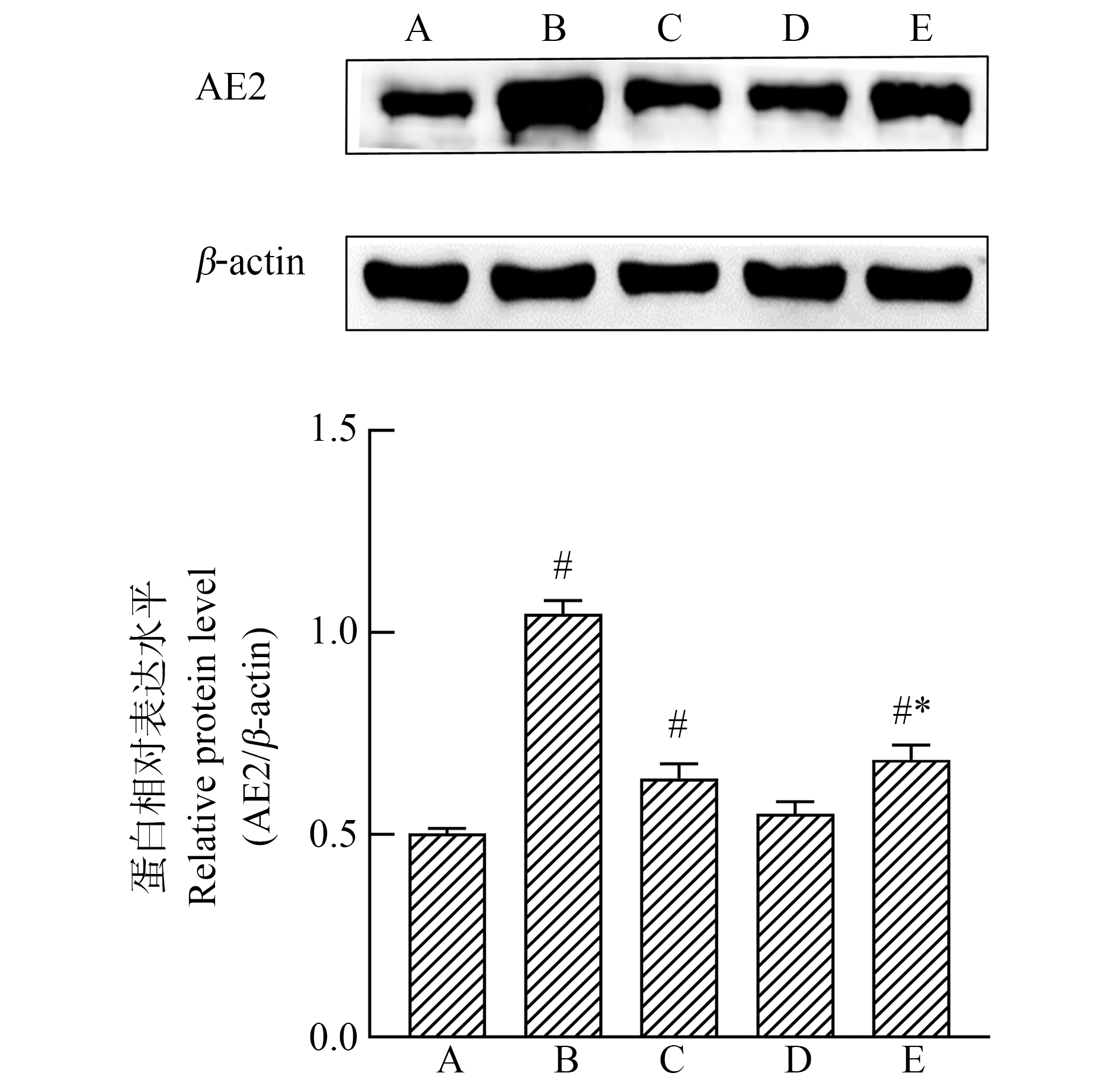
图3 二氧化硫体内衍生物对大鼠切牙成釉器
细胞AE2蛋白表达的影响
注:A对照组,B高剂量组,C中剂量组,D低剂量组,E高剂量+NAC组;
与对照组比较,# P<0.05;与高剂量组比较,*P<0.05;n=3。
Fig. 3 Effect of sulfur dioxide derivatives on the expression
of AE2 protein in incisor enamel organ of rats
Note: A means control group, B means high-dose group,
C means medium-dose group, D means low-dose group,
and E means high dose+NAC group; # P<0.05 vs control group;
*P<0.05 vs high-dose group; n=3.
氧化应激导致活性氧簇的大量积累可激活多种信号转导途径,引起下游NF-κB、AP-1等转录因子的活化而介导相关基因的表达改变[20-22]。广泛存在于组织细胞中的MAPKs信号转导途径可被紫外线、炎性细胞因子和ROS等胞外刺激激活,参与胞外刺激向细胞内传递的过程,在触发细胞生物化学变化相关靶基因表达的过程中发挥重要作用,主要涉及3种激酶的活化:p38 MAPK、ERK1/2和JNK。核转录因子AP-1(activator protein 1, AP-1)是由c-Jun和c-Fos构成的一类转录激活因子,作为MAPKs信号通路的下游分子,在接受自胞外逐渐传递入胞的信号后,即从胞质进入细胞核,与多种基因的DNA调节序列相结合,调控相应基因的表达,进而参与细胞炎性反应、分化和凋亡等多种细胞过程。有研究指出,氧化应激可通过诱导核转录因子AP-1活化,介导呼吸道上皮细胞AE2的表达上调,通过阻断AE2的功能可减轻肺缺血/再灌注损伤的程度[23]。另有研究发现,高糖引起的血管平滑肌内皮细胞凋亡与AE2表达上调及其功能激活进而诱导的线粒体氧化应激相关,AE2的异常表达上调与功能激活可通过诱导胞内活性氧簇的大量产生,引起细胞凋亡等不良结局的发生[24-25]。作为膜结合的![]() 交换蛋白,AE2主要参与细胞内pH值(pHi)和离子平衡的调节,在成熟期,成釉细胞表达于基底侧部膜区[26]。根据AE2胞膜定位与功能特性,其交换
交换蛋白,AE2主要参与细胞内pH值(pHi)和离子平衡的调节,在成熟期,成釉细胞表达于基底侧部膜区[26]。根据AE2胞膜定位与功能特性,其交换![]() 的作用被认为与成釉细胞内碳酸酐酶及顶端膜质子泵的功能相耦联,是成釉细胞顶端膜周期性的H+分泌功能得以实现的关键[26-27]。同时,AE2还起到向胞外排出
的作用被认为与成釉细胞内碳酸酐酶及顶端膜质子泵的功能相耦联,是成釉细胞顶端膜周期性的H+分泌功能得以实现的关键[26-27]。同时,AE2还起到向胞外排出![]() 中和釉质晶体生长所释放的大量质子以维持胞外釉质基质微环境酸碱平衡稳态的作用[28]。但AE2在排出
中和釉质晶体生长所释放的大量质子以维持胞外釉质基质微环境酸碱平衡稳态的作用[28]。但AE2在排出![]() 和泵入Cl-时可使细胞酸化,也能够将细胞外的超氧阴离子自由基
和泵入Cl-时可使细胞酸化,也能够将细胞外的超氧阴离子自由基![]() 交换至细胞内[29]。因此,当AE2被异常激活时将会有大量的
交换至细胞内[29]。因此,当AE2被异常激活时将会有大量的![]() 和Cl-由胞外被转移入胞内,可导致细胞酸化并引发胞内“呼吸爆发”,进而活化活性氧相关信号转导途径引起细胞功能改变或诱导细胞凋亡发生。AE2的异常表达及活性改变可能是某些疾病状态发生的中间事件[30-31],在一些肿瘤发生的过程中也观察到AE2蛋白高表达与疾病不良预后高度相关[32-35]。
和Cl-由胞外被转移入胞内,可导致细胞酸化并引发胞内“呼吸爆发”,进而活化活性氧相关信号转导途径引起细胞功能改变或诱导细胞凋亡发生。AE2的异常表达及活性改变可能是某些疾病状态发生的中间事件[30-31],在一些肿瘤发生的过程中也观察到AE2蛋白高表达与疾病不良预后高度相关[32-35]。
综合以上论述,细胞活性氧簇的大量产生与AE2表达及功能之间应存在某种复杂关系,为此,本研究探讨了在随染毒剂量增加,氧化应激激活且AE2蛋白表达升高的状态下,切牙成釉器细胞MAPKs信号通路3种主要蛋白激酶的活化及AP-1蛋白的核浆分布情况,实验结果显示,随着二氧化硫衍生物剂量升高,p-p38 MAPK/p38 MAPK及p-ERK/ERK水平较对照组未见明显变化,而p-JNK/JNK明显升高伴随着胞浆内c-Fos、c-Jun蛋白水平减少,核内c-Fos、c-Jun蛋白上升,提示AP-1蛋白发生核转位,ROS抑制剂能在一定程度上逆转高剂量二氧化硫衍生物暴露下引起的AE2蛋白表达上调及p-JNK/JNK水平升高,AP-1蛋白核转位情况亦有所改善。上述结果表明,二氧化硫衍生物可通过激活氧化应激并可能主要由ROS/JNK/AP-1信号通路诱导大鼠成釉器细胞AE2蛋白表达升高,具有对成釉器细胞的生理状态与功能产生不良影响的潜在毒性,由此推测二氧化硫衍生物具有影响切牙细胞生理功能、干扰牙齿正常形成与发育的潜能。可能涉及以下关键环节:二氧化硫衍生物激活成釉器细胞氧化应激,通过活化MAPKs/AP-1等信号通路诱导AE2表达上调,使其交换细胞内外离子的功能在总体上得到增强,而细胞酸化与胞内氧化应激的进一步发展增大了细胞负荷,甚至可能引起细胞凋亡的发生;另外,AE2表达上调与及功能激活使成釉细胞内外的离子稳态遭到破坏,与成釉细胞AE2的![]() 交换作用高度关联的顶端膜周期性H+分泌功能可能受到干扰,引起胞外基质酸碱水平改变,进而影响釉质晶体的形成,如图4所示。
交换作用高度关联的顶端膜周期性H+分泌功能可能受到干扰,引起胞外基质酸碱水平改变,进而影响釉质晶体的形成,如图4所示。

图4 二氧化硫体内衍生物通过ROS/JNK/AP-1通路
诱导成釉细胞AE2蛋白表达潜在机制示意图
注:CA表示碳酸酐酶。
Fig. 4 Schematic diagram of the potential mechanism of
internal sulfur dioxide derivatives inducing AE2 protein
expression in ameloblasts through ROS/JNK/AP-1 pathway
Note: CA stands for carbonic anhydrase.
综上,二氧化硫衍生物可激活大鼠切牙组织氧化应激并主要通过ROS/JNK/AP-1信号通路诱导成釉器细胞AE2蛋白表达上调,具有影响切牙细胞生理功能进而干扰牙齿正常形成与发育的潜能。这提示我们,在氟合并硫高背景地区“燃煤型氟斑牙”的产生可能具有更复杂的影响因素,因此,进一步深入探讨二氧化硫的这一“潜能”在“燃煤型氟斑牙”的形成过程中所发挥的作用,氧化应激与AE2在其中扮演了何种角色及此过程涉及的具体机制等问题将有助于从全新角度推进“燃煤型氟斑牙”患病机制的基础性研究。
[1] Lacruz R S, Habelitz S, Wright J T, et al. Dental enamel formation and implications for oral health and disease [J]. Physiological Reviews, 2017, 97(3): 939-993
[2] Yin K F, Paine M L. Bicarbonate transport during enamel maturation [J]. Calcified Tissue International, 2017, 101(5): 457-464
[3] Bronckers A L J J. Ion transport by ameloblasts during amelogenesis [J]. Journal of Dental Research, 2017, 96(3): 243-253
[4] 官志忠. 关注地方性氟中毒发病机制研究的重要性和热点问题[J]. 中华地方病学杂志, 2014, 33(2): 119-120
[5] 彭睿, 李玲, 管晓燕, 等. 氟斑牙发生的分子机制的研究现状[J]. 中华地方病学杂志, 2016, 35(1): 71-74
Peng R, Li L, Guan X Y, et al. Molecular mechanisms of dental fluorosis [J]. Chinese Journal of Endemiology, 2016, 35(1): 71-74 (in Chinese)
[6] 官志忠. 氧化应激在地方性氟中毒分子发病机制中的作用[J]. 中华地方病学杂志, 2016, 35(2): 79-82
Guan Z Z. Role of oxidative stress in molecular pathogenesis of endemic fluorosis [J]. Chinese Journal of Endemiology, 2016, 35(2): 79-82 (in Chinese)
[7] 李薛燕, 黄文丽. 氟中毒致机体损伤及其机制[J]. 国外医学: 医学地理分册, 2015, 36(3): 186-189
Li X Y, Huang W L. Injuries caused by fluorosis and its mechanisms [J]. Foreign Medical Sciences: Section of Medgeography, 2015, 36(3): 186-189 (in Chinese)
[8] 刘盘龙, 周红艳, 王东苗, 等. 氟牙症发病机制的研究进展[J]. 国际口腔医学杂志, 2013, 40(1): 94-97
Liu P L, Zhou H Y, Wang D M, et al. Research progress on pathogenesis of dental fluorosis [J]. International Journal of Stomatology, 2013, 40(1): 94-97 (in Chinese)
[9] 梁超轲, 何兆龙, 曹和赣, 等. 煤烟型氟中毒模拟实验及二氧化硫对氟中毒的影响[J]. 卫生研究, 1993, 22(3): 148-151, 190
Liang C K, He Z L, Cao H G, et al. Study on the joint effect of fluoride and sulphur dioxide from indoor coal burning on experimental animal through natural inhalation [J]. Journal of Hygiene Research, 1993, 22(3): 148-151, 190 (in Chinese)
[10] Gao Y, Liang C, Zhang J H, et al. Combination of fluoride and SO2 induce DNA damage and morphological alterations in male rat kidney [J]. Cellular Physiology and Biochemistry, 2018, 50(2): 734-744
[11] Zhang J H, Liang C, Ma J J, et al. Effects of sodium fluoride and sulfur dioxide on oxidative stress and antioxidant defenses in rat testes [J]. Fluoride, 2006, 39(3): 185-190
[12] 孟紫强, 李君灵. 二氧化硫生物学研究进展: 从毒理学到生理学[J]. 生理学报, 2011, 63(6): 593-600
Meng Z Q, Li J L. Progress in sulfur dioxide biology: From toxicology to physiology [J]. Acta Physiologica Sinica, 2011, 63(6): 593-600 (in Chinese)
[13] 孟紫强. 氧化应激效应与SO2全身性毒作用研究[J]. 中国公共卫生, 2003, 19(12): 1422-1424
Meng Z Q. Oxidation stress effects of SO2 and its systemic toxin [J]. China Public Health, 2003, 19(12): 1422-1424 (in Chinese)
[14] Houari S, Babajko S, Loiodice S, et al. Micro-dissection of enamel organ from mandibular incisor of rats exposed to environmental toxicants [J]. Journal of Visualized Experiments, 2018(133): 57081
[15] 褚启龙. 氧化应激与细胞凋亡关系的研究进展[J]. 卫生研究, 2003, 32(3): 276-279
Chu Q L. Research progress on oxidative stress and apoptosis [J]. Journal of Hygiene Research, 2003, 32(3): 276-279 (in Chinese)
[16] 武冬梅. 二氧化硫对小鼠不同组织器官的氧化应激、DNA损伤及细胞因子的影响[D]. 太原: 山西大学, 2004: 41-43
Wu D M. Effects of sulfur dioxide inhalation on the oxidative stress, DNA damage in tissues and cytokines in serum of mice [D]. Taiyuan: Shanxi University, 2004: 41-43 (in Chinese)
[17] 孟紫强, 白巨利. 二氧化硫吸入对小鼠9种脏器谷胱甘肽过氧化物酶活性的影响[J]. 环境与职业医学, 2003, 20(1): 6-9
Meng Z Q, Bai J L. Effect of sulfur dioxide inhalation on the activities of glutathione peroxidase in nine organs of mice [J]. Journal of Labour Medicine, 2003, 20(1): 6-9 (in Chinese)
[18] 孟紫强, 耿红, 秦国华, 等. 二氧化硫吸入对小鼠心脏脂质过氧化和抗氧化指标的影响[J]. 中华劳动卫生职业病杂志, 2003, 21(6): 448-449
[19] 孟紫强, 张波, 秦国华. 二氧化硫对小鼠不同组织器官的氧化损伤作用[J]. 环境科学学报, 2001, 21(6): 768-773
Meng Z Q, Zhang B, Qin G H. Oxidation damage of sulfur dioxide on various organs of mice [J]. Acta Scientiae Circumstantiae, 2001, 21(6): 768-773 (in Chinese)
[20] Kunsch C, Medford R M. Oxidative stress as a regulator of gene expression in the vasculature [J]. Circulation Research, 1999, 85(8): 753-766
[21] 朱建伟. MAPK/纤调蛋白信号通路在氧化应激介导慢性胰腺炎纤维化中的机制研究[D]. 上海: 中国人民解放军海军军医大学, 2018: 42-46
Zhu J W. The role of MAPK/fibromodulin pathway in pancreatic fibrosis induced by oxidative stress [D]. Shanghai: Naval Medical University, 2018: 42-46 (in Chinese)
[22] 李春雷. 理肺汤干预慢性阻塞性肺病通过MAPK/AP-1信号通路缓解氧化应激状态机制研究[D]. 北京: 北京中医药大学, 2017: 45-55
[23] Turi J L, Jaspers I, Dailey L A, et al. Oxidative stress activates anion exchange protein 2 and AP-1 in airway epithelial cells [J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2002, 283(4): L791-L798
[24] 饶胜芳. 高糖诱导血管内皮细胞AE2表达的动态改变及机制[D]. 南昌: 南昌大学, 2009: 35-43
Rao S F. Dynamic change and mechanism of anion exchange 2 (AE2) expression induced by high glucose in vascular endothelial cells [D]. Nanchang: Nanchang University, 2009: 35-43 (in Chinese)
[25] 李丽. 阴离子交换蛋白-2(AE2)在2型糖尿病大鼠血管内皮功能失常中的作用及其机制[D]. 南昌: 南昌大学, 2009: 25-37
Li L. Effects of anion exchanger-2 on endothelial disfunction in type 2 diabetic rats and its possible mechanisms [D]. Nanchang: Nanchang University, 2009: 25-37 (in Chinese)
[26] Bronckers A L J J, Lyaruu D M, Jansen I D C, et al. Localization and function of the anion exchanger Ae2 in developing teeth and orofacial bone in rodents [J]. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 2009, 312B(4): 375-387
[27] Damkier H H, Josephsen K, Takano Y, et al. Fluctuations in surface pH of maturing rat incisor enamel are a result of cycles of H+-secretion by ameloblasts and variations in enamel buffer characteristics [J]. Bone, 2014, 60: 227-234
[28] Lyaruu D M, Bronckers A L J J, Mulder L, et al. The anion exchanger Ae2 is required for enamel maturation in mouse teeth [J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2008, 27(2): 119-127
[29] Ghio A J, Nozik-Grayck E, Turi J, et al. Superoxide-dependent iron uptake: A new role for anion exchange protein 2 [J]. American Journal of Respiratory Cell and Molecular Biology, 2003, 29(6): 653-660
[30] Pan X Y, Chen G Q, Cai L, et al. Anion exchanger 2 mediates the action of arsenic trioxide [J]. British Journal of Haematology, 2006, 134(5): 491-499
[31] Huang Q R, Li Q, Chen Y H, et al. Involvement of anion exchanger-2 in apoptosis of endothelial cells induced by high glucose through an mPTP-ROS-Caspase-3 dependent pathway [J]. Apoptosis: An International Journal on Programmed Cell Death, 2010, 15(6): 693-704
[32] Wang T, Zhao L, Yang Y, et al. EGR1 is critical for gastrin-dependent upregulation of anion exchanger 2 in gastric cancer cells [J]. The FEBS Journal, 2013, 280(1): 174-183
[33] Zhang L J, Lu R, Song Y N, et al. Knockdown of anion exchanger 2 suppressed the growth of ovarian cancer cells via mTOR/p70S6K1 signaling [J]. Scientific Reports, 2017, 7: 6362
[34] Wu T T, Hsieh Y H, Wu C C, et al. Overexpression of anion exchanger 2 in human hepatocellular carcinoma [J]. The Chinese Journal of Physiology, 2006, 49(4): 192-198
[35] Hwang J M, Kao S H, Hsieh Y H, et al. Reduction of anion exchanger 2 expression induces apoptosis of human hepatocellular carcinoma cells [J]. Molecular and Cellular Biochemistry, 2009, 327(1-2): 135-144