氟喹诺酮类抗生素(fluoroquinolones, FQs)是在以4-喹诺酮为基本骨架的基础上引入氟原子,人工合成的一类抗生素[1]。FQs通过抑制DNA的促旋酶和拓扑异构酶Ⅳ,阻碍DNA的正常转录和复制从而产生杀菌作用[2]。常用的FQs包括环丙沙星(ciprofloxacin, CIP)、诺氟沙星(norfloxacin, NOR)和左氧氟沙星(levofloxacin, LEVO)(表1)。由于FQs具有抗菌范围广、抗菌活性强和价格低等优点[3],因此被广泛使用于人畜疾病的预防与治疗,其使用量近年来在世界范围内持续增长[4]。伴随FQs的大量使用,其不可避免地进入环境当中。水环境是FQs的主要环境归宿[5],近年来,FQs在全球范围内的水体中被频繁检出。其中河流和湖泊中的平均检出浓度达到ng·L-1。如孙秋根等[6]对我国太湖流域中宜溧-洮滆水系中FQs的研究发现其中氧氟沙星(ofloxacin, OFL)的检出率达到60.5%,FQs总检出浓度达到127~1 210 ng·L-1;Valdés等[7]在阿根廷的某河流中67%的样本中检测到FQs,其中OFL和CIP在上覆水中的最高检出浓度分别为69 ng·L-1和78 ng·L-1;付雨等[8]在我国白洋淀水体中检测出FQs的浓度达到0.738~2 004 ng·L-1;Wagil等[9]对波兰河流中FQs检测发现,其检出浓度达到2.7 μg·L-1。
表1 3种氟喹诺酮类抗生素(FQs)的分子结构
Table 1 Molecular structure of 3
fluoroquinolones (FQs)
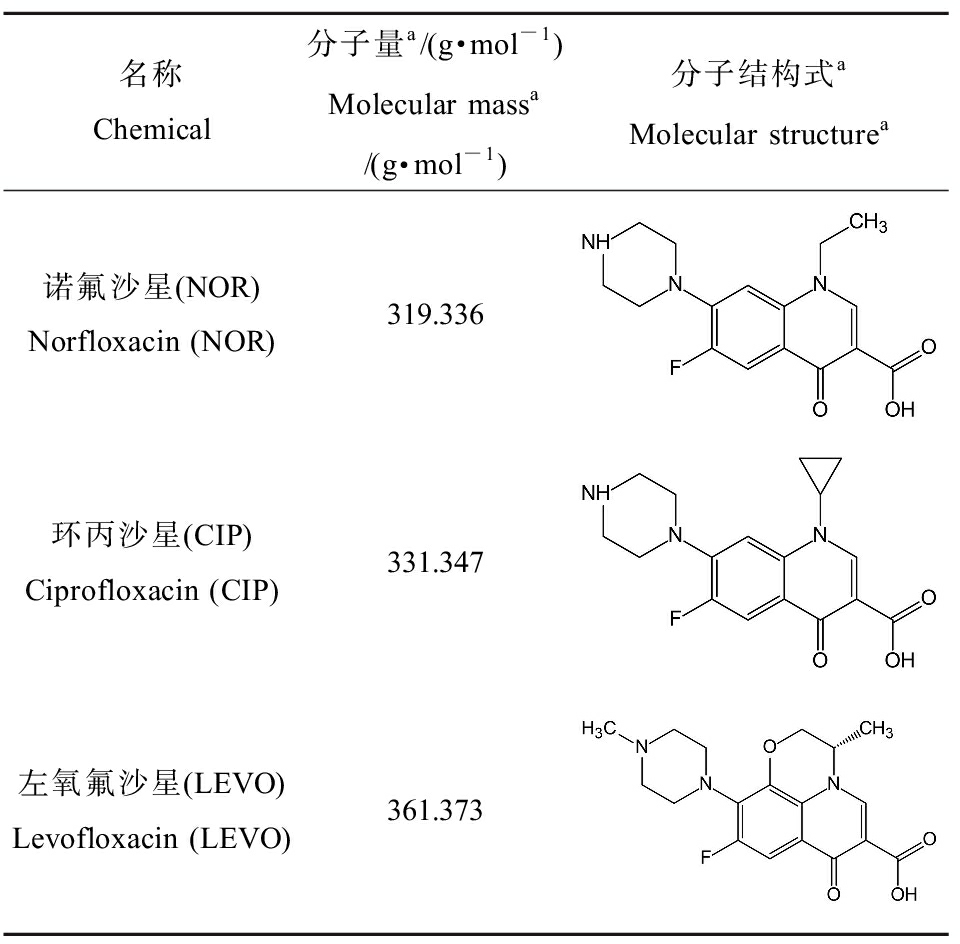
名称Chemical分子量a/(g·mol-1)Molecular massa/(g·mol-1)分子结构式aMolecular structurea诺氟沙星(NOR)Norfloxacin (NOR)319.336环丙沙星(CIP)Ciprofloxacin (CIP)331.347左氧氟沙星(LEVO)Levofloxacin (LEVO)361.373
注:a数据参考美国环境保护局(US EPA)(https://comptox.epa.gov/dashboard)。
Note: a Data refers to United States Environmental Protection Agency (US EPA) (https://comptox.epa.gov/dashboard).
已有大量研究表明,进入水环境中的FQs会对水生生物产生毒性作用,如导致水中微生物活性丧失和降低生物群落的多样性[10]。FQs还会积累在鱼类的组织中,影响鱼的发育,损害其心血管和代谢系统,并改变鱼的抗氧化和免疫反应[11]。目前,关于FQs对水生生物的急性毒性效应已引起了广泛关注,研究结果表明水生生物暴露于高浓度的FQs中会对其产生急性致死效应[12-13]。然而当前关于FQs生态毒理的研究大多是基于单独的某种FQs,而关于不同FQs联合作用的研究较少。在受FQs污染的水环境中,往往存在多种FQs[14]。如Du等[15]对盐城沿海地区25种抗生素的分布调查中发现一份样品中至少检出3种以上的FQs,且通过对FQs的风险评估发现单一FQs对水生生物的风险较低,而混合FQs产生的潜在风险可能高于预期风险;Liu等[16]调查胶州湾的湿地表层中FQs,发现所有样品中都检测到了FQs,共有8种FQs,其中NOR对环境可能达到中风险水平。鉴于此,为了合理评估FQs的潜在生态风险,需要针对不同种类FQs的联合生态毒理开展研究。
我国生态环境部在2020年12月发布的《化学物质环境与健康危害评估技术导则(试行)》[17]中明确指出,在进行生态毒理学数据的筛选和评估时应优先采用我国本土生物的实验数据。铜锈环棱螺(Bellamya aeruginosa)属于腹足纲田螺科的淡水软体动物,是我国淡水环境中一种主要底栖大型无脊椎动物。近年来,已有大量使用铜锈环棱螺对污染物生态毒性进行评价的相关研究见诸报道[18-20],本研究使用铜锈环棱螺幼螺为受试生物,以CIP、LEVO和NOR为目标污染物,考察了3种FQs单一及联合暴露的急性毒性效应,分析了联合作用模式。本研究结果可为合理评价FQs的潜在生态风险提供理论依据,并为发展铜锈环棱螺在生态毒理学中的应用提供参考。
1 材料与方法(Materials and methods)
1.1 测试生物
本次实验所用的铜锈环棱螺种螺采自吉首市峒河湿地公园洁净水体,在实验室人工控制条件下按照Ma[21]的方法进行培养:采用上覆水(水温(24±1) ℃,pH 7.99±0.15,硬度(78.4±3.3) mg·L-1)循环系统进行培养并连续繁殖,每日投喂一次商用鱼饲料(三元牌,中国),光周期为16 h∶8 h(光∶暗)。每日将新生幼螺挑出并单独培养。本研究选择同批次出生的大小均匀的健康幼螺(7日龄,(0.04±0.002) g)用于暴露实验。
1.2 个体毒性测试暴露方法
1.2.1 单一毒性测试
根据预实验结果将CIP和LEVO(98%,联硕生物科技有限公司,中国)暴露浓度设置为25、50、100、200和400 mg·L-1,NOR(98%,联硕生物科技有限公司,中国)暴露浓度设置为12.5、25、50、100和200 mg·L-1,并设空白对照组(0 mg·L-1)。每组设3个平行,所有溶液配制均使用超纯水。暴露实验于90 mm培养皿中进行,每个培养皿放入10只幼螺及46 mL对应浓度的溶液。在生化培养箱(SPL-250,天津市莱玻特瑞仪器设备有限公司,中国)中于25 ℃下暴露96 h,每24 h更换暴露液,每8 h观察并记录死亡螺数量,以将幼螺取出放入清水中静置观察10 min,期间幼螺无主动反应为死亡依据,螺死亡后及时取出。为确保数据有效性,共进行3次重复实验
1.2.2 二元、三元联合毒性测试
培养皿中加入二元复合工作液(CIP+NOR、CIP+LEVO、NOR+LEVO)及三元复合工作液(CIP+NOR+LEVO),其浓度均为相应FQs单独暴露下的10%致死浓度(LC10)、20%致死浓度(LC20)和半致死浓度(LC50)的等毒效应比混合,每组设3个平行。
1.3 联合毒性评价方法
采用毒性单位法(TU)、混合毒性指数法(MTI)对CIP、NOR和LEVO二元、三元联合毒性作用模式进行分析。
毒性单位法和混合毒性指数法对联合毒性作用模式的计算方法如公式(1)~(4)所示[22]。
TUi=Am/Ai
(1)
(2)
S0=S/(TUi)max
(3)
MTI=1-lg S/lg n
(4)
式中:TUi为混合物中i组分的毒性单位;Am为联合染毒后混合物中i组分相应的LC值(mg·L-1);Ai为i组分单独染毒后相应的LC值;S为各组分生物毒性单位相加之和;(TUi)max为混合物中所有组分的毒性单位的最大值;S0为生物毒性单位之和与毒性单位最大值的比值;MTI为混合毒性指数;n为混合物中各组分的种类个数。
联合毒性作用分为独立、相加、协同和拮抗4种作用类型,判断依据如表2所示[23]。
表2 联合毒性作用类型判断方法
Table 2 Combined toxicity type judgment method
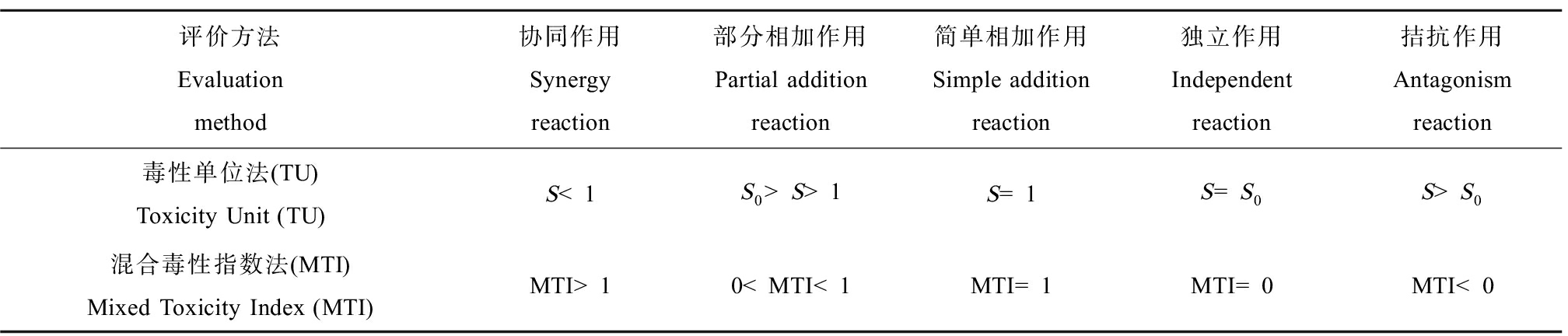
评价方法Evaluation method协同作用Synergy reaction部分相加作用Partial addition reaction简单相加作用Simple addition reaction独立作用Independent reaction拮抗作用Antagonism reaction毒性单位法(TU)Toxicity Unit (TU)S<1S0>S>1S=1S=S0S>S0混合毒性指数法(MTI)Mixed Toxicity Index (MTI) MTI>10
注:S表示各组分生物毒性单位相加之和,S0表示生物毒性单位之和与毒性单位最大值的比值。
Note: S represents the sum of the biological toxicity units of each component, and S0 represents the ratio of the sum of the biological toxicity units to the maximum value of the toxicity unit.
1.4 数据处理
使用SPSS 21.0软件,采用Probit回归模型分析计算LC10、LC20和LC50值;使用OriginLab 2021绘制随着时间和浓度增加死亡数变化的柱状图。
2 结果(Results)
2.1 单一暴露致死效应
图1显示了3种FQs在不同暴露时间段和浓度下铜锈环棱螺的死亡数量。总体而言,死亡数量与FQs暴露时间和浓度呈正比。如图1(a)所示,在25 mg·L-1和200 mg·L-1 CIP下暴露24 h不会导致幼螺发生死亡,死亡主要发生在暴露48 h,随着暴露时间的增加,死亡数随暴露浓度的增加而显著增加,最高暴露浓度下的幼螺死亡率最高;如图1(b)所示,在最低和最高浓度NOR下暴露24 h不造成幼螺死亡,死亡主要出现在72 h,随着暴露时间的增加死亡数增加;如图1(c)所示,LEVO暴露下死亡主要出现在24 h,其中100 mg·L-1处理组的死亡数在72 h时显著上升,96 h死亡数有所降低但仍高于24 h和48 h,在高浓度处理组(200 mg·L-1和400 mg·L-1)中,随着暴露时间的增加,死亡数有所增长。3种FQs对螺的急性致死效应按大小排列依次为NOR>CIP>LEVO。根据死亡数计算出96 h LC10、LC20和LC50如表3所示。
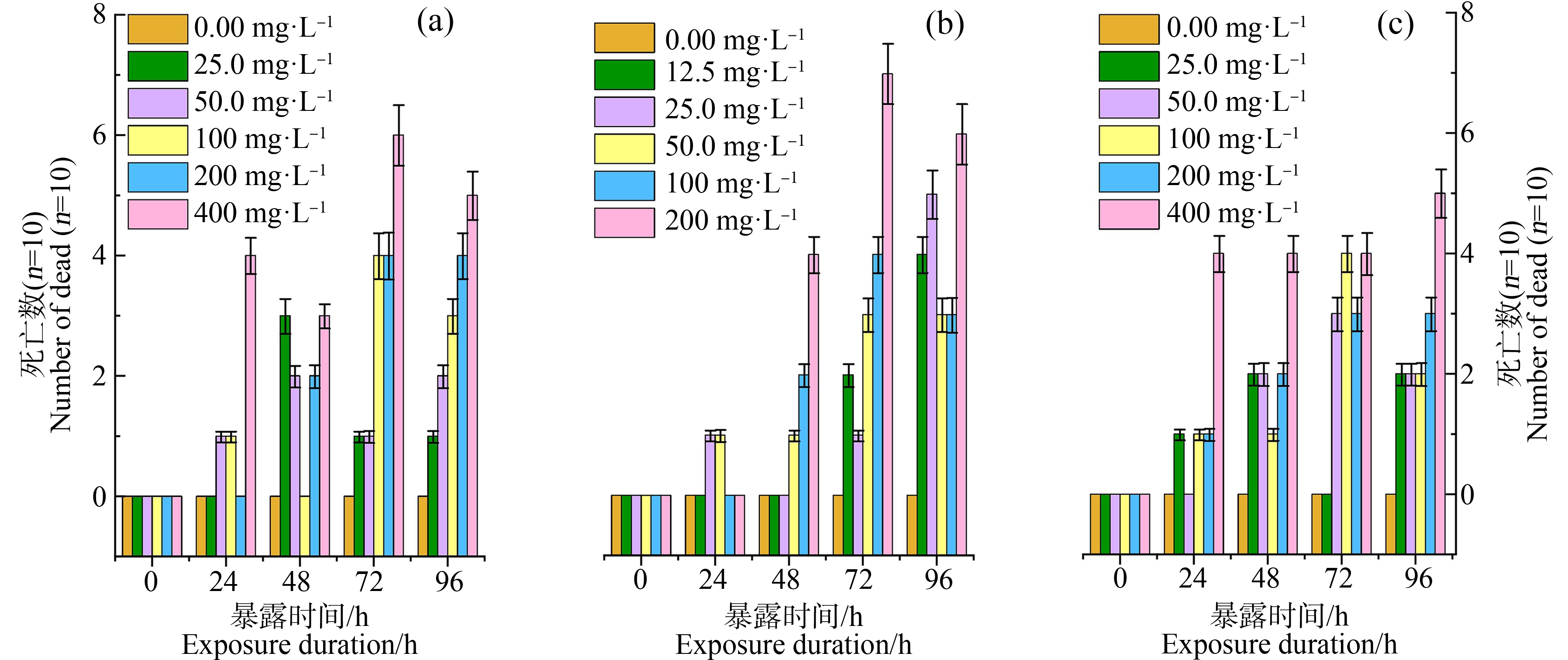
图1 FQs暴露不同时间下铜锈环棱螺死亡数量
注:(a) CIP;(b) NOR;(c) LEVO。
Fig. 1 Number of dead Bellamya aeruginosa under FQs exposure at different time
Note:(a) CIP; (b) NOR; (c) LEVO.
表3 3种FQs暴露96 h对铜锈环棱螺幼螺的致死效应
Table 3 Lethal effects of 3 kinds of FQs on Bellamya aeruginosa larva after exposure for 96 h (mg·L-1)
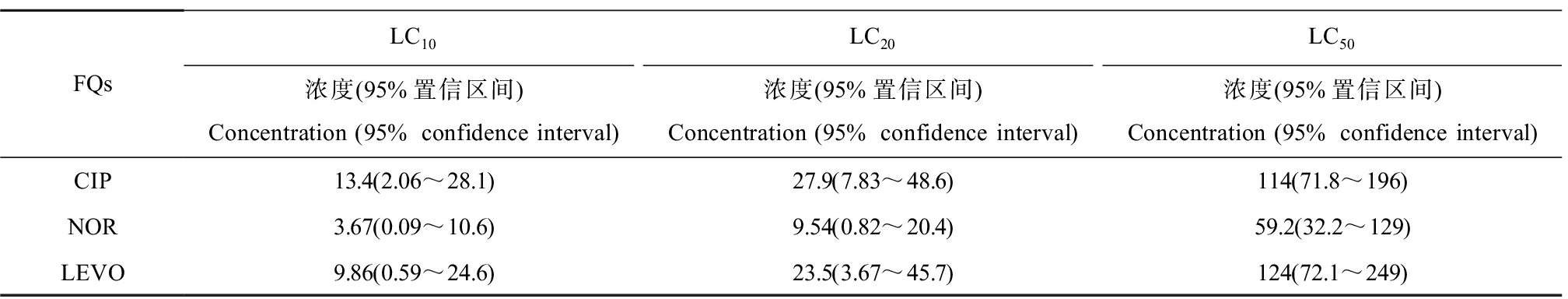
FQsLC10LC20LC50浓度(95%置信区间)Concentration (95% confidence interval)浓度(95%置信区间)Concentration (95% confidence interval)浓度(95%置信区间)Concentration (95% confidence interval)CIP13.4(2.06~28.1)27.9(7.83~48.6)114(71.8~196)NOR3.67(0.09~10.6)9.54(0.82~20.4)59.2(32.2~129)LEVO9.86(0.59~24.6)23.5(3.67~45.7)124(72.1~249)
2.2 联合暴露致死效应
二元体系(CIP+LEVO、CIP+NOR和NOR+LEVO)及三元体系(CIP+LEVO+NOR)对铜锈环棱螺幼螺的联合毒性评价分别如表4~7所示。由表4可知,CIP和LEVO联合暴露下,对螺的毒性作用在24 h均表现为拮抗作用;48 h LC10、LC20表现为协同作用,48 h LC50表现为拮抗作用;96 h LC10、LC20表现为协同作用,96 h LC50表现为部分相加作用。CIP和NOR(表5)以及NOR和LEVO(表6)联合暴露下表现出相同的作用,即对螺的毒性作用在24 h和48 h时均表现为拮抗作用,然而,在暴露至96 h时,转变为协同作用。CIP、NOR和LEVO联合暴露24 h对螺的毒性作用均为拮抗作用;48 h LC10表现为协同作用,48 h LC20表现为部分相加作用,48 h LC50表现为拮抗作用,96 h均表现为协同作用(表7)。
表4 CIP和LEVO联合暴露对铜锈环棱螺幼螺的毒性作用
Table 4 Toxic effects of CIP and LEVO combined exposure on Bellamya aeruginosa larva
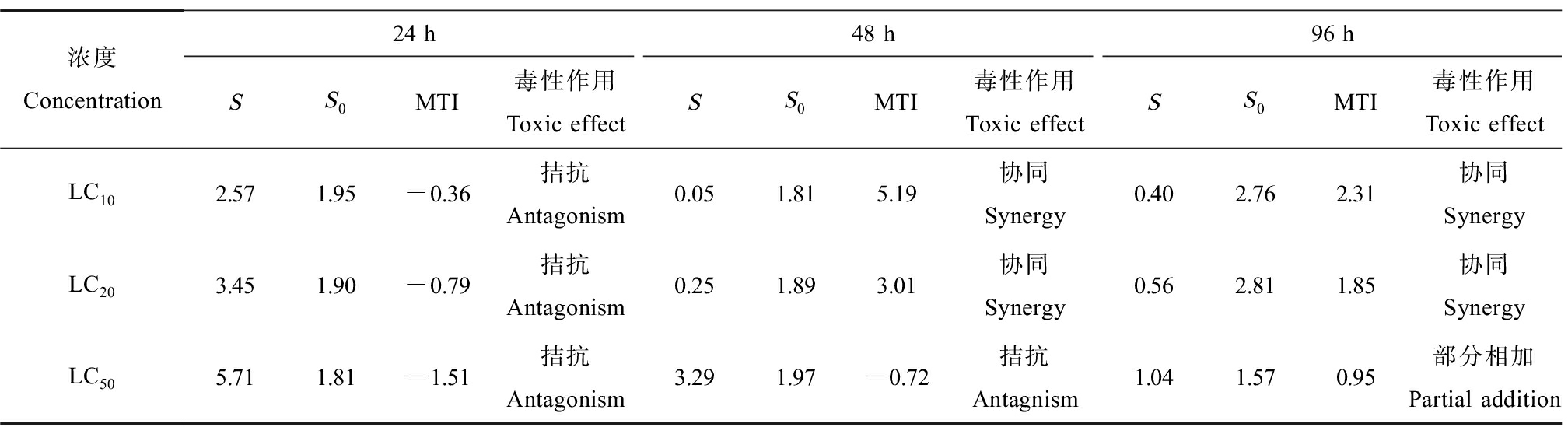
浓度Concentration24 h48 h96 hSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectLC102.571.95-0.36 拮抗Antagonism0.051.815.19协同Synergy0.402.762.31协同SynergyLC203.451.90-0.79 拮抗Antagonism0.251.893.01协同Synergy0.562.811.85协同SynergyLC505.711.81-1.51 拮抗Antagonism3.291.97-0.72 拮抗Antagnism1.041.570.95部分相加Partial addition
表5 CIP和NOR联合暴露对铜锈环棱螺幼螺的毒性作用
Table 5 Toxic effects of CIP and NOR combined exposure on Bellamya aeruginosa larva
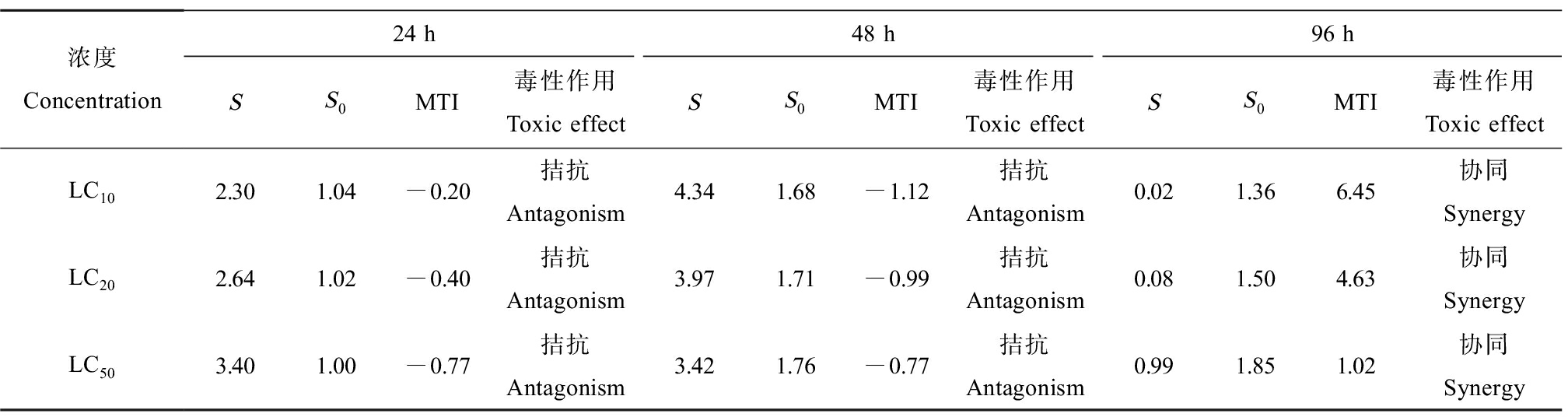
浓度Concentration24 h48 h96 hSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectLC102.301.04-0.20拮抗Antagonism4.341.68-1.12拮抗Antagonism0.021.366.45协同SynergyLC202.641.02-0.40拮抗Antagonism3.971.71-0.99拮抗Antagonism0.081.504.63协同SynergyLC503.401.00-0.77拮抗Antagonism3.421.76-0.77拮抗Antagonism0.991.851.02协同Synergy
表6 NOR和LEVO联合暴露对铜锈环棱螺幼螺的毒性作用
Table 6 Toxic effects of NOR and LEVO combined exposure on Bellamya aeruginosa larva
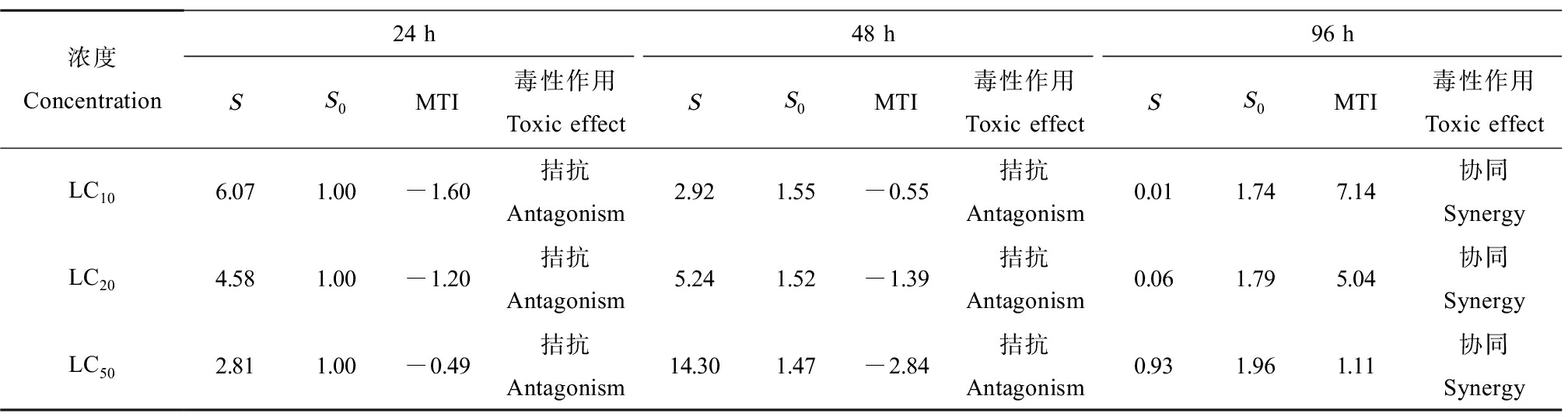
浓度Concentration24 h48 h96 hSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectLC106.071.00-1.60 拮抗Antagonism2.921.55-0.55 拮抗Antagonism0.011.747.14协同SynergyLC204.581.00-1.20 拮抗Antagonism5.241.52-1.39 拮抗Antagonism0.061.795.04协同SynergyLC502.811.00-0.49 拮抗Antagonism14.301.47-2.84 拮抗Antagonism0.931.961.11协同Synergy
表7 CIP、NOR和LEVO联合暴露对铜锈环棱螺幼螺的毒性作用
Table 7 Toxic effects of CIP, NOR and LEVO combined exposure on Bellamya aeruginosa larva
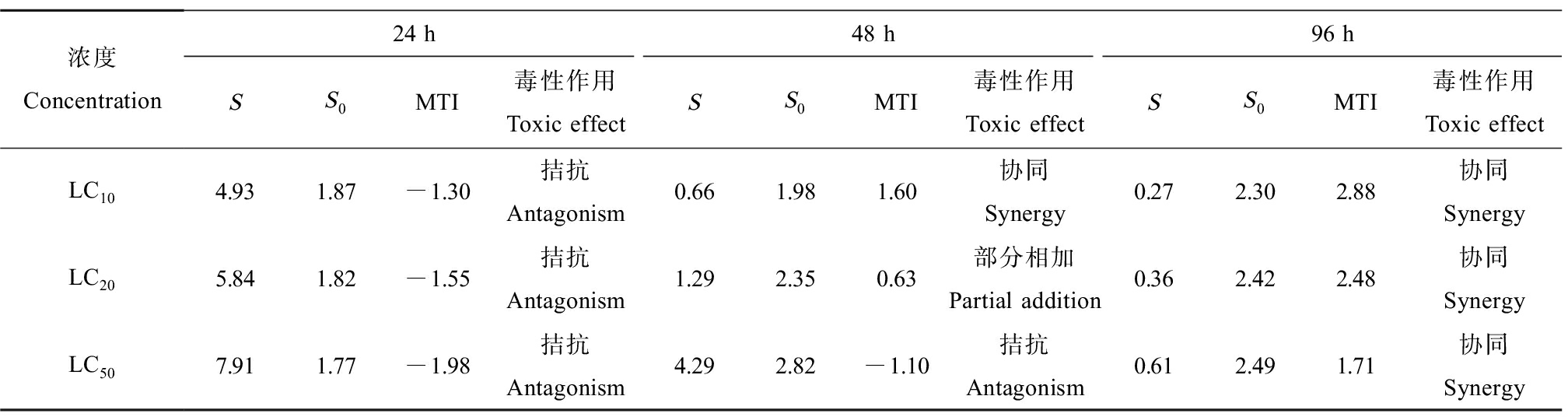
浓度Concentration24 h48 h96 hSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectSS0MTI毒性作用Toxic effectLC104.931.87-1.30 拮抗Antagonism0.661.981.60协同Synergy0.272.302.88协同SynergyLC205.841.82-1.55 拮抗Antagonism1.292.350.63部分相加Partial addition0.362.422.48协同SynergyLC507.911.77-1.98 拮抗Antagonism4.292.82-1.10 拮抗Antagonism0.612.491.71协同Synergy
3 讨论(Discussion)
本次研究中的3种FQs单一暴露下幼螺死亡数均随着时间和浓度的增加呈上升趋势。与本研究结果类似,Peltzer等[24]的研究表明,随着暴露于低浓度FQs的时间和浓度的增加,蟾蜍幼虫(Rhinella arenarum)生长和发育受到的影响会逐渐增加。Shen等[25]研究了多种FQs单一暴露24 h后斑马鱼的致死率,发现斑马鱼的致死率随着FQs浓度的增加而升高,与本次实验中铜锈环棱螺幼螺死亡率随浓度的增加而升高一致。通过比较本研究中3种FQs间的LC50可知NOR的毒性大于CIP和LEVO。He等[18]用NOR和OFL对铜锈环棱螺幼螺进行急性毒性实验,研究发现NOR的毒性大于OFL。根据《新化学物质危害评估导则》(HJ/T 154—2004)[26],化学品生态毒理学危害性按LC50可分为极高(≤1 mg·L-1)、高(>1~10 mg·L-1)、中(>10~100 mg·L-1)和低(>100 mg·L-1)。据此,CIP和LEVO对铜锈环棱螺幼螺属低度生态毒理学危害,而NOR属于中度危害。
目前关于不同FQs间联合毒性作用的研究已有一些报道,如Riaz等[27]研究了CIP、LEVO和恩诺沙星(enrofloxacin, ENR)联合暴露对小麦萌发和温室沙土培养下的短期毒性,结果表明FQs在低浓度下便会发生协同毒性作用;Wang等[14]探究了红霉素和ENR单一及联合暴露对小球藻的毒性,发现联合暴露对小球藻的抗氧化和光合系统有更大的刺激作用。上述研究结果与本文中暴露96 h后各浓度产生的毒性作用趋向于协同作用的结果一致,指示不同种类FQs的联合污染产生的风险不容忽视。此外,本研究结果还显示,在暴露至24 h时联合毒性作用均为拮抗,而在96 h时绝大部分均转为协同作用,仅有CIP+LEVO在LC50浓度下为部分相加作用。Magdaleno等[28]用6种抗生素分别二元联合对羊角月牙藻(Pseudokirchneriella subcapitata)进行了复合暴露,结果表明联合暴露产生的毒性作用在前期为拮抗作用,后期为协同作用,这与本研究结果一致。对于联合暴露毒性在前期表现为拮抗作用的原因可能是不同化合物间在生物体内发生了竞争吸收作用[29]。Xu等[30]的研究指出CIP可通过下调药物代谢酶CYP3A29的基因表达和阻碍CYP3A29与ENR的结合而延缓ENR在猪肝脏中的代谢,这可能是本研究中不同FQs间联合暴露毒性最终趋向协同作用的潜在机制。
目前针对FQs对水生生物毒性的研究大多使用国际上通用的模式生物,如Han等[31]研究了17种FQs对斑马鱼胚胎的致死效应,研究结果表明CIP和LEVO的LC50分别为619.618 mg·L-1和5 420.595 mg·L-1;Xi等[12]的研究表明1 200 mg·L-1的NOR对斑马鱼胚胎暴露96 h后,死亡率为46.7%。相比于本次实验所使用的铜锈环棱螺幼螺,上述研究中FQs对斑马鱼胚胎的LC50较高,指示铜锈环棱螺幼螺对FQs暴露的敏感性更高。Kergaravat等[32]使用大型溞(Daphnia magna)和网纹溞(Ceriodaphnia dubia)研究了莫西沙星(MOXI)的生态毒性,结果显示大型溞暴露48 h和72 h的LC50分别为14.2 mg·L-1和3.4 mg·L-1,网纹溞暴露48 h和72 h的LC50分别为29.2 mg·L-1和5.4 mg·L-1,表明水溞类对FQs暴露较为敏感。大量研究证实FQs在进入水环境后倾向于富集于沉积物当中,其在沉积物中浓度远高于地表水[33],因此开展基于沉积物介质的FQs生态毒理研究具有重要科学意义。为顺利开展该方面的研究迫切需要一种营沉积物栖居且对FQs较为敏感的受试生物,本研究结果表明本土淡水底栖大型无脊椎动物铜锈环棱螺对FQs暴露较为敏感,是一种适合开展FQs在我国水环境尤其是沉积物中生态风险评价的受试生物。
当前关于FQs对水生生物的毒性效应已受到大量关注,然而对于不同FQs的联合毒性效应研究较少。本研究考察了3种FQs单一及联合暴露对本土生物铜锈环棱螺幼螺的致死效应。单一暴露结果表明NOR对铜锈环棱螺幼螺为中度危害,而CIP和LEVO为低度危害。铜锈环棱螺对FQs暴露较为敏感,是一种适合开展FQs在我国水环境中生态风险评价的受试生物。联合暴露研究结果显示3种FQs的毒性作用趋向于协同作用,指示尽管FQs单独暴露导致的毒性效应较低,然而鉴于不同FQs往往共存于水环境当中,其联合毒性作用可能会导致更高的水生态风险,需对其开展深入研究。
[1] 沙乃庆, 李艳红. 氟喹诺酮类抗生素水污染现状及去除技术研究进展[J]. 工业水处理, 2021, 41(5): 22-28
Sha N Q, Li Y H. Current situation of water pollution and research progress treatment technology of fluoroquinolone antibiotics [J]. Industrial Water Treatment, 2021, 41(5): 22-28 (in Chinese)
[2] Xiao C Q, Han Y, Liu Y, et al. Relationship between fluoroquinolone structure and neurotoxicity revealed by zebrafish neurobehavior [J]. Chemical Research in Toxicology, 2018, 31(4): 238-250
[3] Dalla Bona M, Lizzi F, Borgato A, et al. Increasing toxicity of enrofloxacin over four generations of Daphnia magna [J]. Ecotoxicology and Environmental Safety, 2016, 132: 397-402
[4] Klein E Y, van Boeckel T P, Martinez E M, et al. Global increase and geographic convergence in antibiotic consumption between 2000 and 2015 [J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(15): E3463-E3470
[5] Manzetti S, Ghisi R. The environmental release and fate of antibiotics [J]. Marine Pollution Bulletin, 2014, 79(1-2): 7-15
[6] 孙秋根, 王智源, 董建玮, 等. 太湖流域河网4种典型抗生素的时空分布和风险评价[J]. 环境科学学报, 2018, 38(11): 4400-4410
Sun Q G, Wang Z Y, Dong J W, et al. Spatial-temporal distribution and risk evaluation of four typical antibiotics in river networks of Taihu Lake Basin [J]. Acta Scientiae Circumstantiae, 2018, 38(11): 4400-4410 (in Chinese)
[7] Valdés M E, Santos L H M L M, Rodríguez Castro M C, et al. Distribution of antibiotics in water, sediments and biofilm in an urban river (Córdoba, Argentina, LA) [J]. Environmental Pollution, 2021, 269: 116133
[8] 付雨, 剧泽佳, 付耀萱, 等. 白洋淀优势水生植物中喹诺酮类抗生素的生物富集特征及其与环境因子相关性研究[J]. 环境科学学报, 2021, 41(9): 3620-3630
Fu Y, Ju Z J, Fu Y X, et al. The bioaccumulation of quinolones (QNs) in the dominant macrophytes and the correlation with environmental factors in Baiyangdian Lake [J]. Acta Scientiae Circumstantiae, 2021, 41(9): 3620-3630 (in Chinese)
[9] Wagil M, Kumirska J, Stolte S, et al. Development of sensitive and reliable LC-MS/MS methods for the determination of three fluoroquinolones in water and fish tissue samples and preliminary environmental risk assessment of their presence in two rivers in northern Poland [J]. The Science of the Total Environment, 2014, 493: 1006-1013
[10] Grenni P, Ancona V, Caracciolo A. Ecological effects of antibiotics on natural ecosystems: A review [J]. Microchemical Journal, 2018, 136: 25-39
[11] Yang C, Song G, Lim W. A review of the toxicity in fish exposed to antibiotics [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2020, 237: 108840
[12] Xi J L, Liu J, He S J, et al. Effects of norfloxacin exposure on neurodevelopment of zebrafish (Danio rerio) embryos [J]. Neurotoxicology, 2019, 72: 85-94
[13] Liang X M, Wang F, Li K, et al. Effects of norfloxacin nicotinate on the early life stage of zebrafish (Danio rerio): Developmental toxicity, oxidative stress and immunotoxicity [J]. Fish & Shellfish Immunology, 2020, 96: 262-269
[14] Wang G X, Zhang Q, Li J L, et al. Combined effects of erythromycin and enrofloxacin on antioxidant enzymes and photosynthesis-related gene transcription in Chlorella vulgaris [J]. Aquatic Toxicology, 2019, 212: 138-145
[15] Du J, Zhao H X, Liu S S, et al. Antibiotics in the coastal water of the South Yellow Sea in China: Occurrence, distribution and ecological risks [J]. The Science of the Total Environment, 2017, 595: 521-527
[16] Liu K, Yin X F, Zhang D L, et al. Distribution, sources, and ecological risk assessment of quinotone antibiotics in the surface sediments from Jiaozhou Bay wetland, China [J]. Marine Pollution Bulletin, 2018, 129(2): 859-865
[17] 中华人民共和国生态环境部. 化学物质环境与健康危害评估技术导则(试行)[S]. 北京: 中华人民共和国生态环境部, 2020
[18] He S W, Sun Q Y, Liu Y, et al. Acute toxicity, bioaccumulation, and bioreduction of two antibiotics, norfloxacin and ofloxacin, in the snail Bellamya aeruginosa [J]. Water, Air, & Soil Pollution, 2020, 231(3): 96
[19] Ma T W, Wang M, Gong S J, et al. Impacts of sediment organic matter content and pH on ecotoxicity of coexposure of TiO2 nanoparticles and cadmium to freshwater snails Bellamya aeruginosa [J]. Archives of Environmental Contamination and Toxicology, 2017, 72(1): 153-165
[20] Li Q, Wang M, Duan L, et al. Multiple biomarker responses in caged benthic gastropods Bellamya aeruginosa after in situ exposure to Taihu Lake in China [J]. Environmental Sciences Europe, 2018, 30(1): 34
[21] Ma T W. Laboratory culture of the freshwater benthic gastropod Bellamya aeruginosa (Reeve) and its utility as a test species for sediment toxicity [J]. Journal of Environmental Sciences, 2010, 22(2): 304-313
[22] 徐怡璐, 吴彬, 石倩倩, 等. 锰铅镉复合暴露对人神经母细胞瘤细胞的毒性作用[J]. 环境与健康杂志, 2019, 36(8): 679-684
Xu Y L, Wu B, Shi Q Q, et al. Toxicity of co-exposure to manganese, lead and cadmium to SK-N-SH cells [J]. Journal of Environment and Health, 2019, 36(8): 679-684 (in Chinese)
[23] 汪皓琦, 董玉瑛, 汪灵伟. 3种新型污染物对发光菌的毒性作用研究[J]. 生态毒理学报, 2018, 13(4): 179-184
Wang H Q, Dong Y Y, Wang L W. Study on the toxicity of three emerging pollutants to Photobacterium phosphoreum [J]. Asian Journal of Ecotoxicology, 2018, 13(4): 179-184 (in Chinese)
[24] Peltzer P M, Lajmanovich R C, Attademo A M, et al. Ecotoxicity of veterinary enrofloxacin and ciprofloxacin antibiotics on anuran amphibian larvae [J]. Environmental Toxicology and Pharmacology, 2017, 51: 114-123
[25] Shen R, Yu Y C, Lan R, et al. The cardiovascular toxicity induced by high doses of gatifloxacin and ciprofloxacin in zebrafish [J]. Environmental Pollution, 2019, 254(Pt B): 112861
[26] 中华人民共和国国家环境保护总局. 新化学物质危害评估导则: HJ/T 154—2004[S]. 北京: 中华人民共和国国家环境保护总局, 2004
[27] Riaz L, Mahmood T, Coyne M S, et al. Physiological and antioxidant response of wheat (Triticum aestivum) seedlings to fluoroquinolone antibiotics [J]. Chemosphere, 2017, 177: 250-257
[28] Magdaleno A, Saenz M E, Juarez A B, et al. Effects of six antibiotics and their binary mixtures on growth of Pseudokirchneriella subcapitata [J]. Ecotoxicology and Environmental Safety, 2015, 113: 72-78
[29] Jia J, Zhu F, Ma X H, et al. Mechanisms of drug combinations: Interaction and network perspectives [J]. Nature Reviews Drug Discovery, 2009, 8(2): 111-128
[30] Xu X Q, Lu Q, Yang Y, et al. A proposed “steric-like effect” for the slowdown of enrofloxacin antibiotic metabolism by ciprofloxacin, and its mechanism [J]. Chemosphere, 2021, 284: 131347
[31] Han Y, Ma Y Y, Yao S C, et al. In vivo and in silico evaluations of survival and cardiac developmental toxicity of quinolone antibiotics in zebrafish embryos (Danio rerio) [J]. Environmental Pollution, 2021, 277: 116779
[32] Kergaravat S V, Gagneten A M, Hernandez S R. Development of an electrochemical method for the detection of quinolones: Application to cladoceran ecotoxicity studies [J]. Microchemical Journal, 2018, 141: 279-286
[33] van Doorslaer X, Dewulf J, van Langenhove H, et al. Fluoroquinolone antibiotics: An emerging class of environmental micropollutants [J]. The Science of the Total Environment, 2014, 500-501: 250-269