阿维菌素(avermectin, AVM)是一类具有杀菌、杀虫、杀螨、杀线虫活性的十六元大环内酯化合物。作为甲胺磷等高毒农药的替代品,AVM由于具有杀虫范围广、效果明显持久且相对安全可靠等优点,顺应了现代农业对农药的要求,在世界范围内被广泛应用[1-2]。其衍生物伊维菌素(ivermectin, IVM)对寄生虫特别是线虫和节肢动物均有较好的防治效果,被广泛应用于农业、畜牧业、医药行业和水产养殖中的害虫防治剂[3]。AVM和IVM是高脂溶性的,不论以何种途径给药,进入动物体内后残留时间长且代谢很少,大部分是以原药的形式经粪尿排出体外[4]。因此,该类药物除在农业生产和畜禽水产养殖过程中通过直接喷洒进入环境外,还可能随畜禽类生物的代谢物进入水体环境[5-6],其对非靶标生物的毒性效应及其生态风险值得关注。该类药物还可能通过诱导DNA损伤和AMPK/mTOR信号通路介导的自噬产生遗传毒性和细胞毒性,从而对人类健康构成潜在风险[7]。
大型蚤(Daphnia magna)为甲壳纲的枝角类浮游动物,广泛分布于淡水水域。它以水环境初级生产者淡水绿藻类为食,同时又是鱼和无脊椎捕食动物的天然饵料,是水生态系统中物质循环和能量流动的重要环节[8]。作为静水生态系统的关键属,大型蚤不仅具有重要的生态意义,而且具有生殖周期短、繁殖迅速、对水体中有害污染物敏感等特点,在水生生态毒理学和环境风险评估中得到了广泛的应用[9-10]。本研究以水生态初级生产者淡水绿藻和浮游动物大型蚤为模式生物,在考察AVM和IVM对斜生栅藻和大型蚤急性毒性的基础上,探讨2种杀虫剂对大型蚤生长繁殖等的影响,为评价AVM、IVM对水生态环境的影响及可能的健康风险提供科学依据。
1 材料与方法(Materials and methods)
斜生栅藻(Scenedesmus obliquus)购自中国科学院水生生物研究所,以水生4号(HB-IV)培养基、人工气候箱中驯养1个月后进行试验。大型蚤购自武汉科乐多生物科技有限公司,选用OECD M4培养基作为培养液,实验室培养4代后,以出生6~24 h的同批幼蚤进行毒性试验。AVM和IVM原药购自湖北猫尔沃生物医药有限公司,试验所用其余试剂均为分析纯(纯度均为99%),实验用水为超纯水。
将处于对数生长期的斜生栅藻接种到150 mL锥形瓶中,实验初始藻细胞密度约7.0×105 个·mL-1,总体积100 mL。设置AVM和IVM的试验浓度梯度均为0、20、40、80、160、320和640 mg·L-1。每个试验浓度组设3次重复,试验期间保持光暗比12 h∶12 h,光照强度4 500~5 000 lx,培养温度(24±1) ℃[11]。药物暴露96 h后用血球计数法计量细胞数量,计算AVM和IVM对藻细胞的生长抑制率。大型蚤急性毒性试验按照ISO 6341—2012标准试验方法进行[12]。试验容器为50 mL烧杯,盛40 mL试验溶液,每个烧杯中放5只幼蚤,AVM和IVM的大型蚤暴露浓度均设置为0、0.1、0.4、1.6、6.4和25.6 μg·L-1,水温20~22 °C,光照周期为16 h光照∶8 h黑暗,试验期间不喂食,每个浓度4组平行,连续暴露48 h后,记录大型蚤的死亡情况,计算AVM和IVM对大型蚤半数致死浓度(LC50)值。根据急性毒性试验求得的2种药物对大型蚤LC50值,慢性试验的AVM、IVM浓度设置分别为0、0.01、0.02、0.04、0.08、0.16 μg·L-1和0.0038、0.0075、0.015、0.03、0.06 μg·L-1,慢性毒性试验参照杨晓凡等[13]的方法。每个烧杯中放1只幼蚤,每浓度设置10个平行,染毒过程中保证蚤类的生活环境适宜和食物充足,并且每天定时观察、记录和分离幼蚤,每3 d更换一次培养液,其余条件与急性毒性试验相同。
利用Origin 8.0软件进行斜生栅藻急性毒性剂量效应曲线的拟合,利用SPSS 17.0软件计算AVM和IVM对大型蚤的LC50值及95%置信区间;通过Duncan法进行组间差异显著性分析,数据结果采用means±SD的方法。
2 结果与讨论(Results and discussion)
2.1 AVM和IVM对斜生栅藻的毒性作用
利用非线性最小二乘拟合(NLSF)模块下的DoseResp模型对斜生栅藻96 h生长抑制结果进行线性拟合,进而求得AVM和IVM对藻生长抑制率的浓度-效应曲线(图1)。由图1可知,20~160 mg·L-1的2种农药暴露下,斜生栅藻的生长抑制曲线变化较为平缓;药物浓度增至320 mg·L-1后,AVM对藻细胞的生长抑制率显著增大,并且远高于相同浓度IVM的抑制率;至最高浓度640 mg·L-1,AVM和IVM对斜生栅藻的抑制率分别达55.73%和41.84%。表明AVM对斜生栅藻的生长抑制作用较IVM更强。
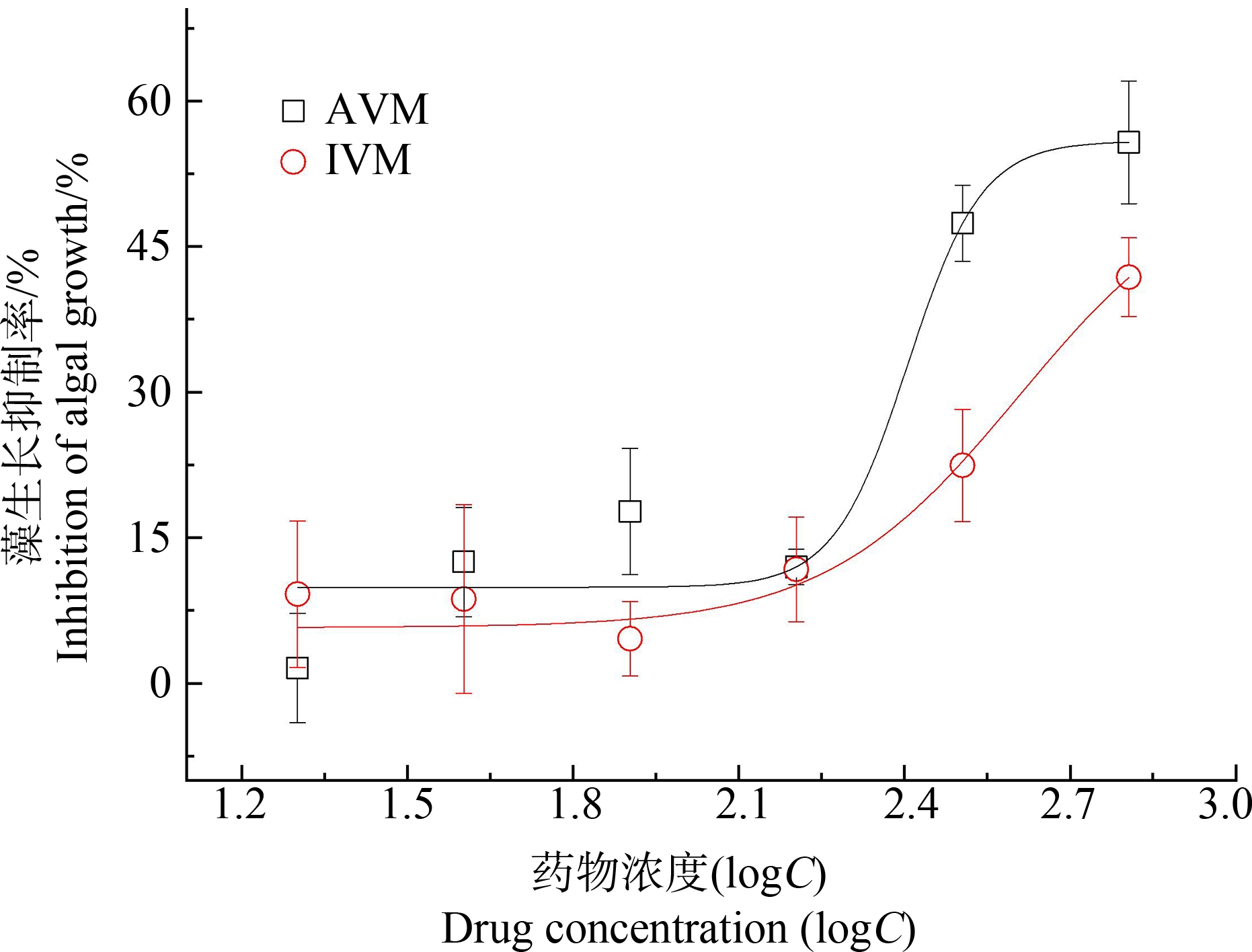
图1 阿维菌素(AVM)和伊维菌素(IVM)暴露的
斜生栅藻急性毒性剂量效应曲线
Fig. 1 Dose-response curves of acute toxicity of
Scenedesmus obliquus exposed
to avermectin (AVM) and ivermectin (IVM)
目前的研究证明,AVM类药物对植物的毒性作用远小于非靶标动物。Tišler和Eržen[6]通过21 d暴露实验研究发现AVM对水环境大型蚤的生存和繁殖具有极高的毒性,而淡水绿藻(Scenedesmus subspicatus)对AVM的响应并不敏感,20 mg·L-1的AVM对藻细胞生长抑制率达到100%。本研究640 mg·L-1的AVM和IVM对斜生栅藻的生长抑制率为50%左右,可见2种药物对淡水绿藻的生长抑制作用并不明显。但张卫卫等[14]研究发现植物伊乐藻(Elodea nuttallii)对于AVM具有明显的吸收和富集作用。经AVM淋溶后的土壤淋出液会造成浮萍(Lemna minor L.)叶绿素含量降低[15]。在群落水平上,AVM类药物短期暴露可显著影响水体浮游植物群落结构。向主养草鱼的池塘中施用AVM 6 d后,水体浮游植物优势种变化显著,小型浮游植物种类增多[16]。此外,Macar[17]报道了AVM对洋葱鳞茎具有细胞毒性和遗传毒性,表现为经AVM暴露的细胞有丝分裂指数下降、染色体异常,超氧化物歧化酶、过氧化氢酶活性和丙二醛含量等氧化应激指示升高。而Muhammad等[18]通过系统分析AVM喷洒水稻后其转录组的变化,发现施药情况下水稻突变的基因数量为0.91%,表明其对水稻生产性能影响不明显。
2.2 AVM和IVM对大型蚤的急性毒性
由图2可知2种药物对大型蚤48 h急性毒性影响,在0.1~6.4 μg·L-1的药物作用浓度范围内,IVM对大型蚤的致死作用始终大于AVM,至最高浓度25.6 μg·L-1时,2种药物暴露的大型蚤死亡率均达到100%。计算得到AVM和IVM 48 h急性毒性LC50值分别为1.43 μg·L-1和0.5 μg·L-1,相应的95%置信区间为0.76~2.74 μg·L-1和0.23~0.96 μg·L-1(表1)。根据化学农药环境安全评价试验准则中农药对大型甲壳类生物急性毒性划分标准,AVM和IVM对大型蚤均为剧毒(LC50-48h值远小于0.1 mg·L-1)[19],且IVM对大型蚤的急性致死作用较AVM更强。
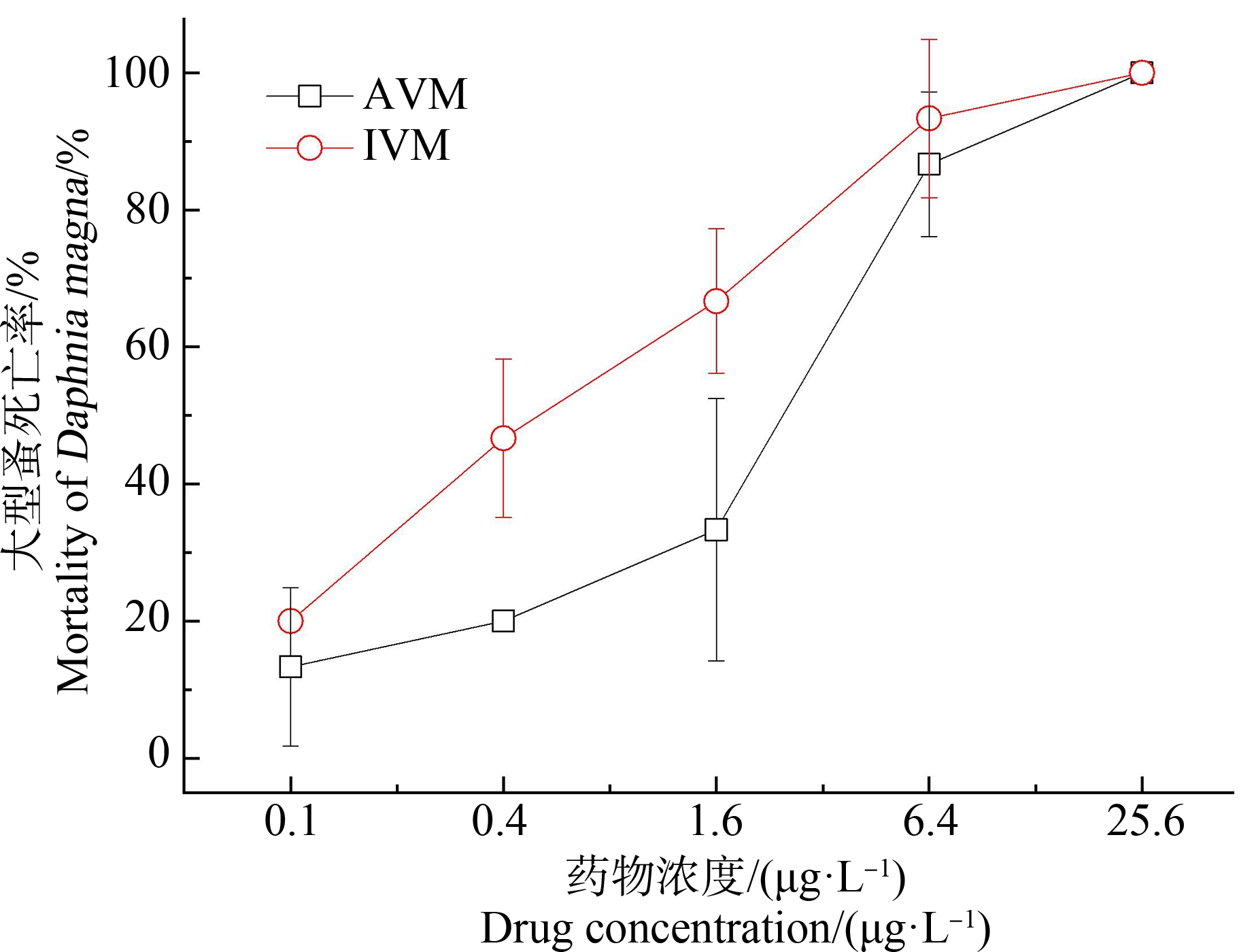
图2 AVM和IVM对大型蚤的急性致死作用
Fig. 2 Acute lethal effects of AVM and IVM
on Daphnia magna
表1 AVM和IVM对大型蚤LC50-48h及置信区间
Table 1 LC50-48h and confidence interval of AVM
and IVM for Daphnia magna

药物名称Drug nameLC50/(μg·L-1)95%置信区间/(μg·L-1)95% confidence interval/(μg·L-1)AVM1.430.76~2.74IVM0.510.23~0.96
与对植物的毒性影响不同的是,AVM类药物对水生动物具有强烈的毒性作用[6, 20]。王锡珍和陆宏达[21]采用换液法求得AVM对大型蚤的LC50-48h为0.37 μg·L-1,AVM对供试淡水水生动物的毒性依次为:大型蚤>异育银鲫鱼苗>鲢鱼苗>异育银鲫鱼种>食蚊鱼>幼蟹>青虾>圆田螺。IVM对淡水常见桡足类近邻剑水蚤48 h的LC50值为0.16 μg·L-1[22]。本研究AVM和IVM对大型蚤的LC50-48h值分别为1.43 μg·L-1和0.51 μg·L-1,表明2种药物对大型蚤的毒性远大于对淡水绿藻的。
2.3 AVM和IVM对大型蚤生长的影响
大型蚤于不同浓度的AVM中暴露第9天起,最高浓度组(0.16 μg·L-1)的大型蚤开始出现死亡,暴露21 d后,最大浓度组的死亡率达到60%;IVM的0.03 μg·L-1和0.06 μg·L-1暴露组从第7天开始出现死亡,21 d后的0.03 μg·L-1和0.06 μg·L-1暴露组大型蚤死亡率分别达40%和50%。从药物暴露后存活的各浓度组中随机选取3组进行体长、繁殖等指标的测定和计算。AVM和IVM暴露21 d的大型蚤体长变化如图3所示,结合显著性差异分析结果可见,低浓度0.01~0.04 μg·L-1的AVM暴露下,大型蚤体长稍有降低,与对照组无显著性差异;0.08 μg·L-1和0.16 μg·L-1浓度组的大型蚤体长分别为对照组的90.8%和78.0%,显著低于对照。IVM暴露的大型蚤自0.0075 μg·L-1浓度组开始显著低于对照,此后随着药物暴露浓度的增大,大型蚤体长缓慢降低。0.0075~0.06 μg·L-1的IVM暴露组大型蚤体长分别相当于对照值的89.7%、88.2%、87.5% 和84.1%。

图3 AVM和IVM暴露21 d的大型蚤体长变化
Fig. 3 Body length changes of Daphnia magna exposed to AVM and IVM for 21 d
2.4 AVM和IVM对大型蚤繁殖的影响
AVM和IVM暴露21 d后大型蚤生殖指标的变化情况分别如表2和表3所示,包括第一次产卵时间、第一次产卵数等。由表3可知,在整个药物作用浓度范围内,大型蚤第一次产卵时间和每只母蚤的胎数与对照组相比均无显著差异;但第一次产卵数、每只母蚤产幼蚤总数和净生殖率均随药物暴露浓度的升高而降低,自0.02 μg·L-1暴露组开始,以上3个指标均随着药物暴露浓度的增大显著低于对照。相比之下,内禀增长率自最低浓度0.01 μg·L-1暴露组开始即显著低于对照,此后随着药物暴露浓度的增大更加显著地降低,表明大型蚤的内禀增长率和净生殖率是对AVM较为敏感的指标[23]。
表2 AVM对大型蚤慢性毒性(生殖影响)
Table 2 Chronic toxicity of AVM on reproduction of Daphnia magna
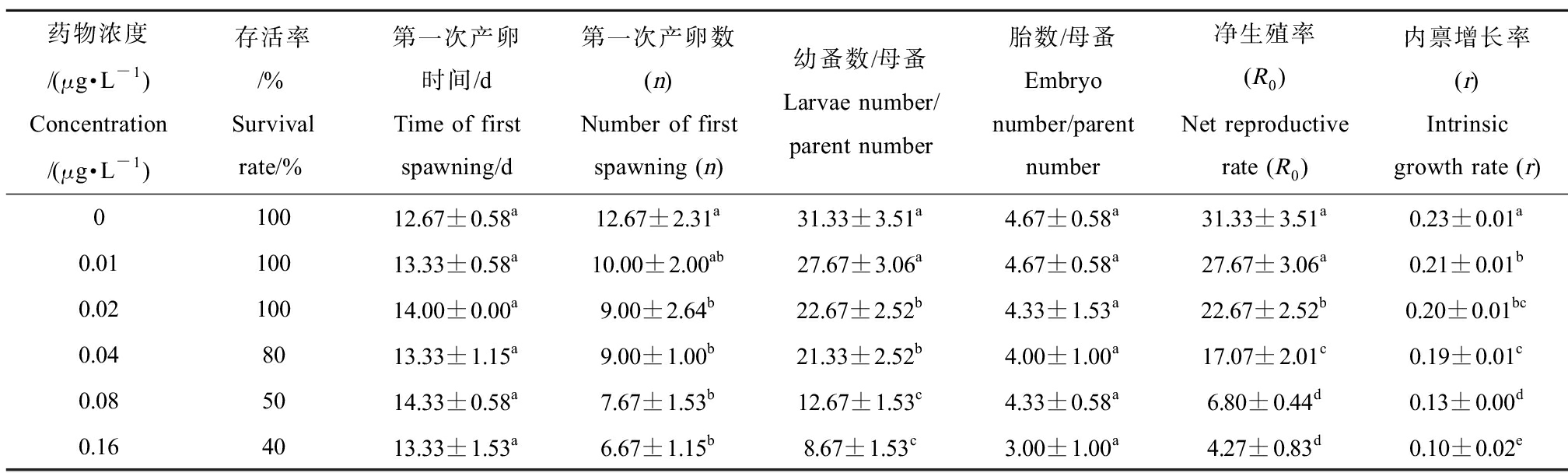
药物浓度/(μg·L-1)Concentration/(μg·L-1)存活率/%Survival rate/%第一次产卵时间/dTime of first spawning/d第一次产卵数(n)Number of first spawning (n)幼蚤数/母蚤Larvae number/parent number胎数/母蚤Embryo number/parent number净生殖率(R0)Net reproductive rate (R0)内禀增长率(r)Intrinsic growth rate (r)010012.67±0.58a12.67±2.31a31.33±3.51a4.67±0.58a31.33±3.51a0.23±0.01a0.0110013.33±0.58a10.00±2.00ab27.67±3.06a4.67±0.58a27.67±3.06a0.21±0.01b0.0210014.00±0.00a9.00±2.64b22.67±2.52b4.33±1.53a22.67±2.52b0.20±0.01bc0.048013.33±1.15a9.00±1.00b21.33±2.52b4.00±1.00a17.07±2.01c0.19±0.01c0.085014.33±0.58a7.67±1.53b12.67±1.53c4.33±0.58a6.80±0.44d0.13±0.00d0.164013.33±1.53a6.67±1.15b8.67±1.53c3.00±1.00a4.27±0.83d0.10±0.02e
注:同一列的不同字母表示不同浓度药物暴露条件下指标差异显著(P<0.05),下同。
Note: Different letters in the same column indicate significant differences in indexes under different concentrations of drug exposure (P<0.05); the same as below.
由表3可知IVM对大型蚤的生殖毒性,除第一次产卵时间在整个药物的作用浓度范围内与对照组相比均无显著差异外,其余生殖指标均随IVM暴露剂量的增大而表现出显著降低的变化趋势。其中对IVM最敏感的为幼蚤数/母蚤和净生殖率,从0.0075 μg·L-1开始即显著低于对照;内禀增长率则从0.015 μg·L-1开始显著低于对照。相比之下,第一次产卵数和胎数/母蚤则从0.03 μg·L-1暴露组开始显著低于对照。
表3 IVM对大型蚤慢性毒性(生殖影响)
Table 3 Chronic toxicity of IVM on reproduction of Daphnia magna
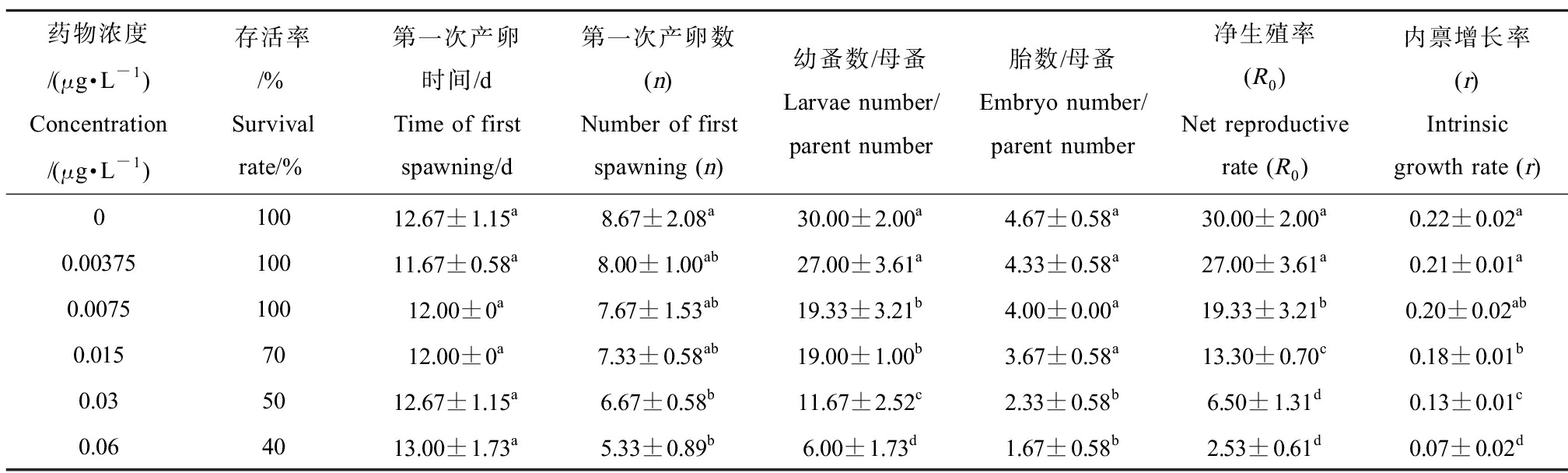
药物浓度/(μg·L-1)Concentration/(μg·L-1)存活率/%Survival rate/%第一次产卵时间/dTime of first spawning/d第一次产卵数(n)Number of first spawning (n)幼蚤数/母蚤Larvae number/parent number胎数/母蚤Embryo number/parent number净生殖率(R0)Net reproductive rate (R0)内禀增长率(r)Intrinsic growth rate (r)010012.67±1.15a8.67±2.08a30.00±2.00a4.67±0.58a30.00±2.00a0.22±0.02a0.0037510011.67±0.58a8.00±1.00ab27.00±3.61a4.33±0.58a27.00±3.61a0.21±0.01a0.007510012.00±0a7.67±1.53ab19.33±3.21b4.00±0.00a19.33±3.21b0.20±0.02ab0.0157012.00±0a7.33±0.58ab19.00±1.00b3.67±0.58a13.30±0.70c0.18±0.01b0.035012.67±1.15a6.67±0.58b11.67±2.52c2.33±0.58b6.50±1.31d0.13±0.01c0.064013.00±1.73a5.33±0.89b6.00±1.73d1.67±0.58b2.53±0.61d0.07±0.02d
生长、繁殖作用等是常被用来评价污染物对大型蚤慢性毒性作用的指标[24]。Lopes等[25]通过试验观察到IVM对大型蚤生长、繁殖的最小有作用剂量为0.01 ng·L-1。AVM和IVM对大型蚤的慢性毒性较铅、镉等重金属和毒死蜱、三唑磷、氟虫腈等农药[26]、全氟化合物[27]等都更加明显。本研究发现AVM和IVM对大型蚤具有较明显的慢性生长抑制和生殖毒性,表现为较高浓度药物暴露下,大型蚤体长、第一次产卵数、幼蚤数/母蚤、净生殖率和内禀增长率均显著降低,尤其以净生殖率和内禀增长率对药物更为敏感。这可能是由于AVM影响了大型蚤生理指标及抗氧化能力的结果。Mahmoud[28]以LC50-96h值的1/10暴露尼罗罗非鱼后,发现AVM胁迫降低了鱼的生长性能、生理、免疫力和抗氧化能力。Huang等[29]研究发现10 μmol·L-1 AVM暴露显著降低中华绒螯蟹血细胞的细胞活力,抑制吞噬活性,降低酸性磷酸酶和碱性磷酸酶活性,并推测活性氧(ROS)的过量产生可能是导致中华绒螯蟹细胞活力和免疫功能下降的主要原因。此外,AVM类药物对水生动物还具有一定的神经、发育和免疫等毒性。Raftery和Volz[20]发现AVM可逆地抑制斑马鱼早期胚胎的自发运动,认为是药物与斑马鱼胚胎中氯离子通道门控配体可逆结合,抑制神经传递的结果。依据欧盟关于危险物质分类的相关标准,AVM对于水生生物属剧毒,具有较高的生态环境风险。因此,在水产病害防治中应重视AVM类药物的合理用药。
2.5 AVM对大型蚤慢性毒性的显微镜观察
不同浓度AVM暴露21 d后的大型蚤显微镜下形态观察结果如图4所示。由图4(a)可知,对照组大型蚤肠道、卵巢和孵育囊中的卵均较清晰;而随着AVM暴露浓度的增大,大型蚤除体长变小外,卵巢出现肿胀,尤其以孵育囊中的卵变化更为明显。至高浓度0.04、0.08和0.16 μg·L-1,卵已经模糊不清,表明较高浓度的AVM显著影响了大型蚤的生长和生殖,这与前述的实验结果相一致。
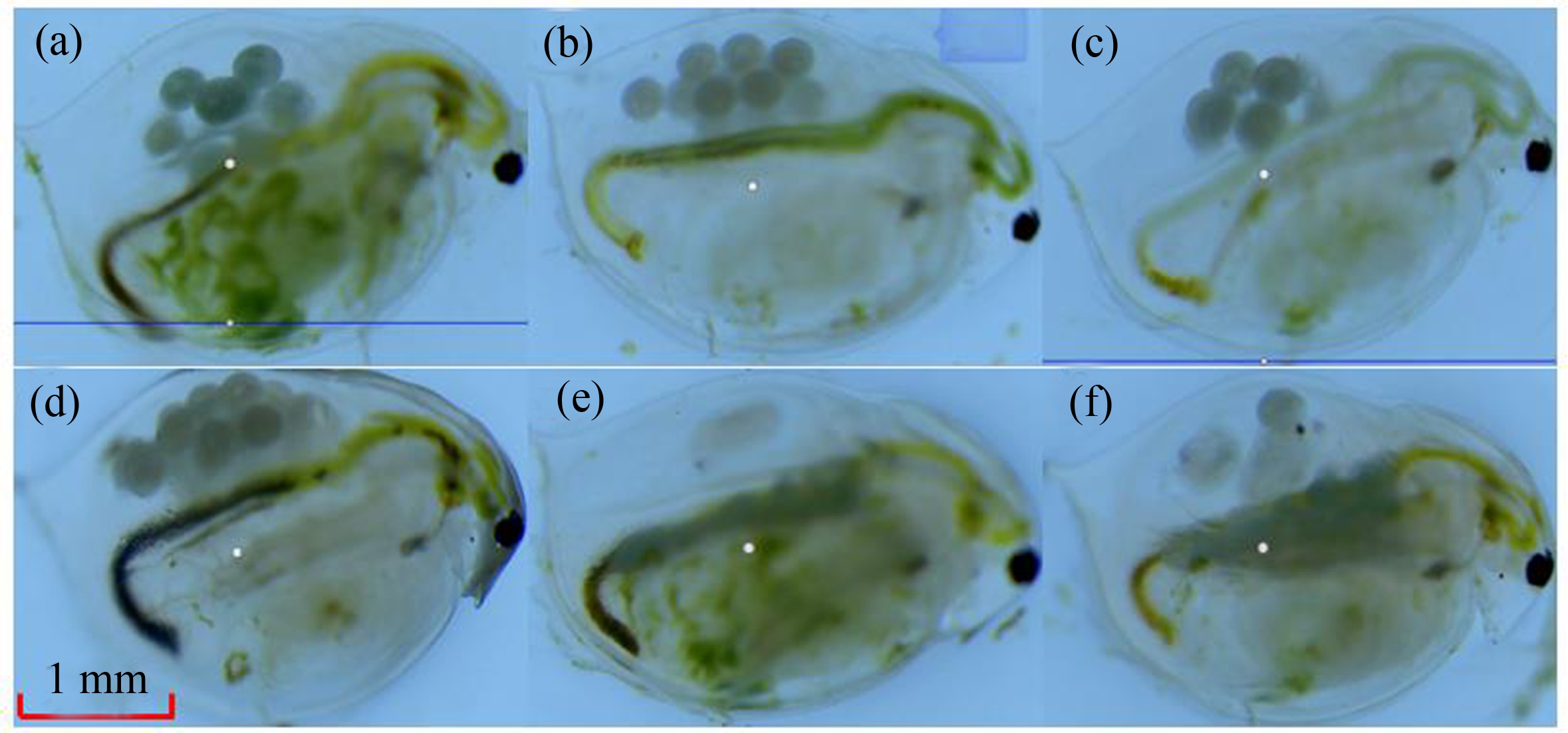
图4 AVM暴露21 d的大型蚤显微镜观察结果
注:(a)、(b)、(c)、(d)、(e)、(f)分别为0、0.01、0.02、0.04、0.08和0.16 μg·L-1的AVM暴露组。
Fig. 4 Microscopic observation of Daphnia magna exposed to AVM for 21 d
Note: (a), (b), (c), (d), (e) and (f) represent AVM exposure group of 0, 0.01, 0.02, 0.04, 0.08 and 0.16 μg·L-1, respectively.
综上所述,本研究表明:(1) 最高暴露浓度640 mg·L-1 AVM和IVM对斜生栅藻生长抑制率分别为55.73%和41.84%;AVM和IVM对大型蚤的LC50-48h值分别为1.43 μg·L-1和0.51 μg·L-1,表明2种药物对淡水绿藻的生长抑制作用不大,但对大型蚤均为剧毒;(2) 0.08、0.16 μg·L-1 AVM和0.015~0.06 μg·L-1 IVM暴露21 d后,大型蚤体长显著降低;而大型蚤产卵数、净生殖率和内禀增长率等生殖指标对2种药物的响应较体长变化更为敏感。
[1] Miller T W, Chaiet L, Cole D J, et al. Avermectins, new family of potent anthelmintic agents: Isolation and chromatographic properties [J]. Antimicrobial Agents and Chemotherapy, 1979, 15(3): 368-371
[2] 付炎, 王于方, 李力更, 等. 天然药物化学史话: 阿维菌素和伊维菌素[J]. 中草药, 2017, 48(17): 3453-3462
Fu Y, Wang Y F, Li L G, et al. Historical story on natural medicinal chemistry: Avermectin and ivermectin [J]. Chinese Traditional and Herbal Drugs, 2017, 48(17): 3453-3462 (in Chinese)
[3] Page A P. The sensory amphidial structures of Caenorhabditis elegans are involved in macrocyclic lactone uptake and anthelmintic resistance [J]. International Journal for Parasitology, 2018, 48(13): 1035-1042
[4] Lozano I E, Piazza Y G, Babay P, et al. Ivermectin: A multilevel approach to evaluate effects in Prochilodus lineatus (Valenciennes, 1836) (Characiformes, Prochilodontidae), an inland fishery species [J]. The Science of the Total Environment, 2021, 800: 149515
[5] 吴昊, 江敏, 彭章晓, 等. 伊维菌素在环境中的降解及其对七种水生生物的急性毒性研究[J]. 水生生物学报, 2012, 36(5): 965-970
Wu H, Jiang M, Peng Z X, et al. Research on the degradation of ivermectin and its acute toxicity to seven aquatic organisms [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 965-970 (in Chinese)
[6] Tišler T, Eržen N K. Abamectin in the aquatic environment [J]. Ecotoxicology, 2006, 15(6): 495-502
[7] Zhang P, Ni H F, Zhang Y, et al. Ivermectin confers its cytotoxic effects by inducing AMPK/mTOR-mediated autophagy and DNA damage [J]. Chemosphere, 2020, 259: 127448
[8] Croce R, Cinà F, Lombardo A, et al. Aquatic toxicity of several textile dye formulations: Acute and chronic assays with Daphnia magna and Raphidocelis subcapitata [J]. Ecotoxicology and Environmental Safety, 2017, 144: 79-87
[9] Heckmann L H, Sibly R M, Connon R, et al. Systems biology meets stress ecology: Linking molecular and organismal stress responses in Daphnia magna [J]. Genome Biology, 2008, 9(2): R40
[10] Zhang Y X, Guo P Y, Wu Y M, et al. Evaluation of the acute effects and oxidative stress responses of phenicol antibiotics and suspended particles in Daphnia magna [J]. Environmental Toxicology and Chemistry, 2021, 40(9): 2463-2473
[11] 中国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 化学农药环境安全评价试验准则 第14部分: 藻类生长抑制试验: GB/T 31270.14—2014[S]. 北京: 中国标准出版社, 2015
[12] International Organization for Standardization (ISO). Water quality. Determination of the inhibition of the mobility of Daphnia magna Straus (Cladocera, Crustacea) [S]. Geneva: ISO, 1996
[13] 杨晓凡, 陆光华, 刘建超, 等. 环境相关浓度下的药物对大型蚤的多代慢性毒性[J]. 中国环境科学, 2013, 33(3): 538-545
Yang X F, Lu G H, Liu J C, et al. Multigenerational chronic effects of pharmaceuticals on Daphnia magna at environmentally relevant concentrations [J]. China Environmental Science, 2013, 33(3): 538-545 (in Chinese)
[14] 张卫卫, 符贵红, 王元, 等. 阿维菌素在模拟水产养殖生态系统中的蓄积与消除规律[J]. 中国水产科学, 2016, 23(1): 225-232
Zhang W W, Fu G H, Wang Y, et al. Accumulation and elimination of avermectin in a simulated aquaculture ecosystem [J]. Journal of Fishery Sciences of China, 2016, 23(1): 225-232 (in Chinese)
[15] 王萌, 杨叶, 吉哲蓉, 等. 吡虫啉和阿维菌素淋溶土壤对蚯蚓及其淋出液对浮萍急性毒性和生理生化指标的影响[J]. 农药, 2017, 56(6): 437-442
Wang M, Yang Y, Ji Z R, et al. Effects of imidacloprid and abamectin leaching soil on earthworm and these leaching solution on the physiological and biochemical indices of duckweed [J]. Agrochemicals, 2017, 56(6): 437-442 (in Chinese)
[16] 董加沙, 何绪刚, 邓闵, 等. 阿维菌素对池塘水质和浮游生物群落结构的短期影响[J]. 水产科学, 2015, 34(9): 546-554
Dong J S, He X G, Deng M, et al. Short-term effects of abamectin on water quality and community structure of plankton in freshwater aquaculture ponds [J]. Fisheries Science, 2015, 34(9): 546-554 (in Chinese)
[17] Macar T K. Investigation of cytotoxicity and genotoxicity of abamectin pesticide in Allium cepa L. [J]. Environmental Science and Pollution Research, 2021, 28(2): 2391-2399
[18] Muhammad S, Tan J G, Deng P C, et al. Pesticide application has little influence on coding and non-coding gene expressions in rice [J]. BMC Genomics, 2019, 20(1): 1009
[19] 中国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 化学农药环境安全评价试验准则 第21部分: 大型甲壳类生物毒性试验: GB/T 31270.21—2014[S]. 北京: 中国标准出版社, 2015
[20] Raftery T D, Volz D C. Abamectin induces rapid and reversible hypoactivity within early zebrafish embryos [J]. Neurotoxicology and Teratology, 2015, 49: 10-18
[21] 王锡珍, 陆宏达. 阿维菌素对几种淡水水生动物的急性毒性作用[J]. 环境与健康杂志, 2009, 26(7): 593-597
Wang X Z, Lu H D. Acute toxic effect of abamectin on fresh-water aquatic animals [J]. Journal of Environment and Health, 2009, 26(7): 593-597 (in Chinese)
[22] 邢跃楠, 王诗跃. 敌百虫和伊维菌素对近邻剑水蚤的急性毒性[J]. 现代畜牧兽医, 2014(3): 41-43
Xing Y N, Wang S Y. The acute toxicity of dipterex and ivermectin on Cyclops vicinus [J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2014(3): 41-43 (in Chinese)
[23] 张欣, 赵文, 徐峰. 三种除草剂对大型溞Daphnia magna存活、生长和繁殖的影响[J]. 农药学学报, 2009, 11(1): 121-125
Zhang X, Zhao W, Xu F. Effects of three herbicides on the survival, growth and reproduction of Daphnia magna [J]. Chinese Journal of Pesticide Science, 2009, 11(1): 121-125 (in Chinese)
[24] Yuan S L, Li H, Dang Y, et al. Effects of triphenyl phosphate on growth, reproduction and transcription of genes of Daphnia magna [J]. Aquatic Toxicology, 2018, 195: 58-66
[25] Lopes C, Charles S, Vollat B, et al. Toxicity of ivermectin on cladocerans: Comparison of toxic effects on Daphnia and Ceriodaphnia species [J]. Environmental Toxicology and Chemistry, 2009, 28(10): 2160-2166
[26] 吴慧明, 陈颖, 胡婷婷, 等. 农药和重金属复合污染物对大型溞的毒性效应[J]. 农药学学报, 2017, 19(6): 716-722
Wu H M, Chen Y, Hu T T, et al. Combined toxicity of pesticide and heavy metal to Daphnia magna [J]. Chinese Journal of Pesticide Science, 2017, 19(6): 716-722 (in Chinese)
[27] Seyoum A, Pradhan A, Jass J, et al. Perfluorinated alkyl substances impede growth, reproduction, lipid metabolism and lifespan in Daphnia magna [J]. The Science of the Total Environment, 2020, 737: 139682
[28] Mahmoud H K. The stress of abamectin toxicity reduced water quality, growth performance, immunity and antioxidant capacity of Oreochromis niloticus fish: Modulatory role of Simmondsia chinensis extract as a dietary supplement [J]. Aquaculture, 2021, 534: 736247
[29] Huang Y, Hong Y H, Huang Z Q, et al. Cytotoxicity induced by abamectin exposure in haemocytes of Chinese mitten crab, Eriocheir sinensis [J]. Environmental Toxicology and Pharmacology, 2020, 77: 103384