近年来,由于人类的活动,如电镀、采矿、冶炼、燃烧、大气沉积、使用无机肥料和杀虫剂等,使得大量重金属进入土壤中,污染土壤环境,造成严重的环境问题。 有调查表明,我国受到污染的农田中有82%的农田土壤中含有Pb 和Cd[1]。 中国东部、南部和西部部分地区污染土壤中Pb 浓度超过了风险控制值(500 mg·kg-1)[2],湖南、云南、广西、甘肃和辽宁农田土壤中Cd 浓度已经远远超过了筛选值(0.3 mg·kg-1)[3]。 目前农田中重金属污染问题已经引起了广泛的关注[4-5]。 Pb、Cd 均为植物生长发育过程中的非必需营养元素,会对植物的种子萌发、生长发育过程产生抑制作用,影响营养元素在植物体内的运输和分布以及植物根系的含水量。 与此同时,Pb、Cd 胁迫会引起植物细胞中抗氧化酶的应激反应、氨基酸和蛋白质含量的变化并造成细胞膜的过氧化损伤[6-7]。
以往的研究大多集中在探讨单一重金属胁迫对模式动物、植物等的毒性效应机制,然而,土壤重金属污染往往具有伴生性和综合性,绝对意义上的单一污染并不存在[8]。 与单一重金属胁迫相比,重金属复合胁迫可能会表现出不同的生物毒性效应。 赵晓祥等[9]研究发现,在Cd、Zn 复合胁迫下,番茄幼苗的叶绿素含量以及抗氧化系统均做出应答改变,其中,低质量比的Zn/Cd 复合胁迫对番茄幼苗表现出拮抗作用,而随着施加质量比的增加,Zn 与Cd 产生协同作用。 台湾相思(Acacia confusa)属豆科金合欢属乔木,生长周期快,抗逆性强,为华南地区常见的木本园林植物[10]。 陈涵等[11]通过盆栽试验,研究不同浓度Pb、Cd 复合胁迫对台湾相思生长、根系形态、养分元素和重金属元素吸收的影响,结果表明,重金属Pb、Cd 复合胁迫显著增加台湾相思根、茎及叶的 Pb、Cd 含量,此外,在高浓度下,Cd、Pb 元素之间存在拮抗作用,从而能够抑制根系对Pb 的吸收。
生菜(Lactuca sativa L, lettuce)由于低热量和高营养价值,常作为生食蔬菜,在世界范围内受到广泛的喜爱[12-13]。 美国环境保护局(US EPA)将生菜规定为研究污染物的植物吸收与迁移的19 种标准植物之一[14]。 目前,生菜作为一种较为新颖的模式生物在毒理学研究中得到广泛的应用。 Hou 等[15]的研究指出,相较于玉米、小麦、黄瓜、卷心菜,生菜对Pb胁迫更为敏感,是探究土壤中Pb 对植物毒性效应的一种较为合适的模式生物。 Li 等[16]研究 Pb、Cu对生菜的毒害效应和亚细胞分布及其毒性机制,结果表明生菜根系中Pb 主要积聚在细胞壁中(41%),Cu 主要积聚在液泡中(46%)。 此外生菜也被用于探究Cd 胁迫下的生理响应以及累积分布,为阐明Cd 对植物的毒性机制提供了科学依据[17]。 以往的研究大多集中于生菜对重金属Pb、Cd 的吸收富集作用,关于Pb、Cd 单一及复合胁迫对生菜幼苗生长发育过程中抗氧化酶以及亚细胞结构的毒性效应仍存在空白。 因此,本研究采用生菜作为受试生物,通过水培实验,探究Pb、Cd 单一及复合暴露下对生菜幼苗期抗氧化系统及亚细胞结构的影响,以期探索重金属Pb、Cd 对生菜的毒性效应,为阐述重金属Pb、Cd 对生菜的毒性效应机制提供基础。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 生菜
供试生菜种子购自上海农乐种子企业店,为意大利全年耐抽苔生菜。
1.1.2 化学试剂
硝酸镉·四水合物(Cd(NO3)2·4H2O)、硝酸铅(Pb(NO3)2)、丙酮(C3H6O)均购于国药集团化学试剂有限公司,其中,Cd(NO3)2·4H2O 和 Pb(NO3)2 为分析纯,C3H6O 为色谱纯。 超氧化物歧化酶(SOD)、过氧化物酶(POD)、抗坏血酸酶(APX)、丙二醛(MDA)的检测试剂盒均购自南京建成生物工程研究所。
1.2 实验设计
本实验共设置10个浓度,浓度的设置参考《农田灌溉水质标准》(GB 5084—2021)[18],其中Pb 的浓度设为标准(0.2 mg·L-1)的 1 倍、2 倍、5 倍和 10 倍,Cd 的浓度设置为标准(0.01 mg·L-1)的 2 倍,去离子水作为对照,即Pb 的单一暴露浓度设置为0.2、0.5、1.0 和 5.0 mg·L-1,Cd 的单一浓度设置为 0.02 mg·L-1,实验浓度设如表1 所示。
表1 实验浓度的设置
Table 1 Setting of experimental concentration
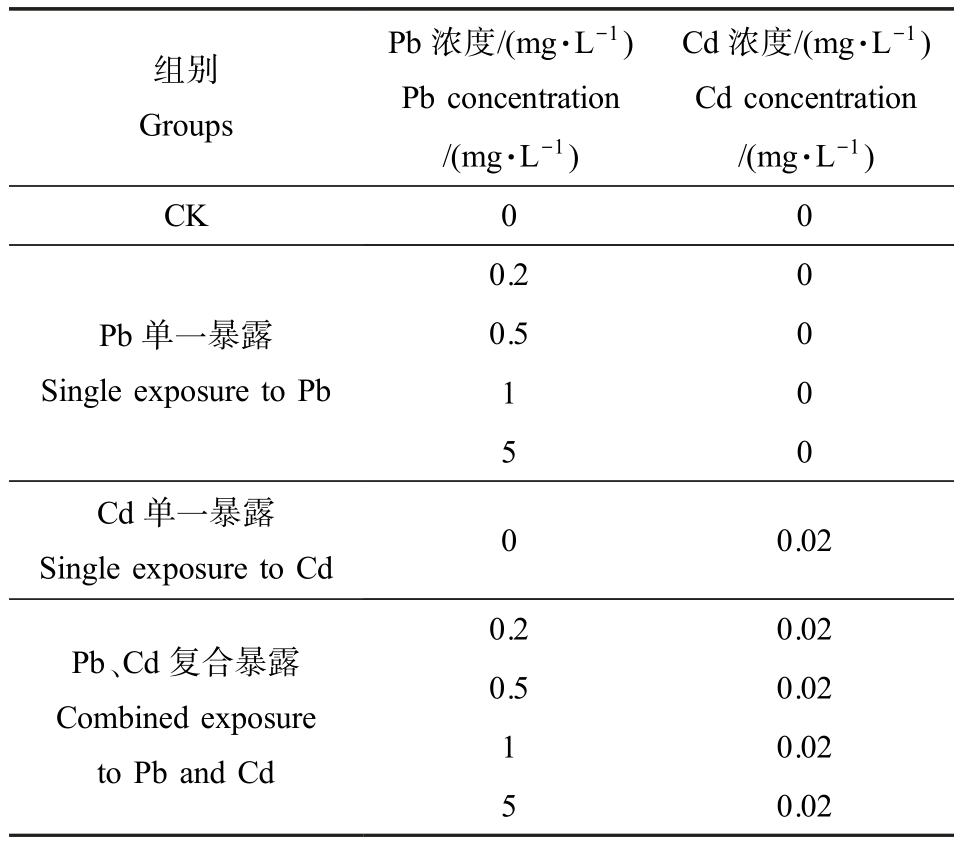
组别Groups Pb 浓度/(mg·L-1)Pb concentration/(mg·L-1)Cd 浓度/(mg·L-1)Cd concentration/(mg·L-1)CK 0 0 0.2 0 Pb 单一暴露Single exposure to Pb 0.5 0 1 0 5 0 Cd 单一暴露Single exposure to Cd 0 0.02 0.2 0.02 Pb、Cd 复合暴露Combined exposure to Pb and Cd 0.5 0.02 1 0.02 5 0.02
生菜种子用0.5%次氯酸钠溶液消毒30 min 后用去离子水彻底洗净,20 ℃在黑暗中静置24 h 后,选择长势一致的生菜种子,放于相应浓度的培养皿中,每个培养皿里放30 粒种子,每个浓度设置9 组平行。 生长温度为(22±1) ℃,光暗比设为 16 h∶8 h,每天补充水分[19-20]。 在暴露第6 天、第10 天和第14天时,采集植物叶片,测量叶绿素a 和MDA 的含量及SOD、POD 和 APX 的活性,第14 天时采集生菜叶片,利用电子透射显微镜(TEM)观察叶片细胞的亚细胞结构。
1.3 实验方法
1.3.1 叶绿素a 含量
叶绿素a 含量测定参考《植物生理学实验指导》[21]和《水质 叶绿素a 的测定 分光光度法》(HJ 897—2017)[22]进行改动,的方法,略作改动,具体方法如下:取0.02 g 生菜叶片,置于含有10 mL 90%丙酮的10 mL 离心管中,避光提取24 h,直至叶片发白,用紫外分光光度计(T6 新世纪,北京普析,北京)分别在 750、664、647 和 630 nm 处测量其吸光度值,计算得到叶绿素a 的含量,每个暴露浓度重复3 次。
1.3.2 抗氧化酶活性以及丙二醛含量的测定
取生菜叶片0.1 g,加入0.9 mL 磷酸缓冲液,在冰水浴条件下研磨成10%的匀浆,为了测量不同抗氧化酶的含量,将匀浆均匀分成2个部分,分别于4℃不同转速下离心10 min。 其中转速设置为3 500 r·min-1 的部分用于测定 MDA 含量、SOD 和 POD活性,转速设置为10 000 r·min-1 的部分,用于测定APX 活性[20]。 离心后取上清液用于MDA 含量的检测以及SOD、POD 和APX 活性的测定。
MDA 含量检测采用硫代巴比妥酸法,在532 nm 处测量吸光度值[23];SOD 活性测定采用黄嘌呤氧化酶法,在550 nm 处测量吸光度值[24];POD 活性的测定是利用POD 催化(H2O2)反应的原理,通过测定420 nm 处吸光度的变化得到酶的活性[25];APX活性测定则利用APX 催化抗坏血酸(ASA)与H2O2反应,ASA 被氧化成单脱氢抗坏血酸(MDASA),通过测定ASA 在单位时间内的减少值,计算得到APX 的活性[26]。 具体操作严格按照试剂盒说明书进行,每个实验浓度均重复3 次上述操作。
1.3.3 生菜叶片切片及超微结构的观察
14 d 后取生菜叶片 2 mm2,用 0.1 mol·L-1、pH 7.0 的磷酸缓冲液漂洗样品3 次;用1%的锇酸溶液固定样品1 ~2 h;取出锇酸废液后,用0.1 mol·L-1、pH 7.0 的磷酸缓冲液漂洗样品3 次;乙醇系列浓度脱水,包埋剂包埋,包埋后的样本在LEICA EM UC7型超薄切片机中切片,切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5 ~10 min,晾干后在透射电镜(Hitachi H-7650,日本)中观察[19-27]。
1.4 数据处理
实验数据使用SPSS 23.0 进行统计分析,采用单因素方差分析(One way ANOVA)中的Duncan 检验进行显著性差异分析,显著性差异水平设置为P<0.05。运用 Origin 2018、Excel 2020 制图。 Abott’s 公式用于评估Pb 和Cd 对生菜幼苗的复合毒性[28],其中,期望抑制率(Cexp)及复合胁迫表征值(RI)分别用下式表示。
式中:A、B 分别表示单一Pb、Cd 胁迫所引起的抑制率,OI 为复合胁迫所引起的抑制率;RI 用于判断Pb、Cd 对生菜的复合胁迫情况;RI<1 表现为毒性拮抗,RI=1 表现为毒性简单相加,RI>1 表现为毒性协同[9-29]。
2 结果与分析(Results and analysis)
2.1 Pb、Cd 单一及复合胁迫对生菜幼苗叶绿素a的影响
如图1 所示,在14 d 暴露过程中,对照组及暴露组生菜叶片中叶绿素a 的含量随暴露时间的增加而增加。 暴露第6 天时,在Pb 单一暴露下,随着暴露浓度的增加,叶绿素a 的含量均表现出先增加后减少的趋势,叶绿素a 含量的峰值出现在Pb 1.0 mg·L-1处;在 Pb、Cd 复合暴露下,Pb 1.0 mg·L-1+Cd 0.02 mg·L-1复合暴露与同样浓度的单一Pb 暴露相比叶绿素a的含量显著性降低(P<0.05),而其他复合暴露组与相同浓度的Pb 单一暴露相比,叶绿素a 的含量没有显著性变化。 与单一Cd 暴露相比,在Pb、Cd 复合暴露下,随着Pb 浓度的增加,叶绿素a 的含量呈现先上升后下降的趋势,在 Pb 0.5 mg·L-1+Cd 0.02 mg·L-1时,与单一Cd 胁迫相比叶绿素a 含量显著增加8.9%。

图1 Pb、Cd 单一和复合暴露对生菜叶绿素a 含量的影响
注:*表示生菜在不同浓度重金属处理下差异显著(P<0.05);(a) Cd 的暴露浓度为0 mg·L-1,(b) Cd 的暴露浓度为0.02 mg·L-1。
Fig.1 Chlorophyll a of lettuce after exposure to single and combined Pb and Cd stress
Note: *mean significant differences between different heavy metal concentration groups (P<0.05);two levels of Cd 0 mg·L-1 (a) and 0.02 mg·L-1 (b); the same below.
暴露至第10 天时,在单一Pb 暴露下叶片中叶绿素a 含量变化的趋势与第6 天Pb 单一暴露下叶绿素a 的变化趋势一致;在Pb、Cd 复合暴露下,当Pb 浓度为 0.5、1 和 5 mg·L-1时,Pb、Cd 复合暴露与同样浓度的单一Pb 暴露相比叶绿素a 的含量显著下降,分别下降了5.3%、18.1%和9.1%;与单一Cd暴露相比,在Pb、Cd 复合暴露下,叶绿素a 的含量随着Pb 浓度的增加呈现先上升后下降的趋势,当处于Pb 5 mg·L-1+Cd 0.02 mg·L-1复合暴露下时,其叶绿素a 的含量与单一Cd 暴露相比显著下降(P<0.05)。
暴露14 d 后,在Pb 单一暴露下,叶绿素a 的含量随着暴露浓度的增加仍表现出先增加后减少的趋势;不同于第6 天、第10 天的Pb 单一暴露,其最高值出现在单一 Pb 暴露0.5 mg·L-1处;在 Pb、Cd 复合暴露下,当 Pb 浓度为0.5 mg·L-1和5 mg·L-1时,Pb、Cd 复合暴露与同样浓度的单一Pb 暴露相比叶绿素a 的含量显著增加。 与单一Cd 暴露相比,在Pb、Cd复合胁迫下,随着Pb 浓度的增加,叶绿素a 的含量表现出先增加后减少的趋势,并且与单一Cd 暴露相比均有显著性差异(P<0.05)。
2.2 Pb、Cd 单一及复合胁迫对生菜幼苗抗氧化酶活性及丙二醛含量的影响
2.2.1 SOD
第6 天时,在 Pb、Cd 单一暴露下,各暴露组SOD 活性较对照组均受到显著抑制(P<0.05)。 在Pb、Cd 复合暴露下,与相同浓度的单一Pb 暴露相比,SOD 活性没有明显变化;与单一Cd 暴露相比,在 Pb、Cd 复合暴露下,当 Pb≤0.5 mg·L-1时 SOD 活性受到诱导,在 Pb≥1 mg·L-1 时 SOD 活性受到抑制(图 2)。
第10 天时,在Pb 单一暴露下,与对照组相比,当Pb≥1 mg·L-1 时,叶片中 SOD 活性受到显著抑制(P<0.05);在Pb、Cd 复合暴露下,与相同浓度的单一Pb 暴露相比,SOD 活性无显著性变化;与单一Cd 胁迫相比,Pb、Cd 复合胁迫下SOD 的活性也无显著性变化(图2)。
第14 天时,在 Pb 单一暴露下,SOD 活性受到显著抑制(P<0.05),随着Pb 单一暴露浓度的增加,叶片中SOD 的活性与第10 天叶片中SOD 的活性逐渐表现为同一水平;在Pb、Cd 复合暴露下,在Pb相同暴露浓度下,Pb、Cd 复合暴露与Pb 单一暴露时叶片中SOD 活性没有显著区别;与单一Cd 暴露相比,随着Pb 暴露浓度的增加,Pb、Cd 复合暴露下叶片中 SOD 的活性在 Pb≤0.5 mg·L-1 时被诱导,在Pb≥1 mg·L-1时受到抑制(图 2)。
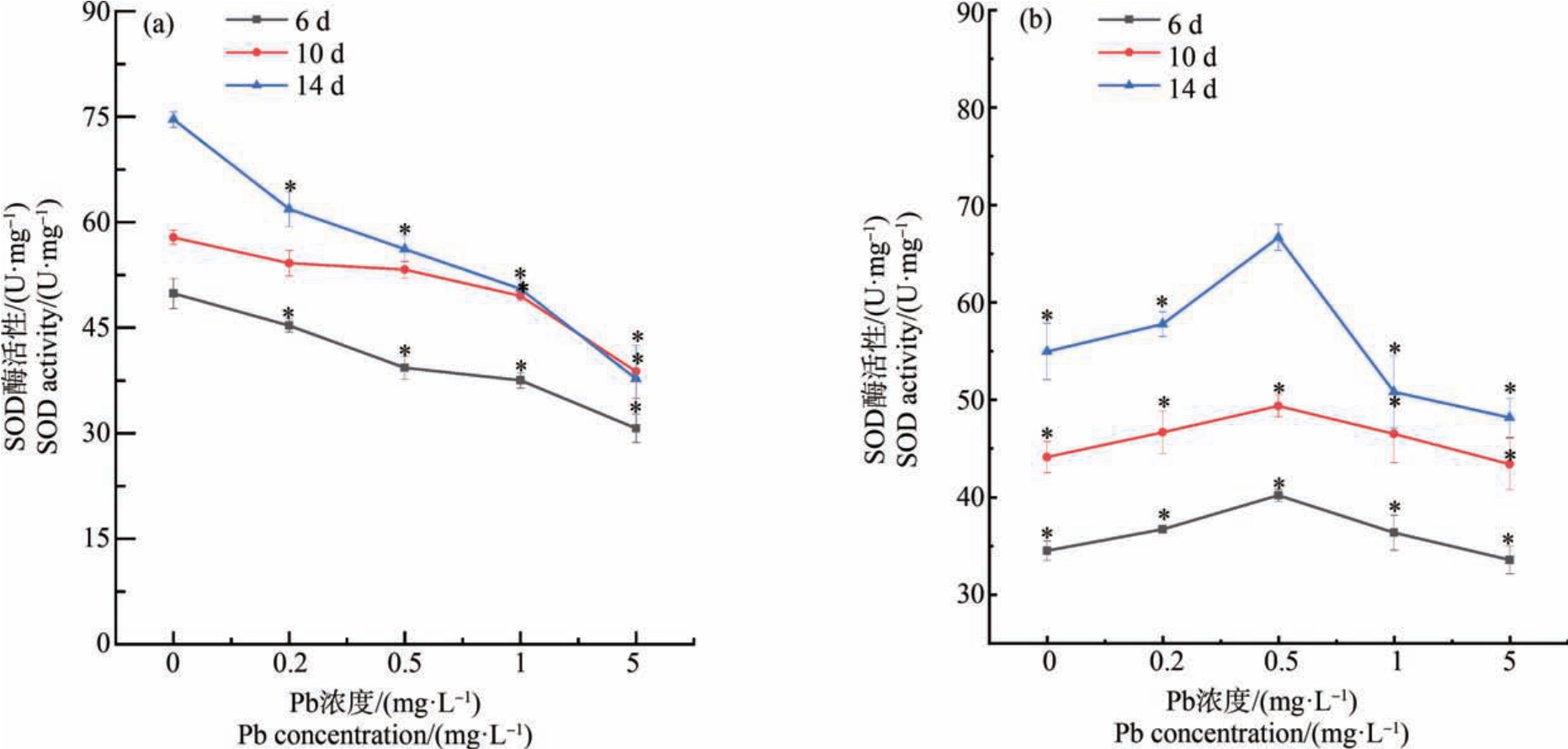
图2 Pb、Cd 单一及复合暴露对生菜叶片超氧化物歧化酶(SOD)活性的影响
注:*表示生菜在不同浓度重金属处理下差异显著(P<0.05);(a) Cd 的暴露浓度为0 mg·L-1,(b) Cd 的暴露浓度为0.02 mg·L-1。
Fig.2 Superoxide dismutase (SOD) activity of lettuce leaves after exposure to single and combined Pb and Cd stress
Note: *mean significant differences between different heavy metal concentration groups (P<0.05); two levels of Cd 0 mg·L-1(a) and 0.02 mg·L-1(b).
2.2.2 POD
如图3 所示,在同一暴露浓度下,随着暴露时间的增加,叶片中POD 的活性受到诱导。 第6 天时,在 Pb 单一暴露下,当 Pb 浓度≥5 mg·L-1 时,POD的活性与对照组相比表现出显著性增加(P<0.05);相同Pb 暴露浓度下,Pb、Cd 复合暴露与单一Pb 暴露相比,叶片中POD 活性没有显著性差异;与单一Cd暴露相比,在Pb、Cd 复合暴露下,当Pb 浓度为5 mg·L-1时,POD 活性受到显著性诱导(P<0.05)。
第10 天时,在Pb 单一暴露下,随着Pb 浓度的增加,POD 活性受到诱导;当Pb 浓度为0.2 mg·L-1和5 mg·L-1 时,与相同浓度的单一Pb 暴露相比,Pb、Cd 复合暴露下的 POD 活性受到诱导;Pb、Cd 复合暴露下,与单一Cd 暴露相比,当Pb 浓度≥1 mg·L-1时,POD 活性受到诱导(图 3)。
第14 天时,在 Pb 单一暴露下,当 Pb≥0.5 mg·L-1时,与对照组相比,POD 活性受到诱导;在相同的Pb 暴露水平下,只有当Pb 浓度为0.2 mg·L-1时,Pb、Cd 复合暴露下POD 活性与Pb 单一暴露相比受到诱导(P<0.05),其余复合暴露组与Pb 单一暴露组在相同Pb 浓度下,POD 活性无显著性差异;与单一Cd 暴露相比,当 Pb≥1 mg·L-1时,Pb、Cd 复合暴露下POD 活性被显著诱导(图3)。
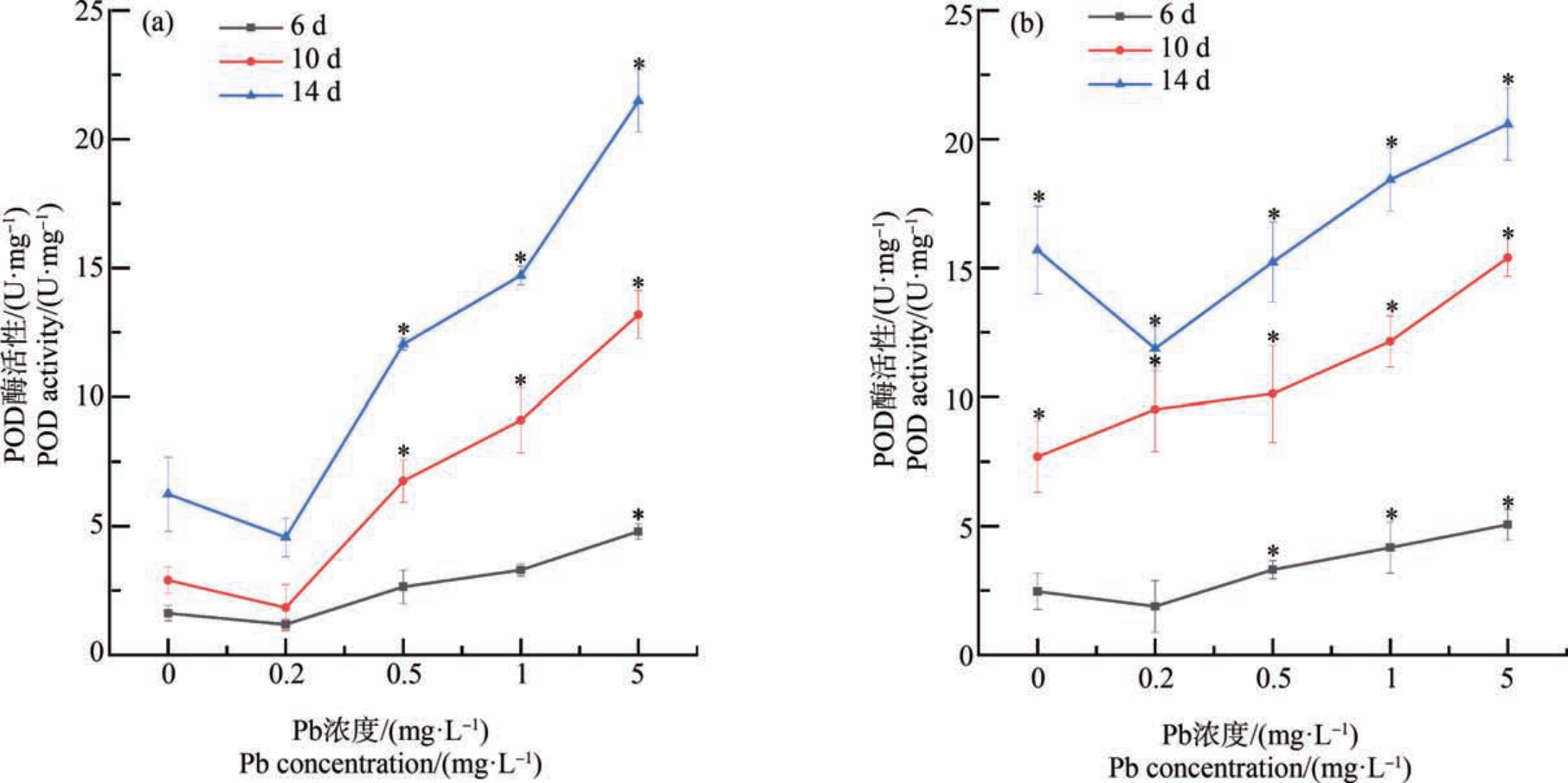
图3 Pb、Cd 单一及复合暴露对生菜叶片过氧化物酶(POD)活性的影响
注:*表示生菜在不同浓度重金属处理下差异显著(P<0.05);(a) Cd 的暴露浓度为0 mg·L-1,(b) Cd 的暴露浓度为0.02 mg·L-1。
Fig.3 Peroxidase (POD) activity of lettuce leaves after exposure to single and combined Pb and Cd stress
Note:*mean significant differences between different heavy metal concentration groups (P<0.05); two levels of Cd 0 mg·L-1(a) and 0.02 mg·L-1(b).
2.2.3 APX
对照组叶片中APX 活性随着暴露时间的增加而增强,在Pb 单一胁迫下,随着Pb 暴露浓度的增加,其叶片中APX 的活性在第6 天、第10 天均表现出“低促高抑”的趋势,然而当暴露时间延长至14 d,叶片中APX 的活性随着暴露浓度的增加而被显著抑制。 第6 天时,Pb、Cd 复合暴露与相同浓度的单一Pb 暴露相比,叶片中APX 活性无显著性变化;与单一Cd 暴露相比,当生菜处于Pb 5 mg·L-1+Cd 0.02 mg·L-1 暴露下,APX 活性受到显著抑制。 第10 天时,当 Pb≥1 mg·L-1,Pb、Cd 复合暴露与单一Pb 暴露相比,APX 活性受到显著抑制;与单一Cd暴露相比,在 Pb、Cd 复合暴露下,当 Pb≥5 mg·L-1时,APX 活性受到抑制。 第14 天时,当重金属暴露浓度相同时,Pb、Cd 复合暴露叶片中APX 的活性与第6 天和第10 天叶片中APX 的活性相比均受到显著抑制,并且随着重金属暴露程度的增加,APX 活性受到抑制的程度也逐步增加(图4)。
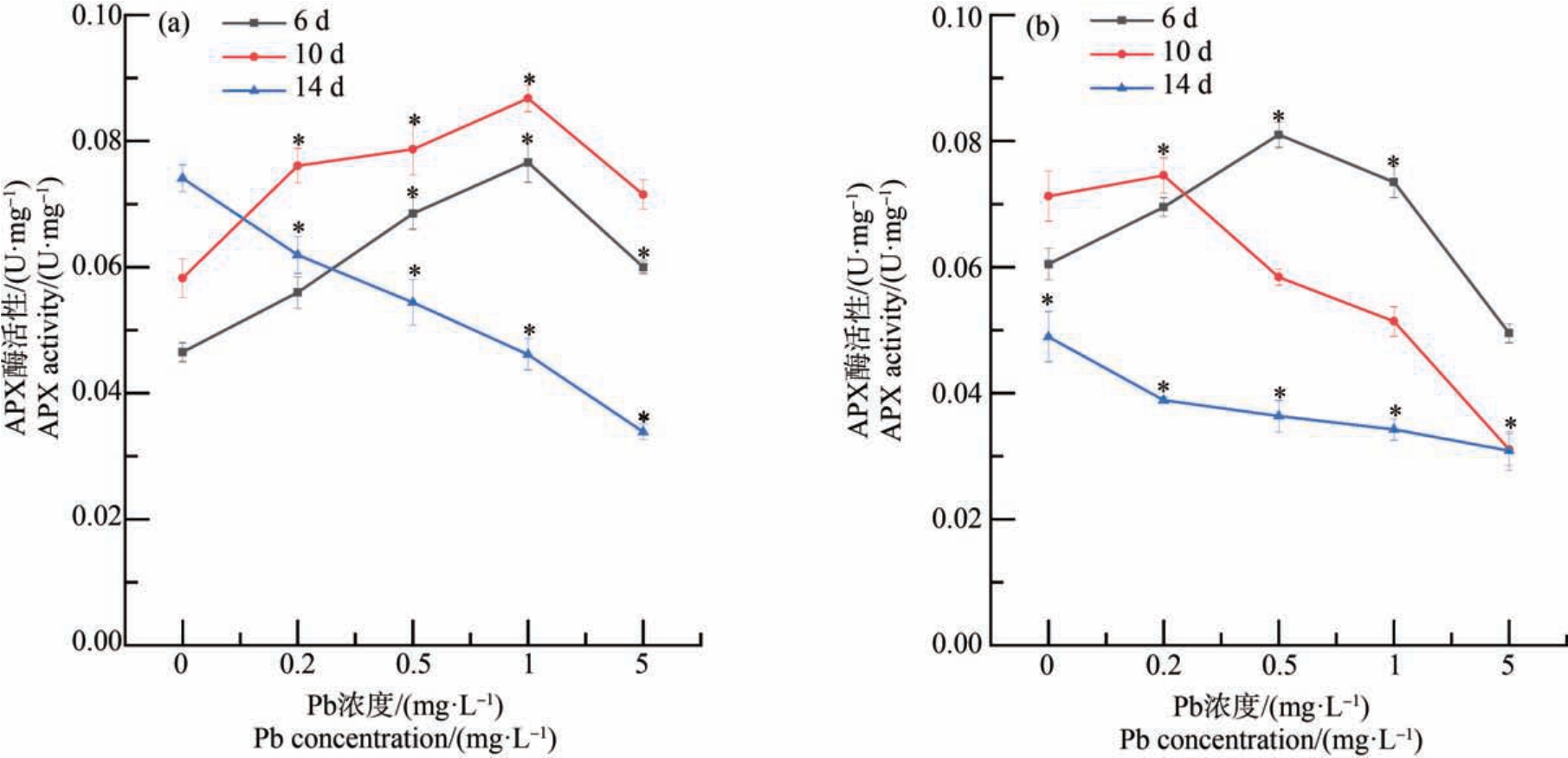
图4 Pb、Cd 单一及复合暴露对生菜叶片抗坏血酸过氧化物酶(APX)活性的影响
注:*表示生菜在不同浓度重金属处理下差异显著(P<0.05);(a) Cd 的暴露浓度为0 mg·L-1,(b) Cd 的暴露浓度为0.02 mg·L-1。
Fig.4 Ascorbate peroxidase (APX) activity of lettuce leaves after exposure to single and combined Pb and Cd stress
Note:*mean significant differences between different heavy metal concentration groups (P<0.05); two levels of Cd 0 mg·L-1(a) and 0.02 mg·L-1(b).
2.2.4 MDA
在6 ~14 d 暴露过程中,对照组生菜叶片中MDA 的含量维持在较低水平,基本不变,而暴露组生菜叶片中MDA 的含量均显著高于对照组(P <0.05),在同一暴露浓度下,随着暴露时间的增加,暴露组叶片中MDA 的含量也随之增加。 在暴露第6天、第10 天和第14 天,生菜叶片中MDA 的含量均表现出相同的趋势。 在Pb 单一暴露下,随着Pb 暴露浓度的增加,MDA 含量随之增加;当Pb 暴露浓度相同时,在Pb、Cd 复合暴露下叶片中MDA 的含量与Pb 单一暴露下MDA 含量相比,无显著性差异(P>0.05)。 Cd 单一暴露下叶片中 MDA 含量显著高于对照组叶片中MDA 的含量,与单一Cd 暴露相比,在 Pb、Cd 复合暴露下随着 Pb 浓度的增加,叶片中MDA 的含量呈现先减少再增加的趋势,最小值出现在 Pb 0.2 mg·L-1+Cd 0.02 mg·L-1处(图 5)。

图5 Pb、Cd 单一和复合暴露对生菜叶片丙二醛(MDA)含量的影响
注:*表示生菜在不同浓度重金属处理下差异显著(P<0.05);(a) Cd 的暴露浓度为0 mg·L-1,(b) Cd 的暴露浓度为0.02 mg·L-1。
Fig.5 Malondialdehyde (MDA) content of lettuce leaves after exposure to single and combined Pb and Cd stress
Note: *mean significant differences between different heavy metal concentration groups (P<0.05); two levels of Cd 0 mg·L-1(a) and 0.02 mg·L-1(b).
2.2.5 联合毒性分析
根据公式(1)、(2)计算复合胁迫下生菜的叶绿素a 含量、MDA、POD、SOD 和 APX 的 RI 值,计算结果显示,除了除第 14 天时,5.0 mg·L-1 Pb 和 0.02 mg·L-1 Cd 复合胁迫下,对APX 酶的活性表现出协同作用,其余Pb 和Cd 复合胁迫的联合毒性均表现为拮抗作用(图6)。
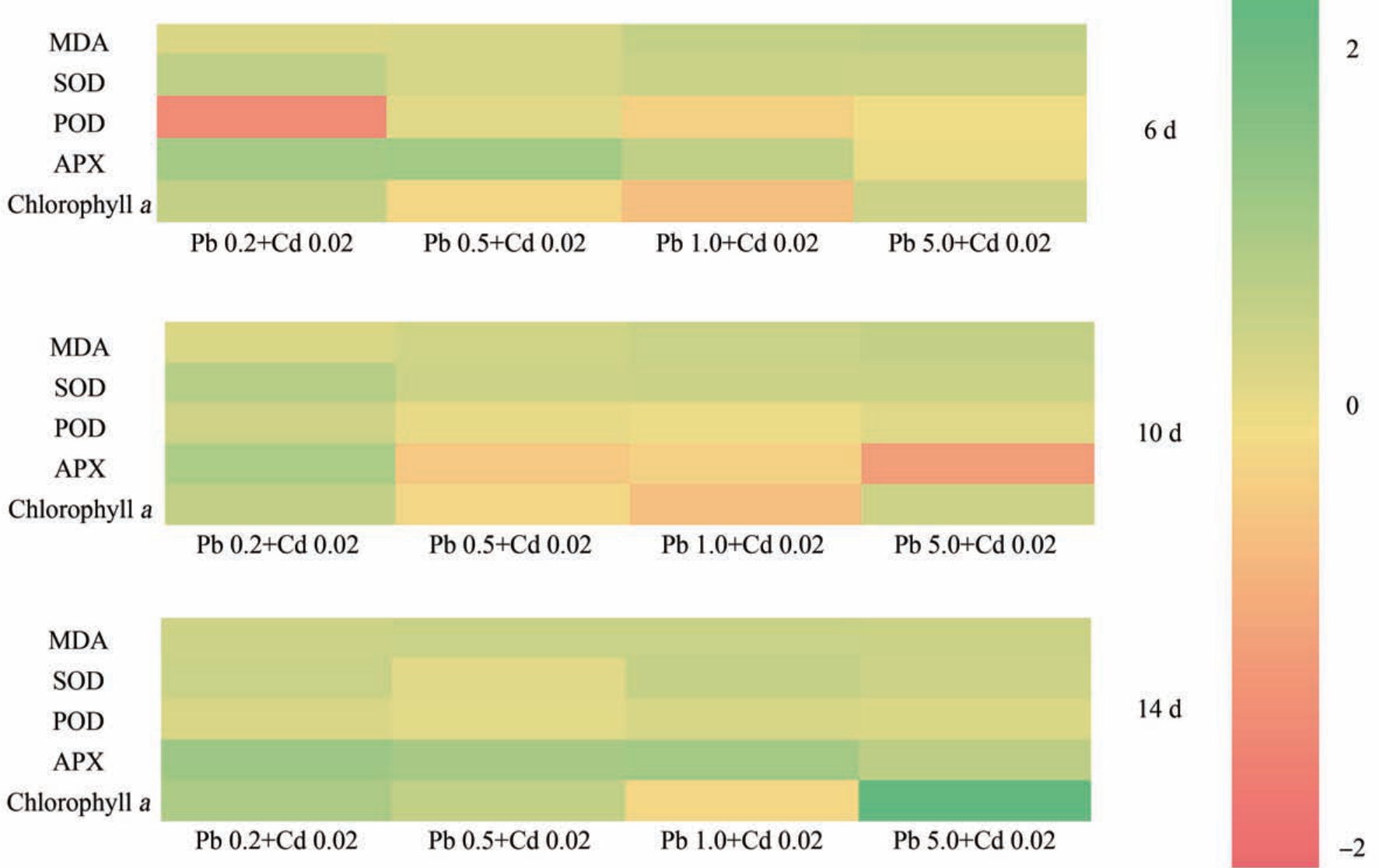
图6 Pb、Cd 复合胁迫下联合毒性复合胁迫表征值的变化
Fig.6 Changes of ratio of inhibition under combined stress of Pb and Cd
2.3 Pb、Cd 单一及复合胁迫对生菜叶片超微结构的影响
暴露14 d 后,制作生菜叶片切片,于TEM 下观察生菜叶片的超微结构。
如图7 所示,在对照组(图7(a)和图7(b))的生菜细胞的细胞壁和各细胞器在电子显微镜下结构完整,清晰可见。 叶绿体排列有序,呈现梭形或椭圆形,淀粉粒含量较多,类囊体片层垛叠整齐。 线粒体具有双层膜结构,基质均匀,可以观察到内膜凹陷所形成的嵴。 各细胞器结构完整。
在Pb 5 mg·L-1单一暴露时(图7(c)和图7(d)),细胞壁结构完整。 细胞器与对照组相比变化明显,主要表现为:叶绿体数量减少,形状由梭形变成半月形或圆形,且膜边缘开始模糊;淀粉粒数量减少,嗜锇颗粒变大,部分类囊体开始膨胀,内部结构趋于瓦解。 线粒体的结构遭到破环,内部出现大量空泡,且空泡化较严重,外膜破裂,嵴的结构不清晰;核内容物呈现无序状态,染色体凝集。
单一 Cd(0.02 mg·L-1)暴露 14 d 后(图 7(e)和图7(f)),生菜叶片细胞的细胞质中出现聚集的黑色颗粒,叶绿体结构基本完好,部分叶绿体被膜出现外膜破裂的情况。 线粒体结构受到破坏,外膜破裂,无结构清晰的嵴,且出现轻度空泡化。
Pb、Cd 复合暴露下(图 7(g)),与单一 Pb 5 mg·L-1、单一Cd 0.02 mg·L-1暴露相比,生菜叶片细胞的叶绿体损伤加剧,其基质和类囊体的结构模糊不清,有空泡出现,功能结构受到严重损害,线粒体空泡化现象严重,但未在细胞的细胞质中观察到黑色颗粒。

图7 Pb、Cd 单一及复合暴露下对生菜叶片亚细胞结构的影响
注:(a)、(b) CK;(c)、(d) Pb 5 mg·L-1;(e)、(f) Cd 0.02 mg·L-1;(g) Pb 5 mg·L-1+Cd 0.02 mg·L-1;Ch 为叶绿体;Mi 为线粒体;Th 为类囊体;N 为细胞核;OG 为嗜锇颗粒。
Fig.7 Single and combined stress effects of Pb and Cd on subcellular structure of lettuce leaves
Note: (a), (b) CK; (c), (d) Pb 5 mg·L-1; (e), (f) Cd 0.02 mg·L-1; (g) Pb 5 mg·L-1+Cd 0.02 mg·L-1; Ch stands for chloroplast;Mi stands for mitochondrion; Th stands for thylakoid; N stands for nucleus; OG stands for osmium granule.
3 讨论(Discussion)
叶绿素在光合作用中起着捕获光的作用,是光合色素中重要的色素,参与光合作用中光能的吸收、传递和转化,在光合作用中占有重要地位,是植物代谢的重要物质[30-31]。 因此,叶绿素含量的高低能够反映光合作用水平的强弱[32],被广泛用于评价重金属暴露对植物的毒性效应。 本研究中,在Pb 单一及Pb、Cd 复合暴露下,生菜叶片中叶绿素的含量均发生显著变化,呈现出“低促高抑”的趋势。 赖长鸿等[33]研究As(Ⅲ)暴露对生菜的影响中发现,随着As(Ⅲ)暴露浓度的增加,生菜叶片叶绿素的含量呈现出“低浓度促进、高浓度抑制”,这与本研究结果相一致。 然而孙健等[34]的研究结果显示,在重金属Cu、Cd、Pb、Zn 和 As 复合胁迫下,灯心草叶绿素含量随重金属复合暴露浓度的增加而下降明显。 这可能是因为生菜对低浓度Pb 胁迫具有一定的耐受性,并且Pb、Cd 复合暴露对叶绿素的毒性效应表现为拮抗效应,降低重金属向地上部的迁移,从而减缓了重金属对叶绿体结构的破坏。
重金属胁迫会诱导植物产生大量活性氧自由基(reactive oxygen species, ROS),从而对细胞的正常代谢过程造成负面的影响,植物细胞中存在的抗氧化酶(SOD、POD 和APX)可清除过量ROS,从而使植物维持正常生理活动,提高植物对环境的适应能力[35]。
SOD 普遍存在于植物体内,是植物细胞抗氧化防御系统的第一道防线,SOD 能够催化超氧阴离子的歧化反应,并将其歧化为H2O2 和O2[20]。 本实验中,在Pb、Cd 单一及复合暴露下,各暴露组生菜叶片细胞中SOD 活性被抑制,这与贾月慧等[17]的研究结果一致,该研究表明,生菜对Cd 胁迫响应时,随着Cd 浓度的增加,生菜叶片细胞中SOD 活性显著降低。 陈顺钰等[36]的研究表明,在 Pb 单一暴露的第 0 天、第 4 天、第 7 天和第 10 天枫香 SOD 的活性先减后增,而在同一时间,随着Pb 暴露浓度的增加,SOD 的活性则表现出“升高-降低-升高”的趋势。 本研究中,同一暴露浓度下,大部分暴露组生菜叶片在生长过程中,叶片中SOD 的活性被诱导,表明生菜应对重金属Pb、Cd 胁迫的能力增强,但在第14 天,Pb 单一暴露浓度为 5 mg·L-1时,SOD 活性下降到与第10 天同一水平,表明长时间高浓度的Pb暴露会在很大程度上抑制生菜叶片SOD 的活性;在同一暴露时间,Pb 单一暴露下,随着暴露浓度的增加,SOD 活性受到抑制,在Pb、Cd 复合胁迫下,SOD活性则表现出“升高-降低”的趋势,清除ROS 以达到保护自身的目的。
为清除H2O2,植物细胞可以利用POD 和APX将 H2O2 转化成 H2O 和![]() 田丹等[38]在研究 Cd胁迫对生菜幼苗抗氧化酶系统影响时,发现随着Cd暴露浓度的增加,生菜叶片POD 活性受到显著诱导。 与此相类似,在本研究中,POD 活性在暴露第6天、第10 天和第14 天均表现出相同的应答反应,即在单一 Pb 暴露下,随着 Pb 浓度的升高,叶片中POD 的活性受到显著诱导;在Cd 单一暴露下,POD的活性受到诱导;在Pb、Cd 复合暴露下,POD 的活性也随着胁迫程度的增加而受到诱导,以此降低自由基的产生速率,从而减活性氧对细胞膜脂的伤害。APX 是植物活性氧代谢中重要的抗氧化酶之一,可以缓解自由基造成的膜脂过氧化的伤害。 本研究表明,在暴露前期(第6 天、第10 天)APX 在缓解膜脂过氧化伤害中,起到了重要的作用,这与杨波等[39]发现的Cd 胁迫对三叶鬼针草APX 酶活的影响一致,重金属Cd 对APX 活性的影响表现为低浓度促进、高浓度抑制,而随着暴露时间的延长,即使在较低的浓度下,APX 的活性仍会受到较大的影响。 此外,有研究发现,当生菜处于0 ~15 mg·L-1 的 Cd 胁迫下时,随着Cd 胁迫浓度的增加,生菜叶片中APX酶的活性受到诱导[38],与本研究随着Pb 浓度的增加生菜APX 活性“低促高抑”表现不一致,这可能是因为重金属种类以及暴露时间不同。 第14 天时,APX 的活性随着暴露浓度的增加而受到显著抑制,生菜细胞中 SOD、POD 应对重金属 Pb、Cd 胁迫产生的ROS 的作用开始变大。 在复合胁迫下,APX的活性随时间变化逐渐受到抑制,说明在较高浓度的Pb、Cd 复合胁迫下,APX 的活性受到显著的抑制,生菜叶片细胞中的APX 相较于SOD、POD 对重金属胁迫更加敏感。
田丹等[38]在研究 Cd胁迫对生菜幼苗抗氧化酶系统影响时,发现随着Cd暴露浓度的增加,生菜叶片POD 活性受到显著诱导。 与此相类似,在本研究中,POD 活性在暴露第6天、第10 天和第14 天均表现出相同的应答反应,即在单一 Pb 暴露下,随着 Pb 浓度的升高,叶片中POD 的活性受到显著诱导;在Cd 单一暴露下,POD的活性受到诱导;在Pb、Cd 复合暴露下,POD 的活性也随着胁迫程度的增加而受到诱导,以此降低自由基的产生速率,从而减活性氧对细胞膜脂的伤害。APX 是植物活性氧代谢中重要的抗氧化酶之一,可以缓解自由基造成的膜脂过氧化的伤害。 本研究表明,在暴露前期(第6 天、第10 天)APX 在缓解膜脂过氧化伤害中,起到了重要的作用,这与杨波等[39]发现的Cd 胁迫对三叶鬼针草APX 酶活的影响一致,重金属Cd 对APX 活性的影响表现为低浓度促进、高浓度抑制,而随着暴露时间的延长,即使在较低的浓度下,APX 的活性仍会受到较大的影响。 此外,有研究发现,当生菜处于0 ~15 mg·L-1 的 Cd 胁迫下时,随着Cd 胁迫浓度的增加,生菜叶片中APX酶的活性受到诱导[38],与本研究随着Pb 浓度的增加生菜APX 活性“低促高抑”表现不一致,这可能是因为重金属种类以及暴露时间不同。 第14 天时,APX 的活性随着暴露浓度的增加而受到显著抑制,生菜细胞中 SOD、POD 应对重金属 Pb、Cd 胁迫产生的ROS 的作用开始变大。 在复合胁迫下,APX的活性随时间变化逐渐受到抑制,说明在较高浓度的Pb、Cd 复合胁迫下,APX 的活性受到显著的抑制,生菜叶片细胞中的APX 相较于SOD、POD 对重金属胁迫更加敏感。
MDA 是膜脂过氧化的最终分解产物,其含量越高,表明膜脂过氧化程度越高,细胞膜受到的损伤越严重。 大量研究表明,植物在受到重金属胁迫时,会导致活性氧的大量积累,损伤细胞膜,致使膜脂过氧化产物的增加,从而导致MDA 含量上升[40-43]。在本研究中,在重金属Pb、Cd 单一及复合暴露下,叶片中MDA 含量均有不同程度的增加,表明细胞膜受到了不同程度的损伤。 在Pb 单一胁迫下,随着暴露浓度的升高,MDA 的含量上升,呈正相关,表明随着Pb 胁迫强度的增加,细胞膜脂过氧化的程度加深,细胞膜受到损伤的程度加剧;而在Pb、Cd复合胁迫下,当Pb 浓度一致时,其MDA 含量低于Pb 单一暴露组,在此浓度下,可能是因为Pb、Cd 之间存在相互竞位点,Pb、Cd 复合胁迫表现为拮抗作用,减缓了Pb 单一胁迫对生菜的毒性效应。
通过TEM,可以更直接地观察在 Pb、Cd 胁迫下,生菜细胞所受到的损伤。 在本研究中,在Pb、Cd单一及复合胁迫下均可以观察到生菜叶片中叶绿体的结构遭到破坏,线粒体空泡化,染色质出现不同程度的凝缩。 叶绿体以及细胞膜受到损害的程度为Pb 5 mg·L-1+Cd 0.02 mg·L-1>Pb 5 mg·L-1>Cd 0.02 mg·L-1,14 d 时,Cd 0.02 mg·L-1暴露下生菜叶片中SOD、APX 的活性均高于 Pb 5 mg·L-1 的单一暴露以及 Pb 5 mg·L-1+Cd 0.02 mg·L-1 的复合暴露,此时,Cd 单一暴露下生菜叶片细胞清除ROS 的能力要强于Pb 5 mg·L-1的单一暴露以及Pb 5 mg·L-1+Cd 0.02 mg·L-1 的暴露,从而导致细胞膜受到的损害程度轻于这2个暴露组,MDA 的含量也低于这2个暴露组。 此外,在0.02 mg·L-1 Cd 单一胁迫下,细胞中出现了黑色颗粒,赵雅曼等[44]在研究中发现Cd胁迫下宽叶雀稗细胞中积聚很多黑色颗粒,并通过能谱分析证实这些黑色颗粒物的主要成分是Cd,与此相类似,在本实验中,Cd 胁迫下生菜叶片中出现的黑色颗粒很可能是因为Cd 颗粒进入细胞并在细胞质中累积;而在 Pb 5 mg·L-1+Cd 0.02 mg·L-1 胁迫下,细胞中并没有出现黑色颗粒,可能是因为在此浓度下,Pb、Cd 之间产生相互作用,一定程度上阻止了Cd 进入生菜叶片细胞中,前文RI 分析表明,Pb、Cd 复合胁迫的毒性效应为拮抗作用,与此相印证。
[1]Chen R S, de Sherbinin A, Ye C, et al. China’s soil pollution: Farms on the frontline [J]. Science, 2014, 344(6185):691
[2]Jin Z F, Zhang Z J, Zhang H, et al. Assessment of lead bioaccessibility in soils around lead battery plants in East China [J]. Chemosphere,2015,119:1247-1254
[3]Shi T R,Zhang Y Y,Gong Y W,et al.Status of cadmium accumulation in agricultural soils across China (1975-2016):From temporal and spatial variations to risk assessment [J]. Chemosphere,2019,230:136-143
[4]Lasat M M.Phytoextraction of toxic metals [J].Journal of Environmental Quality,2002,31(1):109-120
[5]Yang Q Q, Li Z Y, Lu X N, et al.A review of soil heavy metal pollution from industrial and agricultural regions in China: Pollution and risk assessment [J]. Science of the Total Environment,2018,642:690-700
[6]Zulfiqar U, Farooq M, Hussain S, et al. Lead toxicity in plants: Impacts and remediation [J]. Journal of Environmental Management,2019,250:109557
[7]Haider F U, Cai L Q,Coulter J A,et al.Cadmium toxicity in plants: Impacts and remediation strategies [J]. Ecotoxicology and Environmental Safety,2021,211:111887
[8]Zhang Z,Guo G L,Wang M,et al.Enhanced stabilization of Pb,Zn,and Cd in contaminated soils using oxalic acidactivated phosphate rocks [J]. Environmental Science and Pollution Research International,2018,25(3):2861-2868
[9]赵晓祥, 冯璐, 王宇晖. 锌、镉单一及复合胁迫下番茄幼苗生理响应及联合毒性的研究[J]. 安全与环境学报,2020,20(3):1176-1184
[10]沙桦欣, 伍建榕, 马焕成, 等. 接种根瘤菌对台湾相思生长和抗旱能力的影响[J]. 云南农业大学学报: 自然科学,2013,28(4):517-522
Sha H X, Wu J R, Ma H C, et al. Inoculation of rhizobia strains enhance the growth and drought tolerance of Acacia confusa [J]. Journal of Yunnan Agricultural University: Natural Science,2013,28(4):517-522 (in Chinese)
[11]陈涵, 庄玉婷, 冯嘉仪, 等. 铅镉复合污染对台湾相思生长和元素吸收的影响[J]. 西南林业大学学报: 自然科学,2022,42(1):76-82
Chen H,Zhuang Y T,Feng J Y,et al.Effects of combined pollution of Pb and Cd on the growth and element uptake of Acacia confusa [J].Journal of Southwest Forestry University: Natural Sciences,2022,42(1):76-82 (in Chinese)
[12]Qiu P L,Nguyen V,Guan G X,et al.Occurrence of powdery mildew caused by Golovinomyces orontii on Lactuca sativa var. ramosa (lettuce) in China [J]. Crop Protection,2018,110:108-111
[13]Costa A I G, Queiroz M E L R, Neves A A, et al.Determination of pesticides in lettuce using solid-liquid extraction with low temperature partitioning [J]. Food Chemistry,2015,181:64-71
[14]Hua L,Yang X,Liu Y J,et al.Spatial distributions,pollution assessment, and qualified source apportionment of soil heavy metals in a typical mineral mining city in China [J]. Sustainability,2018,10(9):3115
[15]Hou J, Liu G N,Fu W J,et al.Sensitive crop species and appropriate bioassays for potential use in phytotoxicity assessment of Pb-contaminated soils [J]. Chemistry and E-cology,2014,30(5):463-472
[16]Li J H, Qiu Y, Zhao Q J, et al. Lead and copper-induced hormetic effect and toxicity mechanisms in lettuce(Lactuca sativa L.) grown in a contaminated soil [J]. Science of the Total Environment,2020,741:140440
[17]贾月慧, 韩莹琰, 刘杰, 等. 生菜对镉胁迫的生理响应及体内镉的累积分布[J]. 农业环境科学学报, 2018, 37(8):1610-1618
Jia Y H, Han Y Y, Liu J, et al. Physiological adaptations to cadmium stresses and cadmium accumulation in lettuce[J]. Journal of Agro-Environment Science, 2018, 37(8):1610-1618 (in Chinese)
[18]中华人民共和国生态环境部. 农田灌溉水质标准: GB 5084—2021[S]. 北京: 中国环境出版集团,2021
[19]Gao M L, Liu Y,Dong Y M,et al.Effect of polyethylene particles on dibutyl phthalate toxicity in lettuce (Lactuca sativa L.) [J]. Journal of Hazardous Materials, 2021, 401:123422
[20]Song Y, Zhang F L, Li H P, et al. Antioxidant defense system in lettuces tissues upon various As species exposure [J]. Journal of Hazardous Materials, 2020, 399:123003
[21]张志良, 卓伟箐, 李小芳. 植物生理学实验指导[M]. 北京: 高等教育出版社,2009:42-45
[22]中华人民共和国生态环境部.水质叶绿素a 的测定分光光度法: HJ 897—2017[S]. 北京: 中国环境出版有限责任公司,2017
[23]Graaff M A,Six J,Jastrow J D,et al.Variation in root architecture among switchgrass cultivars impacts root decomposition rates [J]. Soil Biology and Biochemistry,2013,58:198-206
[24]Kucˇerová K, Henselová M, Slováková L’, et al.Effect of plasma activated water, hydrogen peroxide, and nitrates on lettuce growth and its physiological parameters [J].Applied Sciences,2021,11(5):1985
[25]崔晓峰, 丁效东, 李淑仪, 等. 叶面施硅和铈对缓解生菜镉、铅毒害作用的研究[J].安全与环境学报,2012,12(5):7-12
Cui X F, Ding X D,Li S Y,et al.Effects of the foliar application of silicon and cerium sol on relieving toxicity of Pb, Cd in the lettuce [J]. Journal of Safety and Environment,2012,12(5):7-12 (in Chinese)
[26]Cakmak I. Activity of ascorbate-dependent H2O2-scavenging enzymes and leaf chlorosis are enhanced in magnesium- and potassium-deficient leaves, but not in phosphorus-deficient leaves [J]. Journal of Experimental Botany,1994,45(9):1259-1266
[27]He S Y,Feng G P,Yang H S,et al.Effects of pressure reduction rate on quality and ultrastructure of iceberg lettuce after vacuum cooling and storage [J].Postharvest Biology and Technology,2004,33(3):263-273
[28]Gatidou G, Thomaidis N S.Evaluation of single and joint toxic effects of two antifouling biocides, their main metabolites and copper using phytoplankton bioassays [J].A-quatic Toxicology,2007,85(3):184-191
[29]Chesworth J C,Donkin M E,Brown M T.The interactive effects of the antifouling herbicides Irgarol 1051 and Diuron on the seagrass Zostera marina(L.)[J].Aquatic Toxicology,2004,66(3):293-305
[30]黑泽文, 向慧敏, 章家恩, 等. 水合欢对重金属Cd、Pb的耐受性及吸收富集特性[J]. 生态毒理学报, 2019, 14(3):286-296
Hei Z W, Xiang H M,Zhang J E,et al.Tolerance and accumulation ability of Neptunia olerace to Cd and Pb stress in soil [J]. Asian Journal of Ecotoxicology, 2019, 14(3):286-296 (in Chinese)
[31]刘智峰, 呼世斌, 宋凤敏, 等. 陕西某铅锌冶炼区土壤重金属污染特征与形态分析[J]. 农业环境科学学报,2019,38(4):818-826
Liu Z F,Hu S B,Song F M,et al.Pollution characteristics and speciation analysis of heavy metals in soils around a lead-zinc smelter area in Shaanxi Province, China [J].Journal of Agro-Environment Science, 2019, 38(4): 818-826 (in Chinese)
[32]胡国涛, 杨兴, 陈小米, 等. 速生树种竹柳对重金属胁迫的生理响应[J]. 环境科学学报, 2016, 36(10): 3870-3875
Hu G T, Yang X, Chen X M, et al. Physiological responses of bamboo-willow plants to heavy metal stress [J].Acta Scientiae Circumstantiae, 2016, 36(10): 3870-3875(in Chinese)
[33]赖长鸿, 刘亚玲, 贺鸿志, 等. 无机三价砷对生菜的生态毒性及其生物积累[J]. 农业环境科学学报, 2015, 34(5):831-836
Lai C H, Liu Y L, He H Z, et al. Eco-toxicity and accumulation of inorganic trivalent arsenic in lettuce [J]. Journal of Agro-Environment Science, 2015, 34(5): 831-836(in Chinese)
[34]孙健, 铁柏清, 钱湛, 等. 复合重金属胁迫对灯心草生长及其积累特性的影响[J]. 安全与环境工程, 2006(3):17-22,28
[35]Sytar O, Kumar A, Latowski D, et al. Heavy metal-induced oxidative damage, defense reactions, and detoxification mechanisms in plants [J].Acta Physiologiae Plantarum,2013,35(4):985-999
[36]陈顺钰,韩航,薛凌云,等.Pb、Cd 和酸胁迫对枫香种子萌发、幼苗生长及体内抗氧化酶活性的影响[J]. 农业环境科学学报,2018,37(4):647-655
Chen S Y, Han H, Xue L Y, et al. Effects of Pb, Cd, and acid stress on seed germination, seedling growth, and antioxidant enzyme activities of Liquidambar formosana [J].Journal of Agro-Environment Science, 2018, 37(4): 647-655 (in Chinese)
[37]Dvorˇák P,Krasylenko Y,Zeiner A,et al.Signaling toward reactive oxygen species-scavenging enzymes in plants [J].Frontiers in Plant Science,2021,11:618835
[38]田丹, 任艳芳, 王艳玲, 等. 镉胁迫对生菜种子萌发及幼苗抗氧化酶系统的影响[J].北方园艺,2018(2):15-21
Tian D, Ren Y F, Wang Y L, et al. Effects of cadmium stress on seed germination, seedling growth and antioxidant enzyme system of lettuce [J]. Northern Horticulture,2018(2):15-21 (in Chinese)
[39]杨波, 陈银萍, 柯昀琪, 等. EDDS 对Cd 胁迫下三叶鬼针草生长和抗氧化酶系统及Cd 积累的影响[J]. 农业环境科学学报,2018,37(5):875-882
Yang B, Chen Y P, Ke Y Q, et al. Effects of EDDS on growth, antioxidant enzyme, and Cd accumulation of Bidens pilosa L. seedlings under Cd stress [J]. Journal of Agro-Environment Science,2018,37(5):875-882 (in Chinese)
[40]Thakur S, Singh L, Zularisam A W, et al. Lead induced oxidative stress and alteration in the activities of antioxidative enzymes in rice shoots [J]. Biologia Plantarum,2017,61(3):595-598
[41]Kaur G,Kaur S,Singh H P,et al.Biochemical adaptations in Zea mays roots to short-term Pb2+ exposure: ROS generation and metabolism [J]. Bulletin of Environmental Contamination and Toxicology,2015,95(2):246-253
[42]Kaur G, Singh H P, Batish D R, et al. A time course assessment of changes in reactive oxygen species generation and antioxidant defense in hydroponically grown wheat in response to lead ions (Pb2+) [J]. Protoplasma, 2012, 249(4):1091-1100
[43]Lamhamdi M, Bakrim A, Aarab A, et al. Lead phytotoxicity on wheat (Triticum aestivum L.) seed germination and seedlings growth [J]. Comptes Rendus Biologies,2011,334(2):118-126
[44]赵雅曼,陈顺钰,张韵,等.酸、Cd 胁迫对宽叶雀稗种子萌发、幼苗生长及亚细胞结构的影响[J]. 农业环境科学学报,2019,38(1):60-69
Zhao Y M, Chen S Y, Zhang Y, et al. Effects of acid and cadmium stresses on seed germination, seedling growth,and subcellular structure of Paspalum wettsteinii [J].Journal of Agro-Environment Science,2019,38(1): 60-69 (in Chinese)