镉(cadmium, Cd)是我国近岸海域典型的重金属污染物,海水中较低浓度的Cd 即可被水生生物富集[1],并通过食物链放大,诱导毒性效应[2]。 近年来,随着我国生态文明建设的不断推进,全国总体上Cd直排入海量呈现下降趋势,但Cd 难以从环境中清除,仍是我国近岸海域主要的污染物之一。 据报道,锦州湾海水中最高Cd 含量达5 μg·L-1[3],超国家第Ⅰ类海水水质标准(GB 3097—1997)[4]。 海洋生物是海水污染的直接受害者,山东烟台附近海域太平洋牡蛎(Crassostrea gigas)体内Cd 含量最高可达5.69 μg·g-1(湿质量)[5],超国家第Ⅲ类海洋生物质量标准(GB 18421—2001)[6]。
离子稳态在生命活动过程中发挥重要作用,但有关Cd 引起海洋生物离子稳态变化的研究鲜有报道。 研究表明,Cd 可置换超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)等抗氧化酶活性中心的必需金属元素导致锰(Mn)和锌(Zn)等离子平衡失调[7-8],并影响蛋白分子的结构和功能,进而诱导机体产生氧化应激反应[9]。 此外,Cd具有亲巯基(—SH)的特性[10],可通过结合—SH 抑制钠钾ATP 酶(Na+, K+-ATPase, NKA)活性[11],干扰钠离子(Na+)和钾离子(K+)的转运。 线粒体内也富含具有—SH 的蛋白,Cd 可导致线粒体电子传递链功能受损,诱导细胞产生大量活性氧(reactive oxygen species, ROS),进而导致线粒体及细胞损伤[12]。 能量动态平衡在海洋生物应对污染物胁迫过程中发挥重要作用,是氧化应激和离子稳态等多种生命活动的重要基础[13]。 Cd 不仅造成能量代谢的主要场所线粒体的损伤,也影响机体的能量代谢过程。 Bao等[14]发现,Cd 可诱导泥蚶(Tegillarca granosa)鳃中产生与能量代谢相关的差异表达蛋白(异柠檬酸脱氢酶(isocitric dehydrogenase, IDH)等)。 我们之前的研究结果表明,海洋双壳贝类体内三羧酸(TCA)循环、糖酵解以及氨基酸的代谢和合成等关键代谢途径均受Cd 暴露的影响[15-16]。
尽管国内外已围绕Cd 对海洋生物的毒性开展了大量研究,但环境因子(如盐度)对Cd 毒性影响的报道相对较少。 研究表明,盐度变化可改变Cd 在水体中的赋存形态和生物可利用性[17]。 Sun 等[18]发现在相同Cd 暴露浓度下,盐度为13 psu 和34 psu时太平洋牡蛎(C. gigas)消化腺中Cd 含量分别为13.27 μg·g-1和 7.37 μg·g-1(干质量),表明低盐显著提高牡蛎消化腺对Cd 的富集,进而加剧Cd 的毒性效应。 受潮汐周期、气候变化以及淡水汇入等因素的影响,近岸海域的海水盐度低于正常海水盐度,而Cd 污染也常发生在这一区域,因此有必要深入研究低盐对Cd 毒性效应的影响。
生物标志物是指生物体遭受环境胁迫时在组织、细胞和分子等不同生物学水平上表现出异常变化的信号指标,可对应激伤害提供预警。 综合生物标志物响应(integrated biomarker response, IBR)法通过将各类生物标志物统一量化,可直观地体现环境胁迫对生物体造成的影响,目前已经被广泛应用于水生生物毒性效应的研究[19]。 太平洋牡蛎(C. gigas)广泛分布于我国北方近岸海域,部分牡蛎生活在河口等低盐环境中,营固着和滤食性生活方式,对污染物具有较强的富集能力,是一种理想的海洋环境监测生物[20]。 因此,本研究以太平洋牡蛎(C. gigas)为受试生物,在实验室模拟低盐和Cd 胁迫条件,通过测定Cd 和必需金属元素含量以及氧化应激、能量代谢和渗透调节等相关生物指标,探究低盐对Cd毒性效应的影响,并运用IBR 法评估Cd 和低盐单一和复合胁迫的毒性差异,以期为近岸Cd 污染的研究及生态风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 暴露实验
实验用牡蛎采自崆峒岛(中国烟台),低温快速运回实验室,经过滤海水洗净后,挑选140个壳形完整且大小相近的个体(壳长:(5.7±0.7) cm,壳宽:(3.2±0.5) cm,壳厚:(1.5±0.3) cm),在正常盐度(31.4 psu)海水中暂养3 d。 然后将牡蛎随机分成2 组,其中一组在正常盐度条件下驯化7 d;另一组以3.1 psu·d-1的速率将水体盐度降至15.7 psu,之后在低盐度(15.7 psu)海水中继续驯化2 d,以使牡蛎适应低盐环境。 本研究中低盐度(15.7 psu)参考前期调研的莱州湾主要河口的平均盐度(数据未发表)。 在2个盐度条件下均设置对照组和Cd 暴露组(表1)。 利用水合氯化镉(CdCl2·2.5H2O) (上海麦克林生化科技有限公司,纯度99.99%)制备Cd 暴露液,暴露浓度设置为 5、20、80 和 240 μg·L-1,其中 5 μg·L-1 和 20 μg·L-1为环境相关浓度[21]。 每组有 14 只牡蛎,养殖水体为20 L。 暂养、驯化和暴露期间,实验条件为温度(17.1±1.6) ℃,溶解氧含量(7.6±1.2) mg·L-1,pH(8.0±0.1),自然光照 12 h·d-1,持续曝气。 每日按牡蛎组织干质量的2%喂食小球藻(Chlorella vulgaris),进食2 h 后换水。 取样前一日停止投喂饵料。 暴露7 d 后,将牡蛎置于冰上解剖,取鳃组织,用中性滤纸快速吸干组织表面水分,置于液氮中速冻后,存于-80 ℃冰箱。
表1 Cd 暴露实验设置
Table 1 The treatments of Cd exposure
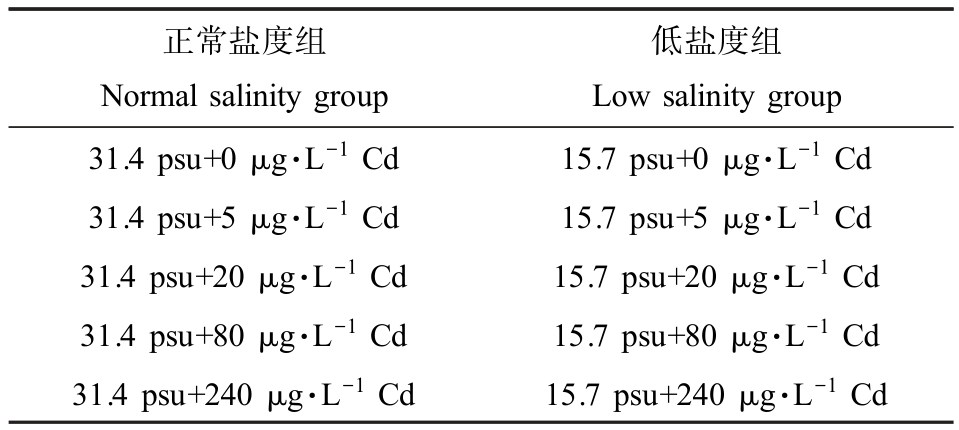
正常盐度组Normal salinity group低盐度组Low salinity group 31.4 psu+0 μg·L-1 Cd 15.7 psu+0 μg·L-1 Cd 31.4 psu+5 μg·L-1 Cd 15.7 psu+5 μg·L-1 Cd 31.4 psu+20 μg·L-1 Cd 15.7 psu+20 μg·L-1 Cd 31.4 psu+80 μg·L-1 Cd 15.7 psu+80 μg·L-1 Cd 31.4 psu+240 μg·L-1 Cd 15.7 psu+240 μg·L-1 Cd
1.2 Cd 和必需金属元素的含量测定
称取约100 mg 鳃组织样品(n=6)置于电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司,DHG-9140A)中,80 ℃烘干至恒重并记录。 每个样品加入1 mL 二次纯化浓硝酸(美国Thermo Scientific 公司,浓度70%,亚沸蒸馏纯化),80 ℃水浴加热至消解完全。 冷却至室温,超纯水定容至10 mL,采用电感耦合等离子体质谱仪(ICP-MS) (美国PerkinElmer 公司,ELAN DRC-Ⅱ)测定分析Cd 和必需金属元素如钠(Na)、镁(Mg)、钾(K)、Mn、Zn、铜(Cu)和铁(Fe)的含量。 组织内 Cd、Mn 和 Fe 含量以 μg·g-1(干质量)表示,Na、Mg、K、Zn 和 Cu 含量以 mg·g-1(干质量)表示。
1.3 酶活性及MDA 含量测定
称取约100 mg 鳃组织样品(n=6)于匀浆管中,加入生理盐水或试剂盒提供的提取液进行匀浆。 使用南京建成生物工程研究所提供的试剂盒,测定总蛋白浓度(BCA 法) 和丙二醛(malondialdehyde,MDA)含量,以及 SOD (EC: 1.15.1.1)、CAT (EC:1.11.1.6)、GPx (EC: 1.11.1.9)、丙酮酸激酶(pyruvate kinase, PK) (EC: 2.7.1.40)、柠檬酸合酶(citrate synthase,CS)(EC:2.3.3.1)、NKA (EC:7.2.2.13)活性。 使用北京索莱宝科技有限公司提供的试剂盒,测定IDH (EC: 1.1.1.41)活性。 SOD、CAT、GPx、CS、IDH和NKA 活性的活力单位为U·mg-1,PK 活性的活力单位为U·g-1,其中1 U 代表单位质量蛋白在单位时间内吸光度的变化;MDA 含量的单位为nmol·mg-1;蛋白浓度的单位为 μg·mL-1。
1.4 综合生物标志物响应(IBR)分析
IBR 计算方法参考 Beliaeff 和 Burgeot 的方法[22],并稍做改进,具体计算过程简述如下:将各组的生物标志物数据(Ai)与正常盐度条件下对照组的数据(A0)进行比较,并取对数以减少方差;计算各处理组中Yi 的平均值(m)和标准差(s),将Yi 标准化;计算生物标志物偏差指数(B),其中Zi 为处理组,Z0为正常盐度条件下对照组;对每种生物标志物的B值进行绝对值求和(n 为所选用的生物标志物的个数),计算出IBR 值。 IBR 值越大表明生物所受影响越大,其中正常盐度条件下对照组的IBR 值为0。星图中描绘出生物标志物偏差指数(B),其中B 值高于0(正常盐度条件下对照组的B 值)的区域表明生物标志物被诱导,低于0 的区域表明生物标志物被抑制。
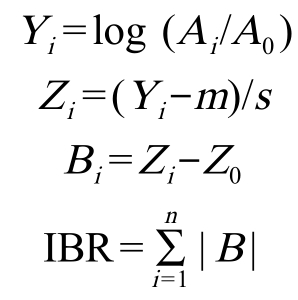
1.5 数据统计分析
实验结果均以平均值±标准差(Mean±SD)表示,并采用统计软件SPSS 20.0 对数据进行统计分析。对数据进行正态分布(Shapiro-Wilk)检验和方差齐性(Levene)检验,运用双因素方差分析(Two-Way ANOVA)研究Cd 和低盐对Cd 和必需金属元素含量以及生物标志物响应的影响。 运用单因素方差分析(One-Way ANOVA)结合 Dunnett’s 检验比较各暴露组与对照组间差异的显著性,运用t 检验分析比较低盐度组与正常盐度组间差异的显著性以及低盐度与正常盐度条件下IBR 值差异的显著性,若P<0.05则认为差异具有统计学意义。
2 结果(Results)
2.1 牡蛎鳃中Cd 和必需金属元素的含量
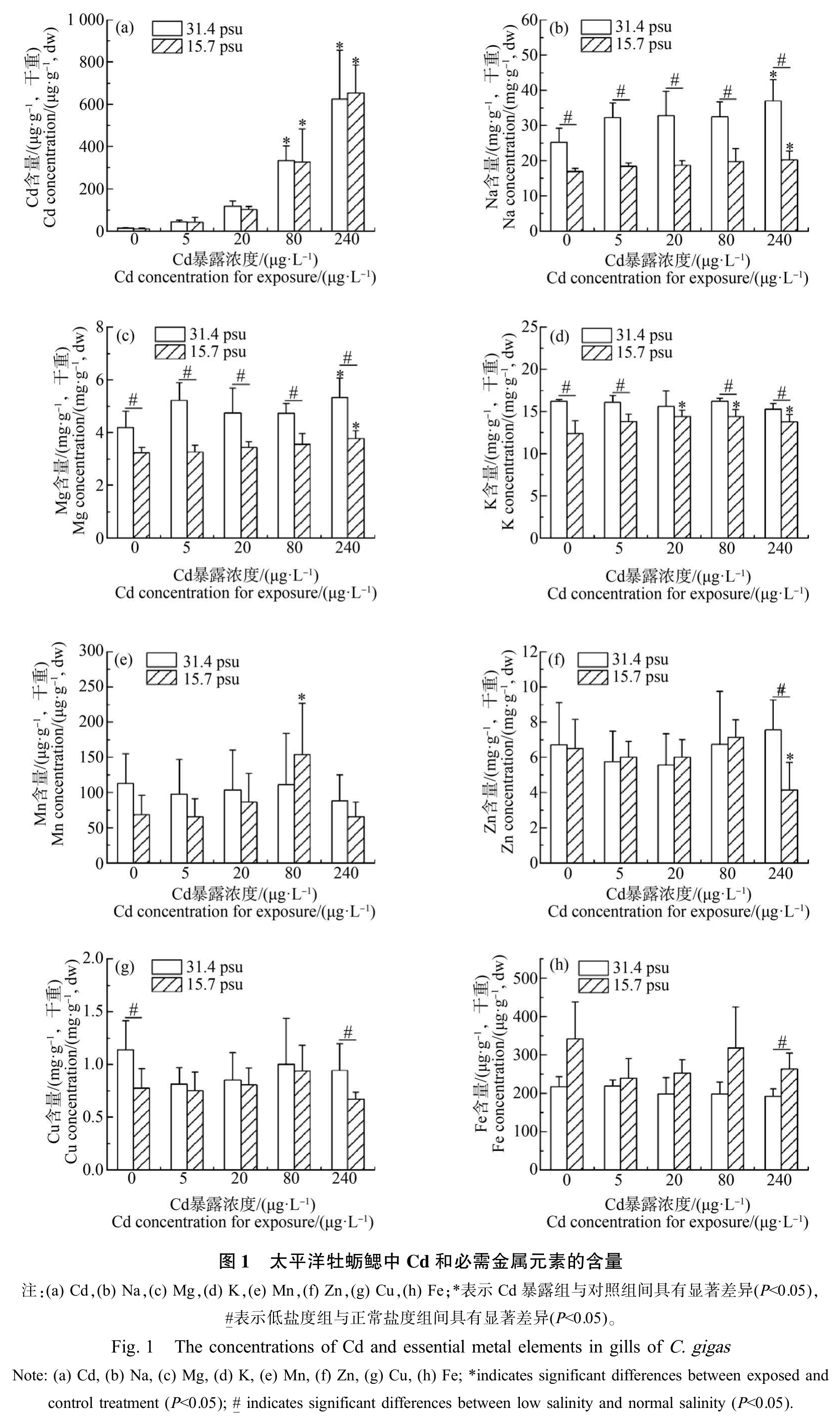
经Cd 暴露的牡蛎鳃中Cd 和必需金属元素的含量如图1 所示。 在正常盐度和低盐度条件下,牡蛎鳃中Cd 含量均随Cd 暴露浓度的升高而升高(图1(a)),且在 80 μg·L-1和 240 μg·L-1 Cd 暴露组中均显著高于对照组(P<0.05)。 此外,在低盐度条件下,对照组和Cd 暴露组样品中Cd 含量与正常盐度条件下相比无明显差异。
经Cd 暴露的牡蛎鳃中必需金属元素Na、Mg、K、Mn、Zn、Cu 和 Fe 的含量也发生改变。 双因素方差分析结果显示,Cd 和低盐对样品中K 含量变化存在显著交互作用(P<0.05),对Zn 含量变化的交互作用接近显著(P=0.051),而对 Na、Mg、Mn、Cu 和 Fe含量变化的交互作用不显著;Cd 和低盐均显著(P<0.05)影响样品中 Na 和 Mg 含量,低盐还显著(P <0.05)影响 K、Fe 和 Cu 含量(表 2)。
表2 双因素方差分析:Cd 和低盐对太平洋牡蛎鳃中Cd 及必需金属元素含量的影响
Table 2 Two-way ANOVA: Effects of Cd and low salinity on the concentrations of Cd and essential metal elements in gills of C. gigas
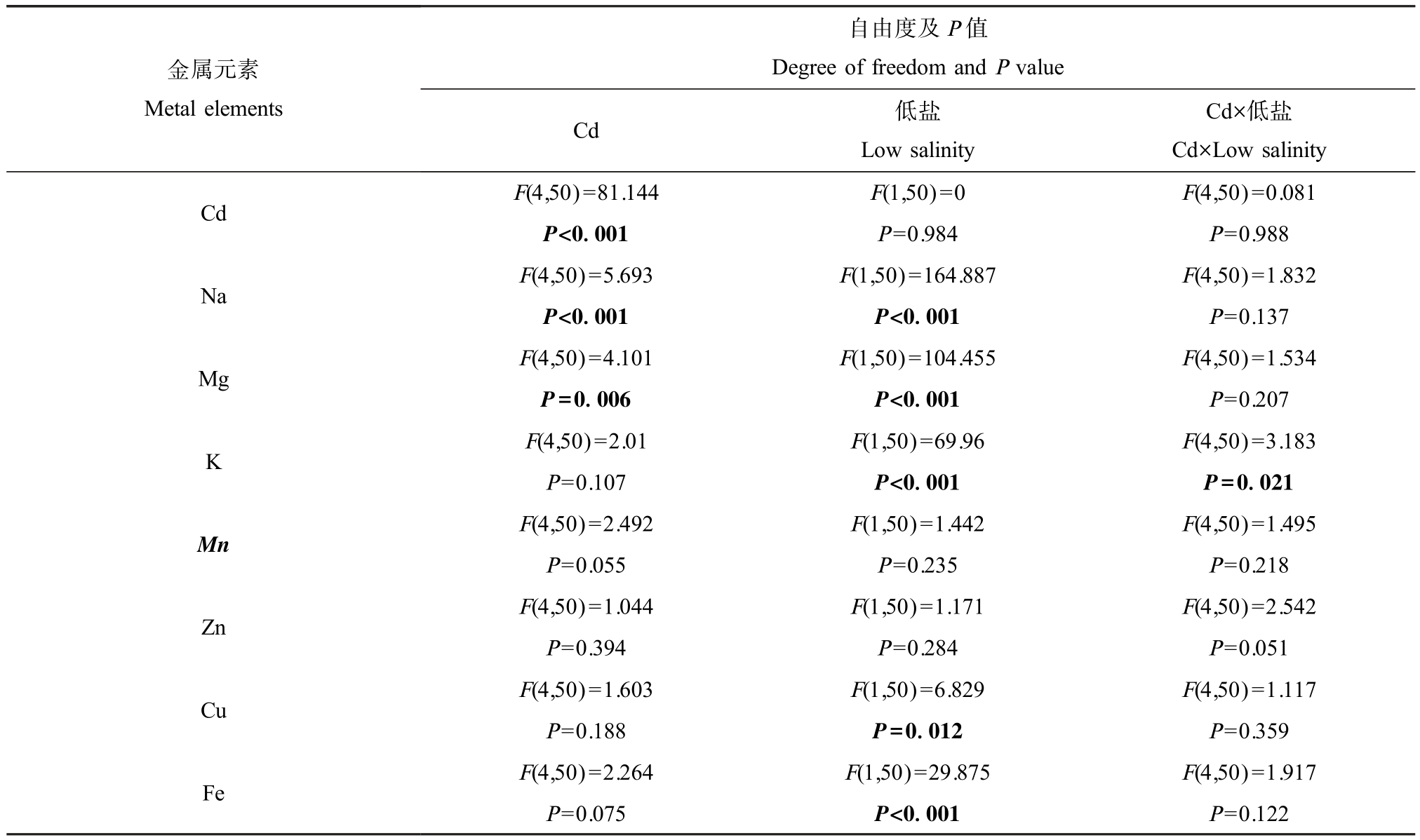
注:表中加粗字体表示具有显著作用(P<0.05)。
Note: Statistically significant results are indicated in bold (P<0.05).
金属元素Metal elements自由度及P 值Degree of freedom and P value Cd 低盐Low salinity Cd×低盐Cd×Low salinity Cd F(4,50)=81.144 F(1,50)=0 F(4,50)=0.081 P<0.001 P=0.984 P=0.988 Na F(4,50)=5.693 F(1,50)=164.887 F(4,50)=1.832 P<0.001 P<0.001 P=0.137 Mg F(4,50)=4.101 F(1,50)=104.455 F(4,50)=1.534 P=0.006 P<0.001 P=0.207 F(4,50)=2.01 F(1,50)=69.96 F(4,50)=3.183 P=0.107 P<0.001 P=0.021 Mn F(4,50)=2.492 F(1,50)=1.442 F(4,50)=1.495 P=0.055 P=0.235 P=0.218 Zn F(4,50)=1.044 F(1,50)=1.171 F(4,50)=2.542 P=0.394 P=0.284 P=0.051 Cu F(4,50)=1.603 F(1,50)=6.829 F(4,50)=1.117 P=0.188 P=0.012 P=0.359 Fe F(4,50)=2.264 F(1,50)=29.875 F(4,50)=1.917 P=0.075 P<0.001 P=0.122 K
正常盐度条件下,最高浓度Cd 暴露组(240 μg·L-1)样品中Na 和Mg 含量显著高于对照组(P<0.05)(图 1(b)~(c));而 Cd 暴露后 K、Mn、Zn、Cu 和 Fe 含量与对照组相比均无显著变化(图1(d)~(h))。 低盐度条件下,除5 μg·L-1 Cd 暴露组外,其余3个 Cd暴露组样品中K 含量均显著高于对照组(P<0.05);Mn 含量呈倒 U 型曲线,80 μg·L-1 Cd 暴露组样品中Mn 含量最高,显著高于对照组(P<0.05);最高浓度 Cd 暴露组(240 μg·L-1)样品中 Zn 含量显著低于对照组(P<0.05);而Cd 暴露后Cu 和Fe 含量与对照
组相比均无显著变化。 此外,与正常盐度条件下相比,在低盐度条件下,对照组和Cd 暴露组样品中Na和 Mg 含量均显著降低(P<0.05);除20 μg·L-1 Cd 暴露组外,对照组和其余3个Cd 暴露组样品中K 含量均显著降低(P<0.05);最高浓度Cd 暴露组(240 μg·L-1)样品中 Zn 含量显著降低(P<0.05),而 Fe 含量显著升高(P<0.05);对照组和最高浓度Cd 暴露组(240 μg·L-1)样品中 Cu 含量显著降低(P<0.05)。
2.2 牡蛎鳃中抗氧化相关酶的活性及MDA 含量
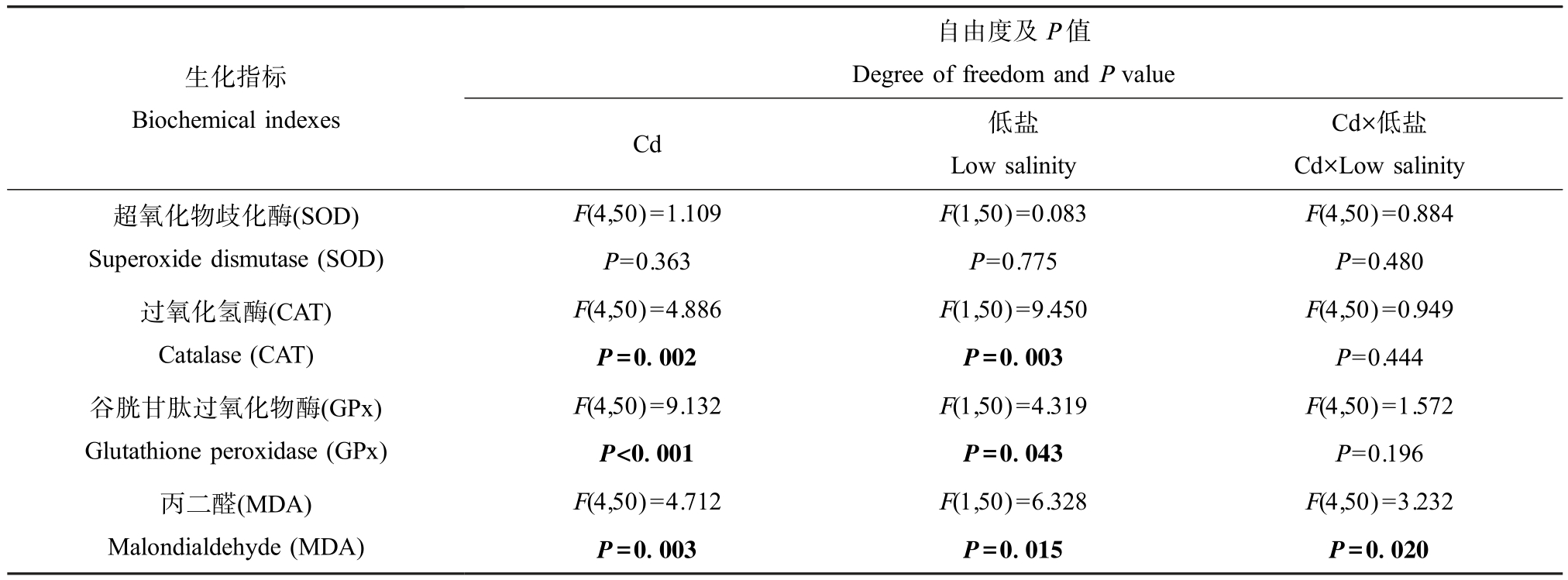
双因素方差分析结果显示,Cd 和低盐对牡蛎鳃中MDA 含量变化存在显著交互作用(P<0.05),而对SOD、CAT 和GPx 活性变化的交互作用不显著;Cd和低盐均显著(P<0.05)影响样品中CAT 和 GPx 活性以及MDA 含量,未显著影响SOD 活性(表3)。
表3 双因素方差分析:Cd 和低盐对太平洋牡蛎鳃中氧化应激相关指标的影响
Table 3 Two-way ANOVA: Effects of Cd and low salinity on endpoints related to oxidative stress in gills of C. gigas
注:表中加粗字体表示具有显著作用(P<0.05)。
Note: Statistically significant results are indicated in bold (P<0.05).
生化指标Biochemical indexes自由度及P 值Degree of freedom and P value Cd 低盐Low salinity Cd×低盐Cd×Low salinity超氧化物歧化酶(SOD)Superoxide dismutase (SOD)F(4,50)=1.109 F(1,50)=0.083 F(4,50)=0.884 P=0.363 P=0.775 P=0.480 F(4,50)=4.886 F(1,50)=9.450 F(4,50)=0.949 P=0.002 P=0.003 P=0.444谷胱甘肽过氧化物酶(GPx)Glutathione peroxidase (GPx)过氧化氢酶(CAT)Catalase (CAT)F(4,50)=9.132 F(1,50)=4.319 F(4,50)=1.572 P<0.001 P=0.043 P=0.196丙二醛(MDA)Malondialdehyde (MDA)F(4,50)=4.712 F(1,50)=6.328 F(4,50)=3.232 P=0.003 P=0.015 P=0.020
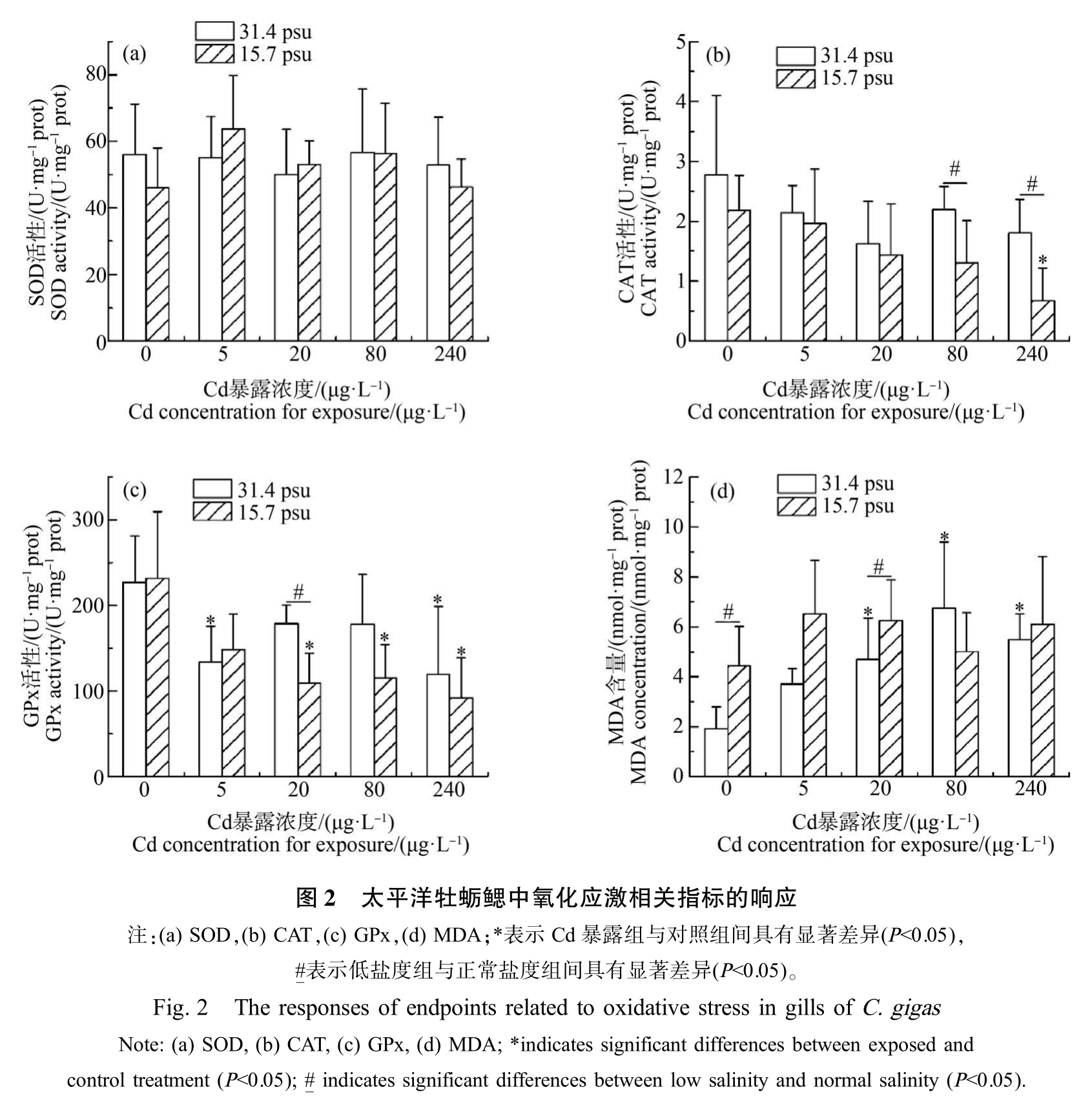
牡蛎鳃中抗氧化相关酶活性及MDA 含量如图2 所示。 正常盐度条件下,与对照组相比,5 μg·L-1和240 μg·L-1 Cd 暴露组样品中 GPx 活性显著降低(P<0.05) (图2(c));MDA 含量随着 Cd 暴露浓度升高而升高,在高于20 μg·L-1 Cd 的暴露组中均显著升高(P<0.05) (图 2(d));而 Cd 暴露后 SOD 和 CAT 活性无显著变化(图2(a) ~(b))。 低盐度条件下,与对照组相比,240 μg·L-1 Cd 暴露组样品中 CAT 活性显著降低(P<0.05);各Cd 暴露组样品中GPx 活性均显著降低(P<0.05);而Cd 暴露后SOD 活性和 MDA含量均无显著变化。 此外,与正常盐度条件下相比,在低盐度条件下,80 μg·L-1和 240 μg·L-1 Cd 暴露组样品中 CAT 活性显著降低(P<0.05);20 μg·L-1 Cd暴露组样品中GPx 活性显著降低(P<0.05);对照组和20 μg·L-1 Cd 暴露组样品中MDA 含量显著升高(P<0.05);而对照组和Cd 暴露组样品中SOD 活性无显著变化。
2.3 牡蛎鳃中能量代谢和渗透压调节相关酶的活性
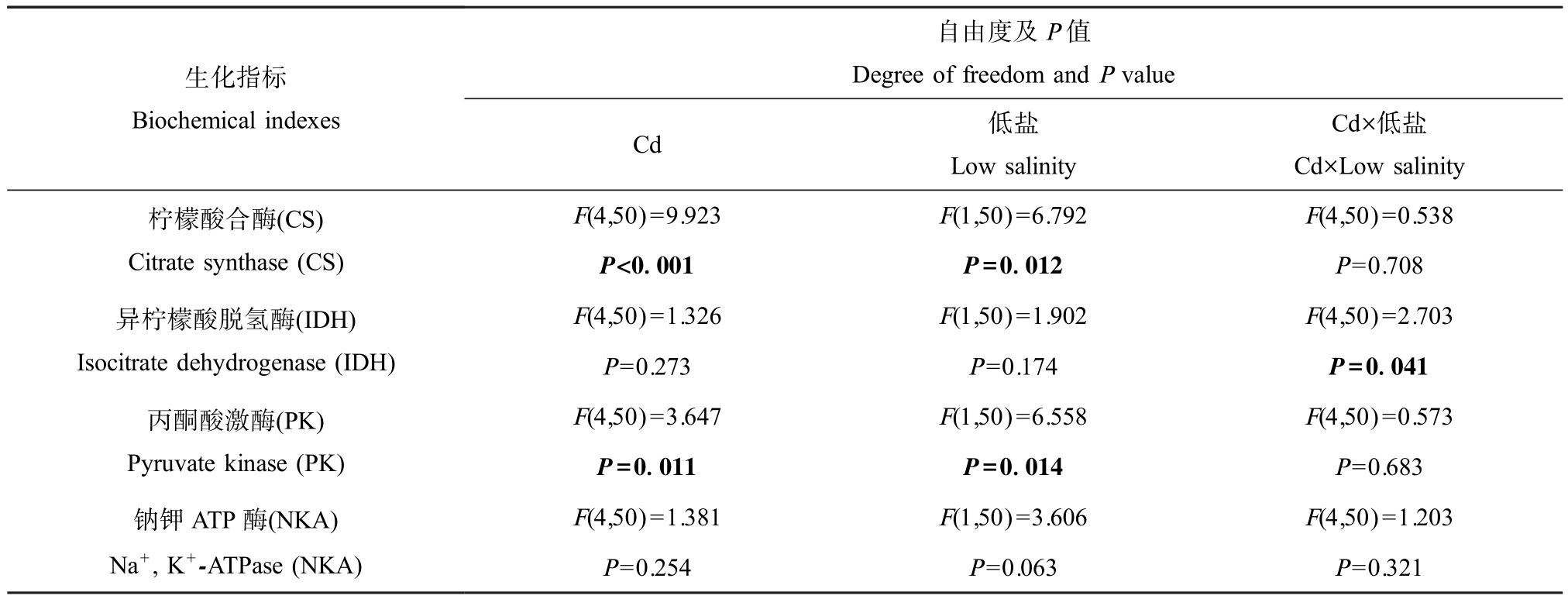
双因素方差分析结果显示,Cd 和低盐对牡蛎鳃中IDH 活性变化存在显著交互作用(P<0.05),而对CS、PK 和NKA 活性变化的交互作用不显著;Cd 和低盐均显著(P<0.05)影响 CS 和 PK 活性,仅低盐对NKA 活性接近显著影响(P=0.063) (表4)。
表4 双因素方差分析:Cd 和低盐对太平洋牡蛎鳃中能量代谢和渗透压调节相关指标的影响
Table 4 Two-way ANOVA: Effects of Cd and low salinity exposure on endpoints related to energy metabolism and osmotic regulation in gills of C. gigas
注:表中加粗字体表示具有显著作用(P<0.05)。
Note: Statistically significant results are indicated in bold (P<0.05).
生化指标Biochemical indexes自由度及P 值Degree of freedom and P value Cd 低盐Low salinity Cd×低盐Cd×Low salinity柠檬酸合酶(CS)Citrate synthase (CS)F(4,50)=9.923 F(1,50)=6.792 F(4,50)=0.538 P<0.001 P=0.012 P=0.708异柠檬酸脱氢酶(IDH)Isocitrate dehydrogenase (IDH)F(4,50)=3.647 F(1,50)=6.558 F(4,50)=0.573 P=0.011 P=0.014 P=0.683钠钾ATP 酶(NKA)Na+, K+-ATPase (NKA)F(4,50)=1.326 F(1,50)=1.902 F(4,50)=2.703 P=0.273 P=0.174 P=0.041丙酮酸激酶(PK)Pyruvate kinase (PK)F(4,50)=1.381 F(1,50)=3.606 F(4,50)=1.203 P=0.254 P=0.063 P=0.321
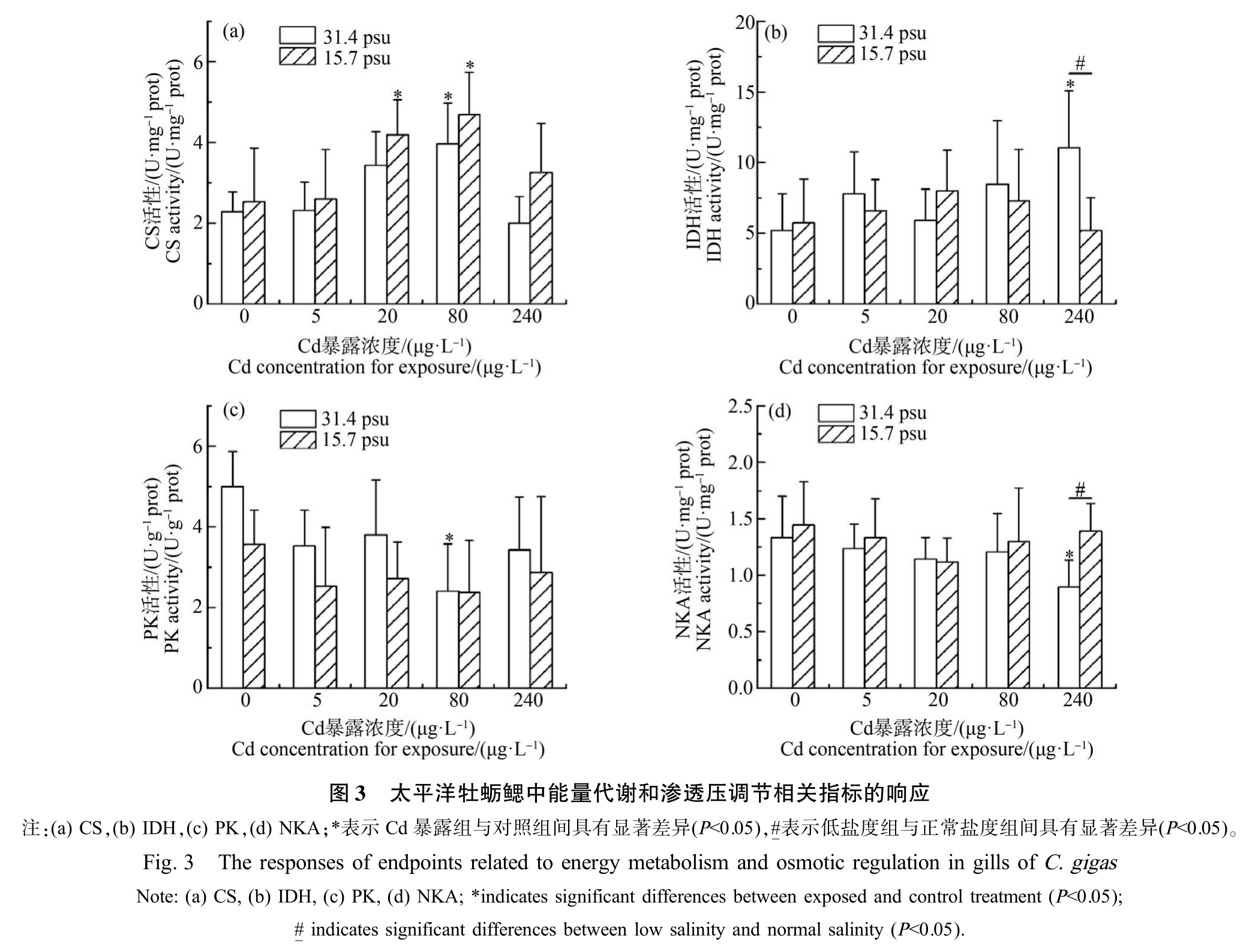
牡蛎鳃中能量代谢和渗透压调节相关酶的活性如图3 所示。 在正常盐度和低盐度条件下,牡蛎鳃中CS 活性均随Cd 暴露浓度升高呈倒U 型曲线(图3(a)),且均以 80 μg·L-1 Cd 暴露组样品中 CS 活性最高,显著高于对照组(P<0.05)。 而不同盐度条件下样品中IDH、PK 和NKA 活性的变化趋势不同(图3(b)~(d))。 正常盐度条件下,240 μg·L-1 Cd 暴露组样品中IDH 活性显著高于对照组(P<0.05),而NKA活性显著低于对照组(P<0.05);PK 活性呈U 型曲线,80 μg·L-1 Cd 暴露组样品中 PK 活性最低,显著低于对照组(P<0.05)。 低盐度条件下,Cd 暴露后样品中IDH、PK 和NKA 活性与对照组相比均无显著变化。 此外,与正常盐度条件下相比,在低盐度条件下,240 μg·L-1 Cd 暴露组样品中 IDH 活性显著降低(P<0.05),而 NKA 活性显著升高(P<0.05)。
2.4 综合生物标志物响应(IBR)
IBR 星图显示了牡蛎鳃中8 种生物标志物(SOD、CAT、GPx、MDA、CS、IDH、PK 和 NKA)的响应(图4(a)~(b))。 IBR 值分析结果显示,正常盐度条件下,IBR 值随着Cd 暴露浓度升高而逐渐增大;正常盐度和低盐度条件下IBR 值差异接近显著(P=0.056)。
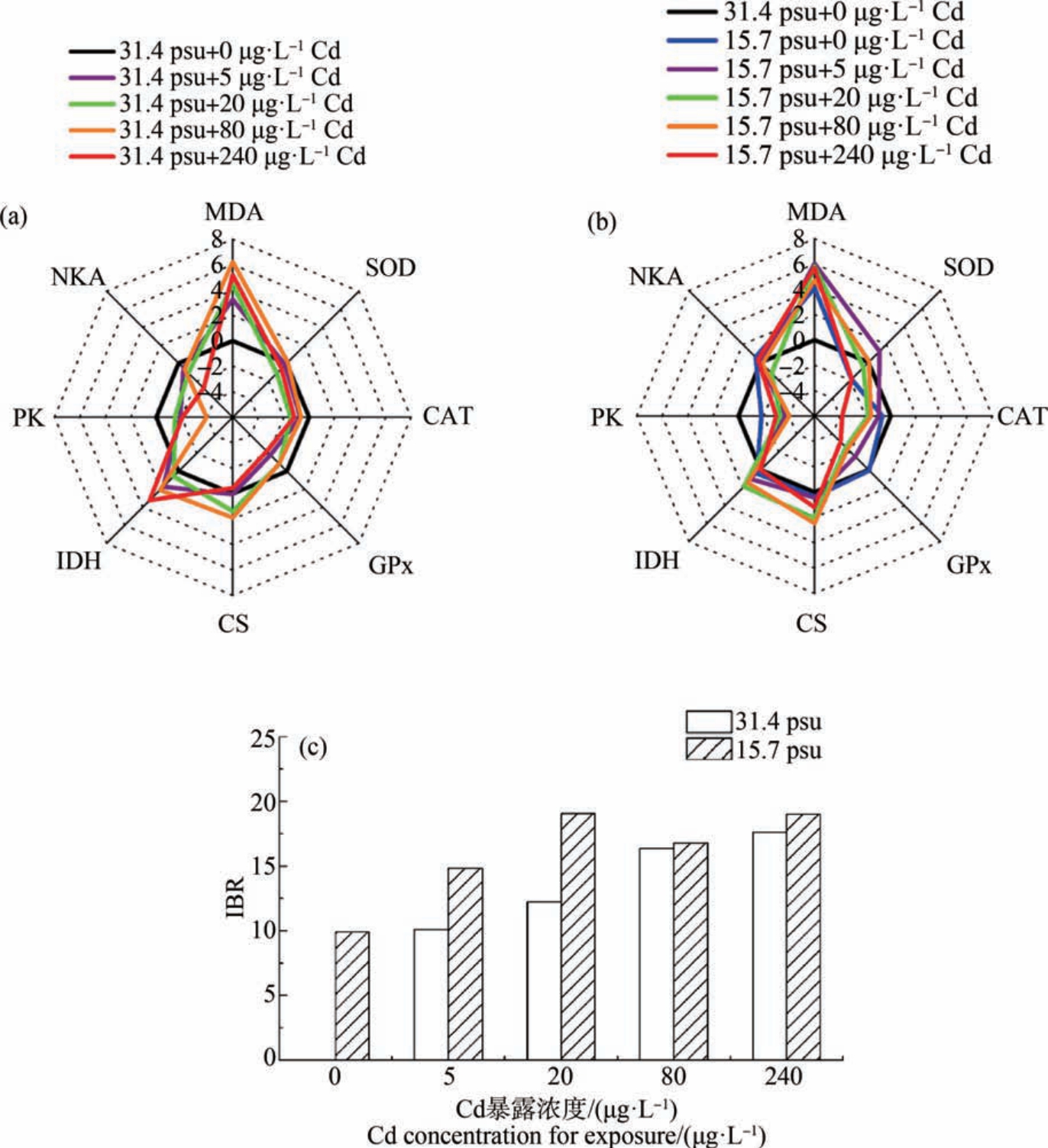
图4 Cd 和低盐单一及复合胁迫后太平洋牡蛎鳃中生物标志物星状图和综合生物标记物响应(IBR)
注:(a) Cd 单一胁迫后生物标志物星状图;(b) Cd 和低盐复合胁迫后生物标志物星状图;(c) 综合生物标记物响应(IBR)。
Fig.4 Biomarker star plots and integrated biomarker response (IBR) of C. gigas gills after the exposures to Cd, low salinity and their combination
Note: (a) Biomarker star plots after the exposures to Cd; (b) Biomarker star plots after the exposures to Cd and low salinity; (c) Integrated biomarker response (IBR).
3 讨论(Discussion)
3.1 Cd 对牡蛎鳃的毒性效应
海洋双壳贝类的鳃与水环境直接接触,是富集Cd 的主要组织[23]。 本研究发现,牡蛎鳃中 Cd 富集量随Cd 暴露浓度升高呈线性增长,而Cd 对机体氧化损伤、离子平衡和能量代谢等过程的影响表现出多样化的剂量依赖效应。
生物体正常的氧化代谢会产生ROS,如超氧阴离子![]() 、羟自由基(·OH)和过氧化氢(H2O2)等。SOD 将
、羟自由基(·OH)和过氧化氢(H2O2)等。SOD 将![]() 和·OH 歧化为氧分子(O2)和 H2O2,CAT和GPx 进一步催化H2O2 为无毒的 O2 和水分子(H2O)[24-25]。 当生物体受到环境胁迫时,会诱发机体产生过量ROS,从而造成氧化损伤,而MDA 含量可作为指示生物体内氧化损伤程度的指标[9]。 在本研究中,Cd 胁迫对牡蛎鳃中SOD 活性无显著影响,但显著抑制了CAT 和GPx 活性,且造成MDA 含量显著升高。 CAT 和GPx 活性降低可能与歧化反应产生的H2O2 积累增加有关[26]。 研究表明,过量H2O2会打破SOD 与CAT、GPx 活性之间的平衡,从而抑制CAT 和 GPx 的功能,导致其活性降低[27]。 抗氧化系统的正常功能被扰乱又会造成机体内ROS 进一步蓄积,加剧脂质过氧化程度,导致MDA 含量升高。 此外,与 CAT 相比,GPx 除了清除 H2O2,还清除有机氢过氧化物和脂质过氧化物等。 因此,在Cd胁迫条件下,机体内过氧化物的含量可能直接影响GPx 活性[28]。 本研究发现,最低浓度 Cd 暴露组(5 μg·L-1)样品中 GPx 活性被显著抑制,而 CAT 活性无明显变化,表明牡蛎鳃中GPx 较CAT 对低浓度Cd 污染更灵敏,更适合作为实际环境中Cd 污染的生物标志物。
和·OH 歧化为氧分子(O2)和 H2O2,CAT和GPx 进一步催化H2O2 为无毒的 O2 和水分子(H2O)[24-25]。 当生物体受到环境胁迫时,会诱发机体产生过量ROS,从而造成氧化损伤,而MDA 含量可作为指示生物体内氧化损伤程度的指标[9]。 在本研究中,Cd 胁迫对牡蛎鳃中SOD 活性无显著影响,但显著抑制了CAT 和GPx 活性,且造成MDA 含量显著升高。 CAT 和GPx 活性降低可能与歧化反应产生的H2O2 积累增加有关[26]。 研究表明,过量H2O2会打破SOD 与CAT、GPx 活性之间的平衡,从而抑制CAT 和 GPx 的功能,导致其活性降低[27]。 抗氧化系统的正常功能被扰乱又会造成机体内ROS 进一步蓄积,加剧脂质过氧化程度,导致MDA 含量升高。 此外,与 CAT 相比,GPx 除了清除 H2O2,还清除有机氢过氧化物和脂质过氧化物等。 因此,在Cd胁迫条件下,机体内过氧化物的含量可能直接影响GPx 活性[28]。 本研究发现,最低浓度 Cd 暴露组(5 μg·L-1)样品中 GPx 活性被显著抑制,而 CAT 活性无明显变化,表明牡蛎鳃中GPx 较CAT 对低浓度Cd 污染更灵敏,更适合作为实际环境中Cd 污染的生物标志物。
生物体为了满足对不同金属离子的需要,通过多种机制从胞外环境摄取离子并维持动态平衡。 本研究发现,Cd 胁迫导致牡蛎鳃中Mg 和Na 含量显著升高。 Mg2+参与激活多种代谢途径[29],因此推测Mg 含量升高与Cd 胁迫后机体能量和蛋白质合成的需求增加有关。 本研究还发现,牡蛎鳃中NKA活性随Cd 暴露浓度升高而降低,与Na 含量变化趋势相反。 因此,推测Cd 可能通过抑制NKA 活性引起Na 含量升高。 此外,Cd 胁迫还导致线粒体酸中毒[30],机体为了应对酸中毒,会激活Na+/H+转运体和Na+/HCO3-共转运体,造成 Na+积累[31]。
PK 是糖酵解的限速酶,CS 和 IDH 是 TCA 循环的限速酶。 本研究发现,牡蛎鳃中 IDH 活性随Cd 暴露浓度的升高而升高,表明机体在氧化损伤修复和维持离子动态平衡过程中消耗了大量的能量。此外,随Cd 暴露浓度升高,牡蛎鳃中PK 和CS 活性分别呈U 型和倒U 型曲线,表现出毒物兴奋效应。毒物兴奋效应表现为毒物在低剂量水平下刺激、高剂量水平下抑制,是一种过度补偿或应激适应性响应[32]。 Cd 诱导的能量代谢过程的毒物兴奋效应在其他海洋贝类体内也有发现,如Cd 胁迫后菲律宾蛤仔(Ruditapes philippinarum)体内TCA 循环和糖酵解等关键代谢途径均表现出毒物兴奋效应[1]。
3.2 低盐对Cd 毒性效应的影响
本研究中,低盐并未显著改变牡蛎鳃对Cd 的富集,但显著提高消化腺中Cd 含量(数据未发表),推测可能与鳃和消化腺的功能差异有关。 牡蛎鳃参与呼吸和过滤,而消化腺在代谢、解毒过程中发挥重要作用[33]。 水体中的Cd 经由鳃摄入生物体后,主要储存在消化腺中,因此,在低盐度条件下Cd 的生物可利用性得到提高,从而提高了Cd 在消化腺中的生物积累水平。 Burke 等[34]也发现,低盐度条件下滨蟹(Carcinus maenas)体内起呼吸功能的前鳃中Cd 含量没有显著变化。 此外,鳃在离子内稳态过程中也发挥了重要的作用。 本研究发现,低盐显著降低了牡蛎鳃中 Na、Mg 和 K 含量。 Na+、Mg2+和 K+是海水中主要的阳离子,低盐度条件下牡蛎鳃中这3 种离子含量显著降低,其主要原因是低盐养殖海水中这3 种离子浓度显著降低,表明机体通过减少必需金属元素Na、Mg 和K 的吸收维持渗透压平衡。
本研究发现,低盐显著影响了Cd 诱导的氧化应激。 Wu 等[35]发现,低盐显著抑制菲律宾蛤仔(R.philippinarum)鳃中GPx 活性,对CAT 活性的抑制作用接近显著。 本研究中,低盐显著抑制了CAT 和GPx 活性,且造成MDA 含量显著升高,表明低盐诱导机体产生氧化应激和脂质过氧化反应。 在抗氧化系统中,CAT 和 GPx 催化 H2O2 为 H2O,降低了过量ROS 对细胞造成的伤害,但细胞内H2O2 在Fe2+存在下可通过芬顿(Fenton)反应转化为毒性更强的·OH[36]。 本研究未直接测定牡蛎鳃中Fe2+浓度,但有研究表明,低盐显著上调悉尼岩牡蛎(Saccostrea glomerata)体内Fe2+运输和转运相关基因表达[37],这与本研究中低盐显著提高牡蛎鳃中Fe 含量的现象相符。 因此,牡蛎在低盐度条件下提高Fe2+吸收可能增加抗氧化系统的负担。 尤其在Cd 和低盐复合胁迫时,低盐引起机体氧化还原平衡的改变可能进一步加剧Cd 诱发的氧化胁迫。
Cd 和低盐复合胁迫的牡蛎鳃中出现了离子平衡失调。 随Cd 暴露浓度升高,低盐度条件下K 含量表现为先升高、后基本保持不变,而NKA 活性无显著变化,表明Cd 和低盐复合胁迫条件下牡蛎鳃中K 含量变化可能与NKA 活性无关。 此外,Cd2+与K+通道中带负电荷的氨基酸残基结合,可以有效阻止 K+通过 K+通道[38-39]。 因此,推测 K 含量变化可能与非选择性阳离子通道(nonselective cation channels, NSCCs)有关。 NSCCs 是生物膜上能同时允许不同价态阳离子通过的多种通道蛋白的集合体,能够快速转运K+等细胞代谢必需元素。 研究表明,NSCCs 的激活作用受Cd2+浓度和盐度调控[38],结合本研究结果推测,低盐和高浓度Cd 胁迫增强了细胞质膜的NSCCs 活性。 本研究还发现,低盐度条件下最高浓度Cd 暴露组(240 μg·L-1)样品中 Zn含量显著降低。 有研究表明,低盐能够下调悉尼岩牡蛎(Saccostrea glomerata)Zn2+内流通路的基因表达[37],结合本研究结果可知,当Cd 暴露浓度达到一定程度,低盐可能通过干扰Zn2+吸收或外排等生物学通路的基因表达导致Zn 含量降低。
低盐胁迫增加了机体维持正常机能的成本,以满足渗透调节、氧化应激和损伤修复的能量需求,从而对机体的能量代谢产生负面影响[13]。 在本研究中,低盐显著抑制牡蛎鳃中PK 活性,显著提高了CS 活性,表明低盐干扰了牡蛎鳃的能量动态平衡。PK 和磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)会竞争底物磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP),PK 通过形成丙酮酸引导PEP 进行有氧氧化,而PEPCK 将PEP 转化为草酰乙酸,最终通过延胡索酸还原酶生成厌氧产物[40]。 因此,PK 活性降低有利于碳水化合物的厌氧代谢[41]。 Noor 等[41]也发现低盐胁迫诱导紫贻贝(Mytilus edulis)中PK 活性显著降低,表明机体可能采取无氧代谢来满足低盐胁迫导致的能量需求增加。然而,低盐诱导PEP 参与无氧代谢可能影响机体在Cd 胁迫过程中的有氧代谢能力。 本研究发现,Cd 胁迫后机体通过提高IDH 活性为解毒、氧化应激和损伤修复过程增加能量供给。 然而,相较于Cd 单一胁迫,Cd 和低盐复合胁迫诱导牡蛎鳃中IDH 活性降低,表明机体的有氧代谢受阻,推测低盐可能通过厌氧代谢途径干扰Cd 诱导的能量动态平衡紊乱。
综上所述,Cd 诱导了牡蛎鳃氧化应激、离子平衡失调和能量代谢紊乱;同时,牡蛎通过增加机体能量和蛋白质合成,以修复氧化损伤和维持离子动态平衡。 低盐未改变牡蛎鳃对Cd 的富集,但显著影响了部分必需金属元素的动态平衡;Cd 和低盐复合胁迫对能量代谢和脂质过氧化的影响存在显著交互作用。 IBR 分析结果显示,Cd 和低盐复合胁迫对牡蛎产生的压力高于Cd 单一胁迫,表明低盐加剧了Cd 对牡蛎的毒性效应。 因此,在Cd 污染严重的湿地、河口等低盐区域,应充分考虑低盐对Cd 毒性效应及生态风险的影响。
[1]Zhan J F, Wang S, Li F, et al. Dose-dependent responses of metabolism and tissue injuries in clam Ruditapes philippinarum after subchronic exposure to cadmium [J]. The Science of the Total Environment,2021,779:146479
[2]薛蓓, 张培, 李志辉, 等. 镉胁迫对脊尾白虾的毒性效应研究[J]. 生态毒理学报,2016,11(6):207-213
Xue B, Zhang P, Li Z H, et al. Toxicity effects of cadmium on the ridgetail white prawn Exopalaemon carinicauda[J]. Asian Journal of Ecotoxicology,2016,11(6):207-213(in Chinese)
[3]Gao X L, Zhou F X, Chen C T A. Pollution status of the Bohai Sea: An overview of the environmental quality assessment related trace metals [J]. Environment International,2014,62:12-30
[4]国家环境保护局. 海水水质标准: GB 3097—1997[S].北京: 环境科学出版社,2004
[5]Xie J, Zhao Y, Wang Q, et al. An integrative biomarker approach to assess the environmental stress in the north coast of Shandong Peninsula using native oysters, Crassostrea gigas [J]. Marine Pollution Bulletin, 2016, 112(1-2):318-326
[6]国家质量监督检验检疫总局. 海洋生物质量: GB 18421—2001[S]. 北京: 中国标准出版社,2004
[7]Thévenod F. Catch me if You can! Novel aspects of cadmium transport in mammalian cells [J]. BioMetals, 2010,23(5):857-875
[8]Choong G, Liu Y, Templeton D M. Interplay of calcium and cadmium in mediating cadmium toxicity [J]. Chemico-Biological Interactions,2014,211:54-65
[9]蔡荣, 郭赛男, 郑家浪. Cd2+暴露对斑马鱼肝脏和卵巢抗氧化和免疫系统的影响及蓝LED 光预暴露的保护作用[J]. 生态毒理学报,2018,13(1):169-178
Cai R, Guo S N, Zheng J L. Effect of cadmium exposure on antioxidant and immune responses and the ameliorative role of blue LEDs pre-exposure in the liver and ovary of zebrafish [J].Asian Journal of Ecotoxicology,2018,13(1):169-178 (in Chinese)
[10]乔艺飘, 张龙飞, 刘欢, 等. 青蟹对As 和Cd 的生物富集动力学特性[J]. 生态毒理学报,2020,15(6):290-299
Qiao Y P,Zhang L F,Liu H,et al.The kinetic characteristics of bioconcentration of As and Cd in Scylla paramamosain [J]. Asian Journal of Ecotoxicology, 2020, 15(6):290-299 (in Chinese)
[11]da Silva A O F, Martinez C B R. Acute effects of cadmium on osmoregulation of the freshwater teleost Prochilodus lineatus: Enzymes activity and plasma ions [J]. A-quatic Toxicology,2014,156:161-168
[12]Xu P, Zeng G M, Huang D L, et al. Metal bioaccumulation,oxidative stress and antioxidant defenses in Phanerochaete chrysosporium response to Cd exposure [J]. Ecological Engineering,2016,87:150-156
[13]Sokolova I M, Frederich M, Bagwe R, et al. Energy homeostasis as an integrative tool for assessing limits of environmental stress tolerance in aquatic invertebrates [J].Marine Environmental Research,2012,79:1-15
[14]Bao Y B, Liu X, Zhang W W, et al. Identification of a regulation network in response to cadmium toxicity using blood clam Tegillarca granosa as model [J].Scientific Reports,2016,6:35704
[15]Wu H F,Xu L L,Yu D L,et al.Differential metabolic responses in three life stages of mussels Mytilus galloprovincialis exposed to cadmium [J].Ecotoxicology,2017,26(1):74-80
[16]Ji C L, Lu Z, Xu L L, et al. Evaluation of mitochondrial toxicity of cadmium in clam Ruditapes philippinarum using iTRAQ-based proteomics [J]. Environmental Pollution,2019,251:802-810
[17]Blackmore G, Wang W X. Inter-population differences in Cd, Cr,Se,and Zn accumulation by the green mussel Perna viridis acclimated at different salinities [J]. Aquatic Toxicology,2003,62(3):205-218
[18]Sun M, Liu G B, Lin H, et al. Effect of salinity on the bioaccumulation and depuration of cadmium in the Pacific cupped oyster, Crassostrea gigas [J]. Environmental Toxicology and Pharmacology,2018,62:88-97
[19]迟潇, 陈碧鹃, 孙雪梅, 等. 基于IBR 模型研究BDE-47和BDE-153 对半滑舌鳎的毒性效应[J].生态毒理学报,2020,15(4):192-202
Chi X, Chen B J, Sun X M, et al. Toxic effects of BDE-47 and BDE-153 on Cynoglossus semilaevis Gunther based on IBR model [J]. Asian Journal of Ecotoxicology,2020,15(4):192-202 (in Chinese)
[20]杨占宁, 丁光辉, 于源志, 等. 单壁碳纳米管对太平洋牡蛎(Crassostrea gigas)的毒性效应及生物体防御机制研究[J]. 生态毒理学报,2019,14(1):90-98
Yang Z N, Ding G H, Yu Y Z, et al. Study on toxicity of single-walled carbon nanotubes(SWCNTs)to Pacific oyster (Crassostrea gigas) and the defense mechanism involved [J]. Asian Journal of Ecotoxicology, 2019, 14(1):90-98 (in Chinese)
[21]Fu J, Wang H, Billah S M, et al. Heavy metals in seawater, sediments, and biota from the coastal area of Yancheng City, China [J]. Environmental Toxicology and Chemistry,2014,33(8):1697-1704
[22]Beliaeff B, Burgeot T. Integrated biomarker response: A useful tool for ecological risk assessment [J]. Environmental Toxicology and Chemistry, 2002, 21(6): 1316-1322
[23]Luo L Z, Ke C H, Guo X Y, et al. Metal accumulation and differentially expressed proteins in gill of oyster(Crassostrea hongkongensis) exposed to long-term heavy metal-contaminated estuary [J]. Fish & Shellfish Immunology,2014,38(2):318-329
[24]Huang X Z, Liu Y M, Liu Z K, et al. Impact of zinc oxide nanoparticles and ocean acidification on antioxidant responses of Mytilus coruscus [J]. Chemosphere, 2018,196:182-195
[25]张钰昆, 巩宁, 车程, 等. 纳米氧化镍颗粒对长牡蛎(Crassostrea gigas)抗氧化防御体系的影响[J].生态毒理学报,2019,14(2):268-279
Zhang Y K, Gong N,Che C,et al.Effects of nickel oxide nanoparticles on antioxidant defense system of Crassostrea gigas [J]. Asian Journal of Ecotoxicology, 2019,14(2):268-279 (in Chinese)
[26]Cui W T, Cao L, Liu J H, et al.Effects of seawater acidification and cadmium on the antioxidant defense of flounder Paralichthys olivaceus larvae [J]. The Science of the Total Environment,2020,718:137234
[27]Qu R J, Wang X H, Wang Z Y, et al.Metal accumulation and antioxidant defenses in the freshwater fish Carassius auratus in response to single and combined exposure to cadmium and hydroxylated multi-walled carbon nanotubes [J]. Journal of Hazardous Materials, 2014, 275: 89-98
[28]李亚男, 张海滨. 海洋无脊椎动物抗氧化酶研究进展[J]. 海洋通报,2018,37(3):241-253
Li Y N, Zhang H B. Progress in antioxidant enzymes study of marine invertebrates [J].Marine Science Bulletin,2018,37(3):241-253 (in Chinese)
[29]Bulat Z P, Djukic'-C'osic' D, Malicˇevic' Ž, et al. Zinc or magnesium supplementation modulates Cd intoxication in blood, kidney, spleen, and bone of rabbits [J]. Biological Trace Element Research,2008,124(2):110-117
[30]Lu Z, Wang S, Ji C L, et al. iTRAQ-based proteomic analysis on the mitochondrial responses in gill tissues of juvenile olive flounder Paralichthys olivaceus exposed to cadmium [J].Environmental Pollution,2020,257:113591
[31]Wilson J M, Laurent P, Tufts B L, et al. NaCl uptake by the branchial epithelium in freshwater teleost fish: An immunological approach to ion-transport protein localization[J]. The Journal of Experimental Biology, 2000, 203(Pt 15):2279-2296
[32]Calabrese E J. Overcompensation stimulation: A mechanism for hormetic effects [J].Critical Reviews in Toxicology,2001,31(4-5):425-470
[33]吴林德, 林志华, 沈伟良, 等. Cd2+、Pb2+、Hg2+对泥蚶鳃及消化腺显微结构和超微结构的影响[J]. 海洋湖沼通报,2015(2):45-52
Wu L D, Lin Z H, Shen W L, et al. Effect of Cd2+, Pb2+,Hg2+ on the microstructure and ultrastructure of gill and hepatopancreas in Tegillaraca granosa [J]. Transactions of Oceanology and Limnology,2015(2):45-52 (in Chinese)
[34]Burke J,Handy R D,Roast S D.Effect of low salinity on cadmium accumulation and calcium homeostasis in the shore crab (Carcinus maenas) at fixed free Cd2+ concentrations [J]. Environmental Toxicology and Chemistry,2003,22(11):2761-2767
[35]Wu H F, Xu L L, Ji C L, et al. Proteomic and metabolomic responses in D—SHape larval mussels Mytilus galloprovincialis exposed to cadmium and arsenic [J]. Fish &Shellfish Immunology,2016,58:514-520
[36]Kültz D.Evolution of cellular stress response mechanisms[J]. Journal of Experimental Zoology Part A, Ecological and Integrative Physiology,2020,333(6):359-378
[37]Ertl N G,O’Connor W A,Elizur A.Molecular effects of a variable environment on Sydney rock oysters, Saccostrea glomerata: Thermal and low salinity stress,and their synergistic effect [J].Marine Genomics,2019,43:19-32
[38]Bouron A, Kiselyov K, Oberwinkler J. Permeation, regulation and control of expression of TRP channels by trace metal ions [J]. Pflügers Archiv: European Journal of Physiology,2015,467(6):1143-1164
[39]Zhou Y, Xia X M, Lingle C J. Cadmium-cysteine coordination in the BK inner pore region and its structural and functional implications [J].Proceedings of the National A-cademy of Sciences of the United States of America,2015,112(16):5237-5242
[40]Bayne B L. Metabolic Expenditure [M]. London: Academic Press,2017:331-415
[41]Noor M N, Wu F L, Sokolov E P, et al. Salinity-dependent effects of ZnO nanoparticles on bioenergetics and intermediate metabolite homeostasis in a euryhaline marine bivalve,Mytilus edulis [J].The Science of the Total Environment,2021,774:145195