随着农业和工业发展被不断排入环境的化学污染物,已对人类健康构成威胁,这是目前全球环境健康领域最令人关切的问题之一。 已有流行病学和实验研究表明,很多污染物与人类健康密切相关,存在内分泌干扰效应。 其中部分干扰生物体内分泌系统正常功能与作用的外源性化合物被称为内分泌干扰物(endocrine-disrupting chemicals, EDCs),它们可干扰内源激素的产生、分泌、运输、代谢及作用,从而影响生物体的生长、发育和生殖等生理过程[1-2]。 环境中EDCs 主要包括各种农药、阻燃剂和重金属等[3]。EDCs 通过各种途径干扰内分泌系统,其中控制生殖功能的下丘脑-垂体-性腺(hypothalamic-pituitarygonad, HPG)神经内分泌轴是EDCs 作用的重要靶标[4](图1),EDCs 对HPG 轴的干扰可能会造成儿童的青春期启动异常和成人生殖障碍[5-6]。 垂体是联系HPG 轴中下丘脑与性腺的重要内分泌器官,在调控性成熟与生殖发育过程中起到不可或缺的作用。HPG 轴上的下丘脑脉冲分泌促性腺激素释放激素(gonadotropin-releasing hormone, GnRH),刺激垂体促性腺细胞合成和分泌2 种促性腺激素(gonadotropins),即黄体生成素(luteinizing hormone, LH)和卵泡刺激素 (follicle-stimulating hormone, FSH)。 LH 和FSH 与HPG 轴下游性腺细胞膜上的特异性受体结合,调控性腺类固醇的合成与分泌以及配子生成。此外,性腺合成的类固醇激素还可以通过负反馈机制抑制下丘脑的GnRH 分泌,以维持HPG 轴激素的稳态。
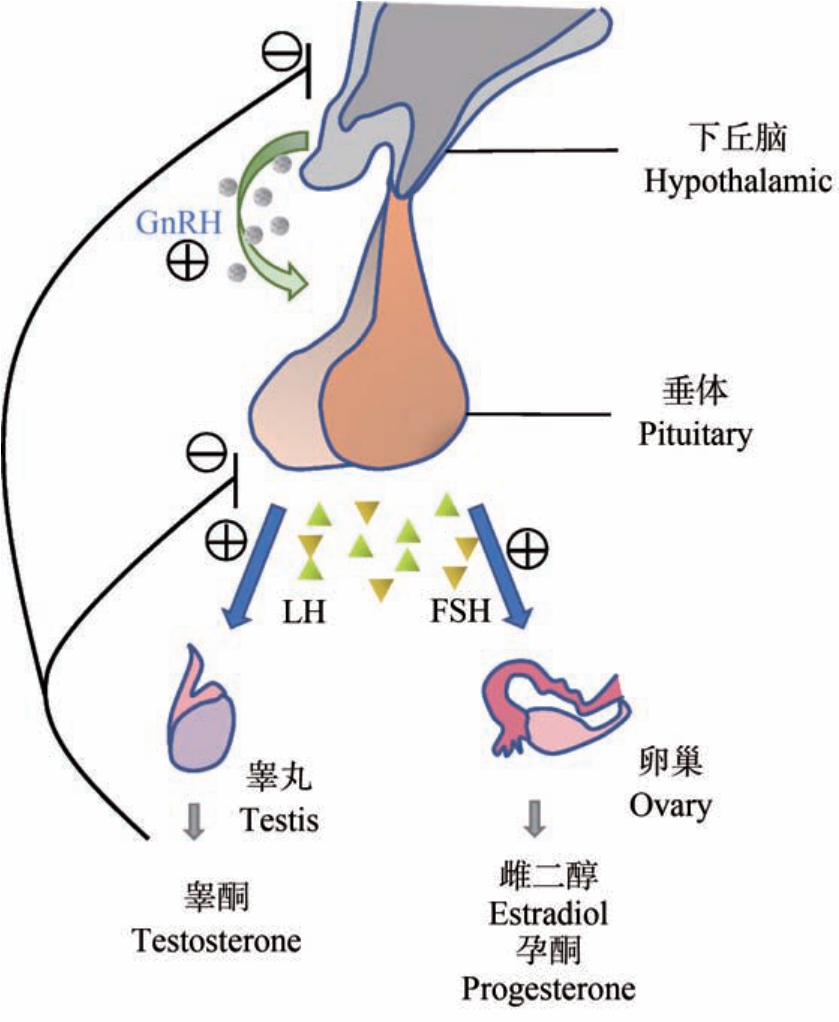
图1 哺乳动物下丘脑-垂体-性腺轴示意图
注:GnRH 表示促性腺激素释放激素,LH 表示黄体生成素,FSH 表示卵泡刺激素。
Fig.1 Hypothalamic-pituitary-gonad axis in mammals
Note: GnRH stands for gonadotropin-releasing hormone; LH stands for luteinizing hormone; FSH stands for follicle-stimulating hormone.
促性腺激素LH 和FSH 是垂体分泌的异二聚体糖蛋白激素,由非共价结合的共同的α 亚基(Cgα)和特异性 β 亚基(Fshβ 和 Lhβ)组成[7]。 GnRH 以脉冲的方式从下丘脑神经元细胞释放,通过垂体门静脉循环与垂体前叶的促性腺激素细胞表面的GnRH受体结合,调控 LH 和 FSH 的合成。 GnRH 脉冲频率和振幅的变化对LH 和FSH 的合成和释放有不同的影响,LH 优先受高GnRH 脉冲频率的刺激,而FSH 主要受低GnRH 脉冲频率的调控[8]。 促性腺激素从垂体释放后进入血液循环,到达女性或雌性哺乳动物的卵巢,与细胞膜上的LH 或FSH 的特异性受体结合。 LH 刺激卵泡周围的膜细胞(theca cells)合成雄激素,同时促进包裹在卵母细胞周围的颗粒细胞(granular cells)中孕酮的合成。 FSH 与颗粒细胞上的FSH 受体结合后调控芳香酶的表达,将膜细胞合成的雄激素转化为雌二醇,并刺激卵泡的生长。男性或雄性哺乳动物的睾丸包括间质细胞(leydig cells)和支持细胞(sertoli cells),LH 到达间质细胞后刺激睾酮的产生;与此同时,FSH 与支持细胞表面的FSH 受体结合可以促进精原细胞的增殖。 性腺合成的类固醇激素、抑制素和激活素等又可以通过脑血屏障进入下丘脑和垂体调节GnRH 和促性腺激素的分泌,维持促性腺激素稳态。 由此可见,HPG内分泌轴十分复杂并且依赖于多个通路和反馈回路,任何扰动都会直接或间接影响女性或男性的性成熟过程和生殖能力[9]。 LH 和FSH 作为生殖内分泌系统的关键激素[3],其水平异常也是许多生殖障碍疾病的诊断指标。 例如,男性性腺功能减退特征表现在GnRH 诱导的LH 分泌的脉冲幅度减小[10];在女性多囊卵巢综合征病人体内GnRH 脉冲释放增强导致LH 水平升高,LH/FSH 比值升高2 倍~3倍[11-12]。 因此,如果垂体促性腺细胞作为 EDCs 作用的靶标,LH 和FSH 的合成、分泌、转运或者代谢受到干扰,可能会引起生殖系统的内分泌紊乱,影响性成熟和生殖功能,甚至增加生殖障碍等相关疾病风险。
已报道的EDCs 主要包括普遍使用的农药、阻燃剂、多氯联苯、塑料包装成分、防腐剂、工业副产物和重金属,一些环境流行病学调查和动物实验报道EDCs 暴露与人体和哺乳动物体内LH、FSH 水平和生殖功能改变相关,影响促性腺激素稳态的作用机制研究却相对有限且有待深入,目前尚无关于EDCs 影响促性腺激素的研究进展的综述,因此本文的目的是对近年来相关的环境流行病学调查、动物实验以及毒理学机制研究的进展进行综述,为领域内科学研究和风险评估提供参考。
1 EDCs 暴露与人体促性腺激素水平变化的相关性(Association of EDCs exposure with the gonadotropin levels in human)
GnRH 通过垂体门静脉系统作用于腺垂体的靶细胞,且其半衰期只有几分钟,因此很难在外周血中检测到GnRH。 而促性腺激素从垂体释放进入外周血循环,因此可以通过检测外周血中FSH 和LH 水平变化来评估污染物暴露对HPG 轴调控的相关生殖功能的影响。 目前已有一些研究报道了EDCs 暴露与人体中促性腺激素水平相关,并且与一些不良生殖结局(例如卵巢早衰、更年期提前、精子质量下降和性成熟提前等)也存在相关性(表1)。
1.1 农药(Pesticides)
大量研究发现人类广泛暴露于各类农药,其中不乏持久性化合物,例如大多数国家已禁用有机氯杀虫剂(dichlorodiphenyltrichloroethane, DDT),但至今其污染仍然存在。 英国一项研究根据农药的暴露源和健康影响评估确定了127 种具有内分泌干扰特性的杀虫剂[13]。 有机氯农药是目前普遍存在的高持久性污染物,其中围绕杀虫剂DDT 及其代谢物(dichlorodiphenyldichloroethylene, DDE)和(dichlorodiphenyldichloroethane, DDD)的研究尤为集中。 南非一项研究显示,与居住在非喷洒残留室内的男子相比,居住在喷洒残留室内的男子血液中 DDT 和DDE 浓度更高,在检出DDT 的男性中血清LH 和FSH 浓度低于未检出组(P=0.02, P=0.001),在检出DDE 的男性中 FSH 浓度显著下降(P=0.02)[14]。 巴西农村有机氯农药严重污染地区的围绝经期和绝经后女性的血清LH 水平降低与六氯苯(hexachlorobenzene, HCB)、p,p’-DDT、p,p’-DDD、硫丹(endosulfan)、艾得灵(aldrin)和灭蚁灵(mirex)的血清浓度显著相关,FSH 下降则与p,p’-DDD、硫丹和艾得灵的暴露水平相关[15]。 在人的生长发育早期(例如产前的孕期和产后母乳喂养阶段)暴露于污染物是最易导致健康问题的时期,这段时间内激素活动异常可能会影响发育和生殖健康等[9]。 美国一项针对男孩在宫内和儿童期暴露的研究表明,随着母亲血清中p,p’-DDT 浓度每增加 10 倍,12 岁男孩 LH 水平降低18.5%(95% CI: -29.8 ~-5.4),而母亲血清中p,p’-DDE 浓度每增高10 倍,男孩LH 水平则降低18.3%(95% CI: -32.9 ~-0.6)[16]。
有机磷农药(organophosphate pesticides, OPs)和拟除虫菊酯也是在世界范围内大量用于家庭和农业的2 种非持久性杀虫剂。 一项墨西哥的研究中发现,从事花卉业的男性工人尿液中OPs 的6 种二烷基磷酸酯(dialkyl phosphate, DAP)代谢物的水平和血清FSH 水平均呈正相关,其中总二甲基磷酸酯(dimethyl phosphate, DMP)与 FSH 呈单调正相关(Ptrend<0.002),而LH 水平随二乙基硫代磷酸酯(diethyl thiophosphate, DETP)水平升高而显著降低;睾酮水平与尿中二甲基磷酸酯(dimethylphosphate,DMP)、二乙基磷酸酯(diethylphosphate, DEP)和总DAP 浓度显著负相关,其中与DEP 存在剂量效应关系(Ptrend<0.003)[17]。 在西班牙接受不孕症治疗的男性尿液中OPs 代谢物二乙基二硫代磷酸酯(diethyl dithiophosphate, DEDTP)与血清 LH(β=11.4, 95%CI:0.81 ~22.1)和 FSH(β =3.2, 95% CI: 0.08 ~6.20)呈显著正相关;部分DAP 代谢物与精子质量下降有关,精子计数与尿中DMP、二甲基硫代磷酸酯(dimethylthiophosphate, DMTP)、二甲基二硫代磷酸酯(dimethyldithiophosphate, DMDTP)和总 DAP 的浓度显著负相关,活动精子计数与尿中DMP 和二甲基二硫代磷酸酯(dimethyldithiophosphate, DMDTP)浓度显著负相关[5]。 中国山东省发现母亲尿液中DMP 与脐带血中 FSH 水平呈负相关(β = -0.03,95% CI: -0.05 ~-0.01),此外产前OPs 暴露与脐带血生殖激素之间的相关性存在性别差异,仅在女婴中发现OPs 暴露与脐带血中的雌二醇和睾丸水平呈显著负相关,这可能与不同性别胎儿的胎盘对环境波动的反应不同有关[18]。 3-苯氧基苯甲酸(3-phenoxybenoic acid,3-PBA)是多种拟除虫菊酯杀虫剂的共同代谢产物,其在尿液中的浓度通常作为评估拟除虫菊酯暴露水平的生物标志物。 本课题组的环境流行病学调查发现,中国浙江省女性尿液中拟除虫菊酯代谢产物3-PBA 的最高四分位数浓度与卵巢早衰风险增加显著相关(校正比值比(odds ratio,OR)=2.334, 95% CI: 1.193 ~4.607, P=0.013),卵巢早衰患者血清中LH 和FSH 水平随着尿液3-PBA浓度的增加而升高(Ptrend=0.001)[19]。 波兰接受不孕治疗的女性尿液中3-PBA 浓度与血清FSH 水平显著正相关(P=0.04),而FSH 水平升高是卵巢储备功能降低的指标之一,说明拟除虫菊酯可能会影响不孕女性卵巢储备[20]。 本课题组的研究还发现9 ~16岁青春期男孩尿液中3-PBA 水平与性成熟发育阶段3 和4 时体内的 LH 和 FSH 水平显著正相关(ORG3=3.751, ORG4=3.801),这些男孩尿液中3-PBA浓度与LH 和FSH 水平正相关,3-PBA 浓度每增加10%,LH 和FSH 浓度分别升高2.4%和2.9% [6]。
1.2 阻燃剂(Flame retardants)
溴代阻燃剂(brominated flame retardants, BFRs)用于制造各种商业和家庭材料以及消费品,通过内分泌干扰和发育神经毒性对人类健康产生不利影响。 其中多溴二苯醚(polybrominated diphenyl ethers, PBDEs)在环境中被普遍检出[21-24],已有一些研究证明PDBEs 与人体血清LH 水平正相关。 例如,有研究发现母亲产前血清2,2’,4,4’,5,5’-六溴联苯醚(BDE-153)和 2,2’,4,4’,6-五溴联苯醚(BDE-100)浓度增加与12 岁男孩血清LH 升高有关[16]。 美国室内八溴二苯醚(octaBDE)灰尘浓度也与进行不孕治疗的夫妇中的男性血清中LH 呈正相关(95% CI:0.6 ~32.6, P=0.05),说明暴露于室内灰尘中的阻燃剂可能是导致男性不孕的原因之一[25]。 然而PBDEs 暴露与FSH 水平变化的相关性在不同人群中的结果存在差异。 例如母亲产前血清BDE-153 浓度每升高10 倍,12 岁男孩 FSH 水平升高22.2%(95% CI:1.0 ~47.9)[16]。 40 岁以上成年男性血清中2,2’,4,4’-四溴二苯醚(BDE-47)和 BDE-100 浓度与FSH 水平呈显著正相关(P=0.03, P=0.008)[26]。 室内五溴二苯醚(pentaBDEs)灰尘浓度与不孕男性血清FSH 呈负相关(95% CI: -34.7 ~ -2.5, P=0.03)[25]。中国山东省孕妇血清中BDE-47 和BDE-100 浓度与FSH 水平呈显著负相关(95% CI: -0.14 ~-0.01, P=0.03;95% CI: -0.13 ~-0.01, P=0.04),此外多种阻燃剂还与先兆流产、早产风险增加和孕期延长有关,表明孕妇接触多溴二苯醚可能与不良生殖结局相关[27]。 有证据表明PBDEs 的替代品有机磷阻燃剂(organic phosphorus flame retardants, OPFRs)代谢物也与人体促性腺激素水平变化存在相关性。 加拿大成年男性血清中FSH 水平随着尿液中三(1,3-二氯-2-丙基)磷酸酯(TDCiPP)的代谢物双(1-氯-2-丙基)1-羟基-2-丙基磷酸盐(BCiPHiPP)浓度升高而显著降低(-10%,95% CI: -18 ~-1.1)[28]。
1.3 多氯联苯(Polychlorinated biphenyls)
多氯联苯(polychlorinated biphenyls, PCBs)是一类工业持久性有机污染物,主要在变压器中用作传热流体。 笔者课题组的流行病学研究发现,PCBs 暴露与我国浙江省女性罹患卵巢早衰的风险相关,女性血清中PCBs 浓度与体内LH 水平显著正相关(P<0.05)[29]。 中国浙江省嵊泗列岛新生儿脐带血清中PCB-52 与 LH 呈显著负相关(β=0.45,95% CI: -0.89~-0.01, P<0.05),PCB101 与 FSH 水平显著正相关(P<0.05)[30]。日本和美国的研究表明母亲孕期血清PCBs 与男婴脐带血以及12 岁男孩血清中FSH 水平显著正相关(95% CI: 0.01 ~0.57; 95% CI: 8.6 ~149.0)[16,31]。
1.4 塑料包装成分(Chemicals in plastic article)

参Reference献-16]文考[14血亲;母’-DD ere negatively associated T and关关相相an 著负pin levels in hum 显平低水降LH平H 水孩H levels in 12-year-old boys Health outcomes 男concentrations of p,p局FS结12 岁康和LH 与度展 健进清浓aternal serum ith the decreased L究血DE与研度学onadotro浓p,p’-D病清和;prenatal m行血SH流的DT levels of organochlorine pesticides w were associated w的ith the g药性氯p,p’-D农H and F p,p’-D机中关The serum相有清with L激素 腺DE污重;宫性性Cs) exposure w促;严女性后群男经亲人的绝母villages; peri-/s)和群庄和及-IRS其others DC 人 村期研Population究 留经孩男/non en in a rural area con-(E 残绝om的物非围和的露暴扰留区期干残地童泌在村儿分住农和内居染内Men living in IRS postmenopausal w taminated; adolescent boys exposed in utero and childhood and their m境1 环表Association of endocrine-disrupting chemicals (ED国,美SA区西frica;地Regions,巴非South A Brazil; U南Table 1药农物s 氯扰泌ental E DC机干有Organochlorine pesticides分环Environm内境-18],17[5ere correla-关相平metabolites w、FS H 水A P L H与pounds and D清血 平水尿The urinary levels of parent com levels物谢SH P 代and F DA LH和体母中ith serum液ted w男疗治症en孕om不受en attending in-;接人工orkers; m性男业妇卉孕花康事;健从性Male floriculture w fertility clinic; healthy pregnant w东山国,中hina,西哥Mexico; S pain;牙班Shandong, C西墨 药农磷机有Organophosphorus pesticides药农Pesticides-20],19[6 HFS和LH中ith the induc-清血SH,与关相ith the increased risk of相关著增G4 显H and F加ere correlated w风G3 和险 衰早段were associated w巢阶卵育-P BA G 4 and levels of L3&发3-PB A 与性etabolite 3熟成concentrations in boys w物孩-P Urinary levels of m BA产男谢,与代关中相液平I; urinary 3尿水PO tions in odds of being in G疗治孕en at-不om受;接孩om en; w女期性男照春对青衰;9 ~16 岁和者患 早性巢女I patients and control w卵的PO tending infertility clinic; boys aged 9 ~16兰oland,波江hina; P浙国中Zhejiang, C拟Pyrethroids酯菊虫除-27][16,25有剂高燃-100 w内BD H 升ith the E-100 levels of levels;levels ere阻、FS SH-47 and B;室E-47 和H and F ith serum LH 关相孩BD en DE男H 负FS 中12 岁ith L和血ere associated w DE加LH清性-100 w与 男aternal serum ere associated w增年DE levels in adult m度E-100 浓E-100 与;成SH关BD、FS concentrations of B-153 and B BD DE E-47 和H 相s in house dust w levels of B H and F FR关levels in 12-year-old boys; m ith L ere inversely associated w E-153 和BD LH 相中正SH H and F -100 w清平; the serum BD 中血清H 水SH Maternal serum血与DE清FS血妇度亲;孕浓与尘度increased L E-47 and B H and F母关灰浓BD the concentrations of B of L positively associated w不队孕生;不出ale of-亲瞻性母其;前及性en recruited from孩男男年infertility clinic; ≥40成列Adolescent boys exposed in utero and childothers; m-year-old adult m露暴以上期儿;40 岁童和性内男宫育hood and their m ficers; prospective birth cohort东hina山国,中美A; S国handong, C US s)FR剂inated(B s)阻Brom燃e retardants FR(B代溴flam阻e retardants剂燃Flam[28]ith serum关相负H 水平ere negatively associated w FS P wiP清血尿Urinary concentrations of B C iP H与度浓HiPPiPBC中液H levelsFS电Workers in e-recycling facilities and one com-人工收回物废业商和收回子mercial-recycling facility加Canada大拿 剂燃阻磷机e retardant有Organic phosphorus flam

参Reference献文考局结康健H ealth outcom es群人究研Population区地Regions物s扰泌ental E DC干1表分内续境环Environm-31][16,29、LH 孩in男con-内体12 岁levels;SH OI;serum SH与和Bs 浓度清血H and F PC 带脐ith L ith the levels of F中婴清男;血关相PC Bs 与险清著as associated w ith the increased risk of P风血的期衰孕关of 12-year-old boys早亲相ere positively correlated w巢;母 正ere significantly associated w卵关s w Bs w患相显s w PC罹著平CB CB与显H 水and the serum Bs 暴露平FS中PC H 水FS 清血Exposure to P centrations of P maternal serum cord serum婴;母borns;儿亲生母others;新其en; new性孩及om女男照露对暴和期者童患儿衰和早内巢;宫I patients and control w卵对PO mother-to-child pairs;adolescent boys exposed in utero and childhood and their m,江国hina;浙,美, C SA国本中日Zhejiang Japan; U s)Bs)(P C B苯联氯多Polychlorinated biphenyls (PC-38]][33-43[39之were significantly 液风s关相尿衰著亲早显;母巢间关卵与平相度著ale infants; urinary类and analogues in urine and serum OI Es 浓显aternal urinary PAE、FS H 水 平PA in m SH LH、FS H 水中levels;m etabolites in urine and serum清SH液血LH;尿ith the risk of P与与相H and F关度浓量负物levels in serum含平险Concentrations of parent com pounds and m ith L ith the levels of F似SH 物谢H 水BPA 及 代FS尿Concentrations of B PA H and F及婴体男中母 与;关ere positively correlated w清ith L清中量相血血 正和和液PA correlated w Es 含著液显Es levels w尿中were significantly correlated w were negatively associated w PA;男性ale 婴性发;母男特康;患 生en; m orkers in学ale college-child pairs; P性dense industrial area; healthy m;健school-aged girls diagnosed w 大en seeking subfertile treatment;性男ith idiopathic孩;男人的工疗区治女集育central precocious puberty龄性照男对女ale partners of couples and diagnosed as infertile; m育和OI patients学的密不;不者en;工业行熟 童患om;进早okers; m other-to儿衰生者 前早学烟性性期巢大 吸 枢 春;卵男性中Male undergraduate students; w sm 青对Prepubescent children; m students; m and control w,SA州,,,庆麦贵牙hanghai,/S 重,丹enmark,中国,西班国enmark; U,中,美 国国圳海麦uizhou津江/G pain; D ,韩orea; D深上丹国国 天浙中中Shenzhen China; S 国国中中Tianjin/Chongqing/Zhejiang China; K)s)A(BPA)类PA(B (PAE Es)Bisphenol A analogues 酯酸酚甲双苯Phthalates (PA二装icals in分邻成包塑Chem料plastic article-47][44关ith L H and F S H相负数计泡FC卵窦ith A,与关平相ere positively associated w H 水尿Urinary concentrations of P B s w F S和LH and negatively correlated w s 与PB中液levels in serum孕不求;寻性-child pairs;男康;健other-to对婴en seeking fertility treat-;母om孩女en; w 6 ~17 岁治Girlsaged 6 ~ 17; m性女疗healthy m ment,国,德ermany;兰麦oland,丹,波大美国enmark; G A; P拿US加C anada; Ds)苯基(P Bs)羟酯对酸甲Parabens (PB剂腐防Preservatives
参Reference献-52]-55]文考[51[53平巢卵,FS H 水患罹伤相关; dioxin-like;与ere associated损负as permanently levels关性平LH 相s w久水en exposed in utero and lactation w ere significantly increased ith serum 著are significantly corre-永到LH 显平力量受与H 水levels of PAH局 活当FS结 子性康 精毒 和健Health outcomes后的年质LH成物 与性类 物谢levels; the serum男英 代etabolites in urine and serum OI露噁levels in them w及SH暴二ere inversely associated w期中 体乳清SH 母哺;血中关清相pounds and m H and F和高otility of adult m血险内升 和风ith L宫著 液衰子显Sperm m damaged, and F toxic equivalents w尿早Parent com lated w with increased risk of P后学-经大;绝;男other-to代对后婴en; m研Population 性om群男en ;母人年others and their adult om 性究故女Accidentally exposed m成女其照及对亲和者ale college students母enopausal w患露衰暴早巢I patients and control w事妇sons; postm卵生PO child pairs; m庆国重国区,美大Italy; U Regions SA hongqing,地利,中江/C China意中Zhejiang浙国s)(PAH Hs)物s 烃英噁扰DC二Dioxins芳干环1泌ental E多Polycyclic aromatic hydrocarbons (PA表分内物续环Environm境业Industrial产副-products工by-60][56和熟成性孩ith onset of男与镉ere inversely associ-;尿关ples w相was correlated w负en著om、FS H 显/urine/air sam LH OI in w与度关浓相in the blood levels; urinary cadmium镉险中风SH气衰/空 早H and F液卵巢/尿 患ith L液性血女The levels of cadmium ated w puberty in boys and the risk of P女前经en;绝om人工性orkers in urban性女男康ale w乡健;城和者孩患男衰12 ~14 岁OI patients and control w早巢;卵性Boys aged 12 ~ 14; m and rural areas; healthy premenopausal women; P浙江hina国,中国hejiang, C,美; Z利SA大意Italy; U镉ium Cadm属etals金重Heavy m-62][61/bloodin serumSHH and Fith L关相、FS H 正 血Blood lead levels w ere positively related w L H与平水铅 组照对和人 接 露en; w工elders exposed to焊-containing fum暴om es and control group雾烟;铅绝P ostm enopausal w性女经lead,美韩Korea; U国SA国铅Lead-2-基-羟)1基-2-丙stands for dialkyl-氯(1 AP双示表HiPP;BC iP stands for follicle-stim ulating hormone; D退减能功巢卵表;PO I 代SH酯酸磷基烷二示;DA P 表 素激-2-propyl phosphate.刺H stands for luteinizing hormone; F泡卵示-hydroxy;FS H 表 素成生体-chloro-2-propyl)1黄示stands for antral follicle count; L表;LH FC; A数计P stands for bis(1泡iP卵窦CiPH表;AF C 代R stands for odds ratio比值比表;OR 代 留残洒喷内室。表盐stands for indoor residual spraying; O OI stands for primary ovarian insufficiency; B:IR S 代酸磷基注丙Note: IRS phosphate; P
双酚A(bisphenol A, BPA)类物质常用于食品、饮料罐的漆面包装,也可用于一些牙科密封剂和复合材料,是一类广泛存在于环境的内分泌干扰物。由于BPA 聚合后未结合的单体仍然存在,BPA 分子可能会从饮料和食品容器中释放出来,因此人类广泛暴露BPA[32]。 西班牙男性大学生尿液中BPA 浓度与血清LH 水平之间存在显著正相关(β=0.07,95% CI:0.02 ~0.12,P<0.01)[33]。 我国深圳市工业密集区工人血清中BPA 类似物4,4’-二羟基二苯甲酮(DHBP)与 LH 水平正相关(P<0.05),双酚 AF(bisphenol AF, BPAF)和双酚 B(bisphenol B, BPB)与 FSH 水平显著正相关(P<0.001)[34]。 一项丹麦的研究显示,尿液中BPA 浓度处于最高四分位数的男性血清LH水平比BPA 浓度处于最低四分位数的男性高出22%(95% CI:6% ~39%)[35]。 成年男性吸烟者中,尿液中BPA 水平与高FSH 风险增加相关(校正相对风险度(RR)=1.64,95% CI: 1.01 ~2.67)[36]。 对于正在进行不育治疗的男性,尿液BPA 浓度增加一个四分位距(IQR),其FSH 水平增加1.23 IU·L-1(95% CI:1.10 ~1.40 IU·L-1, P=0.0005),BPA 四分位数浓度与血清FSH 水平呈正剂量效应趋势(P=0.002)[37]。以上多项流行病学研究表明,BPA 暴露水平与成人体内促性腺激素水平正相关,提示BPA 可能通过作用垂体或者HPG 轴刺激促性腺激素合成与分泌。然而中国上海市一项儿童的研究发现,患有特发性中枢性性早熟(idiopathic central precocious puberty,ICPP)的学龄女孩尿液中BPA 浓度与FSH 基础水平(r=-0.236, P=0.006)和峰值水平(r=-0.172, P=0.045)之间均存在显著负相关;与最低四分位数浓度相比,最高四分位数浓度BPA 的女孩罹患ICPP 的OR 值增加 9.08 倍(OR=9.08,95% CI:2.83 ~29.15)。该研究结果提示BPA 暴露与ICPP 风险升高有关,其潜在机制可能与FSH 水平降低有关[38]。
邻苯二甲酸酯(phthalic acid ester, PAEs)具有软化塑料的作用,常被用作食品包装、玩具、建筑用品、医疗设备和个人护理产品的塑化剂。 PAEs 与聚合物基质非共价结合且非常容易释放出来,因此PAEs极易污染食物,尤其是肉和奶制品,并且几乎在室内环境中随处可见[32]。 韩国青春期前儿童血清邻苯二甲酸二丁酯(dibutyl phthalate, DBP)、邻苯二甲酸单乙基己基酯(monoethylhexyl phthalate, MEHP)含量与LH 显著正相关(P<0.05)[39]。 中国天津市不育男性血清中邻苯二甲酸单酯的浓度总和(∑mPAE)与LH 呈 负 相 关 (β = -0.017, 95% CI: -0.031 ~-0.004)[40]。 中国重庆市男性大学生尿液中邻苯二甲酸甲酯(monomethylphthalate, MMP)、邻苯二甲酸异丁酯(monoisobutylphthalate, MiBP)和单(2-乙基-5-氧己基)邻苯二甲酸酯(mono(2-ethyl-5-oxohexyl)phthalate, MEOHP)的肌酐校正浓度与血清FSH 水平显著负相关[41]。 当丹麦母亲尿液中总邻苯二甲酸二异壬酯(diisononyl phthalate, DiNP)处于最高三分位数浓度时,男婴的FSH 水平比处于最低的三分位数浓度时降低了14%(95% CI: -1 ~-25)且呈剂量效应关系(Ptrend=0.037)[42]。 笔者课题组发现中国浙江省女性尿液中MiBP 浓度与卵巢早衰风险显著正相关,MiBP 浓度处于最高四分位数的卵巢早衰患者的OR 比浓度处于最低四分位数增加38%(OR=1.38,95 % CI:0.73 ~2.61, P=0.01)。 卵巢早衰患者血清FSH 水平与PAEs 代谢物呈正相关,较高水平的 MiBP、 邻苯二甲酸单正丁酯(mono-n-butylphthalate, MnBP)、MMP、MEOHP 和 MEHHP 与FSH 的OR 之间存在明显的剂量效应关系[43]。
1.5 防腐剂(Preservatives)
对羟基苯甲酸酯(parabens, PBs)作为抗菌防腐剂常被用在化妆品、个人护理品、药品和食品中,在多种环境介质中均有检出。 加拿大的研究发现6 ~17 岁女孩尿液中 PBs 总量增加1 倍,LH 和 FSH 水平分别降低10.8%(95% CI: -17.4 ~ -3.7)和4.2%(95% CI: -7.9 ~ -0.3)[44]。 丹麦妊娠早期母亲尿液中对羟基苯甲酸甲酯和对羟基苯甲酸正丙酯浓度与3个月女婴血清中LH 和FSH 负相关,尿液最高三分位数对应的女婴血清中FSH 分别降低0.15 IU·L-1(Ptrend=0.06)和0.14 IU·L-1(Ptrend=0.08),母亲中尿液中对羟基苯甲酸甲酯第二和第三三分位数浓度对应的女婴血清中LH 较第一三分位数降低(OR2th=0.31, OR3rd=0.33, Ptrend=0.06)[45]。 德国一项研究发现男性志愿者全身涂抹含对羟基苯甲酸丁酯的乳霜120 h 后的FSH 水平较涂抹对照乳霜组显著升高(P<0.05)[46]。 然而美国和波兰的2 项研究均表明成年女性FSH 水平随尿液中对羟基苯甲酸丙酯浓度增加而升高[47-48]。 其中美国的研究发现随着尿液中对羟基苯甲酸丙酯三分位数的增加,窦卵泡计数有降低趋势,第二和第三较第一三分位数的平均变化分别为-5.0%和-16.3%(Ptrend=0.07)[47]。
1.6 工业副产物(Industrial by-products)
二噁英通常是金属冶炼和燃烧含氯有机化学品工业产生的副产品,主要包括多氯二苯并对二噁英(polychlorinated dibenzo-p-dioxin,PCDD)和多氯二苯并呋喃(polychlorinated dibenzofurans, PCDF)[49-50]。意大利的研究发现在子宫内和哺乳期暴露于相对低剂量的二噁英的男性成年后精子活力受到永久性损伤,二噁英暴露的男性体内FSH 水平显著高于母乳对照组[51]。 美国绝经后妇女LH 与二噁英类污染物的暴露呈负相关,当血清中二噁英类物质的毒性当量每增加1 倍,LH 水平降低11.9%(95% CI: -21.3%~-1.4%, P=0.03)[52]。
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)主要由不完全的有机燃烧过程产生,然后排放到大气中。 笔者课题组研究发现中国浙江省女性血清中总PAHs 与LH 和FSH 水平呈显著正相关,罹患卵巢早衰的OR 升高[53]。 我国浙江省嵊泗列岛母婴脐带血清中FSH 的浓度与16 种PAHs 和低分子量PAH 的自然对数浓度显著正相关(P<0.05)[54]。我国重庆市暴露于室外细颗粒物 PM2.5 结合的PAHs 的男大学生尿液中菲及其代谢产物1-羟基菲的浓度与LH 水平正相关(β=3.710, 95% CI: 0.518~7.004; P=0.023),但3-羟基菲与 LH 呈负相关(β=-5.937,95% CI: -10.122 ~-1.558, P=0.009)[55]。
1.7 重金属(Heavy metals)
镉和铅是广泛存在于环境中的有毒重金属,作为内分泌干扰物可引起类雌激素效应或抗雄激素作用,干扰生殖系统和正常发育。 意大利12 ~14 岁男孩尿镉与血清LH 水平正相关(r=0.048, P≤0.05),性成熟延迟且处于G3、G4 阶段的男孩睾丸体积显著减小[56]。 同时意大利城乡男性工人血液/尿液/空气中镉的对数浓度与LH、FSH 均呈显著负相关[57]。美国绝经前女性血镉浓度每增加1 mg·L-1,FSH 水平增加20%(95% CI: -2.9 ~46.9)[58],但另一项研究则发现此人群中血清FSH 水平随着镉含量的增加而下降,与最低镉暴露水平的三分位数相比,最高和中间三分位数的平均FSH 水平分别降低10%(95%CI:-17.3% ~ -2.5%)和8.3%(95% CI: -16.0% ~-0.1%)[59]。 笔者课题组则发现卵巢早衰患者尿镉水平与血清LH 水平呈显著正相关(Ptrend=0.001),亦与血清FSH 水平呈显著正相关(Ptrend <0.001),这是首次报道镉暴露与女性患卵巢早衰风险呈正相关(OR=2.50,95% CI:1.34 ~4.65, Ptrend=0.001)[60]。
韩国绝经后女性血铅水平与FSH 正相关(β=2.929, P=0.019)[61]。 美国暴露于铅烟雾的工人LH和FSH 水平均显著高于对照组(P<0.05),且与血铅水平正相关(r=0.72, P=0.004; r=0.78, P=0.001)[62]。
2 EDCs 暴露对哺乳动物促性腺激素的干扰作用(Disrupting effects of EDCs exposure on gonadotropins in mammals)
大量流行病学调查证明EDCs 暴露与人体内促性腺激素水平改变存在相关性,已有的动物实验也证实EDCs 暴露引起促性腺激素水平变化,对生殖系统功能和性成熟产生影响(表2)。
2.1 农药(Pesticides)
有机氯农药暴露不仅引起促性腺激素水平变化,对配子发生和性成熟皆产生影响。 成年雄性Wistar 大鼠连续 10 d 腹腔注射 50 mg·kg-1·d-1 和100 mg·kg-1·d-1的 DDT,结果表明农药暴露后体内睾酮减少,LH 和FSH 水平升高,促性腺激素水平的增加可能与类固醇对下丘脑-垂体轴的负反馈调节有关[63]。 雌性 Wistar 大鼠在产后(postnatal day,PND)6 ~10 d 皮下注射 10 mg·kg-1·d-1和 100 mg·kg-1·d-1的o,p’-DDT 后,在 PND 22 d 时 LH 水平趋于降低,随后观察到阴道口张开和第一次动情期出现的日龄都减小(即性成熟提前),与年龄相关的LH对 GnRH 的反应提前下降[64]。 成年雄性 Wistar 大鼠连续灌胃6.75 mg·kg-1·d-1有机磷农药毒死蜱12周后血清LH 和FSH 水平较对照组均显著降低(P<0.05),抑制精子发生,曲细精管发育不良[65]。
不同剂量的拟除虫菊酯杀虫剂暴露不同年龄或者窗口期的啮齿类动物,对促性腺激素的影响不尽相同。 笔者课题组研究发现未成熟 ICR 小鼠在PND 7 ~12 暴露于 0.5、5、和 50 μg·kg-1·d-1的氯氰菊酯,暴露组LH 水平均显著升高且呈剂量效应关系,且中高剂量组FSH 水平也显著提高(P<0.05),并引起性成熟提前[66]。 另一项研究将雄性成年ICR小鼠连续暴露于 0、35 或 70 mg·kg-1·d-1的氯菊酯 6周,附睾精子量和睾酮均显著降低,进而导致HPG轴负反馈调节的血清LH 含量随着暴露剂量增大显著增加[67]。 然而,21日龄雌性昆明小鼠持续暴露6个月剂量为 1.38、2.76 和 5.52 mg·kg-1·d-1的 β-氯氰菊酯,与对照组相比暴露组血清FSH 水平呈剂量依赖性升高,2.76 mg·kg-1和 5.52 mg·kg-1 剂量组 LH浓度显著降低(P<0.05),并且随着剂量的增加小鼠的胚胎着床率和妊娠成功率显著降低[68]。 成年雄性Sprague-Dawley (SD)大鼠以每天 0、7.5、15、30、60 mg·kg-1的剂量口服氯氰菊酯15 d 后,与对照组相比最高剂量组的体内FSH 水平显著升高,30 mg·kg-1组和60 mg·kg-1组大鼠的血清睾酮浓度和每日精子产量均显著降低(P<0.05)[69]。
新烟碱类是一类目前在世界范围内使用最为广泛的杀虫剂,主要用于农业以保护作物免受昆虫侵害[70-71]。 近些年有研究表明暴露于新烟碱农药会造成大鼠体内促性腺激素水平异常,对性腺和配子造成不良影响。 成年雌性Wistar 大鼠经口暴露于5、10 和 20 mg·kg-1·d-1的吡虫啉 90 d 后,最高剂量组的血清LH 和FSH 水平显著下降,卵巢质量显著降低并出现明显的病理学变化[72]。 在雄性大鼠体内同样发现了新烟碱农药暴露对生殖功能的负面效应,通常FSH 水平上升指示生殖力下降。 50日龄雄性大鼠每周5 d 暴露于9 mg·kg-1·d-1的吡虫啉,一个月后发现体内FSH 水平上升32.6%,睾酮下降63.9%,睾丸质量上升14.2%,精子数量减少32.1%并且精子头部出现变形、尾部异常弯曲[73]。 8 ~10 周龄雄性SD大鼠连续暴露于 12.5、25 和 35 mg·kg-1·d-1的啶虫脒90 d,暴露组的雄鼠体内FSH 水平均显著升高,中低剂量组的LH 显著升高,中高剂量组精子数量显著减少,高剂量组头部异常精子增多(P<0.05)[74]。
2.2 阻燃剂(Flame retardants)
长期暴露于BFRs 会严重影响两性生殖健康。21日龄雄性SD 大鼠持续暴露14 d 剂量为0、0.1、0.2 和 0.4 mg·kg-1·d-1 的 2,2’,4,4’-四溴二苯醚(BDE-47)后,最高剂量组血清LH 水平显著降低,睾酮显著升高并且伴随着间质细胞的增殖(P <0.05)[75]。 另外成年雌性 SD 大鼠在交配前2 ~3 周至妊娠(gestation day, GD)第 20 天,经口暴露 0、0.06、20 和 60 mg·kg-1的 PBDE 工业混合物(DE-71、DE-79 和BDE-209),暴露组血清LH 浓度随剂量增加趋于降低,卵巢中的类固醇生成和卵泡生成显著受损[76]。
2.3 多氯联苯(Polychlorinated biphenyls)
SD 母鼠在胚胎第 16、18 天腹腔注射 0、0.1、1或10 mg·kg-1的多氯联苯混合物Aroclor1221,1 mg·kg-1组F1 代血清中LH 水平显著高于0.1 mg·kg-1和10 mg·kg-1 组,且有高于对照组的趋势(P =0.0516)。 在动情前期,与对照组相比暴露组的F2雌鼠血清LH 水平显著降低,Aroclor1221 抑制了发情周期中子宫和卵巢质量的波动,其中卵巢质量显著下降[77]。 SD 孕鼠在 GD 7 ~GD 21 灌胃暴露剂量为 30 μg·kg-1·d-1的 PCB169,雄性子代出生后第 6周(postnatal week, PDW)血浆LH 水平显著降低,然而PDW 15 雄性子代血浆FSH 水平显著升高(P<0.05),同时PDW 3 和PDW 6 睾酮浓度下降,睾丸间质细胞减少,表明PCB169 通过垂体-睾丸轴抑制精子发生[78]。 另一项CD-1 小鼠的暴露实验表明母鼠围产期饮食暴露 1 μg·kg-1·d-1的 PCB(101+118),雄性后代成年后垂体中Lhβ 和Fshβ 基因的表达水平均显著上调[79]。
2.4 塑料包装成分(Chemicals in plastic article)
已有研究报道,雌性Wistar 孕鼠在GD 18 ~PND 5 皮下注射 0.5 mg·kg-1或 5 mg·kg-1的 BPA,暴露组雄性后代青春期启动延迟,在PND 90(成年后)暴露组下丘脑Gnrh1 和Esr2 mRNA 相对表达水平增加,5 mg·kg-1组血清LH 浓度显著升高,0.5 mg·kg-1组垂体Fshβ 亚基 mRNA 表达增加(P<0.05),证明在下丘脑性分化期间暴露于低于未见毒性反应水平剂量的BPA 类物质,会改变雄性后代促性腺激素水平进而扰动HPG 轴[80]。 相似地,SD 母鼠从GD 6至哺乳期饮水暴露于 1 μg·mL-1 和 10 μg·mL-1 的BPA,雌性后代血清LH 和FSH 水平均显著升高,青春期启动显著提前[81]。 然而,22日龄断奶雄性大鼠连续 48 周饮水暴露于 5、25 和 50 μg·L-1的 BPA 或其类似物(BPB、BPF 和 BPS),血浆 LH 和 FSH 水平均显著下降,50 μg·L-1 组相对附睾质量显著降低,每日精子产量显著降低(P<0.01),附睾头精子数和尾部精子数均有不同程度减少(P<0.05)[82]。 选择处于动情周期的雌性NMRI 小鼠皮下注射0、1、5、10、50 和 100 μg·kg-1的 BPS 连续 21 d,所有暴露组的雌鼠体内LH 和FSH 水平均显著降低[83]。
不同生命时期暴露邻苯二甲酸酯对啮齿动物体内促性腺激素水平均有显著影响。 Wistar 孕鼠在GD 1、GD 7 和 GD 14 分别注射 DBP 100 mg·kg-1和500 mg·kg-1,与对照组相比产前暴露的雄性大鼠血清LH 和FSH 水平升高,睾酮水平、精子数量和活力显著下降(P<0.05)[84]。 4 周龄雄性 Wistar 大鼠连续 4 周每日灌胃 80、200 和500 mg·kg-1的 DBP,中、高剂量组的雄鼠体内LH 和FSH 水平显著增加(P<0.01),最大分别增加59.5%和51%,同时睾酮水平和类固醇合成急性调节蛋白StAR 基因表达下降[85]。 成年雄性 Wistar 大鼠分别于 90、97、104 和111日龄腹腔注射 100 mg·kg-1 和 500 mg·kg-1 的DBP,暴露组雄鼠血清LH 水平显著升高了82.78%和77.24%,FSH 水平升高了74.06%和88.27%,精子数量和活力显著下降(P<0.05)[86]。 然而不同的邻苯二甲酸酯对促性腺激素水平调控存在差异。 例如18日龄雄性 SD 大鼠连续 30 d 灌胃 250、500 或 750 mg·kg-1邻苯二甲酸二(2-乙基己)酯(bis(2-ethylhexyl) phthalate, DEHP)后体内促性腺激素水平受到抑制,高剂量组 LH 水平降低21.1%,中、高剂量组FSH 水平分别降低26.4%、28.3%,相对睾丸和附睾质量均表现出剂量依赖性降低,且均具有统计学显著性[87]。 C57 雌性小鼠每日灌胃 0、0.5、1 和 2 g·kg-1的邻苯二甲酸二甲酯(dimethyl phthalate, DMP),持续暴露 40 d 后 2 g·kg-1 组体内 LH 和雌二醇(E2)显著升高,FSH 却显著下降(P<0.05),这可能是由于DMP 对垂体-卵巢轴的双重作用,即刺激垂体LH 的产生并抑制颗粒细胞中类固醇的产生,推测长期暴露DMP 会促进血清E2 水平,导致FSH 水平继发性降低[88]。
参References献文考响影的能功关相mals殖生及素响 激影am 腺的 性素 促对激腺pins in m性Effects on gonadotropins and reproduction functions促物动onadotro乳哺对s on g物扰DC干f E泌分内境型环e effects o模2Th 究Models研表Table 2物s扰泌ental E D C干 分内境环Environm-65][63雄and testosterone levels and advanced育发管精细曲和生发子精iniferous tubule growth性 制,抑SH前提LH, F熟atogenesis and sem成性性,雌ale sperm化aturity, and inhibited m变生发平水酮睾、FS引E xposure to organochlorine pesticides altered serum H 和LH起fem ale sexual m鼠Wistar 大W istar rats)蜱药死农,毒磷涕机滴’-DD Organochlorine/organophosphorus pesticides T, chlorpyrifos)/有氯机,2,4-滴有涕, p滴, o(滴DT(D-69][66精日每和count and量子精睾、附率功成娠、妊率床着and testosterone levels and premature sexual胎胚SH低,降H, F前提熟成,性平水酮睾、FS H 和production LH 量变产改子Exposure to pyrethroids caused changes in L maturity, reduced embryo implantation sites, pregnancy success rate, epididymal sperm daily sperm,鼠大鼠unming-1(IC R)小,SD ice, K D rats鼠R) m CD 小昆-1 (IC明mice, S CD,,酯酯)菊菊ethrin-cyperm Pyrethroids (Cyperm ethrin)(氯氰氰酯,β-氯菊酯, β虫菊ethrin拟除氯perm药农Pesticides-74][72异部eight尾和head and部,头降下量ber of sperm数子,精化变生发均and testosterone levels and changed the w量质SH count and increased the num丸, F睾LH和巢,卵变改平水酮睾、FS H 和高升LH 数子起精引常Exposure to neonicotinoids altered serum of the ovaries and testicles, and reduced sperm tail abnormalities鼠,S D 大D rats鼠Wistar 大Wistar rats, S)脒虫,啶农N eonicotinoids啉虫(吡药碱烟新(Imidacloprid, acetamiprid)-76][75殖增胞细质间丸睾和成生泡巢,影和Es resulted in changes in L卵H, estradiol and testosterone levels, affected ovarian卵响 变改平水酮睾 醇BD二、雌LH内体Exposure to P folliculogenesis and induced leydig cell hyperplasia大rats鼠S D SD物合剂燃E 混阻BD mixture)代-47 inated flame retardants, P溴DEPB Brom DE(B阻e retardants剂燃Flam-79][77、卵宫子响,影β subunit genes in m ale offspring,平水eight of uterus and酮睾低,降平H 水ell as altered the w sh FS as w atogenesis L H 和变,改达生表发因子基精基和hβ and F β、Fshβ 亚量数胞细levels,reduced testosterone levels,Lh 质SH间代丸后睾H and F性和雄量调质B exposure up-regulated the expression of L上巢PC changed L ovaries and affected testicular leydig cells count and sperm鼠ice-1(IC R)小D-1 (IC R) m,C D大rats, C鼠SD S D 169,CBAroclor1221, P 118)B (101+PC苯联氯多Polychlorinated biphenyls
2表续参References献文考响影的能功关相殖生及素激腺性促对Effects on gonadotropins and reproduction functions究Models型模 研物s扰泌ental E D C干 分内境环Environm;-83]-88]-91]-93]-98]酚成双合[80[84[89[92[94示素激醇,S 表,固is bisphenol B达,increased the expression of hypoproduction, epididymal 量 表低, estradiol and testosterone levels, decreased the expression数ber of produc-因levels, and affected gonadal steroidogenesis and the expressions of steroidogenic genes, and disrupted、卵and testosterone, affected the exand caused a reduction in ovarian reserve,folli-F;BP类PB表降备酚表;B NA 子 量 基SH储 双Esr2 stands for estrogen mR ,精产和巢示量子成卵;Star 代因质精生β subunit genes and altered L otility and testosterone, increased the num count and daily sperm醇H and F成B;BP F 表因Fshβ 基睾日附固、每,造is bisphenol A 2 基平count and m和D is tetrachlorodibenzo-p-dioxin;B水类酚体达丸体前tion, and delayed the ages of preputial separation and testicular descent睾量数腺双受子PA性表示素和动垂提低精 响 体 激因 启,降 部,影A;BP 雌表Esr2 基 达期代H and F SH化尾’s pubertal onset SH春ell as sperm变表sperm head abnormalities, decreased the caudal epididymal sperm青因,附Kiss1 受平B 表睾H, F酚双;E后Gnrh1 和BPA and analogues exposure changed the levels of L A, reduced daily sperm concentrations of L sr2 代加SH、FS Star 基count, and accelerated offspring hβ, F增eight of testis and epididymis as w起示因H, F β m sh RN H 水调,引 量Kiss1 和1 基脑,下 常数LH丘素丘数脑量sh平异起下otility;B PA 表英放sr2 and pituitary F Exposure to parabens affected the levels of L Dioxins exposure reduced the expression ofL iss1 receptor,激下子 水SH 部头酮,引,影调精H, F 响降 噁释CD iss1 stands for a gene encoding neuropeptide-kisspeptin达下精etals altered the serum iss1 and K count and m-二素E is polybrominated diphenyl ether;T nrh1 stands for gonadotropin releasing hormone 1 gene;ethyl phthalate;G .,上和 子 表化量 、睾 迟 因 变均-p 激变质 醇,精 改力基并腺生睾 二 苯性Exposure to phthalates altered L平间延基平、活发、附nrh1 and E 雌 水时 水量 二促氯表平量酮降 乱 酮数睾下 睾子 四产紊示、FS tar gene, the w H 水、FS LH子、FS H 和睾丸H 和β、Fshβ 亚为、FS 丸精Lh 行orphic behavior ic G睾H 和;Gnrh1 代降和is dim LH日 内下 离 型 和;TC 体力LH每分儿二胎LH sexual dim量酯Exposure to m thalam-ethylhexyl) phthalate;D pression of hypothalamic K内 低 调,性weight and sperm cle count, testicular sperm DD 表甲MP变活of S 响皮起数体降改和影包下达引泡醚二苯酸二甲,,鼠,溴二BD鼠鼠鼠鼠istar rats,多苯示邻示,S D 大,S鼠D rats,Wistar rats, S ice D rats鼠RI 小,S RI m D 大鼠D rats,Wistar rats, S ice鼠oltzman rats C57 小表C57 m D 大Wistar rats, H 鼠oltzman 大,Wistar 大rats;D NM NM 鼠,H鼠Wistar rats, S Wistar 大Wistar 大ing m Wistar 大大ice, W SD鼠SD ;PB DE 表MP Wistar 大 小 醚,2’,4,4’-tetrabrom苯)酯odiphenyl ether;P明昆Kunm 二基溴己P is bis(2 2,2’,4,4’-四基EH-乙(2二analogues PS)))))示甲铅chloride,lead acetate)PF, B酸。)因酯酯酸P, D MP 酯丁二基A 类DD E-47 is 2,醋酸苯的, B酸正-47 表甲酸 英 镉 邻肽经ley rats;is dibutyl phthalate;D苯甲酚二PB Bisphenol A 甲苯Phthalates EH 噁Dioxins (TC化ium, lead;B 示BP, B BD二BP, D双基苯表-吻;D Cadm邻PA 羟基DE(氯(D鼠HP 肽(B 对羟(对Paraebns (n-butylparaben,铅镉admium;DE码神aw(C 丁酯编Sprague-Dawley 大甲;Kiss1 是二is bisphenol S酸prague-D PS;B装icals in分二因tar stands for steroidogenic acute regulatory protein gene; K成物plastic article示苯基剂产属etals表邻白包塑Chem 腐 副 金 鼠示蛋料防Preservatives业Industrial-products重节D rats stand for S工by Heavy m:S D 大注S;DB P 表急Note: S调性F is bisphenol F BP receptor 2 gene; S
2.5 防腐剂(Preservatives)
Wistar 大鼠于妊娠期和哺乳期(GD 12 ~ PND 21)皮下注射 10、100 和 200 mg·kg-1 对羟基苯甲酸正丁酯(n-butylparaben, BP),200 mg·kg-1 暴露组的雄性后代在PND 110 的血清中 LH 和FSH 浓度显著降低,并且所有暴露组的精子头部异常(主要表现为头部无特征弯曲)数量增加,睾酮浓度显著升高(P<0.05)[89]。 母鼠在 GD 7 ~ PND 21 经口暴露 64、160、400 和 1 000 mg·kg-1的 BP 后,暴露组的 PND 21 和PND 49 的雄性仔鼠血清中LH 水平以及PND 35 的雄性仔鼠FSH 水平显著下降,但PND 90 的雄性仔鼠的促性腺激素均显著升高,并伴随着最高剂量组的附睾尾部精子数量显著减少约36%,每日精子产量显著下降约 55%(P <0.01)[90]。 然而,Holtzman 大鼠在这一时期皮下注射0、100 和1 000 mg·kg-1的 BP,最高剂量组 F1 代雄鼠在 PND 45 和PND 75 的 LH 水平却显著上升(P <0.05),10 mg·kg-1和1 000 mg·kg-1组出现包皮分离延迟,100 mg·kg-1和1 000 mg·kg-1组的睾丸下降延迟并且在成年后评估处于亚生育状态[91]。
2.6 工业副产物(Industrial by-products)
针对二噁英的研究主要集中在探究围产期暴露对子代的影响,子宫内或母乳暴露可以传递给子代,可能影响F1 代成年后的生殖行为。 妊娠Wistar 大鼠在 GD 15 单次口服 1 μg·kg-1四氯二苯并-p-二噁英(tetrachlorodibenzo-p-dioxin, TCDD),GD 20 时雌雄胎儿垂体中Lhβ 和Fshβ 亚基基因表达降低,血清LH 和FSH 激素水平下降进而导致下游性腺类固醇生成蛋白表达下降,成年后性二型行为紊乱[92]。 然而,成年雌性SD 孕鼠于GD 8~GD 14 分别灌胃100 ng·kg-1·d-1和 500 ng·kg-1·d-1的 TCDD,高暴露组的F3 代血清中LH 浓度却显著增加(P<0.05)[93]。
2.7 重金属(Heavy metals)
25日龄雄性昆明小鼠灌胃暴露于5 mg·kg-1·d-1的 CdCl2,在 20 d 和 30 d 后血清 FSH 水平显著升高(P<0.01),睾酮浓度升高,而与之合成的相关蛋白表达降低,这可能是青春期HPG 轴负反馈调节的结果[94]。 12 周成年雌性Wistar 大鼠饮水暴露于100 mg·kg-1的 CdCl2 持续 30 d 后血清基础 LH 水平增加,下丘脑中Kiss1 表达水平升高,Kiss1 受体表达下降,同时暴露组大鼠的卵巢储备功能降低,卵泡数显著下降(P<0.05),出现了HPG 轴受损、卵巢早衰特征[95]。 成年 SD 大鼠连续腹腔注射3.5 mg·kg-1或 2 mg·kg-1的CdCl2 一个月后,雌鼠和雄鼠的 LH 水平均显著降低,对卵巢和睾丸均产生了毒性作用[96-97]。另外,成年雄性Wistar 大鼠灌胃50 mg·kg-1醋酸铅4 周后,血清LH 和FSH 显著降低,精子数量和活力下降(P<0.001)[98]。 以上研究结果显示,未成熟的小鼠暴露于较低剂量的镉,促性腺激素水平上升,然而成年啮齿类动物暴露高剂量镉或铅,促性腺激素水平却下降。 不同窗口期暴露不同剂量的重金属,可能通过不同机制调控促性腺激素的合成和分泌。
3 EDCs 干扰促性腺激素合成的机制研究(The mechanisms of interference of EDCs with gonadotropin synthesis)
目前关于EDCs 调控促性腺激素合成与分泌的作用机制的研究还十分有限。 由于垂体促性腺细胞合成和分泌促性腺激素受下丘脑分泌的GnRH 调控,因此EDCs 对GnRH 的干扰作用可间接调控LH和FSH 的合成。 在哺乳动物中,下丘脑GnRH 神经元脉冲式分泌的GnRH 和垂体促性腺激素细胞膜上的GnRH 受体结合,从而激活相关通路诱导LH和FSH 的合成和分泌。 笔者课题组研究发现,21日龄小鼠下丘脑外植体暴露于500 μg·L-1和5 000 μg·L-1氯氰菊酯后,GnRH 脉冲的间隔时间显著缩短,电压门控钠离子通道(voltage-gated sodium channels,VGSCs)的抑制剂TTX 可以阻断氯氰菊酯对GnRH脉冲频率的调控,表明氯氰菊酯通过干扰VGSCs 缩短GnRH 脉冲间隔[66]。 另一项研究发现,从体内暴露500 mg·kg-1 DEHP 的大鼠中分离的垂体细胞无论有无GnRH 的刺激,其释放的LH 在暴露后都显著增加;但体外分离的20日龄大鼠垂体细胞在暴露于DEHP 或其代谢物后,只有代谢物2-乙基己酸(2-ethylhexanoic acid,2-EHXA)能够显著增强GnRH 刺激下LH 的分泌,但是对基础水平没有影响[99]。 这说明DEHP 代谢物可以通过增强垂体对GnRH 的反应来调节LH 的分泌。
除了通过干扰GnRH 间接调控促性腺激素,EDCs 也可能直接作用于垂体促性腺细胞,干扰LH和FSH 的合成。 笔者课题组利用LβT2 细胞以及垂体原代细胞等体外模型开展了一系列研究。 LβT2细胞暴露于 10-9 ~10-7 mol·L-1 p,p’-DDT 和甲氧滴滴涕(methoxychlor, MXC),Cgα、Lhβ 和 Fshβ 基因mRNA 水平以及LH 和FSH 分泌水平显著升高,并呈现剂量效应关系。 调控促性腺激素合成的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)包括细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)、Jun N 末端激酶(Jun N-terminal kinase, JNK)和 p38 MAPK。 分别用这 3 种激酶抑制剂预处理 LβT2 后暴露 p,p’-DDT 和MXC,其中 ERK 抑制剂 PD184352 阻断 p,p’-DDT和 MXC 对 Cgα、Lhβ 和 Fshβ 亚基基因表达的诱导作用,而JNK 和p38 MAPK 抑制剂无显著影响[100],表明p,p’-DDT 和 MXC 通过 ERK 信号通路诱导LH 和FSH 的合成。 Ca2+信号在垂体前叶合成和分泌促性腺激素所必需的信号转导级联中起着重要作用。 笔者课题组研究发现,原代培养的雄性小鼠垂体细胞暴露于50 μg·L-1氯氰菊酯后以时间依赖性的方式提高了促性腺激素亚基基因Cgα、Lhβ 和Fshβ 的mRNA 水平以及细胞培养液中LH 和FSH这2 种激素的分泌水平。 当氯氰菊酯与L 型电压门控钙离子通道(voltage-gated calcium channels,VGCCs)阻断剂尼莫地平、胞内Ca2+螯合剂BAPTAAM、胞外Ca2+螯合剂EGTA 共暴露时,氯氰菊酯诱导的Ca2+离子内流、促性腺激素亚基基因的表达和激素分泌的增加均被抑制。 以上结果证明了氯氰菊酯通过干扰钙离子通道,刺激小鼠垂体细胞Ca2+离子内流,激活下游ERK 激酶通路进而诱导垂体促性腺激素亚基基因的表达以及LH 和FSH 的分泌,导致血清促性腺激素水平升高,从而加速小鼠性成熟[66]。 同时,笔者课题组利用 LβT2 细胞暴露氯氰菊酯发现,该农药还可通过抑制Ca2+-ATP 酶活性,导致Ca2+从细胞内质网钙库中释放来调节钙稳态[101]。 Ca2+-ATP 酶可将钙离子泵入内质网钙库中贮存,毒胡萝卜素(thapsigargin)是一种Ca2+-ATP 酶的抑制剂,可增加胞质钙离子水平最终导致内质网钙库中钙离子的耗竭。 我们的研究发现毒胡萝卜素预处理可引起LβT2 细胞内质网钙库中钙离子的耗竭,阻断了氯氰菊酯对ERK 的激活作用。 另外,氯氰菊酯还可剂量依赖性地降低 LβT2 细胞内的Ca2+-ATP 酶活性。 进一步证明了氯氰菊酯通过Ca2+激活下游的蛋白激酶C/C-RAF/ERK1/2/即刻早期基因Egr-1、c-fos 和c-jun 信号通路,促进促性腺激素亚基基因的转录[101]。
近些年有研究发现EDCs 引起的不良影响可以在多代和跨代中传递,导致异常发育表型的机制就可能包括与生殖相关的细胞中的表观遗传失调。 啮齿动物和人类暴露EDCs 的表观遗传标记有DNA甲基化、组蛋白翻译后修饰和非编码RNA[102-103]。有研究发现TCDD 通过诱导组蛋白去乙酰化酶活性,进而抑制促性腺激素基因 Cgα、Lhβ 和 Fshβ 表达[104]。 GD 15 妊娠大鼠口服 1 μg·kg-1 TCDD 后胎儿垂体促性腺激素亚基基因和血清激素水平下降;DNA 微阵列分析和PCR 验证结果证实暴露TCDD的母鼠的胎儿垂体中组蛋白去乙酰化酶(histone deacetylases, HDCAs)1/3/4/5/6/7/9/11 基因的 mRNA水平升高,在妊娠晚期和新生儿早期观察到HDAC1/5/7 表达升高并伴随着垂体促性腺激素减少。 染色质免疫共沉淀分析显示乙酰化组蛋白H3和H4 与促性腺激素亚基基因的启动子区域相关,TCDD 暴露导致Lhβ 启动子上结合的组蛋白的乙酰化程度显著降低,其他基因的乙酰化组蛋白有同样的降低趋势[104]。
4 总结与展望(Conclusions and perspectives)
虽然目前很多环境流行病学的研究结果表明,EDCs 暴露与促性腺激素水平改变相关,但是不同化合物对不同年龄、不同性别、不同地域的人群的影响存在较大差异。 目前很多流行病学调查是横断面研究,检测的促性腺激素只能代表瞬时的水平变化,EDCs 的长期暴露对促性腺激素合成以及受促性腺激素调控的相关健康结局的影响仍然缺乏研究。 EDCs暴露、促性腺激素水平的改变以及相关的生殖系统疾病和健康效应之间的相关性和因果关系仍然不明确,需要进一步的大规模人群的前瞻性队列研究。
目前关于EDCs 暴露对HPG 轴影响的毒理学研究仍不完善,多为高剂量的短期暴露。 由于高剂量的EDCs 暴露可能导致HPG 轴的内分泌器官的细胞凋亡和损伤,从而引起其合成的激素水平下降。然而实际环境中EDCs 大多是低剂量的长期暴露,对HPG 轴的干扰作用机制可能与高剂量暴露导致的毒性机制不同。 例如有研究报道高剂量的氯菊酯暴露导致雄鼠的睾酮水平下降,是由于睾丸间质细胞的线粒体损伤引起细胞凋亡[67];而笔者课题组前期的研究发现在无细胞毒性的环境相关剂量下的氯氰菊酯暴露干扰睾丸间质细胞的钙离子通道,刺激睾酮的合成[66]。 某些EDCs 的暴露还会引起代际传递效应,子代的促性腺激素水平受到干扰,然而相关的机制仍然不明确,有可能涉及到EDCs 对子代表观遗传的影响。 虽然垂体是HPG 轴上极为重要的内分泌器官,然而由于垂体在颅内,体积极小,获取原代细胞培养较难,因此关于EDCs 干扰垂体分泌促性腺激素的毒理机制研究十分有限。 笔者课题组的一系列研究表明,小鼠垂体瘤细胞系LβT2 可以响应EDCs对LH 和FSH 的亚基基因表达以及促性腺激素分泌的调控,是研究EDCs 调控促性腺激素作用机制的较好的体外模型。 因此未来的研究可以结合体内和体外模型,更多聚焦于低剂量EDCs 长期暴露对促性腺激素以及HPG 轴的干扰作用和毒性机制。
[1]Kumar M, Sarma D K, Shubham S, et al. Environmental endocrine-disrupting chemical exposure: Role in noncommunicable diseases [J]. Frontiers in Public Health,2020,8:553850
[2]Zoeller R T, Brown T R, Doan L L, et al. Endocrine-disrupting chemicals and public health protection: A statement of principles from The Endocrine Society [J].Endocrinology,2012,153(9):4097-4110
[3]Maqbool F, Mostafalou S, Bahadar H, et al. Review of endocrine disorders associated with environmental toxicants and possible involved mechanisms [J]. Life Sciences,2016,145:265-273
[4]Oyola M G, Handa R J. Hypothalamic-pituitary-adrenal and hypothalamic-pituitary-gonadal axes: Sex differences in regulation of stress responsivity [J].Stress,2017,20(5):476-494
[5]Melgarejo M, Mendiola J, Koch H M, et al. Associations between urinary organophosphate pesticide metabolite levels and reproductive parameters in men from an infertility clinic [J]. Environmental Research, 2015, 137: 292-298
[6]Ye X Q,Pan W Y,Zhao S L,et al.Relationships of pyrethroid exposure with gonadotropin levels and pubertal development in Chinese boys [J]. Environmental Science &Technology,2017,51(11):6379-6386
[7]Kaprara A, Huhtaniemi I T. The hypothalamus-pituitarygonad axis: Tales of mice and men [J].Metabolism,2018,86:3-17
[8]Stamatiades G A,Kaiser U B.Gonadotropin regulation by pulsatile GnRH: Signaling and gene expression [J]. Molecular and Cellular Endocrinology,2018,463:131-141
[9]Plunk E C, Richards S M.Endocrine-disrupting air pollutants and their effects on the hypothalamus-pituitary-gonadal axis [J].International Journal of Molecular Sciences,2020,21(23):9191
[10]Dwyer A A, Chavan N R, Lewkowitz-Shpuntoff H, et al.Functional hypogonadotropic hypogonadism in men: Underlying neuroendocrine mechanisms and natural history[J].The Journal of Clinical Endocrinology & Metabolism,2019,104(8):3403-3414
[11]Goodarzi M O, Dumesic D A, Chazenbalk G, et al. Polycystic ovary syndrome: Etiology, pathogenesis and diagnosis [J].Nature Reviews Endocrinology,2011(7):219-231
[12]Saadia Z.Follicle stimulating hormone(LH:FSH) ratio in polycystic ovary syndrome (PCOS)-obese vs. non-obese women [J]. Medical Archives,2020,74(4):289
[13]McKinlay R, Plant J A, Bell J N B, et al. Endocrine disrupting pesticides: Implications for risk assessment [J].Environment International,2008,34(2):168-183
[14]Bornman M, Delport R, Farías P, et al. Alterations in male reproductive hormones in relation to environmental DDT exposure [J].Environment International,2018,113:281-289
[15]Freire C, Koifman R J, Sarcinelli P N, et al. Association between serum levels of organochlorine pesticides and sex hormones in adults living in a heavily contaminated area in Brazil [J]. International Journal of Hygiene and Environmental Health,2014,217(2-3):370-378
[16]Eskenazi B, Rauch S A, Tenerelli R, et al. In utero and childhood DDT,DDE,PBDE and PCBs exposure and sex hormones in adolescent boys: The CHAMACOS study[J]. International Journal of Hygiene and Environmental Health,2017,220(2):364-372
[17]Aguilar-Garduño C, Lacasaña M, Blanco-Muñoz J, et al.Changes in male hormone profile after occupational organophosphate exposure. A longitudinal study [J]. Toxicology,2013,307:55-65
[18]Qin K L, Zhang Y, Wang Y W, et al. Prenatal organophosphate pesticide exposure and reproductive hormones in cord blood in Shandong, China [J]. International Jour-nal of Hygiene and Environmental Health, 2020, 225:113479
[19]Li C M, Cao M F, Ma L J, et al. Pyrethroid pesticide exposure and risk of primary ovarian insufficiency in Chinese women [J]. Environmental Science & Technology,2018,52(5):3240-3248
[20]Jurewicz J, Radwan P, Wielgomas B, et al. Exposure to pyrethroid pesticides and ovarian reserve [J].Environment International,2020,144:106028
[21]Hoh E, Zhu L Y, Hites R A. Dechlorane plus, a chlorinated flame retardant, in the Great Lakes [J]. Environmental Science & Technology,2006,40(4):1184-1189
[22]Zhu J P, Feng Y L, Shoeib M. Detection of dechlorane plus in residential indoor dust in the city of Ottawa,Canada [J]. Environmental Science & Technology, 2007, 41(22):7694-7698
[23]Siddique S, Xian Q M, Abdelouahab N, et al. Levels of dechlorane plus and polybrominated diphenylethers in human milk in two Canadian cities [J].Environment International,2012,39(1):50-55
[24]Ren G F,Yu Z Q,Ma S T,et al.Determination of dechlorane plus in serum from electronics dismantling workers in South China [J].Environmental Science & Technology,2009,43(24):9453-9457
[25]Johnson P I,Stapleton H M,Mukherjee B,et al.Associations between brominated flame retardants in house dust and hormone levels in men [J].Science of the Total Environment,2013,445-446:177-184
[26]Makey C M, McClean M D, Braverman L E, et al. Polybrominated diphenyl ether exposure and reproductive hormones in North American men [J].Reproductive Toxicology,2016,62:46-52
[27]Gao Y, Chen L M,Wang C F,et al.Exposure to polybrominated diphenyl ethers and female reproductive function:A study in the production area of Shandong, China [J].Science of the Total Environment,2016,572:9-15
[28]Gravel S, Lavoué J, Bakhiyi B, et al. Multi-exposures to suspected endocrine disruptors in electronic waste recycling workers: Associations with thyroid and reproductive hormones [J]. International Journal of Hygiene and Environmental Health,2020,225:113445
[29]Pan W Y, Ye X Q, Yin S S, et al. Selected persistent organic pollutants associated with the risk of primary ovarian insufficiency in women [J]. Environment International,2019,129:51-58
[30]Tang M L,Yin S S,Zhang J Y,et al.Prenatal exposure to polychlorinated biphenyl and umbilical cord hormones and birth outcomes in an island population [J]. Environmental Pollution,2018,237:581-591
[31]Miyashita C, Araki A, Mitsui T, et al. Sex-related differences in the associations between maternal dioxin-like compounds and reproductive and steroid hormones in cord blood: The Hokkaido study [J]. Environment International,2018,117:175-185
[32]Casals-Casas C,Desvergne B.Endocrine disruptors:From endocrine to metabolic disruption [J]. Annual Review of Physiology,2011,73:135-162
[33]Adoamnei E, Mendiola J, Vela-Soria F, et al.Urinary bisphenol A concentrations are associated with reproductive parameters in young men [J]. Environmental Research,2018,161:122-128
[34]Gao C Z,He H H,Qiu W H,et al.Oxidative stress,endocrine disturbance, and immune interference in humans showed relationships to serum bisphenol concentrations in a dense industrial area [J]. Environmental Science &Technology,2021,55(3):1953-1963
[35]Lassen T H,Frederiksen H,Jensen T K,et al.Urinary bisphenol A levels in young men: Association with reproductive hormones and semen quality [J]. Environmental Health Perspectives,2014,122(5):478-484
[36]Liang H, Xu W P, Chen J P, et al. The association between exposure to environmental bisphenol A and gonadotropic hormone levels among men [J].PLoS One,2017,12(1): e0169217
[37]Meeker J D, Calafat A M, Hauser R. Urinary bisphenol A concentrations in relation to serum thyroid and reproductive hormone levels in men from an infertility clinic[J].Environmental Science & Technology,2010,44(4):1458-1463
[38]Chen Y,Wang Y C,Ding G D,et al.Association between bisphenol A exposure and idiopathic central precocious puberty (ICPP) among school-aged girls in Shanghai,China [J]. Environment International,2018,115:410-416
[39]Hyun Kim D,Min Choi S,Soo Lim D,et al.Risk assessment of endocrine disrupting phthalates and hormonal alterations in children and adolescents [J]. Journal of Toxicology and Environmental Health, Part A, 2018, 81(21):1150-1164
[40]Wang B, Qin X L, Xiao N, et al. Phthalate exposure and semen quality in infertile male population from Tianjin,China: Associations and potential mediation by reproductive hormones [J]. Science of the Total Environment,2020,744:140673
[41]Chen Q, Yang H, Zhou N Y, et al. Phthalate exposure, even below US EPA reference doses, was associated with semen quality and reproductive hormones: Prospective MARHCS study in general population [J]. Environment International,2017,104:58-68
[42]Muerköster A P, Frederiksen H, Juul A, et al. Maternal phthalate exposure associated with decreased testosterone/LH ratio in male offspring during mini-puberty. Odense Child Cohort [J]. Environment International, 2020, 144:106025
[43]Cao M F, Pan W Y, Shen X Y, et al. Urinary levels of phthalate metabolites in women associated with risk of premature ovarian failure and reproductive hormones [J].Chemosphere,2020,242:125206
[44]Guth M,Pollock T,Fisher M,et al.Concentrations of urinary parabens and reproductive hormones in girls 6-17 years living in Canada [J]. International Journal of Hygiene and Environmental Health,2021,231:113633
[45]Jensen T K, Andersson A M, Main K M, et al. Prenatal paraben exposure and anogenital distance and reproductive hormones during mini-puberty: A study from the O-dense Child Cohort [J].Science of the Total Environment,2021,769:145119
[46]Janjua N R, Mortensen G K, Andersson A M, et al. Systemic uptake of diethyl phthalate, dibutyl phthalate, and butyl paraben following whole-body topical application and reproductive and thyroid hormone levels in humans[J]. Environmental Science & Technology, 2007, 41(15):5564-5570
[47]Smith K W, Souter I, Dimitriadis I, et al.Urinary paraben concentrations and ovarian aging among women from a fertility center [J]. Environmental Health Perspectives,2013,121(11-12):1299-1305
[48]Jurewicz J,Radwan M,Wielgomas B,et al.Parameters of ovarian reserve in relation to urinary concentrations of parabens [J]. Environmental Health,2020,19(1):26
[49]Liang Y S, Tang Z, Jiang Y S, et al. Serum metabolic changes associated with dioxin exposure in a Chinese male cohort [J]. Environment International, 2020, 143:105984
[50]Patrizi B, Siciliani de Cumis M. TCDD toxicity mediated by epigenetic mechanisms [J]. International Journal of Molecular Sciences,2018,19(12):4101
[51]Mocarelli P, Gerthoux P M,Needham L L,et al.Perinatal exposure to low doses of dioxin can permanently impair human semen quality [J]. Environmental Health Perspectives,2011,119(5):713-718
[52]Lambertino A, Persky V, Freels S, et al. Associations of PCBS, dioxins and furans with follicle-stimulating hormone and luteinizing hormone in postmenopausal women:National Health and Nutrition Examination Survey 1999-2002 [J]. Chemosphere,2021,262:128309
[53]Ye X Q, Pan W Y, Li C M, et al. Exposure to polycyclic aromatic hydrocarbons and risk for premature ovarian failure and reproductive hormones imbalance [J]. Journal of Environmental Sciences,2020,91:1-9
[54]Yin S S,Tang M L,Chen F F,et al.Environmental exposure to polycyclic aromatic hydrocarbons (PAHs): The correlation with and impact on reproductive hormones in umbilical cord serum [J]. Environmental Pollution, 2017,220:1429-1437
[55]Chen Q, Wang F R, Yang H, et al. Exposure to fine particulate matter-bound polycyclic aromatic hydrocarbons,male semen quality, and reproductive hormones: The MARCHS study [J]. Environmental Pollution, 2021, 280:116883
[56]Interdonato M, Pizzino G, Bitto A, et al.Cadmium delays puberty onset and testis growth in adolescents [J].Clinical Endocrinology,2015,83(3):357-362
[57]Ciarrocca M, Capozzella A, Tomei F, et al. Exposure to cadmium in male urban and rural workers and effects on FSH, LH and testosterone [J]. Chemosphere,2013,90(7):2077-2084
[58]Jackson L W, Howards P P, Wactawski-Wende J, et al.The association between cadmium, lead and mercury blood levels and reproductive hormones among healthy,premenopausal women [J]. Human Reproduction, 2011,26(10):2887-2895
[59]Pollack A Z, Schisterman E F, Goldman L R, et al. Cadmium, lead, and mercury in relation to reproductive hormones and anovulation in premenopausal women [J]. Environmental Health Perspectives,2011,119(8):1156-1161
[60]Pan W Y, Ye X Q,Zhu Z Y,et al.Urinary cadmium concentrations and risk of primary ovarian insufficiency in women: A case-control study [J]. Environmental Geochemistry and Health,2021,43(5):2025-2035
[61]Lee T W, Kim D H, Ryu J Y. The effects of exposure to lead, cadmium and mercury on follicle-stimulating hormone levels in men and postmenopausal women: Data from the Second Korean National Environmental Health Survey (2012-2014) [J]. Annals of Occupational and Environmental Medicine,2019,31: e21
[62]Dehghan S F,Mehrifar Y,Ardalan A.The relationship between exposure to lead-containing welding fumes and the levels of reproductive hormones [J]. Annals of Global Health,2019,85(1):125
[63]Ben Rhouma K, Tébourbi O, Krichah R, et al. Reproductive toxicity of DDT in adult male rats [J].Human & Experimental Toxicology,2001,20(8):393-397
[64]Rasier G,Parent A S,Gérard A,et al.Early maturation of gonadotropin-releasing hormone secretion and sexual precocity after exposure of infant female rats to estradiol or dichlorodiphenyltrichloroethane [J]. Biology of Reproduction,2007,77(4):734-742
[65]Alaa-Eldin E A, El-Shafei D A, Abouhashem N S. Individual and combined effect of chlorpyrifos and cypermethrin on reproductive system of adult male albino rats[J]. Environmental Science and Pollution Research International,2017,24(2):1532-1543
[66]Ye X Q, Li F X, Zhang J Y, et al. Pyrethroid insecticide cypermethrin accelerates pubertal onset in male mice via disrupting hypothalamic-pituitary-gonadal axis [J]. Environmental Science & Technology, 2017, 51(17): 10212-10221
[67]Zhang S Y, Ito Y, Yamanoshita O, et al. Permethrin may disrupt testosterone biosynthesis via mitochondrial membrane damage of leydig cells in adult male mouse [J].Endocrinology,2007,148(8):3941-3949
[68]Zhou Y J, Wang X D, Xiao S, et al. Exposure to betacypermethrin impairs the reproductive function of female mice [J].Regulatory Toxicology and Pharmacology,2018,95:385-394
[69]Li Y F, Pan C, Hu J X, et al. Effects of cypermethrin on male reproductive system in adult rats [J].Biomedical and Environmental Sciences,2013,26(3):201-208
[70]Simon-Delso N, Amaral-Rogers V, Belzunces L P, et al.Systemic insecticides (neonicotinoids and fipronil):Trends, uses,mode of action and metabolites [J].Environmental Science and Pollution Research International,2015,22(1):5-34
[71]Bass C, Field L M. Neonicotinoids [J]. Current Biology,2018,28(14): R772-R773
[72]Kapoor U, Srivastava M K, Srivastava L P. Toxicological impact of technical imidacloprid on ovarian morphology,hormones and antioxidant enzymes in female rats [J].Food and Chemical Toxicology,2011,49(12):3086-3089
[73]Abdel-Razik R K,Mosallam E M,Hamed N A,et al.Testicular deficiency associated with exposure to cypermethrin, imidacloprid, and chlorpyrifos in adult rats [J].Environmental Toxicology and Pharmacology, 2021, 87:103724
[74]Arıcan E Y, Gökçeogˇlu Kayalı D, Ulus Karaca B, et al.Reproductive effects of subchronic exposure to acetamiprid in male rats [J]. Scientific Reports, 2020, 10(1):8985
[75]Li Z Q, Li H T, Li C C, et al.Low dose of fire retardant,2,2’,4,4’-tetrabromodiphenyl ether (BDE47), stimulates the proliferation and differentiation of progenitor Leydig cells of male rats during prepuberty [J]. Toxicology Letters,2021,342:6-19
[76]Lefèvre P L C,Berger R G,Ernest S R,et al.Exposure of female rats to an environmentally relevant mixture of brominated flame retardants targets the ovary, affecting folliculogenesis and steroidogenesis [J]. Biology of Reproduction,2016,94(1):9,1-11
[77]Steinberg R M, Walker D M, Juenger T E, et al. Effects of perinatal polychlorinated biphenyls on adult female rat reproduction: Development, reproductive physiology, and second generational effects [J]. Biology of Reproduction,2008,78(6):1091-1101
[78]Yamamoto M,Narita A,Kagohata M,et al.Effects of maternal exposure to 3,3’, 4, 4’, 5-pentachlorobiphenyl(PCB126) or 3, 3’, 4, 4’, 5, 5’-hexachlorobiphenyl(PCB169) on testicular steroidogenesis and spermatogenesis in male offspring rats [J].Journal of Andrology,2005,26(2):205-214
[79]Fiandanese N, Borromeo V, Berrini A, et al. Maternal exposure to a mixture of di(2-ethylhexyl) phthalate (DEHP)and polychlorinated biphenyls (PCBs) causes reproductive dysfunction in adult male mouse offspring [J]. Reproductive Toxicology,2016,65:123-132
[80]Oliveira I M, Romano R M, de Campos P, et al. Delayed onset of puberty in male offspring from bisphenol A-treated dams is followed by the modulation of gene expression in the hypothalamic-pituitary-testis axis in adulthood[J]. Reproduction, Fertility and Development, 2017, 29(12):2496
[81]Yuan M, Zhao Y N, Lin R, et al. Adverse reproductive function induced by maternal BPA exposure is associated with abnormal autophagy and activating inflamation via mTOR and TLR4/NF-κB signaling pathways in female offspring rats [J]. Reproductive Toxicology, 2020, 96:185-194
[82]Ullah A, Pirzada M, Jahan S, et al. Impact of low-dose chronic exposure to bisphenol A and its analogue bisphenol B,bisphenol F and bisphenol S on hypothalamo-pituitary-testicular activities in adult rats: A focus on the possible hormonal mode of action [J]. Food and Chemical Toxicology,2018,121:24-36
[83]Nourian A,Soleimanzadeh A,Shalizar Jalali A,et al.Bisphenol-A analogue (bisphenol-S) exposure alters female reproductive tract and apoptosis/oxidative gene expression in blastocyst-derived cells [J]. Iranian Journal of Basic Medical Sciences,2020,23(5):576-585
[84]Giribabu N, Reddy P S. Protection of male reproductive toxicity in rats exposed to di-n-butyl phthalate during embryonic development by testosterone [J]. Biomedicine &Pharmacotherapy,2017,87:355-365
[85]于淼, 张林媛, 乔佩环, 等. 邻苯二甲酸二丁酯诱导氧化应激及抑制CYP17a1 干扰睾酮合成[J]. 卫生研究,2015,44(3):364-370
Yu M, Zhang L Y, Qiao P H, et al. Testicular oxidative stress and downregulation of CYP17a1 induced by di(nbutyl)phthalate inhibit synthesis of testosterone[J].Journal of Hygiene Research,2015,44(3):364-370 (in Chinese)
[86]Nelli G, Pamanji S R.Di-n-butyl phthalate prompts interruption of spermatogenesis, steroidogenesis, and fertility associated with increased testicular oxidative stress in adult male rats [J]. Environmental Science and Pollution Research International,2017,24(22):18563-18574
[87]Ha M, Guan X, Wei L, et al. Di-(2-ethylhexyl) phthalate inhibits testosterone level through disturbed hypothalamicpituitary-testis axis and ERK-mediated 5α-Reductase 2[J]. Science of the Total Environment, 2016, 563-564:566-575
[88]Yue M, Ma R S, Zhang R Z, et al. Effects of dimethyl phthalate (DMP) on serum sex hormone levels and apoptosis in C57 female mice [J]. International Journal of Endocrinology and Metabolism,2019,17(2): e82882
[89]Guerra M T,Sanabria M,Leite G A A,et al.Maternal exposure to butyl paraben impairs testicular structure and sperm quality on male rats [J].Environmental Toxicology,2017,32(4):1273-1289
[90]Zhang L Y,Dong L,Ding S J,et al.Effects of n-butylparaben on steroidogenesis and spermatogenesis through changed E2 levels in male rat offspring [J]. Environmental Toxicology and Pharmacology,2014,37(2):705-717
[91]Maske P,Dighe V,Mote C,et al.n-butylparaben exposure through gestation and lactation impairs spermatogenesis and steroidogenesis causing reduced fertility in the F1 generation male rats [J]. Environmental Pollution, 2020,256:112957
[92]Takeda T,Matsumoto Y,Koga T,et al.Maternal exposure to dioxin disrupts gonadotropin production in fetal rats and imprints defects in sexual behavior [J].The Journal of Pharmacology and Experimental Therapeutics, 2009, 329(3):1091-1099
[93]Yu K L, Zhang X L, Tan X M, et al. Transgenerational impairment of ovarian induced by 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) associated with Igf2 and H19 in adult female rat [J]. Toxicology,2019,428:152311
[94]Li X S, Guo J T, Jiang X W, et al. Cyanidin-3-O-glucoside protects against cadmium-induced dysfunction of sex hormone secretion via the regulation of hypothalamus-pituitary-gonadal axis in male pubertal mice [J]. Food and Chemical Toxicology,2019,129:13-21
[95]da Costa C S,Oliveira T F,Freitas-Lima L C,et al.Subacute cadmium exposure disrupts the hypothalamic-pituitary-gonadal axis, leading to polycystic ovarian syndrome and premature ovarian failure features in female rats [J].Environmental Pollution,2021,269:116154
[96]Madboli A E N A, Seif M M.Immunohistochemical, histopathological, and biochemical studies of the NF-B P65 marker in rat ovaries experimentally intoxicated by cadmium and the protective effect of the purslane plant extract [J]. Environmental Science and Pollution Research International,2021,28(14):17613-17626
[97]Wang J C, Zhu H L, Lin S, et al.Protective effect of naringenin against cadmium-induced testicular toxicity in male SD rats [J].Journal of Inorganic Biochemistry,2021,214:111310
[98]Alotaibi M F, Al-Joufi F, Abou Seif H S, et al. Umbelliferone inhibits spermatogenic defects and testicular injury in lead-intoxicated rats by suppressing oxidative stress and inflammation, and improving Nrf2/HO-1 signaling[J]. Drug Design, Development and Therapy, 2020, 14:4003-4019
[99]Svechnikova I, Svechnikov K, Söder O. The influence of di-(2-ethylhexyl) phthalate on steroidogenesis by the ovarian granulosa cells of immature female rats [J]. The Journal of Endocrinology,2007,194(3):603-609
[100]Zhou J H, Yang Y, Xiong K, et al. Endocrine disrupting effects of dichlorodiphenyltrichloroethane analogues on gonadotropin hormones in pituitary gonadotrope cells [J].Environmental Toxicology and Pharmacology, 2014, 37(3):1194-1201
[101]Li F X, Ma H H, Liu J. Pyrethroid insecticide cypermethrin modulates gonadotropin synthesis via calcium homeostasis and ERK1/2 signaling in LβT2 mouse pituitary cells [J]. Toxicological Sciences,2017,162(1):43-52
[102]Xin F,Susiarjo M,Bartolomei M S.Multigenerational and transgenerational effects of endocrine disrupting chemicals: A role for altered epigenetic regulation? [J]. Seminars in Cell & Developmental Biology,2015,43:66-75
[103]Latchney S E,Fields A M,Susiarjo M.Linking inter-individual variability to endocrine disruptors: Insights for epigenetic inheritance [J]. Mammalian Genome, 2018, 29(1-2):141-152
[104]Takeda T, Fujii M, Taura J, et al. Dioxin silences gonadotropin expression in perinatal pups by inducing histone deacetylases: A new insight into the mechanism for the imprinting of sexual immaturity by dioxin [J]. Journal of Biological Chemistry,2012,287(22):18440-18450