对羟基苯甲酸丙酯(propylparaben, PrP)是一种广泛应用于个人护理品和药物的抗菌防腐剂。 由于该类防腐剂的广泛使用,在不同环境介质(如土壤、水体和室内灰尘等)中均被检出[1]。 PrP 是地表水体中该类防腐剂检出浓度和检出率最高的物质之一[2-3]。 例如,中国珠江地区地表水中检测到PrP 的最大浓度为3 142 ng·L-1[3],日本德岛和大阪的城市溪流中检测的PrP 最大浓度为207 ng·L-1[4],西班牙加利西亚地区检测的PrP 最大浓度为69 ng·L-1[5]。在污水受纳水体中,其浓度可能更高[6],并可能影响水生生物的正常生理过程[7]。 也有研究表明,对羟基苯甲酸酯类及其盐类能在水体和人体组织细胞中积累[8]。 PrP 的结构与雌激素相似,并具有外源性雌激素作用[9],属于内分泌干扰物(EDCs)[10]。 Pedersen等[11]在虹鳟(Oncorhynchus mykiss)腹腔中注射的对羟基苯甲酸乙酯(EtP)、对羟基苯甲酸丁酯(BuP)和PrP 可引起雌激素反应,显著诱导鱼体内卵黄原蛋白(VTG)的增加,表明 BuP 和 PrP 具有与双酚 A(BPA)类似的雌激素作用。 董力等[12]发现PrP 对人体角质形成细胞(HaCat)具有细胞毒性作用,可抑制细胞增殖,且具有时间-剂量效应。 PrP 长时间持续存在于水环境中,对水生生物的潜在风险不可忽视。
溞类是水体中初级生产者(藻类)和消费者(如鱼类)之间的连接枢纽,可影响食物网中营养物质和能量的流动,在水生生态系统中发挥重要作用[13]。 大型溞(Daphnia magna)具有繁殖快、生长周期短等优点,对毒性物质反应灵敏,是一种重要的生态指示种。 Chatterjee 等[14]发现将多代大型溞暴露于受粪大肠杆菌污染的野外溪流水中,会影响大型溞正常的生长发育,出现体表面积增大、血红蛋白和产卵数量增加等异常性状,基于F0 和F1 代样品蛋白组学的分析发现,污染物改变了大型溞的能量代谢途径,机体出现了氧化应激和氧转运减弱。
许多环境污染物可改变解毒和抗氧化相关基因的表达[15],如过氧化氢酶(cat)、谷胱甘肽转移酶(gst)和激素受体96(hr96)等,从而引起暴露生物的生理变化。 cat、gst 和hr96 是大型溞解毒相关的基因,CAT 将H2O2 分解成O2 和 H2O,以减轻 H2O2 对细胞的氧化损伤[16]。 GST 是调节细胞对有毒化学物质反应的分子保护机制中的一种清除剂[17]。 hr96是一种混杂的核受体,由许多内源和外源物质激活[18],负责调节许多参与解毒过程的基因。 cyp314、vtg 是与大型溞生长发育相关的基因,cyp314 属于线粒体细胞色素P450 亚家族的基因,参与蜕皮酮的生物合成,调节无脊椎动物的生长和繁殖过程[19]。 vtg是卵黄蛋白的前体,是许多卵生动物体内的主要脂蛋白[20],受雌激素控制[21]。 因此,可选用 cat、gst、hr96、cyp314 和vtg 等基因,研究生物体的生存、生长速率和繁殖等生理反应与分子水平变化的密切关系[22]。
本研究以大型溞的表型变化(体长、壳刺长、复眼面积、体表面积和心跳等)作为毒性效应指标,使用荧光定量 PCR 技术检测大型溞 cat、gst、hr96、cyp314 和vtg 等基因mRNA 的相对表达量变化,研究PrP 对大型溞抗氧化和解毒代谢系统及生长发育相关基因转录表达的影响,为合理的评价PrP 的潜在毒性提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验生物
大型溞(Daphnia magna)购买于江门弘光高科技有限公司。 试验开始前,大型溞在实验室驯养2 周,实验用水为曝气72 h 的自来水;温度(20±2) ℃;pH 7.0±0.1、溶解氧>5 mg·L-1、光暗期为 12 h ∶12 h;光照强度为8 000 lx。 大型溞每3 d 换水、喂食纯种斜生栅藻(Scenedesmus obliquus)。 斜生栅藻购于中国科学院武汉水生生物研究所。
1.2 试验方法
1.2.1 急性毒性与亚慢性毒性暴露实验
根据文献[23]的实验方法,对大型溞幼溞进行急性毒性与亚慢性毒性暴露实验,探究PrP 对大型溞生长发育的影响。 选取出生约24 h 的480 只健康幼溞进行暴露试验,以PrP 的水环境检测浓度(3 142 ng·L-1)[3]、大型溞 24 h-LC50(21.1 mg·L-1)[24-26]和 24 h最大无观测效应浓度(NOEC 24 hfeeding ≥4 mg·L-1[26])为参考依据,针对日常水环境、特殊环境水体(如污水受纳水体、污水进水口等)以及PrP 在水环境蓄积的极端情况等不同情形,分别设计了0、0.3、12 和 480 μg·L-1 4个不同的处理组。 将 PrP(分析纯,西陇科学有限公司)用DMSO(分析纯,西陇科学有限公司)配制成储备液(20 g·L-1),并逐级稀释配制成不同浓度的暴露液,暴露液中DMSO 的浓度为0.005% (V ∶V)。 每个处理组设置 4 组平行,每个平行组中用100 mL 的玻璃皿装入50 mL 暴露液,随机放入15 只幼溞,置于恒温光照培养箱中,其他条件与驯养期间相同。 暴露实验分为4 d 和8 d 共2 组,每日记录大型溞的存活情况。
1.2.2 大型溞表型变化的测定与取样
4 d 和8 d PrP 暴露实验结束后,使用体式显微镜(Revolve,美国ECHO)观察和记录大型溞的表型变化。 将存活的大型溞置于显微镜下观察,统计大型溞30 s 的心跳次数[27],用目镜测微尺测量大型溞的体长、体高和壳刺长,用显微镜自带软件测量复眼、心脏和体表面积。 观察结束后,将大型溞置于RNA 保存液中(Takara),-20 ℃保存备用,用于提取总RNA。
1.2.3 总RNA 提取和cDNA 合成
采用RNAiso Plus 试剂(TaKaRa)提取大型溞的总RNA。 取8 只大型溞作为混合样品,用匀浆仪(XFSTPRP-48,上海净信实业发展有限公司)进行冷冻匀浆,经过均质化—相分离—RNA 沉淀—RNA洗涤—RNA 溶解等过程,得到大型溞的总RNA。使用微量分光光度计(Q5000,美国 Quawell)检测RNA 的质量。 用 PrimeScript RT reagent Kit with gDNA Eraser 试剂盒(TaKaRa)将RNA 反转录为cDNA,用于荧光定量PCR 实验。
1.2.4 荧光定量PCR 实验
根据文献[28]的方法,设计qPCR 特异性引物(表1),引物由华大基因公司合成。 以各处理组和对照组的32个样品 cDNA 为模板,以大型溞β-actin基因作为内参基因,参照PowerUpTM SYBRTM Green Master Mix 试剂盒(ABI,美国赛默飞世尔科技公司)的操作说明,使用qPCR 仪(QuantStudio 3,美国赛默飞世尔科技公司)开展实时荧光定量PCR 实验,每个样品重复3 次,并设置阴性对照。 PCR 反应体系为:PowerUpTM SYBRTM Green Master Mix 10 μL,cDNA 模板 2 μL,上下游引物(10 μmol·L-1)各 1 μL,双蒸水6 μL。 反应程序为预变性:95 ℃,30 s。 40个循环:95 ℃,5 s;55 ℃,30 s。 熔解曲线:95 ℃,10 s;65 ℃,5 s;95 ℃、0.5 s。 反应结束后,查看 PCR 的扩增曲线和熔解曲线判断PCR 反应的特异性。
表1 大型溞荧光定量PCR 实验的特异性引物序列
Table 1 Specific primer sequences of Daphnia magna used in the qPCR experiments
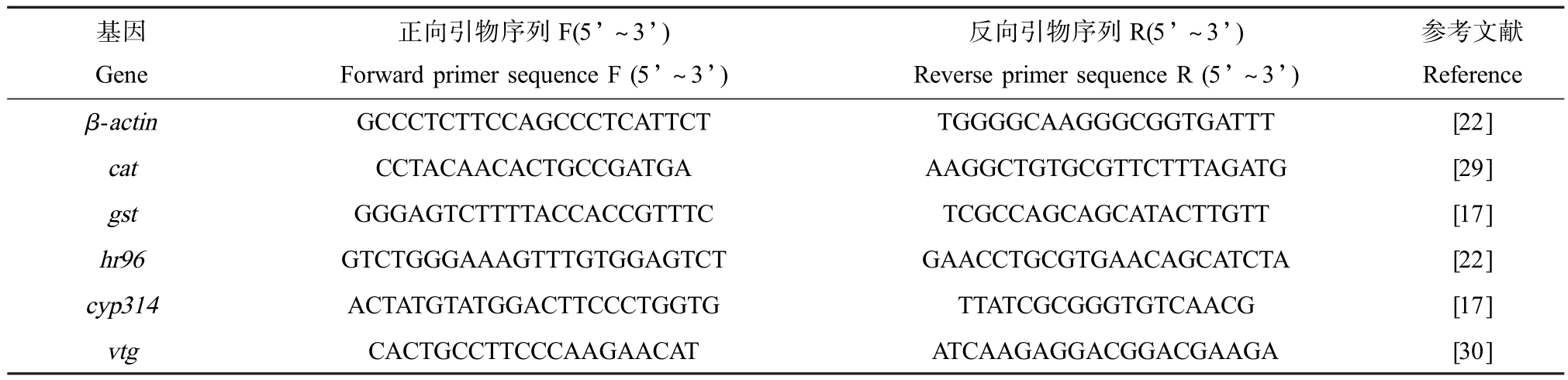
基因Gene正向引物序列F(5’ ~3’)Forward primer sequence F (5’ ~3’)反向引物序列R(5’ ~3’)Reverse primer sequence R (5’ ~3’)参考文献Reference β-actin GCCCTCTTCCAGCCCTCATTCT TGGGGCAAGGGCGGTGATTT [22]cat CCTACAACACTGCCGATGA AAGGCTGTGCGTTCTTTAGATG [29]gst GGGAGTCTTTTACCACCGTTTC TCGCCAGCAGCATACTTGTT [17]hr96 GTCTGGGAAAGTTTGTGGAGTCT GAACCTGCGTGAACAGCATCTA [22]cyp314 ACTATGTATGGACTTCCCTGGTG TTATCGCGGGTGTCAACG [17]vtg CACTGCCTTCCCAAGAACAT ATCAAGAGGACGGACGAAGA [30]
1.3 数据统计与分析
实验结果采用平均值±标准误差(Mean±SEM)表示,用Graphpad 软件进行单因素方差分析(One-Way ANOVA)、Tukey 多重比较,不同 PrP 处理组与空白对照组之间开展配对t 检验,以P<0.05 表示差异显著。
2 结果(Results)
2.1 PrP 对大型溞生长发育的影响
实验结束后,对照组大型溞生长正常,无死亡;PrP 暴露的各处理组中,480 μg·L-1处理组暴露4 d的死亡率为1.67%;12 μg·L-1处理组暴露8 d 的死亡率为3.33%;其余各组大型溞存活率均为100%。不同浓度PrP 暴露后,与对照组的表型相比,处理组出现了壳刺长度减小,体高、体长、心脏面积和体表面积增加的发育异常现象(图1)。 大型溞发育异常的表型统计结果如图2 和图3 所示。
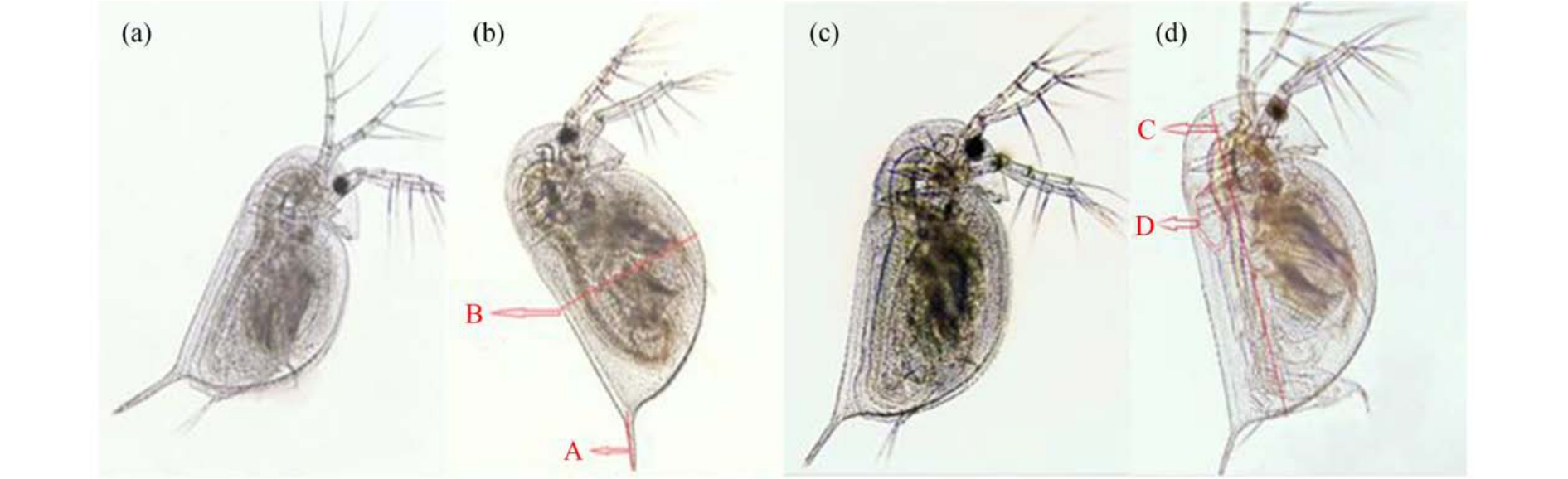
图1 对羟基苯甲酸丙酯(PrP)暴露后大型溞的生长发育异常
注:(a)4 d 对照组的大型溞,(b)4 d 处理组的大型溞,(c)8 d 对照组的大型溞,(d)8 d 处理组的大型溞;A 标示壳刺长度减小,B 标示体高增加,C 标示体长增加,D 标示心脏面积增加。
Fig.1 Abnormal development of Daphnia magna after propylparaben (PrP) exposure
Note: (a) Daphnia magna in the control group of 4 d, (b) Daphnia magna in the treatment group of 4 d, (c) Daphnia magna in the control group of 8 d, (d) Daphnia magna in the treatment group of 8 d; A shows shortening of the shell spines length,B shows increase of the body height, C shows increase of the body length, and D shows increase of the heart area.
由图2(a)可知,不同浓度PrP 暴露4 d 后,各处理组大型溞的体长与对照组无显著性差异(P>0.05);暴露8 d 时,12 μg·L-1处理组大型溞的体长显著大于对照组(1.11 倍)(P<0.05)。 在图 2(b)中,480 μg·L-1 PrP 暴露4 d 时,大型溞体高显著大于对照组(P<0.05);暴露8 d 后,PrP 各处理组大型溞的体高均大于对照组,其中12 μg·L-1和 480 μg·L-1 PrP 处理组的体高显著增加(P<0.05)。 由图2(c)可知,不同浓度PrP 暴露 4 d 时,480 μg·L-1处理组中大型溞壳刺长度平均值仅为对照组均值的0.86 倍,显著小于其他组(P<0.05);暴露 8 d 后,12 μg·L-1处理组的大型溞壳刺长度平均值为对照组均值的1.15 倍,显著大于其他组(P<0.05)。
在图2(d)中,PrP 暴露4 d 后,各组间大型溞复眼面积并无显著差异(P>0.05);暴露 8 d 后,12 μg·L-1 PrP 处理组大型溞复眼面积显著增加(P<0.05)。由图2(e)可知,PrP 暴露4 d 后,480 μg·L-1处理组大型溞的体表面积显著大于对照组(P<0.05);暴露8 d后,各处理组中大型溞的体表面积均显著大于对照组(P<0.05);其中,12 μg·L-1处理组变化最显著,该组平均值为对照组均值的1.35 倍。
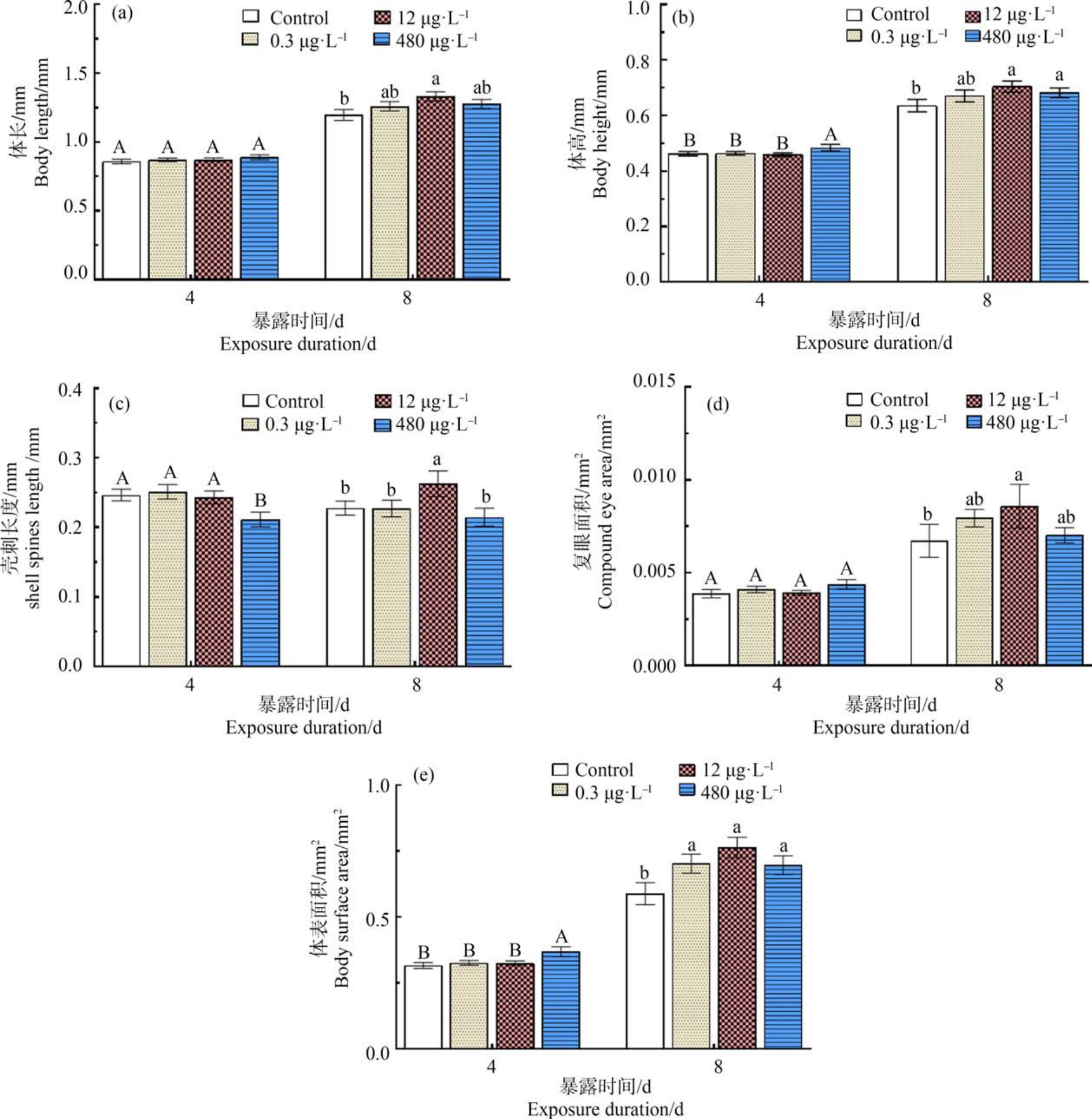
图2 不同PrP 处理组暴露4 d 和8 d 后大型溞表型的变化
注:柱形图上的不同字母代表相同处理时间点不同PrP 处理组间的显著差异(P<0.05);n=30,下同。
Fig.2 Changes of phenotypes of Daphnia magna in the different PrP treatment groups after exposure for 4 d and 8 d
Note: Different letters on the bars represent significant differences between the PrP treatment groups after the same exposure times (P<0.05); n=30, the same as follows.
相比暴露4 d,PrP 暴露8 d 后大型溞的体长、体高、复眼面积和体表面积均显著增长;统计数据表明大型溞的发育异常主要表现为:暴露4 d 后,480 μg·L-1 PrP 处理组体高、体长变化显著;暴露8 d 后,12 μg·L-1 PrP 处理组表型变化最显著,表现为促进大型溞的生长发育。
由图 3(a)可知,PrP 暴露 4 d 和 8 d 后,各处理组心率变化显著(P<0.05),其中480 μg·L-1处理组心率最高,刺激反应显著(P<0.05)。 而随暴露时间延长,0.3 μg·L-1处理组暴露8 d 时的心率较暴露4 d 时显著降低(P<0.05)。 在图 3(b)中,PrP 暴露 4 d 后,480 μg·L-1处理组心脏面积显著大于对照组(P<0.05);暴露8 d 后,12 μg·L-1处理组心脏面积平均值为对照组的均值1.33 倍,增长程度显著高于其他处理组(P<0.05)。 相比暴露 4 d,PrP 暴露 8 d 时大型溞的心脏面积显著增长(P<0.05);综上可知,大型溞暴露于不同浓度的PrP 4 d 和8 d 后,心脏面积和心率均受到影响,表明PrP 对大型溞具有心脏毒性。

图3 不同PrP 处理组暴露4 d 和8 d 对大型溞心脏的影响
注:柱形图上的不同字母代表相同处理时间点不同PrP 处理组间的显著差异(P<0.05),*代表相同剂量PrP 暴露不同时间后的显著差异(P<0.05);n=30,下同。
Fig.3 Effects on Daphnia magna hearts in the different PrP treatment groups after exposure for 4 d and 8 d
Note: Different letters on the bars represent significant differences between the PrP treatment groups after the same exposure times (P<0.05), and stars (*) on the bars represent significant differences after different times between the same PrP treatment groups (P<0.05); n=30, the same as follows.
2.2 PrP 对大型溞解毒和生长发育相关基因表达的影响
在不同浓度的PrP 暴露条件下,cat 基因的mRNA 表达量变化趋势如图4(a)所示,暴露4 d 后,0.3 μg·L-1 和 12 μg·L-1 处理组 cat 基因的表达量显著上调(P<0.05),480 μg·L-1处理组显著下调(P<0.05);暴露8 d 时,PrP 各处理组均与对照组无显著差异(P>0.05),但 0.3 μg·L-1处理组显著小于 12 μg·L-1处理组(P<0.05)。 图 4(b)中,暴露 4 d 后,12 μg·L-1 PrP 处理组gst 基因的相对表达量显著下调(P <0.05);暴露8 d 时,PrP 各处理组均与对照组无显著差异(P>0.05)。 图 4(c)展示 hr96 基因的 mRNA 表达量的变化趋势,暴露 4 d 时,0.3 μg·L-1 PrP 处理组hr96 基因的表达量显著上调(P<0.05),480 μg·L-1 PrP 处理组显著下调(P<0.05);暴露 8 d 后,PrP 各处理组hr96 基因的表达量均无显著变化(P<0.05);但0.3 μg·L-1 PrP 暴露 4 d 后 hr96 基因的表达量显著大于8 d 处理组(P<0.05)。 综上可知,暴露4 d 时,大型溞的解毒相关基因具有一定的剂量效应;暴露时间延长至8 d 时,各处理组解毒相关基因与对照组无显著差异(P>0.05)。
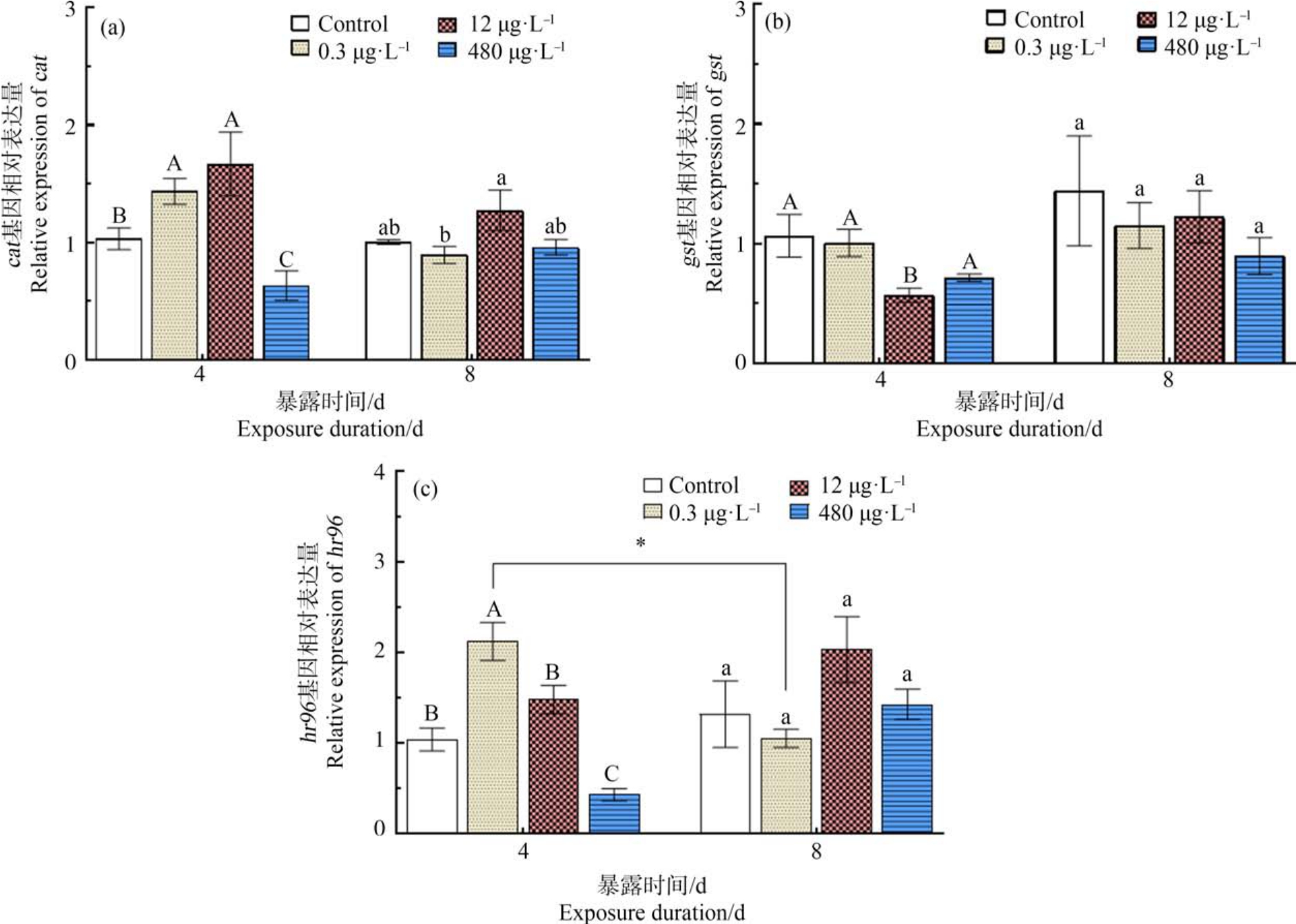
图4 不同PrP 处理组暴露4 d 和8 d 对大型溞解毒相关基因表达的影响
Fig.4 Effects on detoxification-related genes of Daphnia magna in the different PrP treatment groups after exposure for 4 d and 8 d
由图 5(a)可知,0.3 μg·L-1 PrP 处理组 cyp314基因的mRNA 表达量先显著上调(4 d,P<0.05)后又显著下降(8 d,P<0.05)。 图 5(b)中,480 μg·L-1 PrP处理组暴露4 d 后vtg 基因的表达量显著下调(P<0.05);暴露8 d 后,PrP 各处理组vtg 基因的表达量均显著下调(P<0.05)。 由图 4 和图 5 可知,暴露4 d后,cyp314、vtg 基因表达量的变化与解毒相关基因的变化基本保持同步;暴露 8 d 后,cat、gst、hr96 和cyp314 等基因无显著变化,但PrP 各处理组vtg 基因的表达量受到显著抑制。
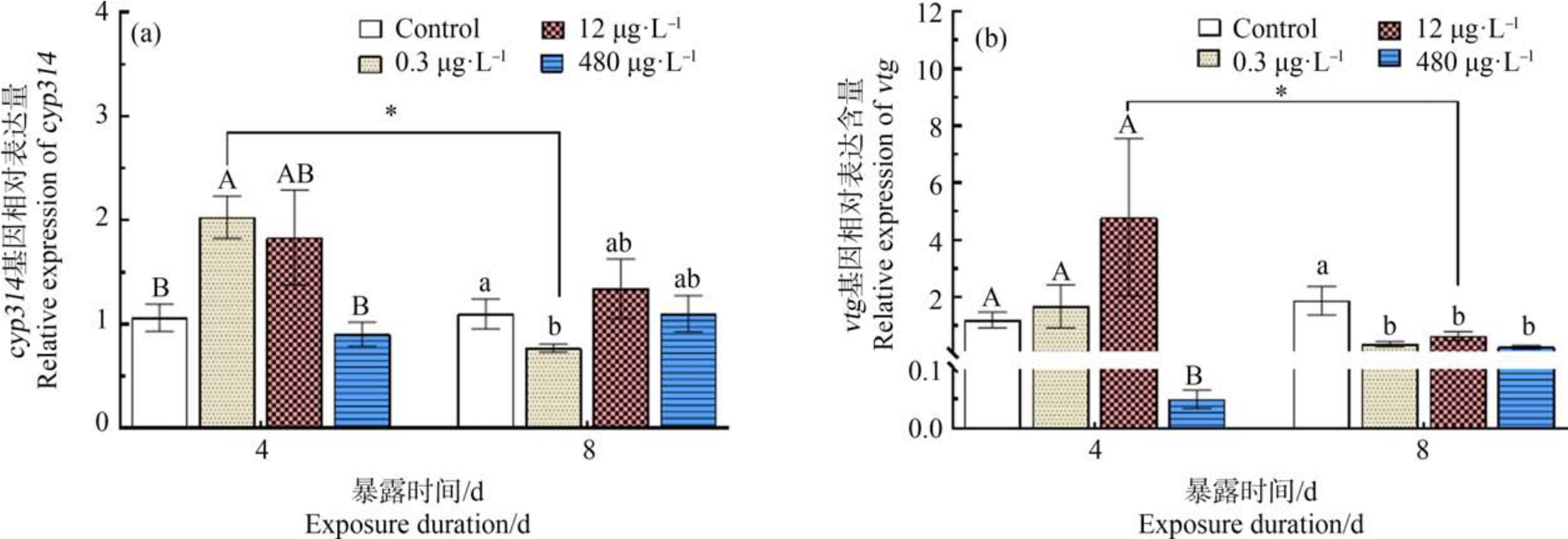
图5 不同PrP 处理组暴露4 d 和8 d 对大型溞生长发育相关基因表达的影响
Fig.5 Effects on growth and development genes of Daphnia magna in the different PrP treatment groups after exposure for 4 d and 8 d
3 讨论(Discussion)
3.1 PrP 暴露对大型溞生长发育的影响
大型溞的自然增长率比生殖参数更加敏感,大型溞被低浓度污染物刺激后,受到轻度逆境胁迫,可促使其瞬时增长率增大,以此来抵御外部不良的环境条件[31]。 本研究中,12 μg·L-1 PrP 处理组大型溞的体长、体高、壳刺长、复眼面积和体表面积均显著大于对照组,表明PrP 促进了大型溞的生长发育。这与一些研究结果相似,黄国兰等[32]研究发现1.0、2.0 和4.0 mg·L-1的邻苯二甲酸二丁酯(DBP)对大型溞繁殖有抑制作用,而0.5 mg·L-1的DBP 显著提高了大型溞的净生殖率;刘青等[31]发现低浓度组(0.432、0.768 和1.120 μg·L-1)印楝素暴露大型溞后,内禀增长率与对照组相比也略有提高。 这些结果表明,大型溞种群动态受到了影响,这种刺激作用干扰了大型溞正常的生长发育,可能会造成大型溞的生命周期紊乱或产生致肥效应。
卵黄素的产生受雌激素的控制,所以常被用作雌激素化合物的生物标志物[33-34]。 暴露4 d 后12 μg·L-1 PrP 处理组vtg 基因的表达量不稳定,可能与大型溞的个体差异有关;暴露4 d 后,cyp314、vtg基因的表达量随着PrP 浓度的升高先增加后下降,呈抛物线型剂量-效应关系;低浓度 PrP 可刺激cyp314、vtg 的表达,具有雌激素效应,但高浓度的PrP 暴露可能对大型溞具有毒害作用,表现为毒性效应,造成大型溞的组织细胞损伤和表型变化。 由此说明,PrP 对大型溞蜕皮激素与卵黄蛋白的合成造成影响,并诱导了大型溞的生长发育异常。
此外,大型溞的生长发育过程中,表型变化相对于基因表达具有一定的滞后性,PrP 暴露4 d 的条件下基因的变化可能造成暴露8 d 时大型溞的发育异常。 Jemec 等[35]研究发现,13.8 mg·L-1(亚致死浓度)BPA 暴露21 d 后,大型溞体长和平均产卵量降低,并显著抑制了CAT 和GST 的酶活性。 本研究中,PrP 暴露8 d 时,各处理组vtg 基因的mRNA 表达量均受到抑制,可能与大型溞体内的活性氧积累引起的抗氧化与解毒反应的能量消耗有关,从而抑制了大型溞卵黄蛋白的产生,使大型溞的发育受到影响。Wang 等[17]发现布洛芬(IBU)暴露后大型溞也出现了类似的现象,IBU 的存在引发的解毒过程也可能消耗大量的能量,导致机体生长和产卵所需的能量减少,产卵量减少,从而导致生殖能力下降。
3.2 PrP 暴露对大型溞的心脏毒性
大型溞心脏器官与其他节肢动物不同,是肌源性的,由一层肌肉细胞组成,在生理水平上可响应各种内源性信号分子,如生物体内产生和循环的激素和神经递质[27]。 心率是反映污染物对大型溞血液循环系统影响的敏感生理指标[36]。 研究发现,PrP 可与血浆蛋白结合,导致运输激素的外周活动紊乱[37]。本研究中,480 μg·L-1 PrP 暴露 4 d 后,大型溞心率激增且心脏面积显著增加,cat 基因的相对表达量显著下调,表明PrP 对心脏具有显著的毒性作用。 也可能是由于PrP 在短时间、高浓度的刺激下,大型溞发生了氧化应激反应,扰乱了大型溞的正常生理功能。
生物在转录水平上的变化,尤其是暴露于环境污染物时解毒系统所涉及的基因表达变化可提供最早期的警告信号[36]。 PrP 暴露 4 d 后,0.3 μg·L-1和12 μg·L-1处理组大型溞解毒相关基因相对表达量显著上调,生物体通过调节cat、gst 活性来清除活性氧以避免氧化损伤;而大型溞在480 μg·L-1处理组的重度胁迫下,cat 活性降低,过度积累活性氧(ROS)会导致有机体损伤。 Silva 等[38]的研究表明,对羟苯甲酸酯类物质的暴露导致了尼罗罗非鱼鳃和肝细胞的生化变化,调节鱼鳃和肝脏的抗氧化剂活性显著增加;Wang 等[39]的研究表明,暴露于啶酰菌胺会降低斑马鱼胚胎的超氧化物歧化酶(SOD)活性,增加CAT 活性,并诱导氧化应激;Cui 等[40]研究发现,在急性接触氯虫苯甲酰胺、氰虫苯甲酰胺和氟苯甲酰胺等农药后,大型溞体内也观察到类似的抗氧化酶活性变化。 本实验中,暴露 4 d 后,cat、hr96 基因的表达量随着浓度升高呈现先升高后下降的趋势,具有抛物线型剂量-效应关系。 大型溞暴露于PrP 的整个周期中,cat、hr96 的表达量变化基本保持同步,其同步的原因可能是PrP 胁迫大型溞时cat、hr96 协同调节生长发育。 然而,由于调控机制的复杂性,后期需要研究更多参与抗氧化解毒系统的基因的变化,如 nrf2、nqo1 和 gpx 等[29]。
通过研究PrP 对大型溞生理变化(如体长、壳刺长、体表面积和心跳等)的影响,分析所选的5个基因(cat、gst、hr96、cyp314、vtg)的表达量来评估 PrP 对大型溞的毒性作用及分子机制。 PrP 暴露对大型溞的生长发育具有促进作用,呈现一定的时间与剂量效应,且PrP 暴露对大型溞具有一定的心脏毒性效应。 暴露4 d 时,大型溞解毒相关基因(cat、gst 和hr96)与生长发育相关基因(cyp314、vtg)的表达量的变化基本保持同步,并呈现一定的剂量效应,表明这5个基因协同调节大型溞的解毒过程与生长发育过程。 综上所述,PrP 能影响大型溞正常的生长发育,研究结果可为PrP 的环境风险表征提供生态毒理数据。
[1]林忠洋, 马万里, 齐迹, 等. 对羟基苯甲酸酯类防腐剂的人体暴露[J]. 化学进展,2015,27(5):614-622
Lin Z Y, Ma W L, Qi J, et al. Human exposure to parabens [J]. Progress in Chemistry,2015,27(5): 614-622 (in Chinese)
[2]Guo Y,Kannan K.A survey of phthalates and parabens in personal care products from the United States and its implications for human exposure [J]. Environmental Science& Technology,2013,47(24):14442-14449
[3]Kimura K, Kameda Y, Yamamoto H, et al. Occurrence of preservatives and antimicrobials in Japanese rivers [J].Chemosphere,2014,107:393-399
[4]Yamamoto H, Tamura I, Hirata Y, et al. Aquatic toxicity and ecological risk assessment of seven parabens:Individual and additive approach [J]. The Science of the Total Environment,2011,410-411:102-111
[5]González-Mariño I,Quintana J B,Rodríguez I,et al.Simultaneous determination of parabens, triclosan and triclocarban in water by liquid chromatography/electrospray ionisation tandem mass spectrometry [J]. Rapid Communications in Mass Spectrometry,2009,23(12):1756-1766
[6]Brooks B W,Riley T M,Taylor R D.Water quality of effluent-dominated ecosystems:Ecotoxicological,hydrological, and management considerations [J]. Hydrobiologia,2006,556(1):365-379
[7]Ankley G T, Brooks B W, Huggett D B, et al. Repeating history: Pharmaceuticals in the environment [J]. Environmental Science & Technology,2007,41(24):8211-8217
[8]Lee J, Bang S H, Kim Y H, et al.Toxicities of four parabens and their mixtures to Daphnia magna and Aliivibrio fischeri [J]. Environmental Health and Toxicology, 2018,33(4): e2018018
[9]田佳林, 李伟轲, 杨成顺. 对羟基苯甲酸甲酯对早孕小鼠子宫内膜蜕膜化的影响[J]. 中国细胞生物学学报,2020,42(6):954-961
[10]Ma W L,Zhao X,Lin Z Y,et al.A survey of parabens in commercial pharmaceuticals from China and its implications for human exposure [J]. Environment International,2016,95:30-35
[11]Pedersen K L, Pedersen S N, Christiansen L B, et al.The preservatives ethyl-, propyl- and butylparaben are oestrogenic in an in vivo fish assay [J]. Pharmacology & Toxicology,2000,86(3):110-113
[12]董力, 张明, 李立, 等. 对羟基苯甲酸丙酯对人角质形成细胞毒作用研究[J]. 环境与健康杂志, 2010, 27(5):420-421
Dong L, Zhang M, Li L, et al. Cytotoxicity of n-propylparaben to HaCat keratinocytes in culture [J]. Journal of Environment and Health, 2010, 27(5): 420-421 (in Chinese)
[13]Gliwicz Z M. Species-specific population-density thresholds in cladocerans? [J]. Hydrobiologia, 2001, 442(1):291-300
[14]Chatterjee N,Choi S,Kwon O K,et al.Multi-generational impacts of organic contaminated stream water on Daphnia magna:A combined proteomics,epigenetics and ecotoxicity approach [J].Environmental Pollution,2019,249:217-224
[15]Huggett R J, Kimerle A R. Biomarkers: Biochemical,physiological and histological makers of anthropogenic stress [J]. Review of Gastroenterology, 1992, 14(9): 615-617
[16]Zhang Q M, Zhang G L, Yin P J, et al. Toxicological effects of soil contaminated with spirotetramat to the earthworm Eisenia fetida [J]. Chemosphere, 2015, 139:138-145
[17]Wang L, Peng Y, Nie X P, et al. Gene response of CYP360A, CYP314, and GST and whole-organism changes in Daphnia magna exposed to ibuprofen [J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology,2016,179:49-56
[18]Karimullina E, Li Y C, Ginjupalli G K, et al. Daphnia HR96 is a promiscuous xenobiotic and endobiotic nuclear receptor [J]. Aquatic Toxicology,2012,116-117:69-78
[19]Adhitama N,Matsuura T,Kato Y,et al.Monitoring ecdysteroid activities using genetically encoded reporter gene in Daphnia magna [J]. Marine Environmental Research,2018,140:375-381
[20]Matozzo V, Gagné F, Marin M G, et al. Vitellogenin as a biomarker of exposure to estrogenic compounds in aquatic invertebrates: A review [J]. Environment International,2008,34(4):531-545
[21]Le T H, Lim E S, Lee S K, et al. Effects of glyphosate and methidathion on the expression of the dhb, vtg, arnt,CYP4 and CYP314 in Daphnia magna [J]. Chemosphere,2010,79(1):67-71
[22]Liu Y,Wang L,Pan B B,et al.Toxic effects of diclofenac on life history parameters and the expression of detoxification-related genes in Daphnia magna [J]. Aquatic Toxicology,2017,183:104-113
[23]杨灿, 沈根祥, 胡双庆, 等. 氯霉素对大型溞的急性和慢性毒性效应研究[J].生态毒理学报,2018,13(5):248-255
Yang C, Shen G X,Hu S Q,et al.Acute and chronic toxicity of chloramphenicol to Daphnia magna [J]. Asian Journal of Ecotoxicology, 2018, 13(5): 248-255 (in Chinese)
[24]Dobbins L L, Usenko S, Brain R A, et al. Probabilistic ecological hazard assessment of parabens using Daphnia magna and Pimephales promelas [J].Environmental Toxicology and Chemistry,2009,28(12):2744-2753
[25]Terasaki M, Makino M, Tatarazako N. Acute toxicity of parabens and their chlorinated by-products with Daphnia magna and Vibrio fischeri bioassays [J]. Journal of Applied Toxicology,2009,29(3):242-247
[26]Pablos M V,García-Hortigüela P,Fernández C.Acute and chronic toxicity of emerging contaminants, alone or in combination,in Chlorella vulgaris and Daphnia magna[J].Environmental Science and Pollution Research International,2015,22(7):5417-5424
[27]Bownik A. Physiological endpoints in daphnid acute toxicity tests [J]. The Science of the Total Environment,2020,700:134400
[28]Zheng Y, Yuan J L, Gu Z M, et al. Transcriptome alterations in female Daphnia (Daphnia magna) exposed to 17β-estradiol [J]. Environmental Pollution, 2020, 261:114208
[29]Liu S J, Ding R, Nie X P. Assessment of oxidative stress of paracetamol to Daphnia magna via determination of Nrf1 and genes related to antioxidant system [J]. Aquatic Toxicology,2019,211:73-80
[30]Hannas B R, Wang Y H, Thomson S, et al. Regulation and dysregulation of vitellogenin mRNA accumulation in daphnids (Daphnia magna) [J]. Aquatic Toxicology,2011,101(2):351-357
[31]刘青, 李扬, 何芳, 等. 印楝素对大型溞生存、生长和繁殖的毒性效应[J].大连海洋大学学报,2013,28(2):121-126
Liu Q, Li Y, He F, et al. The toxicity of azadirachtin to survival, growth and reproduction of water fleas Daphnia magna [J]. Journal of Dalian Ocean University, 2013, 28(2):121-126 (in Chinese)
[32]黄国兰, 孙红文, 高娟, 等. 邻苯二甲酸二丁酯对大型蚤(Daphnia magna)的毒性作用研究[J]. 环境化学,1998,17(5):428-433
Huang G L,Sun H W,Gao J,et al.Study on toxic effects of dibutyl phthalate on Daphnia magna [J].Environmental Chemistry,1998,17(5):428-433 (in Chinese)
[33]Kato Y, Tokishita S, Ohta T, et al. A vitellogenin chain containing a superoxide dismutase-like domain is the major component of yolk proteins in cladoceran crustacean Daphnia magna [J]. Gene,2004,334:157-165
[34]Jones P D,de Coen W M,Tremblay L,et al.Vitellogenin as a biomarker for environmental estrogens [J].Water Science and Technology,2000,42(7-8):1-14
[35]Jemec A, Tišler T, Erjavec B, et al.Antioxidant responses and whole-organism changes in Daphnia magna acutely and chronically exposed to endocrine disruptor bisphenol A [J]. Ecotoxicology and Environmental Safety,2012,86:213-218
[36]Liang R Y,He J,Shi Y J,et al.Effects of Perfluorooctane sulfonate on immobilization, heartbeat, reproductive and biochemical performance of Daphnia magna [J]. Chemosphere,2017,168:1613-1618
[37]Bronowicka-Kłys D E, Lianeri M, Jagodziński P P. The role and impact of estrogens and xenoestrogen on the development of cervical cancer [J]. Biomedicine & Pharmacotherapy,2016,84:1945-1953
[38]Silva D C, Serrano L, Oliveira T M A, et al. Effects of parabens on antioxidant system and oxidative damages in Nile tilapia (Oreochromis niloticus) [J]. Ecotoxicology and Environmental Safety,2018,162:85-91
[39]Wang H L, Meng Z, Liu F S, et al. Characterization of boscalid-induced oxidative stress and neurodevelopmental toxicity in zebrafish embryos [J]. Chemosphere, 2020,238:124753
[40]Cui F, Chai T T, Qian L, et al. Effects of three diamides(chlorantraniliprole, cyantraniliprole and flubendiamide)on life history, embryonic development and oxidative stress biomarkers of Daphnia magna [J]. Chemosphere,2017,169:107-116