我国的饮用水水源以地表水为主,研究表明,目前仍有23.2%的湖泊为Ⅳ至Ⅴ类水,普遍存在水体富营养化的问题[1]。 水体富营养化极易引起藻类爆发性生长[2],藻源嗅味污染是藻类爆发产生的最直观的危害之一。 藻源嗅味的存在会直接影响饮用水的感官性状,降低水的品质,引起人们的广泛关注[3]。 藻源有机物是一类由蛋白质、脂肪胺和多糖等多种成分组成的复杂混合物,是嗅味、藻毒素等藻类次生代谢产物的溶剂和重要载体,这些藻源有机物还是一些消毒副产物(如三卤甲烷、亚硝胺等)的重要前体物质[4],因此研究藻源有机物的特性对于水体中的嗅味物质及其他毒性有机物的去除具有重要意义。
鱼腥藻是一种常见的水华蓝藻,也是某些自然水体中的优势藻类[5-7]。 有研究报道,2008—2009年间,水华鱼腥藻是巢湖春季水华的优势藻种,且其一年中的出现频率为86.09% [8]。 鱼腥藻也是水体中土霉味如2-甲基异莰醇(2-methylisoborneol, 2-MIB)和土臭素(geosmin, GSM)等的重要来源之一。邱丽佳[9]发现由于螺旋鱼腥藻的固氮作用,其在水体中的繁殖速度远超过铜绿微囊藻,且其所产的2-MIB 的污染程度更甚于 β-环柠檬醛。 陈克云[10]研究发现不同氮源及磷源条件下,螺旋鱼腥藻生长过程中代谢产生的GSM 主要分布在藻细胞内,胞外含量低于10%。 其他一些藻类如单细胞的铜绿微囊藻、多细胞的鱼腥藻和颤藻都可以产生嗅味物质,且嗅味物质大多从藻细胞内部产生,随藻的代谢过程从胞内排出,故藻的胞外有机物(extracellular organic matter, EOM)和胞内有机物(intracellular organic matter, IOM)中嗅味物质的含量和种类也有所差别,且随着生长阶段的变化,藻的胞内外的嗅味物质的含量也会发生变化[11]。
研究不同生长阶段的藻的胞内外有机物特性和产嗅特性,对于藻类次生代谢产物的生成和控制有着重要意义,无论是对水源地的水质保护,还是对饮用水厂的工艺调控都有着重要参考价值[12]。 目前少有学者探究水华鱼腥藻(Anabaena aquae)的有机物特性,因此选用作为实验藻类,了解其生长情况及产嗅特性,为实际水体藻污染的控制提供参考。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
BG-11 培养基购自青岛海博生物技术有限公司;水华鱼腥藻(Anabaena aquae)种购自中国科学院武汉水生生物研究所的“中国科学院淡水藻种库”,编号为FACHB-245;配制培养基所用水为超纯水(德国 Merck 公司,Milli-Q 纯水机)。
人工气候箱(德国 Binder 公司,KBWF240),全自动固相萃取仪(中国睿科仪器有限公司,Auto SPE 06PLUS),气相色谱/质谱联用仪(美国ThermoFisher Scientific 公司,DSQ-MS200383),紫外分光光度计(中国北京普析通用仪器有限责任公司,TU-1810),荧光激发-发射矩阵光谱仪(日本 Hitachi 公司,F-2700),液相-有机碳-有机氮联用仪(LC-OCD-OND,德国 LC-OCD 公司,DOC-Labor 第 9 代)。
1.2 试验方法
1.2.1 鱼腥藻培养和生长曲线建立
选用BG-11 培养基接种鱼腥藻,在25 ℃下恒温培养,光照强度2 000 lx,每天光照12 h [13],每日手动摇藻2 次,早8:00 晚8:00 各1 次,每次摇藻5 min,使藻悬浮,不贴壁生长。 当藻液浓度增大,藻种较为充分时,可使用曝气培养柱进一步扩大养殖,藻液和培养基的比例为1∶5。 采用光密度值(optical density value, OD)来表征藻密度,摇动藻液使其悬浮,后于固定点位取鱼腥藻藻液在685 nm 波长下测定紫外吸光度[14],测定不同培养时间的水华鱼腥藻的OD 值,建立其生长曲线。
实验设计要取不同生长阶段的水华鱼腥藻对其藻源有机物的变化情况进行分析,因此建立了水华鱼腥藻生长曲线,通过OD 值、生长曲线和培养时间共同确定水华鱼腥藻的生长阶段。 水华鱼腥藻的生长周期分为4个阶段,分别为停滞期、对数生长期(又称指数生长期)、稳定期和衰亡期(又称生长末期)[15]。 如图1(a)所示,在 25 ℃恒温培养下,接种培养时保持较大的藻密度,生长停滞期大大缩短,在一周之后就可以进入对数生长期,通过对生长曲线的拟合,可以看出在OD 值在0.4 左右之后可以达到对数生长期。 30 d 左右时水华鱼腥藻已经进入稳定生长期,丝状藻的比表面积大,获取养分的能力较强,在增长过程中除了藻个数的增加,还有单个丝状藻的长度和体积变化。 在生长曲线测量过程中,没有补充培养基,故后期的生长空间有限,生长周期大大缩短。 一般稳定期持续的时间比较长,在培养过程定期补充培养基,保持藻的生长空间足够,并保持较低的温度,则生长周期会相对延长[9]。
为了探究水华鱼腥藻不同生长阶段藻源产嗅特性和有机物特性,分别提取来自同一接种源的不同迭代次数的对数生长期鱼腥藻和衰亡期的鱼腥藻藻液冻融离心提取有机物,进行对比分析,初始状态如表1、图1(b)和图1(c)所示。 对数生长期的鱼腥藻色泽比较清透,OD 值比较小,衰亡期藻密度比较大,颜色较深,藻液较为浑浊。
表1 水华鱼腥藻初始参数值
Table 1 Initial data of Anabaena aquae

注:EOM 为胞外有机物;IOM 为胞内有机物;TOC 为总有机碳;OD 值为光密度值。
Note: EOM is extracellular organic matter; IOM is intracellular organic matter; TOC is total organic carbon; OD value is optical density value.
生长阶段Growth phase OD 值OD value叶绿素 a/(μg·L-1)Chlorophyll a/(μg·L-1)EOM 的 TOC/(mg·L-1)TOC of EOM/(mg·L-1)IOM 的 TOC/(mg·L-1)TOC of IOM/(mg·L-1)对数生长期Logarithmic phase 0.45 1 751.20 4.60 49.95衰亡期Decline phase 1.27 6 108.40 26.66 79.36

图1 水华鱼腥藻的生长曲线及其不同生长期外观
注:(a)水华鱼腥藻生长曲线;(b)水华鱼腥藻对数生长期外观;(c)水华鱼腥藻衰亡期外观。
Fig.1 The growth curve and appearance at different growth phases of Anabaena aquae
Note: (a) The growth curve of Anabaena aquae;(b) Appearance at logarithmic phase of Anabaena aquae;(c) Appearance at decline phase of Anabaena aquae.
1.2.2 藻源有机物提取
采用冻融离心法[16-17]进行藻源有机物的提取,分为EOM 和IOM。 分别采集处于特定生长阶段标准鱼腥藻藻液(对数生长期OD 值约为0.4,衰亡期OD 值约为1.3)置于塑料离心管中,转速8 000 r·min-1,离心10 min,去除上清液后得到藻细胞,本实验意在研究相对分子量<20 kDa 的藻源有机物特性,因此将上清液经过0.45 μm 的Millipore 醋酸纤维滤膜过滤,得到EOM 溶液。 将离心的藻细胞用0.8%的NaCl 溶液清洗2 遍,得到不含培养基的纯净藻细胞,重新溶于超纯水中,保持与EOM 的体积相同,在高低温交变箱中反复冻融4 次(-20 ℃冰冻10 h,37 ℃融化2 h),最后融化之后将藻溶液超声40 min,破碎藻细胞壁,使有机物充分释放后,转速8 000 r·min-1离心 15 min 取上清液,经 0.45 μm 的滤膜过滤,得到IOM 溶液。 将提取后的IOM、EOM溶液进行总有机碳(total organic carbon, TOC)分析,以便配制成标准溶液。
由于鱼腥藻内部含有藻蓝蛋白,提取的IOM 溶液呈淡蓝紫色,EOM 溶液基本无色,如图2 所示。

图2 不同水华鱼腥藻源有机物溶液外观
注:(a)IOM 溶液;(b)EOM 溶液。
Fig.2 The appearance of different organic matter solution derived by Anabaena aquae
Note: (a) IOM solution; (b) EOM solution.
1.2.3 嗅味物质检测
嗅味物质采用顶空固相萃取-气相色谱/质谱联用(HS-SPE-GC/MS)方法进行检测,可同时测定10种嗅味物质:2-MIB、GSM、2-异丙基-3-甲氧基吡嗪(2-methoxy-3-propan-2-ylpyrazine, IBMP)、异佛尔酮(isophorone, IPO)、2-异丁基-甲氧基吡嗪(2-methoxy-3-(2-methyl propyl)pyrazine, IPMP)、β-环柠檬醛(βcyclocitral)、2,4,6-三氯苯甲醚(2,4,6-trichloroanisole,2,4,6-TCA)、2,3,6-三氯苯甲醚(2,3,6-trichloroanisole,2,3,6-TCA)、β-紫罗兰酮(β-ionone)和 2,3,4-三氯苯甲醚(2,3,4-trichloroanisole,2,3,4-TCA)。
固相萃取采用HLB 固相萃取小柱(美国Waters公司,Oasis® WAX 6cc/150 mg,编号 186002493),每次均采用新柱,用甲醇和纯水对小柱进行活化,固相萃取水样为400 mL,上样速度为15 mL·min-1,用二氯甲烷进行洗脱。 采用气相色谱/质谱联用仪进行检测,毛细管柱为DB-VRX,高纯氦气为载气,电子轰击源为 EI 源[18-19]。
1.2.4 荧光分析
三维荧光光谱(excitation-emission-matrix spectra, EEMs)采用荧光光度计测量,激发波长(excitation, Ex)范围为220 ~ 450nm,发射波长(emission,Em)范围为 220 ~550nm,步长 5nm(表 2)。 所得数据通过excel 及origin 处理之后得到三维荧光谱图,图中不同区域代表的有机物不同,通过确定峰位置和荧光强弱的变化,实现对有机物含量变化的定性半定量分析[20]。
表2 三维荧光谱图分区
Table 2 Partition of excitation-emissionmatrix spectra
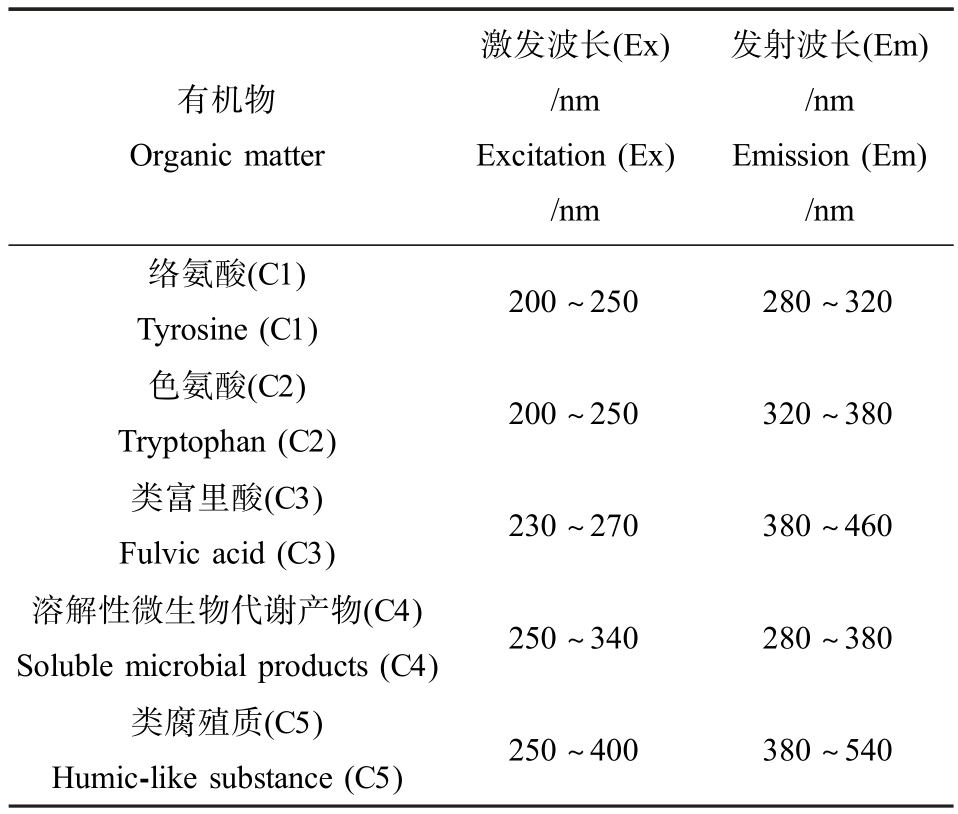
有机物Organic matter激发波长(Ex)/nm Excitation (Ex)/nm发射波长(Em)/nm Emission (Em)/nm络氨酸(C1)Tyrosine (C1) 200 ~250 280 ~320色氨酸(C2)Tryptophan (C2) 200 ~250 320 ~380类富里酸(C3)Fulvic acid (C3) 230 ~270 380 ~460溶解性微生物代谢产物(C4)Soluble microbial products (C4) 250 ~340 280 ~380类腐殖质(C5)Humic-like substance (C5) 250 ~400 380 ~540
1.2.5 LC-OCD 分析
液相色谱-有机碳检测联用法(LC-OCD)是一种新兴的有机物表征手段,应用于饮用水中天然有机物表征、膜污染特性研究及藻源溶解性有机氮(dissolved organic nitrogen, DON)检测表征等领域[21-22],具有操作简单、检测结果全面等优点。 其原理为通过尺寸排阻色谱将有机物按照分子量进行分离,然后进行各组分的有机碳检测(organic carbon detection, OCD)、紫外检测(ultraviolet detection, UVD)和有机氮检测(organic nitrogen detection, OND),最后进行汇总分析。 其可将水中的有机物划分为5个部分,分别是生物聚合物(biopolymers, BP)、腐殖质(humic substances, HS)、有机物结构单元或腐殖酸降解产物(building blocks, BB)、低分子量酸性物质(acids and low molecular weight humics, LMWA)以及低分子量中性物质(low molecular weight humics-neutrals,LMWN)[23],此外还可以将有机碳细分为总有机碳(total organic carbon, TOC)、溶解性有机碳(dissolved organic carbon, DOC)、疏水有机碳(hydrophobic organic carbon, HOC)、亲水有机碳(hydrophilic organic carbon, CDOC)和颗粒性有机碳(particulate organic carbon, POC)。
LC-OCD 的检测条件为:将水样放置到特定进样瓶中,实际进样体积1 000 μL,每个样品总运行时间为70 min,使用特定软件对实验结果进行峰积分得出实验结果。
2 结果(Results)
2.1 产嗅特征
对鱼腥藻不同生长阶段的EOM 和IOM 进行嗅味检测,结果如表3 所示。 由表3 可知,嗅味物质主要存在于IOM 中,其主要成分有β-环柠檬醛和β-紫罗兰酮、IPO 和少量GSM。 其中IPO 主要存在于衰亡期的 EOM 和 IOM 中,β-环柠檬醛和 β-紫罗兰酮主要存在于IOM 中。 对比对数生长期的IOM 和衰亡期的IOM 发现,对数生长期胞内的嗅味物质含量比衰亡期要多。
表3 对数生长期和衰亡期的嗅味物质
Table 3 Taste and odor (T&O) compounds at logarithmic phase and decline phase

嗅味物质种类Types of T&O compounds对数生长期EOM/(ng·L-1)EOM of logarithmic phase/(ng·L-1)衰亡期EOM/(ng·L-1)EOM of decline phase/(ng·L-1)对数生长期IOM/(ng·L-1)IOM of logarithmic phase/(ng·L-1)衰亡期IOM/(ng·L-1)IOM of decline phase/(ng·L-1)2-甲基异莰醇2-methylisorphenol 0.00 11.54 0.00 42.67土臭素Geosmin 8.91 10.62 62.34 73.25 2-异丙基-3-甲氧基吡嗪2-methoxy-3-propan-2-ylpyrazine 0.00 0.00 0.00 0.00异佛尔酮Isophorone 1.11 241.82 1.96 114.61 2-异丁基-甲氧基吡嗪2-methoxy-3-(2-methyl propyl)pyrazine 16.98 0.41 0.00 0.55 β-环柠檬醛 β-cyclocitral 0.00 8.71 1 084.92 440.99 2,4,6-三氯苯甲醚2,4,6-trichloroanisole 0.00 4.49 0.00 0.00 2,3,6-三氯苯甲醚2,3,6-trichloroanisole 11.69 0.00 0.00 31.67 β-紫罗兰酮 β-ionone 0.00 0.00 2 181.62 722.22 2,3,4-三氯苯甲醚2,3,4-trichloroanisole 0.00 0.00 19.27 15.90
2.2 藻源有机物荧光特性
由三维荧光扫描结果(图3)可知,对比胞内胞外,其有机物组分差异较大,鱼腥藻EOM 中主要有类腐殖质和溶解性微生物代谢产物(soluble metabolic products, SMP),IOM 中主要含有SMP 和络氨酸、色氨酸。 对比不同生长阶段,EOM 中的有机物种类并无变化,仅是荧光强度增强。 而对于IOM 而言,由对数生长期到衰亡期,类腐殖质消失,SMP 和络氨酸、色氨酸的荧光响应也随着减弱。观察鱼腥藻的不同生长阶段的胞内胞外物质荧光在C4 区域的变化情况可以看出,SMP 主要存在于鱼腥藻IOM 中,其在对数生长期的强度比衰亡期要大。 在鱼腥藻的 EOM 中,也含有 SMP,但比 IOM中的强度要弱,且随着生长阶段的变化,衰亡期鱼腥藻的EOM 中SMP 逐渐增多。

图3 不同生长期的EOM 和IOM
注:(a)对数生长期EOM;(b)对数生长期IOM;(c)衰亡期EOM;(d)衰亡期IOM。
Fig.3 EOM and IOM in different growth stages
Note: (a) EOM of logarithmic phase; (b) IOM of logarithmic phase; (c) EOM of decline phase; (d) IOM of decline phase.
如图4 所示,对于IOM 而言,对数生长期IOM中所含有机物的荧光强度要比衰亡期高,而EOM则相反,对数生长期中EOM 的有机物总量比衰亡期要少。 从荧光强度值上来看,类腐殖质和SMP 的含量较大,特别是在EOM 中类腐殖质的含量更多,而IOM 中 SMP 含量更大,对数生长期 IOM 中的SMP 占比最大。
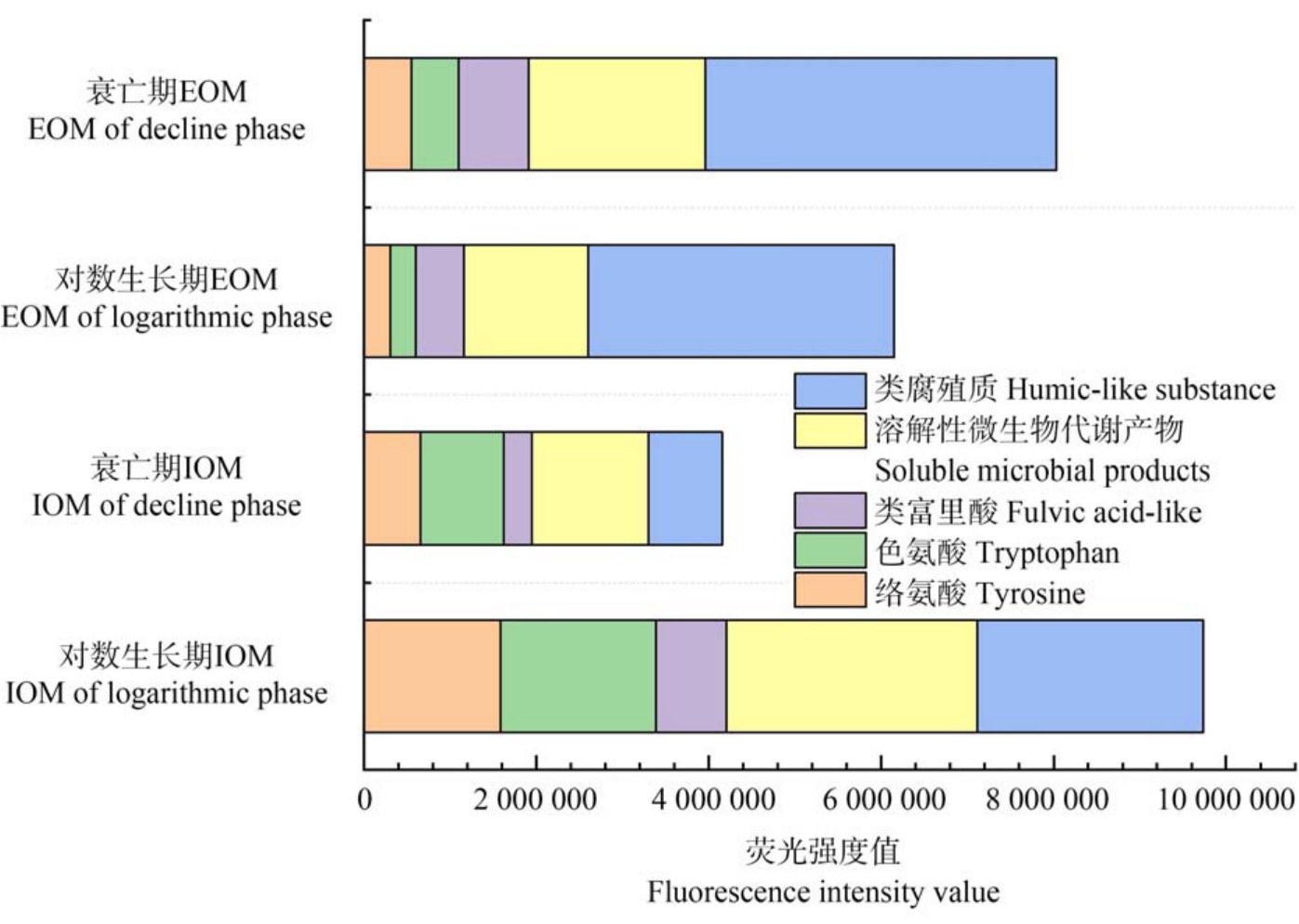
图4 对数生长期和衰亡期胞内外有机物的荧光强度值
Fig.4 Fluorescence intensity values of intracellular and extracellular organic matter at logarithmic phase and decline phase
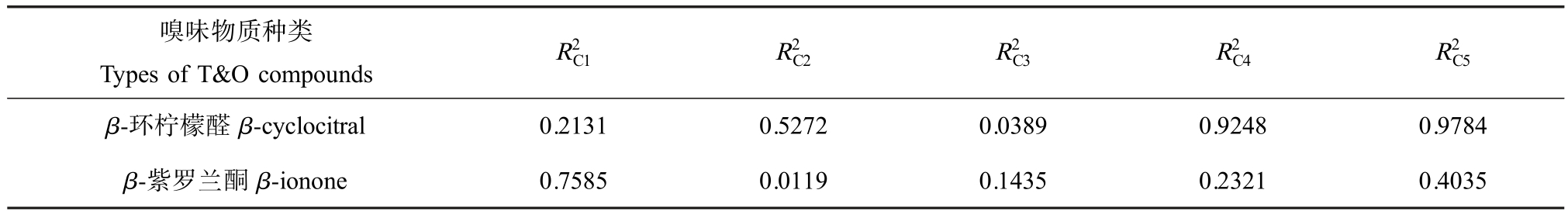
由表4 可知,β-环柠檬醛与SMP 和类腐殖质都有很好的相关性,其中对类腐殖质的相关性更好,![]() 的值为0.9784。 而 β-紫罗兰酮与5个组分的相关性不是很强,相较而言,对络氨酸的相关性更好,
的值为0.9784。 而 β-紫罗兰酮与5个组分的相关性不是很强,相较而言,对络氨酸的相关性更好,![]() 的值为 0.7585。
的值为 0.7585。
表4 嗅味物质与荧光区域的线性相关性
Table 4 Linear correlation between T&O compounds and fluorescent region
注:R2 为线性回归相关系数。
Note: R2 is correlation coefficient of linear regression.
嗅味物质种类Types of T&O compounds R2C1 R2C2 R2C3 R2C4 R2C5 β-环柠檬醛 β-cyclocitral 0.2131 0.5272 0.0389 0.9248 0.9784 β-紫罗兰酮 β-ionone 0.7585 0.0119 0.1435 0.2321 0.4035
2.3 藻源有机物LC-OCD 分析
鱼腥藻对数生长期溶液中的鱼腥藻浓度为4.60 mg·L-1,鱼腥藻衰亡期溶液中的鱼腥藻浓度为5.00 mg·L-1。 图5 为鱼腥藻对数生长期、衰亡期的EOM和 IOM 的 LC-OCD 的分析图。 图 5 中的 OCD 曲线代表的是有机碳,从左向右分子量依次减小。 由OCD 曲线可知,对数生长期 EOM 中 BP、HS 的含量都比衰亡期EOM 中的含量要少,对数生长期IOM中BP、HS 都比较多,而衰亡期中的各个组分含量都相对较少。 UVD 检测的是UV254,是指一些含有碳碳双键或者芳香族有机物,可以看出IOM 中生物聚合物组分在254 nm 处有一定吸光度,但对数生长期的强度要高于衰亡期,EOM 中在HS 组分和低分子有机物组分在254 nm 处有一定吸光度。 OND 代表的是有机氮的含量,由响应值的数值可以看出,在EOM 中有较多的氮元素,IOM 中生物聚合物组分中含有较多的有机氮,且对数生长期的含量要高于衰亡期。

图5 不同生长期的EOM 和IOM 的LC-OCD 分析图
注:1. 生物聚合物,2. 腐殖质,3. 腐殖酸降解产物,4. 低分子量酸性物质,5. 低分子量中性物质;OCD 表示有机碳,UVD 表示UV254 的吸光度,OND 表示有机氮。
Fig.5 LC-OCD of EOM and IOM in different phases
Note:1. Biopolymers,2. Humic substances,3. Building blocks,4. Acids and low molecular weight (LMW) humics,5. Low molecular weight (LMW) neutrals; OCD represents organic carbon, UVD represents ultraviolet absorption at 254 nm, and OND represents organic nitrogen.
由表5 可知,藻源对数生长期EOM 中HOC 和CDOC 的占比分别为20%和80%,BP、HS、BB、LMWA 和 LMWN 的含量分别为 0.86 mg·L-1、1.16 mg·L-1、0.38 mg·L-1、<1.00 μg·L-1和 1.30 mg·L-1,其占比分别为19%、25%、8%、0%和28%;BP 中蛋白质占比为100%,其N/C 约为3.46;HS 中DON 含量为0.32 mg·L-1,N/C 约为 0.27。 而生长末期 EOM 中HOC 和 CDOC 的占比是 0% 和 100%,BP、HS、BB、LMWA 和 LMWN 的含量分别为 1.59 mg·L-1、1.57 mg·L-1、0.82 mg·L-1、<1.00 μg·L-1和 1.01 mg·L-1,其占比分别为32%、31%、16%、0%和20%;BP 中N/C 约为 2.86,HS 中 DON 含量为 0.26 mg·L-1,N/C约为0.16。 这说明对数生长期的含氮量更高。
表5 水华鱼腥藻EOM 和IOM 的有机物组分
Table 5 The organic matter components of EOM and IOM of Anabaena aquae (μg·L-1)

注:DON 为可溶性有机氮;HOC 为疏水有机碳;CDOC 为亲水有机碳。
Note: DON is dissolved organic nitrogen; HOC is hydrophobic organic carbon; CDOC is hydrophilic organic carbon.
可溶性有机碳(DOC)Dissolved organic carbon (DOC)天然有机物(NOM)Natural organic material (NOM)HOC CDOC生物聚合物Biopolymers腐殖质Humic substances 腐殖酸降解产物Building blocks低分子酸性物质LMW acids低分子中性物质LMW neutrals DOC DON DOC DON对数生长期EOM EOM of logarithmic phase 940 3 669 858 29 563 1 156 316 387 <1 1 268衰亡期EOM EOM of decline phase <1 4 988 1 589 4 495 1 569 255 819 <1 1 012对数生长期IOM IOM of logarithmic phase <1 4 665 1 982 917 924 200 987 <1 772衰亡期IOM IOM of decline phase <1 4 804 2 356 <1 884 1 372 404 <1 1 160
藻源对数生长期和生长末期的IOM 中HOC 和CDOC 的占比均为0%和100%,这与EOM 的结果类似。 对数生长期 IOM 中 BP、HS、BB、LMWA 和LMWN 的含量分别为 1.98 mg·L-1、0.92 mg·L-1、0.99 mg·L-1、<1.00 μg·L-1和 0.77 mg·L-1,其占比分别为42%、20%、21%、0%和17%,BP 中蛋白质占比为100%,N/C 约为 0.46;HS 中 DON 含量为0.20 mg·L-1,N/C 约为0.22,表明其较自然水体含有更多的有机氮。 而生长末期IOM 中BP、HS、BB、LMWA 和 LMWN 含量分别是 2.36 mg·L-1、0.88 mg·L-1、0.40 mg·L-1、<1 μg·L-1和1.16 mg·L-1,其占比分别为49%、18%、8%、0%和24%;BP 中DON 含量<1 μg·L-1,而 HS 中 DON 含量为 1.37 mg·L-1,N/C约为1.55,这说明生长末期IOM 中DON 的组分主要集中在HS 中。 IOM 中BB 的占比高达20%。
3 讨论(Discussion)
根据报道,同属不同种的藻株嗅味物质的产生能力也不同,有的产生β-紫罗兰酮[24],有的产生2-MIB[9]。 李维唯等[25]发现实验室培养的Anabaena(sp.PCC7120)无论是在缺氮还是有氮培养条件下均不产2-MIB 和GSM。 这说明嗅味物质的产生具有藻株特异性,由于环境条件及营养源条件等因素的不同,不同藻株嗅味物质的产生特征往往差异很大。本研究结果表明,水华鱼腥藻所产的嗅味物质主要是β-紫罗兰酮、β-环柠檬醛、少量的 IPO 和 GSM。β-环柠檬醛属于草味物质,嗅阈值为0.50 ~19.00 μg·L-1,β-紫罗兰酮属于芳香味物质,嗅阈值为7.00 ng·L-1[26]。 试验结果显示,对数生长期 IOM 所含 β-紫罗兰酮最高可达2 186.69 ng·L-1,远超嗅阈值范围,是水体中嗅味的一个重要来源。
对比不同生长阶段,可以看出对数生长期IOM的嗅味物质含量比衰亡期要多,这是因为衰亡期的藻细胞活性降低,且产生嗅味物质的能力也大幅下降。 且在衰亡期,一些藻的藻细胞破碎,导致胞内的嗅味物质释放到胞外,也会致使IOM 中的嗅味物质含量下降。 而 IPO 主要存在于衰亡期的 EOM 和IOM 中,考虑其是藻类腐败产生的嗅味物质。 对比IOM 和EOM,可以看出各种嗅味物质(β-紫罗兰酮、β-环柠檬醛和GSM 等)主要存在于IOM 中,而 IPO主要存在于EOM 中,推测IPO 主要是在胞外合成,也可能是其他由胞内释放的物质在胞外发生化学变化之后形成的。
水华鱼腥藻为多细胞的丝状蓝藻,鱼腥藻EOM中主要含有类腐殖质和部分SMP,而IOM 主要含有SMP 和大量类蛋白质如络氨酸、色氨酸。 伴随着从对数生长期至衰亡期这一生长阶段的变化,可以看出IOM 的荧光强度也随之减弱,而EOM 的荧光强度则有所加强,这可能是在衰亡期,大多数藻细胞衰败破裂,将胞内物质释放到胞外导致的。 这也导致了对数生长期IOM 中所含有的少量类腐殖质于衰亡期IOM 中消失。 这与嗅味物质的变化规律是一致的,从LC-OCD 图谱上也可以看到相同的规律。
实验结果表明,β-环柠檬醛与SMP 和类腐殖质有很好的相关性,而β-紫罗兰酮与类蛋白质络氨酸有良好的相关性。 这与相关研究报道相符合,嗅味物质作为藻类和放线菌代谢产物,在三维荧光分析中与SMP 有着良好的相关性[27]。 对数生长期IOM所含SMP 和类蛋白质荧光强度更高,这说明对数生长期的藻细胞较为活跃,代谢强烈,产生嗅味物质的能力也较强。 类腐殖质是水华鱼腥藻AOM 的重要组成部分,除衰亡期IOM 外,皆含有较高的类腐殖质,说明鲜活的藻细胞内外皆能产生大量的类腐殖质物质,但进入到衰亡期,大量细胞裂解死亡,胞内产生类腐殖质物质的活性也降低。 据相关文献报道,部分腐殖质的酸化水解产物分解过程中也会散发嗅味,这也是水中嗅味产生的原因之一[28]。 因此推测鱼腥藻在其生长阶段所产生的类腐殖质在实际水体中也会分解产生酸化水解产物,这是水华鱼腥藻在实际水体中产生嗅味的原因之一。
LC-OCD 图谱显示,鱼腥藻 AOM(包括 EOM 和IOM)主要是亲水性的,且低分子物质占比大约30%,这与Goslan 等[4]的研究结果相吻合。 自然水体中BB 的占比大约为10%,而EOM 和IOM 均远高于这个占比,说明水华鱼腥藻AOM 具有良好的生化降解性。 近年来,研究人员发现,DON 易与消毒剂反应生成消毒副产物[29],而氮元素是蛋白质的重要组成部分,实验结果表明,氮元素在胞内外有机物中均有很高的含量,这在三维荧光分析中同样有所体现,AOM 中含有较多的类蛋白质和类腐殖质,这也进一步佐证AOM 是重要的含氮消毒副产物的前体物。
在本实验培养条件下,鱼腥藻嗅味物质主要存在于胞内,主要产生的嗅味物质是柠檬醛和紫罗兰酮、IPO 和少量GSM。 鱼腥藻AOM 主要是亲水性小分子物质,EOM 中主要含有类腐殖质物质和SMP,IOM 主要含有大量类蛋白质如络氨酸、色氨酸和SMP。 且随着生长阶段的变化,藻细胞会发生衰败裂解,致使胞内有机物被释放到胞外。 根据研究结果,在实际水处理工艺中,气浮工艺或生物处理工艺处理高藻水,可以取得较好的降解效果。 气浮工艺可以减少藻细胞的破裂死亡,对控制藻源嗅味物质的产生发挥较大的作用。 生物处理工艺对具有良好的生化降解性的AOM 有较好的处理效果。 同时在供水系统末端可以采用紫外-高级氧化技术高效去除嗅味物质。
[1]中华人民共和国生态环境部.2020年中国生态环境状况公报[R]. 北京: 中华人民共和国生态环境部,2021
[2]王娜, 葛飞, 吴秀珍, 等. 藻类及其胞外分泌物对净水工艺的影响[J]. 水处理技术,2010,36(2):19-24
Wang N, Ge F, Wu X Z, et al. Effect of algae and its extracellular organic matter on drinking water treatment [J].Technology of Water Treatment, 2010, 36(2): 19-24 (in Chinese)
[3]曾宁. 紫外光-双氧水高级氧化技术对饮用水中典型致嗅物质去除的研究[D]. 西安: 西安建筑科技大学,2017:1-2
Zeng N. Study on removing typical odorants in drinking water by advanced oxidation technology of ultraviolet combined with hydrogen peroxide [D]. Xi’ an: Xi’ an U-niversity of Architecture and Technology, 2017: 1-2 (in Chinese)
[4]Goslan E H, Seigle C, Purcell D, et al.Carbonaceous and nitrogenous disinfection by-product formation from algal organic matter [J]. Chemosphere,2017,170:1-9
[5]陈伟涛. 大沙河水库富营养化及蓝藻水华特点分析[J].广东水利水电,2015(6):33-35
Chen W T. Analysis on eutrophication and cyanobacteria blooms characteristics in Dashahe Reservoir [J]. Guangdong Water Resources and Hydropower, 2015(6): 33-35(in Chinese)
[6]高胜玲. 太湖水华蓝藻群落和胶鞘多糖代谢及其基因表达模式的研究[D]. 南京: 南京农业大学,2018:14-15
Gao S L.Studies on cyanobacterial community and sheath polysaccharides metabolism and their gene expression patterns in Lake Taihu [D]. Nanjing: Nanjing Agricultural University,2018:14-15 (in Chinese)
[7]戴国飞, 刘慧丽, 张伟, 等. 江西柘林湖富营养化现状与藻类时空分布特征[J]. 湖泊科学, 2015, 27(2): 275-281
Dai G F, Liu H L, Zhang W, et al. Spatio-temporal variation of algae and eutrophic status of Lake Zhelin, Jiangxi Province [J]. Journal of Lake Sciences,2015, 27(2): 275-281 (in Chinese)
[8]贾晓会, 施定基, 史绵红, 等. 巢湖蓝藻水华形成原因探索及“优势种光合假说”[J]. 生态学报,2011, 31(11):2968-2977
Jia X H, Shi D J, Shi M H, et al.Formation of cyanobacterial blooms in Lake Chaohu and the photosynthesis of dominant species hypothesis [J]. Acta Ecologica Sinica,2011,31(11):2968-2977 (in Chinese)
[9]邱丽佳. H2O2 及O3 氧化两种典型蓝藻致嗅物质和灭藻效应研究[D]. 北京: 北京建筑大学,2017:40-41
Qiu L J.Oxidation of odor compound and inactivation efficiency of two kinds of typical cyanobacteria by hydrogen peroxide and ozone [D]. Beijing: Beijing University of Civil Engineering and Architecture, 2017: 40-41 (in Chinese)
[10]陈克云. 水体藻源嗅味物质产生特征与生物降解研究[D]. 济南: 山东师范大学,2011:21-29
Chen K Y.Study on odorous compounds production characteristics and biodegradation [D].Ji’nan:Shandong Normal University,2011:21-29 (in Chinese)
[11]Guo Q Y, Yu J W, Zhao Y Y, et al.Identification of fishy odor causing compounds produced by Ochromonas sp.and Cryptomonas ovate with gas chromatography-olfactometry and comprehensive two-dimensional gas chromatography [J]. Science of the Total Environment, 2019,671:149-156
[12]张建芳, 顾青清, 符策竿, 等. 某浅水湖型水源地土臭素(GSM)和2-甲基异莰醇(2-MIB)的变化规律[J]. 净水技术,2018,37(11):7-10
Zhang J F, Gu Q Q, Fu C G, et al.Variation regulation of geosmin (GSM) and 2-methylisoborneol (2-MIB) in a water source of shallow-lake type [J]. Water Purification Technology,2018,37(11):7-10 (in Chinese)
[13]Abrha Y, Kye H, Kwon M, et al. Removal of algae, and taste and odor compounds by a combination of plant-mineral composite (PMC) coagulant with UV-AOPs: Laboratory and pilot scale studies [J]. Applied Sciences,2018,8(9):1502
[14]邱丽佳, 张君枝, 张艳娜, 等. H2O2 氧化铜绿微囊藻致嗅物质及灭藻效应研究[J]. 环境科学学报,2017,37(3):954-961
Qiu L J, Zhang J Z, Zhang Y N, et al. Oxidation of odor compound and inactivation efficiency of Microcystis aeruginosa by hydrogen peroxide [J]. Acta Scientiae Circumstantiae,2017,37(3):954-961 (in Chinese)
[15]陈晨. 高藻原水藻类次生嗅味污染特征及光氧化控制技术研究[D]. 杭州: 浙江工业大学,2012:32-56
Chen C. Theoretical study on algae secondary odor metabolic pollution characteristics and control by photo-oxidation of high algae raw water [D]. Hangzhou: Zhejiang U-niversity of Technology,2012:32-56 (in Chinese)
[16]Guo T T, Yang Y L, Liu R P, et al. Enhanced removal of intracellular organic matters (IOM) from Microcystic aeruginosa by aluminum coagulation [J]. Separation and Purification Technology,2017,189:279-287
[17]Liu R P, Guo T T, Ma M, et al. Preferential binding between intracellular organic matters and Al13 polymer to enhance coagulation performance [J]. Journal of Environmental Sciences,2019,76:1-11
[18]冯桂学, 刘莉, 顿咪娜, 等. 固相萃取-气相色谱-质谱法测定水中10 种嗅味物质的含量[J]. 理化检验-化学分册,2017,53(5):502-506
Feng G X, Liu L, Dun M N, et al. SPE-GC-MS determination of 10 odorous materials in water [J]. Physical Testing and Chemical Analysis (Part B: Chemical Analysis),2017,53(5):502-506 (in Chinese)
[19]冯桂学, 宋艳, 刘莉, 等. 固相萃取-气相色谱质谱联用法测定地表水中藻致嗅味物质[J]. 中国环境监测,2014,30(6):163-166
Feng G X, Song Y, Liu L, et al. Determination of taste and odor compounds in surface water using solid phase extraction and gas chromatography-mass spectrometry [J].Environmental Monitoring in China,2014,30(6):163-166(in Chinese)
[20]周昀. 生活饮用水卫生标准中有机物的三维荧光特征及应急处理[D]. 杭州: 浙江工业大学,2016:3-5
Zhou Y. Fluorescent features and emergency measure of the organic matters in standards for drinking water quality[D]. Hangzhou: Zhejiang University of Technology,2016:3-5 (in Chinese)
[21]Huber S A, Balz A, Abert M, et al. Characterisation of aquatic humic and non-humic matter with size-exclusion chromatography-organic carbon detection-organic nitrogen detection (LC-OCD-OND) [J].Water Research,2011,45(2):879-885
[22]Li X, Rao N R H, Linge K L, et al. An evaluation of measurement techniques for algal-derived organic nitrogen [J]. Water Research,2019,165:114998
[23]Villacorte L O, Ekowati Y, Neu T R, et al. Characterisation of algal organic matter produced by bloom-forming marine and freshwater algae [J]. Water Research, 2015,73:216-230
[24]Suurnäkki S,Gomez-Saez G V,Rantala-Ylinen A,et al.I-dentification of geosmin and 2-methylisoborneol in cyanobacteria and molecular detection methods for the producers of these compounds [J].Water Research,2015,68:56-66
[25]李维唯, 郭康宁, 刘莉文, 等. 若干水华相关藻类对太湖水体异味物质贡献的初步研究[J]. 湖泊科学, 2018,30(4):916-924
Li W W, Guo K N, Liu L W, et al. Relationship of odor compounds to some algal strains associated with bloom in Lake Taihu [J]. Journal of Lake Sciences, 2018, 30(4):916-924 (in Chinese)
[26]Young C C,Suffet I H,Crozes G,et al.Identification of a woody-hay odor-causing compound in a drinking water supply [J]. Water Science and Technology, 1999, 40(6):273-278
[27]李雨轩. 超滤-纳滤双膜组合工艺在高品质饮用水处理中的研究[D]. 兰州: 兰州交通大学,2019:61-65
Li Y X. Study on ultrafiltration-nanofiltration combined membrane process in high quality drinking water treatment [D]. Lanzhou: Lanzhou Jiatong University, 2019:61-65 (in Chinese)
[28]魏彬. 地表水表观污染特性及其污染物分布规律研究[D]. 苏州: 苏州科技大学,2019:44-48
Wei B.Study on the characteristics of surface water pollution and the distribution of pollutants [D]. Suzhou:Suzhou University of Science and Technology, 2019: 44-48 (in Chinese)
[29]白敏冬, 李海燕, 满化林, 等. 基于常规饮用水工艺羟基自由基处理高藻水[J]. 环境工程学报, 2017, 11(9):4897-4902
Bai M D, Li H Y, Man H L, et al. Treatment of algae bloom water using·OH based on conventional drinking water process [J].Chinese Journal of Environmental Engineering,2017,11(9):4897-4902 (in Chinese)