目前,抗生素污染及其产生的环境毒害效应已经成为社会各界关注的重点[1-2]。 大量残留的抗生素会通过城市管网、地表径流和下渗作用等方式最终汇入到水体中,不仅会威胁到水生生物的生存,而且还会通过食物链及生态循环等方式,对人类的生产生活和健康造成严重的危害[3-5]。 殷强和付峥嵘[6]研究发现水体中极微量的抗生素,也会对水生动物的机体器官和水生植物的光合呼吸作用造成损伤,且长期饮用会降低人体的免疫力。 此外,抗生素过度使用会诱发细菌的抗性基因,使细菌对其建立耐受性,大大增加了人类感染疾病治疗的难度[7]。
青霉素类作为最早被人类应用于临床疾病治疗的抗生素,在医疗中的应用有着成熟完整的体系,而且在我国的产量较高、使用量较广、研究度较深[8]。此外,青霉素类抗生素具有“三低一高”的显著优势,即耐药性低、毒副作用低、价格低、医疗效果高[9]。 张藜莉和李静[10]研究发现青霉素类药物对革兰氏阴性菌、革兰氏阳性菌和厌氧菌等多种细菌都有抑菌性,可用于治疗多种细菌的感染。 汤雨晴等[11]发现青霉素类抗生素能与细菌细胞膜上的某种蛋白质分子结合成稳定的复合物,会诱发细菌的死亡。 因此,研究多种青霉素类抗生素的抑菌作用具有重要意义。
环境中的污染物常以混合物形式存在,很可能对暴露生物产生联合毒性效应。 那么,对抗生素联合效应的探寻,在多个领域都拥有重要的参考价值[12]。 当混合体系表现出协同作用时,可以为抗耐药菌的问题和新型抗菌药物的研发提供新的解决思路和方法[13-14];当混合体系表现为拮抗作用时,可以为抗生素环境生态毒性问题的解决提供多方位的策略[15];当混合体系表现为加和作用时,表明药物的抑菌作用靶可能相同,可以为混合药物的作用机理提供思考的角度[16]。
此外,药物的抑菌效果受多种因素的共同影响,而时间是除浓度外的另一个重要影响因素,但很多研究仅关注了抑菌性较强的某个特殊暴露时间点的抑菌作用,却很少探究其在不同暴露时间的动态变化规律,这可能会掩蔽药物发挥抑菌作用的完整过程[17]。 杨启文等[18]研究了青霉素类抗生素和环丙沙星或阿米卡星对耐药的铜绿假单胞菌的体外联合抑菌效应,发现在暴露24 h 时主要为协同和加和作用。吴群等[19]以分级抑菌浓度指数(fractional inhibitory concentration, FIC)为药物联合抑菌效应的判断指标,发现抗生素在暴露时间为12 h 时,其对大肠杆菌(Escherichia coli,E.coli)联合抑菌作用呈现出协同、累加和拮抗等多种相互作用。 这些研究均表明,长时间暴露可能会使药物间的相互作用发生变化,但这些研究均忽视了药物联合抑菌作用的连续动态变化规律。因此,不同暴露时间的连续动态测定具有一定的必要性,它能更完整地表达出药物对E. coli 的影响趋势,使药物的联合效应预测结果更加精确可靠。
E. coli 是多种疾病的传播者,且广泛存在于人类的日常生活中,对抗生素极易产生耐药性[20],但作为实验菌种它具有生长周期短、培养方法简单、应用成本低和基因表达水平高等诸多优点[21-22]。 然而,目前针对E. coli 抑菌性的研究仅限于药物在某一特殊暴露时间的抑菌作用,但对于多个药物在不同暴露时间对E. coli 的联合抑菌作用的研究较少[23],且多数人员对E. coli 的抑菌性实验采用微量肉汤稀释法和棋盘法,但都不宜直接用来获取药物及其混合物对E. coli 抑菌数据[24-25]。 因此,本论文拟以临床领域中广泛使用的3 种青霉素类药物哌拉西林钠(piperacillin sodium, PIP)、青霉素 G 钾(penicillin G potassium, PEN)和青霉素V 钾盐(penicillin V potassium salt, PHE)[9,26]为研究对象,以大肠杆菌为受试生物,以透明96 孔板为实验载体,通过调整培养基成分比例、培养条件和测试时间等因素,建立基于E. coli 的时间毒性微板分析方法(time-dependent toxicity microplate analysis, t-MTA)[27],采用均匀设计射线法(uniform design ray,UD-Ray)[28]构建三元混合物体系,且运用t-MTA 全面地测定3 种药物及其三元混合物的时间毒性数据,并采用最小二乘法对其数据进行拟合,应用浓度加和(concentration addition model, CA)模型分析三元混合物的联合抑菌作用。以期为抗耐药菌药物的研发提供新的思路,为抗生素环境风险的评估提供数据。
1 材料与方法(Materials and methods)
1.1 材料与仪器
3 种青霉素类抗生素哌拉西林钠(PIP)、青霉素G 钾(PEN)和青霉素V 钾盐(PHE)均为分析纯,且购自国药集团化学试剂有限公司,其理化性质及储备液浓度如表1 所示。 均采用Milli-Q 水配制储备液,并置于棕色瓶中4 ℃条件下保存、备用。
表1 3 种抗生素的基本性质及储备液
Table 1 Basic properties and stocks of three antibiotics
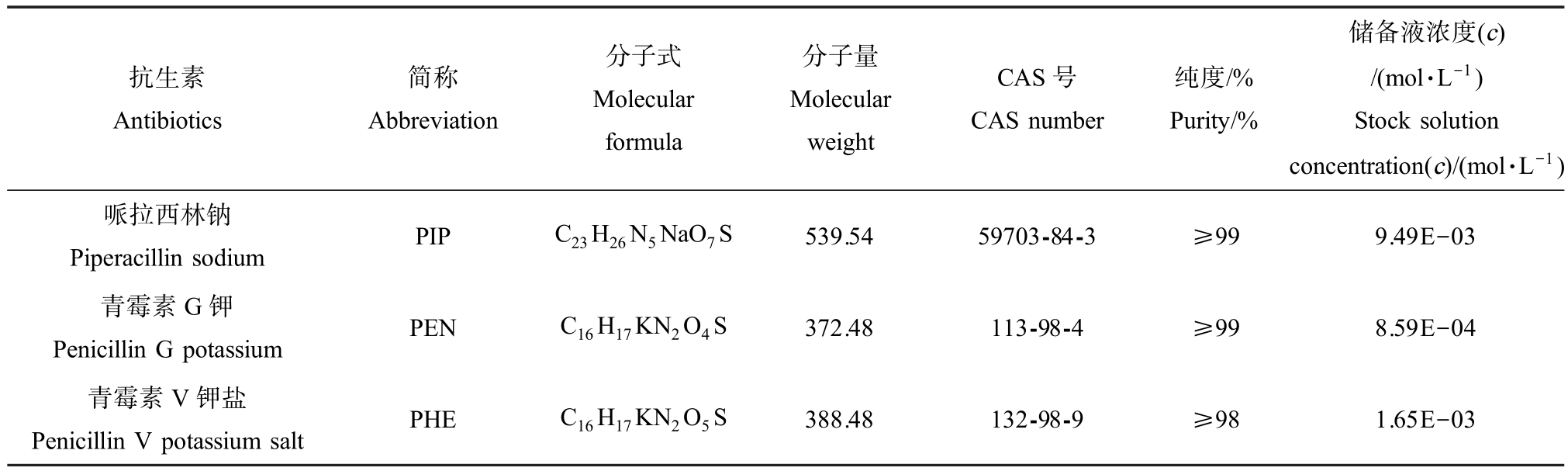
抗生素Antibiotics简称Abbreviation分子式Molecular formula分子量Molecular weight CAS 号CAS number纯度/%Purity/%储备液浓度(c)/(mol·L-1)Stock solution concentration(c)/(mol·L-1)哌拉西林钠Piperacillin sodium PIP C23H26N5NaO7S 539.54 59703-84-3 ≥99 9.49E-03青霉素G 钾Penicillin G potassium PEN C16H17KN2O4S 372.48 113-98-4 ≥99 8.59E-04青霉素V 钾盐Penicillin V potassium salt PHE C16H17KN2O5S 388.48 132-98-9 ≥98 1.65E-03
培养基配制:(1)营养琼脂培养基(nutrient agar,NA)成分包括 10 g 蛋白胨、4 g 牛肉膏、5 g NaCl、20 g 琼脂。(2)营养肉汤培养基(nutrient broth, NB)成分包括 10 g 蛋白胨、4 g 牛肉膏、5 g NaCl。(3)MH 肉汤培养基(Mueller-Hinton broth, MHB)成分包括2 g 牛肉粉、17.5 g 酸水解酪蛋白、1.5 g 可溶性淀粉。 将各成分溶于1 000 mL Milli-Q 水,调节pH 为7.2 ~7.4,于121 ℃高压蒸汽灭菌20 min,冷却后在4 ℃冰箱保存备用,2 倍培养基则按比例扩大各成分。本实验所用主要仪器参照文献[29]。
1.2 基于E.coli 的时间毒性微板分析法建立及优化
以菌株号为ATCC8739 的E. coli(上海鲁微科技有限公司)为实验菌种。 首先,在NA 培养基上挑取2 环活化后的E. coli 转接到NB 培养基中,恒温震荡培养,设置温度(37±1) ℃,转速 170 r·min-1,培养12 h 至对数生长期,于4 ℃冰箱保存备用。 其次,取待测保存菌液20 μL 加入1 mL MHB,置于(37±1) ℃生化恒温培养箱中过夜静止培养12 h 后,再用2 倍MHB 调整E. coli 菌液的 OD600 值在0.08~0.1 之间,备用。
以96 孔透明微板为实验载体,首先为了防止边缘效应的产生,在微板四边共36个微孔中分别加入200 μL 的 Milli-Q 水。 其次,在第 2、6、7 和 11 列的24 孔分别加入100 μL 超纯水作为空白对照组,剩余的36个微孔为处理组,按照预实验确定的稀释因子分别加入12个不同浓度梯度的100 μL 药物溶液,每个浓度梯度设3个平行。 最后,向空白微孔和处理微孔中分别加入100 μL 的菌液,使每个微孔的总体积为200 μL。 重复以上操作3 次,共3 块板,并在每次实验均单独设置3 块96 孔板同步监测E.coli 在微孔中的生长曲线情况,作为阴性对照组。然后再将微板置于(37±1) ℃生化恒温培养箱中培养,在暴露时间分别为 0.25、2、4、8 和 12 h 时,取出并在酶标仪上测定各孔的OD600 值,96 孔透明微板中空白组和药物浓度梯度设计示意图参见文献[30-31]。 3 种抗生素及其三元混合物对E. coli 的抑菌性计算公式如下:
式中:I0 为空白对照的OD600 平均值,I 为各浓度梯度的OD600 平均值,x%为抗生素对E. coli 的生长抑制率。
1.3 混合物的实验设计
为有效地研究混合物中组分之间的相互作用,采用均匀设计射线法设计了3 种抗生素的三元混合体系,共5 条混合物射线,每条射线有12个浓度梯度[32]。 三元混合物的各组分浓度配比(pi)如表2 所示,其中 R1、R2、R3、R4 和 R5 是 PEN、PHE 和 PIP三元混合物体系的5 条混合射线。
表2 三元混合物(PIP-PEN-PHE)的组分浓度配比(pi)
Table 2 The component concentration ratio (pi) of ternary mixture (PIP-PEN-PHE)
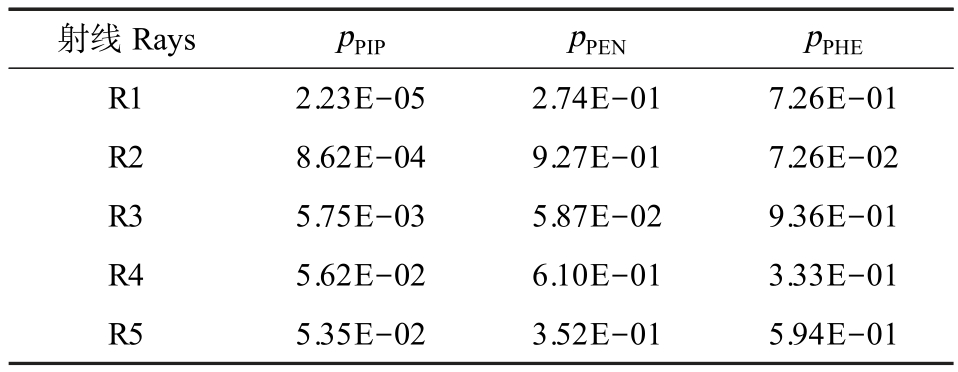
射线Rays pPIP pPEN pPHE R1 2.23E-05 2.74E-01 7.26E-01 R2 8.62E-04 9.27E-01 7.26E-02 R3 5.75E-03 5.87E-02 9.36E-01 R4 5.62E-02 6.10E-01 3.33E-01 R5 5.35E-02 3.52E-01 5.94E-01
1.4 浓度-效应曲线拟合
应用APTox 软件对不同暴露时间下的浓度-效应数据进行拟合[33],拟合函数为Logit 或Weibull 函数,其表达式如下:
式中:E 为效应(0≤E≤1),c 为单个化合物或者混合物浓度,α 和 β 为模型参数。
1.5 混合物抑菌作用分析
浓度加和(CA)模型能够很好地评估混合物组分间的相互作用[34],其表达式如下:
式中:Ci 表示混合物产生总效应为x%时第i 种组分的浓度,ECx,i 为i 组分单独存在时产生等效应x%时的效应浓度。 如果由CA 模型预测结果大于、小于和等于混合物的实际观测值,则认为该混合物组分间发生了协同作用、拮抗作用和加和作用。
2 结果与讨论(Results and discussion)
2.1 3 种抗生素对E. coli 的时间毒性微板分析方法的建立及其抑菌活性
通过调整培养基成分比例和培养条件、暴露时间、增加药物浓度梯度以及实验浓度重复次数等因素,建立了基于E.coli 的t-MTA。 其中,暴露时间点为 0.25、2、4、8 和12 h,与传统方法的某一特殊暴露时间点相比,多个暴露时间点更有利于污染物的抑菌作用的动态变化规律研究;采用最小二乘法计算出的半数效应浓度(EC50)的负对数(pEC50)作为评价抑菌活性大小的指标,并在此基础上设计了混合物体系,相较于传统方法中最小抑菌浓度(EC80)更有代表性;在微板设计上,增加了实验重复次数和空白对照数量,并同步监测E. coli 在微孔中的生长曲线情况,作为阴性对照组,大大提高了实验数据的准确性;实验将初始菌液浓度的OD600 值严格控制在0.08 ~0.1 范围之内,确保了初始菌液浓度的一致性,减小了干扰因素。 总之,相比于传统方法只能获得某一特殊暴露时间的浓度-效应数据的缺点,优化后的t-MTA 法不仅能够获得多种污染物或混合药物的多浓度梯度、多浓度比例和多暴露时间点抑菌作用实验数据,而且能更大限度地使试验点分散更均匀、代表性更强、更接近于最优条件和可探究的影响因子更多,且简便不易出错,优点明显。 此外,还能够准确地得到不同抑菌率下的实验数据和药物的抑菌浓度,这也可为医药类相关的研究提供佐证,所以,对于E. coli 的多种混合药物的多浓度梯度、多浓度比例和多暴露时间点抑菌作用实验的优化研究有一定的创新价值。
基于已建立的t-MTA 法,系统测定了3 种抗生素对E. coli 的抑菌活性数据,且采用非线性最小二乘法拟合单个药物对E. coli 在不同暴露时间的浓度-效应数据[35]、模型拟合参数 α 和 β、拟合效应的均方根误差(RMSE)、拟合相关系数(R)以及半数效应浓度负对数(pEC50)等结果如表3 所示。 3 种药物的时间-剂量-效应曲线(t-CRC)如图1 所示。
由表3 可知,以t-MTA 测定的实验结果不仅分散均匀,而且测试数据的精密度和代表性更高,几乎所有数据R>0.90、RMSE<0.10,说明3 种药物的剂量-效应关系均可用 Weibull 函数有效表征。 以pEC50 为指标,3 种药物对E.coli 的抑菌活性大小关系随暴露时间的变化而变化,但均随暴露时间的延长而增大。 3 种药物对E. coli 的抑菌性大小关系为:在暴露时间为0.25 ~2 h 时,3 种药物对E. coli的呈现微弱抑菌性;在暴露时间为4 h 时,抑菌活性大小关系为PEN(pEC50=3.47)>PHE(pEC50=3.32)>PIP(pEC50=2.81);在暴露时间为8 ~12 h 时,抑菌活性大小关系为PIP(pEC50=4.46 ~5.21)>PEN(pEC50=4.16 ~4.39)>PHE(pEC50 =4.01 ~4.39)。 总的来看,3 种药物抑菌活性大小整体表现为PIP>PEN>PHE。
表3 3 种抗生素的Weibull 函数拟合结果及其统计学参数
Table 3 Fitted results by Weibull function and some statistics for the three antibiotics
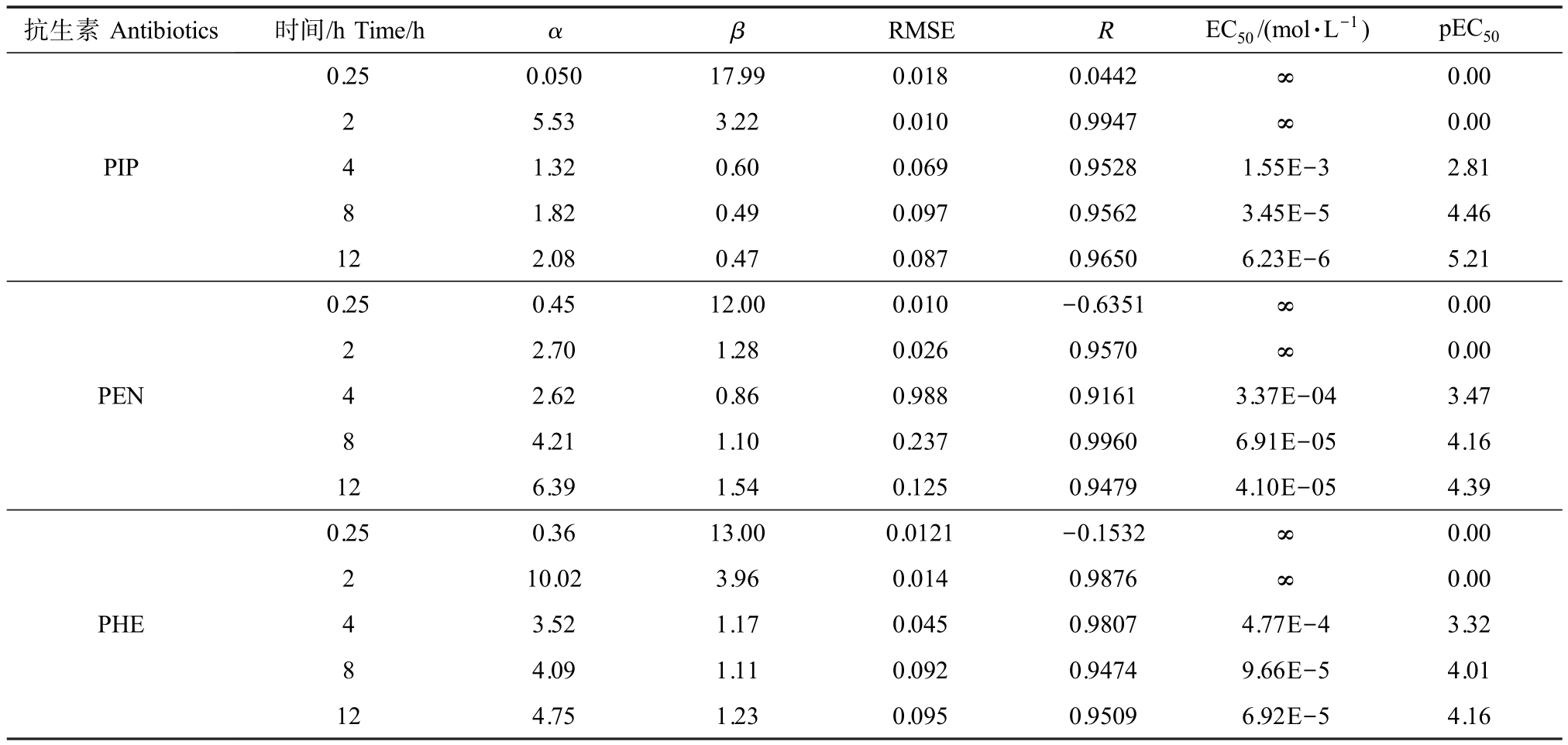
注:α 和β 分别是Weibull 模型中的2个浓度-响应曲线(CRC)参数;EC50、pEC50 分别为半数效应浓度和半数效应浓度负对数;RMSE、R 分别为均方根误差和拟合相关系数。
Note:α and β are two concentration-response curves(CRC)parameters of Weibull model;EC50 and pEC50 were median effective concentration and negative logarithm of median effective concentration, respectively; RMSE and R were root mean square error and fitting correlation coefficient, respectively.
抗生素Antibiotics 时间/h Time/h α β RMSE R EC50/(mol·L-1) pEC50 0.250.05017.990.0180.0442∞0.00 PIP 2 5.533.220.0100.9947∞0.00 4 1.32 0.60 0.069 0.9528 1.55E-3 2.81 1.82 0.49 0.097 0.9562 3.45E-5 4.46 12 2.08 0.47 0.087 0.9650 6.23E-6 5.21 8 PEN 0.25 0.4512.000.010-0.6351∞0.00 2 2.701.280.0260.9570∞0.00 4 2.62 0.86 0.988 0.9161 3.37E-04 3.47 8 4.21 1.10 0.237 0.9960 6.91E-05 4.16 12 6.39 1.54 0.125 0.9479 4.10E-05 4.39 PHE 0.25 0.3613.000.0121-0.1532∞0.00 2 10.023.960.0140.9876∞0.00 4 3.52 1.17 0.045 0.9807 4.77E-4 3.32 4.09 1.11 0.092 0.9474 9.66E-5 4.01 12 4.75 1.23 0.095 0.9509 6.92E-5 4.16 8
由图1 可知,3 种药物对 E. coli 的 t-CRC 均为典型的“S”型,且均具有明显的时间依赖性。 在暴露时间为0.25 h 时,3 种药物对E. coli 均未表现出抑菌性,即3 种药物对E.coli 均无急性抑菌性;在暴露时间为4 ~12 h 时,3 种药物对E. coli 的抑菌性,均随着暴露时间的延长而不断增大,且3 种抗生素的最大抑菌率达到了95%以上。 青霉素类抗生素是通过阻止细菌转肽酶的转肽,抑制其细胞壁的形成,进而促使细菌的衰亡,且该过程是需要一定时间才能完成的[36],即暴露时间是影响药物抑菌性效果的重要因素之一,只有充分地考虑时间对实验结果的影响,才能更加全面地得出准确的结论[37]。 以上结果也表明,基于E. coli 的t-MTA 分析方法可以用来测定和分析不同暴露时间和浓度抗生素对E. coli的抑菌活性的影响,且该法不仅降低了工作强度,而且提高了实验数据量。
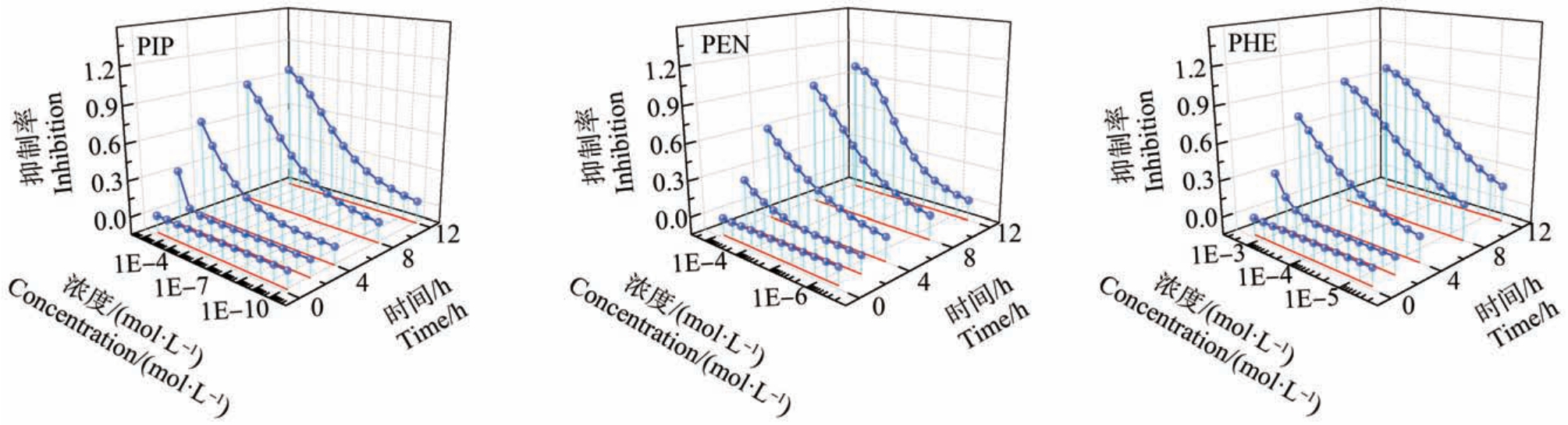
图1 3 种抗生素的时间-浓度-效应曲线随时间变化曲线
Fig.1 Time-concentration-effect curve change over time for three kinds of antibiotics
2.2 3 种抗生素的三元混合物对E. coli 的时间依赖抑菌活性
想要得到精准全面的实验结果,不仅要充分考虑时间对药物抑菌性的影响,而且更要关注到药物浓度的大小、组成成分和浓度比等重要因素对抑菌性的影响[38]。 因此,本文研究了三元混合物PENPHE-PIP 初始药物浓度大小、浓度比和暴露时间对其抑菌活性的影响。 三元混合物的各拟合参数结果如表4 所示,其t-CRC 如图2 所示。

图2 三元混合物(PIP-PEN-PHE)的时间-浓度-效应曲线
Fig.2 The time-concentration-effect curve of ternary mixture (PIP-PEN-PHE)
表4 三元混合物体系的Weibull 函数拟合结果及其统计学参数
Table 4 Fitted results by Weibull function and some statistics for ternary mixture system
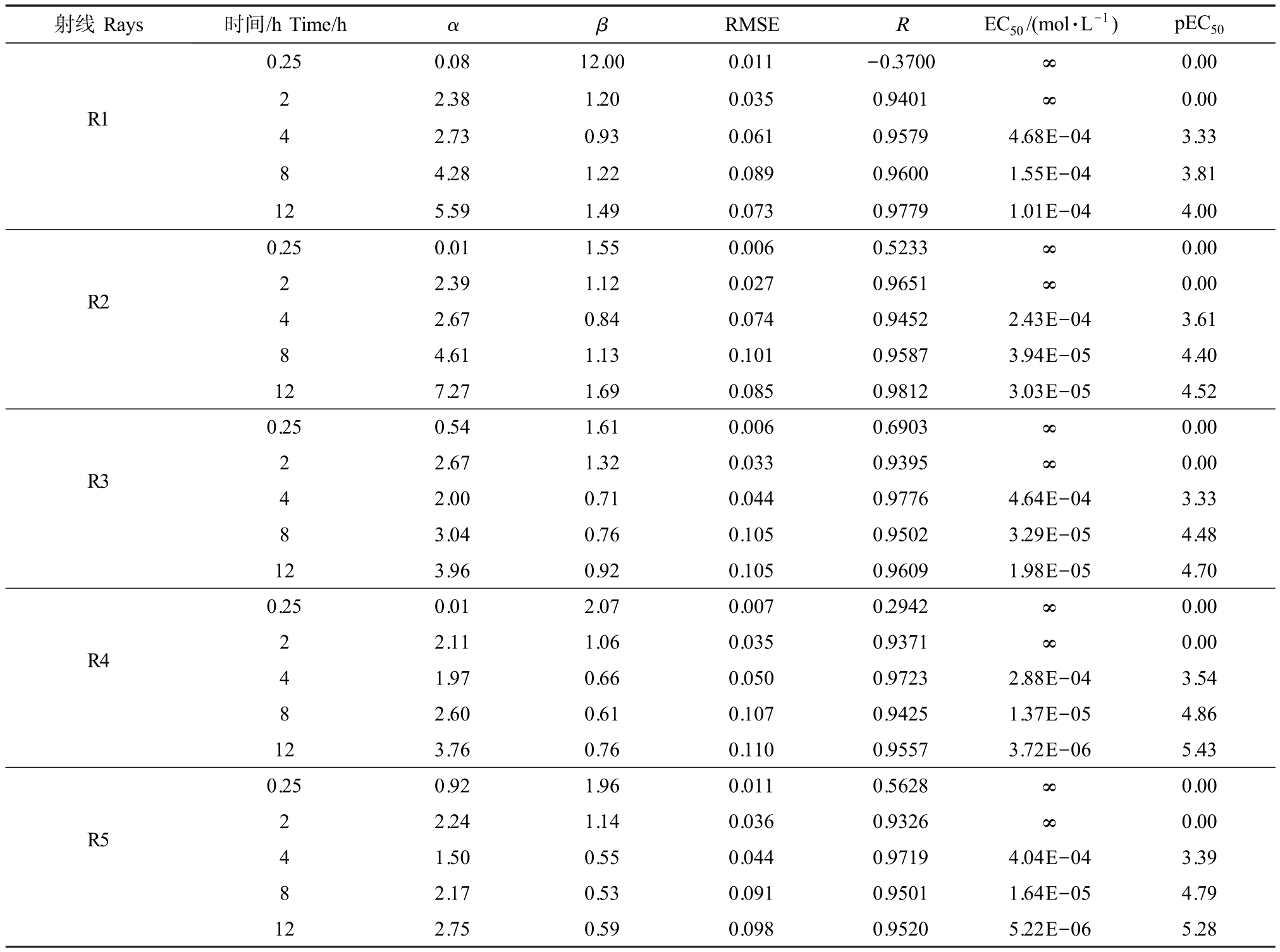
射线Rays 时间/h Time/h α β RMSE R EC50/(mol·L-1) pEC50 0.25 0.0812.000.011-0.3700∞0.00 R122.381.200.0350.9401∞0.00 4 2.73 0.93 0.061 0.9579 4.68E-04 3.33 4.28 1.22 0.089 0.9600 1.55E-04 3.81 12 5.59 1.49 0.073 0.9779 1.01E-04 4.00 8 R2 0.250.011.550.0060.5233∞0.00 2 2.391.120.0270.9651∞0.00 4 2.67 0.84 0.074 0.9452 2.43E-04 3.61 4.61 1.13 0.101 0.9587 3.94E-05 4.40 12 7.27 1.69 0.085 0.9812 3.03E-05 4.52 8 R3 0.250.541.610.0060.6903∞0.00 2 2.671.320.0330.9395∞0.00 4 2.00 0.71 0.044 0.9776 4.64E-04 3.33 3.04 0.76 0.105 0.9502 3.29E-05 4.48 12 3.96 0.92 0.105 0.9609 1.98E-05 4.70 8 R4 0.250.012.070.0070.2942∞0.00 2 2.111.060.0350.9371∞0.00 4 1.97 0.66 0.050 0.9723 2.88E-04 3.54 2.60 0.61 0.107 0.9425 1.37E-05 4.86 12 3.76 0.76 0.110 0.9557 3.72E-06 5.43 8 R5 0.250.921.960.0110.5628∞0.00 2 2.241.140.0360.9326∞0.00 4 1.50 0.55 0.044 0.9719 4.04E-04 3.39 8 2.17 0.53 0.091 0.9501 1.64E-05 4.79 12 2.75 0.59 0.098 0.9520 5.22E-06 5.28
由表4 可知,运用UD-Ray 所构建的三元混合物体系,所有数据基本呈现为R>0.90、RMSE<0.10,说明UD-Ray 法适用于构建多元混合体系以进行E. coli 的抑菌性实验,三元药物混合体系的5 条射线的剂量-效应关系均可用Weibull 函数有效表征,且运用UD-Ray 所构建的三元混合物体系所得的实验数据极具代表性。 以pEC50 为指标,5 条射线对E. coli 的抑菌性大小关系为:在暴露时间为0.25 ~2 h 时,三元混合物的5 条射线对E. coli 的呈现微弱抑菌性;在暴露时间为4 h 时,抑菌性大小关系为R2(pEC50=3.61)>R4(pEC50=3.54)>R5(pEC50=3.39)>R3(pEC50=3.33)=R1(pEC50=3.33);在暴露时间为8~12 h 时,抑菌性大小关系为R4(pEC50=4.86 ~5.43)>R5(pEC50=4.79 ~5.28)>R3(pEC50= 4.48 ~4.70)>R2(pEC50=4.40~4.52)>R1(pEC50=3.81~4.00)。
综上所述,探究多元药物混合体系对E. coli 的抑菌性可用UD-Ray 构建,三元混合药物对E. coli的抑菌性大小关系随暴露时间的变化而变化,且均随暴露时间的延长而增大。 抑菌大小关系整体表现为 R4>R5>R3>R2>R1。
由图2 可知,三元混合体系的5 条射线CRC 曲线表现出典型的“S”型,且对E. coli 的抑菌活性均具有明显的时间依赖性。 在暴露时间为0.25 h 时,5条射线对E. coli 均未表现出抑菌性,即均无急性抑菌性;在暴露时间为2 h 时,5 条射线均在中浓度、低浓度区域表现无抑菌性,在高浓度区域表现出微弱抑菌性;在暴露时间为4 ~12 h 时,5 条射线的CRC曲线表现出明显的上扬趋势,整体表现出低浓度区域具有微弱抑菌效果,而中高浓度区域的抑菌效果较为明显。 方翼和王睿[39]研究指出,青霉素类抗生素的杀菌活性对药物的浓度依赖性较小,但对药物与细菌接触时间的依赖性较大,这可能是“5 条射线的总趋势变化基本相同,均随暴露时间的延长抑菌性不断增大”的主要原因。 此外,低浓度的青霉素类抗生素仅会引起细菌细胞的形态变化,但高浓度的青霉素类抗生素会使细菌的细胞裂解,这可能是高浓度的药物对E. coli 抑制率较高的原因之一[40]。
结合表2 和图3 可知,在三元混合体系中,暴露时间为12 h 时,5 条混合射线的抑菌大小关系为R4>R5>R3 >R2 >R1,该顺序与 5 条混合射线中组分PIP 的浓度大小关系(PPIP:R4>R5>R3>R2>R1)基本一致(R=0.9189, RMSE=0.0703),体现了组分依赖抑菌性,且混合物射线中组分PIP 的浓度比越大,5 条混合射线的抑菌性就越大,体现了浓度比依赖抑菌性,即三元混合物对E. coli 的抑菌性大小随着组分中PIP 的浓度变化而变化。 有研究表明,PIP 对E. coli 的抑菌效果明显优于其他青霉素类抗生素,这也可能是三元混合物的整体抑菌效果与PIP 浓度比相关性较高的原因之一[9]。
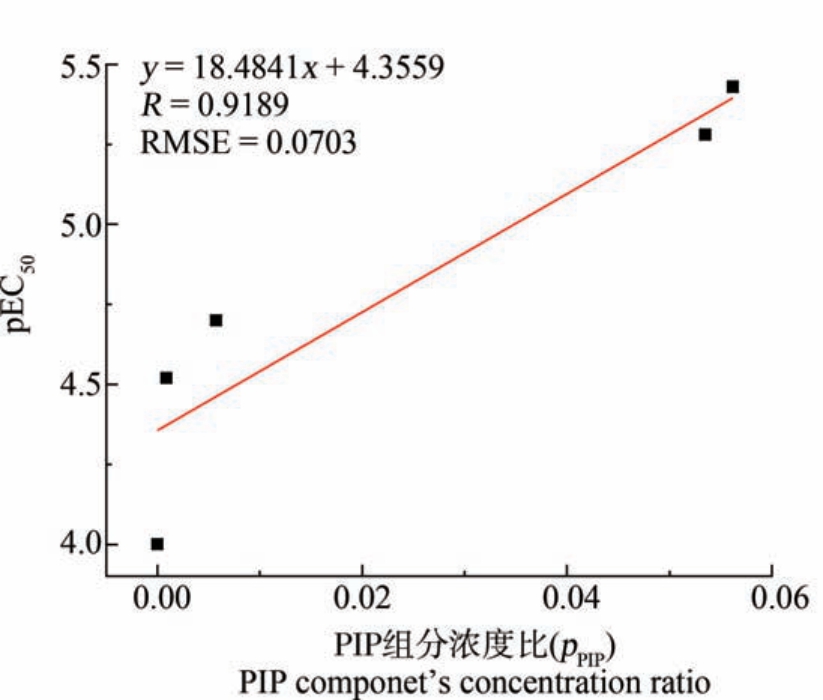
图3 5 条三元混合射线的毒性(pEC50 值)与PIP 组分浓度比(pPIP)之间的线性关系
Fig.3 Linear relationship between toxicity (pEC50 value) of 5 ternary mixed rays and concentration ratio (pPIP)of the component PIP
综上所述,三元混合体系的5 条射线对E. coli的抑菌活性,不仅均具有明显的时间依赖性,而且均具有组分浓度比依赖抑菌性,且高浓度区域的抑菌效果较为显著。 这也进一步证实了药物的抑菌效果与暴露时间、药物浓度的大小、药物的组分和药物的浓度比的因素密切相关。 以上结果也表明,基于E.coli 的t-MTA 分析方法可以用来测定和分析不同暴露时间和浓度的抗生素混合物对E. coli 的抑菌活性,即该法为研究多因素对E. coli 抑菌性的影响提供了参考。
2.3 3 种抗生素的三元混合物相互作用分析
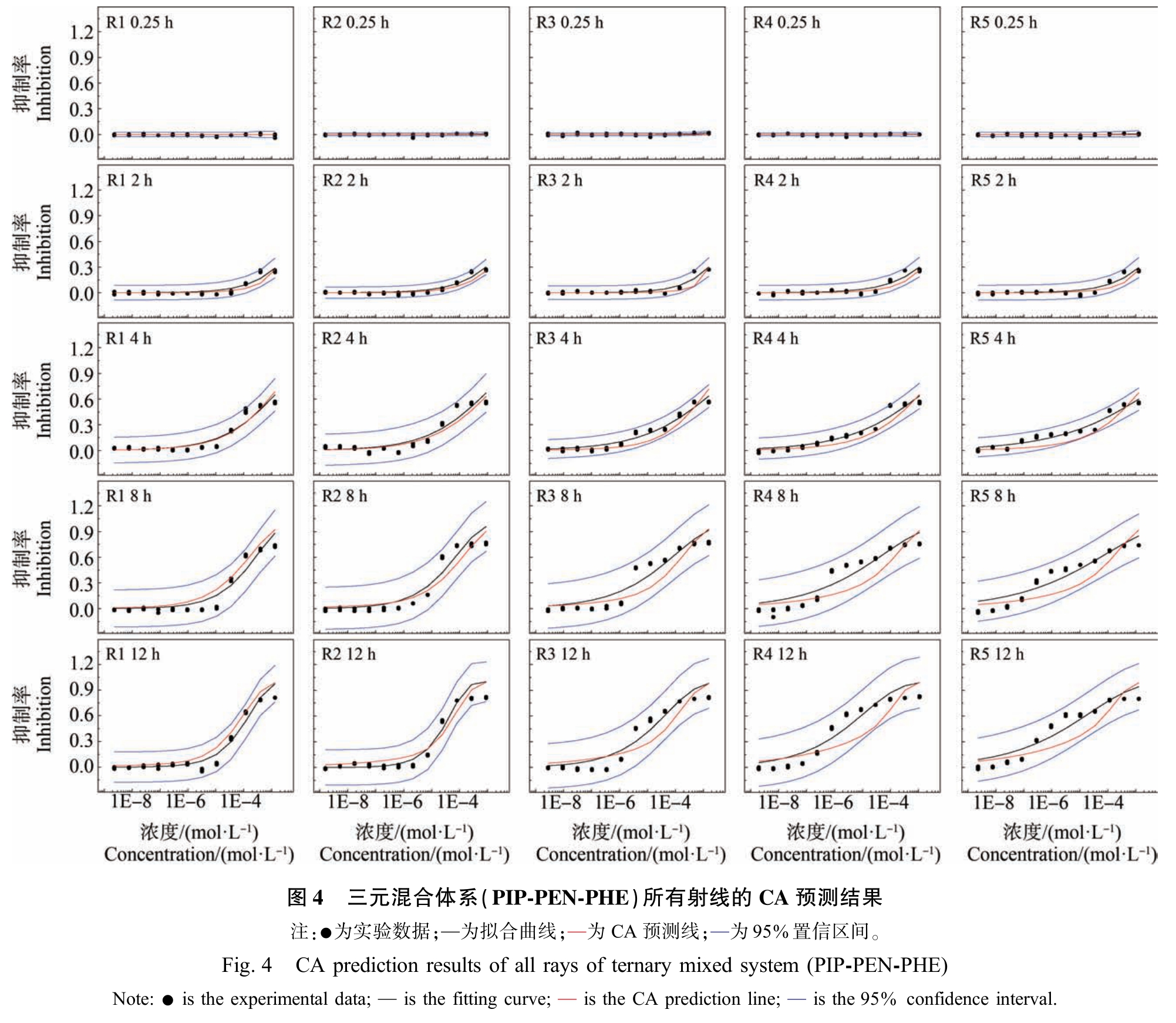
由图4 可知,三元混合物体系的5 条射线,在暴露时间0.25 h 时,CA 模型预测线均位于95%置信区间之内,即此时5 条混合射线表现为加和作用,且无急性抑菌性;随着暴露时间的延长,在暴露时间为2 ~12 h 时,CA 模型预测线均位于95%置信区间之内,且低浓度区域的CA 预测线与拟合曲线的重合度较高,但中浓度、高浓度区域的CA 预测线与拟合曲线的重合度较低,即此时5 条混合射线在低、中、高浓度区域整体呈现出典型加和作用,但在中浓度、高浓度区域具有明显的协同或拮抗作用趋势。 可能是因为青霉素类抗生素抑制细菌的细胞壁形成的过程发生在细胞的繁殖期,且青霉素类既是繁殖期杀菌剂,又是时间依赖性抗生素[41];也可能与三元混合物体系中的决定性组分的变化紧密相关[42]。 此外,也可能因为3 种药物同属青霉素类抗生素,其对E.coli 的抑菌作用机制相同,当它们联合使用时会对抑菌结合位点形成竞争关系,且由于青霉素类抗生素具有独特的时间依赖抑菌性,在暴露时间较短时,其抑菌作用较低[43-45]。
综上所述,针对耐药菌问题,应从药物的组分、浓度、浓度比和暴露时间等多角度进行考察,科学合理地制定对策。 暴露时间较短时,可能并不能透彻地剖析混合物的相互作用及其抑菌机理。 因此,全面地研究和收集药物在不同组分、浓度、浓度比和暴露时间条件下的动态实验数据,不仅有利于药物作用规律的总结,更有利于为解决耐药菌问题提供新的解决思路。 此外,只有避免滥用抗生素,才能够从源头减少其生态危害。
通过以上结果分析,可得出:
(1) 通过对实验条件、数据处理方法和混合体系设计等多方面因素进行优化后,建立了基于E. coli的t-MTA,与传统方法相比,不仅操作简便、数据准确,而且可探测的浓度范围更广,为研究多因素对E. coli 抑菌性的影响提供了参考方法。
(2) 应用t-MTA 系统地分析了3 种不同浓度青霉素类抗生素及其混合物对E. coli 在不同暴露时间的抑菌性,3 种青霉素类抗生素对E. coli 的抑菌性具有明显的时间依赖性,且浓度-效应曲线呈现出典型的“S”拟合性状。 随暴露时间的延长,3 种抗生素对E. coli 的抑菌活性不断增加,且在不同暴露时间,抗生素对E. coli 的抑菌性大小关系略有不同。在暴露0.25 ~2 h 时,3 种抗生素对E. coli 的均无明显急性抑菌作用;在暴露4 h 时,抑菌作用大小关系为 PEN(pEC50=3.47)> PHE(pEC50=3.32)>PIP(pEC50=2.81);在暴露8 ~12 h 时,抑菌作用大小关系为PIP(pEC50=4.46 ~5.21)> PEN(pEC50=4.16 ~4.39)>PHE(pEC50=4.01 ~4.39)。
(3)3 种抗生素三元混合体系的5 条射线对E.coli 的抑菌性具有明显的时间依赖性,抑菌活性大小关系整体表现为R4>R5>R3>R2>R1,该顺序与5条混合射线中组分PIP 的浓度大小关系基本一致(R=0.9189,RMSE=0.0703),即三元混合物对E.coli 的抑菌性,不仅具有明显的时间依赖性,而且具有组分浓度比依赖抑菌性。
(4)3 种抗生素单元及其三元混合物,在暴露时间相同时,对E. coli 的抑菌大小随药物的浓度升高而增大;在药物浓度相同时,对E. coli 的抑菌性随暴露时间的延长而增大。
(5) 依据CA 模型,三元混合物体系对E. coli 的抑菌性相互作用,整体呈现为经典的加和作用。
[1]Costanzo S D, Murby J, Bates J. Ecosystem response to antibiotics entering the aquatic environment [J]. Marine Pollution Bulletin,2005,51(1-4):218-223
[2]董欣琦, 陈敏, 张瑾, 等. 氨基糖苷类抗生素混合物对蛋白核小球藻的时间依赖毒性[J]. 安徽建筑大学学报,2016,24(6):67-73
Dong X Q, Chen M, Zhang J, et al. Time-dependent toxicity of aminoglycoside antibiotics to Chlorella pyrenoidosa [J]. Journal of Anhui Jianzhu University,2016,24(6):67-73 (in Chinese)
[3]崔泽林, 郭晓奎. 食物链中抗生素耐药性基因的转移[J]. 中国微生态学杂志,2011,23(1):89-92,97
Cui Z L, Guo X K. Transfer of antibiotic resistance genes in the food chain [J]. Chinese Journal of Microbiology,2011,23 (1):89-92,97 (in Chinese)
[4]Xue B M, Zhang R J, Wang Y H, et al. Antibiotic contamination in a typical developing city in South China:Occurrence and ecological risks in the Yongjiang River impacted by tributary discharge and anthropogenic activities [J]. Ecotoxicology and Environmental Safety, 2013,92:229-236
[5]Heberer T. Occurrence, fate, and removal of pharmaceutical residues in the aquatic environment: A review of recent research data [J].Toxicology Letters,2002,131(1-2):5-17
[6]殷强, 付峥嵘. 我国水环境中抗生素污染的研究进展[J]. 安徽农业科学,2017,45(31):50-51,55
Yin Q, Fu Z R. Research progress of antibiotic pollution in water environment in China[J].Journal of Anhui Agricultural Sciences,2017,45(31):50-51,55 (in Chinese)
[7]Kapil A. The challenge of antibiotic resistance: Need to contemplate [J]. The Indian Journal of Medical Research,2005,121(2):83-91
[8]张永信. 青霉素类的药用特点与选用[J]. 上海医药,2003,24(10):449-451
Zhang Y X. Medicinal characteristics and selection of penicillins [J]. Shanghai Medical & Pharmaceutical Journal,2003,24(10):449-451 (in Chinese)
[9]万林峰. 浅谈青霉素类抗生素的特点及临床应用[J].求医问药(下半月),2012,10(2):627
[10]张藜莉, 李静. 半合成青霉素的临床应用概况[J]. 中国医院用药评价与分析,2006,6(1):53-54
[11]汤雨晴, 叶倩, 郑维义. 抗生素类药物的研究现状和进展[J]. 国外医药(抗生素分册),2019,40(4):295-301
Tang Y Q, Ye Q, Zheng W Y. Research status and development of antibiotics [J]. World Notes on Antibiotics,2019,40(4):295-301 (in Chinese)
[12]Areej S, Sattar A, Javeed A, et al. Diphenhydramine and levofloxacin combination therapy against antimicrobial resistance in respiratory tract infections [J].Future Microbiology,2021,16:409-420
[13]高美英. 抗生素耐药性的挑战与控制对策[J]. 医药导报,2004(4):210-212
Gao M Y.Challenges and control countermeasures of antibiotic resistance [J].Medical Herald,2004(4):210-212 (in Chinese)
[14]Martens E, Demain A L. The antibiotic resistance crisis,with a focus on the United States [J].The Journal of Antibiotics,2017,70:520-526
[15]张瑾, 刘树深, 邓慧萍, 等. 吡啶类离子液体对青海弧菌Q67 的混合毒性评估[J]. 生态毒理学报, 2013, 8(6):955-962
Zhang J, Liu S S,Deng H P,et al.Evaluation on the combined toxicity of pyridium-based ionic liquids to Vibrio qinghaiensis sp.-Q67 [J]. Asian Journal of Ecotoxicology,2013,8(6):955-962 (in Chinese)
[16]丁婷婷,张瑾,董欣琪,等.4 种农药对青海弧菌Q67 混合毒性作用的评估[J].安徽农业大学学报,2017,44(5):817-822
Ding T T, Zhang J, Dong X Q, et al. Evaluation of the joint toxicity of four pesticides towards Vibrio qinghaiensis-Q67 [J]. Journal of Anhui Agricultural University,2017,44(5):817-822 (in Chinese)
[17]Baas J, Jager T, Kooijman B. Understanding toxicity as processes in time [J]. The Science of the Total Environment,2010,408(18):3735-3739
[18]杨启文, 王辉, 徐英春, 等. 环丙沙星或阿米卡星联合β-内酰胺类抗生素对多重耐药铜绿假单胞菌的体外联合抑菌效应研究[J]. 中国实用内科杂志, 2006, 26(9):685-687
Yang Q W, Wang H, Xu Y C, et al. In vitro activity of ciprofloxacin or amikacin combined with β-lactams against multidrug-resistant Pseudomonas aeruginosa strains[J]. Chinese Journal of Practical Internal Medicine, 2006,26(9):685-687 (in Chinese)
[19]吴群, 黄楠, 刘贝欣, 等. 六种抗菌药单用与联合应用对大肠杆菌的体外抑菌效果观察[J]. 黑龙江畜牧兽医,2018(10):88-91
Wu Q,Huang N,Liu B X,et al.Antibacterial effect of six antimicrobial agents with single or combined application against Escherichia coli in vitro [J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(10): 88-91 (in Chinese)
[20]易力, 赵嘉盟, 杨洪, 等. 鹅、鱼源大肠杆菌的耐药性研究[J]. 黑龙江畜牧兽医,2021(12):80-84
Yi L, Zhao J M, Yang H, et al. Study on drug resistance of goose and fish-derived Escherichia coli [J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(12):80-84 (in Chinese)
[21]Yang Y X, Xu Z H, Zhang Y Q, et al. A new quorumsensing inhibitor attenuates virulence and decreases antibiotic resistance in Pseudomonas aeruginosa [J]. Journal of Microbiology,2012,50(6):987-993
[22]Sondi I, Salopek-Sondi B. Silver nanoparticles as antimicrobial agent: A case study on E. coli as a model for Gram-negative bacteria [J]. Journal of Colloid and Interface Science,2004,275(1):177-182
[23]Kuok C F, Hoi S O, Hoi C F, et al.Synergistic antibacterial effects of herbal extracts and antibiotics on methicillin-resistant Staphylococcus aureus: A computational and experimental study [J]. Experimental Biology and Medicine,2017,242(7):731-743
[24]Ruan X C,Deng X L,Tan M L,et al.In vitro antibiofilm activity of resveratrol against avian pathogenic Escherichia coli [J]. BMC Veterinary Research,2021,17(1):249
[25]Nyuykonge B,van Amelsvoort L,Eadie K,et al.Comparison of disc diffusion, E-test, and a modified CLSI broth microdilution method for in vitro susceptibility testing of itraconazole, posaconazole, and voriconazole against Madurella mycetomatis [J].Antimicrobial Agents and Chemotherapy,2021,65(9): e0043321
[26]Wilke M S, Lovering A L, Strynadka N C. β-lactam antibiotic resistance: A current structural perspective [J].Cur-rent Opinion in Microbiology,2005,8(5):525-533
[27]Zhang J, Liu S S, Yu Z Y, et al. The time-dependent hormetic effects of 1-alkyl-3-methylimidazolium chloride and their mixtures on Vibrio qinghaiensis sp. -Q67 [J].Journal of Hazardous Materials,2013,258-259:70-76
[28]Liu S S, Xiao Q F, Zhang J, et al. Uniform design ray in the assessment of combined toxicities of multi-component mixtures [J]. Science Bulletin,2016,61(1):52-58
[29]Zhang J, Liu S S, Liu H L. Effect of ionic liquid on the toxicity of pesticide to Vibrio-qinghaiensis sp.-Q67 [J].Journal of Hazardous Materials,2009,170(2-3):920-927
[30]梁丽营, 曾鸿鹄, 龙茜, 等. 基于群体感应抑制剂与磺胺对大肠杆菌联合毒性效应的QSAR 模型建立[J]. 环境化学,2017,36(1):92-99
Liang L Y, Zeng H H, Long X, et al. Establishment of a QSAR model based on the joint effects of quorum sensing inhibitors and sulfonamides on Escherichia coli [J].Environmental Chemistry,2017,36(1):92-99 (in Chinese)
[31]Zhang J, Tao M T, Song C C, et al. Time-dependent synergism of five-component mixture systems of aminoglycoside antibiotics to Vibrio qinghaiensis-Q67 induced by a key component [J]. RSC Advances, 2020, 10(21):12365-12372
[32]Dou R N, Liu S S,Mo L Y,et al.A novel direct equipartition ray design (EquRay) procedure for toxicity interaction between ionic liquid and dichlorvos [J].Environmental Science and Pollution Research International,2011,18(5):734-742
[33]Zhang Y H, Liu S S, Liu H L, et al. Evaluation of the combined toxicity of 15 pesticides by uniform design [J].Pest Management Science,2010,66(8):879-887
[34]Howard G J, Webster T F. Generalized concentration addition: A method for examining mixtures containing partial agonists [J].Journal of Theoretical Biology,2009,259(3):469-477
[35]Newman M C, McCloskey J T.Time-to-event analyses of ecotoxicity data [J]. Ecotoxicology,1996,5(3):187-196
[36]祖玉梅. β-内酰胺类抗生素的应用与发展现状[J]. 中国实用医药,2010,5(30):246-248
[37]Devi K P, Nisha S A, Sakthivel R, et al. Eugenol (an essential oil of clove) acts as an antibacterial agent against Salmonella typhi by disrupting the cellular membrane [J].Journal of Ethnopharmacology,2010,130(1):107-115
[38]Tao M T, Bian Z Q, Zhang J, et al. Quantitative evaluation and the toxicity mechanism of synergism within three organophosphorus pesticide mixtures to Chlorella pyrenoidosa [J]. Environmental Science Processes & Impacts,2020,22(10):2095-2103
[39]方翼, 王睿. β-内酰胺类药物抗生素后效应研究概况[J]. 中国医院药学杂志,1998,18(4):170-172
[40]Ruppé É,Woerther P L,Barbier F.Mechanisms of antimicrobial resistance in Gram-negative bacilli [J]. Annals of Intensive Care,2015,5(1):61
[41]张新战. 青霉素类抗生素的使用[J]. 中国医学创新,2009,6(25):181-182
[42]Groten J P,Feron V J,Sühnel J.Toxicology of simple and complex mixtures [J]. Trends in Pharmacological Sciences,2001,22(6):316-322
[43]于泳, 张雅文, 张晓欢, 等. 兽药滥用的成因分析: 基于南京地区兽药使用情况的调研[J]. 江苏科技信息,2015(23):76-78
Yu Y,Zhang Y W,Zhang X H,et al.Analysis on the causes of drug abuse: Based on the research of the use of veterinary drugs in Nanjing [J]. Jiangsu Science & Technology Information,2015(23):76-78 (in Chinese)
[44]Khameneh B,Diab R,Ghazvini K,et al.Breakthroughs in bacterial resistance mechanisms and the potential ways to combat them [J].Microbial Pathogenesis,2016,95:32-42
[45]Ocampo P S,Lázár V,Papp B,et al.Antagonism between bacteriostatic and bactericidal antibiotics is prevalent [J].Antimicrobial Agents and Chemotherapy, 2014, 58(8):4573-4582