随着我国城市化进程的加速以及工业、农业生产的快速发展,重金属、农药等有害污染物渗入土壤。 而土壤污染具有隐蔽性、潜伏性和长期性等特点,容易被人忽视,其造成的严重后果可通过不同暴露途径给动物和人类健康带来危害[1]。
2014年政府公布的土壤污染报告显示,我国土壤被重金属和农药污染总超标率为16%,其中,镉(cadmium, Cd)的点位超标率高达7.0% [2]。 而对于我国设施农田土壤Cd 污染,南方重于北方,西南、中南地区土壤重金属超标范围较大[3],特别是西南高镉地质背景区的农田土壤,由于其酸性土壤、环境因素和设施农业发展等原因使土壤弱酸提取态Cd占比高,从而增加其生物可利用性,导致作物中更容易富集Cd,大大增加了农作物Cd 污染风险,对农产品质量安全构成威胁[4-5]。 农业生产中,农田杂草是引起农作物减产的重要因素之一,除草剂在农业生产中的使用量呈上升趋势,而三嗪类除草剂用量更是位居前五[6]。 扑草净(prometryne),是一种三嗪类、低毒、高选择的内吸性除草剂,具有杀草谱广、药效长等优点[7],被广泛运用于多种作物、蔬菜、中草药、茶园和果树等杂草防除,甚至用于水产养殖[8]。 研究发现,扑草净在土壤中半衰期为1 ~3个月,其残留长达13个月[9],在土壤中还可通过微型生物的降解作用产生一系列具有潜在毒理效应的代谢产物,这些物质的存在都有可能通过食物链及食物网的传递对生态环境中的各级生物造成急性、慢性或遗传毒性,从而破坏生态平衡[10],对农产品安全、生态环境造成巨大影响[11]。
近年来,复合污染引起人类的广泛关注,同时也成为环境科学研究的重点和热点[12-13]。 有研究表明,复合污染物会对诸如鱼类[14]、蚯蚓[15]和哺乳类[16]等生物产生较为显著的联合毒性效应[17]。 蚯蚓在土壤生态系统中较为常见,数量大、分布广,在土壤中生存时与各类污染物均有密切接触,并对污染物感知敏感[18]。 由于对外界环境因子敏感度较高,蚯蚓的生态毒性指标又可反映化学污染物的毒性效应,因此成为土壤污染毒性效应和土壤污染状况的指示生物[19]。 当蚯蚓遭到外源污染物胁迫后体内会积累活性氧自由基(ROS),累积超过一定水平会造成机体氧化损伤,并且也会使蚯蚓机体内的抗氧化酶活性发生变化[20]。 Huang 等[21]通过微塑料和Cd共同暴露实验得出,随着污染物含量的增加,28 d后微塑料(microplastics, MPs)和Cd 可显著诱导蚯蚓产生更高的回避反应,蚯蚓体质量减轻、繁殖减少。MPs 和 Cd 联合抑制超氧化物歧化酶(superoxide dismutase, SOD)和过氧化物酶(peroxidase, POD)活性,同时提高谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性和丙二醛(malondialdehyde,MDA)含量;并且微塑料改变了Cd 的有效性而加剧Cd 对蚯蚓的毒性。 宋欣媛等[22]发现在相同时间条件下,草甘膦和扑草净作用下蚯蚓体内蛋白质含量变化趋势为先升高后降低,同时扑草净和草甘膦对蚯蚓体内乙酰胆碱酯酶(acetyl cholinesterase, AChE)酶活性有抑制作用。
目前,混合污染物对蚯蚓的毒性已有报道,这些研究主要集中在金属化合物上[23],其中关于Cd 对蚯蚓毒理学研究较多[24],扑草净的研究多集中于水生动植物、浮游植物等方面[25],但没有关于Cd-扑草净复合污染方面的研究。 为探究Cd-扑草净对蚯蚓的毒性效应,本研究采用滤纸接触法、人工土壤法测定不同暴露时间和暴露浓度下蚯蚓的中毒状况以及机体中抗氧化酶(SOD、CAT 和POD)活性、解毒酶谷胱甘肽S-转移酶(GST)活性和MDA 含量等指标的变化,旨在掌握Cd-扑草净对蚯蚓抗氧化系统的剂量-效应关系,为评价蚯蚓作为Cd-扑草净复合污染的指示生物的指标筛选提供基础数据。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 供试动物
实验动物为赤子爱胜蚓(Eisenia foetida),在山东枣庄蚯蚓养殖基地购买。 蚯蚓放在温度为(20±2)℃、光暗比为12 h∶12 h 的光照培养箱中培养2 周,选择生殖环带健康、体质量250 ~400 mg 的成年蚯蚓测定不同酶活性指标。
1.1.2 供试土壤
由15%苔藓泥炭细土、25%高岭黏土(高岭土>50%)[26]、60%工业石英砂粒(含50%以上0.05 ~0.2 mm 细小颗粒)等物质均匀混合为人工土壤,对蚯蚓进行培养。 每一处理质量为5 000 g,依次将各种成分加入到长49 cm×宽14 cm×高21 cm 的长方形塑料花盆中混匀,并在花盆底部打孔保持通风。
1.1.3 药品试剂及仪器
药品试剂:供试药品97%扑草净标准品购买于济南仁诺化工有限公司;Cd 选用 98% CdCl2·2.5H2O,购买于昆明盘龙华森有限公司。 SOD 试剂盒、POD 试剂盒、CAT 试剂盒、GST 试剂盒及MDA 试剂盒均由苏州科铭生物技术有限公司(中国)提供。
主要仪器设备:万分之一电子天平(ATX224,岛津企业管理(中国)有限公司,中国);台式高速冷冻离心机(3-15K,德国SIGMA 公司);酶标仪(MD SpectraMax Plus 384,美谷分子仪器(上海)有限公司,中国);智能人工气候箱(RQX-400H,上海跃进医疗器械有限公司,中国);样品分样、粉碎、筛分系统(MM400+AS200,德国 RETSCH(莱驰)公司)。
1.2 染毒浓度及染毒方式
1.2.1 滤纸接触法
将扑草净溶于甲醇(分析纯),并用甲醇由高浓度向低浓度逐级稀释;Cd 溶于去离子水,用去离子水进行逐级稀释。 分别配成系列浓度梯度的溶液。单一污染物 Cd 浓度设定为 0、50、100、150、200 和250 mg·L-1;扑草净浓度设定为 0、5、50、100、150 和200 mg·L-1。 每一处理组3个平行,每个平行分别加入15 条体质量、大小相近的蚯蚓(约350 mg)。 在玻璃培养皿内铺衬1 层滤纸,吸取1 mL 配制好的溶液分别均匀洒在滤纸上;其中扑草净空白对照组将1 mL 甲醇均匀地洒在滤纸上,待甲醇挥发干后加入蒸馏水2 mL 润湿滤纸;同时将培养好的蚯蚓取出、洗净,用新滤纸吸干蚯蚓体表水分,放入培养皿中,扎孔保鲜膜封口。 在试验开始后第24、48 小时进行观察,记录蚯蚓死亡率、中毒症状,实验过程用镊子触碰蚯蚓头部、尾部,无反应视为已死亡。
1.2.2 人工土壤法
为进一步探索Cd 和扑草净对赤子爱胜蚓的氧化胁迫效应,采用人工土壤法进行研究。 据文献确定预期毒性中值,以该值为中间剂量组,以3 倍之差上、下各推一个剂量组做预试验,找出Cd 和扑草净的最大致死浓度(LC100) 以及最小致死浓度(MLC)[2,9,27]。 根据预试验结果在 MLC 和 LC100 区间内设置各污染物溶液浓度:设置Cd 毒性浓度为0、30、60 和90 mg·kg-1;除草剂扑草净的实验浓度设置成0 mg·kg-1和10 mg·kg-1。 毒性处理时,每个处理组称取5 000 g 土壤,其中扑草净处理组先将甲醇与其中1 000 g 的土壤混合均匀,放入通风厨将甲醇挥发后和剩余4 000 g 土壤混合均匀,同时将人工土壤含水率大致保持在40%,对照组同上述操作。 染毒浓度操作时从对照组开始,由低到高依次处理。 每一处理均设有3个平行组,以及CK 对照组。 复合污染物浓度依照单一污染物的土壤毒性而设定,设置对照组,分别在7、14、21 和28 d 各处理组中选择蚯蚓20 条,放置在玻璃培养皿中用于酶活性测定。
蚯蚓酶液的制备:蚯蚓放置于垫有干净湿润滤纸的培养皿中,将清肠后的蚯蚓用去离子水洗净,将身体表面水渍用滤纸擦干,置入预冷的2 mL EP 管中,然后加入1 mL 匀浆缓冲液(250 mmol·L-1蔗糖、50 mmol·L-1 Tris、1 mmol·L-1 EDTA、1 mmol·L-1 DTT,混合,定容至1 L,pH=7.5)[28],冰浴匀浆制成组织匀浆液。 将匀浆液放入2 mL 离心管,8 500 r·min-1、4 ℃离心 10 min,测定。
CAT 活性的测定采用徐镜波等[29]的方法,每毫克组织蛋白每分钟催化1 nmol H2O2 降解定义为一个酶活性单位。 SOD 活性测定采用氮兰四唑比色法[30]。 POD 活性采用愈创木酚比色法[31]测定,以每分钟吸光度变化值表示酶活性的大小。 GST 活性参照Habig 等[32]所用方法进行测定,通过测定25℃、340 nm 条件下反应液的吸光度值来确定GST活性的大小。 MDA 含量测定采用硫代巴比妥酸比色法[33]。
1.3 数据处理
数据采用SPSS 26.0 软件进行计算和分析,并利用单因素方差分析方法中的LSD 检验进行差异显著性分析。
2 结果(Results)
2.1 Cd、扑草净单一暴露下赤子爱胜蚓中毒症状
单一重金属污染对蚯蚓产生潜在的毒性效应如图 1 所示,在 0 mg·L-1和 5 mg·L-1 Cd 暴露下,蚯蚓未出现断裂或死亡;当Cd 浓度达100 mg·L-1、暴露时间达12 h 时,蚯蚓开始出现环带肿大和自溶;Cd浓度增加到150 mg·L-1、暴露48 h 时蚯蚓便出现出血和尾部呈串珠状现象。 在浓度达200 mg·L-1 和250 mg·L-1 时,蚯蚓暴露 12 h 后出现死亡状况,暴露时间到24 h 时250 mg·L-1Cd 处理组蚯蚓死亡率大幅度提高,但有蚯蚓存活,说明250 mg·L-1的Cd对蚯蚓机体损伤程度较200 mg·L-1 严重。 蚯蚓的中毒症状可概括为:蚯蚓更加柔软,易腐烂,有自溶现象;环带肿涨,出血并渗出黄色体液,周围滤纸有明显红色染迹;身体有断裂现象,活动能力减弱;有抱团现象。 蚯蚓的死亡率随染毒时间延长呈上升趋势。

图1 镉暴露对蚯蚓(Eisenia foetida)形态学的影响
注:(a) 空白对照组正常蚯蚓;(b) 黄色体液渗出;(c) 生殖环带肿大;(d) 体色变黑;(e) 尾部串珠状;(f) 身体肿大。
Fig.1 The effect of cadmium on the morphology of Eisenia foetida
Note: (a) Normal healthy earthworms in control group; (b) Yellow fluid exudation; (c) Enlargement of the genital girdle;(d) The body color turns black; (e) Beaded tail; (f) The body became swollen.
如图2 所示,扑草净暴露下蚯蚓的中毒症状与Cd 相似,在 0 mg·L-1 和 50 mg·L-1 暴露组,蚯蚓未出现断裂或死亡;当浓度达50 mg·L-1、暴露时间达12 h 时,蚯蚓开始出现环带红肿变大和黄色体液渗出;扑草净浓度增加到100 mg·L-1、暴露48 h 时蚯蚓便出现出血和尾部串珠状现象。 当浓度达150 mg·L-1和200 mg·L-1时,蚯蚓暴露12 h 后开始出现死亡状况,24 h 时200 mg·L-1暴露组蚯蚓死亡率较高,而150 mg·L-1暴露组蚯蚓有存活迹象,说明200 mg·L-1的扑草净对蚯蚓机体损伤程度较150 mg·L-1严重。 蚯蚓中毒症状表现为:身体松软,外界触碰下略有反应,置于阳光下反应变慢,有黄色体液渗出,蚯蚓身体颜色发黑、滤纸有血色晕染痕迹,生殖环带肿大,尾部有串珠现象,有断尾现象。

图2 扑草净暴露对蚯蚓(Eisenia foetida)形态学的影响
注:(a) 空白对照组正常蚯蚓;(b) 黄色体液渗出;(c) 生殖环带肿大;(d) 体色变黑;(e) 尾部串珠状;(f) 身体肿大并出血。
Fig.2 The effect of prometryne on the morphology of Eisenia foetida
Note: (a) Normal healthy earthworms in control group;(b) Yellow fluid exudation; (c) Enlargement of the genital girdle;(d) The body color turns black; (e) Beaded tail; (f) The body became swollen and bled.
2.2 Cd、扑草净暴露对赤子爱胜蚓的急性毒性效应
如表1 所示,蚯蚓的死亡率与Cd 和扑草净暴露浓度呈一定的线性关系。 染毒24 h 时,Cd 24 h-LC50 值为 163.821 mg·L-1,扑草净 24 h-LC50 值为46.469 mg·L-1。 染毒 48 h 时,Cd 和扑草净 48 h-LC50 分别为 96.336 mg·L-1和 18.149 mg·L-1,毒性分别增强1.7 倍和2.6 倍。
表1 镉、扑草净暴露对蚯蚓的急性毒性效应
Table 1 The acute toxic effect of cadmium and prometryne on Eisenia foetida
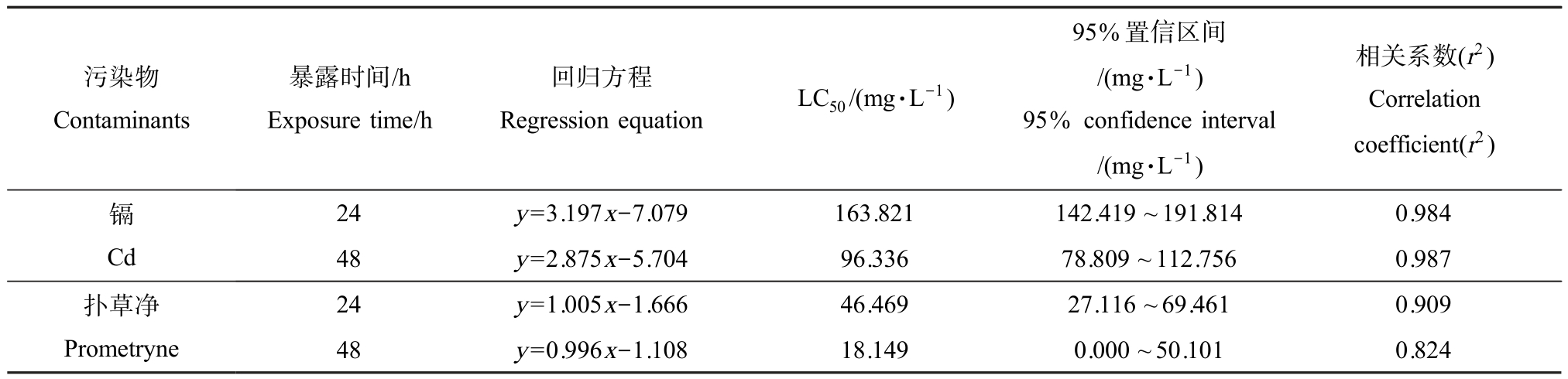
注:LC50 为半致死浓度。
Note: LC50 stands for half lethal concentration.
污染物Contaminants暴露时间/h Exposure time/h回归方程Regression equation LC50/(mg·L-1)95%置信区间/(mg·L-1)95% confidence interval/(mg·L-1)相关系数(r2)Correlation coefficient(r2)镉24 y=3.197x-7.079 163.821 142.419 ~191.814 0.984 Cd 48 y=2.875x-5.704 96.336 78.809 ~112.756 0.987扑草净Prometryne 24 y=1.005x-1.666 46.469 27.116 ~69.461 0.909 48 y=0.996x-1.108 18.149 0.000 ~50.101 0.824
2.3 Cd、扑草净暴露对蚯蚓抗氧化酶活性的影响
2.3.1 Cd 单一及与扑草净复合作用对蚯蚓SOD活性的影响
Cd 在不同暴露浓度和暴露时间对蚯蚓体内SOD酶活性的影响如图3 所示。 暴露7 d 时,各浓度处理组SOD 活性较对照组低,各处理组与对照组无显著性差异(P>0.05);暴露14 d 时,不同浓度组SOD活性激活,与对照组差异显著(P<0.05),其中60 mg·kg-1组活性最大;在21 ~28 d 不同浓度处理组SOD活性存在不同程度的降低趋势。 在7 ~28 d 蚯蚓体内SOD 活性整体表现为抑制-激活-抑制,随时间变化蚯蚓机体组织受到外界影响损伤增大,使蚯蚓体内SOD 活性降低。 7 ~28 d 复合组蚯蚓SOD 活性表现为升高-降低走势。 暴露 7 d 时,(Cd 90 mg·kg-1+P 10 mg·kg-1)处理组蚯蚓SOD 活性被激活并且活性高于对照组,复合组SOD 活性总体上与对照组、扑草净单一组相比无显著差异(P>0.05);暴露14 d 时,各复合处理组SOD 活性均被激活,其中(Cd 60 mg·kg-1+P 10 mg·kg-1)处理组 SOD 活性达到最大值;21 d 时,(Cd 30 mg·kg-1+P 10 mg·kg-1)处理组蚯蚓SOD 活性达到最大,在28 d 其他各复合处理组活性均降低;扑草净单一组在7 ~28 d 时SOD 活性均被激活。
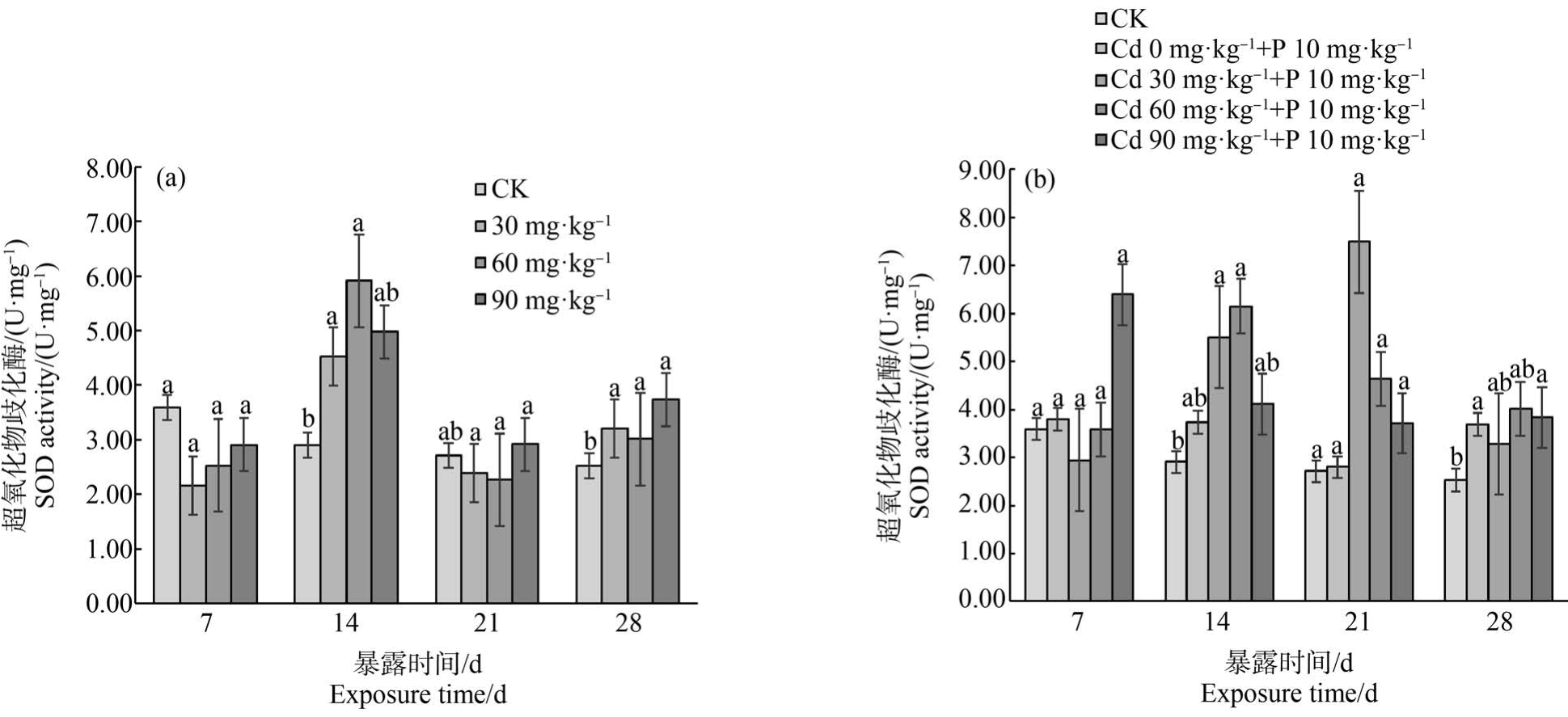
图3 镉单一染毒(a)及镉-扑草净复合染毒(b)对蚯蚓超氧化物歧化酶(SOD)活性的影响
注:不同小写字母表示处理间差异显著(P<0.05)。
Fig.3 Effects of cadmium single exposure (a) and cadmium-prometryne compound exposure (b)on superoxide dismutase (SOD) activity of earthworms
Note: The different lowercase letters indicate significant differences among treatments (P<0.05).
2.3.2 Cd 单一及与扑草净复合作用对CAT 活性的影响
Cd 在不同暴露浓度和暴露时间对蚯蚓体内CAT 酶活性的影响如图4 所示。 蚯蚓在Cd 单一染毒后,不同浓度处理组CAT 活性有不同趋势。 对照组CAT 活性比较稳定,波动较小。 暴露7 d 时,不同处理组CAT 活性均被抑制,说明在染毒初期不同浓度Cd 对蚯蚓机体造成氧化损伤,阻碍CAT 发挥作用,使得蚯蚓体内CAT 活性降低;暴露14 d 时,除高浓度处理组外,其他组CAT 活性均被诱导上升,这可能是蚯蚓机体为应对氧化胁迫所产生过量的H2O2,进而激活CAT 活性,而高浓度处理组中蚯蚓受到较大的氧化胁迫影响,使CAT 受到抑制;暴露21 d 时,60 mg·kg-1处理组 CAT 活性显著高于对照组(P<0.05);暴露 28 d 时,60 mg·kg-1和 90 mg·kg-1处理组与对照组相比无显著差异(P>0.05)。
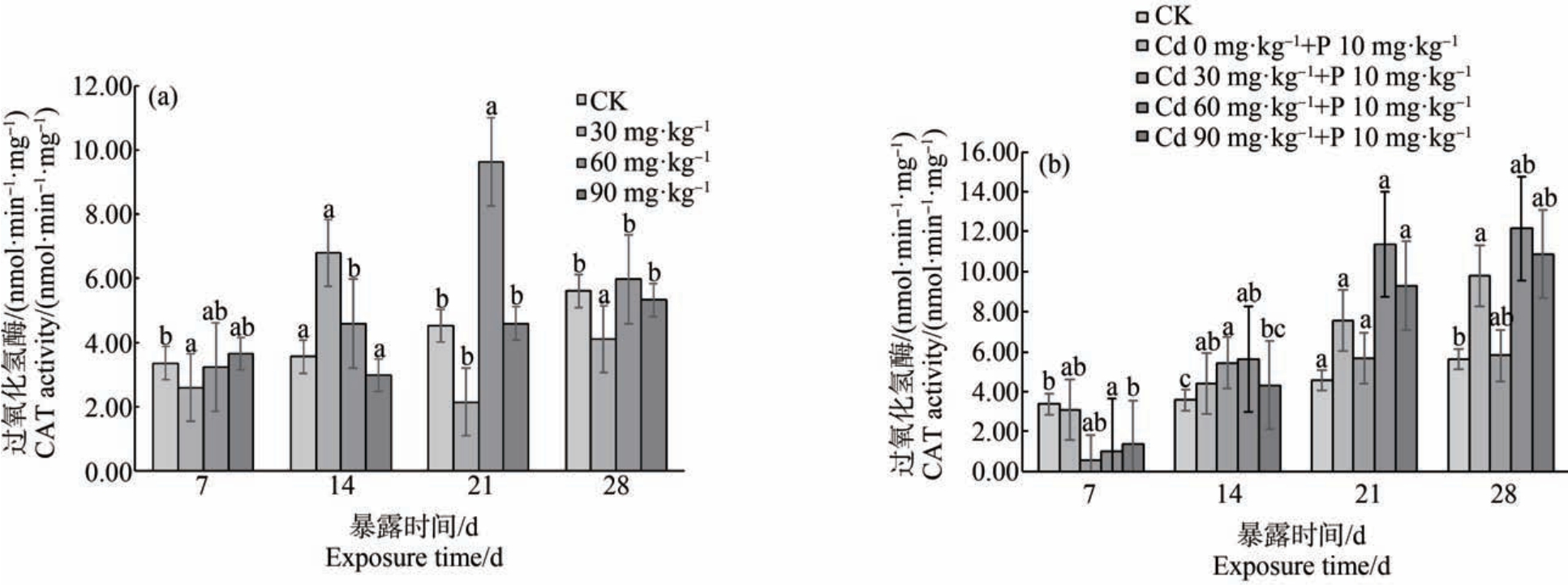
图4 镉单一染毒(a)及镉-扑草净复合染毒(b)对蚯蚓过氧化氢酶(CAT)活性的影响
Fig.4 Effects of cadmium single exposure (a) and cadmium-prometryne compound exposure (b)on catalase (CAT) activity of earthworms
在暴露7 ~28 d 时,不同浓度组CAT 活性随暴露时间延长和暴露浓度增大呈升高趋势,且活性高于Cd 单一作用组;单一扑草净暴露组CAT 活性在试验期内随暴露时间延长呈升高趋势。 暴露7 d时,各复合处理组CAT 活性未被激活;在14 ~28 d时,各组CAT 活性有所激活,其中(Cd 60 mg·kg-1+P 10 mg·kg-1)处理组CAT 活性在第28 天达到最大值。
2.3.3 Cd 单一及与扑草净复合作用对蚯蚓POD活性的影响
Cd 在不同暴露浓度和暴露时间对蚯蚓体内POD 酶活性的影响如图5 所示。 暴露第7 ~14 天时,各处理组POD 活性被激活呈上升趋势;90 mg·kg-1处理组POD 在第14 天达到最大值;暴露21 ~28 d 时,各处理组POD 活性降低受到抑制,在染毒第28 天,各处理组POD 活性仍被抑制,活性降至最低。 总体来看蚯蚓POD 活性表现为先升高后降低。
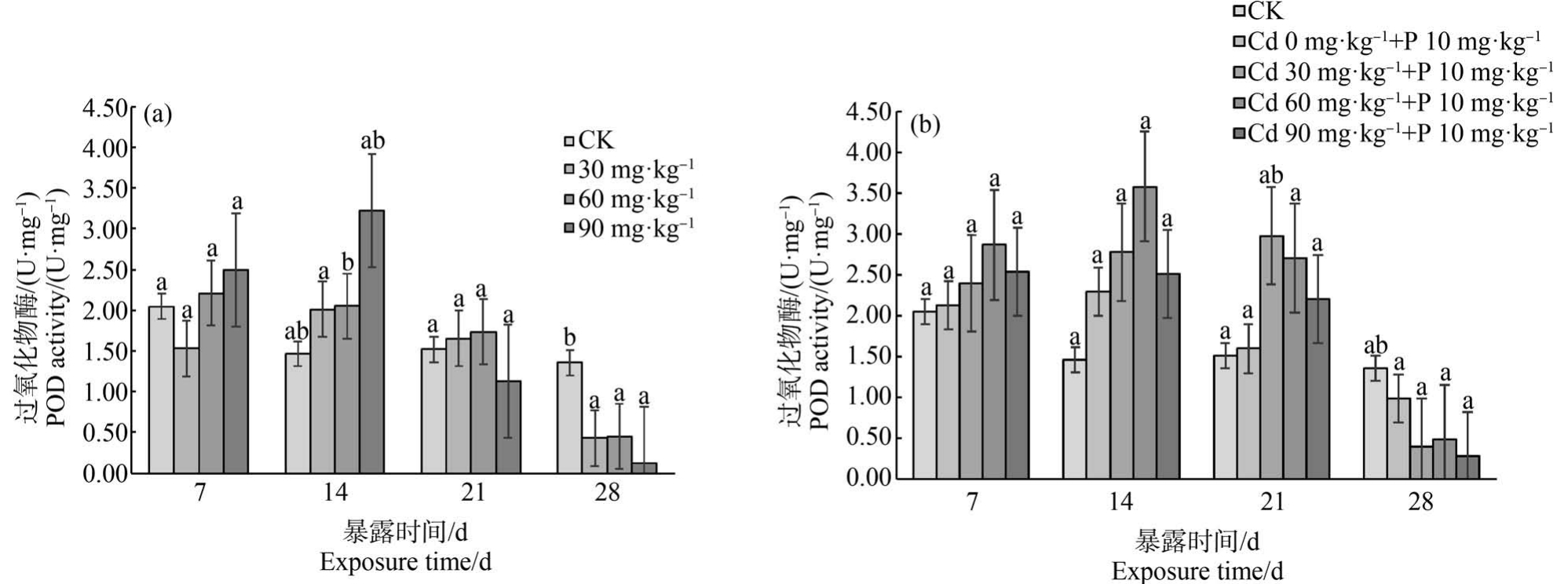
图5 镉单一染毒(a)及镉-扑草净复合染毒(b)对蚯蚓过氧化物酶(POD)活性的影响
Fig.5 Effects of cadmium single exposure (a) and cadmium-prometryne compound exposure (b)on peroxidase (POD) activity of earthworms
第7 ~28 天时,复合处理组蚯蚓体内POD 的活性先升高后降低,在7 ~21 d 高于扑草净单一组;扑草净单一作用组POD 活性随暴露时间延长逐渐降低。 在暴露14 d 时,(Cd 60 mg·kg-1+P 10 mg·kg-1)处理组POD 活性升高并达到最大值;暴露28 d 时,各处理组POD 活性受到抑制并降到最低。
2.4 Cd 单一及与扑草净复合作用对蚯蚓GST 活性的影响
Cd 在不同暴露浓度和暴露时间对蚯蚓体内GST 酶活性的影响如图6 所示。 暴露7 d 时,各处理组GST 活性处于激活状态;第14 天活性下降,在21 d 各处理组 GST 活性上升、28 d 下降。 在整个试验期内各处理组随暴露浓度增加和暴露时间延长GST 活性呈升高-降低-升高-降低的趋势。
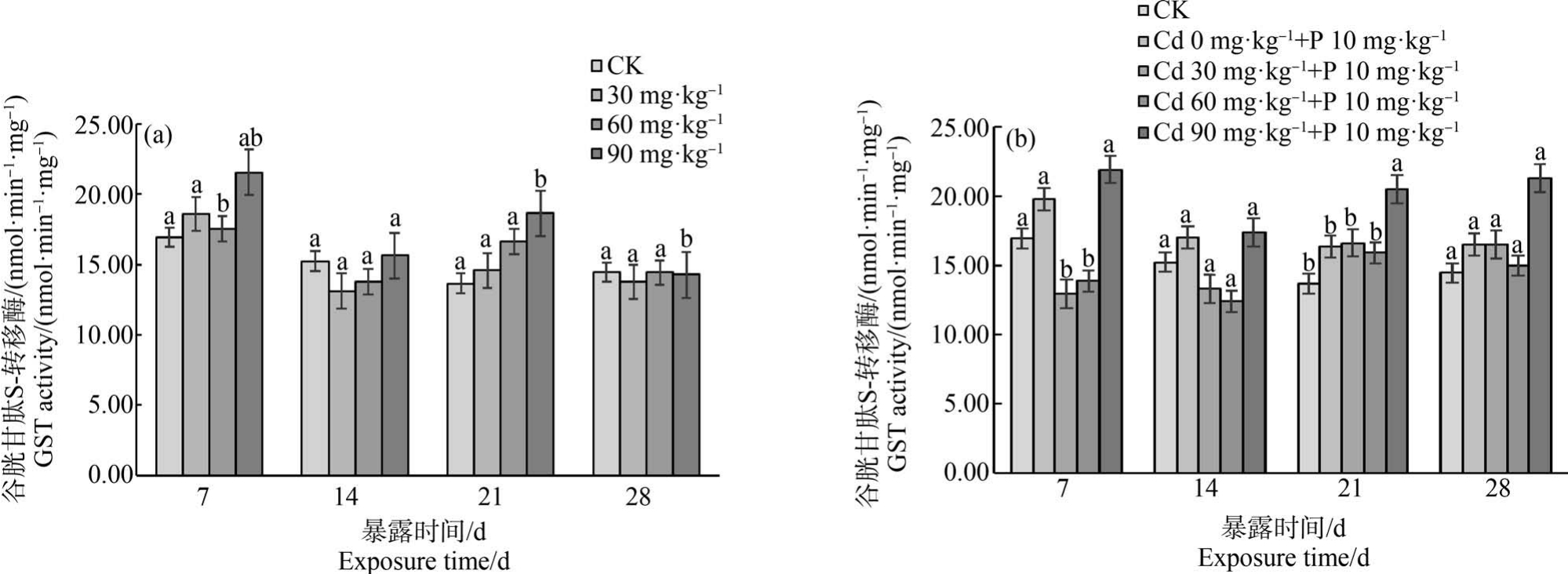
图6 镉单一染毒(a)及镉-扑草净复合染毒(b)对蚯蚓谷胱甘肽S-转移酶(GST)活性的影响
Fig.6 Effects of cadmium single exposure (a) and cadmium-prometryne compound exposure (b)on glutathione S-transferase (GST) activity of earthworms
除(Cd 30 mg·kg-1+P 10 mg·kg-1)、(Cd 60 mg·kg-1+P 10 mg·kg-1)复合处理组蚯蚓体内GST 活性在7 ~14 d 未被激活外,其他处理组GST 活性呈现激活状态。 暴露7 d 时,相较于对照组,(Cd 30 mg·kg-1+P 10 mg·kg-1)、(Cd 60 mg·kg-1+P 10 mg·kg-1)处理组GST 活性明显低于对照组(P<0.05);在暴露21 d,(Cd 90 mg·kg-1+P 10 mg·kg-1)处理组 GST 活性升高,显著高于对照组(P<0.05)。 扑草净单一组在整个试验周期一直处于被激活状态。
2.5 Cd 单一及与扑草净复合作用对蚯蚓MDA 含量的影响
Cd 不同暴露浓度和暴露时间对蚯蚓体内MDA含量的影响如图7 所示。 在整个暴露期各组蚯蚓体内MDA 含量变化和空白对照组相比变化趋势较小,低浓度处理组MDA 含量在第14 天被激活且达到最大值;高浓度处理组MDA 含量在试验周期内呈升高-降低-升高趋势,在第28 天达到最大值。 总体来说,蚯蚓体内MDA 含量为升高后降低至对照水平的走势。

图7 镉单一染毒(a)及镉-扑草净复合染毒(b)对蚯蚓丙二醛(MDA)含量的影响
Fig.7 Effects of cadmium single exposure (a) and cadmium-prometryne compound exposure (b)on malondialdehyde (MDA) content of earthworms
在暴露7 ~28 d,复合处理组MDA 含量随染毒浓度的增加和时间延长含量升高。 暴露14 d 时,(Cd 60 mg·kg-1+P 10 mg·kg-1)处理组 MDA 含量升高且达到最大值;高浓度复合组在整个周期内呈现升高-降低趋势,随时间延长恢复至对照组水平,与对照组无显著性差异(P>0.05)。 在第28 天,各复合处理组MDA 含量逐渐降低并达到最低值。 扑草净单一作用组MDA 含量随时间延长整体呈升高-降低-升高趋势。
3 讨论(Discussion)
本研究以不同浓度的Cd 和扑草净对蚯蚓进行急性毒性染毒试验,观测2 种污染物胁迫下蚯蚓中毒症状。 滤纸接触法试验结果表明,污染物浓度与蚯蚓死亡率之间存在剂量-效应关系,浓度越高死亡率随之上升;扑草净对蚯蚓毒性大于Cd;重金属的水溶性较强,有机污染物脂溶性较强,污染物在进入蚯蚓体内后,毒性存在差异[34-36],造成蚯蚓中毒症状、个体形态不同(如在扑草净染毒状态下蚯蚓体色发黑、生殖环带明显红肿变大)。
急性毒性试验在生态毒理学研究中占据重要地位,滤纸接触法具有便捷快速、易操作等特点,并通过接触生物皮肤获取污染物对其产生的毒性信息[37-38]。 不过此方法存在一定弊端,现实生态环境与滤纸接触法所处环境有较大差异,生态环境中污染物对生物产生的毒性一方面取决于污染物本身毒性,另一方面受污染物所处环境(土壤、水等)的影响[39]。 因此,使用滤纸接触法评估污染物对生物及生态环境产生的影响具有一定的局限性。 而人工土壤法可通过模拟蚯蚓生存环境反映污染物在生态环境中造成的影响[38-40],因此采用人工土壤法测定蚯蚓酶活性相关指标。
3.1 Cd 单一及与扑草净复合作用对蚯蚓抗氧化酶系的影响
SOD 是在生物体内广泛存在的金属酶类[41],可消除氧化过程产生的超氧阴离子自由基![]() [42],并将其生成过氧化氢(H2O2)和氧气(O2),维持生物体内自由基动态平衡,是生物体重要的抗氧化酶之一[43]。 细胞SOD 活性的变化反映了生物细胞中氧化应激的变化,通常这种变化被认为是环境污染的早期生物标志[44]。 在Cd 单一暴露时,蚯蚓SOD 活性表现为抑制-激活,在第14 天蚯蚓体内SOD 活性较空白对照组增强,Cd 胁迫使蚯蚓机体受损,ROS积累较多,破坏蚯蚓体内自由基的动态平衡。 在Cd与扑草净复合作用时,SOD 在前、中期被诱导上升,后期降低。 初期阶段,单一组及复合组SOD 活性较对照组有所降低,因为,在受到外界污染物胁迫时蚯蚓机体进行自我保护,当蚯蚓体内原有的SOD 被消耗殆尽时,活性降低。 蚯蚓在接触有毒物质一段时间后,对当下环境有所适应,SOD 也随之被激活。而在有毒物质的长期影响下,蚯蚓机体受损无法对抗积累过多的ROS,因此复合组SOD 活性与对照组相比有所降低,受到抑制。 王艳等[39]在研究邻苯二甲酸酯类(PAEs)对蚯蚓体内SOD 活性的影响时发现,蚯蚓遭受逆境影响时SOD 活性被诱导,随着暴露浓度升高和暴露时间的延长生物体内细胞膜受损氧化,酶活性降低。 刘嫦娥等[45]研究丁草胺和乙草胺对蚯蚓SOD 活性的影响时也发现酶活性表现为诱导-抑制。 Cd 与扑草净复合组SOD 活性较Cd单一组活性高,原因可能是土壤具有一定的吸附能力并带有负电荷,Cd 离子带正电荷,Cd 离子被吸附,在一定程度上使SOD 活性升高[42,46]。
[42],并将其生成过氧化氢(H2O2)和氧气(O2),维持生物体内自由基动态平衡,是生物体重要的抗氧化酶之一[43]。 细胞SOD 活性的变化反映了生物细胞中氧化应激的变化,通常这种变化被认为是环境污染的早期生物标志[44]。 在Cd 单一暴露时,蚯蚓SOD 活性表现为抑制-激活,在第14 天蚯蚓体内SOD 活性较空白对照组增强,Cd 胁迫使蚯蚓机体受损,ROS积累较多,破坏蚯蚓体内自由基的动态平衡。 在Cd与扑草净复合作用时,SOD 在前、中期被诱导上升,后期降低。 初期阶段,单一组及复合组SOD 活性较对照组有所降低,因为,在受到外界污染物胁迫时蚯蚓机体进行自我保护,当蚯蚓体内原有的SOD 被消耗殆尽时,活性降低。 蚯蚓在接触有毒物质一段时间后,对当下环境有所适应,SOD 也随之被激活。而在有毒物质的长期影响下,蚯蚓机体受损无法对抗积累过多的ROS,因此复合组SOD 活性与对照组相比有所降低,受到抑制。 王艳等[39]在研究邻苯二甲酸酯类(PAEs)对蚯蚓体内SOD 活性的影响时发现,蚯蚓遭受逆境影响时SOD 活性被诱导,随着暴露浓度升高和暴露时间的延长生物体内细胞膜受损氧化,酶活性降低。 刘嫦娥等[45]研究丁草胺和乙草胺对蚯蚓SOD 活性的影响时也发现酶活性表现为诱导-抑制。 Cd 与扑草净复合组SOD 活性较Cd单一组活性高,原因可能是土壤具有一定的吸附能力并带有负电荷,Cd 离子带正电荷,Cd 离子被吸附,在一定程度上使SOD 活性升高[42,46]。
CAT 在抗氧化机制中发挥着重要作用,清除机体H2O2,避免细胞受到 H2O2 的侵害[47]。 Cd 单一染毒时,蚯蚓CAT 活性总体表现为上升-下降。 染毒初期CAT 活性未被激活;在中期时CAT 被激活,抗氧化酶系统发挥作用;染毒后期,随Cd 浓度升高、时间延长,CAT 活性降低,可能是受到长时间Cd暴露,体内污染物大量富集使得机体细胞受损严重,无法处理过量H2O2,最终CAT 活性降低。 与平令文等[48]的研究结果相似,其研究发现蚯蚓在受邻苯二甲酸二乙酯(DEP)暴露的前期、后期CAT 活性受到抑制,与对照组无显著差异,而在受DEP 暴露的中期蚯蚓机体为对抗过量的H2O2,体内CAT 酶活性发挥作用由此被激活而升高。 Cd 与扑草净复合暴露时,CAT 活性为逐渐升高趋势,且活性较Cd、扑草净单一作用时有所上升。 在第7 天复合组蚯蚓体内CAT 活性低于Cd 单一处理组,也低于空白对照组,在复合作用下其毒性大于单一Cd 污染毒性,使蚯蚓体内ROS 含量升高。 伴随染毒时间的延长蚯蚓受到氧化胁迫影响,同时在SOD 共同作用下蚯蚓体内CAT 活性升高;蔡文贵等[49]研究邻苯二甲酸二乙基己酯(DEHP)对翡翠贻贝(Perna viridis)内脏中的酶活性影响时,也发现CAT 有相同的变化现象。
POD 也属于氧化还原酶,且是抗氧化酶系统中不可缺少的成员,对生物体代谢起一定的防御作用[47]。 在Cd 单一及与扑草净复合暴露时,蚯蚓体内POD 活性的变化趋势是上升-下降并与对照组无较大差异。 在复合暴露初期,Cd 与扑草净复合作用对蚯蚓产生的氧化胁迫使得POD 被激活,H2O2 有一定程度消除;在复合暴露28 d 时,污染物的毒性增强使蚯蚓机体受损,因而各浓度组POD 活性降低,与对照组无显著性差异。 Cd 与扑草净复合污染时,POD 活性较Cd 单一作用时高,复合污染使蚯蚓机体对外界环境产生更大反应,由此生成较多的POD。 王飞菲等[38]在研究草甘膦对蚯蚓的氧化胁迫时发现低浓度草甘膦的暴露下,CAT 在清除H2O2时起首要作用,当 H2O2 过量时 POD 协同发挥作用。
3.2 Cd 单一及与扑草净复合作用对蚯蚓GST 活性的影响
GST 在生物体遭遇环境污染等逆境胁迫时可有效排除入侵机体的有毒污染物、细胞毒素和基因毒素等,维持生物体动态平衡[50]。 本实验中,在Cd单一作用下随着GST 活性升高有毒物质有所清除,后期GST 活性降低。 在复合暴露期间,扑草净的影响作用下,蚯蚓机体中GST 的活性单一Cd 污染组,说明生物体有一定的自我修复能力,但由于长时间受逆环境胁迫GST 活性下降与对照组无显著差异。三氯卡班和Cd 的复合作用对蚯蚓GST 活性影响的试验结果显示,复合组在长时间污染暴露下机体有毒物质积累过量,GST 合成受到影响,导致GST 活性下降[51]。 这与本试验中经过Cd 和扑草净处理后,蚯蚓体内GST 活性变化趋势相一致。 在整个复合作用期间GST 活性高于Cd 单一作用的GST 活性,同时在此期间SOD 和CAT 活性被激活,说明蚯蚓体内GST 起到排除有毒物质的作用。
3.3 Cd 单一及与扑草净复合作用对蚯蚓MDA 含量的影响
MDA 是膜脂过氧化最重要的产物并且会造成膜的损伤加剧、细胞的代谢功能无法正常发挥作用,学者采用MDA 含量来判断细胞代谢以及其他功能损伤状况[52]。 不论Cd 单一作用还是与扑草净复合污染时,蚯蚓体内MDA 含量可归纳为先升高后降低。 暴露初期蚯蚓在污染环境的胁迫下抗氧化酶系统未能及时发挥作用,ROS 增多细胞代谢功能减弱,蚯蚓体腔细胞受到损伤,MDA 含量升高。 钟碧瑾等[53]发现有机磷农药随着时间与浓度的增加沼水蛙蝌蚪(Hylarana guentheri tadpole)机体 MDA 含量也增加。 在暴露后期,抗氧化酶活性系统有所恢复并发挥作用,同时土壤也具有一定的吸附能力,能吸收一部分有毒污染物含量,使MDA 含量有所降低。
通过人工土壤法对蚯蚓进行染毒研究,结果表明Cd 单一及与扑草净复合暴露均能引起蚯蚓体内抗氧化酶活性变化,机体内自由基累积最终造成过氧化损伤。 实验中所设定的污染物浓度较高,污染物在低剂量水平下对蚯蚓所造成的生态毒理效应在本研究中没有深入研究,因此有待进一步结合细胞、组织和基因表达来探索复合污染对蚯蚓所造成的生态毒性效应,为土壤风险评估及早期预警提供理论依据。
[1]赵慧, 何博, 王铁宇, 等. 我国南方典型城市土壤重金属污染特征及源汇关系分析[J]. 环境科学学报, 2019,39(7):2231-2239
Zhao H, He B, Wang T Y, et al. Pollution characteristics of heavy metals and source-sink relationship in typical city of the South China [J].Acta Scientiae Circumstantiae,2019,39(7):2231-2239 (in Chinese)
[2]陈能场, 郑煜基, 何晓峰, 等. 《全国土壤污染状况调查公报》探析[J]. 农业环境科学学报, 2017, 36(9): 1689-1692
Chen N C, Zheng Y J, He X F, et al. Analysis of the Report on the National General Survey of Soil Contamination [J]. Journal of Agro-Environment Science, 2017, 36(9):1689-1692 (in Chinese)
[3]孟敏, 杨林生, 韦炳干, 等. 我国设施农田土壤重金属污染评价与空间分布特征[J]. 生态与农村环境学报,2018,34(11):1019-1026
Meng M, Yang L S, Wei B G, et al. Contamination assessment and spatial distribution of heavy metals in greenhouse soils in China [J].Journal of Ecology and Rural Environment,2018,34(11):1019-1026 (in Chinese)
[4]郝汉舟, 靳孟贵, 李瑞敏, 等. 耕地土壤铜、镉、锌形态及生物有效性研究[J]. 生态环境学报, 2010, 19(1): 92-96
Hao H Z, Jin M G, Li R M, et al.Fractionations and bioavailability of Cu,Cd and Zn in cultivated land [J].Ecology and Environmental Sciences, 2010, 19(1): 92-96 (in Chinese)
[5]倪中应, 谢国雄, 章明奎. 酸化对耕地土壤镉铅有效性及农产品中镉铅积累的影响[J]. 江西农业学报, 2017,29(8):52-56
Ni Z Y, Xie G X, Zhang M K. Effects of acidification on bioavailability of cadmium and lead in cultivated land soil and their accumulation in agricultural products [J]. Acta Agriculturae Jiangxi,2017,29(8):52-56 (in Chinese)
[6]梁栋. 扑草净降解菌DY-1 的筛选、鉴定及特性的研究[D]. 哈尔滨: 东北农业大学,2016:1-5
Liang D. Screening and identification of prometryn-degrading bacterium DY-1 and its characteristics [D]. Harbin: Northeast Agricultural University,2016: 1-5 (in Chinese)
[7]石傲傲, 郑毅, 张坤, 等. 香根草对扑草净胁迫的响应和去除效果[J]. 福建农林大学学报: 自然科学版,2021,50(2):170-177
Shi A A,Zheng Y,Zhang K,et al.Stress response and removal efficiency of Vetiveria zizanioides for prometryn[J].Journal of Fujian Agriculture and Forestry University:Natural Science Edition, 2021, 50(2): 170-177 (in Chinese)
[8]陈立杰. 茶叶和茶园土壤中扑草净与莠去津残留快速测定技术[J]. 农药,2019,58(10):745-748
Chen L J. Rapid determination technique for prometryn and atrazine residues in tea and tea garden soil [J]. Agrochemicals,2019,58(10):745-748 (in Chinese)
[9]曹军. 除草剂扑草净在土壤环境中的行为研究[D]. 南京: 南京农业大学,2008:1-6
Cao J. Study on the behavior of prometryne in soil environment [D]. Nanjing: Nanjing Agricultural University,2008:1-6 (in Chinese)
[10]张骞月, 吴伟. 扑草净在养殖水体中的生态毒理效应及其微生物降解的研究进展[J]. 生物灾害科学, 2014,37(1):64-69
Zhang Q Y, Wu W. Research advance in eco-toxical effects and microbial degradation of prometryne in aquaculture water [J].Biological Disaster Science,2014,37(1):64-69 (in Chinese)
[11]刘长江, 门万杰, 刘彦军, 等. 农药对土壤的污染及污染土壤的生物修复[J]. 农业系统科学与综合研究,2002,18(4):291-292,297
Liu C J, Men W J, Liu Y J, et al. The pollution of pesticides in soils and its bioremediation [J]. System Sciemces and Comprehensive Studies in Agriculture, 2002, 18(4):291-292,297 (in Chinese)
[12]Jiang W Q, Gao J, Cheng Z, et al. The effect of antibiotics on the persistence of herbicides in soil under the combined pollution [J]. Chemosphere,2018,204:303-309
[13]Alvarado-Zambrano D, Green-Ruiz C R. Assessment of the pollution status and human health risk in soils from an agricultural valley in northwest Mexico [J]. Water, Air, &Soil Pollution,2019,230(9):1-13
[14]孟顺龙, 瞿建宏, 宋超, 等. 农药灭多威和辛硫磷对罗非鱼的联合毒性研究[J]. 农业环境科学学报, 2014, 33(2):257-263
Meng S L, Qu J H, Song C, et al. Joint toxicity of pesticides methomyl and phoxim to tilapia (Oreochromis niloticus) [J]. Journal of Agro-Environment Science,2014,33(2):257-263 (in Chinese)
[15]张融, 范文宏, 唐戈, 等. 水体中重金属镉和锌对大型蚤联合毒性效应的初步研究[J]. 生态毒理学报, 2008,3(3):286-290
Zhang R,Fan W H,Tang G,et al.A preliminary study on joint toxic effects of Cd and Zn on Daphnia magna[J].A-sian Journal of Ecotoxicology, 2008, 3(3): 286-290 (in Chinese)
[16]刘文丽, 徐冬梅, 刘惠君, 等. 异丙甲草胺对蚯蚓体重及酶活性的影响[J].环境科学学报,2007,27(12):2025-2031
Liu W L, Xu D M, Liu H J, et al. Effects of metolachlor on the weight and enzyme activities of earthworms [J].Acta Scientiae Circumstantiae, 2007, 27(12): 2025-2031(in Chinese)
[17]卢春凤, 王以美, 彭双清, 等. 2,3,7,8-四氯二苯并二噁英和Aroclor 1254 对大鼠睾丸的单独和联合毒性效应[J]. 生态毒理学报,2009,4(1):63-68
Lu C F, Wang Y M, Peng S Q, et al.The alone and combined toxic effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin and Aroclor 1254 on testes of rats [J]. Asian Journal of Ecotoxicology,2009,4(1):63-68 (in Chinese)
[18]邵将, 张宗鹏, 谢宇震, 等. 蚯蚓在生态毒理试验中的应用研究[J]. 农业与技术,2020,40(16):24-26
[19]苏连水, 杨桂玲, 吴声敢, 等. 三唑磷和氯氟氰菊酯对蚯蚓的联合毒性效应[J]. 生态毒理学报, 2016, 11(3):294-301
Su L S, Yang G L, Wu S G, et al. The single and joint toxicity of tiazophos and cyhalothrin to earthworm [J].A-sian Journal of Ecotoxicology, 2016, 11(3): 294-301 (in Chinese)
[20]丁龙, 李冬冬, 汪承润, 等. 土壤镉诱导赤子爱胜蚓的氧化损伤、防御反应及其致毒阈值[J]. 环境化学,2014,33(7):1115-1122
Ding L, Li D D, Wang C R, et al. Oxidative damage, defense response and toxicity threshold in Eisenia foetida exposed to cadmium-polluted soils [J]. Environmental Chemistry,2014,33(7):1115-1122 (in Chinese)
[21]Huang C D,Ge Y,Yue S Z,et al.Microplastics aggravate the joint toxicity to earthworm Eisenia fetida with cadmium by altering its availability [J].The Science of the Total Environment,2021,753:142042
[22]宋欣媛, 吴培福, 吴博, 等. 草甘膦和扑草净对蚯蚓体内SOD 和AChE 酶活性的影响[J]. 江西农业大学学报,2018,40(2):371-377
Song X Y,Wu P F,Wu B,et al.The activities of superoxide dismutase and acetyl cholinesterase in vivo earthworm affected by glyphosate and prometryn [J].Acta Agriculturae Universitatis Jiangxiensis, 2018, 40(2): 371-377 (in Chinese)
[23]Sinkakarimi M H, Solgi E, Hosseinzadeh Colagar A. Interspecific differences in toxicological response and subcellular partitioning of cadmium and lead in three earthworm species [J]. Chemosphere,2020,238:124595
[24]Zhou H R, Zhang T X, Zhuang J Y, et al. Study on the regulation of earthworm physiological function under cadmium stress based on a compound mathematical model[J]. Environmental Toxicology and Pharmacology, 2020,80:103499
[25]张骞月, 吴伟. 扑草净在养殖水体中的生态毒理效应及其微生物降解的研究进展[J]. 生物灾害科学, 2014,37(1):64-69
Zhang Q Y, Wu W. Research advance in eco-toxical effects and microbial degradation of prometryne in aquaculture water [J].Biological Disaster Science,2014,37(1):64-69 (in Chinese)
[26]刘修园, 赵海刚, 陈志厚, 等. 氟虫双酰胺对蚯蚓的生化毒性与细胞毒性研究[J]. 生态毒理学报,2017,12(4):293-301
Liu X Y,Zhao H G,Chen Z H,et al.Biochemical toxicity and cytotoxicity of flubendiamide on earthworms (Eisenia fetida) [J]. Asian Journal of Ecotoxicology, 2017, 12(4):293-301 (in Chinese)
[27]赵作媛, 朱江, 陆贻通, 等. 镉-菲复合污染对蚯蚓急性毒性效应的研究[J]. 上海交通大学学报: 农业科学版,2006,24(6):553-557
Zhao Z Y,Zhu J,Lu Y T,et al.Acute toxicological effects of Cd and Phe single and combined pollution on earthworm Eisenia fetida [J].Journal of Shanghai JiaoTong U-niversity: Agricultural Science, 2006, 24(6): 553-557 (in Chinese)
[28]窦晶晶. Cd、Cr 单一及复合污染对赤子爱胜蚓的毒理研究[D]. 杨凌: 西北农林科技大学,2015:50-51
Dou J J. Individual and combined toxicity of cadmium and chromium on the earthworm Eisenia fetida [D]. Yangling: Northwest A & F University,2015: 50-51 (in Chinese)
[29]徐镜波, 袁晓凡, 郎佩珍. 过氧化氢酶活性及活性抑制的紫外分光光度测定[J]. 环境化学,1997,16(1):73-76
Xu J B, Yuan X F, Lang P Z. The determination of enzymic activity and its inhibition on catalase by ultraviolet spectrophotometry [J].Environmental Chemistry,1997,16(1):73-76 (in Chinese)
[30]Dhindsa R S, Plumb-Dhindsa P, Thorpe T A. Leaf senescence: Correlated with increased levels of membrane permeability and lipid peroxidation, and decreased levels of superoxide dismutase and catalase [J]. Journal of Experimental Botany,1981,32(1):93-101
[31]张志良, 瞿伟菁. 植物生理学实验指导[M].3 版. 北京:高等教育出版社,2003:123-124
Zhang Z L,Qu W J.Guide of Experiment of Plant Physiology [M]. Beijing: Higher Education Press, 2003: 123-124 (in Chinese)
[32]Habig W H,Pabst M J,Jakoby W B.Glutathione S-transferases. The first enzymatic step in mercapturic acid formation [J]. The Journal of Biological Chemistry, 1974,249(22):7130-7139
[33]Livingstone D R,Martinez P G,Michel X,et al.Oxyradical production as a pollution-mediated mechanism of toxicity in the common mussel, Mytilus edulis L., and other molluscs [J]. Functional Ecology,1990,4(3):415
[34]Morgan J E, Morgan A J. The distribution and intracellular compartmentation of metals in the endogeic earthworm Aporrectodea caliginosa sampled from an unpolluted and a metal-contaminated site [J]. Environmental Pollution,1998,99(2):167-175
[35]Vijver M G, Wolterbeek H T, Vink J P M, et al. Surface adsorption of metals onto the earthworm Lumbricus rubellus and the isopod Porcellio scaber is negligible compared to absorption in the body [J]. Science of the Total Environment,2005,340(1-3):271-280
[36]段晓尘. 重金属和有机污染物对赤子爱胜蚓(Eisenia fetida)的生态毒理效应及机制差异[D].南京: 南京农业大学,2015:6-10
Duan X C. Ecotoxicological effects and different mechanisms of heavy metal and organic pollutants on earthworm (Eisenia fetida) [D]. Nanjing: Nanjing Agricultural University,2015:6-10 (in Chinese)
[37]王彦华, 俞卫华, 杨立之, 等.22 种常用除草剂对蚯蚓(Eisenia fetida)的急性毒性[J]. 生态毒理学报, 2012, 7(3):317-325
Wang Y H, Yu W H, Yang L Z, et al. Acute toxicity of twenty-two commonly used herbicides to earthworm(Eisenia fetida) [J]. Asian Journal of Ecotoxicology, 2012, 7(3):317-325 (in Chinese)
[38]王飞菲, 郑梦梦, 刘树海, 等. 两种除草剂对蚯蚓的急性毒性及氧化胁迫效应[J]. 生态毒理学报, 2014, 9(6):1210-1218
Wang F F, Zheng M M,Liu S H,et al.Acute toxicity and oxidative stress of two herbicides on earthworm Eisenia fetida [J]. Asian Journal of Ecotoxicology, 2014, 9(6):1210-1218 (in Chinese)
[39]王艳, 马泽民, 吴石金.3 种PAEs 对蚯蚓的毒性作用和组织酶活性影响的研究[J].环境科学,2014,35(2):770-779
Wang Y, Ma Z M, Wu S J. Study on the effect of enzymatic activity and acute toxicity of three PAEs on Eisenia foetida [J]. Environmental Science, 2014, 35(2): 770-779(in Chinese)
[40]薛银刚, 王晓蓉, 顾雪元, 等. 四溴双酚A 对赤子爱胜蚓的急性毒性及抗氧化防御系统酶的影响[J]. 生态毒理学报,2009,4(1):93-100
Xue Y G,Wang X R,Gu X Y,et al.Acute toxicity of tetrabromobisphenol A to earthworms Eisenia fetida and its effects on antioxidant defense system enzymes [J]. Asian Journal of Ecotoxicology,2009,4(1):93-100 (in Chinese)
[41]姚洪伟, 沈根祥, 朱江, 等. 全氟辛烷磺酸对蚯蚓体内4种酶活性的影响[J]. 环境科学与技术,2013,36(4): 5-8,27
Yao H W, Shen G X, Zhu J, et al. Activity of antioxidant enzymes of PFOS pollution on Eisenia foetida [J]. Environmental Science & Technology,2013,36(4):5-8,27 (in Chinese)
[42]Pan L Q, Ren J Y, Liu J. Responses of antioxidant systems and LPO level to benzo(a)pyrene and benzo(k)fluoranthene in the haemolymph of the scallop Chlamys ferrari [J]. Environmental Pollution,2006,141(3):443-451
[43]徐楠, 施国新, 杜开和, 等. Hg、Cd 及其复合污染对浮萍叶片的毒害研究[J]. 南京师大学报: 自然科学版,2002,25(3):109-115
Xu N,Shi G X,Du K H,et al.The study on effect of Hg,Cd and their combined pollution in leaves of Lemna minor L. [J]. Journal of Nanjing Normal University: Natural Science Edition,2002,25(3):109-115 (in Chinese)
[44]Xu Q S, Min H L, Cai S J, et al. Subcellular distribution and toxicity of cadmium in Potamogeton crispus L. [J].Chemosphere,2012,89(1):114-120
[45]刘嫦娥, 段昌群, 王旭, 等. 丁草胺和乙草胺对蚯蚓CAT 和SOD 活性的影响[J]. 环境化学, 2008, 27(6):756-761
Liu C E, Duan C Q, Wang X, et al. Effects of butachlor and acetochlor in soil on antioxidant enzymes (SOD and CAT) in earthworms (Eisenia fetida) [J]. Environmental Chemistry,2008,27(6):756-761 (in Chinese)
[46]李艳强. 甲基叔丁基醚单一及与镉复合对蚯蚓生理指标和DNA 损伤影响研究[D]. 泰安: 山东农业大学,2015:36-46
Li Y Q.Effects of methyl tert-butyl ether (MTBE) of sin-gle factor and combined with cadmium on earthworm physiological indicators and DNA damage [D]. Tai’an:Shandong Agricultural University, 2015: 36-46 (in Chinese)
[47]李紫薇. 苯醚甲环唑与镉复合作用对蚯蚓的毒性效应[D]. 泰安: 山东农业大学,2020:30-34
Li Z W. The toxic effects of difenoconazole and Cd combined pollution on earthworms [D]. Tai’an: Shandong Agricultural University,2020:30-34 (in Chinese)
[48]平令文, 李现旭, 张翠, 等. DEP 对蚯蚓抗氧化酶系的影响及DNA 损伤[J]. 环境科学, 2018, 39(10): 4825-4833
Ping L W, Li X X, Zhang C, et al. Oxidative stress and DNA damage induced by DEP exposure in earthworms[J]. Environmental Science, 2018, 39(10): 4825-4833 (in Chinese)
[49]蔡文贵, 秦洁芳, 贾晓平, 等. 邻苯二甲酸二乙基己酯对翡翠贻贝(Perna viridis)生化指标的影响[J]. 生态学杂志,2012,31(1):100-105
Cai W G,Qin J F,Jia X P,et al.Effects of di-(2-ethylhexyl) phthalate on the biochemical indices of green mussel(Perna viridis) [J]. Chinese Journal of Ecology, 2012, 31(1):100-105 (in Chinese)
[50]雷安平, 陈欢, 黎双飞, 等. 谷胱甘肽S-转移酶的功能、应用及克隆表达[J].环境科学与技术,2009,32(12):85-91
Lei A P, Chen H, Li S F, et al. Function, application, cloning and expression of glutathione S-transferases [J]. Environmental Science & Technology, 2009, 32(12): 85-91(in Chinese)
[51]李倩倩. 三氯卡班和镉复合作用对蚯蚓的毒性研究[D]. 泰安: 山东农业大学,2020:33-38
Li Q Q. Toxicity of triclocarban and cadmium on earthworms [D]. Tai’an: Shandong Agricultural University,2020:33-38 (in Chinese)
[52]宋超, 陈家长, 胡庚东, 等. 除草剂氟乐灵及其降解过程对斑马鱼氧化应激状况的影响[J]. 生态环境学报,2017,26(3):468-472
Song C, Chen J Z, Hu G D, et al.Effects of herbicide trifluralin and its degradation on the oxidative stress of zebrafish [J].Ecology and Environmental Sciences,2017,26(3):468-472 (in Chinese)
[53]钟碧瑾, 姚丹, 刘娟娟, 等. 两种有机磷农药对沼水蛙蝌蚪抗氧化系统及MDA 浓度的影响[J]. 福建师范大学学报: 自然科学版,2009,25(2):91-96
Zhong B J, Yao D, Liu J J, et al. Effects of two organophosphorus insecticides on the antioxidant system and MDA content of Hylarana guentheri tadpoles [J]. Journal of Fujian Normal University: Natural Science Edition,2009,25(2):91-96 (in Chinese)