脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON),化学名为3α,7α,15-三羟基-12,13-环氧单端孢霉-9-烯-8-酮,CASRN 为51481-10-8,又称呕吐毒素(vomitoxin),结构如图1 所示,是禾谷镰刀菌(Fusarium graminearum)和黄色镰刀菌(Fusarium culmorum)等真菌侵染谷物及其制品产生的有毒代谢产物[1-2]。DON 能引发人和禽畜拒食、呕吐、生长延迟、生殖紊乱等症状,对人畜造成伤害[3]。 在我国,DON 在小麦和玉米中检出阳性率和污染水平均较高[1-2],小麦和玉米中DON 的检出率基本呈现由南向北逐渐增高之势。 DON 污染水平一般在 0.3 ~ 1 mg·kg-1,部分甚至超过 5 mg·kg-1[1-2]。 为避免 DON通过饲料污染禽畜产品,粮食和饲料的DON 脱除非常重要。

图1 脱氧雪腐镰刀菌烯醇(DON)的结构及其在生物体内的转化过程
注:DOM-1 表示脱环氧雪腐镰刀菌烯醇;3-keto-DON 表示3-酮基脱氧雪腐镰刀菌烯醇;3-epi-DON 表示3-异构化脱氧雪腐镰刀菌烯醇。
Fig.1 The deoxynivalenol (DON) structure and the metabolites in organisms
Note: DOM-1 is de-epoxy-deoxynivalenol;3-keto-DON is 3-keto-deoxynivalenol;3-epi-DON is 3-epi-deoxynivalenol.
昆虫是世界上最繁盛的动物类群之一[3-5]。 由于真菌毒素广泛存在于各种粮食中,很多植食性昆虫也不可避免地通过取食暴露于真菌毒素污染。 近年来,科学家发现昆虫可以通过一系列的生理过程,将其摄入的真菌毒素代谢或排出体外[6-12]。 黄粉虫(Tenebrio molitor larvae)、黑水牤(Hermetia illucens larvae)和黑菌虫(Alphitobius diaperinus Panzer)等昆虫能够代谢50% ~80%摄入的玉米赤霉烯酮、黄曲霉素和 DON 等真菌毒素[6]。 van Broekhoven 等[7]发现部分DON 及3-乙酰基脱氧雪腐镰刀菌烯醇(3-ADON)和15-乙酰基脱氧雪腐镰刀菌烯醇(15-ADON)能够被代谢和排出黄粉虫体外,24 h 后虫体内即检测不到DON 残留。 黄粉虫对DON 的代谢率高达80% ~96%,同时,肠道中也检测到DON 的环氧开环代谢产物脱环氧雪腐镰刀菌烯醇(DOM-1)[6-12],由此可见黄粉虫肠道微生物中存在着DON 降解菌。
黄粉虫(Tenebrio molitor)是非常具有代表性的一种食用昆虫品种,属于鞘翅目(Coleoptera),拟步甲科(Tenebrionidae),粉甲属(Lepidoptera)。 目前,DON在昆虫体内代谢和毒理学研究鲜有报道。 本研究探究了DON 超标的饲料对黄粉虫的影响,同时将考察DON 在黄粉虫体内的代谢规律。
1 材料与方法(Materials and methods)
1.1 试剂和生物材料
脱氧雪腐镰刀菌烯醇(DON)和13C 标记的DON稳定同位素标准溶液(100 mg·L-1)购自Romer 公司(美国)。 甲醇、乙腈、乙酸铵、甲酸和乙酸均为HPLC 级,购自默克公司(美国)。 实验用水为Milli-Q 超纯水。
实验用黄粉虫(Tenebrio molitor larvae)购自北京本地花鸟鱼菜市场。 在实验室人工气候箱中(25℃,湿度60%)驯化1 周后进行实验。 驯养采用的饲料为小麦粉,由2020年黄淮海地区生产的小麦加工制成。
1.2 实验仪器
四极杆/静电场轨道阱高分辨质谱仪(Q-Exactive,赛默飞世尔科技公司,美国);快速液相色谱仪(UltiMate 3000,赛默飞世尔科技公司,美国)用于小麦 粉、 黄 粉 虫 体 内 和 粪 便 中 DON、 3AcDON、15AcDON 及其代谢产物的分析。
液相色谱条件:Waters 公司CORTECSTM UPLC C18 柱(100 mm×2.1 mm,1.6 μm),柱温为 40 ℃,进样量 2 μL。 流动相:A 为甲醇,B 为含 1%(体积分数)的甲酸和1 mmol·L-1 乙酸铵的水溶液,流速0.3 mL·min-1。 梯度洗脱条件:0 ~2 min,90% B;2~3 min,90% ~80% B;3 ~4 min,80% ~79% B;4~5 min,79% ~74% B;5 ~7 min,74% B;7 ~7.5 min,74% ~40% B;7.5 ~10.5 min,40% B;10.5 ~13.5 min,40% B;13.5 ~14.5 min,40% ~5% B;14.5~17 min,5% B;17 ~18 min,5% ~90% B;18 ~21 min,90% B。
质谱条件:加热电喷雾离子源(HEST)温度为300 ℃;毛细管电压为3.2 kV;离子传输管温度为320 ℃。 Full scan/ddms2 扫描模式:采集范围为200~800 Da,正离子采集;一级质谱分辨率为70 000 FWHM,二级质谱分辨率为17 500 FWHM,碰撞池能量(NCE)为35 eV。
1.3 DON 加标小麦粉饲料的制备
我国国家标准《食品安全国家标准食品中真菌毒素限量》(GB 2761—2017)[13]规定,谷物及谷物制品中DON 的限定量为1 mg·kg-1,需通过 UPLCMS/MS 技术对小麦粉原样进行多毒素检测。 为考察黄粉虫对低(low dosage, LD)、中(medium dosage,MD)、高(high dosage, HD)3 种剂量 DON 污染的小麦粉饲料的耐受情况,需人工掺毒制备中浓度、高浓度污染的小麦粉饲料,相关方法如下:分别准确称取0.815 mg 和1.63 mg DON 毒素标准品,加入2 mL水涡旋振荡至完全溶解,分别将DON 水溶液与5.0 g 饲料混匀,然后再与10.0 g 饲料混匀,以此方式逐渐加入饲料混匀,最后将490 g 饲料全部混匀,分别制成5 mg·kg-1中剂量组和8 mg·kg-1高剂量组的掺毒饲料,未经人工添加DON 的小麦粉作为低剂量对照组。
混匀后采用四分法取样,对人工掺毒饲料中DON 的浓度进行检测,以评价掺毒的均一性。
1.4 DON 暴露实验
驯养后的黄粉虫禁食48 h,在温度(25±1) ℃、湿度60%的条件下进行DON 暴露。 在250 mL 烧杯中放入30.0 g 黄粉虫(约270 条),每3 d 投喂黄粉虫质量10%的低、中、高3个浓度(分别定义为LD、MD、HD)的DON 染毒小麦粉,每组设置2个平行。实验期间,每3 d 测定黄粉虫体质量、收集粪便并称量,剔除死亡黄粉虫,记录黄粉虫及其粪便质量、死亡黄粉虫的数量,暴露时间为14 d。 最后一次喂食后,在 0、1、2、4、8、12、24 和 48 h 分别取黄粉虫 3.0 g,于-80 ℃保存。 将收集的黄粉虫粪便在研钵中研磨成颗粒均匀的粉末置于-80 ℃冰箱中保存。
1.5 样品前处理
小麦粉样品:准确称取小麦粉5.00 g 样品,加入20 mL 乙腈-水-乙酸(体积比为 70 ∶29 ∶1)提取液,用涡旋混合器混匀1 min,置于涡旋振荡器上提取20 min,然后以 7 000 r·min-1离心 5 min,准确移取0.5 mL 上清液加入0.5 mL 去离子水,涡旋混匀,然后用冷冻离心机以 4 ℃、12 000 r·min-1 离心 10 min,取上清液,过 0.2 μm 有机滤膜,取 180 μL 过滤液加入20 μL 内标液,混匀上机。
黄粉虫样品:将黄粉虫在50 ℃烘箱中烘干至恒重,在研钵中研磨成颗粒均匀的粉末。 称取0.5000 g 加入乙腈-水-乙酸(体积比为 70 ∶29 ∶1)提取液 2 mL。 并用涡旋混合器混匀,置于涡旋振荡器上提取20 min,置于超声机中超声15 min;然后以12 000 r·min-1离心10 min,准确移取0.5 mL 上清液和0.5 mL 去离子水,涡旋混匀,然后用冷冻离心机以4℃、12 000 r·min-1离心20 min,用针头取下层液体,用0.2 μm 有机滤膜过滤,取180 μL 过滤液加入20 μL 内标液,混匀上机。
黄粉虫粪便:称取0.5000 g 加入乙腈-水-乙酸(体积比为 70 ∶29 ∶1)提取液 2 mL。 用涡旋混合器混匀1 min,置于涡旋振荡器上提取20 min,然后以7 000 r·min-1离心5 min,精确移取0.5 mL 上清液加入0.5 mL 去离子水,涡旋混匀,然后用冷冻离心机以 4 ℃、12 000 r·min-1离心 10 min,取上清液过 0.2 μm 有机滤膜,取 180 μL 过滤液加入 20 μL 内标液,混匀上机。
2 结果与讨论(Results and discussion)
2.1 小麦粉中的DON
实际环境中,黄粉虫接触DON 途径主要是膳食暴露。 本研究以DON 染毒小麦粉作为黄粉虫饲料,分析黄粉虫摄入染毒小麦粉后,DON 在黄粉虫体内和排泄物中的DON 残留和代谢产物。 将黄淮海地区2020年生产的小麦制粉,测得其DON 残留为0.25 mg·kg-1,低于食品安全标准GB 2761—2017中DON 的限量1 mg·kg-1。 以该小麦粉作为暴露的对照组,定义为LD 组,再通过向此小麦粉中加入DON 标准物质溶液,以制备DON 污染水平比较高的饲料。 通过液相色谱质谱检测,获得2个不同DON 污染水平的小麦粉饲料样品,分别为5.51 mg·kg-1(MD)和8.83 mg·kg-1(HD)。 后续黄粉虫的 DON暴露将以此3个样品为饲料。
2.2 黄粉虫的DON 暴露
以LD、MD 和 HD 3 组不同 DON 浓度的小麦粉为饲料饲喂黄粉虫,经过3 d 的喂食,观测到染毒小麦粉已全部转化为黄粉虫粪便。 在此期间,黄粉虫将全部染毒饲料啮食干净,并未有剩余的小麦饲料,说明黄粉虫并未对染毒小麦粉有厌食的情况。
对黄粉虫进行14 d 的暴露实验,观测黄粉虫的体质量变化和死亡情况,由表1 可知,LD 组幼虫存活率(85%)>HD 组幼虫存活率(83%)>MD 组幼虫存活率(78%)。 t 检验结果表明不同剂量组之间存活率无显著差异(P>0.05)。 黄粉虫进食高浓度 DON污染的小麦粉并不影响其存活率,通过外推法粗略估计DON 对黄粉虫的半数致死浓度(LC50)>5 000 mg·kg-1,表明DON 对黄粉虫为低毒或无毒。
表1 DON 暴露对黄粉虫生长的影响
Table 1 Effect of DON on the development of Tenebrio molitor L.
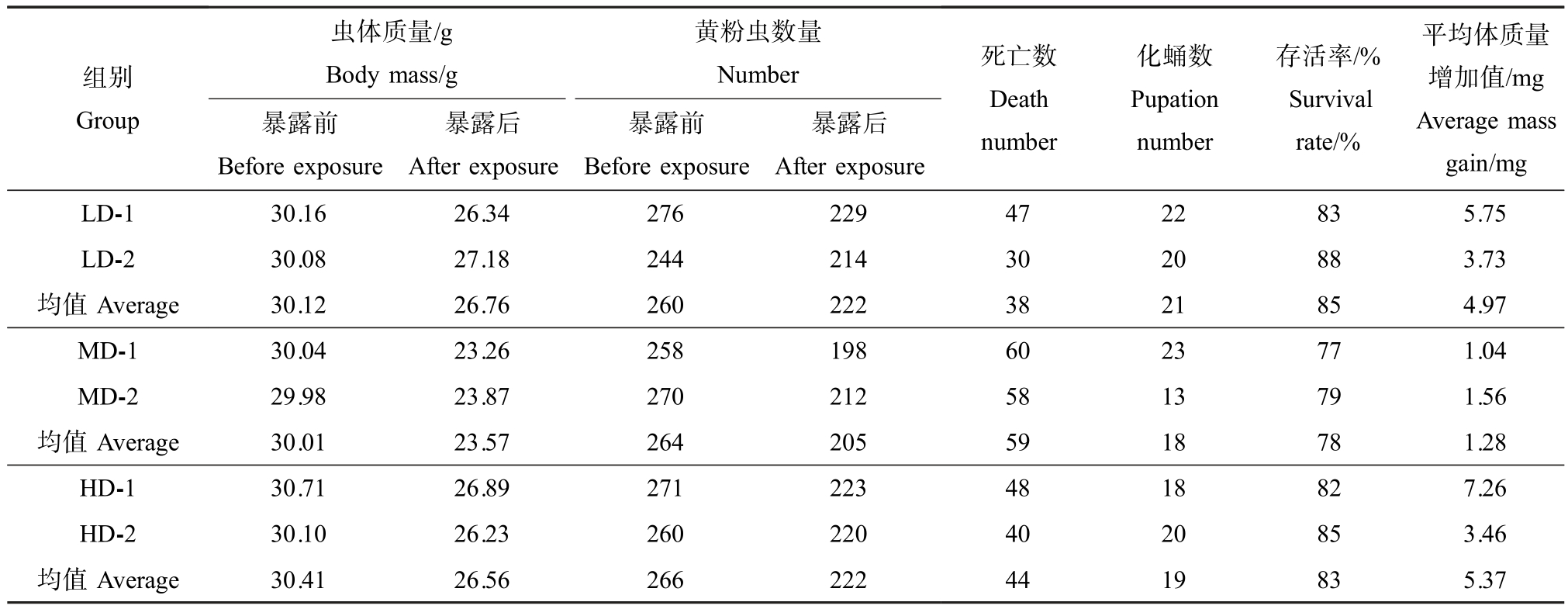
注:LD 代表低剂量组(麦麸中DON 水平为0.25 mg·kg-1);MD 代表中剂量组(麦麸中DON 水平为5.51 mg·kg-1);HD 代表高剂量组(麦麸中DON 水平为 8.83 mg·kg-1)。
Note: LD is low dosage (0.25 mg·kg-1 DON in wheat flour); MD is medium dosage (5.51 mg·kg-1 DON); HD is high dosage (8.83 mg·kg-1 DON).
组别Group虫体质量/g Body mass/g黄粉虫数量Number暴露前Before exposure暴露后After exposure暴露前Before exposure暴露后After exposure死亡数Death number化蛹数Pupation number存活率/%Survival rate/%平均体质量增加值/mg Average mass gain/mg LD-1 30.16 26.34 276 229 47 22 83 5.75 LD-2 30.08 27.18 244 214 30 20 88 3.73均值Average 30.12 26.76 260 222 38 21 85 4.97 MD-1 30.04 23.26 258 198 60 23 77 1.04 MD-2 29.98 23.87 270 212 58 13 79 1.56均值Average 30.01 23.57 264 205 59 18 78 1.28 HD-1 30.71 26.89 271 223 48 18 82 7.26 HD-2 30.10 26.23 260 220 40 20 85 3.46均值Average 30.41 26.56 266 222 44 19 83 5.37
经过14 d 暴露实验,LD 组黄粉虫体质量增加4.97 mg;MD 量组体质量增加1.28 mg;HD 组体质量增加5.37 mg。 通过t 检验表明3个实验组中黄粉虫的增重并无显著性差异(P>0.05=0.407)。 黄粉虫在喂养第5 天时,各组均出现了化蛹的情况,通过t 检验表明3个实验组的化蛹情况,同样无显著性差异(P>0.05)。
2.3 黄粉虫体内DON 残留
在不同的时间点对染毒后的黄粉虫取样,检测其体内DON 浓度。 如图2(a)所示,DON 浓度整体为下降趋势,黄粉虫在进食含DON 的小麦粉前2 h体内毒素呈现上升趋势,2 h 时DON 浓度在体内达到最高值,之后明显下降;在8 h 后DON 开始缓慢下降;24 h 时毒素完全降解。 随着黄粉虫开始取食,其体内的DON 逐渐上升。 黄粉虫体内酶和肠道微生物参与DON 的代谢过程[10]。 DON 在黄粉虫体内的消除过程还包括其排便过程。 在MD 和HD 组中,2 h 后黄粉虫体内的DON 浓度达到峰值,而在LD 组中,DON 达到峰值需要的时间则会比较晚(8 h)。 这说明高浓度的DON 更容易激活黄粉虫体内的代谢通路和肠道微生物对DON 的代谢活性。 在MD 和HD 组中,DON 浓度在黄粉虫体内会出现一个平台,说明DON 的摄入和代谢形成了一个平衡态。 随后,随着DON 污染的饲料经排泄排出体外和代谢水平升高,黄粉虫体内DON 浓度会明显下降,在24 h 后黄粉虫体内没有DON 毒素残留。
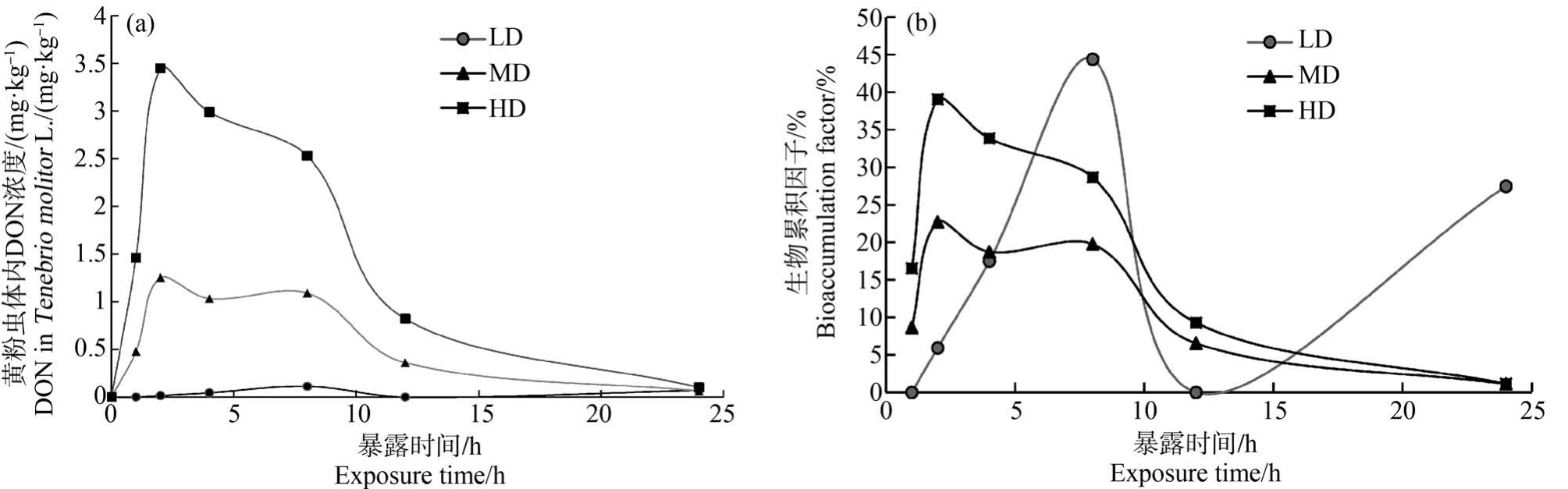
图2 黄粉虫体内DON 浓度变化
注:(a)DON 在黄粉虫体内浓度;(b)DON 在黄粉虫体内的生物累积因子。
Fig.2 The DON concentration in Tenebrio molitor L.
Note: (a) DON concentration in Tenebrio molitor L.; (b) Bioconcentration factors of DON in Tenebrio molitor L..
生物累积因子(bioaccumulation factor, BAF)反映了污染物在动物体内累积效应。
式中:Cfeed 是饲料中的DON 浓度,CTM 为黄粉虫体内的DON 浓度。
当BAF>1 表示污染物在生物体内有生物累积作用,BAF<1 表示无生物累积作用。 生物累积因子用黄粉虫体内DON 的浓度与饲料中DON 的比值来表示(式1)。 黄粉虫体内的生物累积因子变化趋势见图2(b),结果表明DON 进入黄粉虫体内,容易通过代谢和排泄排出体外,无生物累积效应。
2.4 DON 在黄粉虫体内的排泄
采用排泄率(excretion rate, ER)来表征通过粪便排出的DON,采用代谢率(metabolization rate, MR)来表征DON 在黄粉虫体内通过体内酶和肠道微生物代谢的比例。
式中:Mfeed 为投喂饲料的总量,Cfeed 为饲料中DON的浓度,Mfeces 为产生粪便的总量,Cfeces 为粪便中DON 的浓度。
黄粉虫粪便中DON 的检测结果如表2 所示,在粪便样品中均未检测到DON 衍生物。 进食污染饲料的黄粉虫粪便中的DON 浓度低于污染小麦粉饲料 DON 的浓度。 LD 组黄粉虫粪便中未检出DON。 MD 组的粪便的 DON 浓度为 0.16 mg·kg-1,DON 排泄率为9%;HD 组粪便 DON 浓度为0.47 mg·kg-1,DON 排泄率为 17%。 由此可以推断,DON 在黄粉虫体内的转化途径,主要是降解。 黄粉虫进食DON 污染的小麦粉饲料后,小部分通过粪便代谢排出,24 h 后体内没有DON 残留,说明大部分DON 在黄粉虫体内通过肠道微生物和体内酶降解。
表2 黄粉虫粪便中DON 浓度
Table 2 DON in feces of Tenebrio molitor L. (mg·kg-1)

LD MD HD 1 ND 0.18 0.43 ND 0.14 0.51平均值Average ND 0.16 0.47 2
[1]张静, 张琼琼, 计成, 等. 微生物及生物酶对脱氧雪腐镰刀菌烯醇生物转化研究进展[J]. 动物营养学报,2020,32(10):4807-4820
Zhang J,Zhang Q Q,Ji C,et al.Research advance on biotransformation of deoxynivalenol by microbes and biological enzymes [J]. Chinese Journal of Animal Nutrition,2020,32(10):4807-4820 (in Chinese)
[2]唐语谦, 潘药银, 刘晨迪, 等. 脱氧雪腐镰刀菌烯醇的生物转化及其隐蔽型毒素的形成研究进展[J]. 食品科学,2020,41(19):281-289
Tang Y Q, Pan Y Y, Liu C D, et al. Advances in understanding the biotransformation of deoxynivalenol and its masked forms [J]. Food Science, 2020, 41(19): 281-289(in Chinese)
[3]Bosch G, Fels-Klerx H J V, Rijk T C, et al. Aflatoxin B1 tolerance and accumulation in black soldier fly larvae(Hermetia illucens) and yellow mealworms (Tenebrio molitor) [J]. Toxins,2017,9(6): E185
[4]Niermans K, Woyzichovski J, Kröncke N, et al. Feeding study for the mycotoxin zearalenone in yellow mealworm(Tenebrio molitor) larvae-investigation of biological impact and metabolic conversion [J]. Mycotoxin Research,2019,35(3):231-242
[5]Piacenza N, Kaltner F, Maul R, et al. Distribution of T-2 toxin and HT-2 toxin during experimental feeding of yellow mealworm (Tenebrio molitor) [J]. Mycotoxin Research,2021,37(1):11-21
[6]Camenzuli L, van Dam R, de Rijk T, et al. Tolerance and excretion of the mycotoxins aflatoxin B1,zearalenone,deoxynivalenol, and ochratoxin A by Alphitobius diaperinus and Hermetia illucens from contaminated substrates [J].Toxins,2018,10(2):91
[7]van Broekhoven S, Gutierrez J M, de Rijk T C, et al.Degradation and excretion of the fusarium toxin deoxynivalenol by an edible insect, the yellow mealworm(Tenebrio molitor L.) [J].World Mycotoxin Journal,2017,10(2):163-169
[8]Ochoa Sanabria C, Hogan N, Madder K, et al. Yellow mealworm larvae (Tenebrio molitor) fed mycotoxin-contaminated wheat: A possible safe, sustainable protein source for animal feed? [J]. Toxins,2019,11(5): E282
[9]Hong J S,Han T,Kim Y Y.Mealworm (Tenebrio molitor larvae) as an alternative protein source for monogastric animal: A review [J]. Animals,2020,10(11):2068
[10]Grau T, Vilcinskas A, Joop G. Degradation and excretion of the Fusarium toxin deoxynivalenol by an edible insect,the Yellow mealworm(Tenebrio molitor L.)[J].Journal of Biosciences,2017,72(9-10):337-349
[11]Guo B Y, Yin J, Hao W Y, et al. Polyurethane foam induces epigenetic modification of mitochondrial DNA during different metamorphic stages of Tenebrio molitor [J].Ecotoxicology and Environmental Safety, 2019, 183:109461
[12]Yang Y,Yang J,Wu W M,et al.Biodegradation and mineralization of polystyrene by plastic-eating mealworms:Part 2. Role of gut microorganisms [J]. Environmental Science & Technology,2015,49(20):12087-12093
[13]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局, 中华人民共和国国家食品药品监督管理总局. 食品安全国家标准食品中真菌毒素限量: GB 2761—2017[S]. 北京: 中国标准出版社,2017