作为传统农业大国,我国的农药使用量是世界平均水平的2.5 倍~3 倍[1]。 每年全球农药使用量约30 亿kg[2],作为陆地环境的主要污染物[3],大量残留农药进入土壤或者挥发到大气,进入土壤中的农药再经渗透作用进入水体,破坏生态系统,威胁人类和动物的健康生存。 新烟碱类杀虫剂于20 世纪90年代开始商品化,是自拟除虫菊酯类农药商品化后进入市场的增长最快的一类杀虫剂[4]。 该类化合物的作用靶点是哺乳动物和昆虫胆碱能神经系统中的烟碱乙酰胆碱受体(nAChR),与昆虫nAChR 的亲和力很高,又不被乙酰胆碱酯酶分解,因此使昆虫神经系统持续兴奋,干扰中枢神经信号的正常传导,杀灭害虫。
许多农药已被证明具有内分泌干扰作用,能够干扰内分泌系统的一种或多种功能,对生物体和后代造成不利影响[5]。 因此,研究农药的内分泌干扰效应具有重要意义。 噻虫胺(clothianidin, CLO)是一种典型的新烟碱类杀虫剂,对害虫有触杀、胃毒及内吸活性[6]。 CLO 被广泛应用于防治害虫,如蓟马、粉虱、蚜虫、潜叶虫和鞘翅目昆虫[7]。 因为新烟碱类物质对脊椎动物的烟碱乙酰胆碱受体的亲和力比较低,所以对脊椎动物的毒性较低[8]。 但已有研究证明新烟碱类杀虫剂会对脊椎动物产生内分泌干扰效应。例如Pandey 等[9]研究了吡虫啉染毒对红文鸟生殖行为的影响,发现在繁殖阶段,鸣叫和配对行为逐渐减少直至完全消失。 Caron-Beaudoin 等[10]研究发现,在胚胎联合培养模型中的CLO 会引起细胞色素P450酶CYP19 的强表达,并影响雌激素的合成。 Wang等[11]对丽斑麻蜥染毒CLO,发现CLO 会在性腺内积累并干扰性腺轴相关基因表达,影响睾酮和雌二醇的浓度。 因此,CLO 可能是潜在的内分泌干扰物质。
外源物质可以通过下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal axis, HPG axis)的反馈机制直接影响内源性激素的产生[12]。 睾酮(testosterone,T)和雌二醇(estradiol, E2)是重要的性类固醇激素,主要分泌于性腺中,促进性腺成熟,发展第二性征,对生殖系统具有重要的调控意义。 基于此,本研究将 SD 大鼠分别按照50、150 和250 mg·kg-1 CLO 的浓度进行染毒,通过分析CLO 在大鼠体内的富集代谢以及28 d 后对大鼠性腺组织的损伤情况和血液中性腺激素的变化,探讨CLO 对大鼠HPG 轴的可能影响以初步探讨新烟碱农药对大鼠内分泌系统的干扰作用。
1 材料与方法(Materials and method)
1.1 试剂和仪器
CLO(纯度>98%)购自湖南海利化工有限公司。色谱纯级别的乙腈、甲酸、无水乙醇均购自迪马科技有限公司(北京)。 Elisa 试剂盒购自武汉伊莱瑞特生物科技股份有限公司。
仪器:TSQ Quantum Access MAX 高效液相色谱-质谱联用仪(赛默飞世尔科技公司,美国);可调式移液器(艾本德,德国);Sigma 3K15 高速冷冻离心机(默克,德国);RE-2000 旋转蒸发仪(上海亚荣生化仪器厂,中国)。
1.2 大鼠饲养
成年Sprague-Dawley (SD)大鼠购自北京维通利华实验动物技术有限公司,实验动物生产许可证编号:SCXK(京)2016-0006。 大鼠饲养于北京万合科技有限公司SPF 级动物房中,饲养许可证编号:SYXK(京)2020-0008。 控制大鼠饲养条件为温度20 ~26℃,光暗比12 h ∶12 h,试验前大鼠进行7 d 检疫观察,合格大鼠用于试验。 染毒前大鼠隔夜禁食,饮水不限。
1.3 剂量选择和实验设计
CLO 的大鼠经口灌胃 LD50 为>5 000 mg·kg-1,选择 LD50 的 1%(50 mg·kg-1),3%(150 mg·kg-1)和5%(250 mg·kg-1)作为 3个染毒浓度。 把 CLO 配成混悬液用于灌胃。 把羧甲基纤维素钠粉末缓慢加入60 ℃蒸馏水中,边加边搅拌,配成均一透明的溶液(0.5%羧甲基纤维素钠),放凉后用于配药。 CLO 粉末倒入0.5%羧甲基纤维素钠溶液中超声,边加边搅拌,配成混悬液,灌胃期间持续搅拌。
48 只大鼠,雌雄各24 只,雌鼠和雄鼠都分别随机分成4 组:溶剂对照组(灌胃等体积0.5%羧甲基纤维素钠)、低剂量CLO 组、中剂量 CLO 组和高剂量 CLO 组,共 8 组(雌、雄各 4 组),每组 6 只。 每天经口灌胃,持续28 d 后解剖,取大鼠的脑、肝、性腺(睾丸和卵巢)以及血清保存于-20 ℃,用于检测CLO 浓度;一部分性腺保存于4%多聚甲醛溶液中,用于组织病理分析;一部分血清保存于-80 ℃,用于激素水平分析。
1.4 大鼠组织中CLO 浓度分析
在血清和脑、肝、性腺的匀浆中加入10 mL 乙腈,涡旋 3 min,超声振荡20 min,然后10 000 r·min-1离心5 min,取上清液。 重复以上操作,并将上清液合并,在35 ℃用真空旋转蒸发仪将溶剂蒸干,然后用1 mL 乙腈溶解,通过0.22 μm 微孔过滤膜过滤后上机检测。
使用TSQ Quantum Access MAX 高效液相色谱-质谱联用仪(赛默飞世尔科技公司),定量分析CLO 含量。 采用 Thermo C18 色谱柱(100 mm×2.1 mm,1.9 μm),柱温40 ℃,进样量10 μL,流动相梯度洗脱条件如表1 所示。 采用电喷雾离子源(ESI),正离子扫描模式,毛细管温度350 ℃,毛细管电压3 500 V,蒸发温度200 ℃,鞘气流速为207 kPa,辅助气流速为34 kPa,监测方式为选择反应监测(SRM),定性离子对(m/z)为 250.200/131.966 和 250.200/169.052,定量离子对(m/z)为250.200/169.052。
表1 流动相梯度洗脱条件
Table 1 Gradient elution conditions of mobile phase
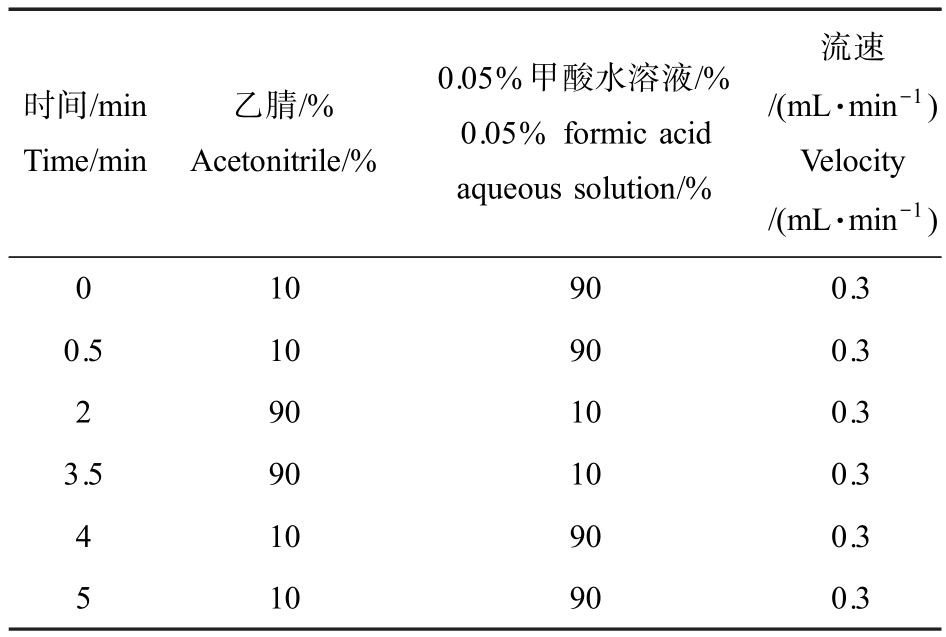
时间/min Time/min乙腈/%Acetonitrile/%0.05%甲酸水溶液/%0.05% formic acid aqueous solution/%流速/(mL·min-1)Velocity/(mL·min-1)0 10 90 0.3 0.5 10 90 0.3 2 90 10 0.3 3.5 90 10 0.3 4 10 90 0.3 5 10 90 0.3
进样过程进行质量控制,每15个样品测定一次标准曲线,每5个样品之间测一个空白样。
1.5 组织病理学分析
将解剖得到的大鼠性腺组织剪下一小部分,用4%多聚甲醛固定,切成小块,放入包埋盒中,用纱布包裹,流水冲洗一晚,用50% ~100%的乙醇进行梯度脱水,加二甲苯透明剂,然后将组织浸蜡。 用轮转式切片机把包埋好的蜡块切出4 μm 的切片,用苏木精-伊红染色法(hematoxylin-eosin staining, HE)染色,胞核呈蓝色,胞浆呈红色,红细胞呈桔红色,其他成分呈深浅不同的红色,用光学显微镜观察组织病理损伤情况。
1.6 性激素水平的检测
把大鼠麻醉后,进行腹腔静脉取血,把血液收集到促凝管中,4 ℃静置5 min,在4 ℃下4 000 r·min-1离心10 min,取上清液保存于-80 ℃。 使用酶联免疫吸附测定(ELISA)试剂盒检测血清中性激素T 和E2 的浓度。 板内和板间变异系数均<10%,试剂盒测定的灵敏度T 为0.17 ng·mL-1,E2 为1 pg·mL-1。 用酶标仪在450 nm 波长处测吸光度OD 值,激素浓度与OD 值负相关,通过绘制双对数曲线计算出血清中T 和E2 的浓度。 为了便于分析,激素含量用相对于对照组激素浓度的倍数来表示。
1.7 数据分析与统计
使用SPSS24.0 软件进行统计分析,采用单因素方差分析方法比较组间差异。 *P<0.05 表示具有统计学差异。
2 结果(Results)
2.1 CLO 在大鼠脑、肝、性腺和血清中的分布
CLO 染毒28 d 后在脑、肝、性腺和血清中的分布如图1 所示。 各染毒组的CLO 残留浓度为:低剂量雄鼠组1.44 mg·kg-1,低剂量雌鼠组1.36 mg·kg-1;中剂量雄鼠组3.20 mg·kg-1,中剂量雌鼠组2.76 mg·kg-1;高剂量雄鼠组64.52 mg·kg-1,高剂量雌鼠组58.09 mg·kg-1。 比较分析 3个不同剂量染毒组,发现雄性大鼠体内的CLO 浓度一直高于雌性大鼠。低、中剂量组雌雄大鼠各组织中CLO 的浓度从大到小的顺序是:血清>肝脏>性腺>脑。 高剂量雌鼠组,虽然CLO 在肝脏中的富集比例明显减小,但仍保持低、中剂量组的分布规律。 高剂量雄鼠组,CLO 在各组织中的浓度从大到小的顺序是:血清>性腺>肝脏>脑。
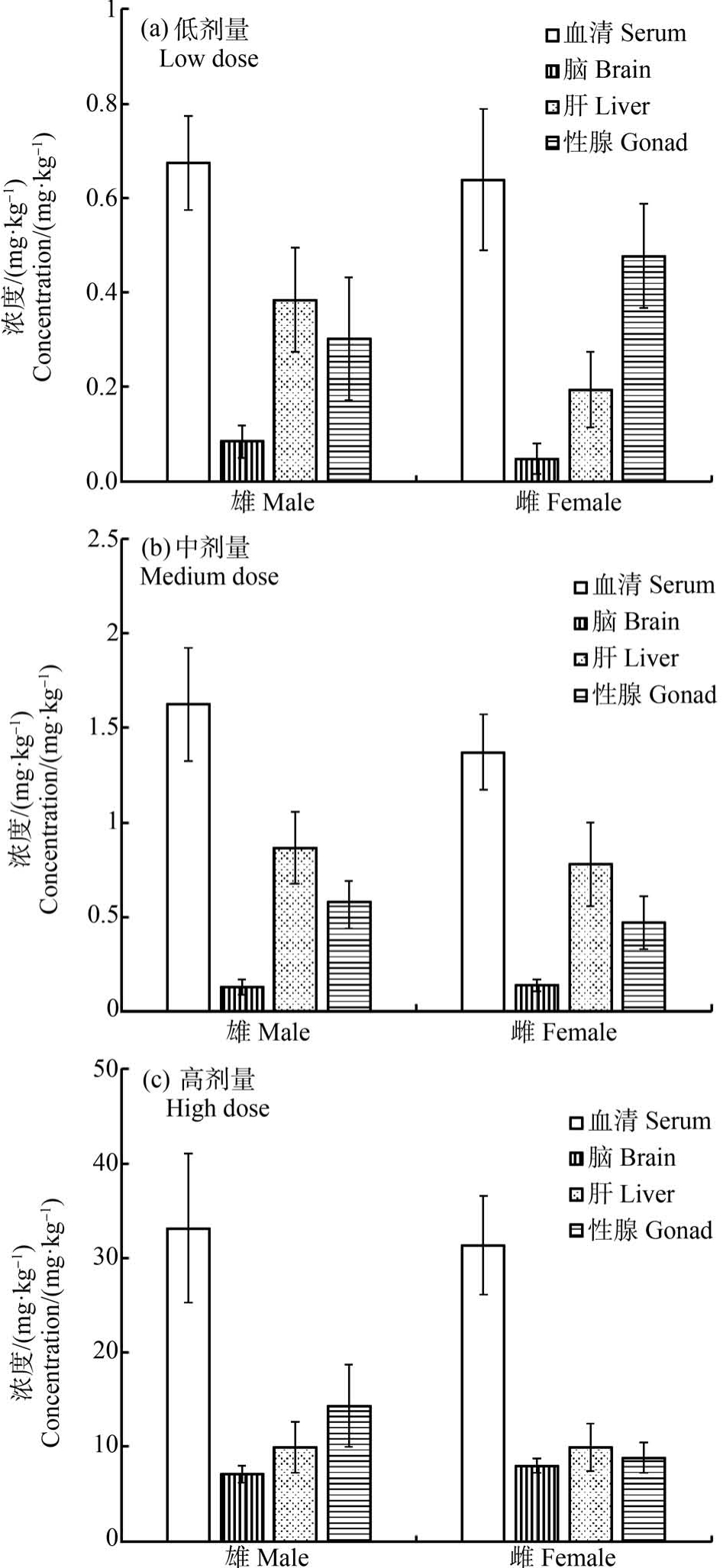
图1 噻虫胺(CLO)在大鼠血清、脑、肝和性腺组织中的分布
Fig.1 Distribution of clothianidin (CLO) in serum,brain, liver and gonad tissues of rat
2.2 性腺组织病理学
经过28 d 的CLO 染毒后,观察到了大鼠性腺(睾丸和卵巢)的病理学变化(图2 和图3)。 在雄鼠对照组中,正常的大鼠睾丸组织被膜完整,生精小管内各级生精细胞排列整齐,结构较为清晰(图2(a))。 与对照组相比,低、中剂量染毒组未见异常病变(图2(b)和2(c)),高剂量组睾丸周边局部区域部分曲细精管可见生精细胞变性坏死脱落于管腔内,有的曲细精管上皮严重变性坏死,腔内充满坏死的无结构红染的团块(图2(d))。
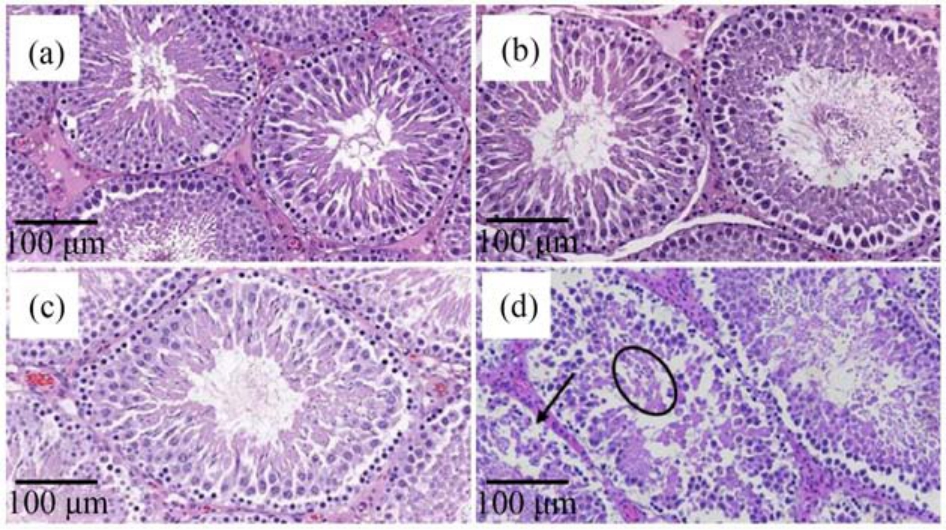
图2 雄性大鼠睾丸细胞切片
注:(a)对照组;(b) CLO 低剂量染毒组;(c) CLO 中剂量染毒组;(d) CLO 高剂量染毒组;圆圈代表生精细胞坏死,箭头代表曲细精管上皮细胞坏死。
Fig.2 Representative histology of the testis of male rat
Note: (a) Control; (b) Low-dose CLO treated group; (c) Medium-dose CLO treated group; (d) High-dose CLO treated group; circle represents necrosis of spermatogenic cells and arrow represents necrosis of seminiferous epithelial cells.
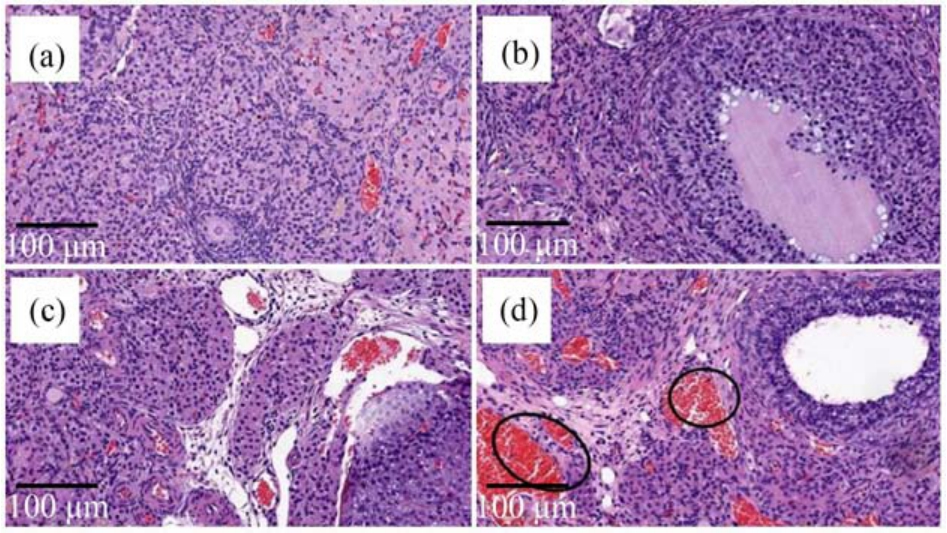
图3 雌性大鼠卵巢细胞切片
注:(a)对照组;(b) CLO 低剂量染毒组;(c) CLO 中剂量染毒组;(d) CLO 高剂量染毒组;圆圈代表间质血管明显充血。
Fig.3 Representative histology of the ovaries of female rat
Note: (a) Control; (b) Low-dose CLO treated group; (c) Medium-dose CLO treated group; (d) High-dose CLO treated group ;circles represent significant congestion of interstitial blood vessels.
雌性大鼠对照组卵巢皮质中有不同数量的卵泡和黄体,其间为梭形的成纤维细胞及网状纤维,髓质中有富含血管的疏松结缔组织。 与对照组相比,低、中剂量组卵巢未见异常病变;高剂量组间质血管明显充血,其余无异常病变。
2.3 血清性激素水平
CLO 染毒28 d 后,不同剂量组血清性激素(T和E2)水平如图4 所示。 为了便于分析,激素含量用相对于对照组激素浓度的倍数来表示。 雄性大鼠染毒组,T 和E2 浓度均显著高于对照组,且中剂量组浓度均显著高于低剂量组,高剂量组浓度均显著低于中剂量组,呈现出非单调剂量效应关系。 雌性大鼠染毒组,低、中剂量组大鼠血清中的T 激素水平与对照组相比无显著差异,高剂量组浓度显著低于对照组;3个剂量组大鼠血清中的E2 激素水平与对照组均无显著差异。
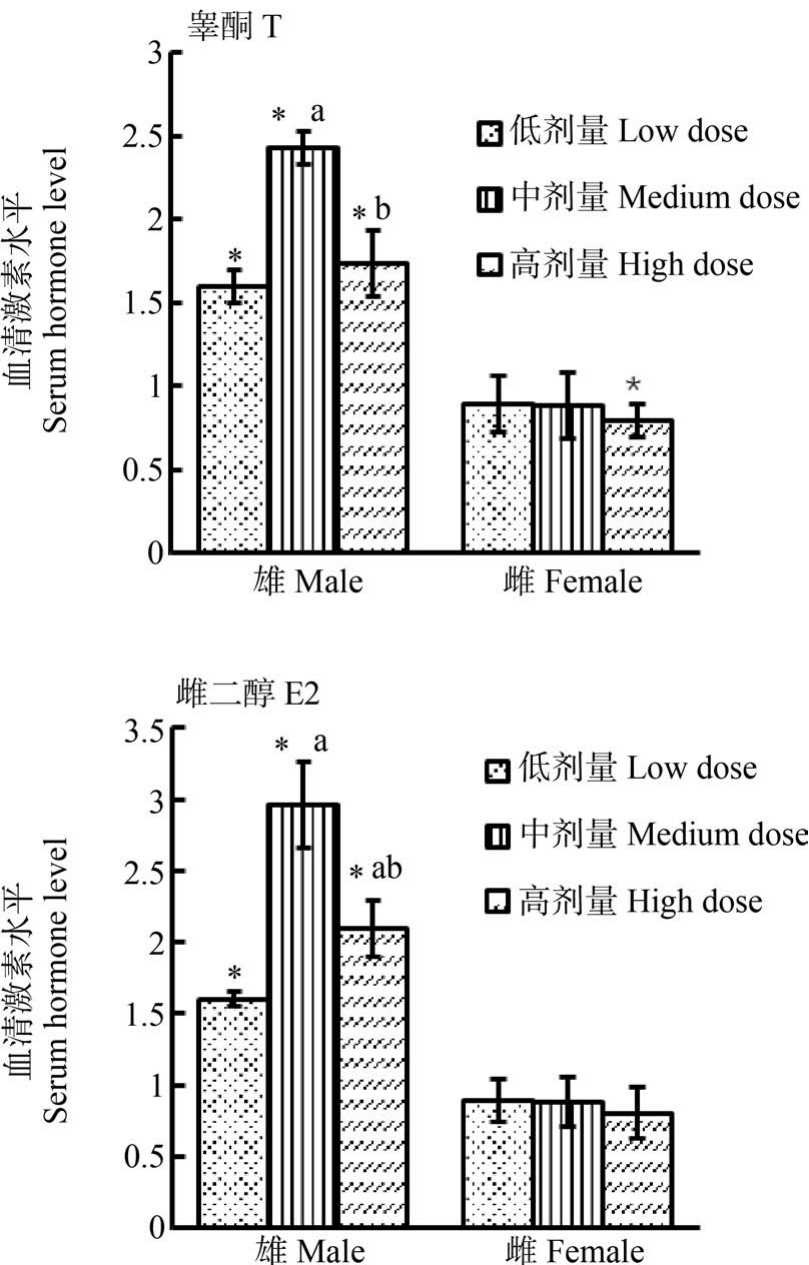
图4 CLO 染毒28 d 后血清中性激素睾酮(T)和雌二醇(E2)的含量
注:* 相对于对照组P<0.05,a 相对于低剂量组P<0.05,b 相对于中剂量组P<0.05。
Fig.4 Serum concentration of testosterone (T) and estradiol(E2) after CLO exposure for 28 d in male and female rats
Note:* P<0.05 relative to control, a P<0.05 relative to low dose, b P<0.05 relative to medium dose.
3 讨论(Discussion)
大鼠连续28 d 染毒CLO,检测肝、脑、性腺和血清中CLO 的浓度,发现不同剂量的暴露组中,雄鼠体内的CLO 浓度一直高于雌鼠,CLO 更容易在雄鼠体内富集。 在低(50 mg·kg-1)、中(150 mg·kg-1)剂量组,CLO 在雌、雄大鼠体内的残留量较小,主要分布在血清和肝脏中,各组织中浓度从大到小的顺序是:血清>肝脏>性腺>脑。 药物通过跨膜运输和扩散进入血液循环系统,随后通过血液的流动被输送到各个组织中,肝脏内具有丰富的氧化还原酶,是许多外源性物质解毒的最佳场所,因此大量CLO 被输送到肝脏中进行代谢。 在高剂量组(250 mg·kg-1),CLO 在大鼠体内有较高的残留量,除了血清和肝脏,在性腺中也大量富集,尤其是雄鼠睾丸中,平均浓度达到14.34 mg·kg-1,超过了肝脏中的浓度,过高的残留浓度可能会对睾丸的正常生理功能造成影响。
在高倍镜下观察大鼠性腺组织的切片,与对照组相比,低(50 mg·kg-1)、中(150 mg·kg-1)剂量组睾丸没有异常病变(图2(b)和2(c)),高剂量组(250 mg·kg-1)睾丸严重病变,部分细胞变性坏死(图2(d))。组织细胞发生坏死后,物质代谢停止,功能完全丧失,出现一系列形态学改变,坏死是一种不可逆的病理过程,因此250 mg·kg-1 CLO 染毒会对大鼠睾丸造成病理损伤,从而可能导致生殖障碍,已有研究表明新烟碱类杀虫剂吡虫啉能够使成年雄性大鼠产生生殖障碍[13-14]。 雌性大鼠3个染毒组中,卵巢细胞均无异常病变,CLO 对雌鼠卵巢正常结构影响不大。
许多环境污染物通过改变内分泌系统的发育和功能来影响动物的繁殖。 暴露此类污染物会影响性激素水平或阻断/激活类固醇激素受体,从而对人类和野生动物造成不利的健康后果[10]。 在脊椎动物中,性类固醇激素(T 和E2)在睾酮和卵巢中合成、分泌,参与调节生殖系统发育、维护第二性征等一系列过程。 因此,T 和E2 水平是评估CLO 染毒对大鼠性腺影响的重要指标。 低(50 mg·kg-1)、中(150 mg·kg-1)剂量CLO 染毒组中,与对照组相比,雄性大鼠性激素(T 和E2)含量均显著升高,且中剂量组性激素浓度显著高于低剂量组,性激素水平与性腺中的CLO 残留浓度呈现出正相关的趋势,说明CLO 染毒促进雄鼠性激素合成和分泌。 在高剂量染毒组(250 mg·kg-1)中,雄鼠性激素含量虽然也高于对照组,但却不符合低、中剂量组的趋势,结合病理学分析,导致此结果的原因可能是250 mg·kg-1染毒使雄鼠睾丸部分细胞坏死,无法进行正常的生命活动,所以高剂量(250 mg·kg-1)CLO 对雄鼠性激素分泌的促进作用有限。 低(50 mg·kg-1)、中(150 mg·kg-1)剂量的CLO 染毒对雌鼠性激素水平无影响,高剂量(250 mg·kg-1)的CLO 染毒会使雌鼠血清中T 含量显著降低,而E2 浓度无明显变化,说明CLO 染毒可能会抑制雌鼠T 分泌,而对E2 作用不显著。
综上,在本试验剂量设置和实验条件下,3个剂量CLO 染毒均促进雄性大鼠T 和E2 分泌,CLO 高剂量染毒(250 mg·kg-1)会在雄性大鼠睾丸中大量富集,并导致生精细胞和曲细精管上皮细胞变性坏死,影响大鼠睾丸的正常生理功能;同时不同剂量CLO染毒不会对雌鼠造成明显的病理损伤,低(50 mg·kg-1)、中(150 mg·kg-1)剂量 CLO 染毒对雌鼠性激素无显著影响,而高剂量CLO 染毒会抑制雌性大鼠T分泌。 由以上结果可知3个剂量CLO 染毒均对雄性大鼠性腺系统的正常生理功能产生影响,250 mg·kg-1 CLO 染毒对雌性大鼠性腺系统的生理功能可能产生一定影响。 CLO 可能是潜在的内分泌干扰物。
[1]孙致陆, 贾娟琪, 李先德. 我国农药使用强度的演进特征与省际收敛: 基于1991—2014年省级面板数据的分析[J]. 农业现代化研究,2017,38(5):792-800
Sun Z L, Jia J Q, Li X D. Evolution characteristics and provincial convergence of pesticide application density in China: An empirical study based on the provincial data from 1991 to 2014 [J].Research of Agricultural Modernization,2017,38(5):792-800 (in Chinese)
[2]Hayes T B, Hansen M. From silent spring to silent night:Agrochemicals and the anthropocene [J]. Elementa: Science of the Anthropocene,2017,5:57
[3]Sanchez-Bayo F. Impacts of Agricultural Pesticides on Terrestrial Ecosystems [M]//Ecological Impacts of Toxic Chemicals. Bentham Science Publishers,2011:63-87
[4]Nauen R,Bretschneider T.New modes of action of insecticides [J]. Pesticide Outlook,2002,13(6):241-245
[5]Costa N O, Vieira M L, Sgarioni V, et al. Evaluation of the reproductive toxicity of fungicide propiconazole in male rats [J]. Toxicology,2015,335:55-61
[6]Domingues C E C,Abdalla F C,Balsamo P J,et al.Thiamethoxam and picoxystrobin reduce the survival and overload the hepato-nephrocitic system of the Africanized honeybee [J]. Chemosphere,2017,186:994-1005
[7]Fan Y J,Shi X Y.Characterization of the metabolic transformation of thiamethoxam to clothianidin in Helicoverpa armigera larvae by SPE combined UPLC-MS/MS and its relationship with the toxicity of thiamethoxam to Helicoverpa armigera larvae [J]. Journal of Chromatography B,Analytical Technologies in the Biomedical and Life Sciences,2017,1061-1062:349-355
[8]Zhang P, Sun H W, Ren C, et al.Sorption mechanisms of neonicotinoids on biochars and the impact of deashing treatments on biochar structure and neonicotinoids sorption [J]. Environmental Pollution,2018,234:812-820
[9]Pandey S P, Tsutsui K, Mohanty B. Endocrine disrupting pesticides impair the neuroendocrine regulation of reproductive behaviors and secondary sexual characters of red munia(Amandava amandava)[J].Physiology &Behavior,2017,173:15-22
[10]Caron-Beaudoin E, Viau R, Hudon-Thibeault A A, et al.The use of a unique co-culture model of fetoplacental steroidogenesis as a screening tool for endocrine disruptors:The effects of neonicotinoids on aromatase activity and hormone production [J].Toxicology and Applied Pharmacology,2017,332:15-24
[11]Wang Y H, Zhang Y, Zeng T, et al. Accumulation and toxicity of thiamethoxam and its metabolite clothianidin to the gonads of Eremias argus [J]. Science of the Total Environment,2019,667:586-593
[12]Zhu L F, Li W, Zha J M, et al. Chronic thiamethoxam exposure impairs the HPG and HPT axes in adult Chinese rare minnow (Gobiocypris rarus): Docking study, hormone levels, histology,and transcriptional responses [J].Ecotoxicology and Environmental Safety,2019,185:109683
[13]Najafi G,Sc D V,Razi M,et al.The effect of chronic exposure with lmidacloprid insecticide on fertility in mature male rats [J]. International Journal of Fertility & Sterility,2010.10.1093/humrep/dep461
[14]Bal R, Nazirogˇlu M, Türk G, et al. Insecticide imidacloprid induces morphological and DNA damage through oxidative toxicity on the reproductive organs of developing male rats [J]. Cell Biochemistry and Function,2012,30(6):492-499