塑料及其制品应用广泛,巨大消耗量及不当处置方式导致塑料废弃物在环境中的残留量不断增加[1]。 大型塑料垃圾在自然条件下经物理、化学和生物作用,逐渐分解、破碎,形成更为微小的塑料碎片或颗粒,当其粒径<5 mm 时被定义为微塑料(microplastics, MPs)[2-3]。 迄今为止,有关微塑料的研究大多集中在海洋环境,对土壤微塑料污染的研究相对比较匮乏[4],而陆地环境与人类接触更为频繁,因此土壤环境中的微塑料污染应受到更多重视[5]。 已有证据表明,土壤中也存在不同程度微塑料的检出。Zhang 等[6]在我国东北地区农田中检测到微塑料的平均含量为0.27 mg·kg-1,最高含量为8.5 mg·kg-1;Fuller 和Gautam[7]的调查显示,在澳大利亚悉尼工业区土壤中微塑料的平均丰度高达4 191 mg·kg-1。陆地环境被认为是塑料进入海洋的起源和运输通道[8],大多数微塑料可通过地膜覆盖、废水灌溉、污泥堆肥、道路径流及大气输入等途径进入土壤中[4,9],并保留数十年或更长时间,对土壤理化性质产生不利影响[10]。
此外,微塑料具有比表面积大、疏水性强的特性,易吸附环境中的持久性有机污染物(POPs)和重金属等污染物并与之发生相互作用,因此其复合毒性效应日益受到关注[11]。 目前,有关微塑料和重金属复合污染对生物体的毒性效应研究较少,且多集中于水生生物。 例如,已有报道证实聚乙烯微塑料的存在可增强重金属对鲤鱼的毒性效应[12],同时暴露于聚苯乙烯微塑料和重金属也可诱导斑马鱼产生氧化应激[13],对七彩神仙鱼的先天免疫系统造成刺激[14]。 然而,聚苯乙烯微塑料和重金属复合污染对土壤生物的毒性影响研究数据非常有限[15]。
镉(Cd)是土壤环境中常见的毒性最强重金属污染物之一。 据调查,我国沿海地区表层土壤中Cd的平均含量为1.21 mg·kg-1,太湖望虞河沉积物中Cd 的最大检出量为 131.53 mg·kg-1[16]。 在我国农田土壤环境的微塑料中,也检出了含量范围为0.058~0.99 mg·kg-1的Cd,表明微塑料和Cd 在自然环境中存在共暴露现象[17]。 目前尚不清楚土壤中重金属对生物的毒性效应是否受微塑料的影响,土壤中微塑料和重金属复合污染的毒性效应及机制仍不明晰,亟需相关毒理学数据的补充。
本文以模式生物赤子爱胜蚓(Eisenia fetida)为受试生物,选取应用最广泛的塑料之一聚苯乙烯微塑料(PS-MPs)和重金属Cd 为受试材料,采用滤纸接触法,考察PS-MPs 存在下Cd 对蚯蚓的急性致死作用。 进一步通过人工土壤法,模拟实际环境中两者复合污染土壤对蚯蚓生长、抗氧化系统、消化酶活性及DNA 损伤的影响,从生长、生理和遗传毒性角度初步探讨PS-MPs 和Cd 对蚯蚓的复合毒性效应,以期为聚苯乙烯微塑料在土壤环境中的生态风险评估提供科学依据。
1 材料与方法(Materials and methods)
1.1 试验材料
赤子爱胜蚓(E.fetida)购自江苏省句容市某蚯蚓养殖基地。 试验前,将所购蚯蚓于清洁土壤中预培养3 ~7 d,挑选具有明显生殖环带、体质量500 ~600 mg 的健康成蚓进行试验。
聚苯乙烯荧光微球(PS-MPs)购自中国天津市倍思乐色谱技术开发中心,将原液(10 mg·mL-1)超声处理 10 min 后,取 10 μL 微塑料原液于 10 mL 超纯水中,稀释1 000 倍,采用透射电子显微镜(TEM,Jeol2100F,日本Jeol 公司)和动态光散射激光粒度仪(DLS,Zetasizer Nano-S,英国 Malvern 公司)进行形貌表征。 结果显示,试验所用PS-MPs 呈球状,平均粒径为(5.04±0.02) μm,溶液体系分散效果良好(图1)。
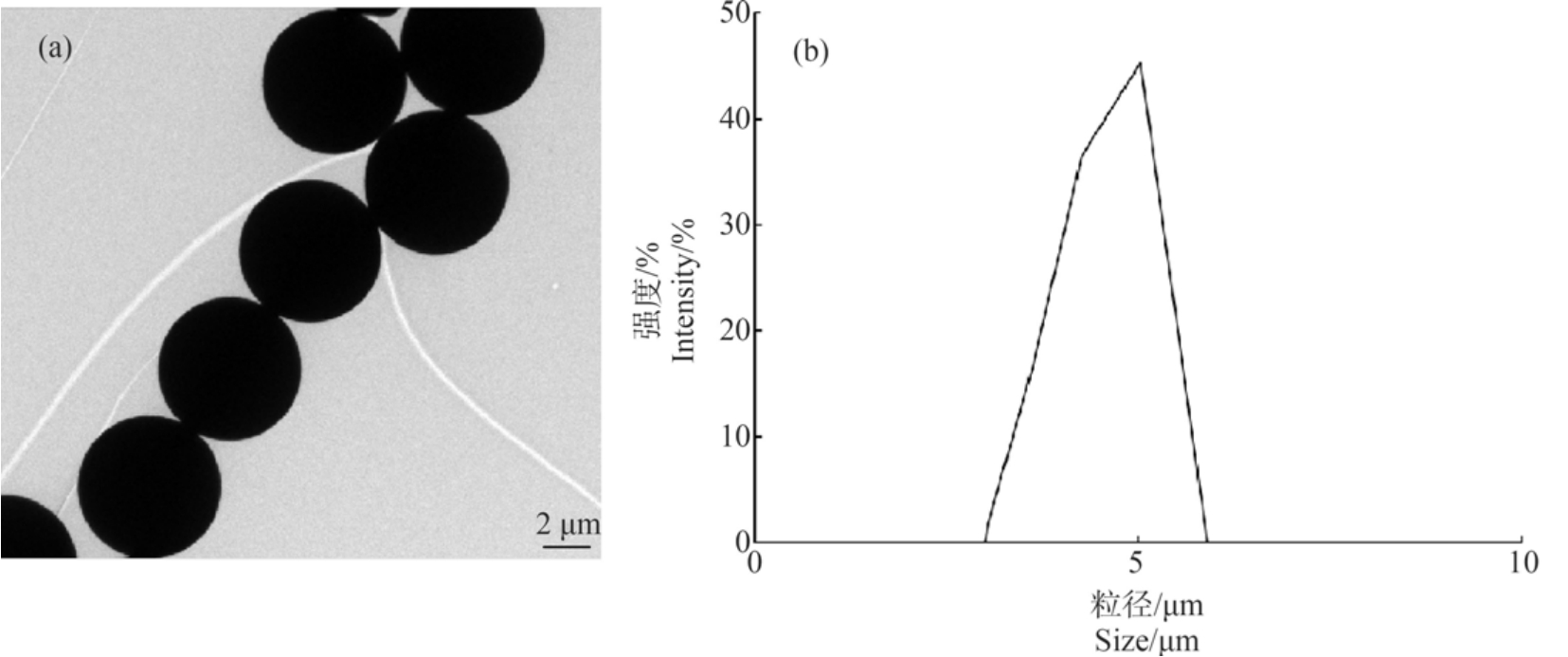
图1 聚苯乙烯塑料微球(PS-MPs)形貌(a)及粒径强度分布(b)
Fig.1 Transition electron microscopy (TEM) image (a) and dynamic light scattering (DLS) result (b) of polystyrene microplastics (PS-MPs)
无水氯化镉(CdCl2)(CAS No. 10108-64-2),纯度≥99.0%,购自中国上海安谱试验科技股份有限公司。
1.2 试验方法
1.2.1 滤纸接触法
参照OECD Guideline No.207 标准滤纸接触法研究Cd 单一及与PS-MPs 复合暴露对蚯蚓的急性致死作用,以探讨PS-MPs 的存在对Cd 引起蚯蚓死亡率的影响。 根据预试验结果,确定正式试验中Cd2+浓度为 0、6.51、9.77、14.33、21.98 和 31.28 μg·cm-2;PS-MPs 暴露水平为 0、8×10-3、1.6×10-1 μg·cm-2。 滤纸法试验采用平底玻璃管进行,取若干长8 cm,直径3 cm 的平底玻璃管,管内壁平铺滤纸,滤纸大小刚好覆盖玻璃管内壁且不重叠。 用移液器依次吸取0.5 mL Cd 溶液和0.5 mL PS-MPs 溶液至玻璃管中,放入37 ℃烘箱烘干,使受试物在滤纸上均匀沉淀。 对照组用1 mL 超纯水做相同处理。 之后,用移液枪移取1 mL 超纯水于玻璃管中,确保内衬滤纸足够湿润,以便蚯蚓生存。 每管放置1 条蚯蚓,以避免同一管内蚯蚓的死亡对其他蚯蚓产生的可能影响,然后置于温度(20±1) ℃,湿度80%的恒温恒湿箱中避光培养48 h。 同时设不含Cd、PS-MPs 的蒸馏水处理为对照组,每个处理组设置10个重复。
1.2.2 人工土壤法
采用人工土壤标准暴露法(OECD Guideline No.207)研究PS-MPs 和Cd 复合污染土壤对蚯蚓的毒性效应。 复合毒性试验的剂量参照先前已有研究[18-19],同时基于滤纸接触法试验的结果进行设定(表1)。 将赤子爱胜蚓暴露于含Cd 和 PS-MPs 的人工土壤中,Cd 和PS-MPs 各设置高和低2个染毒剂量组,其中,低剂量(Cd 1 mg·kg-1,PS-MPs 0.5 mg·kg-1)接近环境实测值,高剂量(Cd 130 mg·kg-1,PSMPs 10 mg·kg-1)用以模拟高污染区域。 人工土壤配制参照OECD 207 试验准则,并在此基础上加以改进。 称取350 g 石英砂,50 g 牛粪和100 g 高岭土于培养缸中,混匀后加入175 mL 经蒸馏水稀释的不同含量受试物溶液,在实验室条件下稳定7 d 后,每缸放置10 条经清洁人工土壤驯化24 h 的蚯蚓,于恒温恒湿箱中避光培养14 d,培养条件同前,每7 d 向土壤表面均匀加入2 g 牛粪作为养料。 同时设置不含Cd、PS-MPs 的清洁人工土壤为对照组,每个处理组设置4个重复。
表1 实验设计(人工土壤法)
Table 1 Design of experiment (artificial soil test)
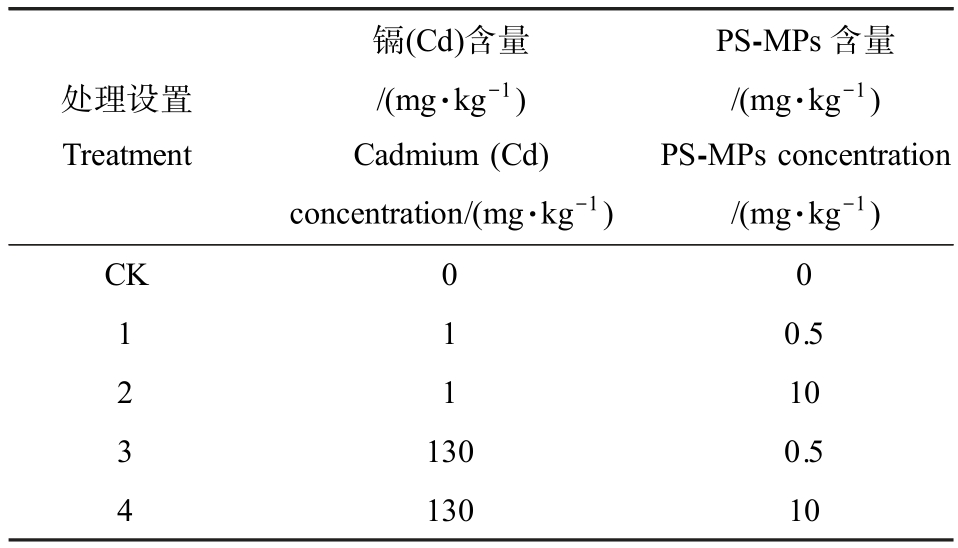
处理设置Treatment镉(Cd)含量/(mg·kg-1)Cadmium (Cd)concentration/(mg·kg-1)PS-MPs 含量/(mg·kg-1)PS-MPs concentration/(mg·kg-1)CK 0 0 1 0.5 2 1 10 1 3 130 0.5 4 130 10
1.3 毒理学指标测定
1.3.1 死亡率
分别于滤纸接触法暴露24 h 和48 h 后,记录每个处理组蚯蚓的死亡数量,并计算死亡率。 若蚯蚓前尾部对轻微针扎无反应,则视为死亡。
1.3.2 体质量变化率
在人工土壤法第0 天和第14 天将蚯蚓从不同处理组培养缸中取出,清洗并用滤纸吸去表面水分后称量,按下式计算体质量变化率:
体质量变化率=(Wt -W0)/W0×100%
式中:Wt 为第14 天蚯蚓的平均体质量(mg),W0 为第0 天蚯蚓的平均体质量(mg)。
1.3.3 酶活性及可溶蛋白含量测定
人工土壤法第14 天将蚯蚓从土壤中取出,每组3 条,于湿润滤纸上清肠24 h。 称取蚯蚓样品组织,按质量(g)∶体积(mL)=1∶4 的比例加入 4 倍体积的生理盐水,冰水浴条件下制成匀浆,3 000 r·min-1离心10 min 后,取上清液,一部分直接用于测定丙二醛(MDA,A003-1-1)含量,另一部分分别稀释成0.5%、5%和10%(V∶V)的蚯蚓组织匀浆,各用于蛋白含量(A045-4-2)、过氧化氢酶(CAT,A007-1-1)和碱性磷酸酶(AKP,A059-2-2)活性的测定。 另取蚯蚓样品组织若干,在冰水浴条件下将其以质量(g)与纤维素酶缓冲液(mL)为 1 ∶9 的比例制成匀浆,4 000 r·min-1离心 10 min,取上清液,稀释成 10%(V ∶V)蚯蚓组织匀浆,进行纤维素酶活性(A138-1-1)测定。 试验用试剂盒及测定方法均由南京建成生物工程研究所提供。
1.3.4 DNA 损伤检测
人工土壤法培养14 d 后,取出蚯蚓,每组3 条,湿润滤纸清肠24 h 后,依据Eyambe 等[20]的方法提取蚯蚓体腔细胞,彗星试验参考Singh 等[21]方法。蚯蚓体腔细胞经制片-裂解-解旋-电泳-中和-染色后,将染色后的载玻片置于荧光显微镜(BX41,日本奥林巴斯公司)下,用明美显微数码测量分析系统软件观察蚯蚓体腔细胞荧光图像,并拍照储存。 图像用CASP 彗星分析软件逐一进行分析,选取彗星尾部DNA 百分比(tail DNA%)、彗星尾长(tail length,TL)和 Olive 尾矩(Olive tail moment,OTM)作为 DNA损伤的指标,每张片子分析50个细胞。
1.4 数据统计与分析
采用Excel 2013 和SPSS 20 统计软件对实验数据进行Probit 回归分析和相关性分析,计算半数致死剂量(lethal dose 50%, LD50),彗星试验3 项指标所得数据经SPSS 20 进行Mann-Whitney U(二样本)检验。 利用方差分析(ANOVA)方法,在 0.05、0.01 和0.001 的显著性水平下进行显著性分析。
2 结果与讨论(Results and discussion)
2.1 滤纸法测定Cd 单一及与PS-MPs 复合暴露对蚯蚓死亡率的影响
不同浓度Cd 及其与PS-MPs 复合暴露条件下赤子爱胜蚓的死亡率如图2 所示。 无论PS-MPs 存在与否,蚯蚓的死亡率均随着Cd 浓度增加呈梯度上升趋势。 当 Cd 浓度为 31.28 μg·cm-2时,Cd 单一暴露及与0.008 μg·cm-2 PS-MPs 复合暴露条件下,赤子爱胜蚓的48 h 死亡率均达100%。

图2 Cd 及其与PS-MPs 复合暴露24 h (a)和48 h (b)后赤子爱胜蚓的急性致死率(滤纸法)
Fig.2 The motility of E. fetida treated with Cd and Cd+PS-MPs after 24 h (a) and 48 h (b) exposure time (filter paper method test)
以Cd 浓度对数作为横坐标,将蚯蚓死亡率进行概率变换作为纵坐标,通过线性拟合得到线性回归方程(表 2)。 Cd 单一暴露时,蚯蚓 24 h 和 48 h 的LD50 分别为 22.09 μg·cm-2 和 13.55 μg·cm-2,即1 380.7 mg·L-1 和 843.75 mg·L-1。 其中,24 h-LD50与Neuhauser 等[22]、吴声敢等[23]的研究结果一致,但48 h 急性毒性结果较已有研究结果稍低,这可能是由于赤子爱胜蚓个体差异及处理剂量的不同造成的。
表2 Cd 及其与PS-MPs 复合暴露对赤子爱胜蚓的急性毒性效应回归分析
Table 2 The regression analysis of the acute toxic effects of Cd and Cd+PS-MPs on E. fetida
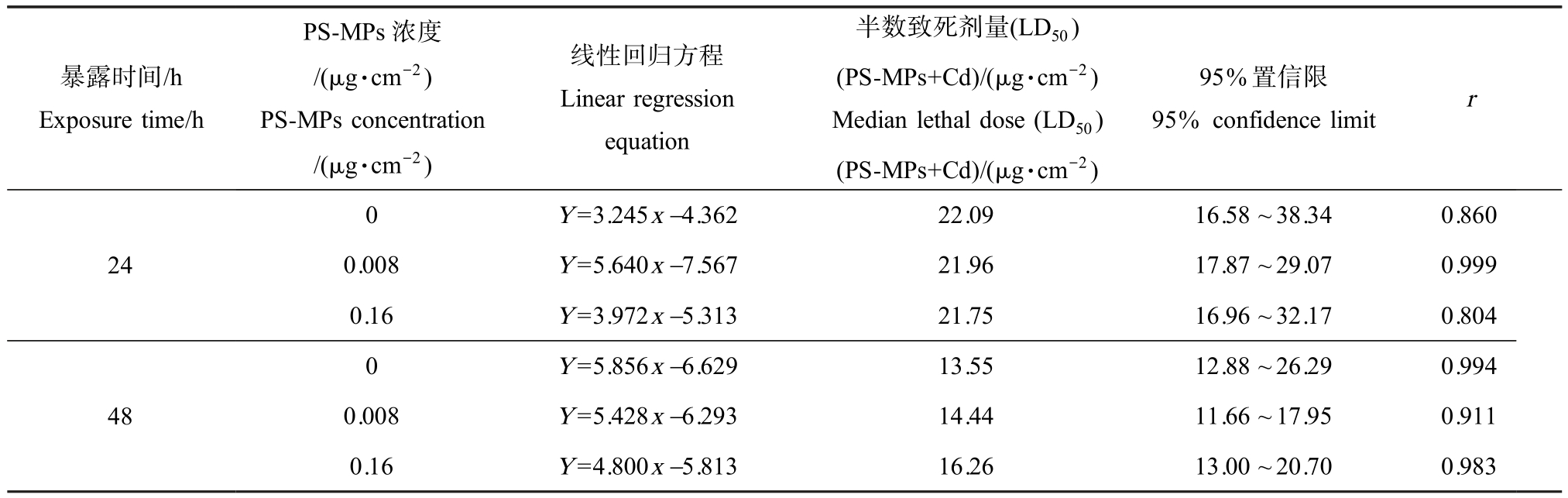
暴露时间/h Exposure time/h PS-MPs 浓度/(μg·cm-2)PS-MPs concentration/(μg·cm-2)线性回归方程Linear regression equation半数致死剂量(LD50)(PS-MPs+Cd)/(μg·cm-2)Median lethal dose (LD50)(PS-MPs+Cd)/(μg·cm-2)95%置信限95% confidence limit r 0 Y=3.245x-4.362 22.09 16.58 ~38.34 0.860 240.008 Y=5.640x-7.567 21.96 17.87 ~29.07 0.999 0.16 Y=3.972x-5.313 21.75 16.96 ~32.17 0.804 0 48 Y=5.856x-6.629 13.55 12.88 ~26.29 0.994 0.008 Y=5.428x-6.293 14.44 11.66 ~17.95 0.911 0.16 Y=4.800x-5.813 16.26 13.00 ~20.70 0.983
当 PS-MPs 浓度为 0.008 μg·cm-2(即 0.5 mg·L-1)时,蚯蚓 24 h 和 48 h 的 LD50 分别为 21.96 μg·cm-2和 14.44 μg·cm-2;当 PS-MPs 浓度为 0.160 μg·cm-2(即 10.0 mg·L-1)时,蚯蚓的 24 h-LD50 和 48 h-LD50 分别为 21.75 μg·cm-2和 16.43 μg·cm-2。 由实验结果可知,Cd 单一及其与PS-MPs 复合暴露对蚯蚓的24 h-LD50 无明显差异;48 h 作用下,Cd 与0.160 μg·cm-2 PS-MPs 复合暴露对蚯蚓的 LD50 最大,Cd 单一暴露对蚯蚓的LD50 最小。 LD50 数值越小,表示急性毒性效应越强。 Davarpanah 和 Guilhermino[24]研究发现,微塑料与铜的结合可以减轻重金属对微藻(Tetraselmis chuii)的毒性。 有证据表明,微塑料颗粒易于吸附包括Cd2+在内的金属阳离子[25],因此在本研究中,PS-MPs 可能在溶液中吸附重金属,导致Cd 在滤纸上的沉积量减少,降低了Cd的生物利用度,从而减轻其对蚯蚓的毒害作用[26]。即PS-MPs 的存在一定程度上降低了Cd 对蚯蚓的滤纸法急性毒性。
2.2 人工土壤法
2.2.1 Cd 与PS-MPs 复合污染对蚯蚓体质量的影响
Cd 与PS-MPs 复合污染对赤子爱胜蚓体质量的影响如图3 所示。 暴露14 d 后,各处理组蚯蚓体质量增长率与对照组相比均显著降低(P<0.05),为对照组的69.15% ~74.93%,表明 Cd 与 PS-MPs 复合暴露对蚯蚓的生长速率具有一定抑制作用,与先前研究结果类似。 有报道表明,土壤中的高含量Cd(250 ~500 μg·g-1)可降低蚯蚓生长速率,导致体质量减轻[27]。 Cao 等[28]研究了赤子爱胜蚓对土壤聚苯乙烯微塑料暴露的适应性,结果表明,高含量(1%和2%)(m/m)PS-MPs 暴露下蚯蚓生长受抑,死亡率增加。 Zhou 等[15]研究发现,聚丙烯微塑料(300 ~9 000 mg·kg-1)与 Cd(8 mg·kg-1)复合暴露使赤子爱胜蚓的生长速率降低,且Cd 的存在加剧了聚丙烯微塑料对蚯蚓生长的负面影响,其中,较高含量(>3 000 mg·kg-1)聚丙烯微塑料对蚯蚓肠道造成的磨损和堵塞可能是蚯蚓体质量减轻的直接原因,这与我们的研究结果略有不同。 在本试验中,不同处理组之间的体质量增长率无明显差异,结果的不同可能与土壤成分、微塑料种类以及暴露浓度有关,这也说明了土壤环境中微塑料和重金属相互作用的复杂性。
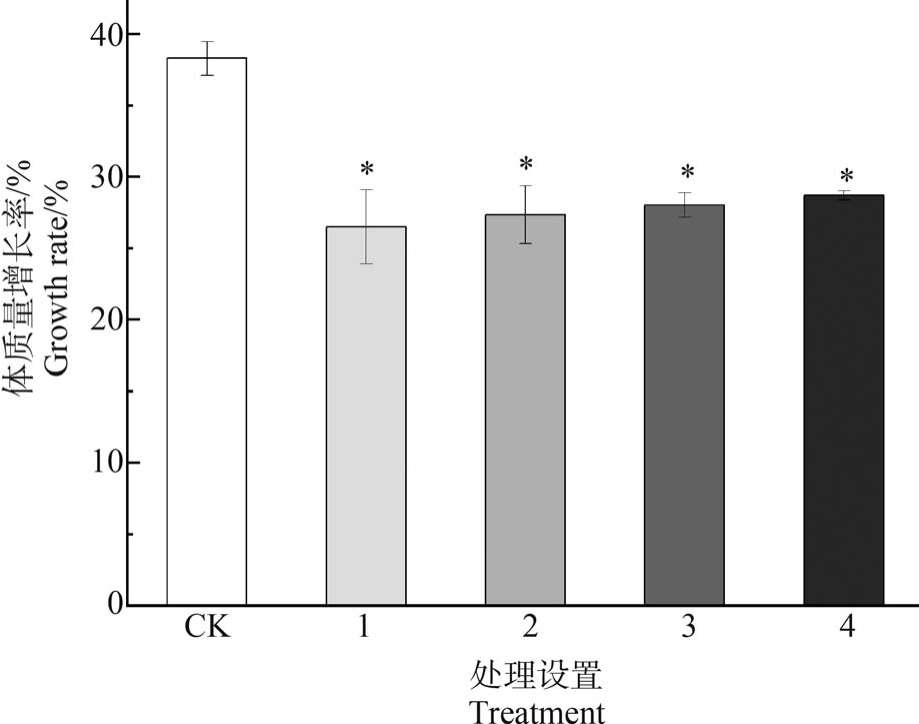
图3 Cd 和PS-MPs 复合污染对赤子爱胜蚓体质量变化的影响
注:CK 表示对照,1 表示 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 表示 1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 表示 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 表示 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs; *表示与 CK 相比有显著差异,P<0.05。
Fig.3 Changes of growth rate of E. fetida treated with PS-MPs and Cd
Note: CK represents the control,1 represents 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 represents 1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 represents 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 represents 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs; *indicates a significant difference compared with CK, P<0.05.
2.2.2 Cd 与PS-MPs 复合污染对蚯蚓体内抗氧化系统的影响
CAT 是抵御活性氧伤害的典型酶类,可以清除逆境过程中活性氧转化产生的H2O2,缓解其对细胞的毒害[29]。 由图4(a)可知,不同处理组蚯蚓体内CAT 活性均显著低于对照组(P<0.05)。 其中,CAT活性在 130 mg·kg-1 Cd 与 10 mg·kg-1 PS-MPs 复合暴露时仅为对照组的29.39%。 比较同含量Cd 与不同含量PS-MPs 组合的实验结果可知,相同暴露时间下,PS-MPs 含量高的处理组,CAT 活性较低。 当PS-MPs 含量为 10 mg·kg-1时,随 Cd 含量升高,CAT活性呈下降趋势,表明 CAT 活性与 Cd 含量以及PS-MPs 含量均呈一定剂量效应关系。 Wen 等[14]的研究也有类似结果,Cd 与PS-MPs 联合暴露七彩神仙鱼(Symphysodon aequifasciatus)时,CAT 活性受MPs、Cd 这2 种压力源及其相互作用影响,且联合暴露组较对照组有所下降,CAT 活性受到抑制。 较对照而言,处理组的CAT 活性值整体呈下降趋势,即活性受到抑制,说明在Cd 与PS-MPs 复合暴露条件下,机体受到氧化胁迫作用,自由基产生和消除之间的平衡被破坏,CAT 分解H2O2 的速度低于其产生速度,使得CAT 消耗殆尽,酶活性降低,而CAT活性的抑制将导致H2O2 的累积,可能对蚯蚓造成过氧化损伤[30]。
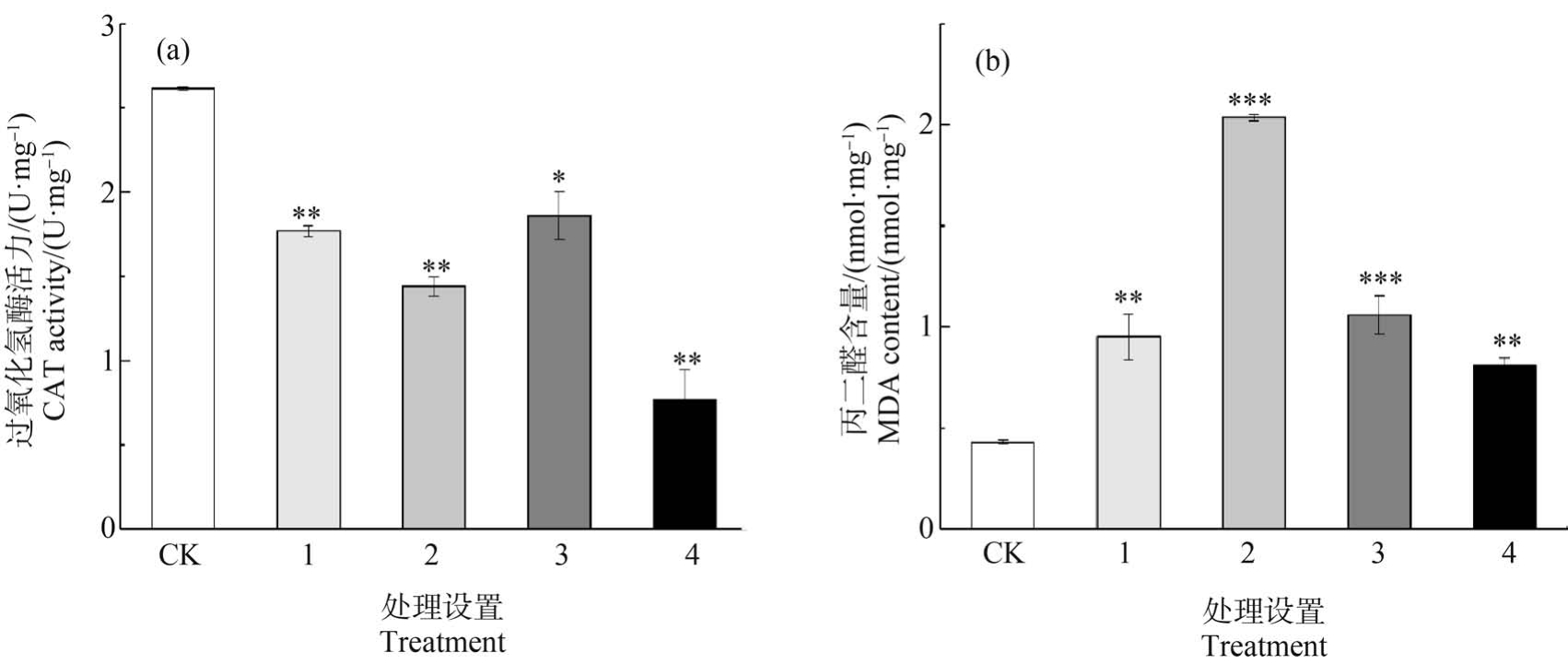
图4 Cd 和PS-MPs 复合污染对赤子爱胜蚓过氧化氢酶(CAT)活性(a)和丙二醛(MDA)含量(b)的影响
注:CK 表示对照,1 表示 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 表示 1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 表示 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 表示 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs;与 CK 相比有显著差异,*表示 P<0.05,**表示 P<0.01,***表示 P<0.001。
Fig.4 Changes of catalase (CAT) activity (a) and malondialdehyde (MDA) content (b) in E. fetida treated with PS-MPs and Cd
Note: CK represents the control,1 represents 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 represents 1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 represents 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 represents 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs;a significant difference compared with CK, *represents P<0.05, **represents P<0.01, ***represents P<0.001.
当蚯蚓受到外界胁迫打破抗氧化防御系统与体内活性氧之间动态平衡时,过量的超氧阴离子![]() 会与细胞中重要大分子结合,造成脂质过氧化、DNA 损伤等。 MDA 是自由基引发的脂质过氧化产物,可指示蚯蚓受到的氧化损伤,含量越高,表明损伤越大[31]。 在本研究中,Cd 与PS-MPs 复合暴露14 d 后,各处理组 MDA 含量均显著高于对照组(P <0.01)(图 4(b)),分别为对照组的 2.21 倍、2.46 倍、4.74倍和1.89 倍,说明蚯蚓受到氧化损伤。 Panzarino等[32]研究了Cd 单一胁迫下蚯蚓(Eisenia andrei)各生物标志物的响应,发现100 μg·g-1 Cd 显著诱导蚯蚓体内MDA 含量的上升,抑制CAT 活性。 也有研究证实,聚苯乙烯微塑料暴露可以诱导赤子爱胜蚓体内活性氧水平的升高和抗氧化酶活性的降低,对蚯蚓产生氧化损伤[33],与本研究结果一致。 在本试验中,Cd 与PS-MPs 复合作用诱导蚯蚓脂质过氧化反应,产生了氧化损伤,对机体产生一定损害,表明在Cd 与PS-MPs 复合作用下,蚯蚓抗氧化系统受到一定程度的损伤。
会与细胞中重要大分子结合,造成脂质过氧化、DNA 损伤等。 MDA 是自由基引发的脂质过氧化产物,可指示蚯蚓受到的氧化损伤,含量越高,表明损伤越大[31]。 在本研究中,Cd 与PS-MPs 复合暴露14 d 后,各处理组 MDA 含量均显著高于对照组(P <0.01)(图 4(b)),分别为对照组的 2.21 倍、2.46 倍、4.74倍和1.89 倍,说明蚯蚓受到氧化损伤。 Panzarino等[32]研究了Cd 单一胁迫下蚯蚓(Eisenia andrei)各生物标志物的响应,发现100 μg·g-1 Cd 显著诱导蚯蚓体内MDA 含量的上升,抑制CAT 活性。 也有研究证实,聚苯乙烯微塑料暴露可以诱导赤子爱胜蚓体内活性氧水平的升高和抗氧化酶活性的降低,对蚯蚓产生氧化损伤[33],与本研究结果一致。 在本试验中,Cd 与PS-MPs 复合作用诱导蚯蚓脂质过氧化反应,产生了氧化损伤,对机体产生一定损害,表明在Cd 与PS-MPs 复合作用下,蚯蚓抗氧化系统受到一定程度的损伤。
2.2.3 Cd 与PS-MPs 复合污染对蚯蚓体内消化酶活性的影响
AKP 是一种普遍存在的膜结合金属酶,在细胞生长、细胞凋亡、细胞迁移和蛋白质磷酸化等生理过程中必不可少[34]。 其活性也可以反映蚯蚓的代谢效率及消化能力[35]。 由图5(a)可知,不同处理组的AKP 活性与体质量变化结果相类似,均较对照组低(图3),但二者变化趋势仍存在一定差异,其可能原因为生物量变化联系着化学胁迫、化学效应与能量变化等多种因素,是机体在个体水平的综合响应[36]。其中,130 mg·kg-1 Cd 与 0.5 mg·kg-1 PS-MPs 复合暴露对蚯蚓体内AKP 活性呈显著抑制(P<0.01),酶活性仅为对照组的29.90%。 这与Banaee 等[12]的研究结果一致,该研究在暴露于高浓度Cd 和MPs 的鲤鱼(Cyprinus carpio)中发现AKP 活性显著下降。AKP 活性的降低一方面可能与机体的Cd 吸收有关,AKP 活性中心含有金属离子锌(Zn),Cd 的存在能打乱其现有构象,从而特异性抑制AKP 活性[37];另一方面,微塑料的加入也能阻碍机体消化能力,降低物质代谢水平,导致AKP 活性降低[38]。
纤维素酶是蚯蚓体内主要的消化酶,其活性变化可以指示蚯蚓生命活动状况,直接反映蚯蚓分解土壤有机质的能力[39]。 纤维素酶活性测定结果显示,除 1 mg·kg-1 Cd 与 0.5 mg·kg-1 PS-MPs 复合暴露组外,其余各处理组纤维素酶活性均显著高于对照组(P<0.01)(图 5(b)),说明土壤中 Cd 与 PS-MPs 复合暴露对蚯蚓体内纤维素酶活性起一定激活作用。由图 4(b)可知,1 mg·kg-1 Cd 与 10 mg·kg-1 PS-MPs复合胁迫下,蚯蚓体内MDA 含量最高,说明此时蚯蚓体内污染物代谢产物积累值最大,因此纤维素酶活性升高,以清除体内产生的代谢产物。
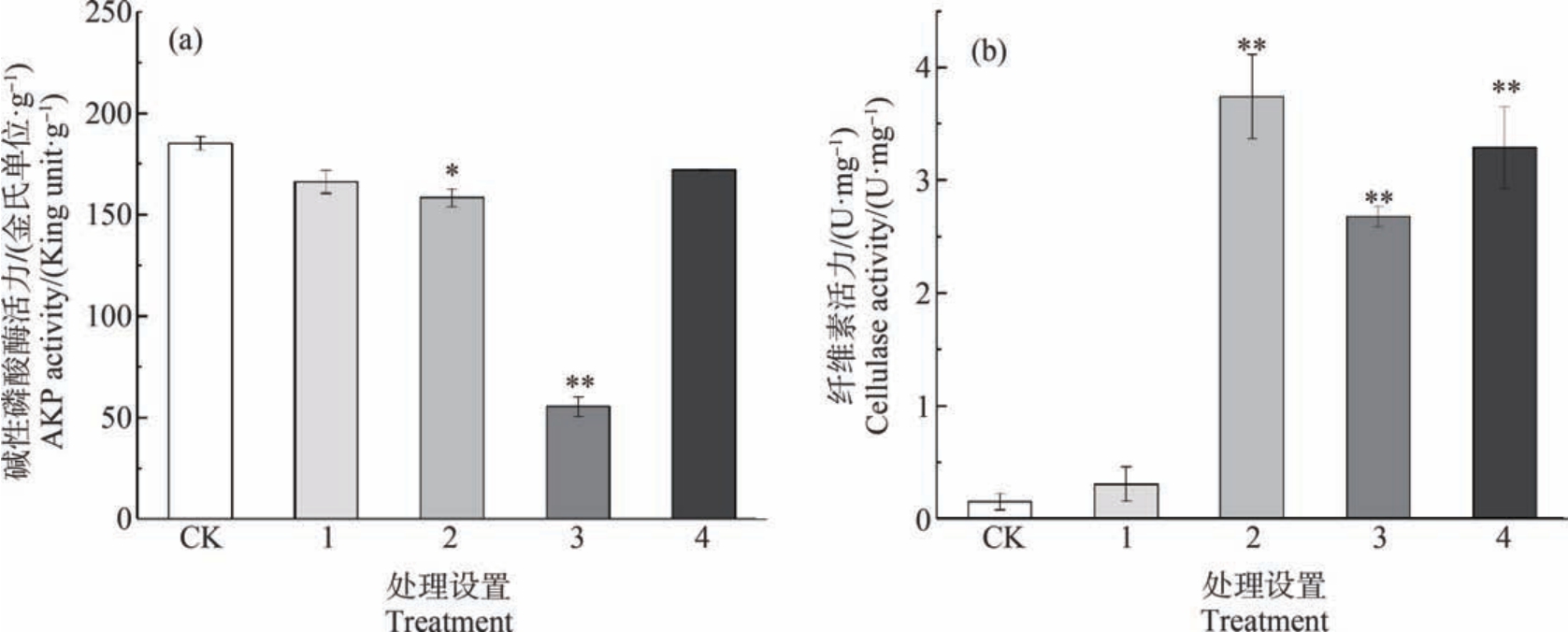
图5 Cd 和PS-MPs 复合暴露对赤子爱胜蚓碱性磷酸酶(AKP)活性(a)和纤维素酶活性(b)的影响
注:CK 表示对照,1 表示 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 表示 1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 表示 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 表示 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs;与 CK 相比有显著差异,*表示 P<0.05,**表示 P<0.01。
Fig.5 Changes of alkaline phosphatase (AKP) (a) and cellulase activities (b) in E. fetida treated with PS-MPs and Cd
Note: CK represents the control,1 represents 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 represents 1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 represents 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 represents 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs; a significant difference compared with CK, *represents P<0.05, **represents P<0.01.
张薇等[40]研究发现,不同含量(0.1 ~4 mg·kg-1)恩诺沙星和200 mg·kg-1铜复合污染14 d 显著抑制赤子爱胜蚓AKP 活性,诱导纤维素酶活性上升;类似地,Shi 等[35]研究了菲暴露14 d 对赤子爱胜蚓消化酶活性的影响,结果显示,蚯蚓的纤维素酶活性增加,而AKP 活性受到抑制,与本研究结果相一致。诱导的纤维素酶活性表明蚯蚓在一定含量下对Cd与PS-MPs 复合暴露可能表现出兴奋效应,增强生理功能以抵抗氧化应激[41-42]。
2.2.4 Cd 与PS-MPs 复合暴露对蚯蚓体腔细胞的DNA 损伤
彗星试验是一种能快速地在单细胞水平上检测DNA 损伤的测试方法[43]。 在本研究中,与对照组相比,Cd 与 PS-MPs 不同含量处理组均能引起 tail DNA% 、TL 和 OTM 这 3 项指标显著增加(图 6),暗示蚯蚓体腔细胞DNA 受损。 根据彗星损伤程度等级分析DNA 损伤情况,可知Cd 与PS-MPs 复合污染对蚯蚓DNA 造成轻中度损伤,其中,1 mg·kg-1 Cd 与0.5 mg·kg-1 PS-MPs 复合暴露组的受损程度最高(表3),说明二者复合暴露对蚯蚓具有潜在的遗传毒性效应。 已有研究证实PS-MPs 或Cd 单独暴露可引起赤子爱胜蚓体腔细胞的DNA 损伤[33,44],且随暴露浓度的增大,损伤加剧。 DNA 损伤可能与污染胁迫引起的氧化应激有关[45],有害环境的刺激诱导蚯蚓体内活性氧自由基的产生[32],DNA 受自由基攻击易受到破坏,从而导致单链或双链断裂[46]。Wang 等[30]的研究也表明,外界胁迫下过量活性氧(ROS)的生成,最终可导致赤子爱胜蚓膜脂过氧化和DNA 损伤。 推测在本试验中,Cd 与 PS-MPs 复合暴露也可能通过氧化胁迫引起蚯蚓DNA 一定程度的损伤。
表3 PS-MPs 和Cd 对赤子爱胜蚓DNA 损伤程度等级表
Table 3 The degree of DNA damage in E. fetida after exposed to PS-MPs and Cd
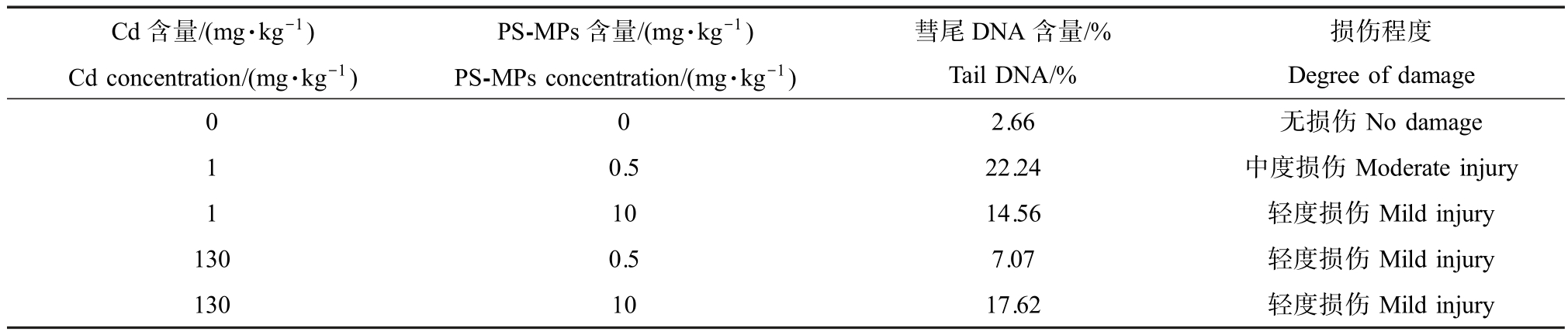
注:彗尾DNA 量占全部DNA 量的百分比与损伤程度的关系为<5%,0 级,无损伤;5% ~20%,1 级,轻度损伤;20% ~40%,2 级,中度损伤;40% ~95%,3 级,高度损伤;>95%,4 级,重度损伤。
Note: The relationship between tail DNA% and the degree of damage is <5%, grade 0, no damage; 5% ~20%, grade 1, mild damage; 20% ~40%,grade 2, moderate damage;40% ~95%, grade 3, high damage; >95%, grade 4, severe damage.
Cd 含量/(mg·kg-1)Cd concentration/(mg·kg-1)PS-MPs 含量/(mg·kg-1)PS-MPs concentration/(mg·kg-1)彗尾DNA 含量/%Tail DNA/%损伤程度Degree of damage 0 0 2.66 无损伤No damage 0.5 22.24 中度损伤Moderate injury 1 10 14.56 轻度损伤Mild injury 130 0.5 7.07 轻度损伤Mild injury 130 10 17.62 轻度损伤Mild injury 1
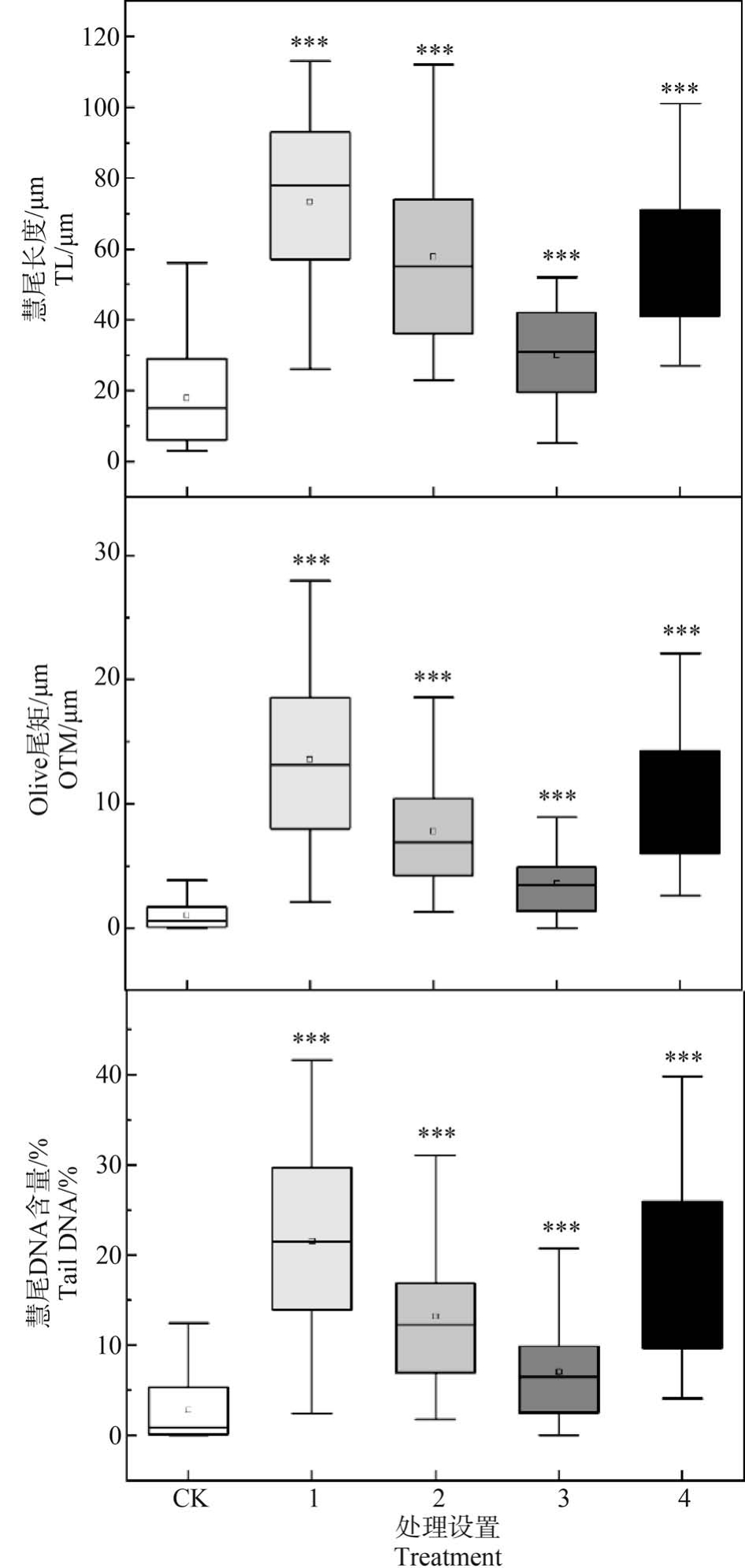
图6 Cd 和PS-MPs 复合暴露对蚯蚓体腔细胞DNA 损伤
注:(a) 彗尾长度,(b) Olive 尾矩,(c) 彗尾DNA 含量;CK 表示对照,1 表示 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 表示1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 表示 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 表示 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs;与CK 相比有显著差异,***表示P<0.001。
Fig.6 Effects of co-exposure of PS-MPs and Cd on DNA damage in E. fetida
Note: (a) Tail length (TL), (b) Oliver tail moment (OTM), (c) Tail DNA%; CK represents the control,1 represents 1 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,2 represents 1 mg·kg-1 Cd+10 mg·kg-1 PS-MPs,3 represents 130 mg·kg-1 Cd+0.5 mg·kg-1 PS-MPs,4 represents 130 mg·kg-1 Cd+10 mg·kg-1 PS-MPs;a significant difference compared with CK, ***represents P<0.001.
总的来说,本研究采用滤纸法试验,比较了Cd单一及其与PS-MPs 复合暴露下蚯蚓存活率的变化情况。 再依据滤纸法结果,开展人工土壤法试验,初步证实了土壤环境中PS-MPs 和Cd 复合污染对蚯蚓的生长、生理代谢及DNA 损伤的不利影响,这些不利影响可能通过食物链干扰土壤生态系统正常的生态功能,表现出的生态毒理效应需引起足够重视。但本研究仅初步探索了微塑料和重金属在土壤环境中共存时对土壤生物的毒性效应,其复合毒性效应具有复杂性,机制尚不明晰。 未来还需结合环境浓度微塑料对土壤生物的单一毒性、微塑料及其复合污染物在土壤环境中的相互作用展开深入研究。
[1]Barnes D K, Galgani F, Thompson R C, et al.Accumulation and fragmentation of plastic debris in global environments [J].Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2009, 364(1526):1985-1998
[2]Yousif E,Haddad R.Photodegradation and photostabilization of polymers,especially polystyrene:Review [J].SpringerPlus,2013,2:398
[3]Auta H S, Emenike C U, Fauziah S H. Distribution and importance of microplastics in the marine environment: A review of the sources, fate, effects, and potential solutions[J]. Environment International,2017,102:165-176
[4]Guo J J, Huang X P, Xiang L, et al. Source, migration and toxicology of microplastics in soil [J]. Environment International,2020,137:105263
[5]Wang W F, Ge J, Yu X Y, et al. Environmental fate and impacts of microplastics in soil ecosystems: Progress and perspective [J]. The Science of the Total Environment,2020,708:134841
[6]Zhang S L, Liu X, Hao X H, et al. Distribution of lowdensity microplastics in the mollisol farmlands of northeast China [J]. The Science of the Total Environment,2020,708:135091
[7]Fuller S, Gautam A. A procedure for measuring microplastics using pressurized fluid extraction [J]. Environmental Science & Technology,2016,50(11):5774-5780
[8]Rillig M C, Ingraffia R, de Souza Machado A A. Microplastic incorporation into soil in agroecosystems [J].Frontiers in Plant Science,2017,8:1805
[9]Steinmetz Z, Wollmann C, Schaefer M, et al. Plastic mulching in agriculture. Trading short-term agronomic benefits for long-term soil degradation? [J]. The Science of the Total Environment,2016,550:690-705
[10]de Souza Machado A A,Lau C W,Kloas W,et al.Microplastics can change soil properties and affect plant performance [J].Environmental Science&Technology,2019,53(10):6044-6052
[11]Bradney L, Wijesekara H,Palansooriya K N,et al.Particulate plastics as a vector for toxic trace-element uptake by aquatic and terrestrial organisms and human health risk[J]. Environment International,2019,131:104937
[12]Banaee M,Soltanian S,Sureda A,et al.Evaluation of single and combined effects of cadmium and micro-plastic particles on biochemical and immunological parameters of common carp (Cyprinus carpio) [J]. Chemosphere, 2019,236:124335
[13]Lu K, Qiao R X, An H, et al. Influence of microplastics on the accumulation and chronic toxic effects of cadmium in zebrafish (Danio rerio) [J]. Chemosphere, 2018, 202:514-520
[14]Wen B, Jin S R, Chen Z Z, et al. Single and combined effects of microplastics and cadmium on the cadmium accumulation, antioxidant defence and innate immunity of the discus fish (Symphysodon aequifasciatus) [J]. Environmental Pollution,2018,243(Pt A):462-471
[15]Zhou Y F, Liu X N, Wang J. Ecotoxicological effects of microplastics and cadmium on the earthworm Eisenia foetida [J]. Journal of Hazardous Materials, 2020, 392:122273
[16]Liu J J, Wang P F, Wang C, et al. Heavy metal pollution status and ecological risks of sediments under the influence of water transfers in Taihu Lake,China [J].Environ-mental Science and Pollution Research International,2017,24(3):2653-2666
[17]Mohsen M, Wang Q, Zhang L B, et al. Heavy metals in sediment,microplastic and sea cucumber Apostichopus japonicus from farms in China [J]. Marine Pollution Bulletin,2019,143:42-49
[18]Kim S W, Kim D, Jeong S W, et al. Size-dependent effects of polystyrene plastic particles on the nematode Caenorhabditis elegans as related to soil physicochemical properties [J]. Environmental Pollution, 2020, 258:113740
[19]Urionabarrenetxea E, Garcia-Velasco N, Marigómez I, et al. Effects of elevated temperatures and cadmium exposure on stress biomarkers at different biological complexity levels in Eisenia fetida earthworms [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2020,231:108735
[20]Eyambe G S,Goven A J,Fitzpatrick L C,et al.A non-invasive technique for sequential collection of earthworm(Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies [J]. Laboratory Animals, 1991, 25(1):61-67
[21]Singh N P, McCoy M T, Tice R R, et al. A simple technique for quantitation of low levels of DNA damage in individual cells [J]. Experimental Cell Research, 1988,175(1):184-191
[22]Neuhauser E F, Loehr R C, Milligan D L, et al. Toxicity of metals to the earthworm Eisenia fetida [J].Biology and Fertility of Soils,1985,1(3):149-152
[23]吴声敢, 王彦华, 吴长兴, 等.6 种重金属对赤子爱胜蚓的急性毒性效应与风险评价[J]. 生物安全学报, 2012,21(3):221-228
Wu S G, Wang Y H, Wu C X, et al. Acute toxicological effects and risk assessment of six heavy metals on the earthworm, Eisenia foetida [J].Journal of Biosafety,2012,21(3):221-228 (in Chinese)
[24]Davarpanah E, Guilhermino L. Single and combined effects of microplastics and copper on the population growth of the marine microalgae Tetraselmis chuii [J].Estuarine, Coastal and Shelf Science,2015,167:269-275
[25]Holmes L A, Turner A, Thompson R C. Interactions between trace metals and plastic production pellets under estuarine conditions [J]. Marine Chemistry, 2014, 167: 25-32
[26]Wang H T,Ding J,Xiong C,et al.Exposure to microplastics lowers arsenic accumulation and alters gut bacterial communities of earthworm Metaphire californica [J]. Environmental Pollution,2019,251:110-116
[27]![]() Effects of cadmium and lead on the life-cycle parameters of juvenile earthworm Eisenia fetida [J]. Ecotoxicology and Environmental Safety,2014,103:9-16
Effects of cadmium and lead on the life-cycle parameters of juvenile earthworm Eisenia fetida [J]. Ecotoxicology and Environmental Safety,2014,103:9-16
[28]Cao D D,Wang X,Luo X X,et al.Effects of polystyrene microplastics on the fitness of earthworms in an agricultural soil [J]. IOP Conference Series: Earth and Environmental Science,2017,61(1):12148
[29]Su Y C, Guo J L, Ling H, et al. Isolation of a novel peroxisomal catalase gene from sugarcane, which is responsive to biotic and abiotic stresses [J]. PLoS One, 2014, 9(1): e84426
[30]Wang H Z, Zhang X L, Wang L P, et al. Biochemical responses and DNA damage induced by herbicide QYR301 in earthworm (Eisenia fetida) [J]. Chemosphere, 2020,244:125512
[31]Wang J, Wang J H, Wang G C, et al. DNA damage and oxidative stress induced by imidacloprid exposure in the earthworm Eisenia fetida [J]. Chemosphere, 2016, 144:510-517
[32]Panzarino O, Hyršl P, Dobeš P, et al.Rank-based biomarker index to assess cadmium ecotoxicity on the earthworm Eisenia andrei [J]. Chemosphere, 2016, 145: 480-486
[33]Jiang X F, Chang Y Q, Zhang T, et al. Toxicological effects of polystyrene microplastics on earthworm (Eisenia fetida) [J]. Environmental Pollution, 2020, 259:113896
[34]Sharma U, Pal D, Prasad R. Alkaline phosphatase: An overview [J]. Indian Journal of Clinical Biochemistry,2014,29(3):269-278
[35]Shi Z M, Wen M, Zhang J, et al. Effect of phenanthrene on the biological characteristics of earthworm casts and their relationships with digestive and anti-oxidative systems [J]. Ecotoxicology and Environmental Safety, 2020,193:110359
[36]徐湘博, 史雅娟, 吕永龙, 等. 四溴双酚A 对赤子爱胜蚓的生长和基因表达的影响[J]. 生态毒理学报, 2014,9(6):1053-1059
Xu X B, Shi Y J, Lv Y L, et al.Effects of tetrabromobisphenol A on growth and gene expression of earthworms(Eisenia fetida) [J].Asian Journal of Ecotoxicology,2014,9(6):1053-1059 (in Chinese)
[37]Suzuki Y, Morita I, Yamane Y, et al.Preventive effects of zinc on cadmium-induced inhibition of alkaline phosphatase activity and mineralization activity in osteoblast-like cells, MC3T3-E1 [J]. Journal of Pharmacobio-Dynamics,1989,12(2):94-99
[38]Wen B, Zhang N, Jin S R, et al. Microplastics have a more profound impact than elevated temperatures on the predatory performance, digestion and energy metabolism of an Amazonian cichlid [J]. Aquatic Toxicology, 2018,195:67-76
[39]Park I Y,Cha J R,Ok S M,et al.A new earthworm cellulase and its possible role in the innate immunity [J]. Developmental and Comparative Immunology, 2017, 67:476-480
[40]张薇, 张萌, 陈凯, 等. 恩诺沙星和铜复合污染对蚯蚓消化酶活性的影响[J]. 应用生态学报, 2019, 30(6):2049-2055
Zhang W,Zhang M,Chen K,et al.Effects of enrofloxacin and Cu combined pollution on the activities of digestive enzymes of earthworm in soil [J].Chinese Journal of Applied Ecology,2019,30(6):2049-2055 (in Chinese)
[41]Zhang Q M, Zhang G L, Yin P J, et al. Toxicological effects of soil contaminated with spirotetramat to the earthworm Eisenia fetida [J]. Chemosphere, 2015, 139:138-145
[42]Zhang Q M, Zhang B H, Wang C X. Ecotoxicological effects on the earthworm Eisenia fetida following exposure to soil contaminated with imidacloprid [J]. Environmental Science and Pollution Research International,2014,21(21):12345-12353
[43]Gajski G, Žegura B, Ladeira C, et al. The comet assay in animal models: From bugs to whales - (Part 1 Invertebrates) [J]. Mutation Research Reviews in Mutation Research,2019,779:82-113
[44]Fourie F, Reinecke S A, Reinecke A J. The determination of earthworm species sensitivity differences to cadmium genotoxicity using the comet assay [J].Ecotoxicology and Environmental Safety,2007,67(3):361-368
[45]平令文, 李现旭, 张翠, 等. DEP 对蚯蚓抗氧化酶系的影响及 DNA 损伤[J]. 环境科学, 2018, 39(10): 4825-4833
Ping L W, Li X X, Zhang C, et al. Oxidative stress and DNA damage induced by DEP exposure in earthworms[J]. Environmental Science, 2018, 39(10): 4825-4833 (in Chinese)
[46]Ramadass K, Palanisami T, Smith E, et al. Earthworm comet assay for assessing the risk of weathered petroleum hydrocarbon contaminated soils:Need to look further than target contaminants [J]. Archives of Environmental Contamination and Toxicology,2016,71(4):561-571