近年来,由于工业化和城市化的快速发展,重金属污染已逐渐成为海洋污染的主要污染源之一[1]。重金属污染来源广、毒性高,不能在物质循环和能量交换中降解,并且会通过食物链在生物体中富集[1-2],对生物体造成巨大的损伤作用。 镉(Cd)是一种较为常见的有毒重金属,在人体内的半衰期长达10 ~30 a,极易在体内积蓄并对细胞、组织和器官产生毒性效应[3]。 Cd 等重金属可诱导机体产生活性氧自由基(ROS)。 ROS 可以和生物体内的脂质、蛋白质等物质反应,致使膜出现脂质过氧化、蛋白质羰基化(PCO)和 DNA-蛋白质交联(DPC)率升高[4],引发细胞凋亡甚至癌变[5-6]。 但生物体在进化过程中形成了有效的抗氧化防御系统,该防御系统由低分子量化合物(维生素 A、C、E、尿酸等)、抗氧化酶及非酶抗氧化物等组成。 机体内重要的抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx),其中SOD 能将超氧化物转化为氧气和过氧化氢(H2O2),CAT 催化H2O2 产生分子氧和水,而GPx 催化谷胱甘肽(GSH)使有毒的过氧化氢还原成无毒的羟基化合物,能有效地清除自由基并降低氧化损伤[7-8]。 但过量的ROS 超过了机体的抗氧化能力时,将会破坏抗氧化酶的功能[8]。Na+-K+ATP 酶和Ca2+-Mg2+ATP 酶是广泛存在于生物膜上的酶,对维持细胞的正常生命活动具有积极作用。 ATP 酶既可以作为酶催化ATP 释放大量能量供应机体代谢所需,也可以作为载体运输细胞所需的物质[9]。 研究表明,过量的ROS 会破坏机体内ATP 酶系统,Na+-K+ATP 酶和 Ca2+-Mg2+ATP 酶的损伤可能会导致离子失衡和细胞内Ca2+的蓄积[10]。 金属硫蛋白(MT)是富含半胱氨酸的非酶抗氧化剂,能够结合金属离子来减缓自由基的产生,直接参与抗氧化防御反应,以保护细胞免受重金属的毒害作用[11]。
软体动物是水生生态系统中的主要组成成分,可通过摄食、呼吸和体表渗透等方式富集水体环境中的Cd[12-13]。 双壳类软体动物由于其埋栖和滤食的生活方式,对重金属十分敏感,故在水生毒理学研究及评价上具有重要的意义。 而作为呼吸器官的鳃直接与水体长期接触,Cd 等重金属易在鳃中富集并对其产生氧化损伤效应[14]。 有研究表明,鳃比其他器官更易受到重金属的污染,可作为环境中重金属污染的指示组织[13,15]。 文蛤(Meretrix meretrix)隶属于双壳纲(Bivalvia)、帘蛤科(Veneridae)、文蛤属(Meretrix),具有较高的营养及生态价值,是我国重要的经济养殖种类之一,文蛤已逐渐被用于水环境中重金属污染的指示生物[16-17]。 有研究报道,Cd 等重金属对文蛤具有很强的毒性效应,如能抑制文蛤性腺抗氧化酶的活性,并导致膜脂质过氧化[18],能诱导幼体酶活性和抗氧化能力下降[19],高浓度Cd2+会显著诱导肝胰腺细胞凋亡[7]。 我们的前期研究发现,文蛤鳃对Cd2+的富集显著高于肝胰腺、足和外套膜[15],但Cd2+对文蛤鳃造成的氧化损伤、对抗氧化生物标志物的影响以及凋亡机制尚不清楚。 故本研究以文蛤为研究对象,旨在探讨急性Cd2+暴露对文蛤鳃组织的毒理效应,并探讨抗氧化生物标志物在Cd2+诱导文蛤鳃细胞凋亡中的响应情况。 该研究结果可以让我们更好地了解文蛤等双壳类动物的抗氧化防御系统是如何应对Cd2+的毒性效应,为进一步研究文蛤鳃细胞凋亡机制提供理论基础;同时为水生环境中Cd2+污染检测生化标志物的筛选提供了潜在的应用前景。
1 材料与方法(Materials and methods)
1.1 试剂
氯化镉(CdCl2·2.5H2O)(AR,≥99%)购自天联精细化工有限公司。 KCl(AR,99.5%)、HCl(36% ~38%)、无水乙醇(AR,≥99.7%)、乙酸乙酯(AR,99.9%)和三氯乙酸(AR,99%)购自浙江中星化工试剂有限公司。 蛋白酶 K 溶液(20 mg·mL-1)、盐酸胍(99%)和硫酸链霉素(98%)均购自麦克林公司。 三羟甲基氨基甲烷(Tris,99.9%)、2,4-二硝基苯肼(DNPH,98%)和十二烷基硫酸钠(SDS,95%)均购自Solarbio 公司。 吖啶橙/溴化乙锭(AO/EB)双荧光染料购自南京基根生物技术有限公司。 DNA 提取测定试剂盒购自天根生物技术有限公司。 SOD、CAT、GPx、ROS、总抗氧化能力(T-AOC)、Na+-K+ATP、Ca2+-Mg2+ATP 和总ATP 酶试剂盒均购自南京建成生物公司。 DNA marker 和 PrimeScript RT Reagent Kit 试剂盒均购自 Takara 公司。 AccuPower 2X Greenstar qPCR Master Mix 试剂盒购自 Bioneer 公司,UNIQ-10 柱式Tizol 总RNA 提取试剂盒购自生工股份有限公司。
1.2 动物处理
实验所用的文蛤购自浙江省灵昆养殖场,壳长(52.72±2.20) mm,壳宽(26.95±1.26) mm,壳高(43.41±1.88)mm,体质量(39.06±4.81)g。 文蛤养殖场的海水和沉积物中 Cd 含量分别为0.54 μg·L-1 和0.89 mg·kg-1。 将文蛤放置在6个装有10 L 15‰人工海水的养殖缸(67 cm×46 cm×36.5 cm)中适应养殖2 d,温度为(22±1) ℃,pH 为 7.9。 根据 Cd2+对文蛤 96 h LC50(15.01 mg·L-1)[7]的 1/10、1/5、1/2.5 和 1/1.25 设置 Cd2+的染毒浓度分别为 0、1.5、3、6 和 12 mg·L-1。各浓度组均设3个平行样,共15个养殖缸,每个养殖缸分别加入不同浓度的Cd2+溶液5.5 L,大小相近的625 只文蛤平均放入15个装有不同浓度Cd2+溶液的养殖缸中,24 h 更换新鲜的不同浓度Cd2+溶液,期间不喂食。 染毒5 d 后于冰上取文蛤鳃组织,立即放入液氮冷冻,然后置于-80 ℃冰箱中备用,用于各指标的测定。
1.3 鳃细胞氧化损伤和凋亡检测
1.3.1 AO/EB 双荧光检测鳃细胞凋亡
按照Ribble 等[20]描述的方法以及AO/EB 试剂盒中的相关说明对鳃细胞凋亡进行检测。 取不同Cd2+浓度组的鳃组织各50 mg,在预冷的1% PBS(pH=7.2)中制备细胞悬液,取制备好的细胞悬液各25 μL 与 1 μL AO/EB 水溶液混合并孵育 5 min,用荧光显微镜(尼康Ti-s,日本)观察并拍照。
1.3.2 DNA 片段检测鳃细胞凋亡
取不同Cd2+浓度组的鳃组织50 mg 至装有500 μL 生理盐水的离心管中,在冰上充分研磨成悬浮液,并在 11 200 r·min-1(4 ℃)下离心 1 min。 除去上清液,将沉淀物用于DNA 片段的提取。 根据DNA提取试剂盒说明书的相关要求和步骤提取DNA。将 DNA 样品混合物(8 μL DNA 提取物,3 μL 溴酚蓝)添加到每个泳道中,泳道中有含1%琼脂糖凝胶(包含 0.1 mg·mL-1溴化乙锭)的 0.5×TBE 缓冲液,并于58 V 进行电泳1 h。 用Gel Doc 2000 凝胶成像系统(Tanon,上海,中国)在紫外线下对所得的条带进行观察并拍照。
1.3.3 蛋白质羰基(PCO)含量检测
取不同浓度Cd2+溶液染毒后的鳃组织50 mg,加入9 倍体积的HEPES 缓冲液进行研磨,匀浆液于3 000 r·min-1下离心 10 min,取 200 μL 上清液,加入9 倍体积的10%硫酸链霉素溶液,室温放置10 min,然后取样品各100 μL,分别加入2 mol·L-1 HCl溶液400 μL 作为对照管以及 400 μL DNPH 溶液作为测定管,在黑暗中反应1 h,每10 min 摇匀一次。再在对照管和测定管中加入500 μL 的20% 三氯乙酸(TCA)溶液,离心 15 min(4 ℃、12 000 r·min-1)后弃上清,沉淀物加乙醇-乙酸乙酯溶液(V(无水乙醇)∶V(乙酸乙酯)=1 ∶1)1 mL 洗涤并离心 10 min(4 ℃ 、12 000 r·min-1),重复 3 次后加盐酸胍 1 mL 溶解沉淀,37 ℃水浴15 min 后再离心15 min(4 ℃、12 000 r·min-1),取上清液用分光光度计于370 nm 波长处测 OD 值。
1.3.4 DNA-蛋白质交联率(DPC)检测
参照Xie 等[21]的方法进行DPC 检测,即取不同浓度Cd2+溶液染毒后的鳃组织0.1 g,按质量(g)∶体积(mL)=1 ∶9 的比例加入 9 倍 PBS 缓冲液进行研磨,得10%的组织匀浆液。 取500 μL 匀浆液于离心管中,加入500 μL SDS 溶液进行轻微振荡,65 ℃水浴 10 min 后加 100 μL Tris-HCl-KCl 液,移液枪吹打 8 次。 冰上骤冷样品 5 min,4 ℃ 下 12 000 r·min-1离心10 min(以下离心条件相同),收集上清液于另一离心管。 向沉淀中加入1 mL 缓冲液重悬65℃水浴10 min,冰上骤冷5 min 后离心,将上清液转入上述离心管中(此步骤重复3 次)。 将终沉淀重悬于 500 μL 清洗缓冲液中,加 500 μL 蛋白酶 K,50℃消化3 h,冰上骤冷5 min 后离心,收集上清消化液于另一离心管中。 上清液和消化液各取100 μL于酶标板,分别加入100 μL 荧光染料后置于暗处反应30 min。 用多功能酶标仪(Biotek Epoch,USA)(Ex=350 nm,Em=460 nm)测定待测样品荧光强度。
1.3.5 ROS 和 T-AOC 测定
ROS 测定:取不同浓度Cd2+溶液染毒后的新鲜鳃组织0.1 g,剪碎放在200 目尼龙网上,并将网扎在小烧杯上,用眼科镊边搓边用PBS 冲洗,将组织搓完,加 PBS 至 2 000 μL,用 300 目尼龙网过滤,取800 μL 于 1.5 mL 离心管,4 ℃下 3 000 r·min-1离心10 min,弃上清。 加 400 μL 荧光染料 DCFH-DA 混匀后37 ℃水浴孵育1 h,每3 ~5 min 颠倒混匀;孵育1 h 后,在离心管中加入 800 μL PBS 在 4 ℃下3 000 r·min-1离心 5 min 后弃上清液,重复操作 2 次后加 1 mL PBS 混匀。 取 200 μL 待测样品于 96 孔板,用酶标仪(Biotek Epoch, USA)(Ex=488,Em=525)测荧光强度。
T-AOC 检测:称取文蛤鳃组织0.1 g,按质量(g)∶体积(mL)=1 ∶9,加入 9 倍生理盐水,冰浴机械匀浆,制备10%的组织匀浆,4 ℃、2 500 r·min-1,离心10 min,取上清液。 按照南京建成提供的T-AOC 试剂盒使用说明进行操作,用多功能酶标仪(Biotek Epoch, USA)对其进行检测。
1.4 抗氧化生物标志物的测定
1.4.1 氧化应激酶活性测定
样本前处理:称取文蛤鳃组织0.1 g,按质量(g)∶体积(mL)=1 ∶9,加入9 倍生理盐水,冰浴机械匀浆,制备10%的组织匀浆,4 ℃、2 500 r·min-1,离心10 min,取上清液用于氧化应激酶活性的测定。 SOD、CAT、GPx、Na+-K+ATP、Ca2+-Mg2+ATP 和总 ATP 酶活性的测定均按照南京建成提供的试剂盒使用说明进行。 酶活性单位采用U·mg-1表示。
1.4.2 MT mRNA 表达量测定
用UNIQ-10 柱式Trizol 总RNA 抽提试剂盒对鳃组织总RNA 进行抽提,凝胶电泳检测RNA 质量,紫外分光光度法测定RNA 含量。 以文蛤鳃总RNA 为模板,使用 PrimeScript RT Reagent Kit 试剂盒将总RNA 进行反转录得到cDNA。
根据NCBI 数据库已公布的文蛤金属硫蛋白MT-1 基因序列(GenBank:GU233466)[19]设计文蛤MT 特异性引物。 以文蛤鳃cDNA 为模板,以文蛤MT 引物为特异性引物,β-actin 引物作为内参,使用Roche LC480 荧光定量 PCR 仪和 AccuPower 2X Greenstar qPCR Master Mix 试剂盒对鳃组织中MT mRNA 表达进行相对定量分析。 PCR 条件如下:95℃预变性5 min,95 ℃变性15 s,58 ℃退火15 s,72℃延伸20 s,共40个循环。 同时设置阴性对照,反应体系中不加入cDNA,总体积为20 μL 不变。
1.5 数据处理
实验所得的数据均用SPSS 25 软件进行分析,用单因素方差分析(One-Way ANOVA)和LSD 检测差异显著性,用OriginPro 9.0 对所得数据进行相关图形的绘制。 数据均以平均值±标准差(Mean±S.D.)表示,P<0.05 即为差异显著。
2 结果(Results)
2.1 文蛤鳃细胞AO/EB 荧光显微观察
如图1 所示,对照组及1.5 mg·L-1 Cd2+处理组的鳃细胞形态圆润无褶皱,绿色荧光着色均匀,表明细胞无明显凋亡现象(图1(a)~(b))。 随Cd2+浓度的升高,呈橙黄色和红色荧光的细胞逐渐增多,说明细胞正常的生理结构有破损,并开始出现凋亡现象(图1(c)~(e))。 3 mg·L-1 Cd2+实验组中,部分鳃细胞出现橘黄色荧光,呈绿色荧光的细胞数量变少(图1(c))。 较高 Cd2+浓度组(6 ~12 mg·L-1)的鳃细胞形态异常,细胞核皱缩,个别细胞呈现“新月形”,且以橙黄色和红色荧光细胞为主(图1(d)~(e))。 由此可见,随着Cd2+浓度的加大,细胞凋亡逐渐增强。
2.2 琼脂糖凝胶电泳检验文蛤鳃细胞DNA 完整性
对照组、1.5 mg·L-1和 3 mg·L-1 Cd2+浓度组的文蛤鳃细胞无明显的梯形条带出现(图1(f) g ~i),说明细胞DNA 相对完好;随Cd2+染毒浓度的增加(6 mg·L-1和12 mg·L-1 Cd2+),文蛤鳃细胞DNA 梯状断裂条带逐渐明显,每个条带的间隔约200 bp(图1(f) j~k),说明随着Cd2+浓度的增加细胞凋亡程度不断加剧。
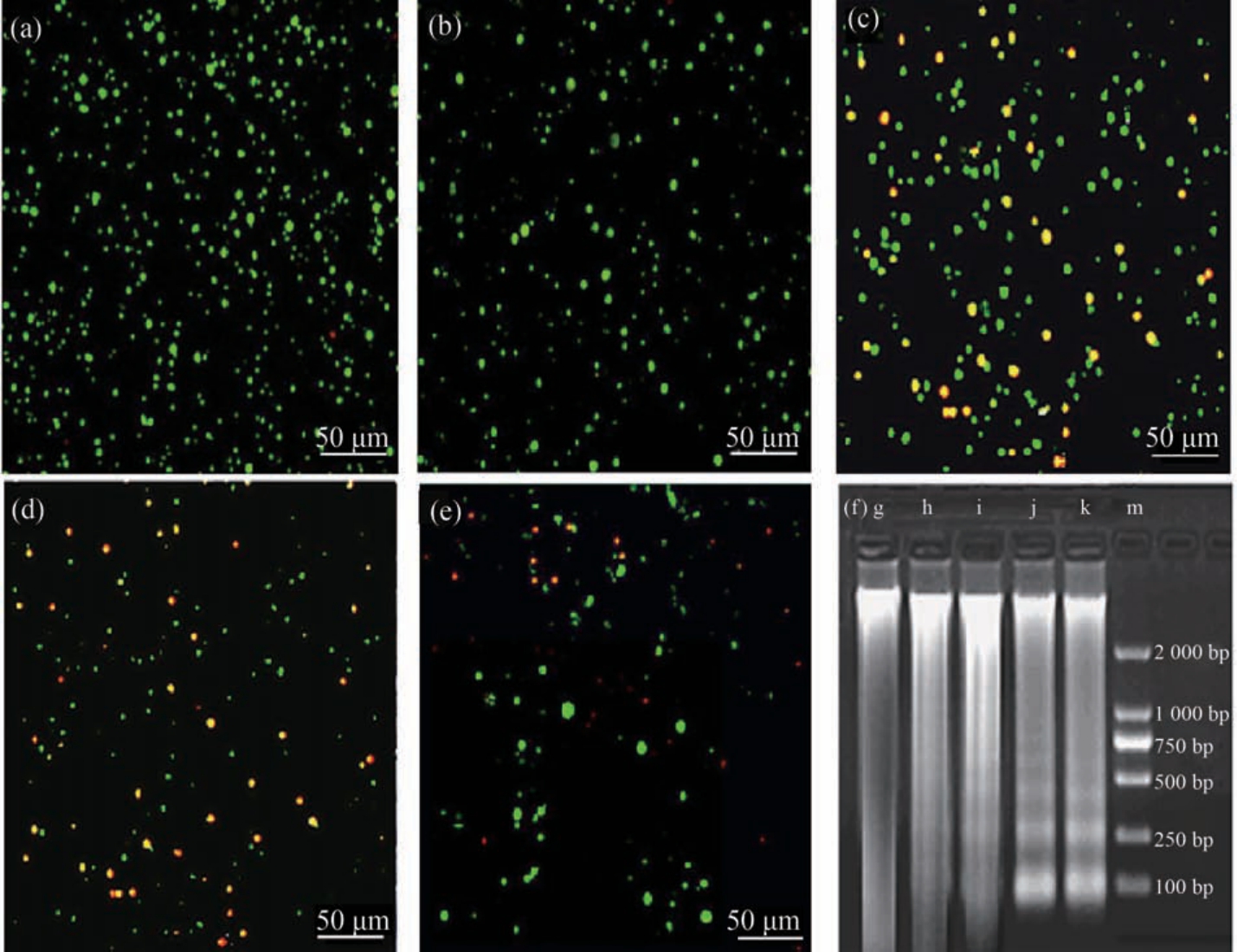
图1 不同浓度Cd2+染毒组文蛤鳃细胞AO/EB 和DNA Ladder 检测图
注:(a)~(e) AO/EB 图,(f) 凝胶电泳图;(a)0 mg·L-1,(b)1.5 mg·L-1,(c)3 mg·L-1,(d)6 mg·L-1,(e)12 mg·L-1,(f) m 表示 marker,g 表示 0 mg·L-1,h 表示 1.5 mg·L-1,i 表示 3 mg·L-1,j 表示 6 mg·L-1,k 表示 12 mg·L-1。
Fig.1 AO/EB fluorescence microscopy analysis and DNA fragmentation in the gill of M. meretrix exposed to different Cd2+ concentrations
Note: (a)~(e) AO/EB fluorescence microscopy analysis, (f) Gel electrophoresis image; (a)0 mg·L-1,(b)1.5 mg·L-1, (c)3 mg·L-1, (d)6 mg·L-1, (e)12 mg·L-1, (f) m represents marker, g represents 0 mg·L-1,h represents 1.5 mg·L-1, i represents 3 mg·L-1, j represents 6 mg·L-1, and k represents 12 mg·L-1.
2.3 Cd2+对文蛤鳃DPC 和PCO 水平的影响
文蛤鳃DPC 和PCO 水平均随Cd2+浓度上升而上升,在12 mg·L-1 Cd2+浓度组中达到最大值,呈明显的剂量-效应关系(图2)。 对照组的 DPC 水平与各Cd2+浓度组均有显著差异(P<0.05),但1.5 mg·L-1和3 mg·L-1 Cd2+浓度组差异不显著(P>0.05)(图2 黑色柱子)。 而文蛤鳃中PCO 水平在对照组和各Cd2+浓度组均有显著差异(P<0.05) (图2 白色柱子)。
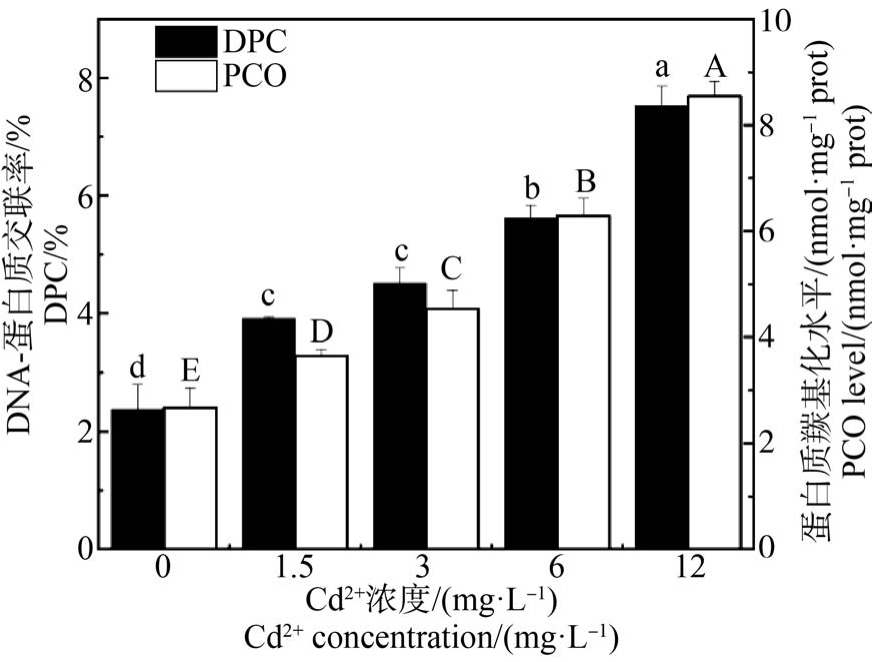
图2 Cd2+对文蛤鳃DNA-蛋白质交联率(DPC)和蛋白质羰基(PCO)水平的影响
注:不同字母表示有统计学差异(P<0.05),n=6;下同。
Fig.2 Effect of Cd2+ on DNA-protein crosslinks (DPC)and protein carbonyl (PCO) level of M. meretrix gills
Note: The different letters indicate significant differences among groups (P<0.05), n=6; the same below.
2.4 Cd2+对文蛤鳃T-AOC 和ROS 水平的影响
随着Cd2+浓度的上升,ROS 水平不断上升,在12 mg·L-1 Cd2+浓度组达到最大值。 对照组文蛤鳃中ROS 含量除与1.5 mg·L-1 Cd2+处理组无显著差异外(P>0.05),与其他Cd2+浓度组均有显著差异(P<0.05)(图 3 黑色柱子)。 T-AOC 水平随 Cd2+浓度的增加呈现先升后降的趋势,在1.5 mg·L-1 Cd2+浓度组达最高水平,且与对照组及其他Cd2+浓度组均有显著差异;12 mg·L-1 Cd2+浓度组达最低水平且与对照组及其他实验组均差异显著(P<0.05),但对照组、3 mg·L-1 Cd2+及 6 mg·L-1 Cd2+浓度组间无显著差异(图 3 白色柱子)。
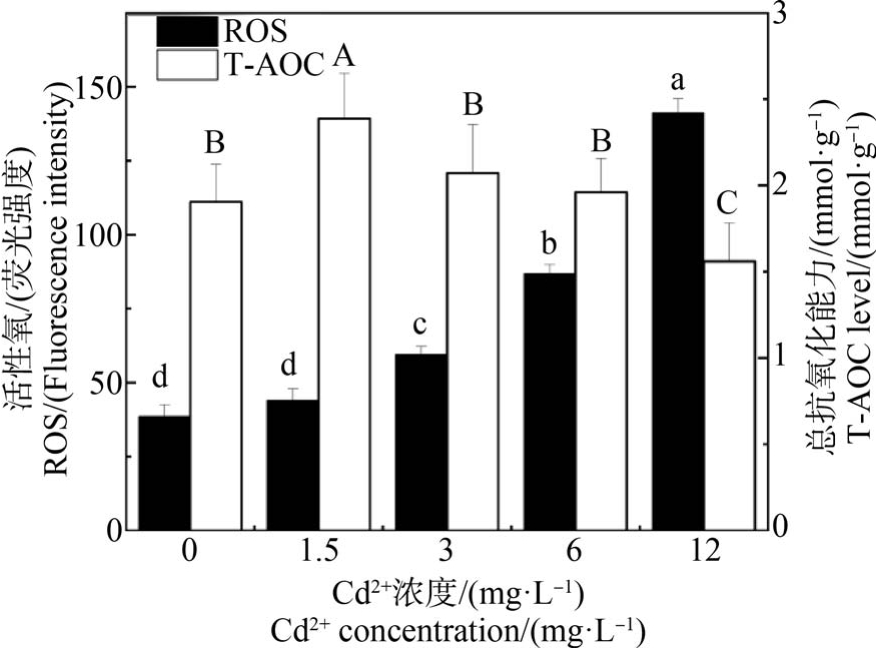
图3 Cd2+对文蛤鳃总抗氧化能力(T-AOC)和活性氧(ROS)水平的影响
Fig.3 Effect of Cd2+ on total antioxidant capacity (T-AOC)and reactive oxygen species (ROS) level of M. meretrix gills
2.5 Cd2+对文蛤鳃抗氧化酶活性的影响
如图4 ~6 所示,文蛤鳃抗氧化酶(SOD、CAT 和GPx)活性随着Cd2+浓度的增加呈现先升后降的趋势。 SOD 和 CAT 活性均在 1.5 mg·L-1 Cd2+浓度达最大值,与对照组和其他Cd2+浓度组均差异显著(P<0.05)。 对照组的 SOD 活性与 3 mg·L-1 和 6 mg·L-1 Cd2+浓度组无显著差异(P>0.05),12 mg·L-1浓度组SOD 活性最小,与对照组及其他各Cd2+浓度组均有显著差异(P<0.05) (图 4)。 对照组的 CAT 活性除与12 mg·L-1 Cd2+浓度组无显著差异外,与其他各组均差异显著(P<0.05) (图 5)。 对照组 GPx 活性与其他各组均无显著差异(图6)。
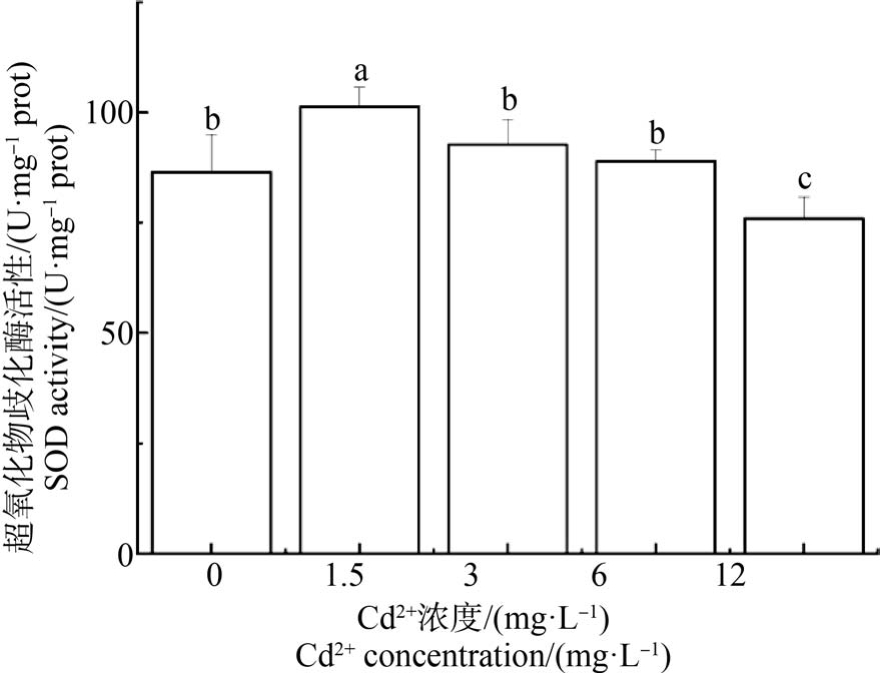
图4 Cd2+对文蛤鳃超氧化物歧化酶(SOD)活性的影响
Fig.4 Effect of Cd2+ on superoxide dismutase (SOD)activity of M. meretrix gills
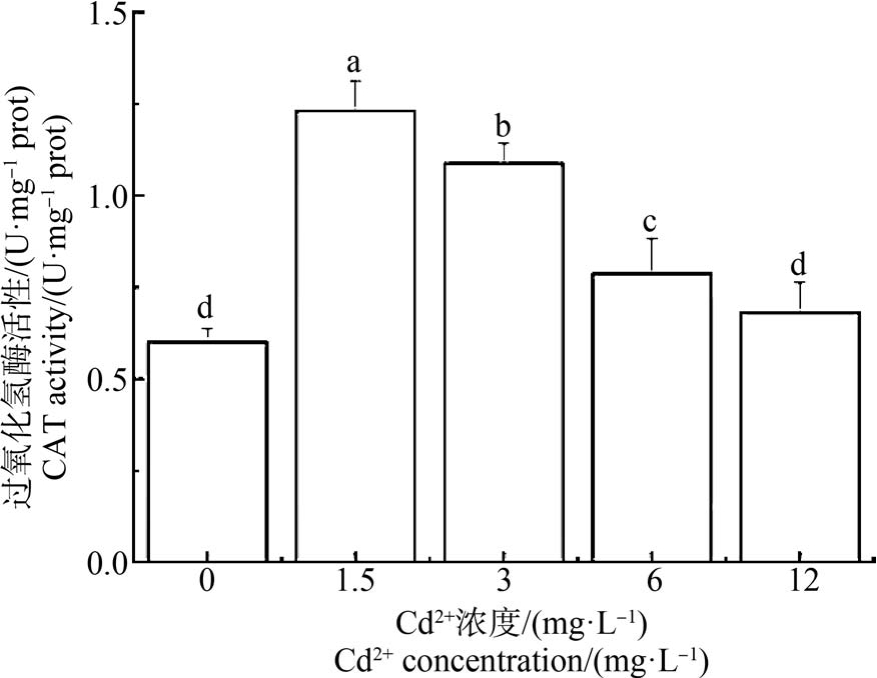
图5 Cd2+对文蛤鳃过氧化氢酶(CAT)活性的影响
Fig.5 Effect of Cd2+ on catalase (CAT)activity of M. meretrix gills
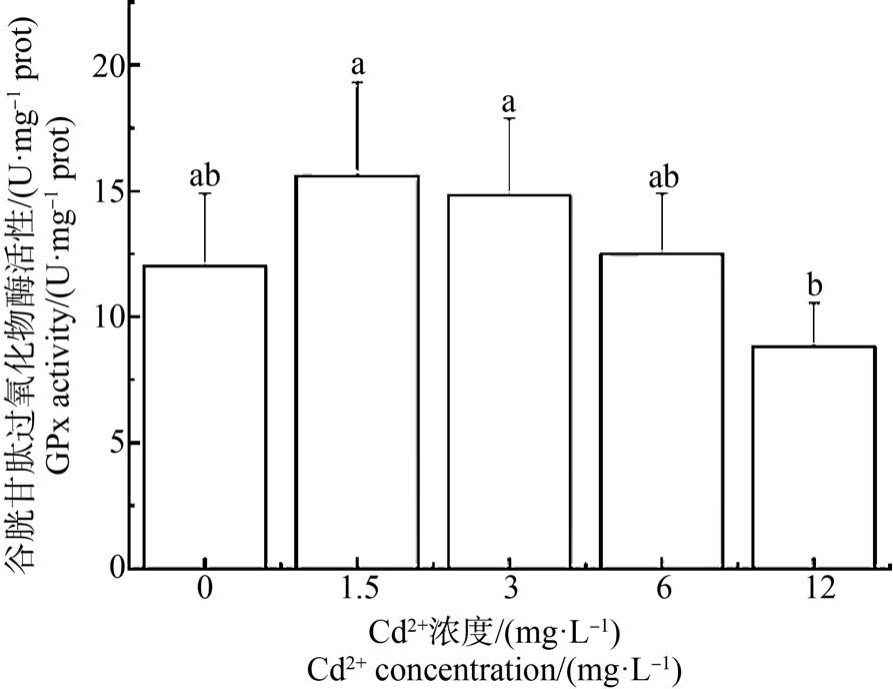
图6 Cd2+对文蛤鳃谷胱甘肽过氧化物酶(GPx)活性的影响
Fig.6 Effect of Cd2+ on glutathione peroxidase (GPx)activity of M. meretrix gills
2.6 Cd2+对文蛤鳃ATP 酶活性的影响
ATP 酶活性随Cd2+染毒浓度的增加呈现明显的抑制状态,对照组ATP 酶活性与1.5 mg·L-1 和3 mg·L-1 Cd2+浓度组无显著差异,但 12 mg·L-1 Cd2+浓度组的ATP 酶活性显著低于对照组及其他染毒组(P<0.05)(图7 ~ 图9)。 Na+-K+ATP 酶活性在6 mg·L-1和12 mg·L-1 Cd2+浓度组显著低于对照组,且与其他各组均有显著差异(P <0.05) (图 7)。 Ca2+-Mg2+ATP 酶活性在 12 mg·L-1与6 mg·L-1 Cd2+浓度组间无显著差异(图8)。 6 mg·L-1和12 mg·L-1 Cd2+浓度组的T-ATP 酶活性显著低于对照组,且与其他各组均有显著差异(P<0.05) (图9)。
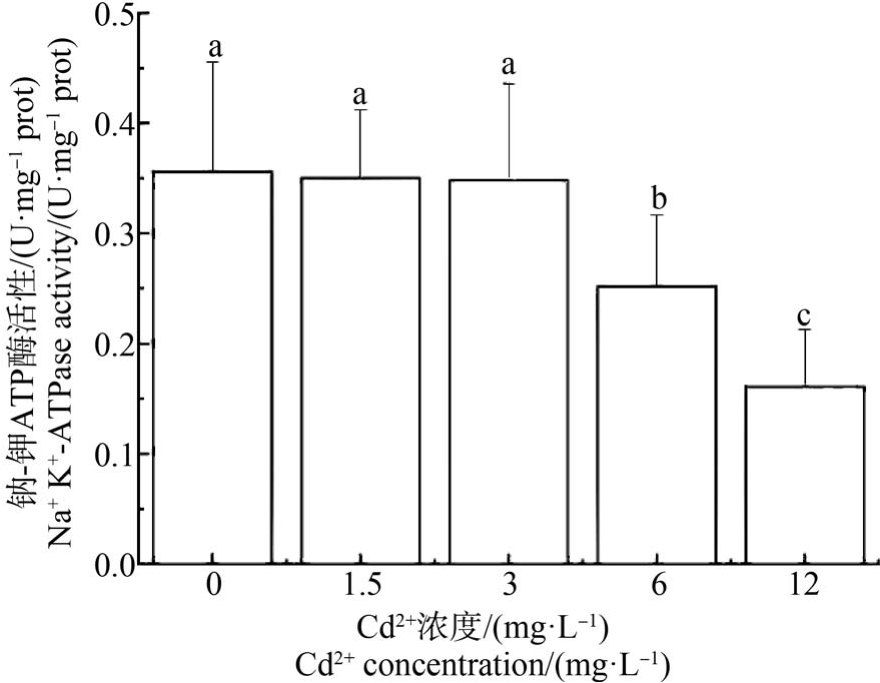
图7 Cd2+对文蛤鳃Na+-K+ATP 酶活性的影响
Fig.7 Effect of Cd2+ on Na+-K+ATPase activity of M. meretrix gills
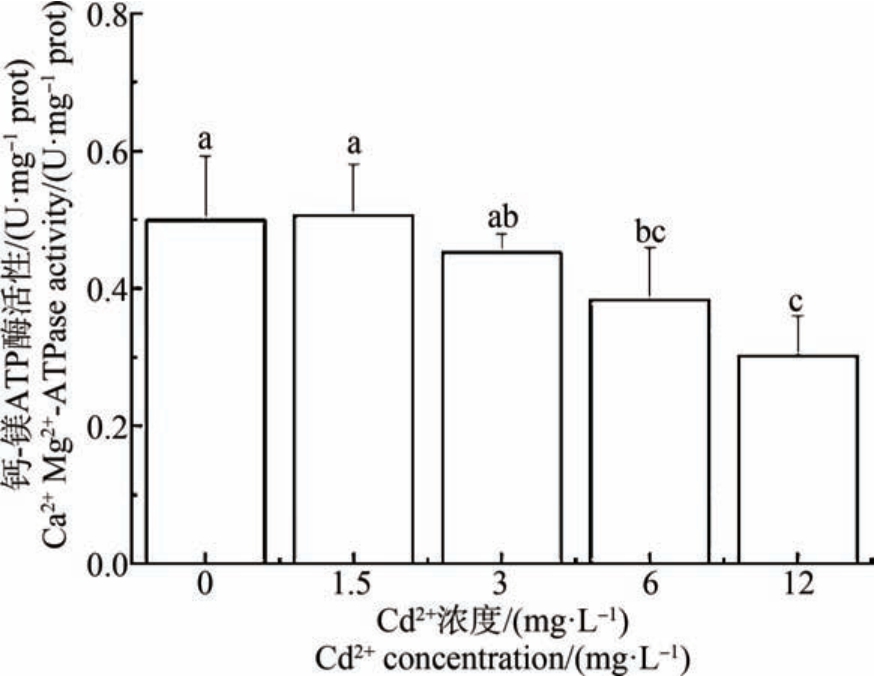
图8 Cd2+对文蛤鳃Ca2+-Mg2+ATP 酶活性的影响
Fig.8 Effect of Cd2+ on Ca2+-Mg2+ATPase activity of M. meretrix gills
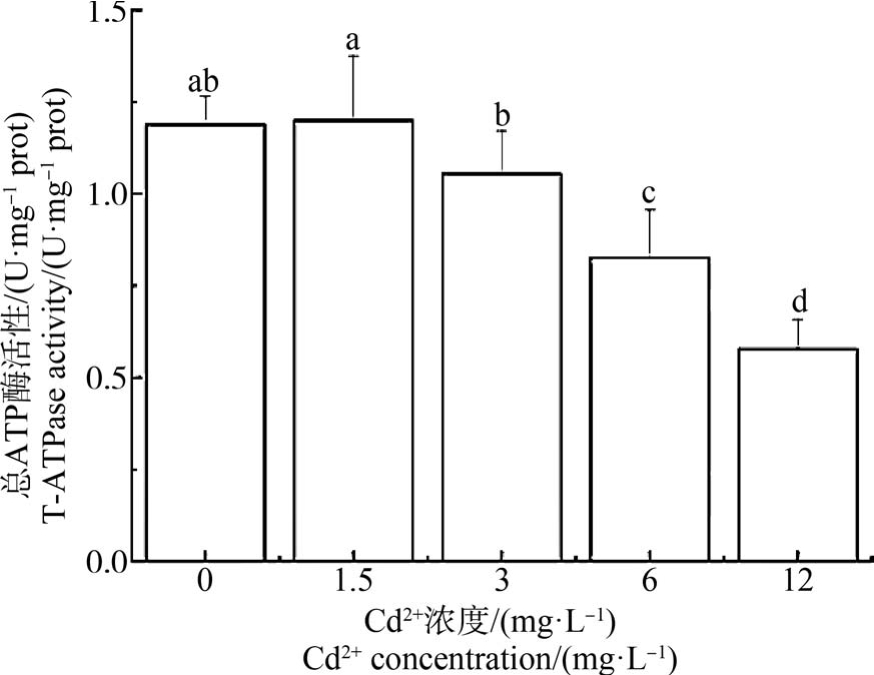
图9 Cd2+对文蛤鳃总ATP 酶活性的影响
Fig.9 Effect of Cd2+ on total ATPase (T-ATPase)activity of M. meretrix gills
2.7 Cd2+对文蛤鳃MT mRNA 表达量的影响
文蛤鳃MT mRNA 的表达量随Cd2+染毒浓度增大出现先增后减的趋势(图10)。 1.5 mg·L-1 Cd2+浓度组MT mRNA 的表达量最大,除与3 mg·L-1 Cd2+浓度组无显著差异外,与其他各组均差异显著(P<0.05);但对照组与12 mg·L-1 Cd2+浓度组无显著差异(P>0.05)。
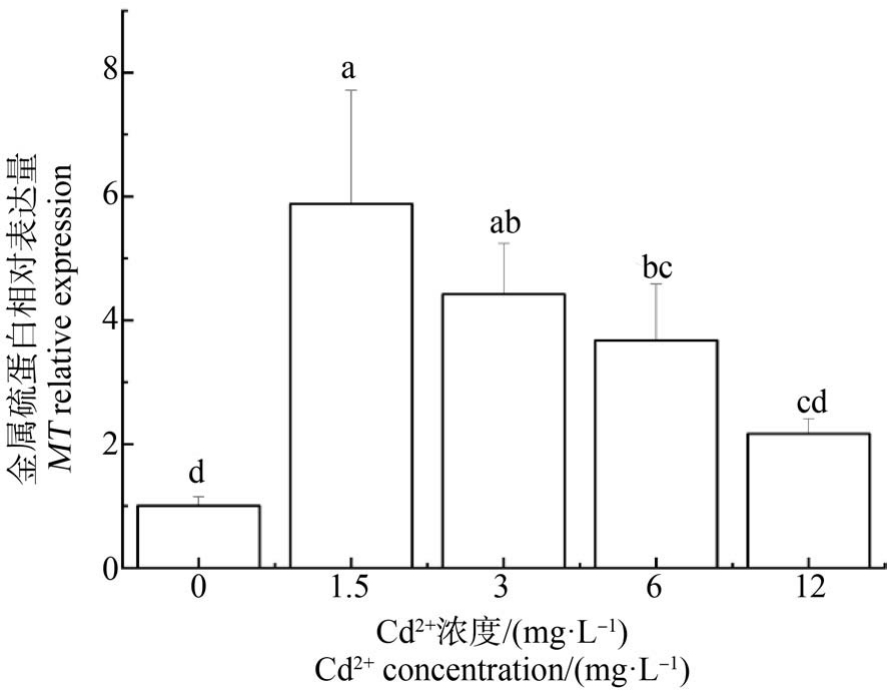
图10 Cd2+对文蛤鳃MT mRNA 表达量的影响
Fig.10 Effect of Cd2+ on MT mRNA expression of M. meretrix gills
3 讨论(Discussion)
3.1 Cd2+对水生动物的氧化损伤和细胞凋亡效应
Cd 等重金属会诱导水生动物产生过量的ROS![]() ,从而破坏细胞内的大分子物质,如脂质中多不饱和脂肪酸的氧化、蛋白质中氨基酸的氧化和通过辅助因子的氧化使特定酶失活[2,22-23]。 有研究表明,过量的ROS 产生是导致机体发生细胞凋亡的一个重要途径[5,7-8]。 文蛤(M. meretrix)鳃中ROS 水平与染毒浓度呈显著正相关(图3),说明随着Cd 等重金属离子浓度的上升会诱导产生过量的ROS,从而攻击氨基酸和蛋白质侧链,使蛋白质产生羰基化[5,24]。 ROS 的升高伴随着DNA 损伤的发生(图1(f),图3),使得细胞在代谢过程中不断产生DNA-蛋白质交联(DPC),DPC 的值不断上升(图2),说明蛋白质和DNA 的氧化损伤效应越来越严重。DNA 和蛋白质的交联会中断几乎所有的DNA 代谢过程[25-26],机体过强的氧化应激是导致细胞凋亡和DNA 损伤的重要诱因之一[27],这从文蛤鳃细胞AO/EB 和DNA Ladder 实验结果中得到了验证(图1(a)~(f))。 DNA 暴露于多余的自由基时会遭受广泛的氧化损伤,通常发现DNA 结构和功能的损伤是不可逆的[22]。 暴露于较高Cd2+浓度下的文蛤鳃细胞其DNA 片段化现象明显高于较低Cd2+浓度下的DNA 片段化(图 1(f)j ~k),这与 Wätjen 等[28]和 Lin等[8]分别对C6 神经胶质瘤细胞和中华绒螯蟹(Eriocheir sinensis)的研究结果一致,即Cd2+诱导细胞凋亡呈浓度依赖效应关系。
,从而破坏细胞内的大分子物质,如脂质中多不饱和脂肪酸的氧化、蛋白质中氨基酸的氧化和通过辅助因子的氧化使特定酶失活[2,22-23]。 有研究表明,过量的ROS 产生是导致机体发生细胞凋亡的一个重要途径[5,7-8]。 文蛤(M. meretrix)鳃中ROS 水平与染毒浓度呈显著正相关(图3),说明随着Cd 等重金属离子浓度的上升会诱导产生过量的ROS,从而攻击氨基酸和蛋白质侧链,使蛋白质产生羰基化[5,24]。 ROS 的升高伴随着DNA 损伤的发生(图1(f),图3),使得细胞在代谢过程中不断产生DNA-蛋白质交联(DPC),DPC 的值不断上升(图2),说明蛋白质和DNA 的氧化损伤效应越来越严重。DNA 和蛋白质的交联会中断几乎所有的DNA 代谢过程[25-26],机体过强的氧化应激是导致细胞凋亡和DNA 损伤的重要诱因之一[27],这从文蛤鳃细胞AO/EB 和DNA Ladder 实验结果中得到了验证(图1(a)~(f))。 DNA 暴露于多余的自由基时会遭受广泛的氧化损伤,通常发现DNA 结构和功能的损伤是不可逆的[22]。 暴露于较高Cd2+浓度下的文蛤鳃细胞其DNA 片段化现象明显高于较低Cd2+浓度下的DNA 片段化(图 1(f)j ~k),这与 Wätjen 等[28]和 Lin等[8]分别对C6 神经胶质瘤细胞和中华绒螯蟹(Eriocheir sinensis)的研究结果一致,即Cd2+诱导细胞凋亡呈浓度依赖效应关系。
3.2 Cd2+胁迫下氧化应激酶和金属硫蛋白mRNA(MT mRNA)的作用特点
SOD、CAT 和GPx 等抗氧化酶的活性变化可作为检验环境中重金属污染的生化标志物,这些酶活性的降低会导致细胞发生氧化损伤[29-30]。 Cd2+可通过结合抗氧化酶的活性位点来改变酶的空间结构,使得其活性下降,导致机体清除ROS 的能力下降[19,31]。 文蛤鳃 SOD 和 CAT 的活性随着 Cd2+浓度的增加呈先上升后下降趋势,均在1.5 mg·L-1浓度组达到最大值(图4 ~图6),说明较低Cd2+浓度下(0~1.5 mg·L-1)SOD 和CAT 的诱导可能是机体应对外来重金属的防御反应机制。 邢慧芳等[32]和于庆云等[33]分别研究了重金属对无齿蚌(A. woodiana woodiana)和菲律宾蛤仔(Ruditapes philippinarum)抗氧化酶的影响,也得出相似的结果。 这可能是在较低浓度Cd2+胁迫下,机体内产生少量的![]() 作为底物诱导SOD 的表达;但较高浓度的Cd2+(3 ~12 mg·L-1)可置换SOD 活性中心中的必需金属并与其结合导致其酶活性降低,这与前人对文蛤(M. meretrix)幼体[19]、斑马鱼(Danio rerio)[22]和海洋纤毛虫(Euplotes crassus)[34]的研究结果一致。 同时,低浓度Cd2+诱导下机体中SOD 酶活性增加会催化
作为底物诱导SOD 的表达;但较高浓度的Cd2+(3 ~12 mg·L-1)可置换SOD 活性中心中的必需金属并与其结合导致其酶活性降低,这与前人对文蛤(M. meretrix)幼体[19]、斑马鱼(Danio rerio)[22]和海洋纤毛虫(Euplotes crassus)[34]的研究结果一致。 同时,低浓度Cd2+诱导下机体中SOD 酶活性增加会催化![]() 产生大量的H2O2,过多的H2O2 刺激CAT 或通过线粒体和细胞质中的GPx 将其分解转化为无毒的O2 和H2O,但随着Cd2+浓度的增加会产生过量的H2O2使得机体内的CAT 和GPx 酶过度消耗,从而出现CAT 和GPx 酶活性下降的趋势[15,18,30,35]。
产生大量的H2O2,过多的H2O2 刺激CAT 或通过线粒体和细胞质中的GPx 将其分解转化为无毒的O2 和H2O,但随着Cd2+浓度的增加会产生过量的H2O2使得机体内的CAT 和GPx 酶过度消耗,从而出现CAT 和GPx 酶活性下降的趋势[15,18,30,35]。
ATP 酶是不可或缺的膜蛋白,能介导Na+、K+和Ca2+等离子在细胞中进行跨膜转运[36];并能调节细胞渗透压和膜通透性,金属离子可与ATP 酶的半胱氨酸巯基(—SH)作用来改变蛋白质功能[37]。 ATP 酶的活性取决于其与富含多不饱和脂肪酸(PUFA)的磷脂的相互作用[38]。 有研究表明,Na+-K+ATP 酶和Ca2+-Mg2+ATP 酶可作为器官功能的生物标记物[39]。Abdulkareem 等[10]发现污水能显著降低小鼠(Mus musculus)心脏Na+-K+ATP 酶活性,并略微降低小鼠心脏Ca2+-Mg2+ATP 酶活性。 Wang 和 Horisberger[40]认为Hg2+与Na+-K+ATP 酶的半胱氨酸残基结合是Hg 抑制 Na+-K+ATP 酶的机制之一。 Pivovarova 和Lagerspetz[41]认为二价重金属阳离子可能通过与Ca2+位点或Mg2+位点结合而抑制Ca2+-Mg2+ATP 酶活性。 文蛤鳃细胞 Na+-K+ATP 酶、Ca2+-Mg2+ATP酶、总 ATP 酶活性均与 Cd2+浓度(0 ~12 mg·L-1)呈负相关(图7 ~图9),说明Cd2+可能与ATP 酶的半胱氨酸巯基(—SH)或离子结合,从而影响其氧化应激功能。 吴众望等[42]对凡纳滨对虾(Litopenaeus vannamei)的研究表明,在较低重金属浓度处理时,鳃短时间内表现为促进作用,而较高浓度下为显著性抑制。 但本研究发现较低Cd2+浓度(1.5 ~3 mg·L-1)对文蛤鳃ATP 酶影响不大,与对照组无显著差异;但较高 Cd2+浓度(6 ~12 mg·L-1)文蛤鳃中 ATP 酶活性显著下降。 McGeer 等[43]认为虹鳟(Oncorhynchus mykiss)长时间暴露于低浓度Cu2+时,鳃丝Na+-K+ATP 酶活性显著升高,这可能会导致代谢负担增加。Zhao 等[37]研究发现Ca2+-Mg2+ATP 酶活性的降低会破坏中华绒螯蟹(Eriocheir sinensis)鳃上皮细胞中Ca2+和Mg2+的稳态,并影响ATP 的合成,可能会导致能量代谢出现问题,并最终损害鳃的正常生理功能。 本研究发现较高 Cd2+浓度(6 ~12 mg·L-1)诱导下文蛤鳃细胞凋亡率明显上升,说明ATP 活性的降低直接破坏鳃上皮,影响其生理功能。
MT 是一种低分子量、富含半胱氨酸的金属结合蛋白,由2个功能独立的球形结构域组成,促进其与二价金属(例如Cd2+和Zn2+)的结合,在金属元素的平衡、调节和解毒等方面具有重要的作用[44-45]。Cd2+(0 ~12 mg·L-1)会诱导文蛤鳃 MT mRNA 的表达(图10),机体可通过合成更多的MT 来抵抗Cd2+的毒害。 这可能是重金属Cd2+进入细胞后,产生的“毒物兴奋效应”,诱使MT mRNA 迅速表达,对重金属进行解毒作用[46-47]。 但当Cd2+浓度继续增加(3~12 mg·L-1)时,文蛤鳃组织 MT mRNA 的表达量出现下降的趋势(图10),这可能是过多的Cd 进入细胞后将诱导MT 表达并与之结合形成Cd-MT 复合物,该复合物有可能进入核内促使DNA 双链的降解[44,48]。 MT 是生物抵御重金属毒害的重要防线,MT 结合重金属达到饱和时,剩余的重金属将会在体内累积并诱导机体产生ROS,或直接与酶活性中心的巯基(—SH)结合占据其活性中心的位置,降低抗氧化酶活性和清除自由基的能力,致使机体产生氧化损伤[11,47]。 Rocha 等[11]的研究也发现,当贻贝(Mytilus galloprovincialis)暴露在不同浓度Cd2+ 3 d和14 d 后,贻贝鳃和消化腺中MT 的表达取决于Cd2+浓度和暴露时间。 目前的研究都表明水生动物对重金属的耐受性与富含半胱氨酸的蛋白质含量之间具有一定的相关性,但MT 在文蛤细胞氧化损伤和凋亡中的作用机制有待于进一步研究。
综上所述,在Cd2+浓度低于1.5 mg·L-1 时文蛤机体中的酶和非酶抗氧化剂在短时间内能抵御Cd2+对机体的毒害作用,但随着浓度的增加,即使在远低于LC50 的浓度下,机体也会产生氧化损伤甚至细胞凋亡,且具浓度依赖关系。 其潜在的毒性机制可能是Cd2+诱导机体产生ROS,促使细胞膜脂质过氧化、蛋白质羰基化以及DNA 和蛋白质发生交联,导致细胞ATP 酶活性受抑制,能量代谢紊乱。 在Cd2+浓度较低(0 ~1.5 mg·L-1)时,MT 和抗氧化酶被激活有助于缓解Cd2+的毒性作用,但环境中Cd2+浓度的持续增加(3 ~12 mg·L-1)会导致MT 的耗尽和抗氧化酶的失活,最终导致细胞凋亡。
[1]Zhang M, Sun X, Xu J L. Heavy metal pollution in the East China Sea: A review [J]. Marine Pollution Bulletin,2020,159:111473
[2]Zhang Y, Li Z Y, Kholodkevich S, et al. Cadmium-induced oxidative stress, histopathology, and transcriptome changes in the hepatopancreas of freshwater crayfish(Procambarus clarkii) [J]. The Science of the Total Environment,2019,666:944-955
[3]Tian J J,Hu J,He W,et al.Parental exposure to cadmium chloride causes developmental toxicity and thyroid endocrine disruption in zebrafish offspring [J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology,2020,234:108782
[4]Lacave J M,Bilbao E,Gilliland D,et al.Bioaccumulation,cellular and molecular effects in adult zebrafish after exposure to cadmium sulphide nanoparticles and to ionic cadmium [J]. Chemosphere,2020,238:124588
[5]Reyes-Becerril M, Angulo C, Sanchez V, et al. Methylmercury, cadmium and arsenic(Ⅲ)-induced toxicity, oxidative stress and apoptosis in Pacific red snapper leukocytes [J]. Aquatic Toxicology,2019,213:105223
[6]Zhou Y Y, Jing W X, Dahms H U, et al. Oxidative damage,ultrastructural alterations and gene expressions of hemocytes in the freshwater crab Sinopotamon henanense exposed to cadmium [J]. Ecotoxicology and Environmental Safety,2017,138:130-138
[7]Xia L P, Chen S H, Dahms H U, et al.Cadmium induced oxidative damage and apoptosis in the hepatopancreas of Meretrix meretrix [J]. Ecotoxicology, 2016, 25(5): 959-969
[8]Lin Y,Huang J J,Dahms H U,et al.Cell damage and apoptosis in the hepatopancreas of Eriocheir sinensis induced by cadmium [J]. Aquatic Toxicology, 2017, 190:190-198
[9]Serafini S,de Freitas Souza C,Baldissera M D,et al.Fish exposed to water contaminated with eprinomectin show inhibition of the activities of AChE and Na+/K+-ATPase in the brain, and changes in natural behavior [J]. Chemosphere,2019,223:124-130
[10]Abdulkareem A O, Olafimihan T F, Akinbobola O O, et al. Effect of untreated pharmaceutical plant effluent on cardiac Na+-K+- ATPase and Ca2+-Mg2+-ATPase activities in mice (Mus musculus) [J]. Toxicology Reports,2019,6:439-443
[11]Rocha T L,Bilbao E,Cardoso C,et al.Changes in metallothionein transcription levels in the mussel Mytilus galloprovincialis exposed to CdTe quantum dots [J]. Ecotoxicology,2018,27(4):402-410
[12]Chen M X,Zhou J Y,Lin J H,et al.Changes in oxidative stress biomarkers in Sinonovacula constricta in response to toxic metal accumulation during growth in an aquaculture farm [J]. Chemosphere,2020,248:125974
[13]Wan R, Meng F P, Fu W C, et al. Biochemical responses in the gills of Meretrix meretrix after exposure to treated municipal effluent [J]. Ecotoxicology and Environmental Safety,2015,111:78-85
[14]Saibu Y, Kumar S, Jamwal A, et al. A FTIRM study of the interactive effects of metals (zinc, copper and cadmium) in binary mixtures on the biochemical constituents of the gills in rainbow trout (Oncorhynchus mykiss) [J].Comparative Biochemistry and Physiology Toxicology &Pharmacology,2018,211:48-56
[15]Huang Y, Tang H C, Jin J Y, et al. Effects of waterborne cadmium exposure on its internal distribution in Meretrix meretrix and detoxification by metallothionein and antioxidant enzymes [J]. Frontiers in Marine Science, 2020, 7:00502
[16]Alyahya H, El-Gendy A H, Farraj S, et al. Evaluation of heavy metal pollution in the Arabian Gulf using the clam Meretrix meretrix Linnaeus, 1758 [J]. Water, Air, & Soil Pollution,2011,214(1-4):499-507
[17]Sarkar S K, Cabral H, Chatterjee M, et al. Biomonitoring of heavy metals using the bivalve molluscs in Sunderban mangrove wetland, northeast coast of Bay of Bengal (India):Possible risks to human health [J].CLEAN-Soil,Air,Water,2008,36(2):187-194
[18]张宜奎, 宋秀凯, 刘爱英, 等. 重金属 Cd2+、Cu2+对文蛤的急性毒性[J]. 海洋湖沼通报,2011(3):51-56
Zhang Y K, Song X K, Liu A Y, et al. Acute toxicity effects of Cd2+ and Cu2+ on Meretrix meretrix Linnaeus[J]. Transactions of Oceanology and Limnology, 2011(3):51-56 (in Chinese)
[19]Wang Q,Wang X M,Wang X Y,et al.Analysis of metallotionein expression and antioxidant enzyme activities in Meretrix meretrix larvae under sublethal cadmium exposure [J]. Aquatic Toxicology,2010,100(4):321-328
[20]Ribble D, Goldstein N B, Norris D A, et al. A simple technique for quantifying apoptosis in 96-well plates [J].BMC Biotechnology,2005,5:12
[21]Xie J F,Fan R J,Meng Z Q.Protein oxidation and DNA-protein crosslink induced by sulfur dioxide in lungs, livers, and hearts from mice [J]. Inhalation Toxicology,2007,19(9):759-765
[22]Gao M L, Yang Y J, Lv M T, et al. Oxidative stress and DNA damage in zebrafish liver due to hydroxyapatite nanoparticles-loaded cadmium [J]. Chemosphere, 2018,202:498-505
[23]Li R J,Zhou Y Y,Ji J F,et al.Oxidative damages by cadmium and the protective effects of low-molecular-weight chitosan in the freshwater crab (Sinopotamon yangtsekiense Bott 1967) [J]. Aquaculture Research, 2011, 42(4):506-515
[24]Wei K Q,Yang J X.Oxidative damage induced by copper and beta-cypermethrin in gill of the freshwater crayfish Procambarus clarkii[J].Ecotoxicology and Environmental Safety,2015,113:446-453
[25]Wei K Q, Yang J X.Copper-induced oxidative damage to the prophenoloxidase-activating system in the freshwater crayfish Procambarus clarkii [J]. Fish & Shellfish Immunology,2016,52:221-229
[26]Borgermann N, Ackermann L, Schwertman P, et al. SUMOylation promotes protective responses to DNA-protein crosslinks [J]. The EMBO Journal,2019,38(8): e101496
[27]Ren X Y, Wang X, Liu P, et al. Bioaccumulation and physiological responses in juvenile Marsupenaeus japonicus exposed to cadmium [J]. Aquatic Toxicology, 2019,214:105255
[28]Wätjen W, Cox M, Biagioli M, et al. Cadmium-induced apoptosis in C6 glioma cells: Mediation by caspase 9-activation [J]. Biometals,2002,15(1):15-25
[29]Cao L,Huang W,Liu J H,et al.Accumulation and oxidative stress biomarkers in Japanese flounder larvae and juveniles under chronic cadmium exposure [J].Comparative Biochemistry and Physiology Toxicology & Pharmacology,2010,151(3):386-392
[30]Wang C, Yue X, Lu X, et al. The role of catalase in the immune response to oxidative stress and pathogen challenge in the clam Meretrix meretrix [J]. Fish & Shellfish Immunology,2013,34(1):91-99
[31]Lu X, Wang C, Liu B Z. The role of Cu/Zn-SOD and Mn-SOD in the immune response to oxidative stress and pathogen challenge in the clam Meretrix meretrix [J].Fish& Shellfish Immunology,2015,42(1):58-65
[32]邢慧芳, 李涌泉, 杨慧珍, 等. 镉对背角无齿蚌外套膜和鳃抗氧化酶活性及脂质过氧化的影响[J]. 环境科学学报,2013,33(3):856-860
Xing H F, Li Y Q, Yang H Z, et al. Effects of cadmium on antioxidant enzyme activities and lipid peroxidation in the mantle and gill of the freshwater bivalve A.woodiana woodiana [J]. Acta Scientiae Circumstantiae,2013,33(3):856-860 (in Chinese)
[33]于庆云, 王悠, 徐彦, 等. 镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响[J]. 生态毒理学报, 2013,8(4):504-512
Yu Q Y, Wang Y, Xu Y, et al. Effects of cadmium and lead on the lipid peroxidation and levels of antioxidant enzymes in Ruditapes philippinarum [J]. Asian Journal of Ecotoxicology,2013,8(4):504-512 (in Chinese)
[34]Kim J S, Kim H, Yim B, et al.Identification and molecular characterization of two Cu/Zn-SODs and Mn-SOD in the marine ciliate Euplotes crassus:Modulation of enzyme activity and transcripts in response to copper and cadmium [J]. Aquatic Toxicology,2018,199:296-304
[35]Taylor A M, Maher W A. Exposure-dose-response of Anadara trapezia to metal contaminated estuarine sediments.1. Cadmium spiked sediments [J]. Aquatic Toxicology,2012,109:234-242
[36]Horáková L, Strosova M K, Spickett C M, et al. Impairment of calcium ATPases by high glucose and potential pharmacological protection [J]. Free Radical Research,2013,47(Suppl 1):81-92
[37]Zhao Y, Wang X, Qin Y W, et al. Gill ATPase activities and microstructures of juvenile Chinese mitten crab,Eriocheir sinensis, exposed to ambient mercury [J]. Advanced Materials Research,2011,183-185:1543-1548
[38]Vijayavel K, Gopalakrishnan S, Balasubramanian M P.Sublethal effect of silver and chromium in the green mussel Perna viridis with reference to alterations in oxygen uptake, filtration rate and membrane bound ATPase system as biomarkers [J]. Chemosphere, 2007, 69(6): 979-986
[39]Juel C, Nordsborg N B, Bangsbo J. Exercise-induced increase in maximal in vitro Na-K-ATPase activity in human skeletal muscle [J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology,2013,304(12): R1161-R1165
[40]Wang X, Horisberger J D. Mercury binding site on Na+/K+-ATPase: A cysteine in the first transmembrane segment [J]. Molecular Pharmacology,1996,50(3):687-691
[41]Pivovarova N B, Lagerspetz K Y H. Effect of cadmium on the ATPase activity in gills of Anodonta cygnea at different assay temperatures [J].Journal of Thermal Biology,1996,21(2):77-84
[42]吴众望, 潘鲁青, 张红霞, 等. 重金属离子对凡纳滨对虾鳃丝Na+-K+-ATPase 活力的影响[J]. 海洋环境科学,2004,23(3):27-29
Wu Z W,Pan L Q,Zhang H X,et al.Effects of metal ions on Na+-K+-ATPase activity in gill of Litopenaeus van-namei [J]. Marine Environmental Science, 2004, 23(3):27-29 (in Chinese)
[43]McGeer J C, Szebedinszky C, McDonald D G, et al.Effects of chronic sublethal exposure to waterborne Cu,Cd or Zn in rainbow trout.1: Iono-regulatory disturbance and metabolic costs [J]. Aquatic Toxicology,2000,50(3):231-243
[44]Gu B N, Liang W, Yang T Z, et al. Metallothionein, hemocyte status and superoxide dismutase/aspartate aminotransferase activity are sensitive biomarkers of cadmium stress in Onchidium reevesii [J]. Aquatic Toxicology,2019,215:105284
[45]Mao H, Wang D H, Yang W X.The involvement of metallothionein in the development of aquatic invertebrate[J].Aquatic Toxicology,2012,110-111:208-213
[46]Felix-Portillo M, Martínez-Quintana J A, Arenas-Padilla M, et al. Hypoxia drives apoptosis independently of p53 and metallothionein transcript levels in hemocytes of the whiteleg shrimp Litopenaeus vannamei [J]. Chemosphere,2016,161:454-462
[47]Serra-Batiste M, Cols N, Alcaraz L A, et al. The metalbinding properties of the blue crab copper specific CuMT-2: A crustacean metallothionein with two cysteine triplets [J]. Journal of Biological Inorganic Chemistry,2010,15(5):759-776
[48]Falfushynska H I, Gnatyshyna L L, Gyori J, et al. Metallothioneins, caspase-3 and oxidative stress responses in the multi-marker study of freshwater mussel inhabiting sites of various human impact [J]. Turkish Journal of Fisheries and Aquatic Sciences,2014,14(3):591-603