我国大气颗粒物污染严重,其主要是由粒径<100 μm 的微米级颗粒和近年来才引起关注的粒径<100 nm 的纳米级颗粒组成[1]。 在城市环境和部分工业场所的空气中都含有大量纳米颗粒物,可以通过形成气溶胶,经呼吸道进入人体,严重影响人体健康[2]。 这些纳米颗粒进入人体后,首先损伤呼吸器官,甚至能够进入血液,穿过血脑屏障,在细胞和分子等水平上影响机体组织和器官的功能,甚至改变基因的表达[3]。 因此,纳米颗粒对呼吸系统的影响不容忽视。 氧化石墨烯(graphene oxide, GO)又称功能化石墨烯,是一种由碳原子组成的单层蜂窝晶格材料,具有电学、光学、力学特性和良好的生物相容性,被广泛应用于材料学、生物医学和药物传递等诸多领域[4]。 因GO日益增多的生产和使用,很有可能在生产、运输、使用和废物处理等过程中进入环境,在空气、水和土壤中大量积累[5-6]。 GO 对环境吸附物表现出不同的吸附性能,能够吸附在其他空气颗粒物表面被人体吸入,可能引起吸入性肺损伤、呼吸系统过敏性疾病等。 因此,GO 的生物安全性引发了研究者的高度关注,尤其是对呼吸系统的损伤作用及机制仍然需要深入研究[7]。 本文通过体外细胞实验,研究GO 对人支气管上皮细胞增殖及凋亡的影响,初步阐明GO 纳米颗粒对呼吸系统的损伤机制,为纳米氧化石墨烯的安全性评价及其诱发的呼吸系统疾病的治疗提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料与试剂
人支气管上皮细胞株BEAS-2B 细胞购自美国ATCC 细胞库;GO 纳米片,含氧量35.29%,购自中国科学院成都有机化学有限公司;胎牛血清、青霉素-链霉素、RPMI 1640 培养基购自美国 GIBCO 公司;0.25%含EDTA 胰酶、RIPA 细胞裂解液、蛋白上样缓冲液、SDS-PAGE 凝胶配制试剂盒、MTT 试剂盒、细胞周期检测试剂盒购自中国碧云天生物技术有限公司;鼠抗人 Caspase-3、Bcl-2、GAPDH 单克隆抗体、兔抗人Bax、PARP 单克隆抗体购自美国CST公司;PI 和Annexin-V 探针细胞凋亡检测试剂盒购自美国BD 公司;活性氧(ROS)荧光探针-DHE 购自中国威格拉斯生物技术有限公司。
1.2 仪器设备
流式细胞仪(Verse,BD 公司,美国);原子力显微镜(Dimension Icon,BRUKER 公司,德国);电泳仪(Mini Protean Tetra,Bio-Rad 公司,美国);化学-荧光发光显影仪(FluroChem M1,Alpha 公司,美国);显微镜(IX70,Olympus 公司,日本);二氧化碳培养箱(3111,Thermo Fisher 公司,美国);离心机(5804R,Eppendorf 公司,德国)等。
1.3 细胞活力检测
在96 孔板中每孔接种4×103个 BEAS-2B 细胞,继续培养24 h;加入不同浓度的GO。 24 h 后,每孔加入 10 μL 5×103 mg·L-1的噻唑蓝(MTT)溶液处理4 h,轻轻吸去所有液体,加入100 μL 二甲基亚砜(DMSO)后振荡溶解结晶;用酶标仪在570 nm/630 nm 双波长检测吸光度。
1.4 细胞内活性氧检测
在6 孔板中每孔接种1×105个BEAS-2B 细胞,继续培养24 h,除去旧的培养基加入相同体积的新培养基后,加入不同浓度的GO,孵育24 h;收集细胞加入100 μL 磷酸缓冲溶液(PBS),溶液中包含10 μmol·L-1 ROS 荧光探针-DHE 染料,37 ℃下孵育 30 min,用流式细胞仪检测。
1.5 细胞周期检测
各组细胞经GO 处理24 h 后,用0.25%的胰酶消化细胞制成单细胞悬液;用75%的乙醇(-20 ℃预冷)固定细胞;加入 PI(终浓度5×104 mg·L-1)和 RNA酶(终浓度 5×104 mg·L-1)染色20 min;上机前用200~400 目筛网过滤细胞后,用流式细胞仪检测。
1.6 细胞凋亡检测
各组细胞经GO 处理24 h 和48 h 后,收集细胞上清于15 mL 离心管中,PBS 洗2 遍的废液也收集到15 mL 离心管中;0.25%含EDTA 胰酶消化后,将细胞收集于上一步的15 mL 离心管中,离心收集细胞;将上一步中的细胞转移至1.5 mL 离心管中,并加入100 μL PBS 重悬,加入 7-AAD 和 Annexin-V探针各5 μL,混匀,室温避光15 min;用PBS 补足体积至400 μL;用流式细胞仪分析。
1.7 Western-blot 实验
各组细胞经GO 处理24 h、48 h 后,加入细胞裂解液(RIPA)裂解细胞,利用BCA 试剂盒对蛋白进行定量;以10%的SDS-聚丙烯凝胶电泳分离各蛋白,切取所需片段,转移到硝化纤维薄膜上;利用脱脂牛奶封闭1 h,加入一抗置于4 ℃孵育过夜,TBST 缓冲液洗涤3 次,再用二抗处理1 h,TBST 缓冲液洗涤3 次;应用ECL 显影剂在化学-荧光发光显影仪上显影并拍照。
1.8 统计学方法
所有实验均至少重复3 次及以上,实验数据均以 mean±SD 表示。 采用 SPSS 19.0 软件进行统计学分析。 相同处理组与对照组之间比较采用Student’s t 检验,以*P<0.05、**P<0.01 为差异有统计学意义。
2 结果(Results)
2.1 GO 纳米片的形貌与尺寸
采用原子力显微镜(AFM)检测了GO 纳米片的形貌和厚度,如图1 所示,GO 纳米片是单层或多层的片状结构,粒径为1 ~5 μm,厚度为2 nm 左右。在AFM 下测量GO 纳米片的尺寸,统计100个GO纳米片的平均长度是(392.7±61.3) nm。
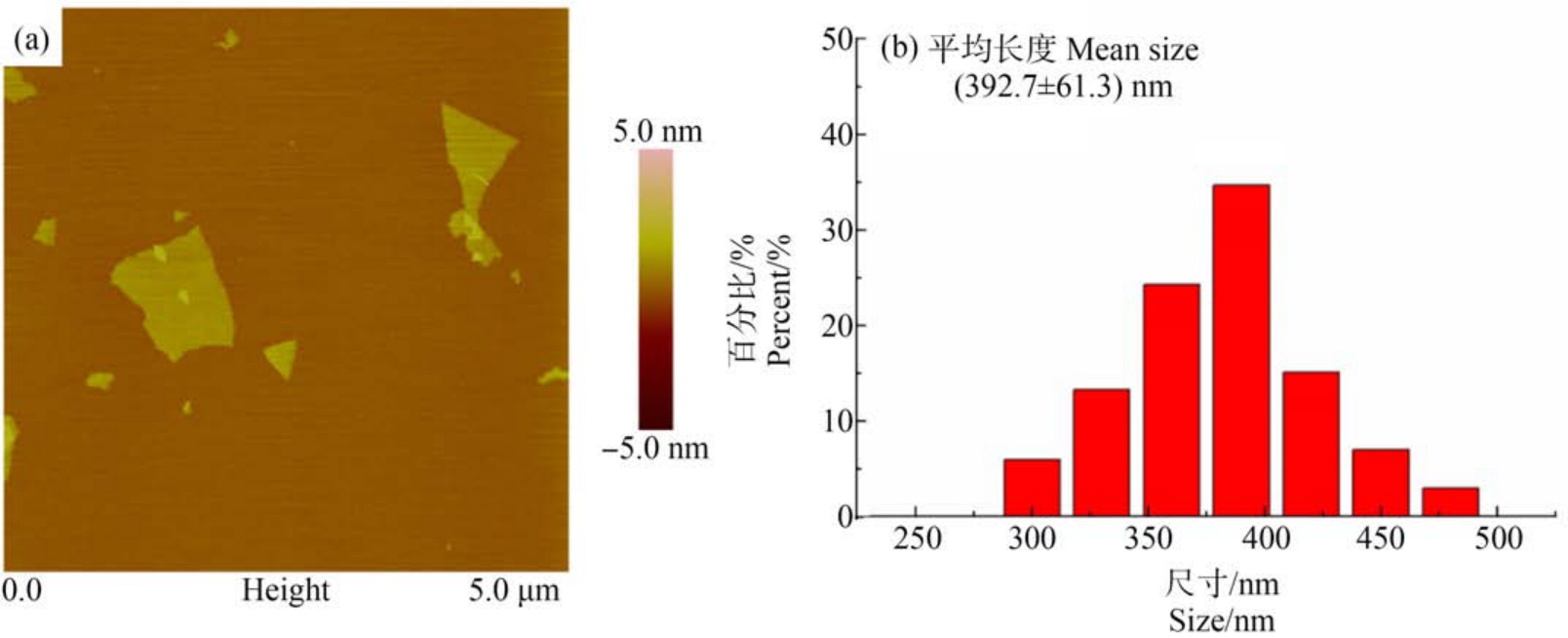
图1 原子力显微镜(AFM)观察氧化石墨烯(GO)的形貌与尺寸
Fig.1 Atomic force microscope (AFM) image of graphene oxide (GO) nanosheets
2.2 GO 对细胞活性的影响
各组细胞经GO 处理24 h 后,检测各组细胞的活性,发现随着GO 的浓度递增,细胞的活性逐渐减低,细胞生长速度减慢,大量细胞形态不正常,如图2 所示,其中 200 mg·L-1时,细胞活力降到 30%,提示GO 对细胞具有一定的毒性作用。 另外,通过流式细胞仪检测各组细胞的侧向角散射光信号(side scatter, SSC)信号可以反映细胞内的颗粒度,显示细胞内吞GO 颗粒的多少,如图3 所示,随GO 的浓度递增,细胞的SSC 信号也逐渐增强。
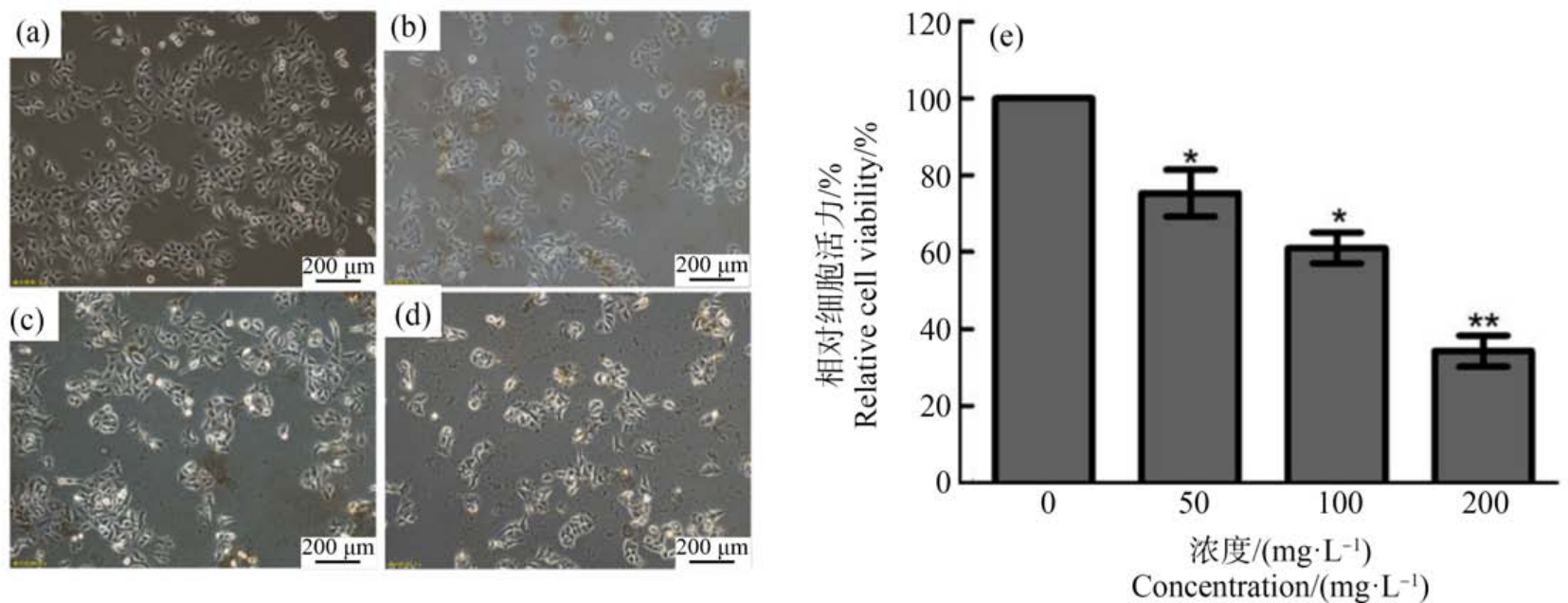
图2 GO 对细胞活性的影响
注:(a)~(d) 不同浓度 GO 处理对细胞形态的影响:(a)0 mg·L-1,(b)50 mg·L-1,(c)100 mg·L-1,(d)200 mg·L-1;*表示 P<0.05,**表示 P<0.01。
Fig.2 The effect of GO on cell activity
Note: (a)~(d) the effect of GO treatment at different concentrations on cell morphology, (a)0 mg·L-1, (b)50 mg·L-1,(c)100 mg·L-1, (d)200 mg·L-1; *represents P<0.05, **represents P<0.01.
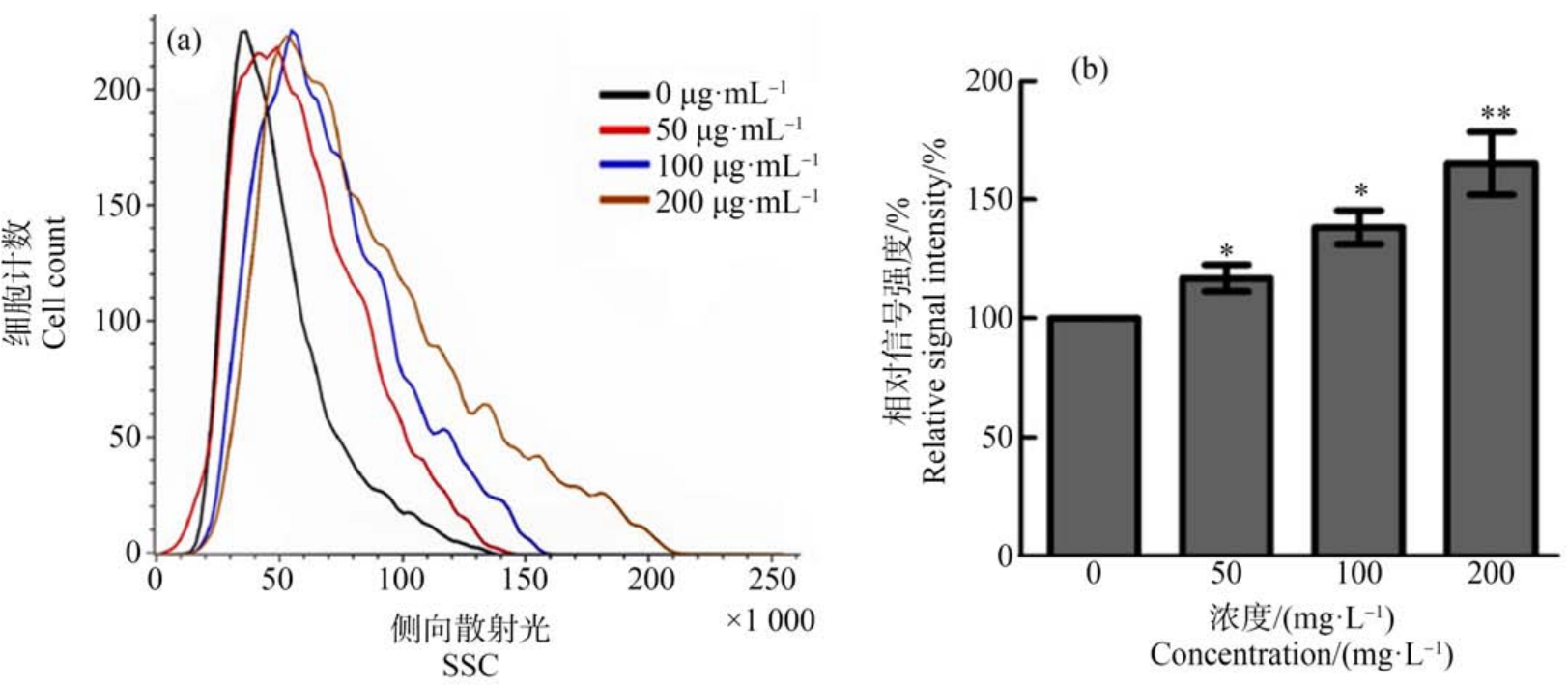
图3 流式细胞术检测细胞内吞GO 颗粒的量
注:(a) 不同浓度GO 处理后细胞的SSC 信号,(b) SSC 信号强度统计分析;*表示P<0.05,**表示P<0.01。
Fig.3 The endocytosis amount of GO particles was detected by flow cytometry
Note: (a) Side scatter (SSC) signal of the cells treated with different concentrations of GO, (b) Statistical analysis of relative SSC signal intensity;*represents P<0.05, **represents P<0.01.
2.3 GO 促进细胞内ROS 产生
ROS 是体内一类氧的单电子还原产物,广泛存在于生物体内[5]。 正常情况下,细胞内的ROS 主要由线粒体呼吸作用产生,ROS 浓度可以在胞内抗氧化系统调节下保持在正常的生理水平。 研究报道GO 对生物体的主要毒性机制之一是通过诱导生物体产生ROS,导致生物体遭受氧化损伤。 本研究使用流式细胞仪检测了不同浓度GO 处理24 h 后,细胞内的ROS 水平,如图4 所示,随着GO 的浓度递增细胞内ROS 逐渐增多。
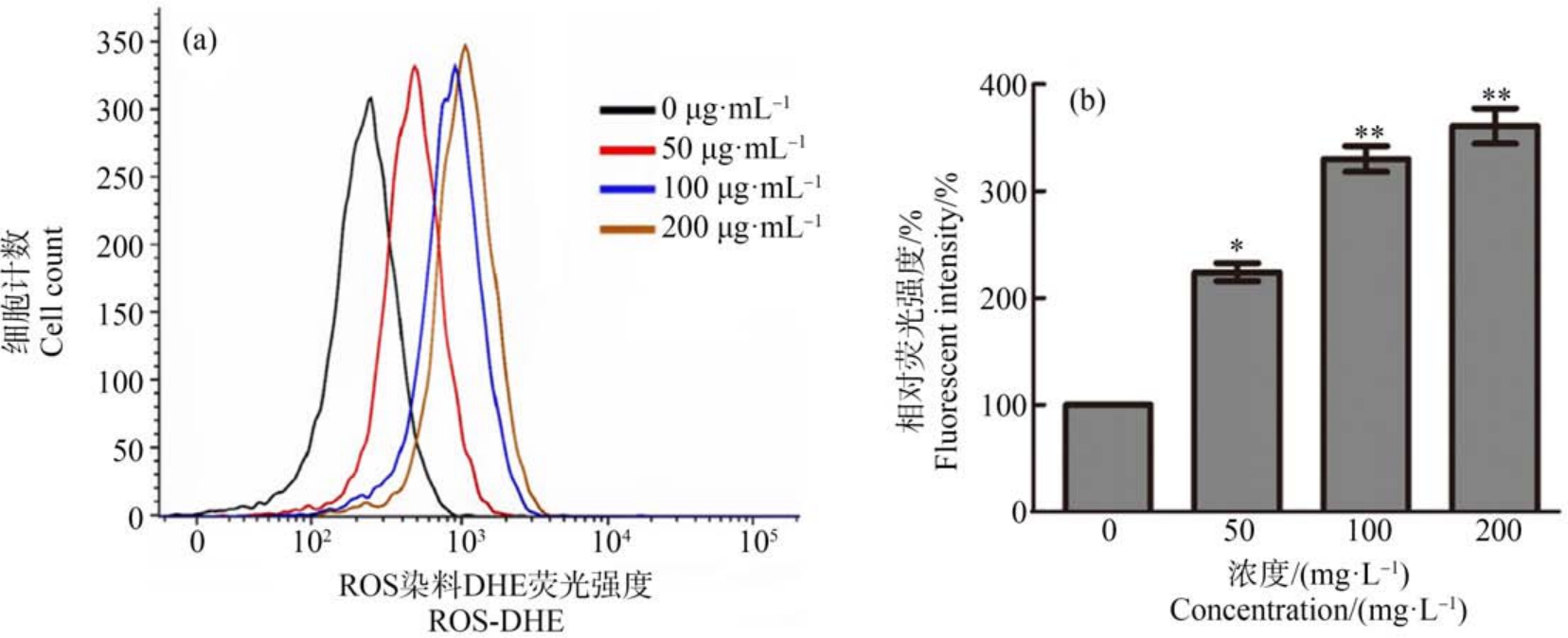
图4 不同浓度的GO 处理细胞后细胞内活性氧(ROS)的产生量
注:(a) 流式细胞仪检测不同浓度GO 处理后细胞内的ROS-DHE 荧光强度,(b) ROS-DHE 荧光强度统计分析;*表示P<0.05,**表示P<0.01。
Fig.4 The production of intracellular reactive oxygen species (ROS) in the cells treated with different concentrations of GO
Note: (a) ROS-DHE fluorescent intensity of the cells treated with different concentrations of GO, (b) Statistical analysis of ROS-DHE fluorescent intensity; *represents P<0.05, **represents P<0.01.
2.4 GO 引起细胞周期阻滞
GO 能够引起胞内 ROS 水平上升,而过多的ROS 会氧化细胞内生物大分子,破坏其正常分子结构,其中DNA 分子比较容易受到ROS 破坏,导致细胞增殖受到影响。 利用PI 染色技术和流式细胞仪检测GO 对BEAS-2B 细胞周期的影响,如图5 所示,在GO 处理24 h 后,对照组的 G2/M 期比例为(16.09±1.34)%,而各GO 处理组都在对照组的2 倍以上,且随着GO 浓度递增,阻滞在G2/M 期的细胞越多,提示GO 能够引起DNA 分子损伤,导致DNA不能正常复制,细胞不能正常分裂成2个细胞,引起有丝分裂异常。
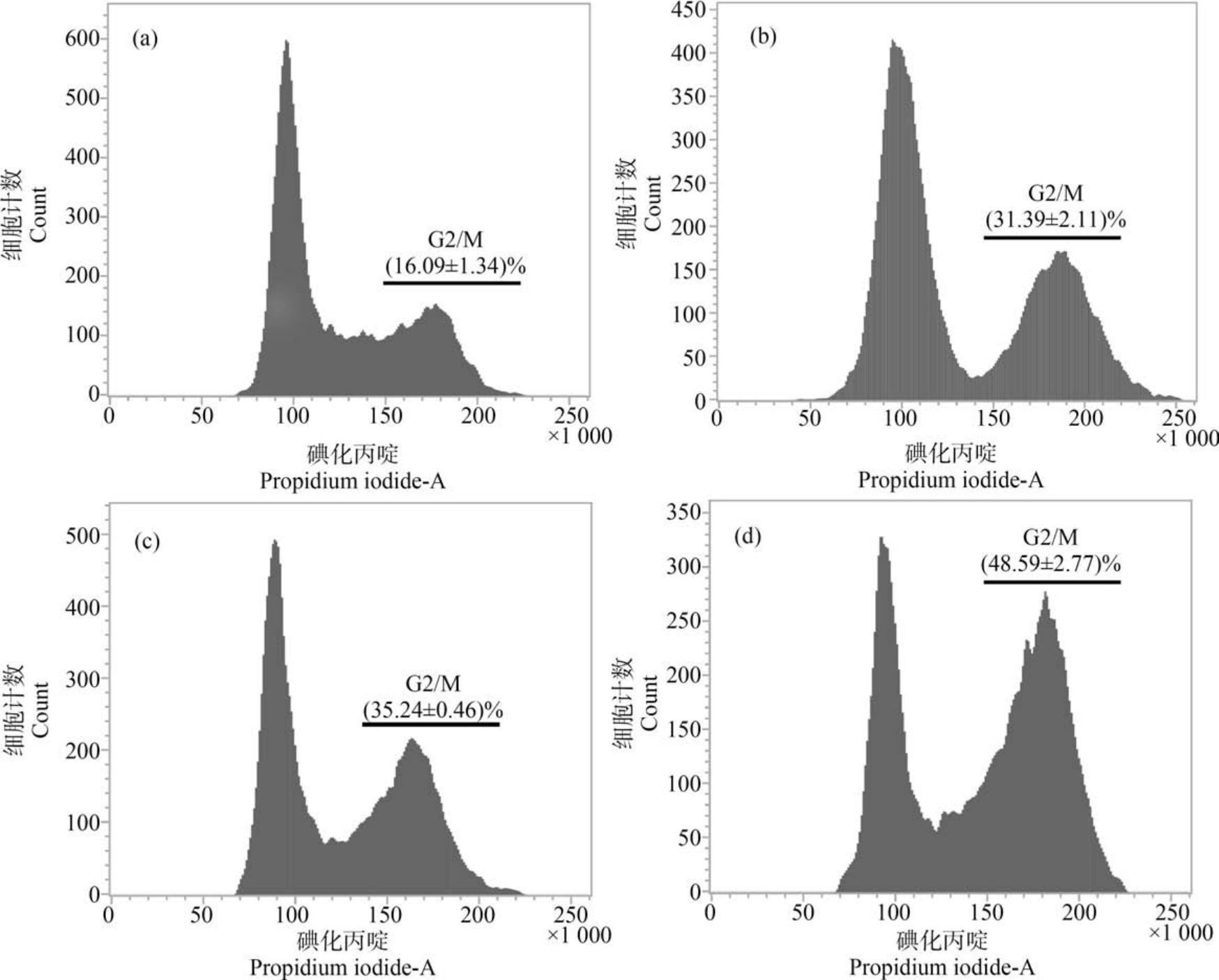
图5 不同浓度GO 对细胞周期的影响
注:(a)0 mg·L-1;(b)50 mg·L-1;(c)100 mg·L-1;(d)200 mg·L-1 。
Fig.5 Effects of different concentrations of GO on cell cycle
Note: (a)0 mg·L-1; (b)50 mg·L-1; (c)100 mg·L-1; (d)200 mg·L-1.
2.5 GO 引起细胞凋亡
当细胞周期不能正常进行时,细胞通常会启动程序性死亡。 因此,本研究检测了GO(100 mg·L-1)处理的 BEAS-2B 细胞凋亡情况,如图6 所示,取GO 处理后24 h 和48 h 这2个时间点,进行凋亡染色检测。 GO 加入24 h 后细胞出现明显的凋亡,其中早期凋亡细胞占14.07%,晚期凋亡细胞占15.07%,而到48 h,晚期凋亡占23.95%,说明细胞凋亡情况加重,凋亡率上升。 另外,细胞凋亡相关蛋白Caspase-3、Bcl-2、Bax、DNA 修复酶 PARP(poly ADP-ribose polymerase, PARP)的表达也受到GO 的影响。 如图7 所示,在细胞培养基中加入GO,培养24 h 和48 h后Caspase-3 明显被活化,48 h 的cleaved Caspase-3和cleaved PARP 急剧增多,表达量明显多于对照组。 另外,促凋亡蛋白 Bax 表达增多,而抑凋亡蛋白Bcl-2 的表达逐渐减少。 说明GO 进入细胞后,破坏了细胞生物大分子的结构,严重影响细胞的生理活动,从而激活细胞凋亡相关通路,上调了促凋亡蛋白,促进细胞凋亡。
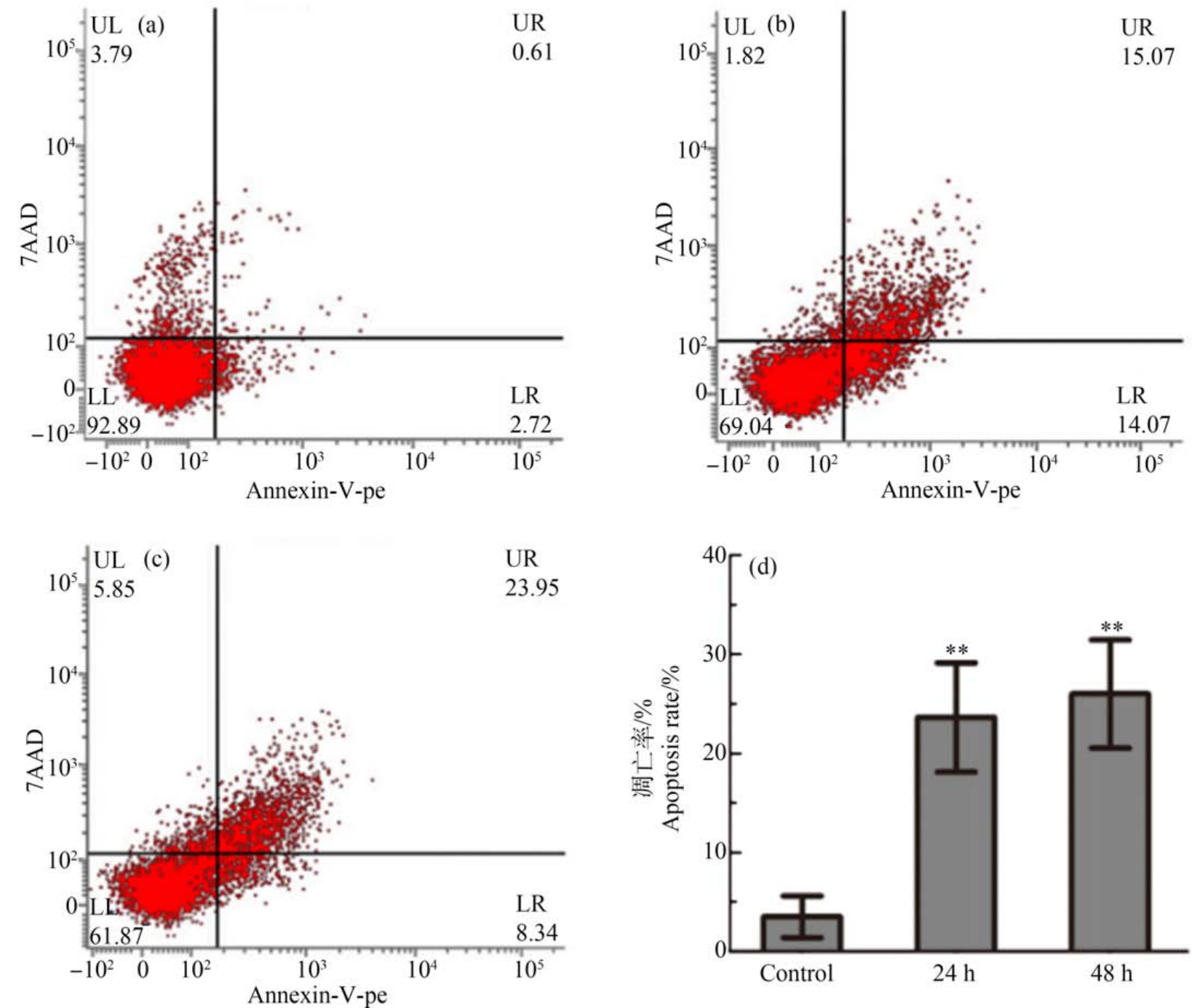
图6 GO(100 mg·L-1)对细胞凋亡的影响
注:(a) 未加GO 处理,(b) GO 处理24 h,(c) GO 处理48 h,(d) 细胞凋亡率统计分析;**表示P<0.01。
Fig.6 The effect of GO (100 mg·L-1) on apoptosis
Note: (a) Without GO treatment, (b) GO treatment for 24 h, (c) GO treatment for 48 h, (d) Statistical analysis of apoptosis rate; **represents P<0.01.
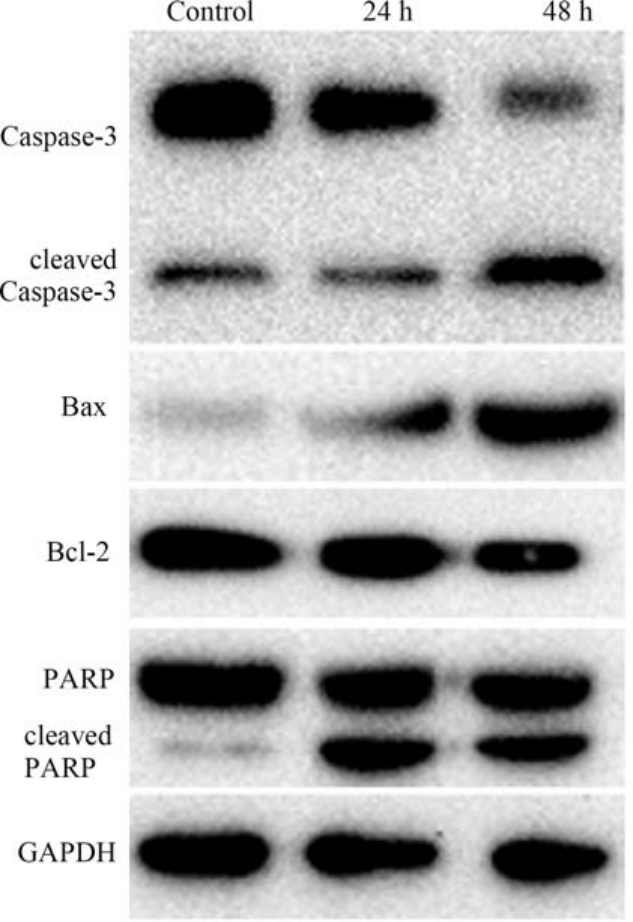
图7 GO(100 mg·L-1)对细胞凋亡相关蛋白表达的影响
Fig.7 Effects of GO (100 mg·L-1) on apoptosis proteins
3 讨论(Discussion)
氧化石墨烯作为石墨烯的氧化产物,由于其独特的物化性质而被广泛应用于众多行业,进入人们的日常生活环境中,对人类健康不可避免地产生一定的影响。 当GO 纳米颗粒以气溶胶的形式通过呼吸道进入人体后,破坏肺部正常结构,甚至进入血液循环对人体的免疫功能、心血管和中枢神经系统等产生危害,引起各种各样的疾病,还可能存在其他潜在和不可预测的风险。 目前,大量毒理研究发现GO可以进入生物体并引起一定的氧化损伤、细胞毒性、遗传毒性和发育毒性[6-10]。 但是,GO 引起细胞损伤的分子生物学机制还尚未完全阐明,有待进一步深入研究。 已有文献报道GO 的细胞毒性和胞内ROS水平升高有关[11-13]。 ROS 是细胞内正常代谢的产物,低浓度的ROS 具有有益的生理功能,其通过激活胞浆内的第二信使,参与细胞内的信号转导、细胞应答和细胞死亡等过程。 但是,当细胞内ROS 浓度过高时,可触发细胞内的氧化应激,直接作用于蛋白质、脂类和核酸,造成氧化损伤,引起癌症、糖尿病、心脑血管疾病、神经退行性疾病和衰老等[14]。 本研究通过流式细胞术检测发现,GO 处理BEAS-2B 细胞后,能够引起胞内ROS 显著增多,进而引起细胞周期阻滞,诱发细胞凋亡。 众所周知,ROS 可以氧化细胞脂质、蛋白质和DNA 分子,从而影响细胞信号传导和代谢。 另外,ROS 增加还可以引起线粒体膜去极化,促进Caspase 激活。 对凋亡通路中的相关蛋白进行检测,进一步验证细胞内吞GO 后激活了Caspase-3 介导的凋亡信号通路。 Caspase-3 可通过Fas 介导的死亡信号途径,降解凋亡抑制蛋白Bcl-2,促进促凋亡蛋白Bax 的表达,同时催化DNA修复酶PARP 的裂解,从而导致细胞凋亡[15-16],说明细胞凋亡是GO 的主要毒理效应。 因此,当GO 被人体吸入后,很可能对鼻黏膜、支气管上皮造成严重损伤,诱发呼吸道感染,导致不同程度的肺部疾病。随着石墨烯及其衍生物纳米材料的广泛引用,越来越多的含有GO 的固体废物被排放到环境中,其对人体的危害不容忽视,不仅要有严格的工业排放标准和有效的废物处理方法。 同时,要分析其对人和动物细胞毒理作用机制,在分子生物学水平上为疾病的治疗提供更直接、更有价值的理论依据。
[1]董发勤, 邵龙义, 冯晨旭, 等. 大气微纳米颗粒物界面反应与矿物协同演化意义[J]. 地球科学, 2018, 43(5):1709-1724
Dong F Q, Shao L Y, Feng C X, et al. Interfacial reaction of atmospheric micro/nano particles and significance of mineral coevolution [J].Earth Science,2018,43(5):1709-1724 (in Chinese)
[2]Kirsh V A, Kirsh A A, Yu M P. Diffusion deposition of nanoparticles in a layer of granule [J]. Colloid Journal,2020,82(6):681-688
[3]龙隆, 谭红, 张爱华, 等. 碳基纳米颗粒的吸入毒性研究进展[J]. 现代预防医学,2017,44(18):3305-3309
Long L, Tan H, Zhang A H, et al. Research progress on the inhalation toxicity of carbon-based nanoparticle [J].Modern Preventive Medicine, 2017, 44(18): 3305-3309(in Chinese)
[4]宋雅丽, 王林变, 高莉, 等. 氧化石墨烯抗菌性及生物安全性研究进展[J]. 生态毒理学报, 2020, 15(1): 109-118
Song Y L,Wang L B,Gao L,et al.Progress on antibacterial and biosafety research of graphene oxide [J]. Asian Journal of Ecotoxicology, 2020, 15(1): 109-118 (in Chinese)
[5]Mueller N C, Nowack B. Exposure modeling of engineered nanoparticles in the environment [J]. Environmental Science & Technology,2008,42(12):4447-4453
[6]Christian P, von der Kammer F, Baalousha M, et al.Nanoparticles:Structure,properties,preparation and behaviour in environmental media [J]. Ecotoxicology, 2008, 17(5):326-343
[7]Zhao J, Wang Z Y, White J C, et al. Graphene in the aquatic environment: Adsorption, dispersion, toxicity and transformation [J]. Environmental Science & Technology,2014,48(17):9995-10009
[8]Yang S S, Lian G J. Correction to: ROS and diseases:Role in metabolism and energy supply [J]. Molecular and Cellular Biochemistry,2020,467(1-2):13
[9]Tian X, Yang Z X, Duan G X, et al. Graphene oxide nanosheets retard cellular migration via disruption of actin cytoskeleton [J]. Small,2017,13(3):1602133
[10]韦慧, 吴超权, 夏星, 等. 氧化石墨烯遗传毒性的实验研究[J]. 生态毒理学报,2019,14(6):136-143
Wei H, Wu C Q, Xia X, et al.Studies on the genotoxicity of graphene oxide [J]. Asian Journal of Ecotoxicology,2019,14(6):136-143 (in Chinese)
[11]Begum P, Fugetsu B. Induction of cell death by graphene in Arabidopsis thaliana (Columbia ecotype) T87 cell suspension [J]. Journal of Hazardous Materials, 2013, 260:1032-1041
[12]Tang Z B, Zhao L, Yang Z X, et al. Mechanisms of oxidative stress, apoptosis, and autophagy involved in graphene oxide nanomaterial anti-osteosarcoma effect [J].International Journal of Nanomedicine,2018,13:2907-2919
[13]Liu Y Y,Han W L,Xu Z Z,et al.Comparative toxicity of pristine graphene oxide and its carboxyl, imidazole or polyethylene glycol functionalized products to Daphnia magna: A two generation study [J]. Environmental Pollution,2018,237:218-227
[14]Valko M, Leibfritz D, Moncol J, et al. Free radicals and antioxidants in normal physiological functions and human disease [J]. The International Journal of Biochemistry &Cell Biology,2007,39(1):44-84
[15]Oliveira C C, Paschoalini R B, Domingues M A C. Fasligand and caspase-3 positivity in three cases of histiocytic sarcoma: A different etiopathogenic pathway? [J]. Autopsy & Case Reports,2018,8(1): e2018001
[16]Yang H, Deng C G, Shen S G, et al. Expression and significance of Bcl-2, Bax, Fas and caspace-3 in different phases of human hemangioma [J]. Journal of Huazhong University of Science and Technology, 2006, 26(4): 402-404