在全球水资源短缺及水污染状况下,再生水回用是解决水资源供需矛盾的有前景的策略。 目前,再生水已经广泛用于工业冷却、城市街道清洗、城市绿化植被浇灌、景观水体补给及农业灌溉等。 多项研究表明,尽管废水处理技术正不断改善,但现有的污水处理设施并不能完全去除污水中的内分泌干扰化合物。 因此,再生水中存在多种微量内分泌干扰化合物,国内外很多污水处理厂排出的再生水中都相继检出辛基苯酚、壬基酚、双酚A 和邻苯二甲酸二丁酯等内分泌干扰化合物[1-3]。 Zhang 等[4]研究发现再生水中存在具有肝脏X 受体(liver X receptor α,LXRα)-激动剂/拮抗剂活性的内分泌干扰化合物。研究表明将再生水用于饮用水、农业灌溉和水产养殖影响了人类健康[5]。 为了维持野生生物生境,再生水回用于河湖溪流等景观水体以及湿地恢复对水体环境造成了影响[6]。 由于再生水中内分泌干扰化合物的存在,再生水回用于水体补给会对水体生物产生潜在健康危害。 但很少有研究关注再生水回用对水体生物产生的健康危害。
关于水体安全评价方法有传统的化学分析方法和生物毒性测试法[7],并且生物毒性测试法已成功应用于废水处理过程中毒性效应的去除研究中[8]。再生水中内分泌干扰化合物是多种、微量及混合存在的。 内分泌干扰化合物在微量时就能引起内分泌干扰效应,并且多种微量污染物共同存在时具有潜在的联合毒性作用[9]。 而传统的化学分析法只是测定再生水中内分泌干扰化合物的种类及浓度,不能对多种微量内分泌干扰化合物的联合毒性进行评价。 对再生水的水质评价不能只局限于传统的化学分析方法,采用生物毒性测试法评价再生水的安全性更加准确。 传统的水生态毒性测试主要是使用鱼类、水蚤和藻类作为测试物种,并对其传统指标如生长速率、繁殖和存活状况进行评估。 然而环境污染物在细胞、组织、个体、种群、群落甚至生态系统等不同水平上的毒害作用均始于污染物的分子作用效应,分子效应是生态毒理效应中最早期、最灵敏的效应。 基于分子毒理效应的生物毒性测试法已逐渐用于评价再生水的安全性。 如再生水对人胚肾细胞毒性研究显示,再生水在细胞水平上降低细胞增殖率、增加细胞损伤率并诱导了细胞凋亡,分子水平上影响了细胞周期调节蛋白(p16INK4a、p27Kip1、细胞依赖性激酶2 和4、细胞周期蛋白D1 和E)和凋亡相关调节蛋白(p-JNK、Bcl-2 和 caspase-3)的表达[10]。 再生水对摇蚊幼虫(Chironomus riparius)暴露21 d 显著影响了分子水平上内分泌相关基因和细胞应激基因卵黄蛋白原(vitellogenin, Vtg)、热应激蛋白(heat shock protein 70, hsp70)、热应激同源蛋白(heat-shock cognate protein 70, hsc70)的表达,而不改变个体水平指标如发育率、繁殖率和孵化率[11]。 再生水对蜗牛(Physa acuta)暴露21 d 降低了蜗牛的生殖力,而生殖力和内分泌相关核受体维甲酸X 受体(retinoid X receptor, RXR)相关[12]。 再生水诱导了雄性斑马鱼Vtg 的表达,干扰了斑马鱼体内睾酮(testosterone, T)和雌二醇(17α-estradiol, E2)的合成[2]。 因此再生水对水体生物具有生殖内分泌干扰毒性,但具体的分子机制还需要进一步研究。
斑马鱼作为模式生物已经广泛应用于环境毒理学领域研究中。 斑马鱼与人类具有高度相似的基因及生理学特征,斑马鱼与人类的内分泌系统相似,因此,关于环境污染物对斑马鱼的毒理研究结果可以类推到对人类的影响上。 近十几年来,斑马鱼广泛应用于研究环境污染物的内分泌干扰及生殖毒性效应[13-14]。 因此,为了评价再生水的内分泌干扰效应分子机制,本研究选择斑马鱼作为测试物种,研究结果对分析再生水对人类健康的影响具有一定的意义。 鱼类的生殖受到下丘脑-垂体-性腺(hypothalamus-pituitary-gonadal, HPG)轴的调控[15],即下丘脑分泌促性腺激素释放激素(gonadotropin-releasing hormone, Gnrh),促进脑垂体分泌促卵泡素(follicle stimulating hormone, Fsh)和促黄体生成素(luteinizing hormone, Lh)。 Fsh 和 Lh 释放后迅速进入鱼类血液循环系统,与对应的受体促卵泡素受体(follicle stimulating hormone receptor, Fshr)和促黄体生成素受体(luteinizing hormone receptor, Lhr)识别并结合,然后以复合体的方式进入性腺(精巢或卵巢),调控下游类固醇激素合成通路相关基因表达,进一步调控性腺分泌T 和E2 以及配子的生长发育。 斑马鱼内分泌系统HPG 轴已经被广泛用于水体环境生态毒理研究中,用于评价生殖内分泌干扰效应并揭示潜在分子机制[16-17]。 如 Maharajan 等[17]采用斑马鱼HPG 轴研究了吡咯氧芬可通过改变HPG 轴基因表达,引起斑马鱼生殖内分泌稳态和性腺组织病理学的损害。 一些研究学者采用斑马鱼HPG 轴研究了铜引起斑马鱼生殖内分泌干扰的分子机制[18]。 所以本研究选用斑马鱼HPG 轴相关基因转录水平分析再生水对水体生物的内分泌干扰分子毒理效应。
本研究以贵阳市某再生水厂出水为研究对象,利用模式生物斑马鱼作为生物检测材料,将成年健康的雌性和雄性斑马鱼直接暴露于再生水中7 d,为了分析斑马鱼在再生水中是否会产生适应或修复机制,暴露时间又延长7 d(14 d),采用荧光定量多聚酶链式反应(polymerase chain reaction, PCR)技术分析再生水对斑马鱼HPG 轴相关基因表达的影响,研究再生水对成年斑马鱼的内分泌干扰分子效应,即分析斑马鱼脑受体信号途径基因,包括雄激素受体(androgen receptor, Ar)和雌激素受体1(estrogen receptor 1, Esr1);下丘脑和垂体激素相关基因,包括促性腺激素释放激素(gonadotropin-releasing hormone 2, Gnrh2)、促性腺激素释放激素(gonadotropin-releasing hormone 3, Gnrh3)、卵泡刺激素 β 多肽(follicle stimulating hormone beta polypeptide, Fshb)和黄体生成素 β 多肽(luteinizing hormone beta polypeptide,Lhb);性腺类固醇途径相关基因,包括Ar、Esr1、孕激素受体(progesterone receptor, pgr)、类固醇源性急性调节蛋白(steroidogenic acute regulatory, star)、细胞色素P450 介导的侧链裂解酶(cytochrome P450-mediated side-chain cleavage enzyme, cyp11a1)、11β-羟化酶(11β-hydroxylase, cyp11b)、细胞色素 P450 芳香化酶 17(c17α-hydroxylase/17-20 lyase, cyp17)、卵巢芳香化酶 ( ovarian cytochrome P450 aromatase,cyp19ala)、3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase, hsd3b)、11β-羟化类固醇脱氢酶 2(11β-hydroxysteroid dehydrogenase 2, hsd11b2)、17β-羟化类固醇脱氢酶3(17β-hydroxysteroid dehydrogenase type 3, hsd17b3)和 20β-羟化类固醇脱氢酶(20β-hydroxysteroid dehydrogenase, hsd20b),通过分析再生水对以上HPG 轴相关基因表达水平的影响,对再生水的生态影响做出预测或早期警报,提示是否有生态风险发生的可能。
1 材料与方法(Materials and methods)
1.1 实验材料
实验组再生水采自贵阳市某再生水厂再生水工艺出水,再生水系统采用“超滤膜+反渗透”双膜法处理工艺将二级工艺出水进行深度处理后得到再生水,再生水主要回用于公园水体及河道补给。 再生水取样后立即运输到实验室进行斑马鱼暴露实验。空白对照组水样为充分曝气脱氯后的自来水。
野生型斑马鱼购自上海费曦生物科技有限公司,饲养于人工气候箱中,温度为(28±0.5) ℃,饲养用水为充分曝气脱氯后的自来水,每天定时喂以饲料2 次,饲料为Zeigler AP100 成鱼专用饲料。 暴露实验开展前驯化培养1 周,每日换水,筛选健康活泼的斑马鱼进行后续实验。
1.2 仪器与试剂
仪器:SW-CJ-1FD 超净工作台(上海博迅,中国);Microfuge 20R 台式(常温/低温)离心机(美国贝克曼库尔特公司);NanoDrop 2000C 超微量分光光度计(美国赛默飞世尔科技公司);T100TM Thermal Cycler 梯度 PCR 仪(美国 BIO-RAD 公司),CFX96TM Real Time System 实时定量 PCR 仪(美国 BIO-RAD公司);超纯净水系统(中国艾柯AKDL-Ⅱ定量分析型超纯水机)。
试剂:RNA 提取试剂盒(宝生物工程(大连)有限公司,中国);反转录试剂盒(EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix,北京全式金生物技术有限公司,中国);PerfectStartTM Green qPCR SuperMix 试剂盒(北京全式金生物技术有限公司,中国)。
1.3 再生水对斑马鱼的暴露试验
将斑马鱼分别静态暴露于充分脱氯自来水(对照组,C 组)和再生水(实验组,RW)中,每个处理设置3个重复。 每个重复组含有30 尾斑马鱼,雌雄比为1∶1,饲养于人工气候箱中,温度为(28±0.5) ℃,每天光照 ∶黑暗时间为14 h ∶10 h,每天定时喂以饲料2次,暴露液每天更换一次,记录斑马鱼死亡数量并及时清除死鱼(斑马鱼无任何反应即确认死亡),分别暴露7 d 和14 d,预实验结果显示暴露7 d 对HPG轴基因转录水平有影响,为了分析延长再生水暴露时间后,斑马鱼是否会在分子水平产生适应或修复机制,所以又延长暴露7 d (14 d),在暴露期间,每天记录鱼的死亡率。 分别暴露7 d 和14 d 后,随机取鱼置于冰上麻醉后测量鱼的全长(total body length,Tbl)和湿质量(wet weight, ww),并计算生长状况因子(condition factor, K)。
式中:wt 为鱼的湿质量(g),Tbl 为鱼的全长(cm)。
解剖分离脑、精巢和卵巢称量并存于-80 ℃备用,用于组织RNA 的提取和实时定量 PCR(qRTPCR)检测,并计算脑指数(brain-somatic index, BSI)和性腺指数(gonadosomatic index, GSI)。
式中:wt 为鱼的湿质量(g),bw 为鱼的脑质量(brain weight, bw),单位为g。
式中:gw 为鱼的性腺质量(gonad weight, gw),单位为g。
1.4 RT-PCR
取斑马鱼脑、精巢和卵巢组织分别倒入盛有液氮的研钵中,用一次性研磨棒充分研成粉末,参照RNA 提取试剂盒说明书提取各组织的总RNA,并取RNA 进行凝胶电泳检测和核酸浓度仪检测。 按照实际和说明书操作,以RNA 为模板将RNA 反转录成cDNA 链。 采用实时定量PCR 技术检测斑马鱼HPG 轴相关基因的相对表达量。 用于荧光定量PCR 的引物序列参考前人研究[19],如表1 所示。 反应体系为 20 μL:GoTaq® qPCR Master Mix 10 μL、cDNA 模板 1 μL、Nuclease-free Water 7 μL 和上下游引物各1 μL。 反应在 CFX96TM Real-Time System 实时定量PCR 仪中进行,反应条件为:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;最后在60 ~95 ℃进行熔解曲线分析。 选择表达相对稳定的β-actin 作为内参基因,利用2-△△CT 方法计算基因的相对表达量[20]。
表1 用于实时荧光定量PCR 分析的引物序列
Table 1 Primers used in the real-time quantitative PCR analysis
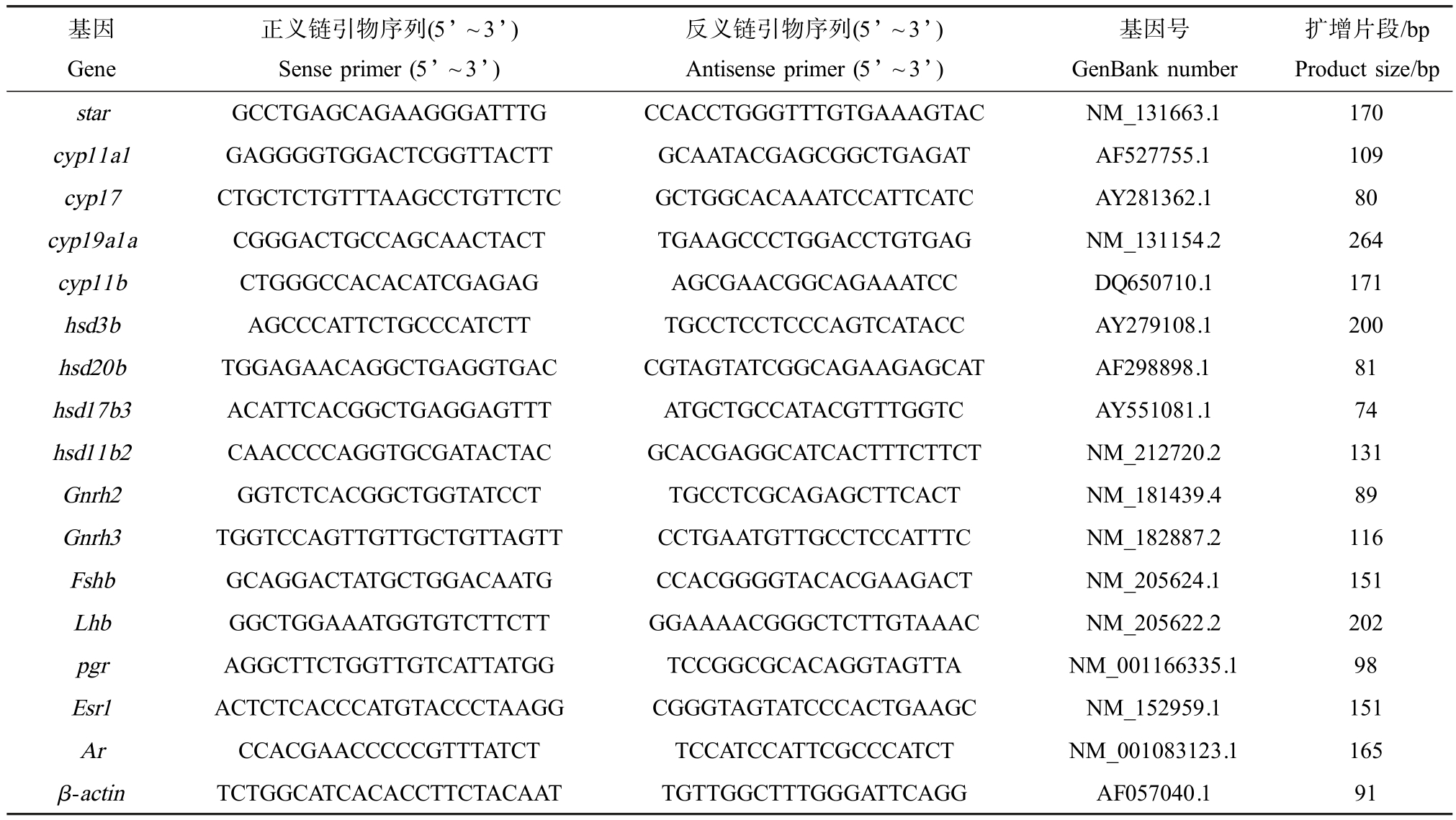
基因Gene正义链引物序列(5’ ~3’)Sense primer (5’ ~3’)反义链引物序列(5’ ~3’)Antisense primer (5’ ~3’)基因号GenBank number扩增片段/bp Product size/bp star GCCTGAGCAGAAGGGATTTG CCACCTGGGTTTGTGAAAGTAC NM_131663.1 170 cyp11a1 GAGGGGTGGACTCGGTTACTT GCAATACGAGCGGCTGAGAT AF527755.1 109 cyp17 CTGCTCTGTTTAAGCCTGTTCTC GCTGGCACAAATCCATTCATC AY281362.1 80 cyp19a1a CGGGACTGCCAGCAACTACT TGAAGCCCTGGACCTGTGAG NM_131154.2 264 cyp11b CTGGGCCACACATCGAGAG AGCGAACGGCAGAAATCC DQ650710.1 171 hsd3b AGCCCATTCTGCCCATCTT TGCCTCCTCCCAGTCATACC AY279108.1 200 hsd20b TGGAGAACAGGCTGAGGTGAC CGTAGTATCGGCAGAAGAGCAT AF298898.1 81 hsd17b3 ACATTCACGGCTGAGGAGTTT ATGCTGCCATACGTTTGGTC AY551081.1 74 hsd11b2 CAACCCCAGGTGCGATACTAC GCACGAGGCATCACTTTCTTCT NM_212720.2 131 Gnrh2 GGTCTCACGGCTGGTATCCT TGCCTCGCAGAGCTTCACT NM_181439.4 89 Gnrh3 TGGTCCAGTTGTTGCTGTTAGTT CCTGAATGTTGCCTCCATTTC NM_182887.2 116 Fshb GCAGGACTATGCTGGACAATG CCACGGGGTACACGAAGACT NM_205624.1 151 Lhb GGCTGGAAATGGTGTCTTCTT GGAAAACGGGCTCTTGTAAAC NM_205622.2 202 pgr AGGCTTCTGGTTGTCATTATGG TCCGGCGCACAGGTAGTTA NM_001166335.1 98 Esr1 ACTCTCACCCATGTACCCTAAGG CGGGTAGTATCCCACTGAAGC NM_152959.1 151 Ar CCACGAACCCCCGTTTATCT TCCATCCATTCGCCCATCT NM_001083123.1 165 β-actin TCTGGCATCACACCTTCTACAAT TGTTGGCTTTGGGATTCAGG AF057040.1 91
1.5 数据统计分析
所有的数据结果均表示为平均值±标准误差(Mean±SEM)。 实验结果中所有图片均用软件SigmaPlot 10.0 绘制。 采用SPSS16.0 软件进行均值比较及 t 检验。 P<0.05、P<0.01 时差异显著。
2 结果(Results)
2.1 再生水对斑马鱼生长发育参数的影响
在7 d 和14 d 的暴露期间,所有处理组的实验鱼均没有死亡。 再生水处理对斑马鱼体长、体质量、生长状况因子、脑指数及性腺指数的影响如表2 所示。 由表2 可知,再生水对斑马鱼暴露14 d 对生长发育参数如体长、体质量、生长状况指数、脑指数及性腺指数无显著影响,再生水处理降低了雄性斑马鱼的脑指数和性腺指数,但不显著(P>0.05)。 类似地,再生水也降低了雌性斑马鱼的性腺指数,但没有显著性(P>0.05)。
表2 再生水对斑马鱼生长发育参数及器官指数的影响
Table 2 Effects of reclaimed water on the growth and development parameters and organ index of zebrafish
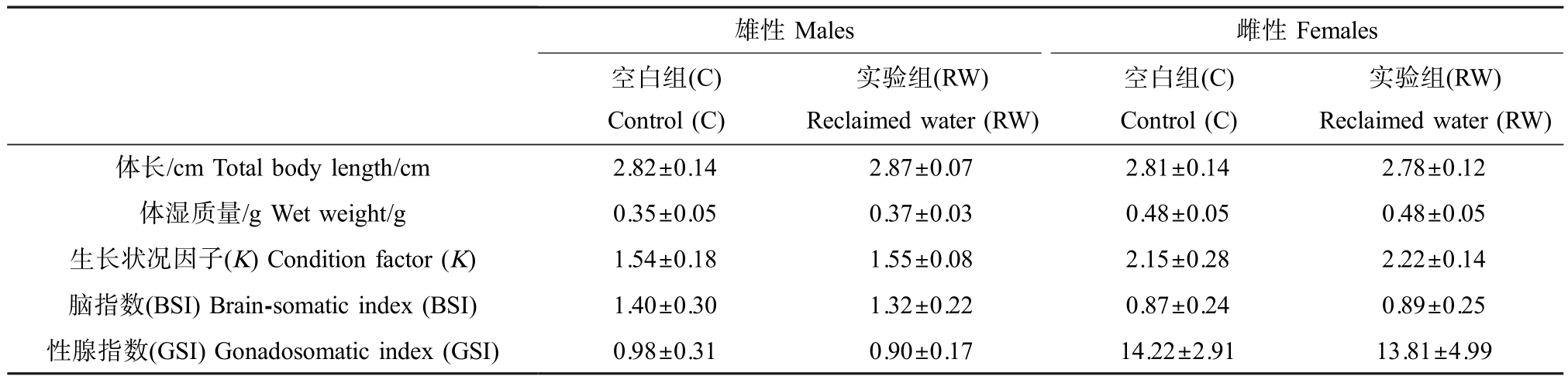
注:结果以 Mean±SEM 表示(n=3)。
Note: Results are expressed as Mean±SEM (n=3).
雄性Males 雌性Females空白组(C)Control (C)实验组(RW)Reclaimed water (RW)空白组(C)Control (C)实验组(RW)Reclaimed water (RW)体长/cm Total body length/cm 2.82±0.14 2.87±0.07 2.81±0.14 2.78±0.12体湿质量/g Wet weight/g 0.35±0.05 0.37±0.03 0.48±0.05 0.48±0.05生长状况因子(K) Condition factor (K) 1.54±0.18 1.55±0.08 2.15±0.28 2.22±0.14脑指数(BSI) Brain-somatic index (BSI) 1.40±0.30 1.32±0.22 0.87±0.24 0.89±0.25性腺指数(GSI) Gonadosomatic index (GSI) 0.98±0.31 0.90±0.17 14.22±2.91 13.81±4.99
2.2 再生水暴露7 d 对斑马鱼HPG 轴相关基因转录水平的影响
再生水对斑马鱼暴露7 d 后受体信号途径、下丘脑和垂体激素相关基因的转录水平变化如图1 所示。 由图1 可知,再生水对斑马鱼暴露7 d 后,成年雄性斑马鱼脑雄激素受体Ar、Fshb、Lhb 和Gnrh2 基因的转录水平显著降低(P<0.05),成年雄性斑马鱼脑Esr1 和Gnrh3 基因的转录水平显著下降(P<0.01);与雄性斑马鱼不同,再生水对雌性斑马鱼脑Ar、Esr1、Fshb、Lhb 和 Gnrh2 表达水平无显著影响(P>0.05),再生水显著上调了脑Gnrh3 转录水平(P <0.01)。 图2 和图3 展示了斑马鱼暴露于再生水7 d后斑马鱼性腺类固醇途径相关基因转录水平变化。由图2 和图3 可知,再生水对斑马鱼暴露7 d 后,成年雄性斑马鱼睾丸受体信号途径Ar 基因的转录水平显著减少(P<0.05),雄性斑马鱼睾丸Esr1 基因的转录水平显著降低(P<0.01),雄性斑马鱼睾丸类固醇途径相关基因 cyp19ala、hsd3b、hsd17b3 和 hsd20b转录水平显著减少(P<0.01),雄性斑马鱼睾丸pgr、star、cyp11a1、cyp11b、cyp17 和 hsd11b2 基因的转录水平无显著改变。 与雄性斑马鱼不同,再生水对雌性斑马鱼暴露7 d 显著上调了卵巢Esr1 和cyp11b转录水平(P<0.05)。 再生水对雌性斑马鱼暴露7 d对 卵 巢 Ar、 pgr、 star、 cyp11a1、 cyp17、 cyp19a1a、hsd3b、hsd11b2、hsd17b3 和 hsd20b 转录水平无显著影响(P>0.05)。
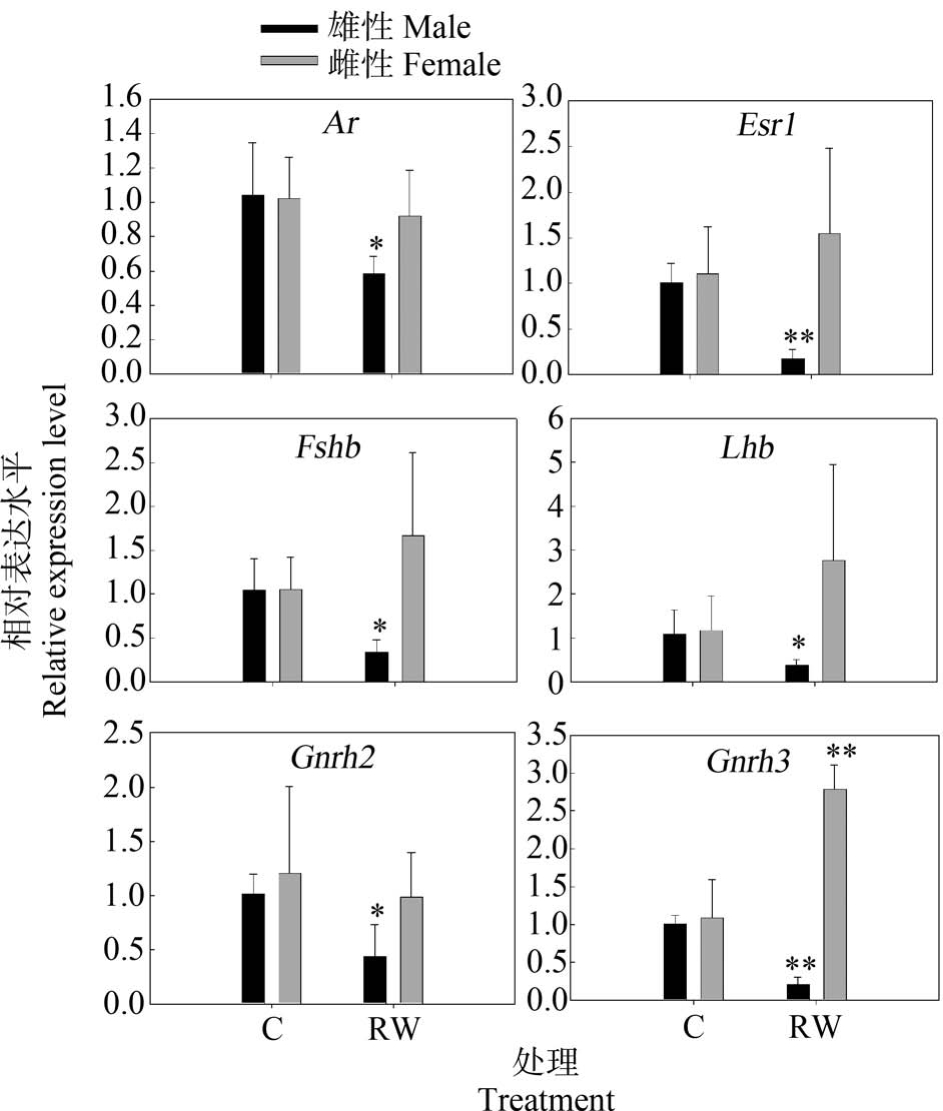
图1 再生水处理7 d 对斑马鱼脑受体信号途径、下丘脑和垂体激素相关基因转录水平的影响
注:结果以 Mean±SEM 表示(n=3);*P<0.05、**P<0.01 表示处理组与对照组有显著差异。
Fig.1 Transcriptional profiles of target genes related to the receptor signaling pathways, hypothalamic and pituitary hormones after exposure to reclaimed water for 7 d
Note: Results are expressed as Mean±SEM (n=3); *P<0.05,**P<0.01 indicate significant differences between the exposure group and the control.
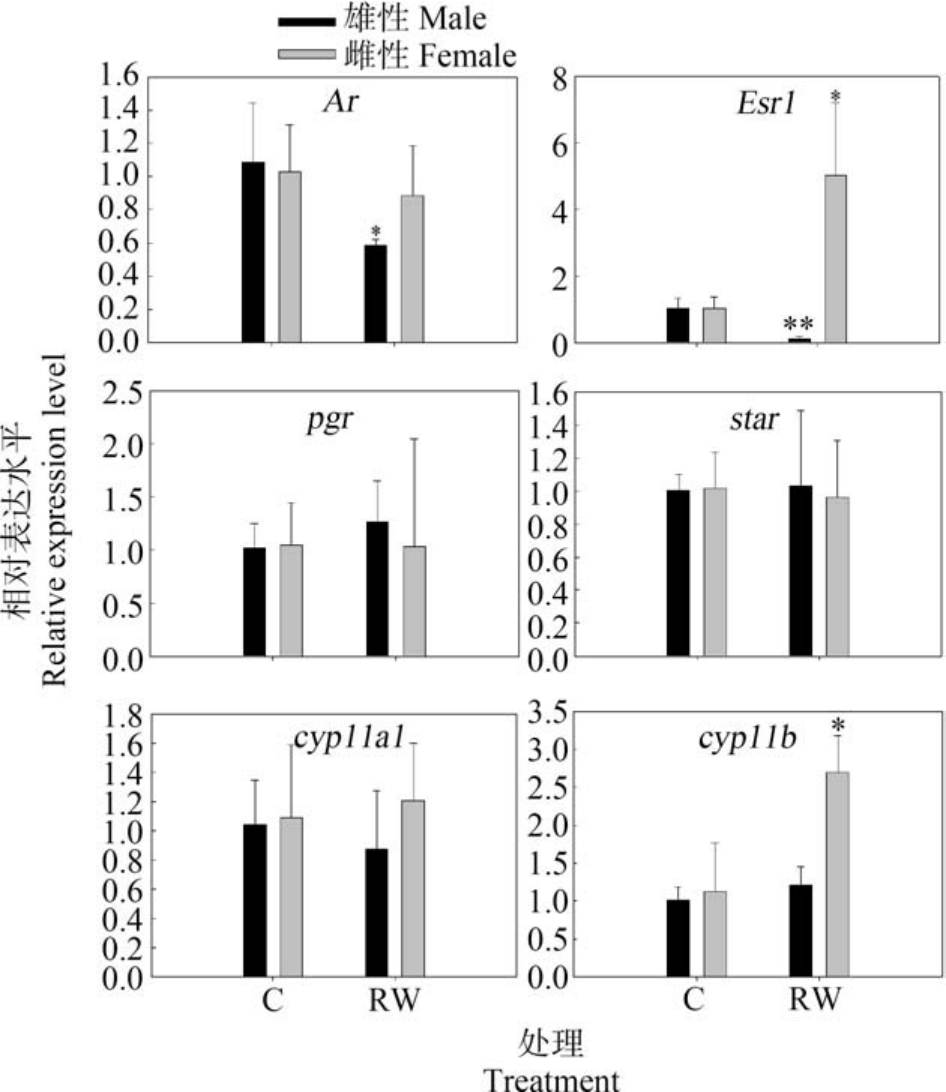
图2 再生水处理7 d 对斑马鱼性腺受体信号和类固醇途径相关基因转录水平的影响
注:结果以 Mean±SEM 表示(n=3);*P<0.05、**P<0.01 表示处理组与对照组有显著差异。
Fig.2 Transcriptional profiles of target genes related to the receptor signaling and steroidogenic pathways after exposure to reclaimed water for 7 d
Note: Results are expressed as Mean±SEM (n=3);*P<0.05, **P<0.01 indicate significant differences between the exposure group and the control.
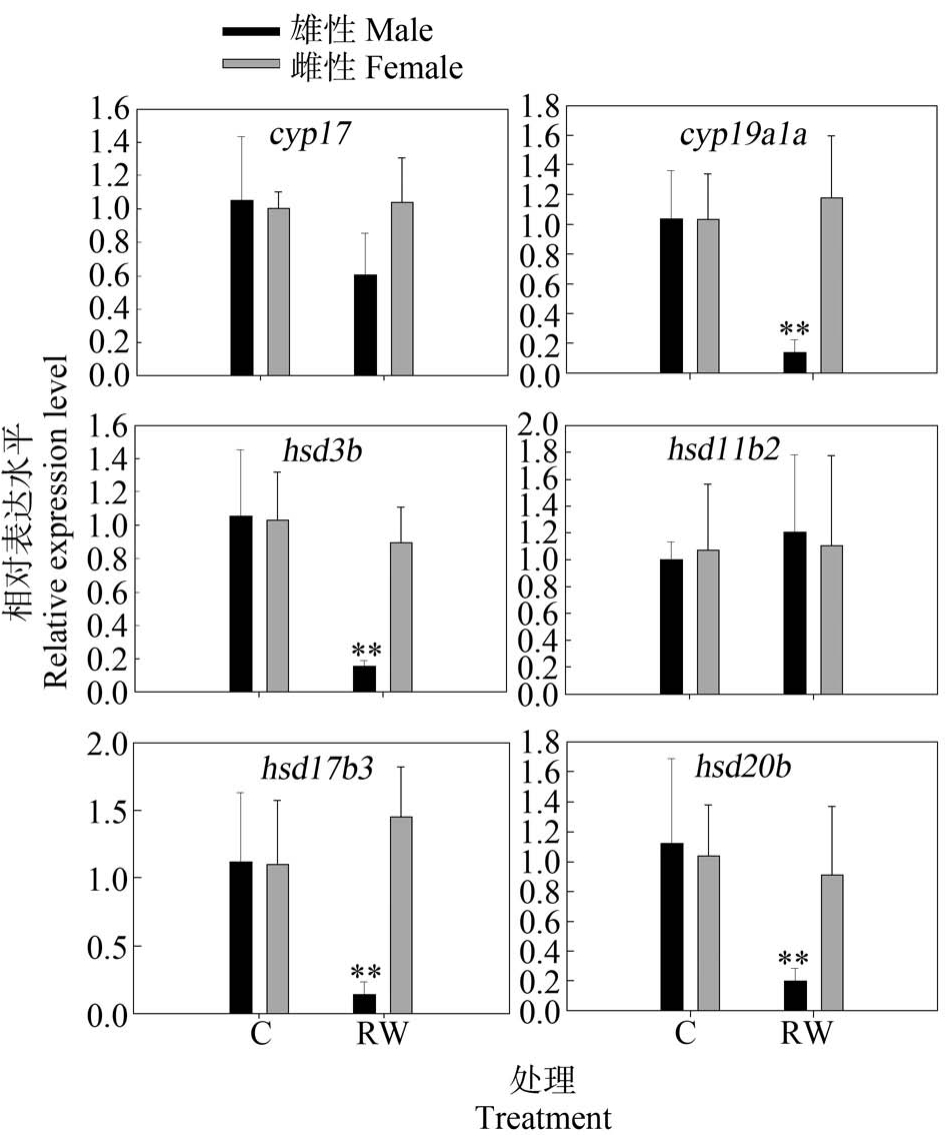
图3 再生水处理7 d 对斑马鱼性腺类固醇途径相关基因转录水平的影响
注:结果以 Mean±SEM 表示(n=3);**P<0.01 表示处理组与对照组有显著差异。
Fig.3 Transcriptional profiles of target genes related to the steroidogenic pathways after exposure to reclaimed water for 7 d
Note: Results are expressed as Mean±SEM (n=3); **P<0.01 indicate significant differences between the exposure group and the control.
2.3 再生水暴露14 d 对斑马鱼HPG 轴相关基因转录水平的影响
图4 展示了再生水处理14 d 后,受体信号途径、下丘脑和垂体激素相关基因的转录水平变化。 由图4 可知,再生水对斑马鱼暴露14 d 后,成年雄性斑马鱼脑Esr1、Fshb 和Lhb 基因的转录水平显著降低(P<0.05),成年雄性斑马鱼脑 Ar、Gnrh2 和 Gnrh3基因的转录水平无显著改变(P>0.05)。 与雄性斑马鱼类似,再生水对雌性斑马鱼暴露14 d 显著下调了脑Fshb 的转录水平(P<0.05),雌性斑马鱼脑Gnrh3的转录水平显著减少(P<0.01)。 再生水对雌性斑马鱼暴露 14 d 对斑马鱼脑 Ar、Esr1、Lhb 和 Gnrh2 转录水平无显著影响(P>0.05)。 再生水暴露14 d 后,斑马鱼性腺受体信号和类固醇途径相关基因转录水平变化如图5 和图6 所示。 由图5 和图6 可知,再生水对斑马鱼暴露14 d 后,成年雄性斑马鱼睾丸受体信号途径雄激素受体Ar 和雌激素受体Esr1 基因的转录水平显著降低(P<0.05),成年雄性斑马鱼睾丸类固醇途径急性调节蛋白star 基因的转录水平显著减少(P<0.05),雄性斑马鱼睾丸 cyp19a1a、hsd11b2和hsd17b3 基因转录水平显著下调(P<0.05),雄性斑马鱼睾丸hsd20b 基因转录水平显著下调(P<0.01),再生水对斑马鱼暴露14 d 对雄性斑马鱼睾丸pgr、cyp11a1、cyp17、hsd3b 和 cyp11b 基因的转录水平无显著影响。 与雄性斑马鱼不同,再生水对雌性斑马鱼暴露 14 d 显著上调了卵巢 Esr1、pgr、cyp19a1a、hsd3b、hsd17b3 和 star 基因转录水平(P<0.05),对卵巢 Ar、cyp11a1、cyp17、hsd11b2、hsd20b 和 cyp11b 基因转录水平无显著影响(P>0.05)。
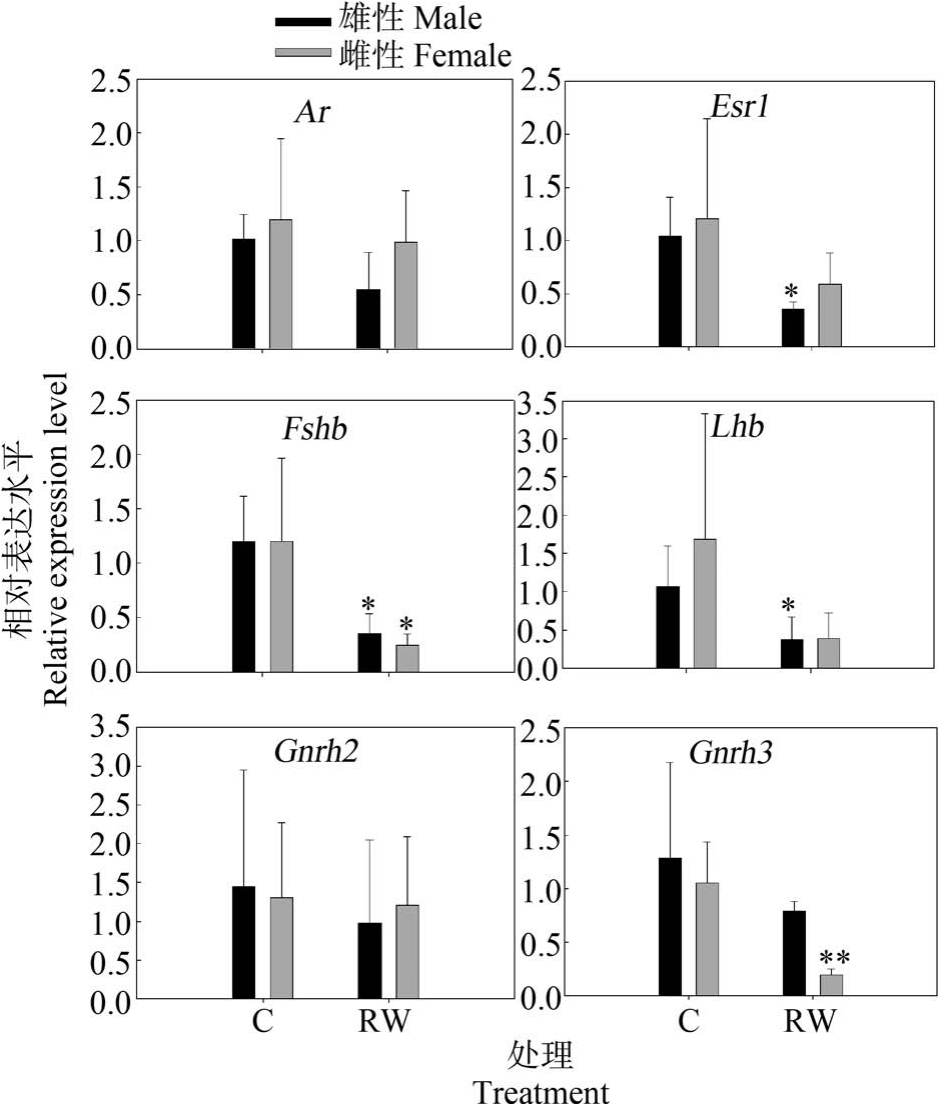
图4 再生水处理14 d 对斑马鱼脑受体信号途径、下丘脑和垂体激素相关基因转录水平的影响
注:结果以 Mean±SEM 表示(n=3);*P<0.05、**P<0.01 表示处理组与对照组有显著差异。
Fig.4 Transcriptional profiles of target genes related to the receptor signaling pathways, hypothalamic and pituitary hormones after exposure to reclaimed water for 14 d
Note: Results are expressed as Mean±SEM (n=3);*P<0.05, **P<0.01 indicate significant differences between the exposure group and the control.
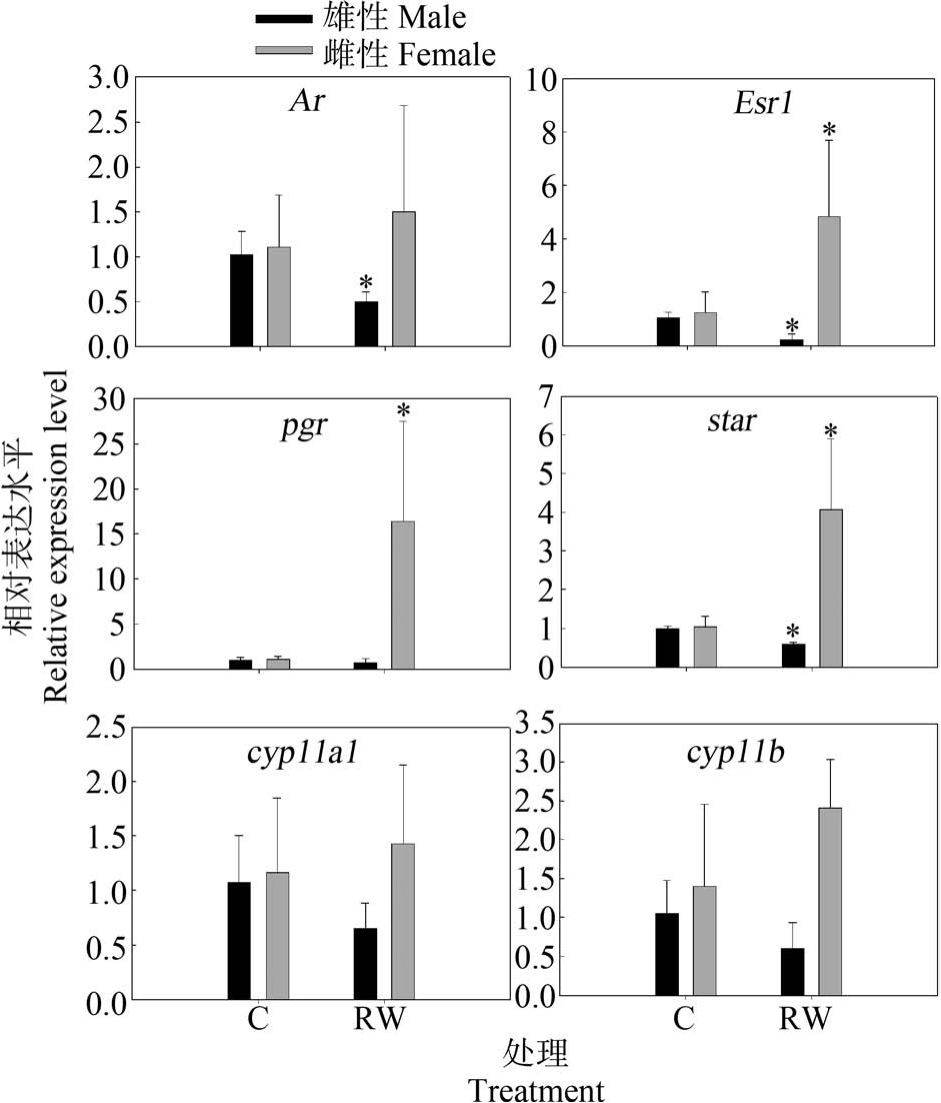
图5 再生水处理14 d 对斑马鱼性腺受体信号和类固醇途径相关基因转录水平的影响
注:结果以 Mean±SEM 表示(n=3);*P<0.05 表示处理组与对照组有显著差异。
Fig.5 Transcriptional profiles of target genes related to the receptor signaling and the steroidogenic pathways after exposure to reclaimed water for 14 d
Note: Results are expressed as Mean±SEM (n=3); *P<0.05 indicate significant differences between the exposure group and the control.
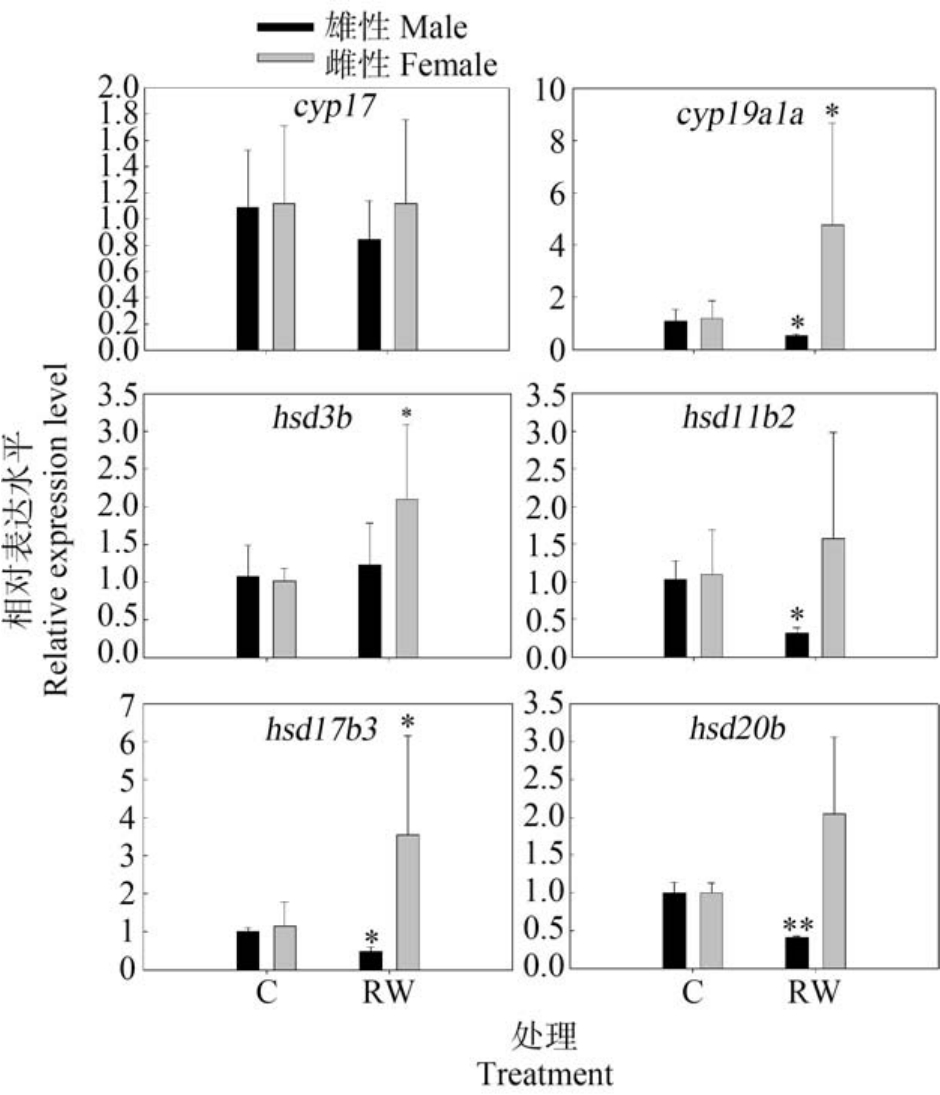
图6 再生水处理14 d 对斑马鱼性腺类固醇途径相关基因转录水平的影响
注:结果以 Mean±SEM 表示(n=3);*P<0.05、**P<0.01 表示处理组与对照组有显著差异。
Fig.6 Transcriptional profiles of target genes related to the steroidogenic pathways after exposure to reclaimed water for 14 d
Note: Results are expressed as Mean±SEM (n=3);*P<0.05, **P<0.01 indicate significant differences between the exposure group and the control.
3 讨论(Discussion)
再生水暴露对斑马鱼没有致死效应,并对生长发育参数如体长、体质量、生长状况因子、脑指数和性腺指数无显著影响,说明再生水暴露还没有产生个体水平的毒理效应。 为了准确分析再生水对水生生物的潜在危害,本研究选择早期灵敏的分子水平进行分析。 类似地,再生水对溪流摇蚊(Chironomus riparius)个体水平如发育率、繁殖率和孵化率无显著影响,对分子水平如内分泌和应激相关基因(Vtg、hsp70、hsc70)表达水平具有显著影响[11]。 马拉硫磷和氯氰菊酯对雄性斑马鱼肝指数和性腺指数等个体水平指标无显著影响,但却在分子水平干扰了HPG轴基因转录水平和激素平衡[21]。
为探究再生水对成年斑马鱼毒性效应的分子机制,本研究利用qRT-PCR 技术对成年斑马鱼HPG轴,即脑受体信号途径、下丘脑和垂体激素以及性腺受体信号和类固醇途径相关基因的转录水平进行分析。 HPG 轴相关基因转录水平被广泛用作内分泌干扰物引起激素改变的分子生物标志物。 雌激素化合物结合HPG 轴相关雌激素受体(ER)通过调节类固醇激素生物合成从而干扰生物生殖功能[22]。 本研究发现了再生水能够调节与HPG 轴相关基因的转录水平,从而可能影响斑马鱼体内雄激素和雌激素的合成,进而干预斑马鱼的生殖能力。 然而,再生水对雌鱼和雄鱼中的基因的调节模式是不相同的。
3.1 再生水对斑马鱼脑受体信号途径、下丘脑和垂体激素相关基因转录水平的影响
在HPG 轴中,雌激素受体在性发育的神经内分泌调节中起主要作用,雌激素或抗雌激素与雌激素受体直接结合以配体依赖的方式控制雌激素受体。Ar 属于核激素受体超家族与雄激素结合,对性别分化和发育起重要作用[23]。 Fsh 和Lh 是垂体释放的参与性激素合成的关键促性腺激素[24]。 本研究发现再生水显著下调雄性斑马鱼脑Ar 和Esr1 基因的转录水平。 斑马鱼中只有Gnrh2 和Gnrh3 这2个亚型[25],从脑传递来的信号控制下丘脑分泌Gnrh2 和Gnrh3,斑马鱼脑中Gnrh 基因表达水平的变化会对性激素平衡产生干扰[26]。 本实验结果显示再生水对斑马鱼暴露7 d 显著下调了成年雄性斑马鱼脑Gnrh2 和Gnrh3 基因的转录水平,类似地,斑马鱼暴露于BDE-28 之后,下丘脑和垂体中基因Gnrh2、Gnrh3显著下调,且与性腺激素合成过程相关的基因卵泡刺激素受体(Fshr)、hsd3b、cyp19a、雌激素受体 a(ERa)和Ar 都显著下调[27]。 Fsh 决定精巢支持细胞的增殖以及促进精子细胞的成熟,而Lh 则作用于精巢中的间质细胞,调节精子发生的最后阶段[28]。本实验结果显示再生水对斑马鱼暴露7 d 显著下调了成年雄性斑马鱼脑Fshb 和Lhb 基因的转录水平,说明再生水可能通过抑制下丘脑产生Gnrh,降低与垂体上的受体结合,进而影响促性腺激素相关基因的表达水平从而改变Gnrh2 和Gnrh3 的转录水平。低转录水平的Gnrh 通过促性腺激素释放激素受体(Gnrhr)作用于垂体,调节垂体减少分泌Fsh 和Lh,从而可能降低精巢中Fshr 和黄体生成素受体(Lhr)表达,降低Fsh 和Lh 的合成,影响类固醇基因的转录水平,干预性激素合成,最终影响雄性斑马鱼精巢组织的正常发育。 Fshb 和Lhb 基因的表达受HPG轴调控,脑中Fshb 和Lhb 转录水平的减少与先前报道的斑马鱼暴露于三(2-丁氧乙基)磷酸盐中是一致的[29]。 与雄性斑马鱼不同,再生水对雌性斑马鱼暴露 7 d 对斑马鱼脑 Ar、Esr1、Fshb、Lhb 和 Gnrh2 转录水平无显著影响。 类似地,再生水对蜗牛(Physa acuta)雌激素相关受体基因无显著影响[12]。 再生水对雌性斑马鱼暴露7 d 显著上调了脑Gnrh3 转录水平,将会增加Gnrh3 激素水平,从而诱导类固醇基因的转录水平和性激素合成,这说明了再生水对雌雄鱼脑受体信号途径、下丘脑和垂体激素相关基因的调节模式是不同的。
3.2 再生水对斑马鱼性腺类固醇途径相关基因转录水平的影响
本研究发现再生水能够调节性腺受体信号途径和类固醇途径相关基因的转录水平。 性腺中性类固醇激素的生物合成起源于star 介导的胆固醇到线粒体的转运[30]。 随后,胆固醇通过 cyp11、cyp17、hsd3b和hsd17b 等参与的级联过程转化为 T。 最后,在cyp19a 酶的作用下T 转化为E2,该酶起着调节斑马鱼类固醇激素水平平衡的关键作用,cyp19a 基因具有cyp19ala 和cyp19alb,cyp19ala 基因主要在卵巢中表达,而cyp19alb 基因则主要在脑组织中表达[31].。 再生水对雌鱼和雄鱼中性腺基因的调节模式也是不相同的。 与脑中雄激素受体Ar 和雌激素受体Esr1 基因表达模式一致,再生水对斑马鱼暴露7 d 显著下调了成年雄性斑马鱼睾丸受体信号途径雄激素受体Ar 和雌激素受体Esr1 基因的转录水平,显著下调了雄性斑马鱼睾丸类固醇途径相关基因 cyp19a1a、hsd3b、hsd17b3 和 hsd20b 转录水平。cyp19ala 表达水平的减少可能导致雄激素向雌激素转化降低,雌激素合成减少,说明了再生水通过干扰类固醇合成途径对斑马鱼生殖发育会造成潜在的影响。 hsd17b3 酶涉及雄激素 T 和11-酮基睾酮(11-ketotestosterone,11-KT)的合成。 因此,研究结果说明了再生水能通过干扰hsd17b3 基因的转录水平进而影响鱼体内雄激素的产生,可能通过干扰精巢中原有性激素的平衡,最终对斑马鱼内分泌系统产生不利的影响。 再生水暴露7 d 对雄性斑马鱼睾丸pgr、star、cyp11a1、cyp11b、cyp17 和 hsd11b2 基因的转录水平无显著影响。 cyp17 基因编码的细胞色素P45017α-羟化酶是体内雄激素合成的限速酶,在雄激素的生物合成过程中非常重要[32]。 star 基因在雄性斑马鱼睾丸中是无显著改变的,说明了类固醇向线粒体的转移过程没有受影响。 hsd20b 是一种关键的类固醇合成酶,涉及鱼体内特有孕激素17α,20β-DHP 的合成,而hsd11b2 基因则涉及雄激素11-KT 的合成[33]。 类似地,甲炔诺酮主要抑制雄鱼精巢中 Ar 基因和类固醇基因 star、cyp11a1、cyp11b、hsd20b、hsd17b3 和 hsd11b2 的转录水平[34]。 再生水已被报道干扰了雄性斑马鱼的类固醇激素合成,再生水暴露显著增加了雄性斑马鱼血浆E2 和Vtg 水平,降低了T 水平,降低了E2/T 的比例[2],原因可能是再生水中存在壬基酚、辛基酚、E2 和双酚A 等内分泌干扰化合物,这些化合物很难通过生物降解和光降解,壬基酚、辛基酚、E2 和双酚A 等化合物显著增加了雄性斑马鱼血浆中Vtg 水平。 然而多项研究表明污水生物处理具有较高的雄激素去除效率,所以再生水中几乎没有雄激素和抗雄激素效应[2]。其他研究报道微量的环境内分泌干扰化合物可影响青蛙和鲫鱼(Carassius auratus)体内 E2 和 T 的浓度[35-36]。 据报道,邻苯二甲酸二丁酯(DBP)可通过非受体依赖性抗雄激素机制降低斑马鱼中的T 浓度[37-39]。 与从美国野外河流中采集的雄鲤相比,来自美国明尼苏达州圣保罗大城镇污水处理厂下游渠道的雄鱼的血清Vtg 浓度显著上调,血清T 浓度显著降低,E2/T 比例无影响[40]。 本研究结果显示,与雄性斑马鱼不同,再生水对雌性斑马鱼暴露7 d 显著上调了卵巢Esr1 和cyp11b 基因转录水平。 再生水对雌性斑马鱼暴露7 d 没有改变卵巢Ar、pgr、star、 cyp11a1、 cyp17、 cyp19a1a、 hsd3b、 hsd11b2、hsd17b3 和hsd20b 转录水平,说明再生水对雌性斑马鱼暴露7 d 对性腺类固醇合成相关基因表达影响较小,雄鱼对再生水较雌鱼敏感。
3.3 再生水对斑马鱼暴露不同时间对HPG 轴相关基因转录水平调节的异同
为了分析再生水处理不同时间对HPG 轴表达模式的影响,本研究还分析了再生水对斑马鱼暴露14 d 对斑马鱼HPG 轴基因转录水平的影响。 对于雄性斑马鱼脑受体信号途径、下丘脑和垂体激素相关基因转录水平的影响,与再生水暴露7 d 的表达变化模式相同,再生水对斑马鱼暴露14 d 显著下调了成年雄性斑马鱼脑Esr1、Fshb 和Lhb 基因的转录水平,然而,与再生水暴露7 d 的表达变化模式不同,再生水对斑马鱼暴露14 d 对成年雄性斑马鱼脑Ar、Gnrh2 和Gnrh3 基因的转录水平无显著影响,说明随着暴露时间的延长,雄性斑马鱼可能通过修复机制对再生水产生了一定的适应性。 对于雌性斑马鱼脑受体信号途径、下丘脑和垂体激素相关基因转录水平的影响,与再生水暴露7 d 的表达变化模式不同,再生水对雌性斑马鱼暴露14 d 显著降低了脑Fshb 和Gnrh3 的转录水平。 与再生水暴露7 d 的表达变化模式相同,再生水对雌性斑马鱼暴露14 d 对斑马鱼脑Ar、Esr1、Lhb 和 Gnrh2 转录水平无显著影响。 对雄性斑马鱼性腺类固醇途径相关基因转录水平的影响,与再生水暴露7 d 的表达变化模式相同,再生水对斑马鱼暴露14 d 显著下调了成年雄性斑马鱼睾丸受体信号途径雄激素受体Ar 和雌激素受体Esr1 基因的转录水平,显著下调了雄性斑马鱼睾丸cyp19a1a、hsd20b 和hsd17b3 基因转录水平,对雄性斑马鱼睾丸pgr、cyp11a1、cyp17 和 cyp11b 基因的转录水平无显著影响。 与再生水暴露7 d 的表达变化模式不同,暴露14 d 显著下调了成年雄性斑马鱼睾丸类固醇途径急性调节蛋白star 和hsd11b2 基因的转录水平,对雄性斑马鱼睾丸hsd3b 基因转录水平无显著改变。 因此,再生水对雄性斑马鱼暴露7 d 和14 d 对睾丸类固醇转录模式基本相同。 这说明,随着暴露时间的延长(延长7 d),雄性斑马鱼虽然可通过修复机制在分子水平对再生水产生了一定的适应性,但再生水对斑马鱼分子水平的影响并没有消除。 对雌性斑马鱼性腺类固醇途径相关基因转录水平的影响,与再生水暴露7 d 的表达变化模式相同,再生水对雌性斑马鱼暴露14 d 对卵巢 Ar、cyp11a1、cyp17、hsd11b2 和 hsd20b 转录水平无显著改变,对Esr1 基因转录水平显著上调。与再生水暴露7 d 的表达变化模式不同,再生水对雌性斑马鱼暴露 14 d 上调了 pgr、cyp19a1a、hsd3b、hsd17b3 和star 基因转录水平,对cyp11b 基因转录水平无显著影响。 这说明,再生水暴露时间延长对雌性斑马鱼分子水平产生了更显著的影响。 因此再生水对雄性斑马鱼和雌性斑马鱼分子水平的影响有差异,这些基因在不同暴露时间的不同转录水平说明了它们是与暴露时间相关的转录模式。
[1]Li Z, Xiang X, Li M, et al. Occurrence and risk assessment of pharmaceuticals and personal care products and endocrine disrupting chemicals in reclaimed water and receiving groundwater in China [J]. Ecotoxicology and Environmental Safety,2015,119:74-80
[2]Sun J, Ji X W, Zhang R, et al.Endocrine disrupting compounds reduction and water quality improvement in reclaimed municipal wastewater: A field-scale study along Jialu River in North China [J]. Chemosphere, 2016, 157:232-240
[3]Sun Y,Huang H,Sun Y,et al.Ecological risk of estrogenic endocrine disrupting chemicals in sewage plant effluent and reclaimed water [J]. Environmental Pollution, 2013,180:339-344
[4]Zhang H F,Jia Y T,Tang Z H,et al.Screening of chemicals with binding activities of liver X receptors from reclaimed waters [J]. Science of the Total Environment,2020,713:136570
[5]Wintgens T, Salehi F, Hochstrat R, et al. Emerging contaminants and treatment options in water recycling for indirect potable use [J]. Water Science and Technology: A Journal of the International Association on Water Pollution Research,2008,57(1):99-107
[6]Yuan J, van Dyke M I, Huck P M. Identification of critical contaminants in wastewater effluent for managed aquifer recharge [J]. Chemosphere,2017,172:294-301
[7]Altenburger R, Scholze M, Busch W, et al. Mixture effects in samples of multiple contaminants: An inter-laboratory study with manifold bioassays [J]. Environment International,2018,114:95-106
[8]Välitalo P, Massei R, Heiskanen I, et al. Effect-based assessment of toxicity removal during wastewater treatment[J]. Water Research,2017,126:153-163
[9]Busch W, Schmidt S, Kühne R, et al. Micropollutants in European rivers: A mode of action survey to support the development of effect-based tools for water monitoring[J]. Environmental Toxicology and Chemistry, 2016, 35(8):1887-1899
[10]Ren X H, Kou Y Y, Kim T, et al. Toxicity study of reclaimed water on human embryonic kidney cells [J].Chemosphere,2017,189:390-398
[11]Planelló R, Herrero O, García P, et al. Developmental/reproductive effects and gene expression variations in Chironomus riparius after exposure to reclaimed water and its fortification with carbamazepine and triclosan [J]. Water Research,2020,178:115790
[12]Aquilino M, Martínez-Guitarte J L, García P, et al. Combining the assessment of apical endpoints and gene expression in the freshwater snail Physa acuta after exposure to reclaimed water [J]. Science of the Total Environment,2018,642:180-189
[13]Huang W H, Ai W M, Lin W W, et al. Identification of receptors for eight endocrine disrupting chemicals and their underlying mechanisms using zebrafish as a model organism [J]. Ecotoxicology and Environmental Safety,2020,204:111068
[14]Huang Y, Wang X, Zhang J, et al. Impact of endocrinedisrupting chemicals on reproductive function in zebrafish(Danio rerio) [J]. Reproduction in Domestic Animals,2015,50(1):1-6
[15]Bassi I, ANDRé V, Marelli F, et al. The zebrafish: An emerging animal model for investigating the hypothalamic regulation of reproduction [J]. Minerva Endocrinologica,2016,41(2):250-265
[16]Ankley G T, Johnson R D. Small fish models for identifying and assessing the effects of endocrine-disrupting chemicals [J]. ILAR Journal,2004,45(4):469-483
[17]Maharajan K, Muthulakshmi S, Karthik C, et al.Pyriproxyfen induced impairment of reproductive endocrine homeostasis and gonadal histopathology in zebrafish(Danio rerio) by altered expression of hypothalamus-pituitary-gonadal (HPG) axis genes [J]. Science of the Total Environment,2020,735:139496
[18]Cao J L, Wang G D, Wang T Y, et al. Copper caused reproductive endocrine disruption in zebrafish (Danio rerio)[J]. Aquatic Toxicology,2019,211:124-136
[19]Liang Y Q, Huang G Y, Ying G G, et al. A time-course transcriptional kinetics of the hypothalamic-pituitary-gonadal and hypothalamic-pituitary-adrenal axes in zebrafish eleutheroembryos after exposure to norgestrel [J]. Environmental Toxicology and Chemistry, 2015, 34(1): 112-119
[20]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method [J]. Methods,2001,25(4):402-408
[21]Guo D M, Liu W P, Yao T S, et al. Combined endocrine disruptive toxicity of malathion and cypermethrin to gene transcription and hormones of the HPG axis of male zebrafish (Danio rerio) [J]. Chemosphere, 2021, 267:128864
[22]Muthulakshmi S, Hamideh P F, Habibi H R, et al. Mycotoxin zearalenone induced gonadal impairment and altered gene expression in the hypothalamic-pituitary-gonadal axis of adult female zebrafish (Danio rerio) [J]. Journal of Applied Toxicology,2018,38(11):1388-1397
[23]Crowder C M, Lassiter C S, Gorelick D A. Nuclear androgen receptor regulates testes organization and oocyte maturation in zebrafish [J]. Endocrinology, 2017, 159(2):980-993
[24]Qiu W H,Fang M J,Liu J Y,et al.In vivo actions of bisphenol F on the reproductive neuroendocrine system after long-term exposure in zebrafish [J]. Science of the Total Environment,2019,665:995-1002
[25]Ji K, Hong S, Kho Y, et al. Effects of bisphenol S exposure on endocrine functions and reproduction of zebrafish[J]. Environmental Science & Technology, 2013, 47(15):8793-8800
[26]Liu X S, Ji K, Jo A, et al. Effects of TDCPP or TPP on gene transcriptions and hormones of HPG axis, and their consequences on reproduction in adult zebrafish (Danio rerio) [J]. Aquatic Toxicology,2013,134-135:104-111
[27]靳亚茹, 刘红玲, 韩志华, 等. BDE-28 及 BDE-99 对斑马鱼早期生命阶段HPT、HPG 和HPA 轴功能基因表达水平的影响[J]. 生态毒理学报,2018,13(1):106-118
Jin Y R, Liu H L, Han Z H, et al.Effects of BDE-28 and BDE-99 on functional gene expression along HPT,HPG and HPA axes during early life stages of zebrafish [J].A-sian Journal of Ecotoxicology, 2018, 13(1): 106-118 (in Chinese)
[28]Ji K, Liu X S, Lee S, et al. Effects of non-steroidal antiinflammatory drugs on hormones and genes of the hypothalamic-pituitary-gonad axis, and reproduction of zebrafish [J]. Journal of Hazardous Materials, 2013, 254-255:242-251
[29]Xu Q L, Wu D, Dang Y, et al. Reproduction impairment and endocrine disruption in adult zebrafish (Danio rerio)after waterborne exposure to TBOEP [J]. Aquatic Toxicology,2017,182:163-171
[30]Teng M M,Qi S Z,Zhu W T,et al.Effects of the bioconcentration and parental transfer of environmentally relevant concentrations of difenoconazole on endocrine disruption in zebrafish (Danio rerio) [J]. Environmental Pollution,2018,233:208-217
[31]Sun W, Jia Y L, Ding X S, et al. Combined effects of pentachlorophenol and its byproduct hexachlorobenzene on endocrine and reproduction in zebrafish [J]. Chemosphere,2019,220:216-226
[32]Fernandes D, Schnell S, Porte C.Can pharmaceuticals interfere with the synthesis of active androgens in male fish? An in vitro study [J]. Marine Pollution Bulletin,2011,62(10):2250-2253
[33]Wang Y J, Ge W. Cloning of zebrafish ovarian carbonyl reductase-like 20β-hydroxysteroid dehydrogenase and characterization of its spatial and temporal expression [J].General and Comparative Endocrinology, 2002, 127(3):209-216
[34]梁燕秋. 孕激素物质黄体酮和甲炔诺酮对斑马鱼不同发育阶段的内分泌干扰效应[D]. 北京: 中国科学院大学,2016:87-104
Liang Y Q. Endocrine disrupting effects of progestins(progesterone and norgestrel) on the different stages of zebrafish(Danio rerio) [D].Beijing: University of Chinese Academy of Sciences,2016:87-104 (in Chinese)
[35]Yi X H, Liu H H, Lu Y T, et al. Altered serum levels of sex steroids and biotransformation enzyme activities by long-term alachlor exposure in crucian carp (Carassius auratus) [J].Bulletin of Environmental Contamination and Toxicology,2007,79(3):283-287
[36]McKinlay R, Plant J A, Bell J N B, et al. Endocrine disrupting pesticides: Implications for risk assessment [J].Environment International,2008,34(2):168-183
[37]Mylchreest E,Cattley R C,Foster P M D.Male reproductive tract malformations in rats following gestational and lactational exposure to di(n-butyl) phthalate: An antiandrogenic mechanism? [J]. Toxicological Sciences, 1998,43(1):47-60
[38]Mylchreest E,Sar M,Cattley R C,et al.Disruption of androgen-regulated male reproductive development by di(nbutyl) phthalate during late gestation in rats is different from flutamide [J]. Toxicology and Applied Pharmacology,1999,156(2):81-95
[39]Kassotis C D, Tillitt D E, Davis J W, et al. Estrogen and androgen receptor activities of hydraulic fracturing chemicals and surface and ground water in a drilling-dense region [J]. Endocrinology,2014,155(3):897-907
[40]Folmar L C, Denslow N D, Rao V, et al. Vitellogenin induction and reduced serum testosterone concentrations in feral male carp (Cyprinus carpio) captured near a major metropolitan sewage treatment plant [J]. Environmental Health Perspectives,1996,104(10):1096-1101