壬基酚(nonylphenol, NP)作为一种典型的酚类内分泌干扰物,是重要的精细化工原料和中间体。水环境中的NP 主要来自于非离子表面活性剂壬基酚聚氧乙烯醚,其伴随工业和城镇污水处理后的出水和污泥进入环境并继续降解成危害性更强的NP[1]。 研究表明,NP 具有较强的疏水性,化学性质稳定,在水中的半衰期可长达1 ~2个月,并会在沉积物中吸附积累,即使水体不再受纳NP 时也可以持续不断地释放到水中[1-2]。 NP 对水生动物的毒害影响包括生殖、免疫、内分泌及神经系统等[3-6],主要毒害方式除了在体内产生活性氧(reactive oxygen species, ROS)诱导氧化损伤外,还可以通过模拟内源性雌激素与相关受体结合,干扰动物体内的激素分泌、基因表达和信号传递等[7-8]。 更为重要的是,NP 可以在水生动物体内富集或经食物链放大,对水生动物和人类具有潜在的生态风险[9]。
水生环境中的NP 浓度往往是变化的,例如污水的集中排放,降雨导致的底泥搅动再释放,或稀释作用、自然降解等均可能导致NP 浓度的增大或减小[10-11],继而引起生物体内的浓度变化。 此前的研究表明,NP 在水生动物体内的积累清除过程一般符合两箱一阶动力学模型,体内NP 的浓度会随着暴露时间和浓度增加而增加,直至与水体平衡[12-13]。水生动物体内的抗氧化、解毒酶能够抵抗外源性污染物生成的ROS 及其本身或代谢物的毒性,超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)能有效清除机体内的ROS;谷胱甘肽S-转移酶(glutathione S-transferase, GST)能够催化多类亲电底物与还原型谷胱甘肽(glutathione, GSH)结合以抵抗毒性物质对机体的损害[14-15]。 这些抗氧化酶和调节物质的波动往往作为机体氧化应激的生物敏感指标,用于监测污染物对生物的毒害效应[16],同时也可以作为污染物浓度变化的指示剂。 值得注意的是,由于水生动物不同组织承担着各自的功能,其对于外源污染物的敏感性也不尽相同。 例如,贻贝的鳃组织对于外源污染物胁迫的敏感性总是高于消化腺,原因在于鳃部是吸收水体污染物的直接器官,而消化腺因为承担重要的代谢功能而需要较高的承受阈值[17]。
目前,关于NP 对水生动物的毒性研究并不少见,但往往侧重于观察不同浓度水平下急性或慢性暴露后的直接变化,关于NP 对鱼体内抗氧化酶的动态影响研究比较有限,缺乏对鱼体NP 浓度变化与毒性效应之间联系的认识。 本文以斑马鱼为供试生物,通过考察NP 在暴露和净化过程中对不同组织(头部、肌肉和内脏团)中抗氧化酶(SOD、CAT、GST 和GSH)活力影响的变化,进一步探究NP 对鱼类的毒性效应和作用机制。
1 材料与方法(Materials and methods)
1.1 实验生物
受试成年斑马鱼(Danio rerio)购自上海某热带鱼市场,均为同期受精卵孵化而成,年龄相近,平均体长为2 ~3 cm。 运回实验室后挑选健康且体型接近的个体继续驯养2 周以上。 实验用水采用曝气48 h 的自来水,以孵化后的丰年虫卵(天津丰年水产养殖有限公司)喂食,光照维持每天12 ~14 h。
1.2 实验方法
1.2.1 实验设计
急性毒性实验采用半静态实验法,每隔24 h 更换实验溶液。 设置溶剂对照组以及一系列浓度的NP 处理组,NP(异构体混合物,纯度>98%,Adamasbeta)的质量浓度设为 59.6、95.4、152、250、390、625、790 和 1 000 μg·L-1,乙醇助溶剂浓度为 0.1 mL·L-1。 每组投放15 尾斑马鱼,驯养期间充分饲喂,直至实验前24 h 停止喂食。 96 h 内观察并记录斑马鱼的症状及死亡情况,触碰尾部无反应即视为死亡,并及时移除。
酶活影响实验根据急性毒性结果设置3个浓度的 NP 处理组,质量浓度分别为 5、50 和 100 μg·L-1,同时设置溶剂对照组,每个浓度水平设置3个平行。 实验设置为14 d 暴露期和7 d 净化期,每隔48 h 更换实验溶液。 暴露14 d 后各自转入洁净的实验用水,每天更换一半。 投喂饲料后将残渣和粪便用虹吸法吸出。 实验用水水质满足斑马鱼的生存需求,水温维持在(22±1) ℃。 以斑马鱼投入暴露溶液的时间为 0 d 计,于 1、7 和 14 d (暴露阶段)以及15 d、21 d (净化阶段)取样。
1.2.2 SOD、CAT、GST 活力和 TP、GSH 含量的测定
斑马鱼样品在冰上麻醉后用蒸馏水冲洗,并用滤纸吸干水分,每个平行样取3 尾合并处理。 用预冷的解剖刀等小心分离鱼头、鱼身和内脏团,鱼身剔除主骨,内脏团除去鱼子。 称得各组织质量,以1 ∶4(m∶V)的比例加入4 ℃的生理盐水,冰水浴中匀浆处理后于 4 ℃、4 000 r·min-1离心 15 min,上清液用生理盐水稀释成各自的最佳浓度。
SOD、CAT、GST 活力和 GSH、总蛋白(total protein, TP)含量测定严格按照测试盒(南京建成生物工程研究所)说明书的方法进行;光密度(optical density, OD)用紫外可见分光光度计测定。
1.3 数据处理与分析
采用冦氏法用EXCEL 2019 计算NP 对斑马鱼的LC50 和95%置信区间,具体计算方法参照李翠萍等[18]的冦氏法。 酶活实验最后结果均表示为与溶剂对照组水平(100%)的比值,即相对活力(%)或相对含量(%),以平均值±标准差(Mean±SD)形式表示,测定数据采用SPSS 25.0 (IBM, USA)进行统计分析,采用单因素方差分析(one-way ANOVA)比较各NP 处理组与对照组之间的差异,显著性水平P <0.05、P<0.01 时为差异显著。
2 结果(Results)
2.1 NP 对斑马鱼的急性致死毒性
斑马鱼刚投入NP 的实验溶液时,没有发现异常现象。 急性毒性暴露过程中,对照组和59.6 μg·L-1组的斑马鱼没有出现死亡且生活状态良好,高浓度的 1 000 μg·L-1组在 24 h 内全部死亡。 NP 对斑马鱼的24 ~96 h 的LC50 数据如表1 所示。 暴露1 h后发现 625、790 和 1 000 μg·L-1组的斑马鱼大部分聚集在水底,游动缓慢,向上游动仍会下沉,触碰后反应正常;暴露5 h 后1 000 μg·L-1组的鱼沉底情况没有好转,游泳迟缓,摇摆无力,部分在水底不游动,且呼吸急促。 死亡个体在死前的症状各组基本一致,逐渐丧失平衡能力,出现侧翻、倾斜,在水底的个体腹部朝上,仍有微弱呼吸,但触碰无反应。 当天死亡个体的鱼鳃和头下部常伴随红肿,而之后死亡的个体则较少出现这种情况,外表无明显损伤,少部分鱼身会发生弯折。
表1 壬基酚(NP)对斑马鱼的急性半致死浓度(LC50)
Table 1 Acute medial lethal concentration (LC50) of nonylphenol (NP) on zebrafish
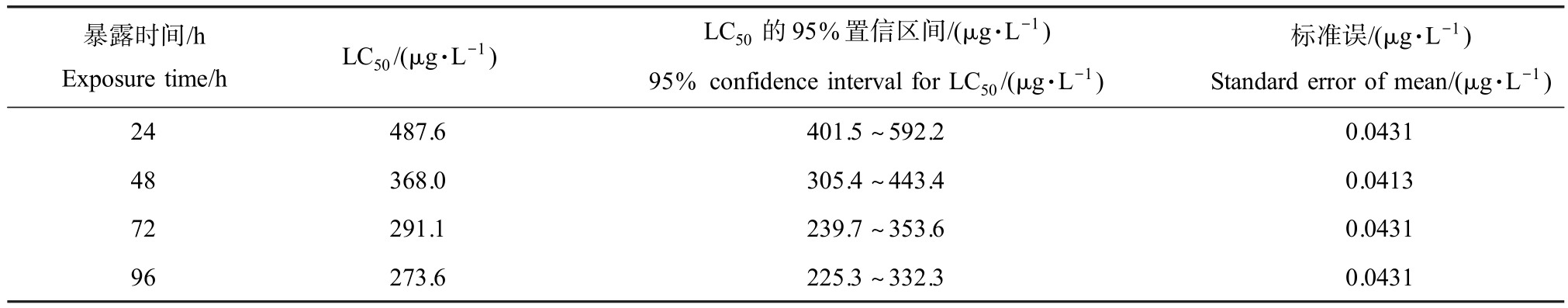
Exposure time/h LC50/(μg·L-1) LC50 的95%置信区间/(μg·L-1)95% confidence interval for LC50/(μg·L-1)暴露时间/h标准误/(μg·L-1)Standard error of mean/(μg·L-1)24 487.6 401.5 ~592.2 0.0431 48 368.0 305.4 ~443.4 0.0413 72 291.1 239.7 ~353.6 0.0431 96 273.6 225.3 ~332.3 0.0431
2.2 NP 对斑马鱼体内SOD 活力的影响
斑马鱼不同组织中的可溶性蛋白质含量的平均值分别为 33.5 g·L-1(鱼头)、36.0 g·L-1(肌肉)、93.5g·L-1(内脏团)。 对照组 SOD 活力在 3个组织的大小关系为内脏团(7.0 U·mg-1)<头部(21.3 U·mg-1)<肌肉(41.5 U·mg-1)。 斑马鱼不同组织内 SOD 与对照组的相对活力变化(%)如图1 所示,5 μg·L-1组头部的SOD 活力在暴露1 d 时被显著诱导(P<0.01),表现出毒性兴奋效应,50 μg·L-1 组在胁迫14 d 时受到轻微抑制,此外各组在暴露期间无显著变化。进入净化阶段,50 μg·L-1 和 100 μg·L-1 组的 SOD活力呈现显著诱导效应(P<0.05)后均有下降,100 μg·L-1组在净化 7 d 时仍高于对照水平(P<0.05)。 肌肉部分,50 μg·L-1 和 100 μg·L-1 组的 SOD 活力在暴露 7 d 时受到显著诱导(P<0.05),而 5 μg·L-1组在暴露14 d 受到显著诱导(P<0.05),此时其余2 组已恢复对照水平。 5 μg·L-1组在净化初期受到的诱导作用显著(P<0.01),50 μg·L-1 和 100 μg·L-1 组的SOD 活力在净化 7 d 时低于对照水平(P<0.05)。 5 μg·L-1组内脏团中SOD 活力在前期低于对照水平,各组在暴露14 d 时均受到显著诱导(P<0.05),100 μg·L-1组在7 d 已较早出现诱导效应。 肌肉和内脏中SOD 活力在高浓度组出现转变的时间要早于低浓度组。 净化阶段,内脏团的SOD 活力呈现不同程度的恢复。 各组织内SOD 的相对活力在暴露和净化期的变化范围为85.1% ~117.4%,整体而言,斑马鱼体内的SOD 活力变化对NP 不太敏感。
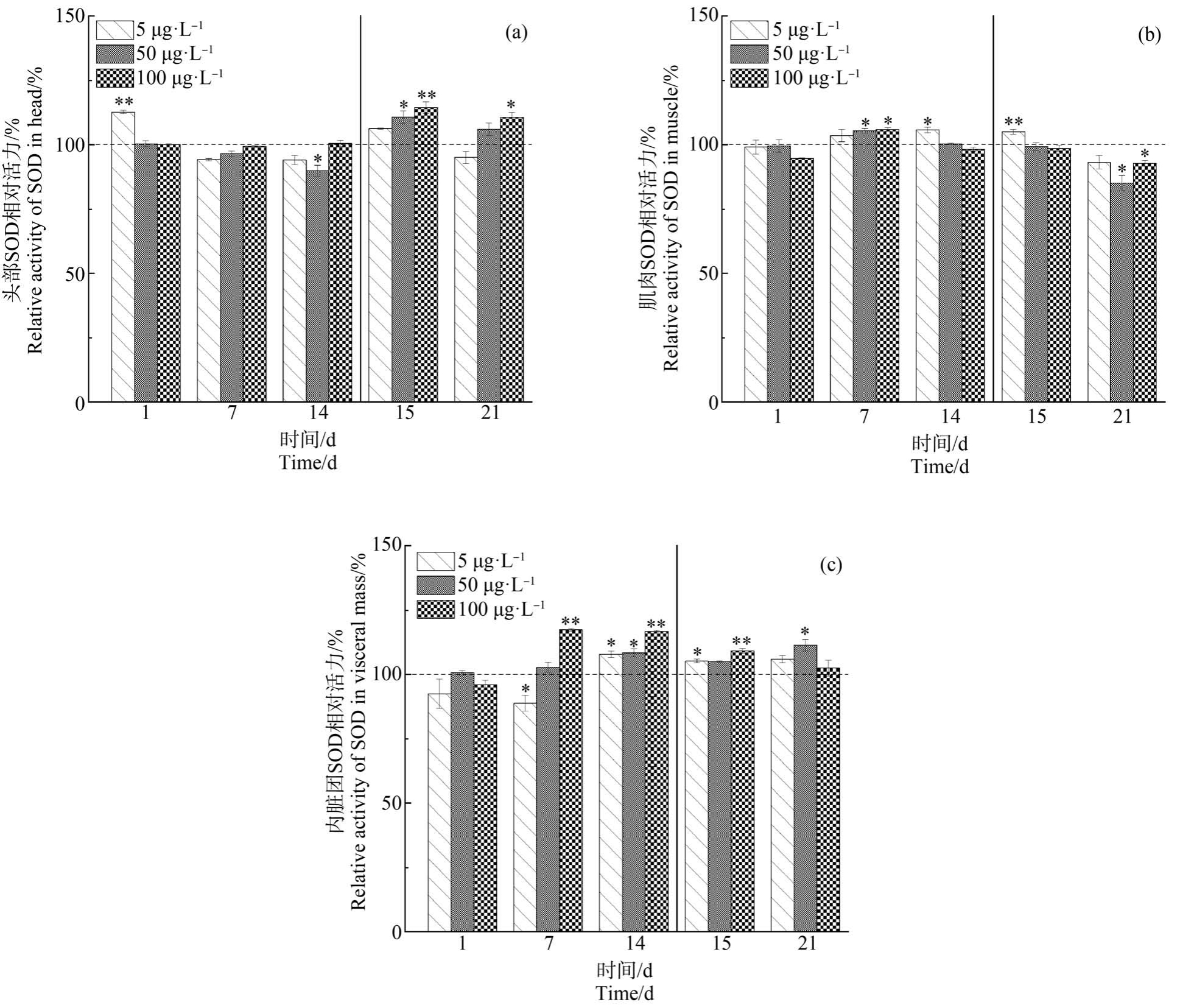
图1 在暴露与净化过程中NP 对斑马鱼头部(a)、肌肉(b)和内脏团(c)中超氧化物歧化酶(SOD)相对活力的影响
注:*表示P<0.05,**表示P<0.01;辅助线前后表示暴露期和净化期,以对照组水平为100%。
Fig.1 Effect of NP on relative superoxide dismutase (SOD) activities in head (a), muscle (b) and visceral mass (c) of zebrafish during exposure and purification stages
Note: *represents P<0.05, **represents P<0.01; auxiliary line separates exposure and purification stages; control treatment level is set at 100%.
2.3 NP 对斑马鱼体内CAT 活力的影响
斑马鱼不同组织内CAT 与对照水平的相对活力(%)变化如图2 所示。 对照组的CAT 活力在3个部分的大小关系依次为肌肉(0.42 U·mg-1)<头部(0.54 U·mg-1)<内脏团(5.8 U·mg-1)。 各组头部的CAT 活力在初期均受到不同程度的抑制,在暴露7 d 时上升到对照水平(P>0.05),在14 d 又受到显著抑制。 进入净化阶段,5 μg·L-1 和 50 μg·L-1 组的CAT 活力均恢复上升到对照水平,而100 μg·L-1组在净化7 d 时仍显著低于对照水平(P<0.05)。 50 μg·L-1和 100 μg·L-1组肌肉内的 CAT 活力在暴露 7 d时受到显著诱导(P<0.05),随后恢复到对照水平(P>0.05)。 从平均水平看,100 μg·L-1组的 CAT 活力下降到对照水平以下,而5 μg·L-1 仍高于对照水平,不同NP 浓度组肌肉内的CAT 活力变化在时间上也存在差异。 在暴露1 d 和7 d 时,NP 对内脏部分的 CAT 活力造成不同程度的抑制(P<0.01)。 100 μg·L-1组受到NP 的抑制程度明显大于其他组,并且在14 d 时仍显著低于对照水平,此时5 μg·L-1和50 μg·L-1组的 CAT 活力已基本恢复,5 μg·L-1组甚至超过了对照水平(P<0.01)。 在净化期内,100 μg·L-1组相较于低浓度组恢复较慢。 整体而言,内脏团CAT 活力对 NP 较为敏感,100 μg·L-1 组的相对活力在暴露7 d 时低至15.5%。

图2 在暴露与净化过程中NP 对斑马鱼头部(a)、肌肉(b)和内脏团(c)中过氧化氢酶(CAT)相对活力的影响
注:*表示P<0.05,**表示P<0.01;辅助线前后表示暴露期和净化期,以对照组水平为100%。
Fig.2 Effect of NP on relative catalase (CAT) activities in head (a), muscle (b) and visceral mass (c) of zebrafish during exposure and purification stages
Note: *represents P<0.05, **represents P<0.01; auxiliary line separates exposure and purification stages; control treatment level is set at 100%.
2.4 NP 对斑马鱼体内GST 活力的影响
斑马鱼不同组织内GST 与对照水平的相对活力(%)受NP 影响的变化规律如图3 所示。 对照组的GST 活力在3个部分的大小关系依次为内脏团(6.5 U·mg-1)<肌肉(14.7 U·mg-1)<头部(18.7 U·mg-1)。 5 μg·L-1组头部的 GST 活力在 14 d 暴露期内持续低于对照水平,而50 μg·L-1和100 μg·L-1组受到不同程度的诱导,并且在净化1 d 后仍高于对照水平。 肌肉组织中,50 μg·L-1和 100 μg·L-1组在暴露和净化初期均受到显著诱导,其余时间变化不显著(P>0.05)。 除了 5 μg·L-1 和 50 μg·L-1 组在暴露期1 d 受到抑制,各组内脏团的GST 活力在NP胁迫下均受到诱导作用,且各组GST 活力均随时间增长而增大。 5 μg·L-1组在 14 d 时达到平衡,为对照水平的 218.8% ~220.0%;50 μg·L-1的 GST 活力增速渐缓,而100 μg·L-1组未见趋于平衡,且相对活力在14 d 时已高达328.4%。 各组织内GST 活力进入净化阶段后逐渐恢复对照水平,低浓度组恢复较快。 在本研究的浓度范围内,NP 对GST 没有造成不可逆的影响。

图3 在暴露与净化过程中NP 对斑马鱼头部(a)、肌肉(b)和内脏团(c)中谷胱甘肽S-转移酶(GST)相对活力的影响
注:*表示P<0.05,**表示P<0.01;辅助线前后表示暴露期和净化期,以对照组水平为100%。
Fig.3 Effect of NP on relative glutathione S-transferase (GST) activities in head (a), muscle (b) and visceral mass (c) of zebrafish during exposure and purification stages
Note: *represents P<0.05, **represents P<0.01; auxiliary line separates exposure and purification stages; control treatment level is set at 100%.
2.5 NP 对斑马鱼体内GSH 含量的影响
GSH 在斑马鱼头部和肌肉中的相对含量(%)受NP 影响的变化情况如图4 所示。 由图4 可知,头部对照水平的 GSH 含量(0.45 nmol·mg-1)小于肌肉(1.03 nmol·mg-1)。 由于 GSH 含量测定所需的样品量较大,故样品量较少的内脏团没有进行测定。 50 μg·L-1 组头部的 GSH 含量在 NP 胁迫下高于对照水平,除此之外,各组在斑马鱼体内的GSH 含量在暴露7 d 前均显著低于对照水平(P<0.05),且随时间增长而增加。 头部的GSH 含量在净化期内下降到对照水平;对于肌肉部分,50 μg·L-1 和 100 μg·L-1组的GSH 含量在净化7 d 时仍显著高于对照水平(P<0.05)。
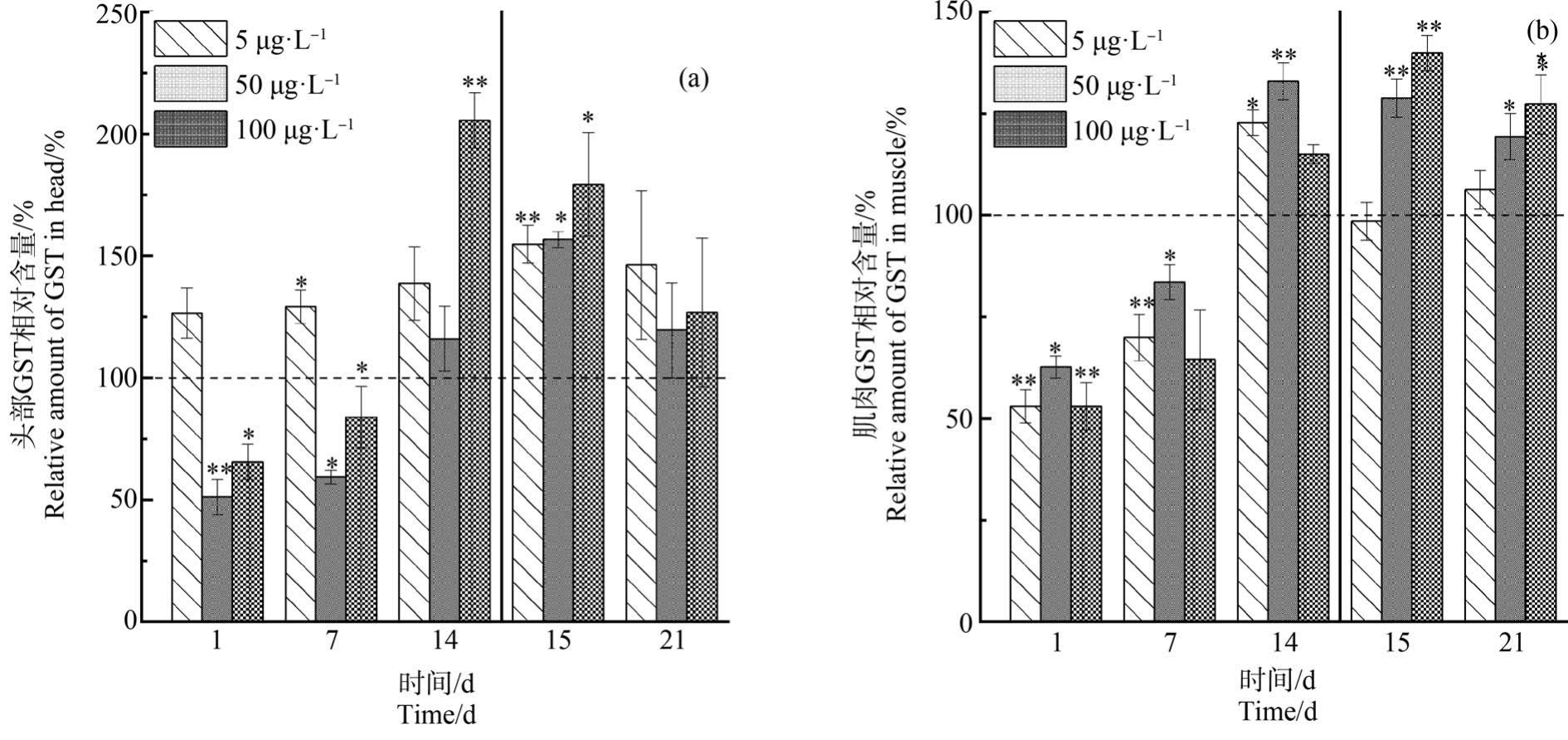
图4 在暴露与净化过程中NP 对斑马鱼头部(a)和肌肉(b)中还原型谷胱甘肽(GSH)相对含量的影响
注:*表示P<0.05,**表示P<0.01;辅助线前后表示暴露期和净化期,以对照组水平为100%。
Fig.4 Effect of exposure to NP on relative glutathione (GSH) level in head (a) and muscle (b) of zebrafish during exposure and purification stages
Note: *represents P<0.05, **represents P<0.01; auxiliary line separates exposure and purification stages; control treatment level is set at 100%.
3 讨论(Discussion)
对于需氧生物而言,在对外源污染物的代谢过程中,会产生副产物ROS,机体主要通过SOD、CAT等抗氧化酶消除ROS 以避免氧化损伤[14]。 GST 也有抗氧化和解毒的重要功能,催化GSH 与外源污染物以及代谢产生的亲电试剂结合,避免其对机体DNA、蛋白质和酶等重要物质造成损伤[19]。
鱼鳃是鱼类与水接触的直接组织,是摄取水中NP 的主要途径[20]。 此前有研究表明 NP 可以引起玫瑰无须鲃的鳃和肝肾的结构病变,表现出上皮组织的增生和次级鳃片的融合,以及肝肾出血和细胞坏死,这可能要归咎于疏水性的NP 与细胞膜结合改变其通透性,继而造成细胞泄露和离子损失等[21]。NP 使斑马鱼鱼鳃组织产生增生和红肿,继而影响其呼吸效率。 除此之外,NP 的暴露还可以破坏机体内促氧化剂与抗氧化系统之间的平衡,诱导氧化应激并造成细胞毒性。 引起斑马鱼急性死亡的主要原因可能是鳃部呼吸功能的严重受损导致缺氧,内部肝、肾等脏器的功能障碍以及生理机能下降加速死亡。NP 对斑马鱼24 h 和96 h 的LC50 值与陈建华等[22]的研究结果(545 μg·L-1 和 332 μg·L-1)相近,而张静[23]报道的96 h LC50(雌、雄斑马鱼LC50 分别为902 μg·L-1和 529 μg·L-1)明显大于本研究结果,可能是因为其实验水温(28 ℃)对斑马鱼更为适宜以及采用对鱼类毒性更小的二甲基亚砜(DMSO)作为助溶剂。NP 通过诱导氧化损伤和直接改变细胞结构等多种方式对斑马鱼造成了毒性作用。
NP 对幼年泥鳅SOD 和CAT 活力的诱导作用随浓度增加而增强,到达最高后表现出随NP 浓度增加而下降的趋势[24]。 本研究中没有发现SOD 和CAT 活力存在明显的浓度依赖性。 在NP 对栉孔扇贝的急性胁迫下,鳃组织和消化盲囊中SOD、CAT的活力在低、中浓度胁迫下先受到轻微诱导后被抑制,而高浓度下全程表现为抑制作用[25]。 Abd-Elkareem 和Mohamed 发现非洲鲇鱼和尼罗河罗非鱼经NP 暴露 21 d 后,SOD 和 CAT 活力显著下降[3]。 本研究结果表明,斑马鱼头部的SOD 活力在低浓度胁迫下受到诱导,虽然后期在头部和肌肉中表现出的抑制效应与其他研究一致,但抑制程度较小。 肌肉中CAT 活力也表现出先被诱导后受到轻微抑制;头部由于通过鳃部吸收水中NP,CAT 活力受到的抑制作用更强而始终低于对照水平。 波纹巴非蛤外套膜中SOD 活力在NP 胁迫下整体表现出先诱导后抑制,进入净化阶段仅1 μg·L-1低浓度组恢复至对照水平[26]。 NP 对波纹巴非蛤毒性效应的研究结果与本研究相似,由于鳃部是吸收水中NP 的主要途径,而肌肉是继头部和内脏后最迟受NP 胁迫的组织[27],因此头部和肌肉内SOD 的诱导效应产生的时间存在先后。 在NP 对波纹巴非蛤内脏团的胁迫过程中,1 μg·L-1和 10 μg·L-1组的 SOD 活力先被抑制后受到诱导[28]。 本研究结果中,SOD 和 CAT 在头部和肌肉中的活力在暴露后期随体内NP 积累浓度增加和胁迫时间持续均会出现下降趋势。 内脏团中的SOD 和CAT 活力在前期受抑制后均表现出上升的趋势。 由于不同组织内抗氧化酶的敏感性和赋存含量有差异,NP 对抗氧化酶的诱导/抑制效应及其影响程度、变化时间均有所不同。
进入机体的NP 浓度随时间增加,在NP 胁迫下机体产生大量ROS 和其他中间产物,进而使得抗氧化酶、非酶类抗氧化物质被大量消耗[29]。 低浓度组斑马鱼头部的GST 活力在暴露阶段受到不同程度的抑制,而GSH 的含量并未被大量消耗而低于对照水平,这一结果符合GSH 在GST 的催化作用下与活性成分结合导致其含量变化。 波纹巴非蛤外套膜内GSH 含量在前中期基本低于对照组,15 d 时显著高于对照组[26]。 本研究中斑马鱼头部和肌肉中GST 的活力在暴露7 d 和14 d 呈现诱导作用或无显著变化,可见GST 的催化反应并未受到抑制,而底物GSH 的含量却保持增长并在14 d 高于对照水平,这表明GSH 的总量出现了延迟性的增长。 大嘴鲈鱼体内GSH 生物合成在NP 暴露下表现出上升趋势[30],斑马鱼体内的GSH 含量在NP 持续胁迫下也会通过合成使总量增加。
斑马鱼肌肉中的SOD 和CAT 活力随暴露时间增加逐渐被诱导,随后表现出活力的下降,尤其是高浓度组比低浓度组更早发生下降的转变。 机体内NP 的积累浓度随暴露时间增加,且在高浓度下积累速度更快[13],可见NP 对抗氧化酶的影响与体内的积累浓度存在相关性。 内脏团SOD 活力在100 μg·L-1中更早地从受抑制转为被诱导,同样与NP 的积累浓度有关。 NP 会对贻贝体内GST 的活力产生剂量依赖性的诱导,并且在净化期持续作用[31]。 斑马鱼头部GST 活力水平也表现出一定的浓度依赖性,但 50 μg·L-1和 100 μg·L-1组的差异并不显著。内脏团GST 活力表现出时间依赖性,并且5 μg·L-1组的GST 活力在暴露期维持一定水平,同时50 μg·L-1组的GST 活力增速渐缓,表明内脏团的GST 活力会随体内NP 浓度的平衡而维持在相应水平,该水平与暴露浓度呈正相关。 结合GST 活力与时间以及暴露浓度的关系,可知斑马鱼体内NP 的积累浓度是诱发GST 活力改变的主因,而不是体外的胁迫浓度,体内的GST 活力随NP 暴露时间和暴露浓度变化而增强,其诱导作用表现出与体内NP 浓度相关的剂量效应[13]。 本研究中内脏团的GST 活力变化与野生贻贝的相同,表明内脏团中的GST 积极参与了NP 的代谢解毒过程,其活力变化对NP 的敏感性远大于头部和肌肉,证实了肝、肾作为代谢解毒的主要功能器官。 GST 活力受到抑制一般有2 种可能的原因:NP 与 GST 结合或 NP 使催化底物GSH 的含量减少。 头部 GST 在 5 μg·L-1组的活力低于对照水平,同时GSH 的含量却没有明显下降,表明头部GST 活力下降的原因可能是低浓度水平的NP 通过结合GST 使其活力下降[32],高浓度NP使GST 活力上升可能是因为NP 在短期内达到一定水平后激活了相关代谢酶的活动。 抗氧化酶的活力变化依赖于体内NP 的积累浓度和一定浓度水平的维持时间。
综上所述,NP 对斑马鱼表现出中等毒性,斑马鱼内脏团中的CAT 和GST 的活力变化能较好地反映体内NP 积累浓度的变化,头部的抗氧化酶活力变化可作为NP 早期污染的敏感指标。
[1]Ying G G,Williams B,Kookana R.Environmental fate of alkylphenols and alkylphenol ethoxylates: A review [J].Environment International,2002,28(3):215-226
[2]Servos M R.Review of the aquatic toxicity,estrogenic responses and bioaccumulation of alkylphenols and alkylphenol polyethoxylates [J]. Water Quality Research Journal,1999,34(1):123-178
[3]Shirdel I,Kalbassi M R,Esmaeilbeigi M,et al.Disruptive effects of nonylphenol on reproductive hormones,antioxidant enzymes, and histology of liver, kidney and gonads in Caspian trout smolts [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2020,232:108756
[4]Rastgar S, Movahedinia A, Salamat N, et al. Interruption of immune responses in primary macrophages exposed to nonylphenol provides insights into the role of ER and NFKB in immunotoxicity of Persian sturgeon [J]. Fish &Shellfish Immunology,2019,86:125-134
[5]Madigou T, Goff P L, Salbert G, et al. Effects of nonylphenol on estrogen receptor conformation, transcriptional activity and sexual reversion in rainbow trout (Oncorhynchus mykiss) [J].Aquatic Toxicology,2001,53(3-4):173-186
[6]Xia J G, Niu C J, Pei X J. Effects of chronic exposure to nonylphenol on locomotor activity and social behavior in zebrafish (Danio rerio) [J]. Journal of Environmental Sciences,2010,22(9):1435-1440
[7]Puy-Azurmendi E,Olivares A,Vallejo A,et al.Estrogenic effects of nonylphenol and octylphenol isomers in vitro by recombinant yeast assay (RYA) and in vivo with early life stages of zebrafish [J]. Science of the Total Environment,2014,466-467:1-10
[8]Sun D,Chen Q,Zhu B,et al.Multigenerational reproduction and developmental toxicity, and HPG axis gene expression study on environmentally-relevant concentrations of nonylphenol in zebrafish [J].Science of the Total Environment,2021,764:144259
[9]Fan J J, Wang S, Tang J P, et al. Bioaccumulation of endocrine disrupting compounds in fish with different feeding habits along the largest subtropical river, China [J].Environmental Pollution,2019,247:999-1008
[10]Chen R,Yin P H,Zhao L,et al.Spatial-temporal distribution and potential ecological risk assessment of nonylphenol and octylphenol in riverine outlets of Pearl River Delta, China [J].Journal of Environmental Sciences,2014,26(11):2340-2347
[11]褚春莹, 但丽霞, 蒋海威, 等. 胶州湾入海河流和排污口水体中壬基酚的污染状况调查及入海通量核算[J].中国环境监测,2013,29(2):29-33
Chu C Y, Dan L X, Jiang H W, et al.Pollution status and flux of nonylphenol in the water of the rivers and drainage outlet entering the Jiaozhou Bay [J]. Environmental Monitoring in China,2013,29(2):29-33 (in Chinese)
[12]Lietti E, Marin M G, Matozzo V, et al. Uptake and elimination of 4-nonylphenol by the clam Tapes philippinarum[J]. Archives of Environmental Contamination and Toxicology,2007,53(4):571-578
[13]Vidal-Liñán L,Bellas J,Salgueiro-González N,et al.Bioaccumulation of 4-nonylphenol and effects on biomarkers,acetylcholinesterase, glutathione-S-transferase and glutathione peroxidase, in Mytilus galloprovincialis mussel gills [J]. Environmental Pollution,2015,200:133-139
[14]Nair P M G,Park S Y,Choi J.Expression of catalase and glutathione S-transferase genes in Chironomus riparius on exposure to cadmium and nonylphenol [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2011,154(4):399-408
[15]Mansour S A, Mossa A T H. Lipid peroxidation and oxidative stress in rat erythrocytes induced by chlorpyrifos and the protective effect of zinc [J]. Pesticide Biochemistry and Physiology,2009,93(1):34-39
[16]Bal A,Panda F,Pati S G,et al.Modulation of physiological oxidative stress and antioxidant status by abiotic factors especially salinity in aquatic organisms [J].Comparative Biochemistry and Physiology Part C: Toxicology &Pharmacology,2021,241:108971
[17]Chen S Y, Shen Z Y, Ding J W, et al. Sulfamethoxazole induced systematic and tissue-specific antioxidant defense in marine mussels (Mytilus galloprovincialis): Implication of antibiotic’s ecotoxicity [J]. Chemosphere, 2021, 279:130634
[18]李翠萍, 吴民耀, 王宏元.3 种半数致死浓度计算方法之比较[J]. 动物医学进展,2012,33(9):89-92
Li C P, Wu M Y, Wang H Y. LC50 caculated by Kochi,probit analysis and linear regression methods [J].Progress in Veterinary Medicine,2012,33(9):89-92 (in Chinese)
[19]MihaljevicˇI, Bašica B, MarakovicˇN, et al. Interaction of organotin compounds with three major glutathione S-transferases in zebrafish [J]. Toxicology in Vitro, 2020,62:104713
[20]Arnot J A, Gobas F A. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms [J]. Environmental Reviews,2006,14(4):257-297
[21]Bhattacharya H, Xiao Q, Lun L M. Toxicity studies of nonylphenol on rosy barb (Puntius conchonious): A biochemical and histopathological evaluation [J]. Tissue and Cell,2008,40(4):243-249
[22]陈建华, 谢艳颖, 陈世红, 等. 茶多酚对壬基酚所致斑马鱼急性死亡和遗传损伤的保护作用[J]. 环境污染与防治,2018,40(10):1126-1131
Chen J H, Xie Y Y, Chen S H, et al. The protection of Danio rerio from acute lethal toxicity and genetic damage induced by nonylphenol through tea polyphenol [J].Envi-ronmental Pollution & Control, 2018, 40(10): 1126-1131(in Chinese)
[23]张静. 环境激素对斑马鱼免疫相关基因表达的影响[D]. 济南: 山东师范大学,2012:31
Zhang J. Effects of environmental hormones on the expression of immune-related genes of the zebrafish (Danio rerio) [D].Ji’nan:Shandong Normal University,2012:31(in Chinese)
[24]戚珍珠, 雷忻, 王文强, 等. 壬基酚胁迫对幼龄泥鳅雌激素活性及抗氧化酶活力的影响[J]. 西北农林科技大学学报: 自然科学版,2017,45(2):49-55
Qi Z Z, Lei X, Wang W Q, et al. Effect of nonylphenol expose on estrogenic activity and antioxidant enzymes of juvenile Misgurnus anguillicaudatus [J].Journal of Northwest A & F University: Natural Science Edition,2017,45(2):49-55 (in Chinese)
[25]高永刚, 李正炎. 壬基酚对栉孔扇贝组织抗氧化酶活性的影响[J]. 中国海洋大学学报: 自然科学版, 2006,36(S1):135-138
Gao Y G, Li Z Y. Effect of nonylphenol on anti-oxidant enzymes of Chlamys farreri [J]. Periodical of Ocean University of China,2006,36(S1):135-138 (in Chinese)
[26]巩秀玉, 黄志斐, 王贺威, 等. 壬基酚对波纹巴非蛤(Paphia undulata)外套膜毒性效应研究[J]. 海洋环境科学,2015,34(2):234-239
Gong X Y, Huang Z F, Wang H W, et al. Toxic effect of nonylphenol (NP) on the mantle of Paphia undulate [J].Marine Environmental Science,2015, 34(2): 234-239 (in Chinese)
[27]Orias F, Simon L, Mialdea G, et al. Bioconcentration of 15N-tamoxifen at environmental concentration in liver,gonad and muscle of Danio rerio [J]. Ecotoxicology and Environmental Safety,2015,120:457-462
[28]巩秀玉, 陈海刚, 张喆, 等. 壬基酚对波纹巴非蛤(Paphia undulata)内脏团毒性效应[J]. 生态学杂志, 2012, 31(6):1473-1479
Gong X Y,Chen H G,Zhang Z,et al.Toxic effect of nonylphenol on Paphia undulata visceral mass [J]. Chinese Journal of Ecology,2012,31(6):1473-1479 (in Chinese)
[29]Lushchak V I. Environmentally induced oxidative stress in aquatic animals [J]. Aquatic Toxicology, 2011, 101(1):13-30
[30]Hughes E M, Gallagher E P. Effects of 17-beta estradiol and 4-nonylphenol on phase Ⅱelectrophilic detoxification pathways in largemouth bass (Micropterus salmoides)liver [J]. Comparative Biochemistry and Physiology Toxicology & Pharmacology,2004,137(3):237-247
[31]张海丽, 边海燕, 杨跃志, 等. 酚类污染物对菲律宾蛤仔抗氧化和解毒系统相关酶活性的影响[J]. 中国海洋大学学报: 自然科学版,2012,42(3):21-26
Zhang H L,Bian H Y,Yang Y Z,et al.Effects of phenolic compounds on enzyme activities of antioxidant and detoxification systems in Ruditapes philippinarum [J]. Periodical of Ocean University of China,2012, 42(3): 21-26 (in Chinese)
[32]杨琦, 张金补, 董然然. 环境激素壬基酚对杂交鲟的氧化胁迫作用[J]. 现代农业科技,2018(2):240-242
Yang Q, Zhang J B, Dong R R. Effect of nonylphenol on oxidative stress of hybrid sturgeon [J]. Modern Agricultural Science and Technology,2018(2): 240-242 (in Chinese)