内分泌干扰物(endocrine disrupting chemicals,EDCs)是一类重要的环境污染物,能够影响生物体的内分泌系统而破坏生物体内激素分泌机能。 近年来,水环境中EDCs 的存在引起研究者的广泛关注。世界各国的饮用水水源中均有EDCs 检出[1-6],如中国、西班牙、美国、亚美尼亚、马来西亚和英国。 在这些环境EDCs 中,内分泌干扰类农药(endocrine disrupting pesticides,EDPs)及其代谢产物占有非常高的比例。 EDPs 是一类外源性干扰内分泌系统的农药,可干扰人类及其他动物内分泌系统的诸多环节,从而使生物体产生异常效应[7]。 世界自然基金会发布的《环境中被报告具有生殖和内分泌干扰作用的化学物质清单》(1999年)中,125 种 EDCs 中农药类污染物有86 种,占比60%以上,包括有机磷类、拟除虫菊酯、取代苯类和含氮杂环类等,常见的六六六、滴滴涕、多菌灵和林丹等均属于EDPs[7-8]。 据报道,EDPs 可产生类雌激素及抗雌激素、类雄激素及抗雄激素、类甲状腺素及抗甲状腺素等多种类型内分泌干扰效应,其中以雌激素效应和抗雄激素效应最为常见[8]。
目前关于EDPs 的生物检测技术主要涉及活体试验和离体试验2个方面,体内试验以卵生脊椎动物、爬行动物和两栖动物等活体动物为对象;体外试验则包括受体结合实验、体外芳香酶活性抑制实验、细胞培养实验和分子生物学检测技术等[7]。 体外试验中,基于哺乳动物细胞的化学激活荧光素酶基因表达法(CALUX)测试技术和重组酵母细胞测试系统(YAS、YES 等)在内分泌干扰效应筛查上应用广泛。重组酵母细胞测试系统对无菌条件没有严格要求,更适用于复合样品的内分泌干扰效应筛查[9];CALUX 采用哺乳动物细胞测试对测试环境要求较为严格,但操作程序简单、快速、适用范围广,分析费用低,检测周期短,检测灵敏度和准确性高,在EDPs的筛查方面具有独特的优势[10]。 Seeger 等[11]同时采用基于哺乳动物细胞系的CALUX 技术和重组酵母细胞测试系统(YAS)进行了杀菌剂的抗雄激素效应研究,结果表明,2 种测试技术都可以成功应用于杀菌剂抗激素效应的评价,其中CALUX 技术对物质的敏感性略高,不易受到测试物质细胞毒性的影响。
通过液相色谱-飞行时间质谱从黄河下游地区水源水中筛查鉴定出包括杀虫剂和除草剂等多种农药类污染物(表1)。 关于这些化合物的内分泌干扰效应(雌激素和雄激素)研究,仅阿特拉津、多菌灵等少数化合物有相关报道,而且不同的测试方法报道结果也存在差异。 对非性激素功能如肾上腺皮质激素活性的干扰作用更是鲜有报道。
表1 测试化合物相关信息
Table 1 Information of the tested compounds
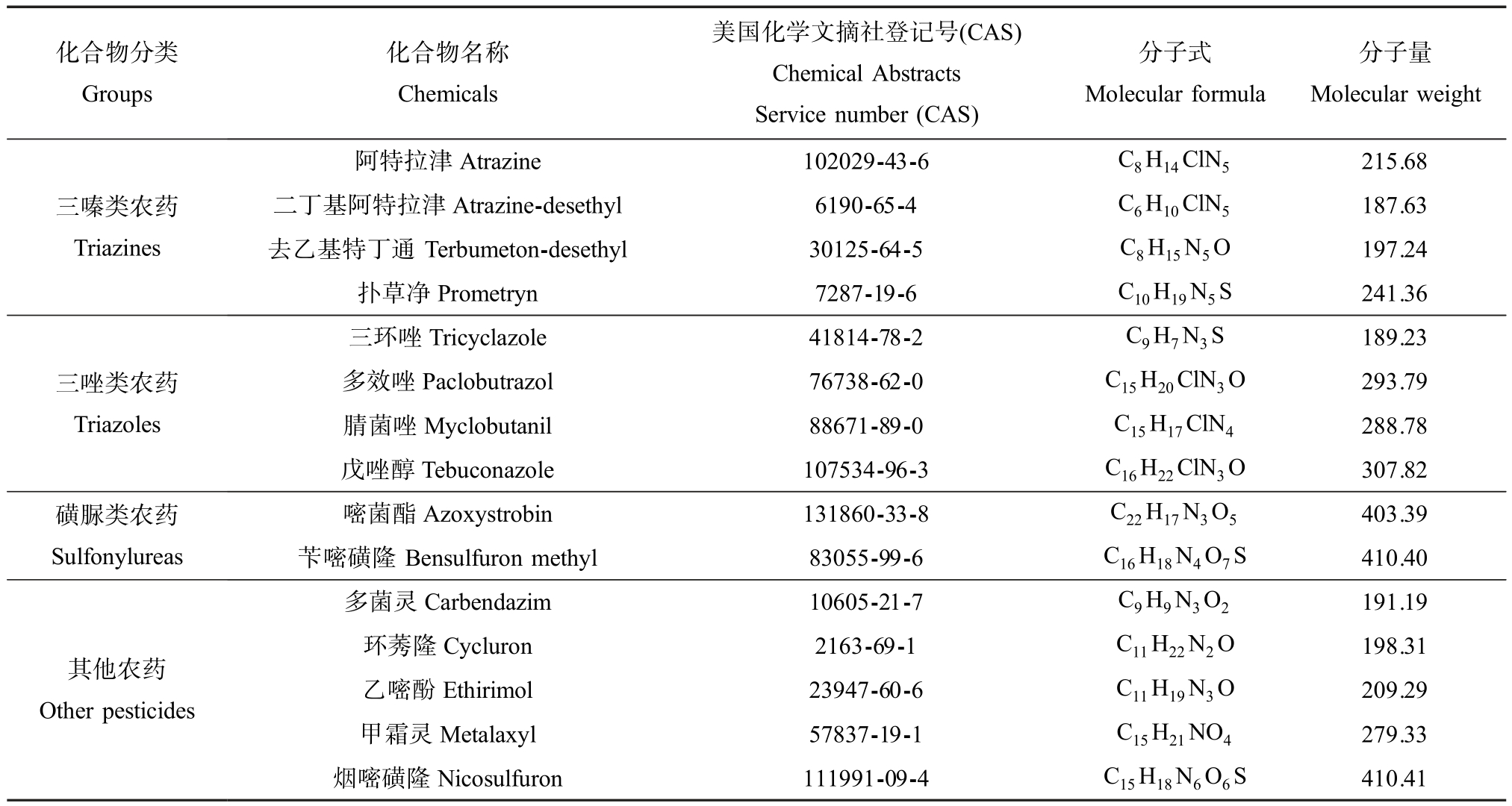
化合物分类Groups化合物名称Chemicals美国化学文摘社登记号(CAS)Chemical Abstracts Service number (CAS)分子式Molecular formula分子量Molecular weight阿特拉津Atrazine 102029-43-6 C8H14ClN5 215.68三嗪类农药Triazines二丁基阿特拉津Atrazine-desethyl 6190-65-4 C6H10ClN5 187.63去乙基特丁通Terbumeton-desethyl 30125-64-5 C8H15N5O 197.24扑草净Prometryn 7287-19-6 C10H19N5S 241.36三环唑Tricyclazole 41814-78-2 C9H7N3S 189.23三唑类农药Triazoles多效唑Paclobutrazol 76738-62-0 C15H20ClN3O 293.79腈菌唑Myclobutanil 88671-89-0 C15H17ClN4 288.78戊唑醇Tebuconazole 107534-96-3 C16H22ClN3O 307.82磺脲类农药Sulfonylureas嘧菌酯Azoxystrobin 131860-33-8 C22H17N3O5 403.39苄嘧磺隆Bensulfuron methyl 83055-99-6 C16H18N4O7S 410.40多菌灵Carbendazim 10605-21-7 C9H9N3O2 191.19其他农药Other pesticides环莠隆Cycluron 2163-69-1 C11H22N2O 198.31乙嘧酚Ethirimol 23947-60-6 C11H19N3O 209.29甲霜灵Metalaxyl 57837-19-1 C15H21NO4 279.33烟嘧磺隆Nicosulfuron 111991-09-4 C15H18N6O6S 410.41
通过与激素的特定受体直接结合激活受体通路,进而产生多种不同的毒性效应是内分泌干扰物的重要作用途径。 本研究采用CALUX 技术对水源水中筛查鉴定出的农药污染物雌激素、雄激素和糖皮质激素受体介导的综合激素效应进行了测试评估,为水环境中农药类污染物健康风险评估提供支撑。
1 材料与方法(Materials and methods)
1.1 仪器设备
液相色谱-飞行时间质谱(G2-XS-QTOF,美国Waters 公司);固相萃取仪(AUTO SPE 06,中国睿科集团股份有限公司);微孔板式化学分光仪(LB960,德国Berthold Centro 公司);微孔板读板机(Emax Plus,美国 Molecular Devices 公司);生物安全柜(AC2-4S1,新加坡 ESCO 公司);二氧化碳培养箱(HERA cell 150i,美国Thermo 公司);组织培养用显微镜(CKX41,日本奥林巴斯株式会社)。
1.2 试剂及培养基
CALUX 测定标准物质浓度系列(雌二醇、二氢睾酮、地塞米松)购自荷兰Biodetection Systems B.V.(BDS)公司;甲醇、二甲基亚砜(DMSO)、正己烷、乙酸乙酯以及测试化合物(表1)均购自Sigma 公司。所有待测化合物的原液均溶于DMSO 中,浓度为10-2 mol·L-1,保存于-20 ℃备用。 根据预实验结果,所有的测试化合物都用相应的培养基稀释至实验浓度用于测试。 DMSO 在培养基中的最终浓度不超过0.1%。 DMEM/F12、DMEM 高糖培养基均购于美国GIBCO 公司。
1.3 液相色谱-飞行时间质谱筛查
(1)样品前处理
HLB 固相萃取,依次用10 mL 甲醇和10 mL 纯水活化,取1 000 mL 水样过柱,流速10 mL·min-1,上样完成后用10 mL 纯水淋洗固相萃取柱,氮吹30 min 干燥后,以5 mL 甲醇洗脱,氮吹定容至1 mL,上机测试。
(2)仪器工作条件
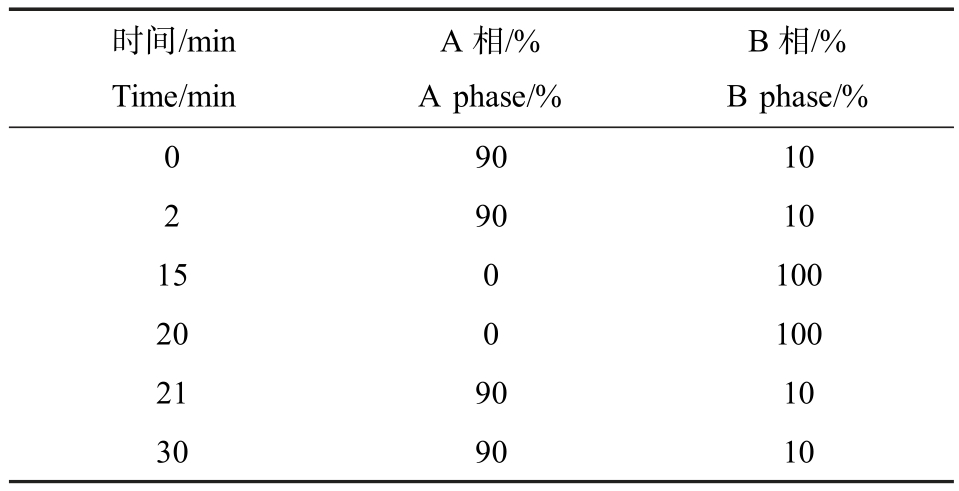
色谱柱:ACQUITY UPLC BEH C18(1.7 μm,2.1 mm×100 mm)。 流动相:A 相(0.1% 甲酸-水溶液)、B相(0.1%甲酸-乙腈溶液)。 洗脱模式及洗脱流速:采用梯度洗脱(表2),洗脱速率为0.2 mL·min-1,柱箱温度30 ℃,进样体积5 μL。 电喷雾离子源,正、负离子模式,MSe 扫描,采集范围(m/z)50 ~1 200。
表2 流动相梯度条件
Table 2 Gradient condition of mobile phase
时间/min Time/min A 相/%A phase/%B 相/%B phase/%0 90 10 90 10 15 0 100 20 0 100 21 90 10 30 90 10 2
1.4 细胞系和细胞培养
生物测定细胞系由BDS 公司提供,其中ERCALUX 生物测定采用人乳腺癌细胞系(T-47D),AR-CALUX 和GR-CALUX 生物测定采用人骨肉瘤细胞系(U2OS)。 所有细胞系培养基为添加10%FBS 的DMEM/F12,于75 cm2 的组织培养瓶中,37℃、5% CO2 条件培养。
1.5 细胞增殖毒性测定
采用噻唑蓝-溴化四唑盐(MTT)法进行测定[12]。细胞铺板密度为1×104个·mL-1,铺板24 h 后进行染毒。 染毒试验设空白对照组(加入相同体积的培养基)、溶剂对照组(加入相同体积的DMSO)和化合物染毒组(加入各测试化合物的DMSO 溶液),每组设6个平行,测试化合物染毒终浓度为10-6 ~10-4 mol·L-1。 染毒处理 24 h 后加入 MTT 于 570 nm 下测定光吸收值。 细胞存活率按下列公式计算:细胞存活率=实验组 OD 值/对照组 OD 值×100% [13]。
1.6 内分泌干扰效应测试
根据ISO17025 认证推荐的标准操作方法进行检测[14]。 首先,将细胞悬浮液稀释至105个·mL-1密度置于96 孔板中,37 ℃、5% CO2 条件下孵育16 h。移出培养基后,将预先制备的含特定浓度标准参照物或样本的培养基填充至微孔板,每组设3个平行。孵育24 h 后,从微孔板中移出所有培养基,每孔加入30 μL 细胞消散试剂并充分混匀,利用微孔板式化学分光检测仪测定萤光素酶活性。 对照标准参照物系列的荧光强度,制作剂量-响应曲线,得出样品中不同 EDCs 的当量值,分别使用 17β-雌二醇(E2)、二氢睾酮(DHT)、地塞米松(DEX)毒性当量来表征雌激素、雄激素和肾上腺皮质激素的内分泌干扰效应。
1.7 数据分析
使用SPSS 软件单因子方差分析法进行试验组间数据的差异显著性检验。
2 结果(Results)
2.1 细胞毒性
T-47D 细胞系毒性测试结果显示,阿特拉津、嘧菌酯、腈菌唑、乙嘧酚、苄嘧磺隆和烟嘧磺隆6 种农药在 1×10-4 mol·L-1浓度下对 T-47D 细胞增殖有明显的促进或抑制作用,非细胞毒性效应浓度均为1×10-5 mol·L-1。 其他测试化合物在 1×10-4 mol·L-1浓度下均无显著的细胞毒性效应。 而U2OS 细胞系毒性测试结果显示,在1×10-4 mol·L-1浓度下,仅多菌灵、乙嘧酚和嘧菌酯3 种浓度具有显著的细胞毒性效应,细胞存活率分别为(74±4)%、(35±8)%和(27±9)%,其他测试化合物均无显著细胞毒性效应。多菌灵、乙嘧酚和嘧菌酯3 种农药对U2OS 细胞系的最高非细胞毒性效应浓度分别为1×10-4、1×10-4和1×10-4 mol·L-1。 所有化学物质的无显著细胞毒性效应浓度用于后续的内分泌干扰效应测试,结果如表3 所示。
表3 测试化合物的细胞毒性效应
Table 3 Cytotoxicity of the tested compounds
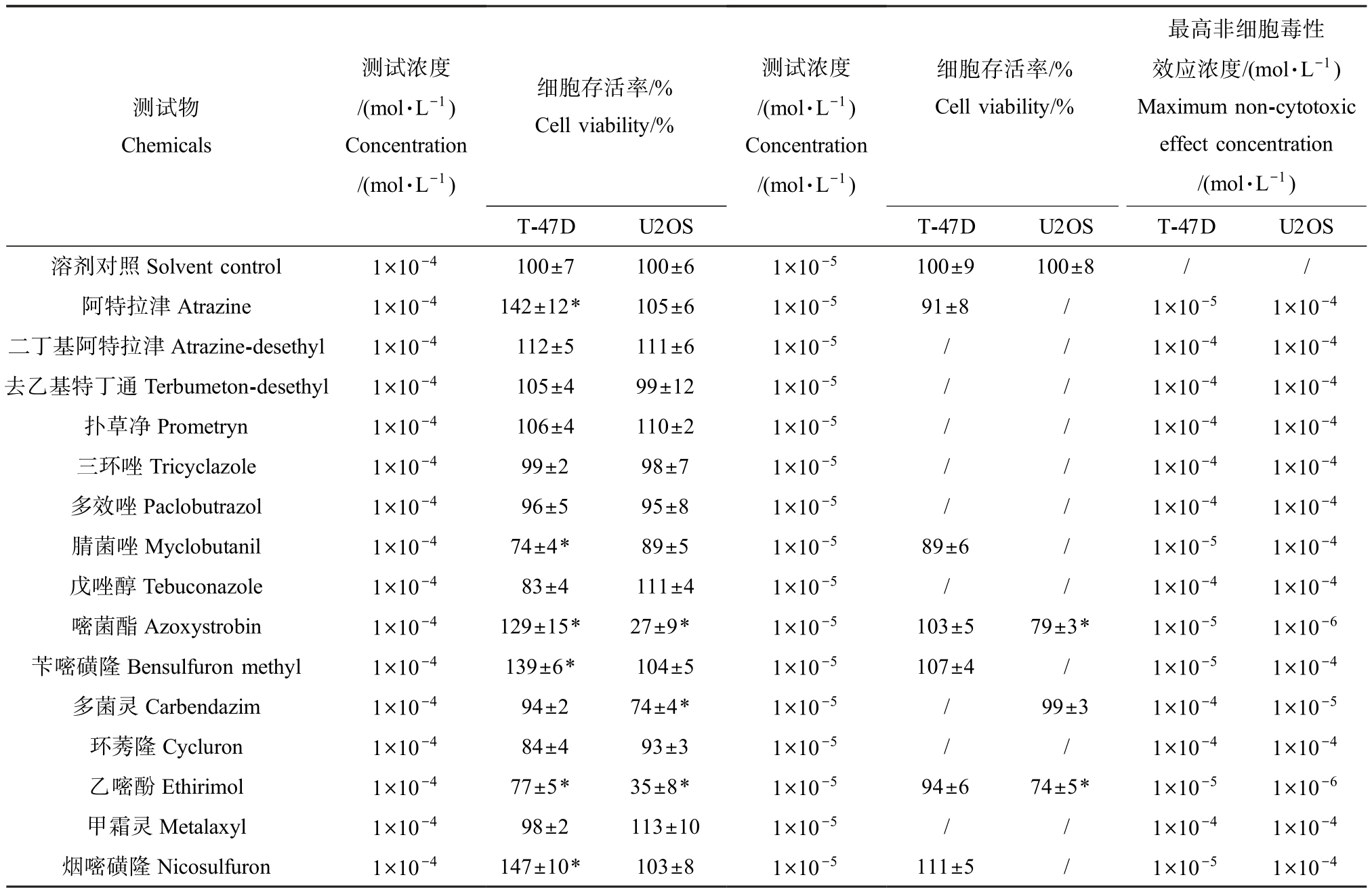
注:细胞存活率结果以平均值±标准偏差表示。
Note: Cell survival results were expressed as mean±standard deviation.
?
2.2 内分泌干扰效应测试
2.2.1 雌激素受体激动和拮抗效应
在试验浓度下,所有测试物均不能诱导萤光素酶活性,说明均不具有雌激素受体激动效应。 拮抗试验中采用浓度为3×10-9 mol·L-1 的 E2 与待测化合物共暴露测试,其中仅环莠隆与E2 共暴露时,检测到荧光强度显著降低,显示雌激素受体拮抗效应,其余14 种测试物均未显示雌激素受体拮抗效应。扑草净在拮抗反应试验中检测到荧光信号增强。
2.2.2 雄激素受体激动和拮抗效应
所有测试物在非细胞毒性剂量下均未表现出显著的荧光诱导作用,表明它们均不具有雄激素受体激动效应。 拮抗试验中采用浓度为3×10-8 mol·L-1的DHT 与待测化合物共暴露测试,多效唑、戊唑醇和三环唑显著降低DHT 诱导的荧光反应,表现出雄激素受体拮抗效应。 化合物在试验最高浓度下分别抑制DHT 介导的反应62%、91%和72%(图1(a)),剂量效应曲线如图1(b)所示。 3 种农药的EC50 分别为 8.2×10-5、3.8×10-5 和 4.7×10-5 mol·L-1。 其余 12种测试物均未显示雄激素受体拮抗剂活性。
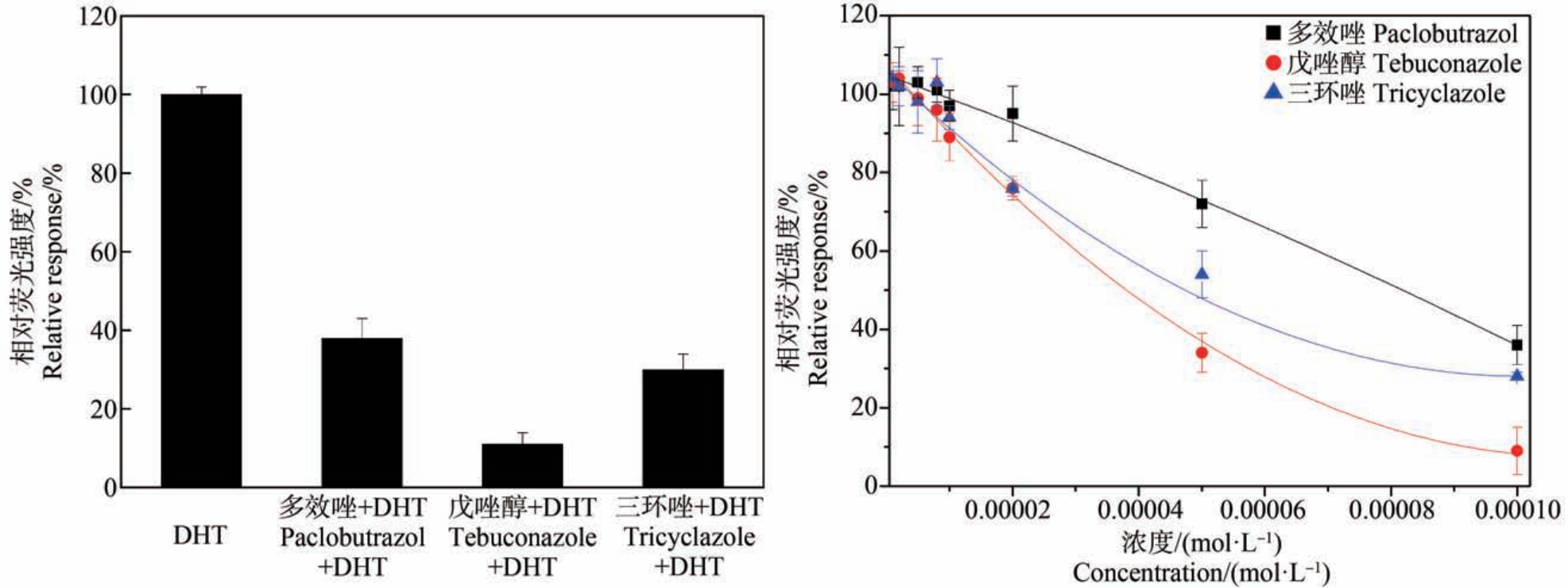
图1 雄激素受体拮抗反应测试
注:(a)测试物在最高浓度下的拮抗反应(3×10-8 mol·L-1),(b)雄激素受体拮抗剂化合物的剂量-反应曲线;DHT 表示二氢睾酮。
Fig.1 Test of androgenic receptor antagonist response
Note: (a) Androgenic antagonist response at the highest concentration (3×10-8 mol·L-1), (b) Dose-response curves of the androgenic antagonist compounds; DHT stands for dihydrotestosterone.
2.2.3 肾上腺皮质激素受体激动和拮抗效应
与雄激素和雌激素受体激动效应测试结果类似,没有一种测试物表现出明显的皮质激素受体激动效应。 与DEX 的共孵育结果显示,在1×10-4 mol·L-1浓度下,甲霜灵、扑草净、三环唑和阿特拉津显著减弱阳性物质DEX 诱导的荧光反应信号,显示出弱皮质激素受体拮抗活性。 4 种化合物对DEX 诱发荧光反应的抑制率为12% ~21%(图2)。
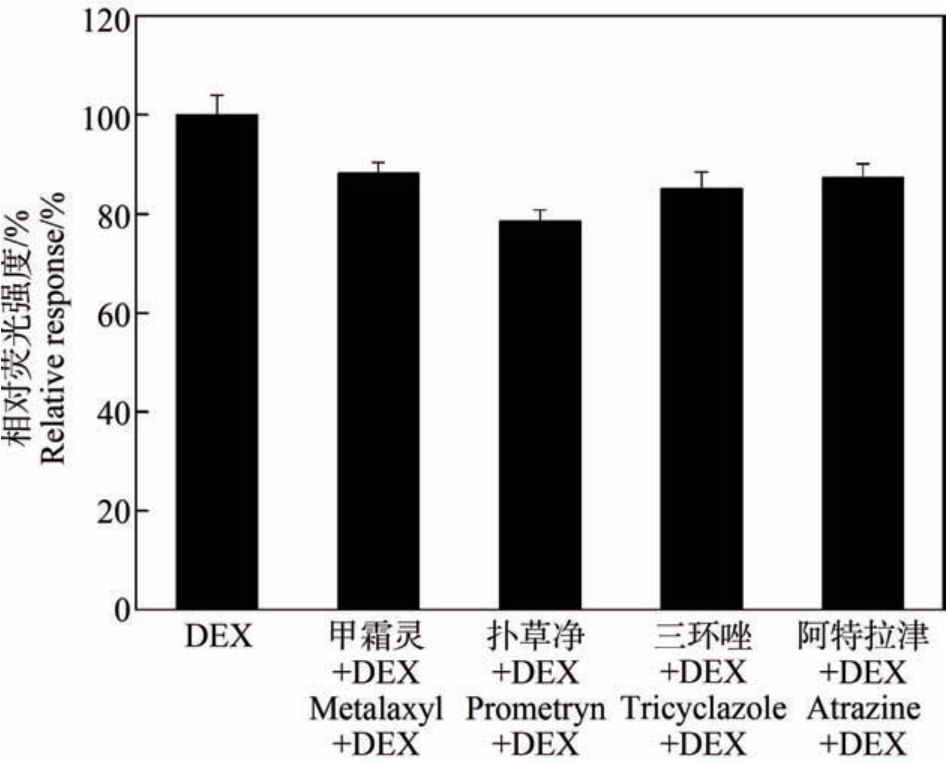
图2 测试物在最高浓度下的皮质激素受体拮抗反应(1×10-4 mol·L-1)
注:DEX 表示地塞米松。
Fig.2 Androgenic antagonist response at the highest concentration (1×10-4 mol·L-1)
Note: DEX stands fordexamethasone.
农药类化合物内分泌干扰效应测试结果显示,在非细胞毒性剂量下,水源水中15 种农药内分泌干扰效应测试未筛查出激素受体激动剂,雌激素受体拮抗剂1 种(环莠隆)、雄激素受体拮抗剂3 种(多效唑、戊唑醇和三环唑)、糖皮质激素受体拮抗效应剂4 种(甲霜灵、扑草净、三环唑和阿特拉津),如表4 所示。
3 讨论(Discussion)
国内外学者应用重组酵母细胞测试系统和CALUX 方法进行了大量农药类物质内分泌效应的筛查研究[12-20],所涉及的干扰效应类型主要为雌激素效应和抗雄激素效应。 方琪等[8]系统梳理了涵盖有机氯、有机磷、拟除虫菊酯、氨基甲酸酯和三唑类等多种类型的85 种EDPs 毒性效应的测试情况,结果显示EDPs 存在雌激素、雄激素和甲状腺激素等多种类型内分泌干扰效应,其中测试方法也以CALUX 技术和重组酵母测试系统应用最多。
本研究以高分辨率质谱法在引黄水源水中筛查鉴定出的三嗪类、三唑类和磺酰脲类等多种类型的农药类化合物为目标,通过体外受体结合实验对其潜在的内分泌干扰效应进行了研究。 研究共涉及15 种农药化合物,除阿特拉津外,其他均为《地表水环境质量标准》(GB 3838—2002)未列入的指标。 这些目标化合物中阿特拉津、二丁基阿特拉津、腈菌唑、戊唑醇和多菌灵等已被证实具有内分泌干扰效应(表5),已有报道中所用筛查方法的不同,筛查结果也不尽相同。 其余物质未见相关内分泌测试报道。
表5 部分农药的内分泌干扰效应
Table 5 Endocrine disrupting effects of some pesticides

分类Groups名称Chemicals测试方法Methods内分泌干扰效应Comprehensive toxicity effect活体试验In vivo test弱雌激素活性[21]Weak estrogen activity[21]三嗪类农药Triazines阿特拉津Atrazine人类重组芳香酶(CYP19)试验Human recombinant aromatase (CYP19) test诱导芳香酶活性[22]Induced aromatase activity[22]哺乳动物细胞测试系统Mammalian cell test system二丁基阿特拉津Atrazine-desethyl抑制糖皮质激素活性[23]Inhibited glucocorticoid activity[23]哺乳动物细胞测试系统Mammalian cell test system无糖皮质激素活性[23]No glucocorticoid activity[23]腈菌唑Myclobutanil人类重组芳香酶(CYP19)试验Human recombinant aromatase (CYP19) test抑制芳香酶活性[24]Inhibited aromatase activity[24]酵母测试系统Yeast testing system三唑类农药Triazoles抑制雌激素、雄激素活性[25]Inhibited estrogen and androgen activity[25]人类重组芳香酶(CYP19)试验Human recombinant aromatase (CYP19) test抑制芳香酶活性[24]Inhibited aromatase activity[24]戊唑醇Tebuconazole雄激素拮抗效应[11]Androgen antagonistic effect[11]酶联免疫测试Enzyme linked immunosorbent assay降低雌激素水平,增加雄激素水平[25]Decreased estrogen and increased androgen[25]酵母测试系统Yeast testing system酵母测试系统Yeast testing system降低孕酮的水平[26]Reduced progesterone levels[26]其他农药Other pesticides多菌灵Carbendazim哺乳动物细胞测试系统Mammalian cell test system增加雌激素及芳香酶活性[27]Increased the activity of estrogen and aromatase[27]哺乳动物细胞测试系统Mammalian cell test system无糖皮质激素活性[23]No glucocorticoid activity[23]

pounds果结试esticide com测f p应效扰干泌分内物合化类药ocrine disrupting effects o 4 农f end表lts o Resu Table 4剂抗R))拮Antagonist(G体剂受动素肾Glucocorticoid receptor (GR激Agonist激质皮腺-1)上/(mol·L -1)度浓Concentration/(mol·L拮剂抗)Antagonist R)剂(A 动体激Agonist受素激雄Androgen receptor (AR-1)/(mol·L浓Concentration/(mol·L -1)度 剂抗拮Antagonist)R)剂(E 动体激Agonist受素激雌Estrogen receptor (ER-1)/(mol·L浓Concentration/(mol·L -1)度称icals名Chem分Groups类+--4 10---4 10---5 Atrazine10津拉特阿-----4 10-4 10-----4 10-4 10-----4 10-4 10 Atrazine-desethyl-desethyl eton津Terbum拉特 通阿 丁基 特丁 基二 乙去药农类三嗪Triazines++---4 10-4 10-+---4 10-4 10 e ----4 10-4 etryn Prom净Tricyclazole10草 唑扑 环三-----4 10-4 10+----4 10-4 10-----4 10-5 Paclobutrazol Myclobutanil10唑 唑效 菌多 腈药唑Triazoles 农类 三---------4 10-6 10-4 10-5 10+--------4 10-6 10-4 10-5 10---------4 Tebuconazole10-5 Azoxystrobin10-5 10-4 10 Carbendazim醇ethyl酯Bensulfuron m灵唑菌隆菌戊嘧磺嘧 多苄磺Sulfonylureas 药农类脲--+----4 10-6 10-4 10-------4 10-6 10-4 10+------4 Cycluron10-5 10-4 10 Ethirimol Metalaxyl隆 酚莠嘧灵环乙霜甲药农他其Other pesticides---4 10---4 10---5。Nicosulfuron10应效强增光荧现出中试测应反抗拮隆 示磺嘧烟;“e”表应效种此出检未示-”表-” indicates that the effect is not detected; “e” indicates the fluorescence enhancement effect in the antagonistic reaction test.:“注Note: “
生物学筛查(ER-CALUX)结果显示,所有测试物均未表现出雌激素受体激动剂活性,不能排除某些农药对雌激素的干扰不是通过受体激活途径完成的,如阿特拉津。 据报道,阿特拉津的雌激素活性是通过抑制cAMP 特异性磷酸二酯酶-4 发挥作用,而不是通过激活或与经典ER 结合的途径实现[28]。 测试结果显示环莠隆具有雌激素拮抗活性,而扑草净与E2 共暴露时荧光信号增强,但单独暴露时荧光信号无明显变化。 Wielogórska 等[13]在拟除虫菊酯类杀虫剂的雌激素受体拮抗剂测试中也发现荧光信号反应增强。 与ER-CALUX 测试结果相似,本研究中AR-CALUX 测试未筛查到雄激素激动剂活性物质。 多效唑、戊唑醇和三环唑3 种物质具有显著的雄激素受体拮抗活性,且在试验浓度下,这些化学物质对雄激素受体的拮抗效应呈现出剂量依赖性。
目前对农药内分泌干扰的研究主要集中在雌激素和雄激素的作用上,而对其他非性激素功能的研究较少,如孕烷X 受体和GR 介导的活性。 本研究对糖皮质激素受体激动剂和拮抗剂进行了筛选,所测试农药均未表现出GR 激动剂的活性,阿特拉津、扑草净、三环唑和甲霜灵4 种物质检测到弱糖皮质激素受体拮抗作用。 Zhang 等[23]采用CHO-K1 细胞hGRα 的双荧光素酶报告基因法证明了阿特拉津具有GR 拮抗作用,而去乙基阿特拉津和多菌灵对GR没有活性,与本研究结果一致。
对水源水中筛查到的15 种农药内分泌干扰效应的测试结果显示,半数以上的测试物存在雌激素受体、雄激素受体或糖皮质激素受体拮抗效应。 环境中往往是多种内分泌干扰物并存条件下的综合效应,未来研究应重点关注低剂量联合暴露下的综合效应以及农药中间体和有毒代谢物的毒性效应,对生物体产生作用的机理研究等。 生物检测技术以生物效应为目标导向,是内分泌干扰类农药识别监测与风险评价的有效方法,但生物方法往往难以对目标物定量,因此应结合化学和仪器测试进行综合性的科学评价,形成以生物检测为导向、化学和仪器分析技术为支撑的内分泌干扰效应导向分析方法。
通讯作者简介:贾瑞宝(1968—),男,博士,研究员,主要研究方向为供排水监测及饮用水安全保障技术。
[1]Sun J, Luo Q, Wang D H, et al. Occurrences of pharmaceuticals in drinking water sources of major river watersheds, China [J]. Ecotoxicology and Environmental Safety,2015,117:132-140
[2]de Jesus Gaffney V, Almeida C M, Rodrigues A, et al.Occurrence of pharmaceuticals in a water supply system and related human health risk assessment [J]. Water Research,2015,72:199-208
[3]Blair B D, Crago J P, Hedman C J, et al.Pharmaceuticals and personal care products found in the Great Lakes above concentrations of environmental concern [J]. Chemosphere,2013,93(9):2116-2123
[4]Simonyan A,Gabrielyan B,Minasyan S,et al.Genotoxicity of water contaminants from the basin of Lake Sevan,Armenia evaluated by the comet assay in gibel carp (Carassius auratus gibelio) and Tradescantia bioassays [J].Bulletin of Environmental Contamination and Toxicology,2016,96(3):309-313
[5]Malakahmad A, Manan T S B A, Sivapalan S, et al.Genotoxicity assessment of raw and treated water samples using Allium cepa assay:Evidence from Perak River,Malaysia [J]. Environmental Science and Pollution Research International,2018,25(6):5421-5436
[6]Dhaini H R, Nassif R M. Exposure assessment of endocrine disruptors in bottled drinking water of Lebanon [J].Environmental Monitoring and Assessment,2014,186(9):5655-5662
[7]韩志华, 卜元卿, 单正军, 等. 内分泌干扰类农药生物检测技术的研究进展[J]. 生态毒理学报, 2011, 6(5):449-458
Han Z H, Bu Y Q, Shan Z J, et al. Review on bioassay technology of endocrine disrupting pesticides [J]. Asian Journal of Ecotoxicology, 2011, 6(5): 449-458 (in Chinese)
[8]方琪, 马彦博, 张思远, 等. 农药内分泌干扰效应研究进展[J]. 生态毒理学报,2017,12(1):98-110
Fang Q, Ma Y B, Zhang S Y, et al. Research progress in endocrine disrupting effects of pesticides [J]. Asian Journal of Ecotoxicology,2017,12(1):98-110 (in Chinese)
[9]Streck G. Chemical and biological analysis of estrogenic,progestagenic and androgenic steroids in the environment[J]. Trends in Analytical Chemistry,2009,28(6):635-652
[10]张诺, 孙韶华, 王明泉, 等. 荧光素酶表达基因法(CALUX)用于二噁英检测的研究进展[J]. 生态毒理学报,2014,9(3):391-397
Zhang N, Sun S H, Wang M Q, et al. Research progress of dioxins detection using chemical-luciferase gene expression (CALUX) [J]. Asian Journal of Ecotoxicology,2014,9(3):391-397 (in Chinese)
[11]Seeger B,Klawonn F,Bekale B N,et al.The ability of the YAS and AR CALUX assays to detect the additive effects of anti-androgenic fungicide mixtures [J].Toxicology Letters,2016,241:193-199
[12]逯南南, 许燕, 赵清华, 等. 三氯乙烯和四氯乙烯的细胞毒性及氧化应激机制研究[J]. 生态毒理学报, 2018,13(6):326-332
Lu N N, Xu Y, Zhao Q H, et al.Cytotoxicity of TCE and PCE to CHO cells and the oxidative stress mechanism [J].Asian Journal of Ecotoxicology, 2018, 13(6): 326-332(in Chinese)
[13]Wielogórska E, Elliott C T, Danaher M, et al. Endocrine disruptor activity of multiple environmental food chain contaminants [J]. Toxicology in Vitro: An International Journal Published in Association with BIBRA, 2015, 29(1):211-220
[14]van der Linden S C,Heringa M B,Man H Y,et al.Detection of multiple hormonal activities in wastewater effluents and surface water, using a panel of steroid receptor CALUX bioassays [J].Environmental Science & Technology,2008,42(15):5814-5820
[15]Orton F, Rosivatz E, Scholze M, et al. Widely used pesticides with previously unknown endocrine activity revealed as in vitro antiandrogens [J].Environmental Health Perspectives,2011,119(6):794-800
[16]郭佳, 杨雪, 张灿, 等. 呋喃丹和氯氰菊酯的类雌激素活性研究[J]. 农药,2012,51(2):105-107,150
Guo J,Yang X,Zhang C,et al.Exploring the estrogenicity of carbofuran and cypermethrin [J]. Agrochemicals,2012,51(2):105-107,150 (in Chinese)
[17]Mnif W, Hassine A I, Bouaziz A, et al. Effect of endocrine disruptor pesticides:A review[J].International Journal of Environmental Research and Public Health,2011,8(6):2265-2303
[18]陈秀云, 祝娉婷, 孙鹏玲, 等. 基因重组酵母测评系统在筛选环境样品雌激素活性中的应用研究[J]. 环境与健康杂志,2009,26(11):965-969
Chen X Y, Zhu P T, Sun P L, et al. Application of gene recombinant yeast cell in screening to environmental estrogen [J]. Journal of Environment and Health, 2009, 26(11):965-969 (in Chinese)
[19]Kojima H,Sata F,Takeuchi S,et al.Comparative study of human and mouse pregnane X receptor agonistic activity in 200 pesticides using in vitro reporter gene assays [J].Toxicology,2011,280(3):77-87
[20]Song Q,Zhang Y,Yan L,et al.Risk assessment of the en-docrine-disrupting effects of nine chiral pesticides [J].Journal of Hazardous Materials,2017,338:57-65
[21]Cooper R L, Stoker T E, Tyrey L, et al. Atrazine disrupts the hypothalamic control of pituitary-ovarian function [J].Toxicological Sciences: An Official Journal of the Society of Toxicology,2000,53(2):297-307
[22]Sanderson J T,Seinen W,Giesy J P,et al.2-Chloro-s-triazine herbicides induce aromatase (CYP19) activity in H295R human adrenocortical carcinoma cells: A novel mechanism for estrogenicity? [J]. Toxicological Sciences:An Official Journal of the Society of Toxicology,2000,54(1):121-127
[23]Zhang J Y, Zhang J, Liu R, et al. Endocrine-disrupting effects of pesticides through interference with human glucocorticoid receptor [J]. Environmental Science & Technology,2016,50(1):435-443
[24]Trösken E R, Scholz K, Lutz R W, et al. Comparative assessment of the inhibition of recombinant human CYP19(aromatase) by azoles used in agriculture and as drugs for humans [J]. Endocrine Research,2004,30(3):387-394
[25]Hurst M R, Sheahan D A. The potential for oestrogenic effects of pesticides in headwater streams in the UK [J].Science of the Total Environment,2003,301(1-3):87-96
[26]Rieke S, Koehn S, Hirsch-Ernst K, et al. Combination effects of(tri)azole fungicides on hormone production and xenobiotic metabolism in a human placental cell line [J].International Journal of Environmental Research and Public Health,2014,11(9):9660-9679
[27]Morinaga H,Yanase T,Nomura M,et al.A benzimidazole fungicide, benomyl, and its metabolite, carbendazim, induce aromatase activity in a human ovarian granulose-like tumor cell line (KGN) [J]. Endocrinology, 2004, 145(4):1860-1869
[28]Kucka M,Pogrmic-Majkic K,Fa S,et al.Atrazine acts as an endocrine disrupter by inhibiting cAMP-specific phosphodiesterase-4 [J]. Toxicology and Applied Pharmacology,2012,265(1):19-26