赣南某钨矿区土壤重金属污染生态风险评价
Ecological risk assessment of heavy metals pollution in a tungsten mine soil in south of Jiangxi Province
-
摘要: 对赣南某钨矿区及周边农田土壤重金属的污染进行调查,分析了2个尾矿堆积区及17个农田采样区土壤中重金属Pb、Cr、Mn、Zn、Cu和Cd的总量和形态,采用潜在生态危害指数法和RAC风险评价法对研究区域土壤重金属的生态风险进行评价.结果表明,尾矿堆积区尾砂中6种重金属远远超过江西省土壤背景值和国家土壤环境质量二级标准,土壤重金属浓度水平分布表现为尾矿堆积区> 尾矿附近农田土壤> 矿区周边农田土壤.形态分析结果显示矿区农田土壤中6种重金属主要以可还原态、可氧化态和残渣态存在,尾矿附近农田土壤重金属Pb、Mn、Zn和Cd酸溶态占比均大于10%,具有较强的生物有效性.潜在生态危害指数评价表明研究区域表层(0—20 cm)和中层(20—40 cm)土壤存在极强的重金属生态危害,Cd是土壤重金属潜在生态风险主要的贡献因子.RAC风险评价结果表明,尾矿附近农田0—40 cm土壤中Zn和Cd存在的生态风险较大,而矿区周边农田0—40 cm土壤中Cd和Mn存在的生态风险相对较大.综合基于重金属总量分析的潜在生态风险指数和基于重金属有效态的RAC评价结果,Cd、Zn和Mn的污染是研究区域土壤污染风险控制需要关注的重点.Abstract: The ecological risk of 6 heavy metals (Pb, Cr, Mn, Cu, Zn, and Cd) of contaminated soil was evaluated in a tungsten mine area located in Gannan area, Jiangxi province, China. Soil samples were collected from 2 tailings disposal sites and 17 farmland sites in the survey area. Contents and species of 6 heavy metals were analyzed, and ecological risk was assessment with the methods of potential ecological risk index and risk assessment code (RAC). The results indicate the contents of all 6 heavy metals in tailings disposal area were much higher than the background values of Jiangxi province soils and the secondary standard of soil environmental quality. The concentrations of heavy metals in different areas followed tailings sites> farmland sites nearby the tailings> farmland sites surrounding mining areas. According to the results of speciation analysis, the acid-soluble fractions of Pb, Mn, Zn, and Cd were over than 10% in all the farmland sites nearby the tailings, which would lead to high bioavailability. The potential ecological risk assessment showed that there were extremely high ecological risks in the top soils (0—20 cm) and 20—40 cm soils of the study area, and Cd was the main contribution factor. According to the analysis of RAC, the ecological risk of Zn and Cd dominated in 0—40 cm soils of farmland nearby the tailing, while the ecological risks of Cd and Mn were relatively high in 0—40 soils of farmland surrounding the mining area. Combined with the two assessment results, Cd, Zn and Mn pose higher potential biological risk than Pb, Cu and Cr in the study area.
-
Key words:
- tungsten mine area /
- soil contamination /
- heavy metal /
- risk assessment
-
作为地表水最小的单位部分和最基本的生态细胞,小微水体在行洪排涝、灌溉供水、养殖及人居生态环境质量保障等方面发挥着重要的基础性功能和作用[1]。然而,由于城镇小微水体污染源的多样性、居民环保意识不足以及治理体系不够完善,加之小微水体自身具有流动性差、自净能力弱、封闭性强等特点,城镇小微水体极易出现富营养化和水体黑臭现象,严重影响居民生活健康与水生态安全[2]。因此,城镇小微水体微污染水治理已成为我国“十四五”水环境治理重点。
在现有的湖泊、河流治理修复技术中,物理技术见效较快,但存在治标不治本的特点;化学技术需要添加外源试剂,容易造成二次污染;生态工程及生物技术具有应用范围广、环境友好、可持续修复性强、运行投资相对较省等优点[3]。其中,生物膜技术可形成紧密与多样化的微生物膜结构,容易聚集较高浓度的生物量,可有效减少处理工艺占地面积、增加处理负荷,在受污染水体治理修复中的应用研究日趋增多。薛同站等[4]采用改性中空纤维膜曝气生物膜(membrane aeration bioreactor,MABR)进行了为期78 d的中试实验,结果表明,MABR技术对河水主要污染物具有较好的去除效果,有助于小型河流生态功能的修复,可用于低流速河流和黑臭水体的污染治理。杨垒等[3]利用外源菌剂构建了强化耦合生物膜系统(enhanced hybrid biofilm reactor,EHBR)治理城市明渠污染水体,结果表明,通过增氧曝气及EHBR膜处理,COD值、NH4+-N及总氮 (total nitrogen,TN)浓度分别下降了55%、93%和94%。王荣昌等[5]将自主设计的悬浮载体生物膜反应器(suspended carrier biofilm reactor,SCBR)应用于清华大学万泉河的修复,当水力停留时间控制在1.0 h左右时,SCBR对COD和NH4+-N的平均去除率可分别达到57%和76%。总之,生物膜技术在城镇小微水体原位修复中具有一定的技术优势和应用前景,但由于自然环境的复杂性和对生物膜净化机理(特别是污染物去除的微生物学机制)的研究还不够深入透彻,其大规模实际应用依然任重而道远。
微生物是生物膜发挥污染物降解功能的核心部件。目前,填料表面微生物的附着挂膜过程分为自然成膜和人工接种强化成膜2种方式。自然挂膜方式所形成的生物膜主要为土著微生物,不存在与外源微生物的竞争和生态风险问题,然而该方式成膜周期长且存在生物膜不易形成等弊端;人工接种强化成膜方式可快速形成具有降解功能的生物膜,但外源微生物可能与土著微生物存在竞争关系而不能稳定存在甚至被演替,导致生物膜处理性能降低甚至失效[6]。事实上,天然生物膜(周丛生物)广泛存在于自然水体中,如水生植物根叶表面、消落带砾石表面、河道混凝土岸坡表面等[7-8]。笔者认为,这些原生生物膜可能是生物技术应用过程中更为理想的接种源,在强化水体污染物降解的同时,还可以有效防范生态环境风险、提高系统运行效率。因此,本实验以小微水体混凝土岸坡表面生物膜为研究对象,重点考察光照强度、污染物(氮、磷)浓度对复合生物膜强化微污染水处理效能的影响,解析复合生物膜多路径脱氮除磷机理及微生物群落结构特征,为城镇小微水体微污染水的有效治理提供理论依据。
1. 材料与方法
1.1 实验材料与试剂
实验所用水样以南京林业大学校内紫湖溪(N: 32.07°;E: 118.82°)溪水为基底进行调配,紫湖溪溪水原始水质如下:51~60 mg·L−1 COD,0.08~0.29 mg·L−1 NH4+-N,0.11~0.32 mg·L−1 NO3−-N,0.03~0.04 mg·L−1 NO2−-N,0.21~0.65 mg·L−1 TN,0.003~0.010 mg·L−1 PO43--P,6.65~8.36 mg·L−1 O2,pH为7.71~8.03。为考察光照强度、NH4+-N及PO43--P浓度对复合生物膜去除污染物的影响,将光照强度分别设置为4 000、6 000、8 000 Lux,利用NH4Cl和K2HPO4将原水NH4+-N及PO43--P质量浓度分别调节至2、6、10 mg·L−1和0.5、1、2 mg·L−1,并以此设计正交实验(表1)。实验所用其他试剂均为分析纯,实验用水为超纯水。
表 1 正交实验表Table 1. Orthogonal experimental table组别 光照强度/Lux NH4+-N浓度/(mg·L−1) PO43--P浓度/(mg·L−1) T1 8 000 2 0.5 T2 8 000 6 1 T3 8 000 10 2 T4 6 000 2 1 T5 6 000 6 2 T6 6 000 10 0.5 T7 4 000 2 2 T8 4 000 6 0.5 T9 4 000 10 1 1.2 实验装置及方法
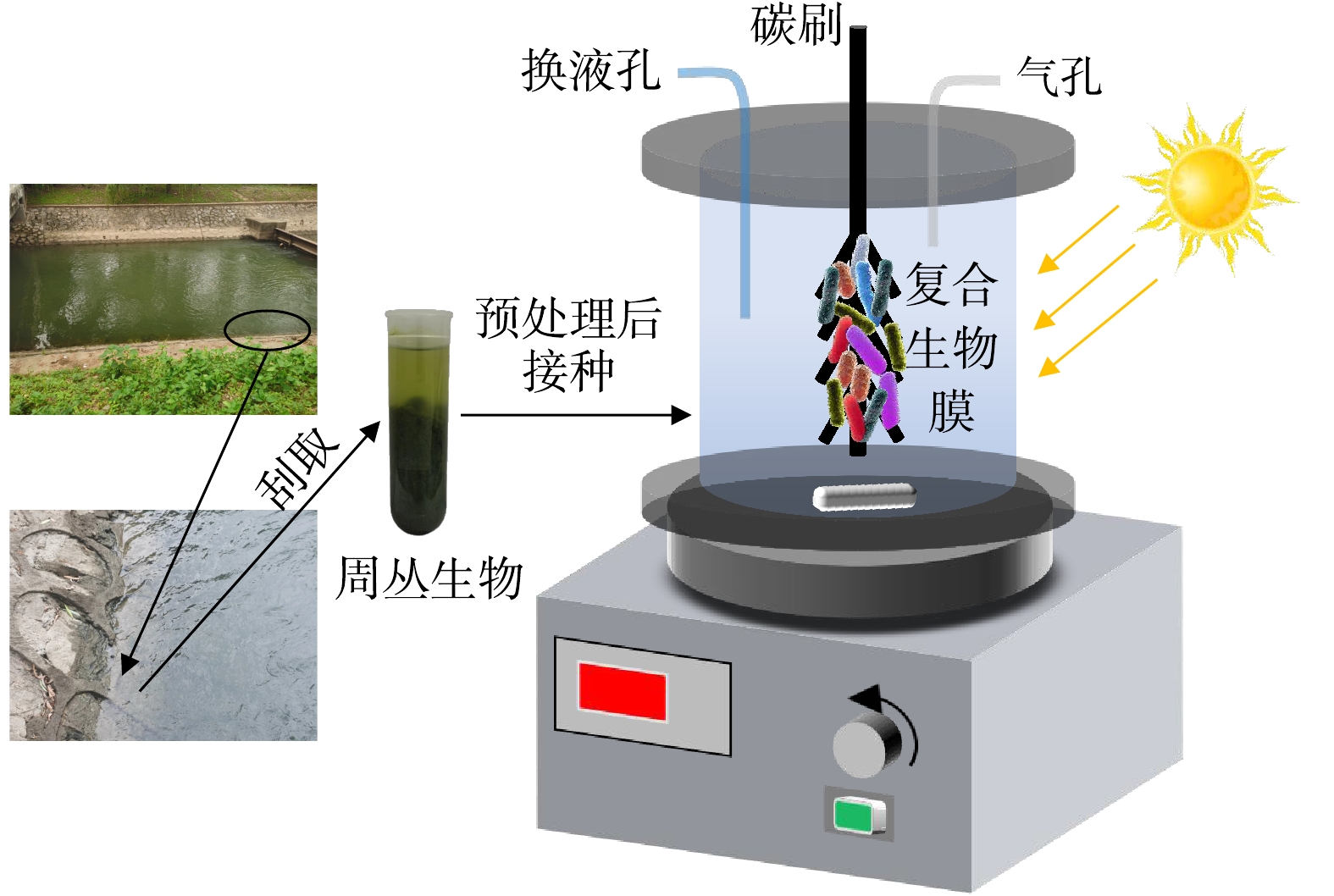
如图1所示,圆柱体实验装置由有机玻璃制成,其高为10 cm,直径为8 cm,有效容积为500 mL,反应装置顶部设置盖板,盖板设置换液孔、气孔及载体安装孔道。周丛生物膜载体为碳纤维刷,刷毛直径为3 cm,刷毛长度为5 cm,总长度为15 cm,碳纤维刷在使用之前先用1 mol·L−1 HCl溶液浸泡12 h,然后用超纯水彻底冲洗,接着再用1 mol·L−1 NaOH溶液浸泡12 h,之后用超纯水彻底冲洗,然后用95%乙醇溶液浸泡12 h,随后在超纯水中浸泡12 h,最后将碳纤维刷置于60 ℃鼓风干燥箱内烘干备用。实验装置接种所用的周丛生物膜取自紫湖溪混凝土岸坡(图1),将周丛生物膜置于摇床中振荡分散,将分散后的周丛生物悬浊液过100目筛,以去除水生植物凋落物和较大的无机碎屑等,然后在4 ℃下以8 000 r·min−1将过筛后的周丛生物悬浊液离心10 min,弃去上清液后向离心管中加入超纯水再次将周丛生物重悬,最后取15 mL重悬污泥接种于实验组反应器(即复合生物膜体系)。此外,另取实验室培养的好氧活性污泥15 mL构建对照组反应器(即单一异养生物膜体系)。重悬污泥和好氧活性污泥的污泥浓度值(mixed liquid suspended solids,MLSS)均为3 000 mg·L−1。
在挂膜启动期间采用LED灯对实验组反应器进行补光照明,光照强度设置为10 000 Lux,连续照明;对照组反应器用锡纸包裹进行遮光并进行曝气,溶解氧(dissolved oxygen,DO)控制在4.0 mg·L−1左右。挂膜期间实验组和对照组反应器进水均为紫湖溪原水,采用磁力搅拌器对反应溶液进行搅拌混匀以免出现短流,每隔48 h换水一次,在至少连续3个换水周期反应器出水均能达到相似污染物去除率时,认为系统挂膜成功。系统挂膜成功后,将紫湖溪原水NH4+-N及PO43--P质量浓度分别调节至5. 0和1.5 mg·L−1,实验组和对照组其他运行条件保持不变,反应器连续运行5个换水周期(48 h),以此考察单一异养生物膜和复合生物膜污染物处理效能的差异性。
之后按照表1所示正交实验表考察光照强度、污染物(氮、磷)浓度对复合生物膜除污性能的影响,实验阶段反应器采用续批式模式运行,换水周期为48 h,每个工况下反应器均运行9个周期(3个适应周期+6个稳定周期),参考自然条件光照变化规律光暗比设置为12 h:12 h。在典型周期污染物去除过程分析中,作为反应器进水,紫湖溪原水NH4+-N及PO43--P质量浓度分别调节至10.0和2.0 mg·L−1,分别在0、12、24、36、48 h对实验组反应器出水进行采样,测定NH4+-N、NO3−-N、NO2−-N、PO43--P、DO质量浓度及pH。为解析复合生物膜的多路径脱氮除磷过程,在主体实验结束后,裁取一部分附着生物膜的碳纤维进行批次活性实验测试,包括硝化(Ⅰ)、反硝化(Ⅱ)、厌氧氨氧化(Ⅲ)、微藻/光合细菌同化及微生物诱导磷酸盐沉淀(Ⅳ),该部分实验采用模拟废水,其主要成分浓度见表2。在第Ⅰ组实验过程中,DO控制在4.0~4.5 mg·L−1,其3#和4#阶段均投加0.1 g·L−1自养硝化抑制剂烯丙基硫脲(allylthiourea,ATU);在第Ⅱ组实验中,1#和2#阶段DO控制在4.0~4.5 mg·L−1,且在1#阶段另投加1 mmol·L−1氯酸盐(NO2−—N抗氧化剂),3#和4#阶段则控制为缺氧条件;第Ⅲ组实验在厌氧条件下进行;在第Ⅳ组实验过程中,光照强度控制在8 000 Lux,在3#阶段另投加20 μmol·L−1二氯苯基二甲脲(光合抑制剂)。如无特殊说明,上述所有实验均在(25±1) ℃的室温下进行。
表 2 复合生物膜脱氮除磷路径探究实验模拟废水水质Table 2. Simulated wastewater quality used in the exploration experiment of nitrogen and phosphorus removal pathways through composite biofilm实验组别 实验阶段 NH4+-N/(mg·L−1) NO2−-N/(mg·L−1) NO3−-N/(mg·L−1) PO43--P/(mg·L−1) NaHCO3/(g·L−1) 乙酸钠/(g·L−1) Ca2+/(mmol·L−1) Ⅰ 1# 5.0 — — — 0.2 — — 2# 5.0 — — — — 0.2 — 3# 5.0 — — — — 0.2 — 4# 5.0 — — — — — — Ⅱ 1# — 5.0 — — — 0.2 — 2# — — 5.0 — — 0.2 — 3# — 5.0 — — — 0.2 — 4# — — 5.0 — — 0.2 — Ⅲ 1# 5.0 6.6 — — 0.2 — — Ⅳ 1# 5.0 — — 1.5 0.2 — — 2# 5.0 — — 1.5 0.2 — 1.0 3# 5.0 — — 1.5 0.2 — 1.0 注:“—”表示无数据。 1.3 检测指标及方法
实验相关水质指标的检测与分析过程参照《水和废水监测分析方法》(第4版)中规定的标准方法,主要的测试分析指标包括COD、NH4+-N、NO2−-N、NO3−-N、TN、PO43--P、pH、DO、Ca2+、总铁(total ferrum, TFe)等。正交实验结果采用SPSS 22.0进行分析。实验结束后,将周丛生物接种污泥与实验组生物膜样品在4 °C下以10 000 r·min−1的转速离心10 min,然后将离心后的样品保存在-80 °C冰箱12 h。微生物DNA提取和PCR扩增过程均交由武汉贝纳科技有限公司完成。本研究利用16S rDNA/ITS/18S rDNA扩增子高通量测序分析复合生物膜的微生物群落组成,其中细菌引物组为338F(ACTCCTACGGGAGGCAGCA)和806R(GGACTACNVGGGTWTCTAAT),真菌引物组为ITS3(GCATCGATGAAGAACGCAGC)和ITS4(TCCTCCGCTTATTGATATGC),真核生物(微藻)引物组为547F(CCAGCASCYGCGGTAATTCC)和V4R(ACTTTCGTTCTTGATYRA)。测序完成后,原始数据经过数据拆分后得到各样本原始序列数据,各样本原始序列数据经过Reads拼接、tags过滤、去嵌合体等步骤得到有效数据(Clean reads),Clean reads在利用DADA2算法降噪后通过UPARSE 软件进行序列分析,以100%相似度进行ASV(Amplicon Sequence Variants)聚类,然后计算样本α和β多样性,评估样本间多样性差异,最后根据NCBI本地BLAST数据库进行物种注释,得到样品在门和属分类水平下的微生物组成及其相对丰度。原始序列数据已上传至CNCB数据库,登录号为CRA019389。实验数据采用Origin 9.0软件进行绘图。
2. 结果与讨论
2.1 单一异养生物膜和复合生物膜污染物处理效能分析
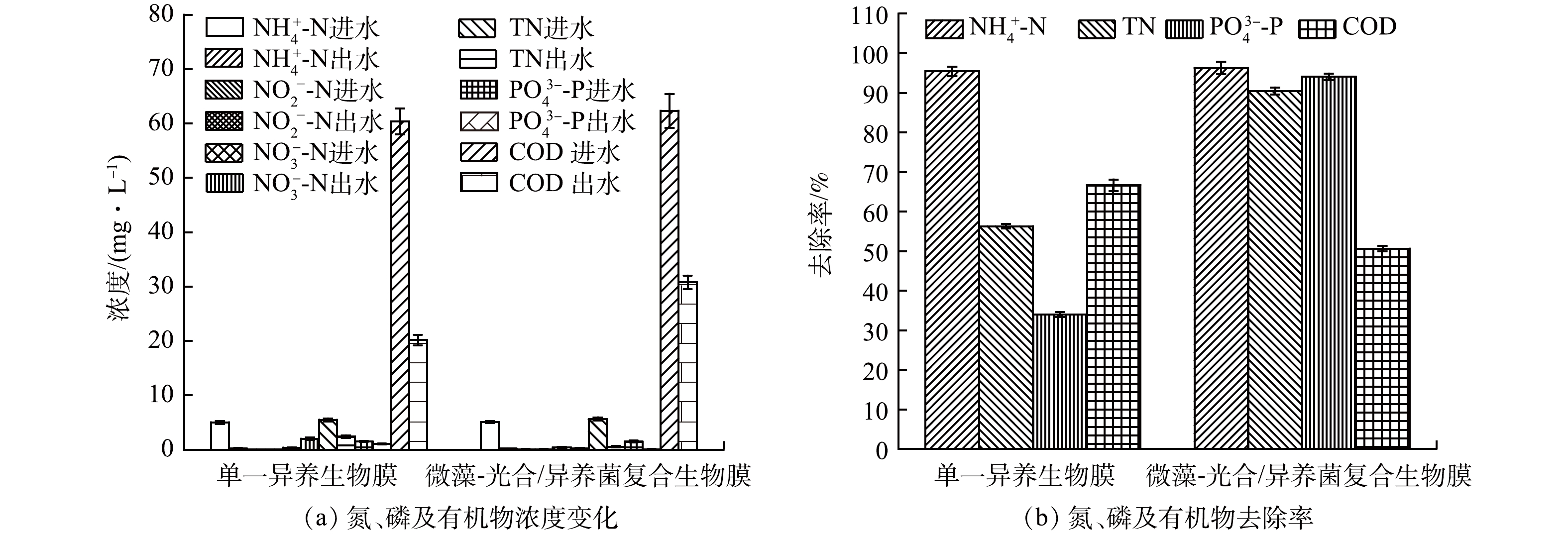
由图2(a)可知,当单一异养生物膜与微藻-光合/异养菌-真菌复合生物膜用于城乡小微水体微污染水处理时,NH4+-N质量浓度分别可从5.02 mg·L−1和5.09 mg·L−1降低至0.23 mg·L−1和0.19 mg·L−1,其相应去除率分别可达95.42%和96.27%(图2(b))。NO2−-N质量浓度基本保持不变,维持在0.06~0.08 mg·L−1,NO3−-N质量浓度分别从进水的0.36 mg·L−1 (单一异养生物膜)和0.39 mg·L−1 (复合生物膜)变化为出水的2.01 mg·L−1和0.21 mg·L−1 (图2(a))。由于NO3−—N的积累,单一异养生物膜体系出水TN质量浓度为2.40 mg·L−1,而复合生物膜体系出水TN质量浓度仅为0.54 mg·L−1 (图2(a)),其相应去除率分别为56.28%和90.43%(图2(b))。在磷去除方面,单一异养生物膜体系和复合生物膜体系PO43--P质量浓度分别从1.53 mg·L−1和1.51 mg·L−1降低至1.01 mg·L−1和0.09 mg·L−1 (图2(a)),其相应去除率分别为33.99%和94.04%(图2(b))。单一异养生物膜体系和复合生物膜体系出水COD值分别为20.16 mg·L−1和30.79 mg·L−1 (图2(a)),去除率分别为66.60%和50.60%。总体来讲,相比于单一异养生物膜体系,复合生物膜对TN和PO43--P的去除效率分别提高了34.15%和60.05%。
上述研究结果表明,在复合生物膜体系中NH4+-N和NO2−-N的转化去除并非小微水体微污染水生物处理的限速步骤,其原因在于自养硝化细菌、异养硝化细菌、异养硝化真菌、厌氧氨氧化菌及光合微生物可能共存于复合生物膜中,进而有效驱动了NH4+-N和NO2−-N的转化去除[9]。此外,通过对比单一异养生物膜和复合生物膜的NH4+-N去除情况,推测微生物硝化过程可能在复合生物膜氮转化中发挥了核心作用。单一异养生物膜体系NO3−-N的积累可能缘于电子供体不足。虽然进水理论碳氮比(COD/TN)约为12左右,但由于进水碳源多为难降解有机物[10],加之异养硝化、好氧异养等过程对碳源的竞争[11],因此造成反硝化不充分及NO3−-N的积累。微污染水中的铁、硫等元素可以驱动NO3−-N的还原[12],然而由于单一异养生物膜体系的高DO(4.0 mg·L−1)环境,铁、硫元素基本处于氧化状态,此时自养反硝化作用可能极为微弱。相比于单一异养生物膜,复合生物膜的高效脱氮主要得益于额外碳源的补充。先前的研究表明,真核微藻等光合微生物可以将CO2转化为有机物,并将其作为碳源提供给反硝化菌[13]。与此同时,光合作用驱动的有机物合成可能造成了复合生物膜COD去除效率的降低。
单一异养生物膜体系较低的PO43--P去除效率表明聚磷菌的同化作用在贫营养条件下较弱。而在复合生物膜中,光合微生物的同化以及微生物诱导磷酸盐沉淀(biologically induced phosphate precipitation, BIPP)过程可能极大地促进了磷的去除。ZHANG等[9]研究表明,微藻的光合作用不仅实现了磷的同化去除,而且有效提升了反应体系溶液的pH,在钙离子存在情况下,PO43--P同时以羟基磷灰石的形式被沉淀去除,微藻同化与BIPP最终承担了大约63.8~70.9%的磷去除量。本研究进水TFe浓度和Ca2+质量浓度分别为10.7 μmol·L−1和600 μmol·L−1左右,据此推测CaP可能是BIPP的主要产物。此外,磷除了可以通过构建细胞有机成分(如磷脂)而被微藻等光合微生物正常吸收外,还可以通过多聚磷酸盐颗粒的形式被光合微生物超量吸收[14],这可能进一步促进磷的高效去除。综上所述,周丛生物可以作为城乡小微水体微污染水生态修复的良好接种源。相比于外源接种物,原生周丛生物可在强化水体污染物降解的同时,达成有效防范生态环境风险发生的目的,这对于城乡水生态环境的可持续保护具有重要的现实意义。
2.2 复合生物膜系统正交实验结果分析
由表3可知,在不同光照强度、NH4+-N及 PO43--P浓度条件下,复合生物膜对NH4+-N、TN、PO43--P及COD的去除率分别为83.1%~98.2%、69.9%~94.1%、77.3%~98.2%及37.9%~53.3%。正交实验的极差分析结果表明(表4),对于城乡小微水体微污染水中NH4+-N、TN、PO43--P及COD去除效果的影响程度而言,光照强度> NH4+-N浓度> PO43--P浓度,此结果表明光照强度对复合生物膜处理性能影响最大;从方差分析结果来看(表4),P(光照强度)均小于0.05,对各项污染物的去除影响显著,而NH4+-N和PO43--P浓度对复合生物膜的处理性能无显著影响。去除NH4+-N和TN对应的最佳光照强度水平为6 000 Lux,去除PO43--P和COD对应的最佳光照强度水平分别为8 000 Lux和6 000 Lux。一方面,光照可影响微藻及光合菌的生长代谢,对氮、磷的吸收产生直接影响;另一方面,光合微生物产生的O2可用于硝化、好氧异养代谢过程,强化NH4+-N的转化与有机物的降解[15]。但光照强度过高,有可能对硝化细菌产生抑制作用并造成有机物的部分累积[9]。再者,过高的DO浓度可能会对反硝化过程产生不良影响,造成TN去除率的降低。随着光照强度的提升,磷的去除率不断提高,这可能是由于光合作用对溶液pH的推升及泌氧极大地促进了BIPP及聚磷菌的好氧磷吸收过程[9, 16]。
表 3 正交实验结果Table 3. Orthogonal experimental results组别 光照强度/Lux NH4+-N /(mg·L−1) PO43--P /(mg·L−1) NH4+-N去除率/% TN去除率/% PO43--P去除率/% COD去除率/% T1 8 000 2 0.5 83.14 69.94 96.93 43.49 T2 8 000 6 1 84.63 71.85 98.23 44.71 T3 8 000 10 2 84.63 72.56 97.22 46.16 T4 6 000 2 1 94.59 87.84 86.96 51.07 T5 6 000 6 2 96.23 91.51 89.45 51.51 T6 6 000 10 0.5 98.24 94.13 86.19 53.27 T7 4 000 2 2 89.63 79.62 78.83 37.88 T8 4 000 6 0.5 90.57 81.79 80.45 40.75 T9 4 000 10 1 92.42 82.34 77.33 41.26 表 4 正交实验极差与方差分析Table 4. Orthogonal range and variance analysis项目 因素 K1 K2 K3 RK F P NH4+-N去除率 光照强度 252.4 273.48 243.75 36.66 170.750 0.006 NH4+-N浓度 267.36 245.15 249.03 7.93 7.963 0.112 PO43--P浓度 271.95 242.03 243.69 1.46 0.300 0.769 TN去除率 光照强度 214.35 273.48 243.75 59.13 300.305 0.003 NH4+-N浓度 237.4 245.15 249.03 11.63 12.046 0.077 PO43--P浓度 245.86 242.03 243.69 2.17 1.267 0.441 PO43--P去除率 光照强度 292.38 262.6 236.61 55.77 1 577.309 0.001 NH4+—N浓度 262.72 268.13 260.74 7.39 29.638 0.033 PO43-—P浓度 263.57 262.52 265.5 2.98 4.627 0.178 COD去除率 光照强度 134.36 155.85 119.89 35.96 258.029 0.004 NH4+-N浓度 132.44 136.97 140.69 8.25 13.454 0.069 PO43--P浓度 137.51 137.04 135.55 1.96 0.825 0.548 2.3 典型周期复合生物膜污染物去除过程分析
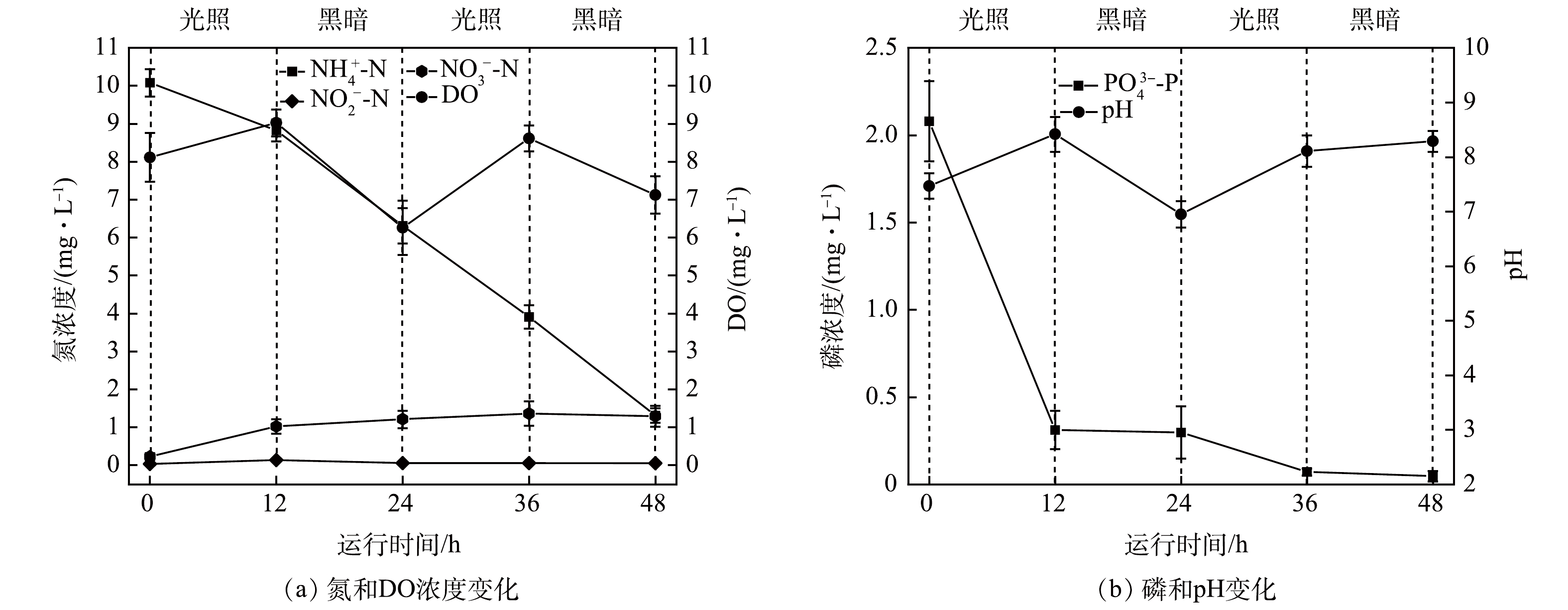
如图3(a)所示,NH4+-N在黑暗和光照条件下的去除速率差异极小,在12~24 h和24~36 h内,NH4+-N去除速率分别为0.21 mg·(L·h)−1和0.20 mg·(L·h)−1。NO2−-N未出现累积,其质量浓度在0.04~0.14 mg·L−1。NO3−-N随着运行时间的延长出现一定程度的积累,在运行末期其累积量为1.29 mg·L−1。DO随着光照/黑暗的切换呈现出波动变化趋势,但其最低浓度维持在6.0 mg·L−1以上。上述结果进一步表明,相比于光合微生物的同化去除,微生物硝化可能在NH4+-N转化过程中发挥了更为关键的作用,特别是异养硝化[9]。NO3−-N的累积一方面可能是因为较高的DO浓度抑制了反硝化相关酶的活性[17],另一方面可能是由于碳源供应不足而引起。虽然微藻光合作用可以合成一定量的有机物用于反硝化过程,但硝化和反硝化步骤可能存在一定程度的错位(即非完全同步硝化反硝化),进而导致异养硝化、好氧异养过程同反硝化过程竞争碳源,造成NO3−-N还原所需电子供体阶段性不足。此外,复合生物膜系统的厌氧氨氧化过程也可能促进了NO3−-N的积累。
如图3(b)所示,复合生物膜在最初的12 h内去除了85.1%的PO43--P,PO43--P去除速率可达0.15 mg·(L·h)−1,随后PO43--P浓度在12~48 h内缓慢下降,最终出水质量浓度为0.05 mg·L−1。pH随着光照/黑暗状态的切换也呈现出波动变化趋势,光照状态下pH可维持在8.0以上。上述结果表明,不同于硝化-反硝化菌主导的生物脱氮过程,磷可能更多是通过沉淀过程及光合微生物的同化吸收被去除[9, 18]。如在黑暗状态下(12~24 h),随着溶液pH的下降及光合微生物代谢活性的减弱,PO43--P去除速率变得极为缓慢(0.000 8 mg·(L·h)−1),也间接表明聚磷菌对磷的去除贡献较小。溶液pH的变化主要由以下过程主导:光合微生物的光合作用、硝化、反硝化及有机物氧化。研究表明,光合微生物代谢过程会消耗部分CO2,导致溶液pH的上升[9],反硝化也会产生一定量的碱度进而推高pH;而硝化和有机物氧化过程均会消耗部分碱度,造成pH的降低。在光照期间,光合微生物的代谢可能较为强烈(由图3(a)所示的DO浓度可推知),其消耗的CO2量超过了硝化及有机物氧化产生的CO2量,由此导致溶液pH不断上升。溶液pH的上升有利于CaP等沉淀的形成,进一步促进磷的去除。而在黑暗状态下,除了硝化及有机物氧化外,微藻等光合微生物的呼吸作用也会产生CO2,造成溶液pH整体呈下降趋势,在光合微生物同化吸收及磷沉淀过程几乎停滞的情况下,磷的去除势必变得缓慢。
2.4 复合生物膜脱氮除磷潜在路径分析
如图4(a)所示,在无光照条件下,当进水不含有机碳源时,无论有无ATU的存在,系统NH4+-N去除率均较低,分别为22.5%(对照组)和22.0%(存在ATU组),相应的NH4+-N去除速率分别为
0.0313 和0.0311 mg·(L·h)−1。结果表明,在复合生物膜系统中,细菌自养硝化和古菌自养硝化反应较为微弱,可能对氮素的转化去除贡献不大。当进水含有有机碳源时,系统对NH4+-N的去除率分别为97.6%(不存在ATU组)和93.8%(存在ATU组),相应的NH4+-N去除速率分别为0.14 mg·(L·h)−1和0.13 mg·(L·h)−1,表明异养硝化可能主导了复合生物膜中NH4+-N的转化过程[11]。如图4(b)所示,在无光照、缺氧及有机碳源存在条件下,复合生物膜系统中NO2−-N和NO3−-N去除率分别为92.0%和99.2%,去除速率分别为0.20 mg·(L·h)−1和0.21 mg·(L·h)−1;而在无光照、曝气及有机碳源存在条件下,复合生物膜系统依然可以实现良好的反硝化性能,其NO2−-N和NO3−-N去除速率分别可达0.16和0.21 mg·(L·h)−1。结果表明,好氧反硝化可能在复合生物膜系统脱氮过程中发挥了重要作用[9]。如图4(c)所示,在黑暗无有机碳源存在条件下,复合生物膜系统中NO2−-N和NH4+-N同步降低被消耗,其化学反应计量比约为1.26~1.32,同时生成了部分NO3−-N,表明厌氧氨氧化过程可能有助于小微水体贫营养条件下氮的去除[19]。如图4(d)所示,在无光合抑制剂存在且Ca2+供应充足的情况下,NH4+-N去除速率为0.11 mg·(L·h)−1,PO43--P去除率高达99.3%,NO2−-N和NO3−-N无明显积累;而当光合抑制剂和Ca2+同时存在时,NH4+-N去除速率仅为0.04 mg·(L·h)−1,PO43--P去除率低至10.7%;无光合抑制剂和Ca2+存在时,PO43--P去除率仅提升至33.1%。上述结果进一步表明,微藻/光合细菌对氮、磷的同化去除作用可能较为有限,然而微生物硝化强烈依赖于光合产氧过程,进而对系统氮去除产生重要影响,CaP沉淀是复合生物膜系统的主要磷汇,但该沉淀过程可能由微藻/光合细菌及钙离子共同驱动,尤其是光合作用营造的碱性溶液环境可能极大地促进了羟基磷灰石的形成[20]。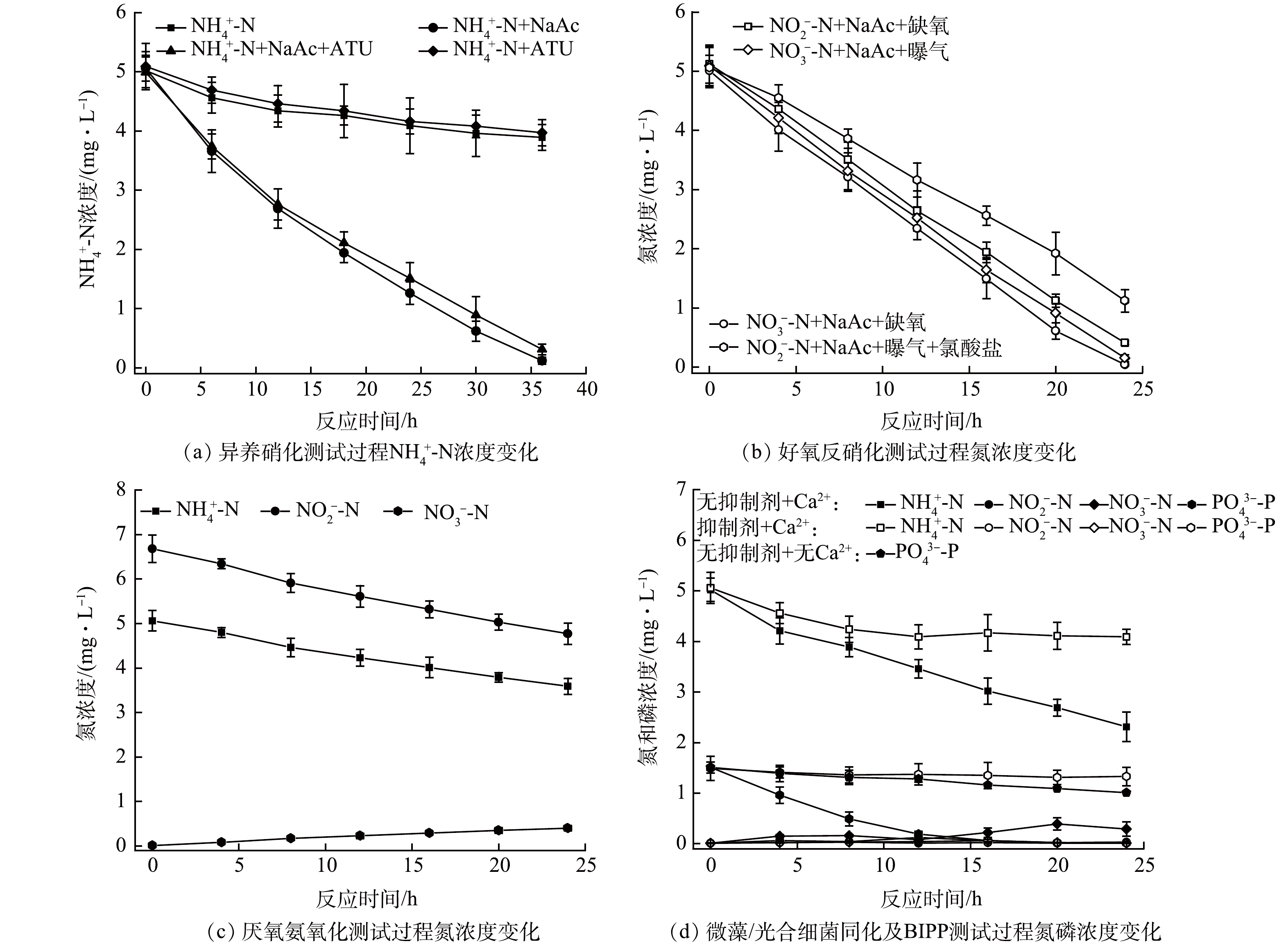 图 4 异养硝化、好氧反硝化、厌氧氨氧化、微藻/光合细菌同化及微生物诱导磷酸盐沉淀验证实验中氮和磷浓度变化Figure 4. Variations of nitrogen and phosphorus concentration in validation experiments of heterotrophic nitrification, aerobic denitrification, anaerobic ammonia oxidation, and microalgae/photosynthetic bacteria assimilation and biologically induced phosphate precipitation
图 4 异养硝化、好氧反硝化、厌氧氨氧化、微藻/光合细菌同化及微生物诱导磷酸盐沉淀验证实验中氮和磷浓度变化Figure 4. Variations of nitrogen and phosphorus concentration in validation experiments of heterotrophic nitrification, aerobic denitrification, anaerobic ammonia oxidation, and microalgae/photosynthetic bacteria assimilation and biologically induced phosphate precipitation2.5 微生物群落结构分析
如表5所示,接种污泥(周丛生物)中细菌的ACE和Chao1指数均远大于复合生物膜,表明接种污泥的细菌群落丰富度要远高于复合生物膜;接种污泥细菌的Shannon和Simpson指数分别为8.429和0.988,也大于复合生物膜的6.507和0.97,说明接种污泥的细菌群落多样性要高于复合生物膜。反观真菌、真核藻类的α多样性指数(ACE、Chao1、Shannon和Simpson指数)变化情况(表5),显示其群落丰富度和多样性保持相对稳定。造成这一变化的原因可能是:相比于紫湖溪原水水质,实验用水氮、磷浓度显著提高,而细菌在污染物去除过程中处于核心地位,尤其是氮的转化去除,因此复合生物膜中不适于“较高”污染物浓度的某些原生细菌可能会被淘洗,细菌种属将趋于集中化。此外,从α多样性指数来看,复合生物膜细菌群落的物种丰富度和多样性明显高于真菌和真核生物群落(P<0.05),再次证明了复合生物膜中细菌群落的主体作用[21]。
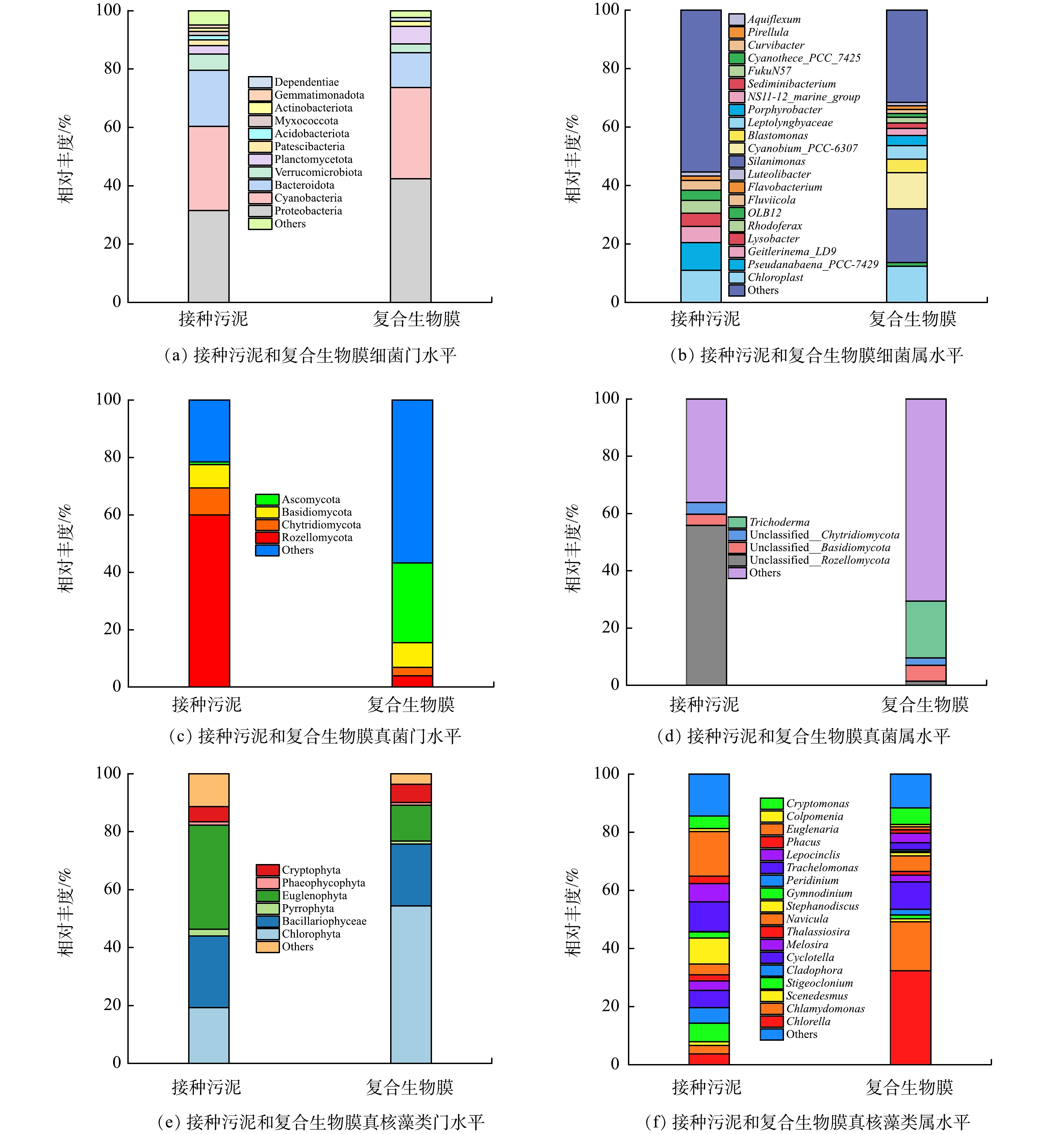
表 5 接种污泥和复合生物膜的微生物多样性分析Table 5. Microbial diversity analysis of inoculated sludge and composite biofilm物种类别 样品名称 Feature ACE Chao1 Shannon Simpson Faith_pd 细菌 接种污泥 1 742 1 742 1 742 8.429 0.988 101.323 复合生物膜 896 896 896 6.507 0.97 60.694 真菌 接种污泥 347 347 347 4.003 0.749 84.233 复合生物膜 356 356 356 6.122 0.964 66.264 真核藻类 接种污泥 426 427 429 3.365 0.816 81.262 复合生物膜 454 454 456 3.796 0.895 94.367 如图5(a)所示,接种污泥(周丛生物)的主要细菌门为Proteobacteria(31.5%)、Cyanobacteria(28.9%)、Bacteroidota(19.2%)、Verrucomicrobiota(5.5%)、Planctomycetota(2.9%)、Patescibacteria(2.0%)等,复合生物膜的主要细菌门为Proteobacteria(42.4%)、Cyanobacteria(31.2%)、Bacteroidota(11.9%)、Planctomycetota(6.0%)、Verrucomicrobiota(3.1%)、Actinobacteriota(1.8%)等。显然,驯化前后细菌群落的优势菌门并未发生明显变化,而Planctomycetota相对丰度的提高则表明厌氧氨氧化菌可能在复合生物膜中得到了进一步发育[22]。如图5(b)所示,接种污泥(周丛生物)中相对丰度大于1.0%的细菌属包括Chloroplast(11.0%)、Pseudanabaena_PCC-
7429 (9.5%)、Geitlerinema_LD9(5.5%)、Lysobacter(4.5%)、Rhodoferax(4.4%)、OLB12(3.5%)、Fluviicola(3.3%)、Flavobacterium(1.5%)和Luteolibacter(1.4%)。Chloroplast、Pseudanabaena_PCC-7429、Geitlerinema_LD9是常见的光合细菌,属于Cyanobacteria菌门[9, 23-24];Lysobacter常见于沉积物与农田土壤,是一种捕食性细菌,能够驱动天然微生物群落的演化过程[25];Rhodoferax是地表水环境中常见的菌属,可能驱动了有机物的氧化及铁(Ⅲ)的还原过程[26];OLB12、Flavobacterium具有异养硝化-好氧反硝化功能[27-28],可能在自然水体氮循环中发挥了关键作用。总之,在寡营养条件下,接种污泥形成了以光合细菌(蓝细菌)为主体,以捕食性细菌为辅的微生物群落体系。复合生物膜中主要的细菌属包括Silanimonas(18.4%)、Chloroplast(12.4%)、Cyanobium_PCC-6307 (12.3%)、Blastomonas(4.7%)、Leptolyngbyaceae(4.6%)、Porphyrobacter(3.5%)、NS11-12_marine_group(2.4%)、Sediminibacterium(1.9%)、FukuN57(1.9%)、Cyanothece_PCC_7425 (1.4%)、Curvibacter(1.3%)、OLB12(1.3%)、Pirellula(1.2%)、Aquiflexum(1.2%)。Silanimonas是一种典型的兼性好氧异养菌属,其既可以利用有机物进行异养反硝化[29],又可以利用氢气等进行自养反硝化[30]。Chloroplast、Cyanobium_PCC-6307 、Cyanothece_PCC_7425 、Leptolyngbyaceae为Cyanobacteria菌门,其中Cyanobium_PCC-6307 在代谢过程中可能产生释放蓝藻毒素[31]。Blastomonas和Porphyrobacter作为好氧不产氧光合异养细菌,具有降解藻毒素的功能[32-33]。尽管如此,在后续研究中依然要重点关注复合生物膜处理出水的藻毒素生态风险评估与控制。NS11-12_marine_group、Sediminibacterium、Curvibacter、OLB12均已被证实具有反硝化功能[34-36]。作为典型的厌氧氨氧化菌,Pirellula可能有助于贫营养条件下氮的去除[37]。除了归属于Cyanobacteria菌门的Chloroplast、Cyanobium等菌属可以承担除磷功能以外,OLB12也具有聚磷能力[38]。值得注意的是,复合生物膜中与自养硝化过程相关的菌属相对丰度很低,如氨氧化菌Bryobacter[39](0.5%)、完全氨氧化菌Reyranella[40](0.2%)、SM1A02[41](0.09%)、NS9_marine_group[42](0.05%)、Devosia[43](0.04%),因此推测Silanimonas、NS11-12_marine_group、Sediminibacterium除了承担反硝化功能外,还担负了异养硝化任务,即异养硝化-好氧反硝化菌属在氮去除过程发挥了核心作用。如图5(c)所示,Rozellomycota、Chytridiomycota、Basidiomycota、Ascomycota是接种污泥中的优势真菌门,其相对丰度分别为60.0%、9.3%、8.1%和1.0%。复合生物膜优势真菌门为Ascomycota(27.7%)、Basidiomycota(8.7%)和Chytridiomycota(2.9%)。在自然水体中,Rozellomycota和Chytridiomycota常作为捕食者侵染真核藻类[44]。Ascomycota和Basidiomycota被证实具有反硝化功能,并且可以同真核藻类建立协作关系以驱动废水处理[45-46]。如图5(d)所示,Trichoderma是复合生物膜中唯一可被识别的真菌属,其具有异养硝化-好氧反硝化功能,已被发现在土壤氮循环过程发挥了重要作用[47]。
如图5(e)所示,Euglenophyta、Bacillariophyceae、Chlorophyta、Cryptophyta是接种污泥中的优势微藻门,其总相对丰度高达85.2%。复合生物膜的优势微藻门则为Chlorophyta(54.4%)、Bacillariophyceae(21.4%)和Euglenophyta(12.4%)。Chlorophyta、Euglenophyta、Bacillariophyceae、Cryptophyta均是淡水环境中常见的真核藻类[48]。有研究[49]表明,高营养条件有利于Chlorophyta的生长繁殖,这可能是复合生物膜中该微藻门相对丰度能够高占比的主要原因。如图5(f)所示,接种污泥中的优势微藻属为Euglenaria(15.4%)、Trachelomonas(10.2%)、Stephanodiscus(9.0%)、Stigeoclonium(6.3%)、Lepocinclis(6.3%)、Cyclotella(5.9%)、Cladophora(5.4%)、Cryptomonas(4.3%)等。Euglenaria和Trachelomonas是小型水体(如鱼塘、农村池塘等)最常见的微藻属,可能在小微水体物质循环过程中发挥了重要作用[50]。而在复合生物膜,Chlorella(32.4%)、Chlamydomonas(16.8%)、Cyclotella(9.4%)、Cryptomonas(5.7%)、Navicula(5.4%)成为优势属。已有研究表明,在藻菌共生系统中,Chlorella和Chlamydomonas可以协同细菌实现废水处理及能源同步回收[51]。总之,复合生物膜体系中异养硝化-好氧反硝细菌、厌氧氨氧化细菌、自养硝化细菌、反硝化聚磷菌、光合细菌、异养硝化-好氧反硝真菌、真核微藻等功能菌群的富集为多路径脱氮除磷过程的实现奠定了坚实基础。
3. 结论
1)利用周丛生物作为接种源,可以在小试条件下成功构建微藻-光合/异养菌-真菌复合生物膜,并用于小微水体微污染水处理。
2)在最佳运行条件下,复合生物膜对TN和PO43--P的最大去除率分别为94.1%和98.2%。
3)光照强度是影响复合生物膜处理性能最为关键的因素;异养硝化-好氧反硝化、厌氧氨氧化、微藻/光合细菌同化、微生物诱导磷酸盐沉淀等过程共同驱动了复合生物膜中氮、磷的高效稳定去除。
4) Silanimonas、Chloroplast、Blastomonas、Pirellula、OLB12、Bryobacter、Trichoderma、Chlorella等代表性功能菌属的富集为复合生物膜多路径脱氮除磷过程奠定了坚实基础。
-
[1] AOSTA J A, FAZ A, MARTINEZ M, et al. Multivariate statistical and GIS—based approach to evaluate heavy metals behaviour in mine sites for future reclamation[J]. Journal of Geochemical Exploration,2011, 109: 8-17. [2] 环境保护部,国土资源部. 全国土壤污染状况调查公报[N]. 中国环境报,2014-4-17. Ministry of Environmental Protection, Ministry of Land and Resources. Bulletin of the National Soil Pollution Survey[N].China Environmental News,2014-4 -17(in Chinese).
[3] WAHSHA M, BINI C, ARGESE E, et al. Heavy metals accumulation in willows growing on Spolic Technosols from the abandoned Imperina Valley mine in Italy[J]. Journal of Geochemical Exploration,2012, 123: 19-24. [4] YANG Y, LI H, PENG L, et al. Assessment of Pb and Cd in seed oils and meals and methodology of their extraction[J]. Food chemistry,2015, 197(Pt A): 482-488. [5] 佚名.中国钨矿的发展简史[J]. 西部资源,2012 (1):32. ANONYMOUS. A brief history of chinese tungsten ore[J].Western Resources, 2012 (1 ):32 (in Chinese).
[6] NOURI M, HADDIOUI A. Human and animal health risk assessment of metal contamination in soil and plants from Ait Ammar abandoned iron mine, Morocco[J]. Environmental Monitoring and Assessment,2016, 188(1): 1-12. [7] MONTERROSO C, RODRIGUEZ F, CHAVES R, et al. Heavy metal distribution in mine-soils and plants growing in a Pb/Zn-mining area in NW Spain[J]. Applied Geochemistry,2014, 44: 3-11. [8] WANG J, FENG X, ANDERSON C W, et al. Effect of cropping systems on heavy metal distribution and mercury fractionation in the Wanshan mining district, China: Implications for environmental management[J]. Environmental Toxicology & Chemistry,2014, 33(9): 2147-2155. [9] 苏耀明,陈志良,雷国建, 等.多金属矿区土壤重金属垂向污染特征及风险评估[J]. 生态环境学报,2016, 25(1): 130-134. SU Y M, CHEN Z L, LEI G J, et al. Vertical pollution characteristic and ecological risk assessment of heavy metal of soil profiles in polymetallic ore mine[J]. Ecology and Environmental Sciences, 2016, 25(1): 130-134(in Chinese).
[10] 于靖,张华,蔡永兵, 等.金矿污染河流的水体和沉积物中重金属分布特征及生态风险评价[J]. 环境污染与防治,2015, 37(12): 1-9. YU J, ZHANG H, CAI Y B, et al. Distribution and ecological risk of heavy metals in water and sediments of a river polluted by gold mining[J].Environmental Pollution and Control,2015, 37(12): 1-9(in Chinese).
[11] 赵永红,张静,周丹, 等.赣南某钨矿区土壤重金属污染状况研究[J]. 中国环境科学,2015, 35(8): 2477-2484. ZHAO Y H, ZHANG J, ZHOU D, et al.Mixed heavy metals contamination of tungsten mine area soil in south of Jiangxi Province[J]. China Environmental Science,2015, 35(8): 2477-2484(in Chinese).
[12] 陈明,杨涛,徐慧, 等.赣南某钨矿区土壤中Cd、Pb的形态特征及生态风险评价[J]. 环境化学,2015, 34(12): 2257-2262. CHEN M,YANG T,XU H,et al. Distribution characteristics and ecological risk assessment of heavy metals Cd and Pb in soils around a tungsten mine of Gannan[J].Environmental Chemistry, 2015, 34(12): 2257-2262(in Chinese).
[13] 窦智勇,程建华,周平, 等.基于总量及有效态的铜陵矿区农田土壤重金属生态风险评价[J]. 环境污染与防治,2015, 37(11): 6-10. DOU Z Y, CHENG J H, ZHOU P, et al. Eologocal risk assessment based on total and available content of heavy metals in farmland soil of Tongling mining area[J]. Environmental Pollution and Control, 2015, 37(11): 6-10(in Chinese).
[14] 王婕,刘桂建,方婷, 等.基于污染负荷指数法评价淮河(安徽段)底泥中重金属污染研究[J]. 中国科学技术大学学报,2013, 43(2): 97-103. WANG J, LIU G J, FANG T, et al. Assessent of pollution characteristics of heavy metals in the sediments of Huaihe River (Anhui Section) by pollution load index[J]. Journal of University of Science and Technology of China, 2013, 43(2): 97-103(in Chinese).
[15] 陈岩,季宏兵,朱先芳, 等.北京市得田沟金矿和崎峰茶金矿周边土壤重金属形态分析和潜在风险评价[J]. 农业环境科学学报,2012, 31(11): 97-103. CHEN Y, JI H B, ZHU X F, et al. Fraction distribution and risk assessment of heavy metals in soils around the gold mine of Detiangou-Qifengcha,Beijing City,China[J].Journal of Agro-Environment Science,2012, 31(11): 97-103(in Chinese).
[16] 王崇臣,刘阳春,王鹏, 等.通惠河某段沉积物污染特征研究与评价[J]. 环境科学与技术,2011,34(7): 186-190. WANG C C, LIU Y C, WANG P, et al. Characteristics of sediments polluted by heavy metals in a reach of Tonghui River[J]. Environmental Science & Technology, 2011,34(7): 186-190(in Chinese).
[17] [18] 范拴喜.宝鸡市长青镇冶炼厂周边居住区土壤重金属污染特征与风险评估[J]. 环境污染与防治,2015, 37(9): 46-54. FAN S X. Pollution and health risk assessment of heavy metals in soil neighborhoods around a smelter in Changqing town of Baoji city[J].Environmental Pollution and Control,2015, 37(9): 46-54(in Chinese).
[19] HAKANSON L. An ecological risk index for aquatic pollution control. A sedimentological approach[J]. Waster Research,1980, 8(14): 975-1001. [20] GUO W. H, LIU X. B, LIU Z G, et al. Pollution and potential ecological risk evaluation of heavy metals in the sediments around Dongjiang Harbor, Tianjin[J]. Procedia Environmental Sciences,2010, 2: 729-736. [21] 胡国成,张丽娟,齐剑英,等.贵州万山汞矿周边土壤重金属污染特征及风险评价[J]. 生态环境学报,2015, 24(5): 879-885. HU G C, ZHANG L J, QI J Y, et al. Contaminant characteristics and risk assessment of heavy metals in soils from Wanshan Mercury Mine Area, Guizhou Province [J]. Ecology and Environmental Sciences, 2015, 24(5): 879-885(in Chinese).
[22] ZHU H. N, YUAN X. Z., ZENG G. M., et al. Ecological risk assessment of heavy metals in sediments of Xiawan Port based on modified potential ecological risk index[J]. Transactions of Nonferrous Metals Society of China,2012, 22(6): 1470-1477. [23] 黄莹,李永霞,高甫威, 等.小清河表层沉积物重污染区重金属赋存形态及风险评价[J]. 环境科学,2015, 36(6): 2046-2053. HUANG Y, LI Y X, GAO F W, et al.Speciation and risk assessment of heavy metals in surface sediments from the heavily polluted area of Xiaoqing River[J].Environmental Science,2015, 36(6): 2046-2053(in Chinese).
[24] INGVERTSEN S T, MARCUSSEN H, HOLM P E. Pollution and potential mobility of Cd, Ni and Pb in the sediments of a wastewater-receiving river in Hanoi, Vietnam[J]. Environmental monitoring and assessment,2013, 185(11): 9531-9548. [25] 高彦鑫,冯金国,唐磊, 等.密云水库上游金属矿区土壤中重金属形态分布及风险评价[J]. 环境科学,2012, 33(5): 1707-1717. GAO Y X, FENG J G, TANG L, et al.Fraction distribution and risk assessment of heavy metals in iron and gold mine soil of Miyun Reservoir upstream[J]. Chinese Journal of Environmental Science,2012, 33(5): 1707-1717(in Chinese).
[26] SUNDARAY S K, NAYAK B B, LIN S, et al. Geochemical speciation and risk assessment of heavy metals in the river estuarine sediments—a case study: Mahanadi basin, India[J]. Journal of hazardous materials,2011, 186(2-3): 1837-1846. [27] 孔明,董增林,晁建颖, 等.巢湖表层沉积物重金属生物有效性与生态风险评价[J]. 中国环境科学,2015, 35(4): 1223-1229. KONG M, DONG Z L, CHAO J Y, et al. Bioavailability and ecological risk assessment of heavy metals in surface sediments of Lake Chaohu[J]. China Environmental Science, 2015,35(4):1223-1229(in Chinese).
[28] 杜森,高祥照, 土壤分析技术规范第2版[M]. 北京: 中国农业出版社, 2006, 36-82. DU S, GAO X Z. Soil analysis technical specifications (Version 2)[M]. Beijing:China Agriculture Press,2006 , 36-82(in Chinese).
[29] 张芙蕖,蒋晶晶.三种土壤消解方法的对比研究[J].环境科学与管理,2008, 33(3): 132-134. ZHANG F Q, JIANG J J. The Comparison study on three methods of soil digestion[J].Environmental Science and Management, 2008, 33(3): 132-134(in Chinese).
[30] TESSIER A, CAMPBLL P G C, BISSON M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry,1979, 51(7): 844-851. [31] 何纪力,徐光炎,朱慧民, 等. 江西省土壤环境背景值研究[M]. 北京:中国环境科学出版社, 2006. HE J L, XU G Y, ZHU H M, et al. Research on Jiangxi province soil environmental background value[M]. Beijing:China Environmental Science Press,2006(in Chinese). [32] GUPTA S K, CHABUKDHARA M, KUMAR P, et al. Evaluation of ecological risk of metal contamination in river Gomti, India: A biomonitoring approach[J]. Ecotoxicology and Environmental Safety,2014, 110: 49-55. [33] 柏建坤,李潮流,康世昌, 等.雅鲁藏布江中段表层沉积物重金属形态分布及风险评价[J]. 环境科学,2014, 35(9): 3346-3351. BAI J K, LI C L, KANG S C, et al. Chemical speciation and risk assessment of heavy metals in the middle part of Yarlung Zangbo surface sediments[J].Environmental Science,2014, 35(9): 3346-3351(in Chinese).
[34] 大余县地名办公室, 江西省大余县地名志[Z]. 邵武市: 福建省邵武市印刷厂, 1985. [35] 陈志凡,王岩松,段海静, 等.开封黑岗口引黄灌区稻麦轮作下农田土壤剖面重金属分布特征[J]. 中国生态农业学报,2012, 20(4): 480-487. CHEN Z F, WANG Y S, DUAN H J, et al. Vertical distribution characteristics of heavy metals in agricultural soil profiles under rice-wheat system in Heigangkou Yellow River Irrigation Region[J]. Chinese Journal of Eco-Agriculture,2012, 20(4): 480-487(in Chinese).
[36] 谢博文,王艺,赵晟雯, 等.土壤重金属污染研究综述[J]. 广州化工,2016, 44(1): 21-24. XIE B W, WANG Y, ZHAO S W, et al. Review of soil heavy metal pollution[J]. Guangzhou Chemical Industry, 2016,44(1): 21-24(in Chinese).
[37] 李芳柏,王旭刚,周顺桂, 等.红壤胶体铁氧化物界面有机氯的非生物转化研究进展[J]. 生态环境,2006, 15(5): 1343-1351. LI F B, WANG X G, ZHOU S G, et al. Reviews on abiotic transformation of organchlorines on the interface of iron oxides and water in red soil colloids[J]. Ecology and Environment,2006, 15(5): 1343-1351(in Chinese).
[38] 阮从海,杨彦.太湖流域某典型农业区不同形态土壤重金属的生物有效性研究[J]. 安徽农业科学,2013, 41(3): 1079-1084. RUAN C H, YANG Y. Study on bioavailability of different forms of heavy metals in a typical agricultural soil of Taihu Lake basin[J]. Journal of Anhui Agricultural Sciences,2013, 41(3): 1079-1084(in Chinese).
[39] WANG L, LONG X X, CHONG Y X, et al. Potential risk assessment of heavy metals in sediments during the denitrification process enhanced by calcium nitrate addition: Effect of AVS residual[J]. Ecological Engineering,2016, 87: 333-339. [40] 洪涛,谢运球,赵一, 等.林口硫铁矿冶炼区土壤重金属垂向分布及其影响因素[J]. 贵州农业科学,2015, 43(12): 90-94. HONG T, XIE Y Q, ZHAO Y, et al. Vertical distribution characteristics of soil heavy metals and its influence factors in Linkou pyrite smelting area[J]. Guizhou Agricultural Sciences, 2015, 43(12): 90-94(in Chinese).
[41] 王森. 矿区下游土壤典型重金属的积累规律研究[D]. 杭州: 浙江大学, 2014. WANG S. Accumulation characteristics of typical heavy metals in soils in mining downstream area[D].Hangzhou: Zhejiang University, 2014(in Chinese). [42] 张晨晨,胡恭任,于瑞莲, 等.晋江感潮河段沉积物重金属的赋存形态与生物有效性[J]. 环境化学,2015, 34(3): 505-513. ZHANG C C, HU G R, YU R L, et al. Speciation and bioavailability of heavy metals in sediments from tidal reach of the Jinjiang River[J]. Environmental Chemistry, 2015, 34(3):505-513(in Chinese).
[43] LIU E F, SHEN J, LIU X Q. Geochemical features of heavy metals in core sediments of northwestern Taihu Lake, China[J]. Chinese Journal of Geochemistry,2005, 24(1): 73-81. [44] 陆泗进,王业耀,何立环.会泽某铅锌矿周边农田土壤重金属生态风险评价[J]. 生态环境学报,2014, 23(11): 1832-1838. LU S J, WANG Y Y, HE L H. Heavy Metal pollution and ecological risk assessment of the paddysoils around a Pb-Zn mine in Huize Country [J]. Ecology and Environmental Sciences, 2014, 23(11): 1832-1838(in Chinese).
[45] 王鹏. 北京某公路两侧土壤重金属污染现状及风险评价研究[D]. 北京:北京建筑大学, 2014. WANG P. Research on pollution situate and evaluation of heavy metal pollution in the soil sampled from a road in Beijing[D]. Beijing:Beijing University of Architecture,2014(in Chinese). -

 点击查看大图
点击查看大图
计量
- 文章访问数: 1529
- HTML全文浏览数: 1452
- PDF下载数: 472
- 施引文献: 0



 DownLoad:
DownLoad: