-
中国心理健康调查报告显示国内精神障碍疾病负担较重,抑郁和焦虑症患病率较高[1]. 心理健康受到社会和环境等多种因素影响,引发的炎症、氧化应激和神经递质紊乱都可能是神经系统疾病的致病因素. 长期压力应激状态会诱发焦虑、抑郁等精神类疾病,还具有导致器官功能性病变的风险[2]. 环境污染也可影响疾病的发生发展过程,污染物暴露可通过影响下丘脑-垂体-肾上腺轴(HPA)的功能和应激反应而引发心理疾病[3]. 研究表明心理应激和交通或工业空气污染对健康的不良影响存在明显协同效应[4]. 慢性压力应激状态下,全身易感性增强,环境污染物的毒性作用更为明显. 据报道,慢性压力应激和150 mg·kg−1醋酸铅同时暴露2个月可显著影响大鼠基底皮质酮水平与HPA轴功能[5]. Zhou等[6]发现妊娠期孕妇社会心理压力较大时,铅金属污染物暴露与婴幼儿神经缺陷、认知发育不全等不良健康的关联性增加. Clougherty等[7]研究发现,处于慢性压力下的大鼠对浓缩细颗粒空气污染的呼吸反应更强,并可能存在不同易感性的途径. 现有流行病学数据无法确定差异易感性的生理机制[8],因此,本文基于毒理代谢组学阐明慢性压力应激和污染暴露之间的潜在相互作用.
B[a]P是环境和食品中常见的污染物,主要通过呼吸和饮食途径进入体内,在肝脏蓄积和代谢活化,导致肝功能异常或肝损伤[9]. B[a]P及其代谢物可与体内氨基酸、有机酸、脂质等代谢物相互作用而具有肝毒性效应[10]. 长期慢性心理应激状态下机体生理功能和免疫力显著降低[11],因此可能对B[a]P暴露的应答会产生更复杂影响,但目前未有明确的影响机制研究. 本研究选用慢性不可预知温和刺激(chronic unpredictable mild stimulation,CUMS)作为慢性压力应激模型,采用靶向代谢组学分析方法研究了不同剂量B[a]P和CUMS单独或两者同时暴露对雄性C57BL/6J小鼠肝脏中氨基酸、TCA循环和胆汁酸代谢的影响,并通过统计学分析筛选出了差异代谢物,拟从代谢物差异变化初步探讨肝脏对B[a]P和慢性压力应激的应答和代谢机制.
-
B[a]P(≥96%,HPLC级)购自Sigma化学公司(St Louis,MO,USA);甲酸(LC-MS级)、乙腈(LC-MS级)、甲醇(LC-MS级)和甲酸铵(LC-MS级)购自J&K化学公司(Beijing,China);超纯水由美国Milli-Q 超纯水系统(Millipore,Billerica,USA)净化.
-
雄性C57BL/6J小鼠(7周龄)购自北京维通利华实验动物技术有限公司(Beijing,China),并在中国科学院深圳先进技术研究院喂养,保持12 h光/暗循环,恒温20—26 ℃,相对湿度40% —70%. 动物实验经中国科学院深圳先进技术研究院动物实验和实验动物福利委员会批准,所有涉及动物的实验程序都严格按照国家动物实验法律法规和参考美国国立卫生研究院出版的《实验动物护理和使用指南》执行.
-
小鼠适应环境一周后被随机分成6组(n = 7):对照组(给予等体积橄榄油)、低剂量B[a]P暴露组(2.0 mg·kg−1·d−1)、高剂量B[a]P暴露组(20.0 mg·kg−1·d−1)、CUMS组(给予等体积的橄榄油和CUMS刺激)、低/高剂量B[a]P和CUMS同时暴露组(不同剂量B[a]P暴露基础上进行CUMS刺激). B[a]P溶于橄榄油中采用口服灌胃方式暴露;低/高剂量B[a]P和CUMS同时暴露组在灌胃2 h后以随机排序给予以下CUMS刺激操作:①小鼠置于相对湿度40%—70%的潮湿环境中12 h,②每只小鼠置于50 mL管中禁食禁水2 h进行约束处理,③将4只小鼠同时置于3 cm × 5 cm × 7 cm的盒子中2 h,并禁食禁水. 持续暴露21 d,暴露实验开始和结束时记录小鼠体重. 暴露结束后颈部脱臼法处死小鼠,立即切除肝组织,称取肝脏湿重用于计算肝脏脏器系数(肝脏脏器系数=肝脏湿重/体重 × 100%),随后在液氮中速冻、转移至-80 ℃冰箱储存.
-
取适量肝脏组织样本置于2.0 mL离心管中,加入超纯水(肝组织重量:水重量 = 4:1),在高通量组织研磨仪(SCIENTZ-48L,Scientz,China)中进行研磨(4 ℃, 2.0 min). 称取约15 mg肝组织匀浆转移至1.5 mL新离心管中,加入0.2 mL甲醇,涡旋振荡20 min,在4 ℃和12000 r·min−1条件下离心15 min,取上清液进行仪器分析.
-
使用超高效液相色谱-三重四极杆串联质谱仪(UPLC-MS/MS 8060,Shimadzu,Japan)对肝脏组织中75种氨基酸、有机酸和胆汁酸类相关代谢物(表1、表2和表3)进行测定,采用外标法进行定量. 具体分析条件如下.
色谱参数:色谱柱柱温为40 ℃,流动相流速为0.2 mL·min−1,进样量为1.0 μL.
氨基酸类:Waters ACQUITY UPLC®HSS T3色谱柱(2.1 mm × 100 mm,1.8 μm),流动相A为0.1%甲酸-水,流动相B为0.1%甲酸-乙腈,梯度洗脱程序为:0 — 0.5 min,0% B;6.0 min,75% B;6.1 min,0% B,维持2.0 min.
有机酸类:Waters ACQUITY UPLC®HSS C18 色谱柱(2.1 mm × 100 mm,1.7 μm),流动相A为0.01mol· L−1甲酸铵-水,流动相B为0.01mol· L−1甲酸铵-甲醇,梯度洗脱顺序为:0 min,5% B;2.0 min,60% B;2.1 min,5% B,维持2 min.
胆汁酸类:Waters ACQUITY UPLC®BEH C18 色谱柱(2.1 mm × 100 mm,1.7 μm),流动相A为0.1%甲酸-水,流动相B为0.1%甲酸-乙腈,梯度洗脱程序:0.0 min,40%B;0.5 min,45%B;1.0 min,50%B;2.0 min,52%B;2.5 min,53%B;4.5 min,54%B;5.0 min,55%B,维持1.0 min;7.0 min,70%B;8.0 min,95%B;8.5 min,100%B,维持1.0 min;10.5 min,40% B,平衡2.0 min.
质谱参数:正离子和负离子模式下电喷雾电压分别为4.0 kV和-3.0 kV,雾化气体流量3.0 L·min−1,干燥气流量10 L·min−1,加热气体流量10 L·min−1,接口温度300 ℃,DL温度250 ℃,加热模块温度400 ℃. 各代谢物具体质谱参数如表1、表2和表3所示,定量限为0.02—220.44 μg·L−1,检出限为0.01—77.44 μg·L−1.
-
代谢扰乱度(Metabolic effect level index, MELI)是一种用于评估暴露后生物体代谢产物、特定代谢途径或整体代谢反应的定量终点指标[12]. 首先根据公式(1)计算不同组别样品中每个代谢物的变化(MCi). 其中,Ai为暴露组与对照组中单个代谢物i平均浓度的比值,ln(1)用于抵消对照组代谢水平.
将各代谢物的代谢变化汇总为累积代谢变化,根据公式(2)计算MELI值:
当MELIComb值接近MELIB[a]P和MELICUMS平方和的算术平方根时,B[a]P和CUMS的联合效应类型为加和效应;当MELIComb值大于MELIB[a]P和MELICUMS之和时,联合效应类型为协同效应;当MELIComb值小于MELIB[a]P或MELICUMS时,联合效应类型为拮抗效应.
-
使用MetaboAnalyst 5.0在线分析软件进行多变量统计分析,基于KEGG数据库进行代谢通路分析(https://www.metaboanalyst.ca/),GraphPad Prism 9.0软件进行统计学分析和绘图. 使用单因素方差分析P < 0.05,偏最小二乘判别分析模型变量影响重要性因子(Variable importance in the projection,VIP)值 > 1.0和ROC曲线下面积(Area under curve,AUC)值 > 0.75,作为显著差异代谢物的筛选准则. 所有数据均以平均数 ± 标准差(Mean ± SD)表示,采用单因素方差分析(One-way ANOVA)分析组间差异,P < 0.05为组间差异有统计学意义.
-
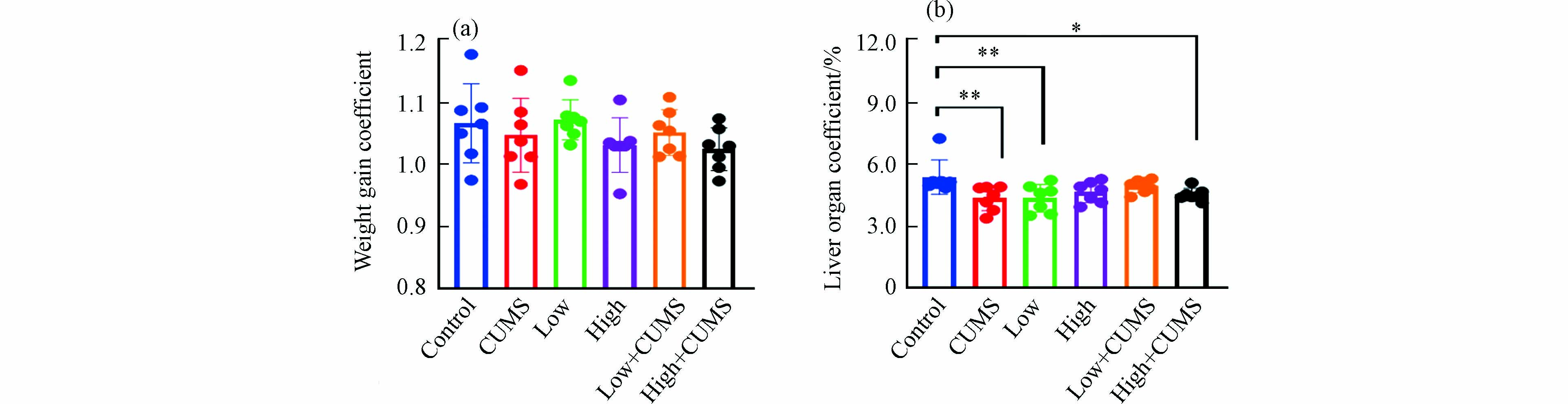
暴露实验结束时小鼠体重增加系数见图1a. 连续暴露21 d,除2.0 mg·kg−1·d−1的B[a]P暴露组外,20.0 mg·kg−1·d−1 B[a]P与CUMS单独暴露及不同剂量B[a]P与CUMS共同暴露的小鼠体重平均增长系数均低于对照组,表明高剂量B[a]P与CUMS单独暴露及B[a]P与CUMS同时暴露均可在一定程度上抑制小鼠的体重增长,减缓小鼠的生长速率. 如图1b所示,不同剂量B[a]P与CUMS单独或二者同时暴露的小鼠肝脏脏器系数均低于对照组,表明B[a]P与CUMS均可引发肝脏出现一定程度萎缩,说明肝脏是B[a]P与CUMS暴露的重要靶器官.
-
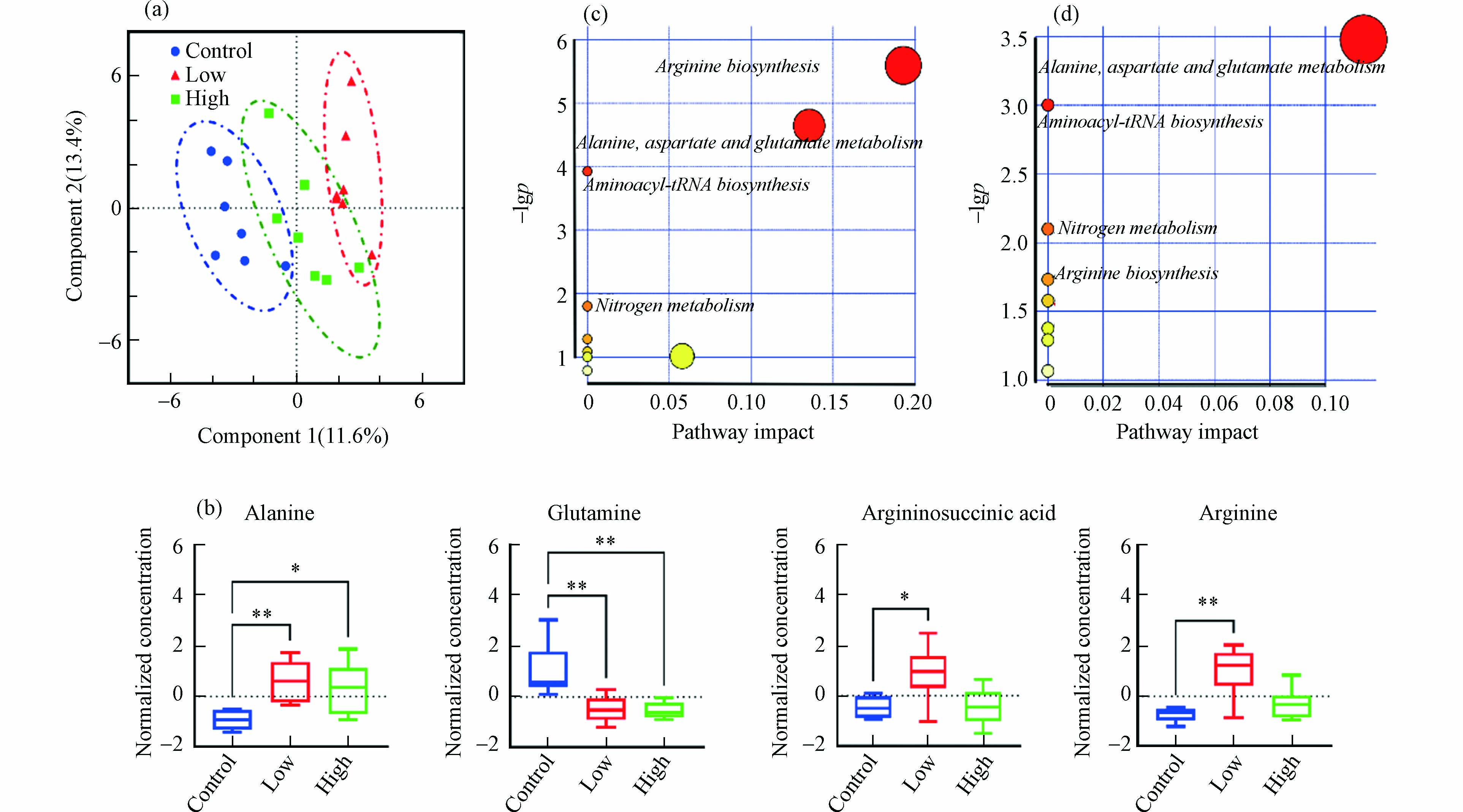
采用PLS-DA评估不同剂量B[a]P暴露后小鼠肝脏氨基酸、TCA循环和胆汁酸代谢的变化. 模型累计贡献率(R2)和模型预测能力(Q2)分别为0.947和0.676,置换检验P值为0.021,表明建立的PLS-DA模型具有良好的解释和预测能力,且不存在过拟合情况. 如图2a所示,两个暴露组和对照组在第一主成分上得到良好区分,说明两个剂量B[a]P暴露均可引起小鼠肝脏代谢紊乱.
筛选出两种B[a]P暴露剂量下的显著差异代谢物,结果如图2b所示(筛选准则见1.6节所述). 与对照组相比,2.0 mg·kg−1·d−1 B[a]P可使小鼠肝脏中精氨琥珀酸、精氨酸、丙氨酸水平显著上升(P < 0.05)而谷氨酰胺水平显著下降(P < 0.01);20.0 mg·kg−1·d−1 B[a]P导致小鼠肝脏中谷氨酰胺水平显著降低(P < 0.01)和丙氨酸显著升高(P < 0.05). 以往研究也发现,腹腔注射1 mg·kg−1·d−1的B[a]P可使SD大鼠肝脏组织中氨基酸代谢发生紊乱,导致谷氨酰胺显著下降,精氨酸、丙氨酸等显著升高,谷草转氨酶显著升高[13]. 作为细胞增殖分化的必需营养物质,肝脏中谷氨酰胺含量下降可能与癌细胞增殖摄取有关,并有可能促发肝细胞凋亡[14]. Wang等[15]发现,10 mg·kg−1和20 mg·kg−1 B[a]P暴露3个月大鼠肝癌发生率分别为26.3%和35.3%,Michurina等[16]也发现,200 mg·kg−1 B[a]P暴露3 d后可致大鼠肝细胞凋亡. 同时,谷氨酰胺与丙氨酸还是肝糖原异生的重要底物[17],推测B[a]P暴露也会影响小鼠肝脏中糖异生能量转化途径. 此外,精氨酸与精氨琥珀酸是尿素循环的中间代谢产物,2.0 mg·kg−1 B[a]P暴露后两者显著上升表明尿素循环代谢被扰乱,可能会引发肝功能衰竭、化学性肝损伤等肝脏疾病[18].
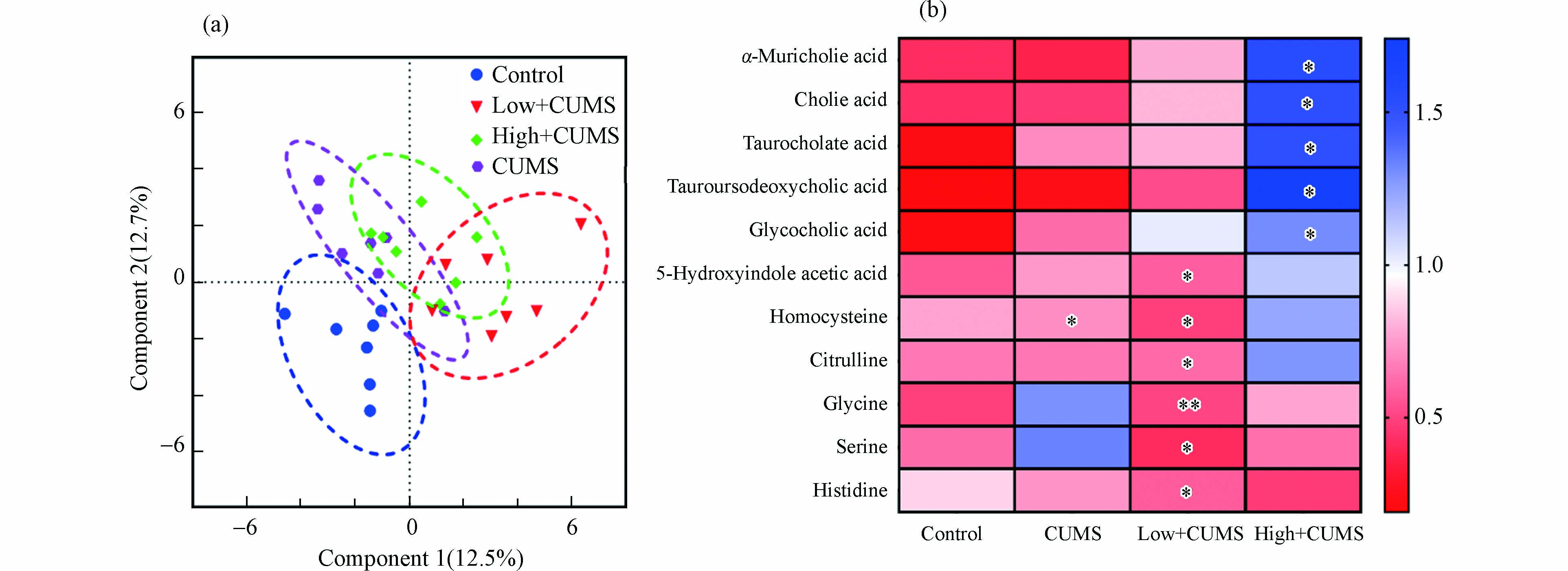
如图2c和2d所示,通过对显著差异代谢物进行KEGG代谢通路分析发现,两个不同剂量B[a]P暴露主要影响小鼠肝脏丙氨酸、天冬氨酸和谷氨酸代谢、氨基酰基-tRNA生物合成、氮代谢、精氨酸代谢合成,而2.0 mg·kg−1·d−1B[a]P影响的9个代谢通路,20.0 mg·kg−1·d−1B[a]P影响的8个代谢通路。 这些结果表明,B[a]P经口暴露后主要影响肝脏氨基酸代谢,低剂量B[a]P暴露的影响更为明显.
-
如图3a所示,从PLS-DA因子得分图(R2 = 0.729,Q2 = 0.357,P < 0.001)可以看出,CUMS单独暴露和与B[a]P同时暴露对小鼠肝脏氨基酸和胆汁酸代谢都有明显影响. 根据差异代谢物筛选准则,发现CUMS刺激后,小鼠肝组织中同型半胱氨酸水平显著下降(P < 0.05),这与以往有关CUMS刺激后小鼠肝脏组织代谢变化的结果一致[19]. 同时,发现两个剂量B[a]P和CUMS同时暴露小鼠肝脏的氨基酸和胆汁酸代谢物变化,如图3b中所示,2.0 mg·kg−1·d−1 B[a]P与CUMS同时暴露使得小鼠肝组织中5-羟基吲哚乙酸、同型半胱氨酸、组氨酸、瓜氨酸、甘氨酸、丝氨酸水平显著降低(P < 0.05);而20.0 mg·kg−1·d−1 B[a]P与CUMS同时暴露则主要干扰肝脏胆汁酸代谢途径,表现为甘胆酸、牛磺熊脱氧胆酸、牛磺胆酸、胆酸和α-鼠胆酸水平显著升高(P < 0.05). 即2.0 mg·kg−1·d−1B[a]P与CUMS共同暴露后肝脏氨基酸代谢紊乱而20.0 mg·kg−1·d−1 B[a]P与CUMS共同暴露后肝脏胆汁酸代谢异常. 作为参与机体胆固醇和脂质代谢的内源性小分子代谢物,胆汁酸在肝组织中的累积会诱导肝损伤的发生[20]. 此外,次级胆汁酸如甘胆酸、牛磺熊脱氧胆酸的水平变化与肝性脑病和2-型糖尿病有关[21]. 同时氨基酸代谢与肝脏正常生理功能密切相关,其紊乱还与肝炎、肝硬化等疾病的发生有关[22]. 已有文献报道,CUMS和B[a]P暴露都可使小鼠肝功能血清生化指标天冬氨酸氨基转移酶和丙氨酸氨基转移酶活性升高[23-24],且肝组织HE染色后可观察到明显的组织病理学变化[25-26],表明CUMS和B[a]P可导致肝功能异常和肝损伤. 因此,推测B[a]P与CUMS暴露引发的小鼠肝脏氨基酸和胆汁酸代谢物的变化是其诱导肝功能异常和肝损伤可能的机制之一.
-
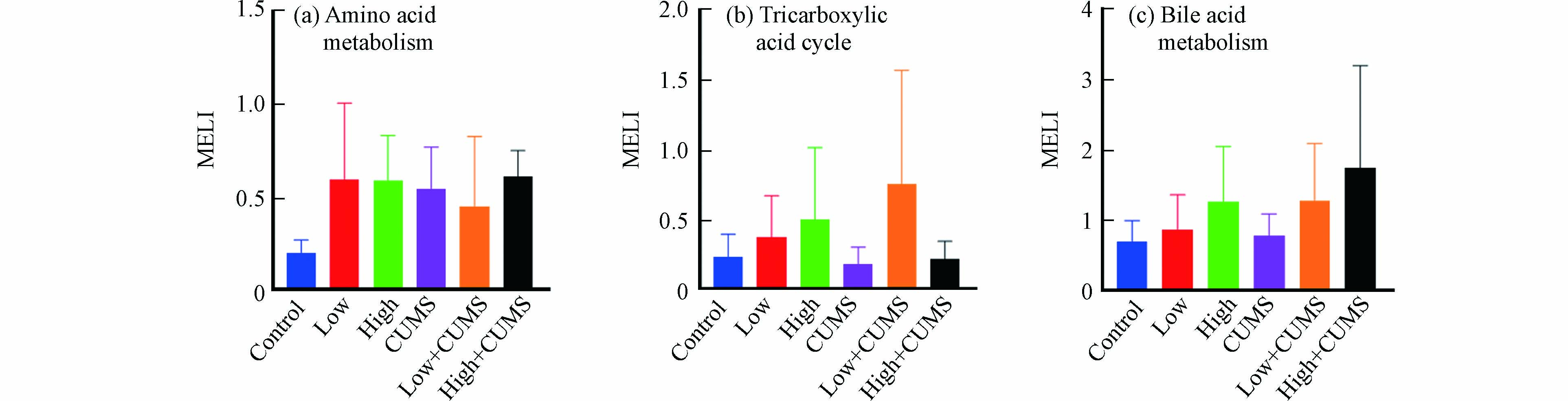
环境污染和心理健康是疾病发生与发展的两大因素,流行病学调查发现空气污染暴露对处于慢性压力状态机体的不良影响显著增加[27],但具体的生理机制及两者间相互作用尚不完全清楚. 毒理代谢组学可从代谢物角度揭示压力应激和环境污染暴露之间的效应,代谢扰乱度(MELI)可将信息量丰富的代谢组学数据转化成一个综合的定量终点,目前已被用于评估反映PM2.5、氯化石蜡等污染物暴露后细胞代谢的的总体变化情况[28-29]. 小鼠肝组织中氨基酸代谢、TCA循环和胆汁酸代谢在B[a]P与CUMS单独或同时暴露后MELI值见图4.
从图4中看出,20.0 mg·kg−1·d−1的B[a]P对氨基酸代谢、TCA循环和胆汁酸代谢的影响更大. 如图4a所示,氨基酸代谢MELILow-CUMS值小于MELILow和MELICUMS表明低剂量B[a]P与CUMS同时暴露对小鼠肝脏氨基酸代谢的联合效应为拮抗效应;MELIHigh-CUMS值接近于MELILow2+MELICUMS2算术平方根的值,说明高剂量B[a]P与CUMS同时暴露对小鼠肝脏氨基酸的联合效应为加和效应. TCA循环的MELILow-CUMS值大于MELILow+MELICUMS,而MELIHigh-CUMS值小于MELIHigh且大于MELICUMS(图4b),说明低剂量B[a]P与CUMS同时暴露对小鼠肝脏TCA循环具有协同效应,而高剂量B[a]P与CUMS同时暴露对小鼠肝脏TCA循环具有拮抗效应. 不同剂量B[a]P与CUMS同时暴露对小鼠肝脏氨基酸代谢和TCA循环的联合效应均不同,其效应的类型与共同暴露时B[a]P的剂量有关. 此外,胆汁酸代谢的MELILow-CUMS与MELIHigh-CUMS值分别接近MELILow2+MELICUMS2和MELIHigh2+MELICUMS2(图4c),表明不同剂量B[a]P与CUMS同时暴露对小鼠肝脏胆汁酸代谢的联合效应类型均为加和效应.
-
本研究通过靶向代谢组学分析方法,发现了暴露在B[a]P下主要影响氨基酸代谢且不同剂量条件下小鼠肝脏代谢应答存在明显差异. 不同剂量B[a]P均可导致谷氨酰胺水平显著下降,丙氨酸显著上升;同时2.0 mg·kg−1·d−1 B[a]P还可使精氨琥珀酸、精氨酸显著上升. 不同剂量B[a]P对肝脏代谢影响的机制是不同的. 慢性压力应激影响小鼠肝脏氨基酸代谢,同型半胱氨酸含量显著下降. B[a]P与CUMS同时暴露,使得小鼠肝脏氨基酸和胆汁酸代谢发生显著变化,差异的代谢物与两者单独暴露明显不同. 利用MELI评估污染物和精神因素对小鼠肝脏代谢的联合作用,不同剂量B[a]P与CUMS对氨基酸代谢、TCA循环和胆汁酸代谢具有不同的作用,差异的机制还需要进一步研究. 本研究初步阐明了两大因子对肝脏氨基酸、有机酸和胆汁酸代谢的影响,但对脂质、激素等代谢的影响及具体作用机制还需进一步研究. 综上,本研究发现的代谢异常与肝损伤、肝功能异常、肝细胞炎症和肝癌等病变的发生有关,这有助于进一步理解环境污染物与精神因素对机体健康的作用.
苯并[a]芘和慢性压力应激暴露对小鼠肝脏代谢的影响
Effects of exposure to benzo[a]pyrene and chronic stress on hepatic metabolism of mice
-
摘要: 环境污染和慢性压力是影响人类健康的两大类常见风险因子,本研究通过表征苯[a]并芘(benzo[a]pyrene,B[a]P)与慢性压力应激(chronic unpredictable mild stimulation,CUMS刺激)暴露对小鼠肝脏代谢的影响,并探讨了同时暴露时两大风险因子之间潜在的相互作用. 采用靶向代谢组学结合多元统计学方法分析了两个剂量B[a]P(2.0 mg·kg−1 ·d−1和20.0 mg·kg−1·d−1)与CUMS刺激单独或联合暴露21 d后,雄性C57BL/6J小鼠肝脏中氨基酸代谢、TCA循环和胆汁酸代谢的变化. 研究发现,2.0 mg·kg−1·d−1 B[a]P可使小鼠肝脏中精氨琥珀酸、精氨酸和丙氨酸显著升高,谷氨酰胺显著降低;20.0 mg·kg−1·d−1 B[a]P则主要导致丙氨酸显著上升,谷氨酰胺下降. 慢性压力应激使小鼠肝脏同型半胱氨酸的含量显著下降. B[a]P与慢性压力应激同时暴露时,小鼠肝脏氨基酸和胆汁酸代谢会发生显著变化. 进一步采用代谢扰乱度(metabolic effect level index,MELI)评估了两个风险因子的联合作用效果,发现2.0 mg·kg−1·d−1 B[a]P和慢性压力应激同时暴露对小鼠氨基酸代谢、TCA循环和胆汁酸代谢的影响分别为拮抗、协同和加和作用;而20 mg·kg−1·d−1 B[a]P和慢性压力应激同时暴露的小鼠氨基酸代谢和胆汁酸代谢的影响均为加和作用,TCA循环为拮抗作用. 结果表明,不同剂量的B[a]P和CUMS暴露造成小鼠肝脏氨基酸代谢和胆汁酸代谢紊乱,差异的代谢物与两者单独暴露时明显不同,且代谢的变化与B[a]P暴露剂量密切相关.Abstract: Environmental pollutants and chronic stress are two common risk factors that have great impact on human health. In this study, potential interactions between these two factors were explored by characterizing the effects of benzo[a]pyrene (B[a]P), or chronic stress, or their combination, on liver metabolism of male C57BL/6J mice using targeted metabolomics followed by multivariate statistical analysis. It was found that the hepatic levels of alanine and glutamine were significantly up- and down-regulated respectively after 21 days of exposure to 2.0 mg·kg−1·d−1 or 20.0 mg·kg−1·d−1 of B[a]P. But only in the 2.0 mg·kg−1·d−1 case did we observe the up-regulation of argininosuccinic acid and arginine, suggesting that the B[a]P-induced alterations in amino acid metabolism were dose dependent. Moreover, chronic stress stimulus was found associated with a significant decrease in the hepatic level of homocysteine. Also, we evaluated the effects of combined exposure on the hepatic metabolism based on the metabolic effect level index (MELI). Specifically, the combined exposure to 2.0 mg·kg−1·d−1 B[a]P and chronic stress exhibited antagonistic, synergistic and additive effects on amino acid metabolism, TCA cycle and bile acid metabolism, respectively. In contrast, the combined exposure to 20.0 mg·kg−1·d−1 B[a]P and chronic stress showed additive effects on both amino acid metabolism and bile acid metabolism, but antagonistic effect on TCA cycle. We conclude that the exposure to both B[a]P and chronic stress can trigger significant disorders in amino acid and bile acid metabolism, which, notably, differ from those caused by exposure to either alone and were closely related to the exposure dose of B[a]P.
-
Key words:
- benzo[a]pyrene /
- chronic stress /
- exposomics /
- mice liver /
- metabolomics
-
铁是一种生物必须的营养元素,直接影响浮游植物的光合作用和碳水化合物形成,由于高含氧量和无机态铁的低溶解性,铁通常是制约HNLC海区(High nutrition low chlorophyll)初级生产力的关键微量元素[1-2]。大规模海洋施铁实验表明,水生态系统中生物可利用铁的增加可以显著提高浮游植物的生物量和光合作用率,从而提高初级生产力,并促使浮游植物的群落结构发生变化[3-7]。以往研究表明,光自养微生物对碳循环和全球气候起关键作用[8-9]。初级生产力的提高,深刻地影响着全球尺度的二氧化碳固定,对温室气体的控制具有重要意义。
水生态系统中,99%溶解性铁(dissolved iron,DFe)与有机配体结合。尽管大部分有机络合态铁不能直接被藻类利用,但通过一些地球化学转化过程,可转变为生物可利用铁[10-11]。Blazevic等[12]研究发现,海洋中腐殖酸结合态铁可以发生光还原反应,进而提高铁的生物可利用性。沼泽性河流是海洋DFe的重要来源[13]。沼泽性河流中大量存在的溶解性有机碳(DOC, dissolved organic carbon)与铁离子形成有机络合物,使水中保持较高浓度DFe。有机质中羧基和酚羟基是与铁络合的主要官能团。泥炭源中的酚酸类物质,含有稳定的芳香环结构。部分酚酸与铁有较高的配合能力,这类物质的存在保护了长距离迁移的DFe,保证了陆源DFe向水生态系统的有效输出[14]。
泥炭沼泽中存在多种类型酚酸,前人在金川泥炭中检测出了9种酚酸,包括对-羟基苯甲酸、丁香酸、香草酸、阿魏酸、对-香豆酸、没食子酸、原儿茶酸和咖啡酸,许多泥炭沼泽中都有这些酚酸的存在[14]。研究证实,酚酸等有机质可以和铁形成较为稳定的配合物,使其可以在淡水运输过程中迁移更长的距离[15]。其中,具有儿茶酚或者没食子酰基结构的原儿茶酸、没食子酸以及咖啡酸可以和Fe(Ⅱ)形成较为稳定的络合物,使得Fe(Ⅱ)在极易被氧化的碱性条件下也可以保存较长时间。而咖啡酸、没食子酸、原儿茶酸以及龙胆酸还对Fe(Ⅲ)有着明显的还原作用,同样有助于这两种铁形态之间的平衡[16]。
植物或微生物分泌代谢物质对环境中其他植物或微生物体产生不利或有利的影响,这种作用称为化感作用。在化感作用过程中分泌的物质即被称为化感物质,自然界的化感物质种类非常丰富,主要包括酚酸类、苯醌类、倍半萜类、黄酮类等几大类物质[17]。迄今发现的化感物质几乎都是植物的次生代谢物质,分子量较小,结构简单,其中酚酸类物质是一类重要的次生代谢产物,也是研究较多,被证实是化感活性较强的一类物质[18]。酚酸具有一定生物毒性。目前对于酚酸抑藻的机制还不十分清楚,其抑制作用可能通过多种方式实现。研究表明,酚酸与蛋白质分子易遵循疏水键-氢键多点键合理论结合。在酚酸存在的情况下,藻细胞的胞外磷酸酶活性受到抑制,碱性磷酸酶活性的抑制使藻利用磷的能力下降。酚酸与细胞膜蛋白的结合,会破坏生物体细胞膜结构,使植物多酚物质进一步穿过细胞膜,进入细胞体内,从而改变微生物细胞酶活性,减少藻类对外源性蛋白质的利用,并通过对细胞外酶的抑制达到抑藻的目的[19]。另外,如果酚酸进入细胞体后,通过与金属离子发生络合反应,形成沉淀而破坏微生物的正常新陈代谢也是植物多酚抑藻的原因所在[20]。尽管酚酸存在生物毒性,但适量前提下,对藻类生长有积极作用[21]。泥炭源典型酚酸与铁的络合物是否对藻类利用铁有显著影响尚待进一步研究。因此,探究酚-铁配合物络合稳定性及其生物可利用性有助于进一步了解生物对铁的吸收,更好地理解全球铁碳耦合循环。
铜绿微囊藻(microcystic aeruginosa) 是中国湖泊、水库及其他水域生态系统水体富营养化蓝藻水华的代表性藻类。本文铜绿微囊藻为培养对象,利用泥炭源典型酚酸及泥炭溶解有机质(DOM)开展了一系列培养试验,以期了解泥炭沼泽源酚酸以及酚-铁络合物对铜绿微囊藻生长的影响。
1. 材料与方法(Materials and methods)
1.1 实验材料
试验所用铜绿微囊藻藻源,由中国科学院水生生物研究所提供,采用BG-11培养基培养。
4种酚酸的配制:以1.7 g·L−1的浓度配制BG-11培养基,然后将对羟基苯甲酸、对香豆酸、水杨酸、咖啡酸加入,分别配制4份浓度为0.24 g·L−1的酚酸溶液。用0.22 μm滤膜在超净台中过滤,并用紫外光照射30 min,消除微生物的影响,现配现用。
藻种培养条件:实验前5天,将铜绿微囊藻进行扩大培养。光照强度4000 lx;光暗比24 h∶0 h;温度(25±1)°C;每天摇动培养瓶5次,使藻类生长进入对数生长期。进入对数增长期后,取铜绿微囊藻各300 mL加入到1 L锥形瓶,再加入BG-11培养基100 mL进行驯化培养。
1.2 实验设计
1.2.1 单一酚酸对铜绿微囊藻的抑制作用
由于对羟基苯甲酸和对香豆酸在泥炭中含量相对较高,水杨酸和咖啡酸和铁离子可以络合,实验选择这4种酚酸进行实验。
使用细胞计数仪确定当前藻液浓度,并根据藻液浓度取一定量的处于对数生长期的藻液加入250 mL锥形瓶内,其中分别添加稀释了不同倍数的酚酸溶液,最后用培养基补足,使得锥形瓶内的液体总体积达到150 mL。每个锥形瓶内藻的初始密度为105 cell·mL−1,酚酸的最终浓度梯度分别为0、10、20、40、60、80 mg·L−1,每组3个平行,置于光照培养箱内。培养温度为(20±1)℃,光照强度为4000 lx,24 h光照,每天震荡3—5次。
1.2.2 酚络合态铁对铜绿微囊藻生长的影响
选用水杨酸和咖啡酸与铁形成络合物,探究酚铁对藻类生长的影响。实验选择的酚酸浓度为5×10−5 mol·L−1,铁浓度为1×10−6 mol·L−1,在此条件下酚酸浓度为铁浓度的50倍,可以有效保护体系中的二价铁。此外,由于泥炭沼泽中也普遍存在草酸、柠檬酸、酒石酸、乙酸等无苯环的小分子有机酸,所以实验选择草酸、柠檬酸、乙酸作为干扰物质加入到酚铁体系中进行藻类的培养实验。
藻类的培养实验分为10组,每组添加的物质如下:A.水杨酸+硫酸亚铁;B.咖啡酸+硫酸亚铁;C.水杨酸+草酸+硫酸亚铁;D.水杨酸+乙酸+硫酸亚铁;E.咖啡酸+草酸+硫酸亚铁;F.咖啡酸+乙酸+硫酸亚铁;G.水杨酸+柠檬酸+硫酸亚铁;H.咖啡酸+柠檬酸+硫酸亚铁;I.不添加酸和铁的对照组;J.只添加铁的对照组。
以上试验均为期15 d,每隔48 h取样1次,记录藻细胞数量的变化,以及藻存活情况的变化和pH值的变化。培养周期结束后分别取10 mL和5 mL样品,测量样品中叶绿素a的含量和叶绿素荧光参数Fv/Fm(最大光能转化效率)。其中Fv/Fm常用来表征叶绿素PsⅡ(低铁环境藻类光系统Ⅱ)反应中心内禀光能转换效率,反映当时所有的PsⅡ反应中心均处于开放态时最大光量子产量。
1.2.3 生理指标的测定方法:
为测藻细胞存活率及藻细胞数量,使用5-CFDA染色,具体操作方法如下:
(1)用DMSO(二甲基亚砜)5-CFDA稀释至10 mmol·L−1。将99 μL已经配制好的BG-11培养基与1 μL的5-CFDA混合作为A液,摇晃10 s混匀;
(2)将50 μL样品与50 μL A液混匀,用移液枪至少吹打10次;
(3)在25℃条件下将上一步准备好的样品避光放置30 min;
(4)用移液枪将待测样品吹打10次或摇晃,使藻细胞分散,然后用移液枪取20 μL加入计数板内。在计数板插入仪器之前,稳定1 min,使样品在其中稳定下来。
将细胞染色后,使用细胞计数仪计数,并观察细胞的存活状态。
测量样品叶绿素a的含量:
(1)取藻液10 mL,4500 r·min-1离心15 min,去掉上层清液,将样品在4℃冰箱中放置1 d;
(2)取出后迅速加入5 mL的90%热乙醇(80℃)于80℃的热水浴萃取2 min,再用超声处理10 min,放在暗处萃取4 h后,用0.22 μm的滤头过滤。用酶标仪于波长665 nm和750 nm处测吸光值,然后滴加1滴1 mol·L−1的盐酸酸化,于波长665 nm和750 nm处再测吸光值。计算公式为:
Chla乙醇=27.9×[(E665−E750)−A665+A750)]×V乙醇/V样品 其中,Chla乙醇为热乙醇法测定的叶绿素a含量(μg·L−1);E665是乙醇萃取液于波长665 nm的吸光值;E750是乙醇萃取液于波长750 nm的吸光值;A665为乙醇萃取液酸化后在665 nm处的吸光值;A750为乙醇萃取液在750 nm处的吸光值;V乙醇为乙醇萃取液的体积(mL),V样品为所取样品的体积(mL)。
抑制率计算公式:IR=(1-N/N0×100%)抑制率为负值则有促进效果,抑制率为正则抑制。
1.2.4 泥炭沼泽源酚络合态铁对铜绿微囊藻生长的影响
培养前准备:
(1)提取泥炭中的DOM;
(2)将样品通过H型阳离子柱交换柱,去除样品中存在的金属离子;然后将DOM样品按照<1 KDa,1—3 KDa,>3 KDa分成3份;
(3)将3份样品中加入FeSO4,待稳定一段时间后,取10 mL加入培养基中,加入后Fe的浓度为5×10−6 mol·L−1。
铜绿微囊藻培养实验分为5组,每组3份平行,每组添加的物质如下:A.无添加;B.Fe,浓度为5×10−6 mol·L−1;C.DOM-Fe(<1 KDa),Fe浓度为5×10−6 mol·L−1;D.DOM-Fe(1—3 KDa),Fe浓度为5×10−6 mol·L−1;E.DOM-Fe(>3 KDa),Fe浓度为5×10−6 mol·L−1。
实验均为期15 d,每隔48 h取样1次,记录藻细胞数量的变化,以及藻存活情况的变化。
2. 结果与讨论(Results and discussion)
2.1 不同酚酸影响微囊藻生长的浓度效应
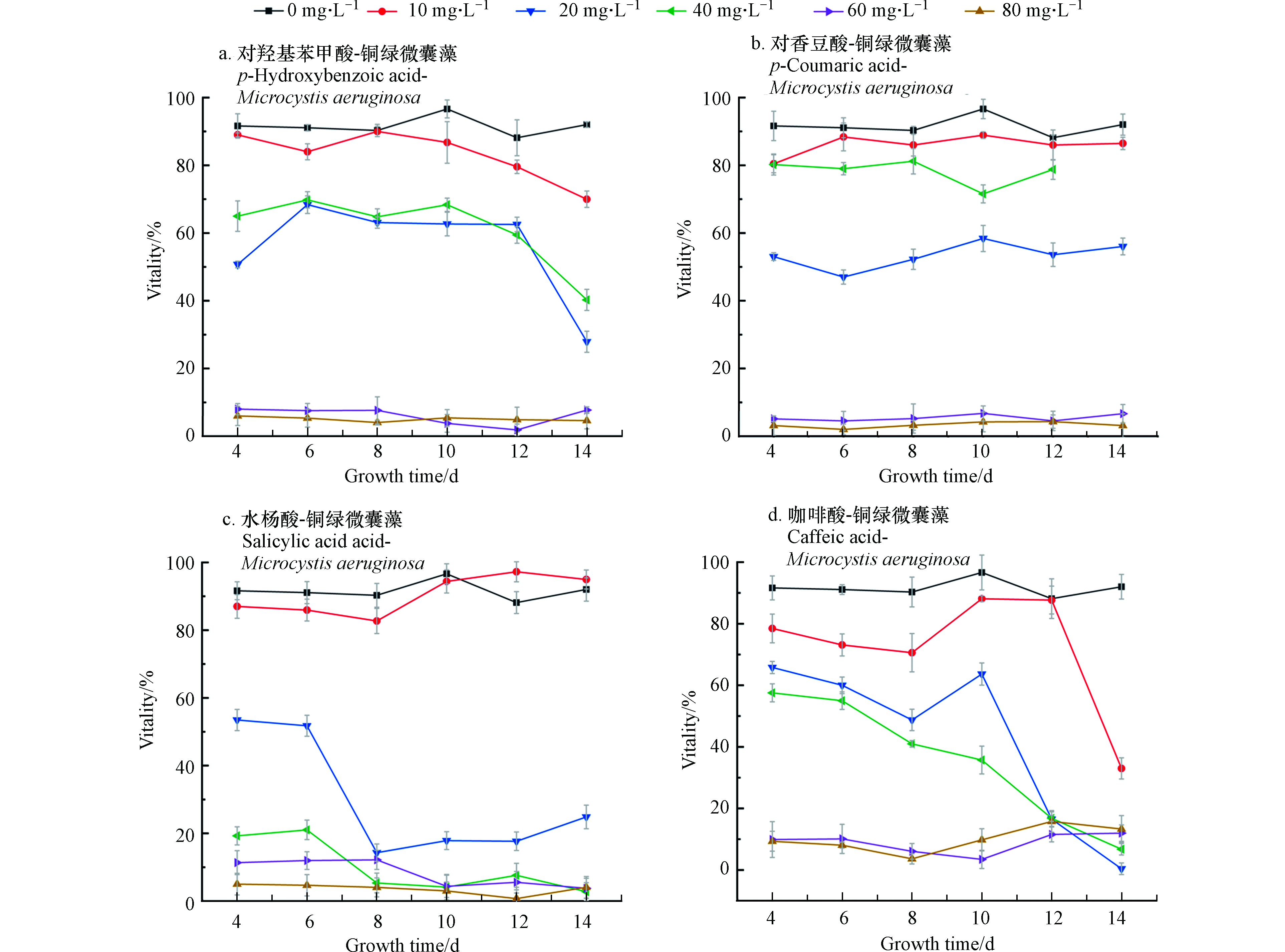
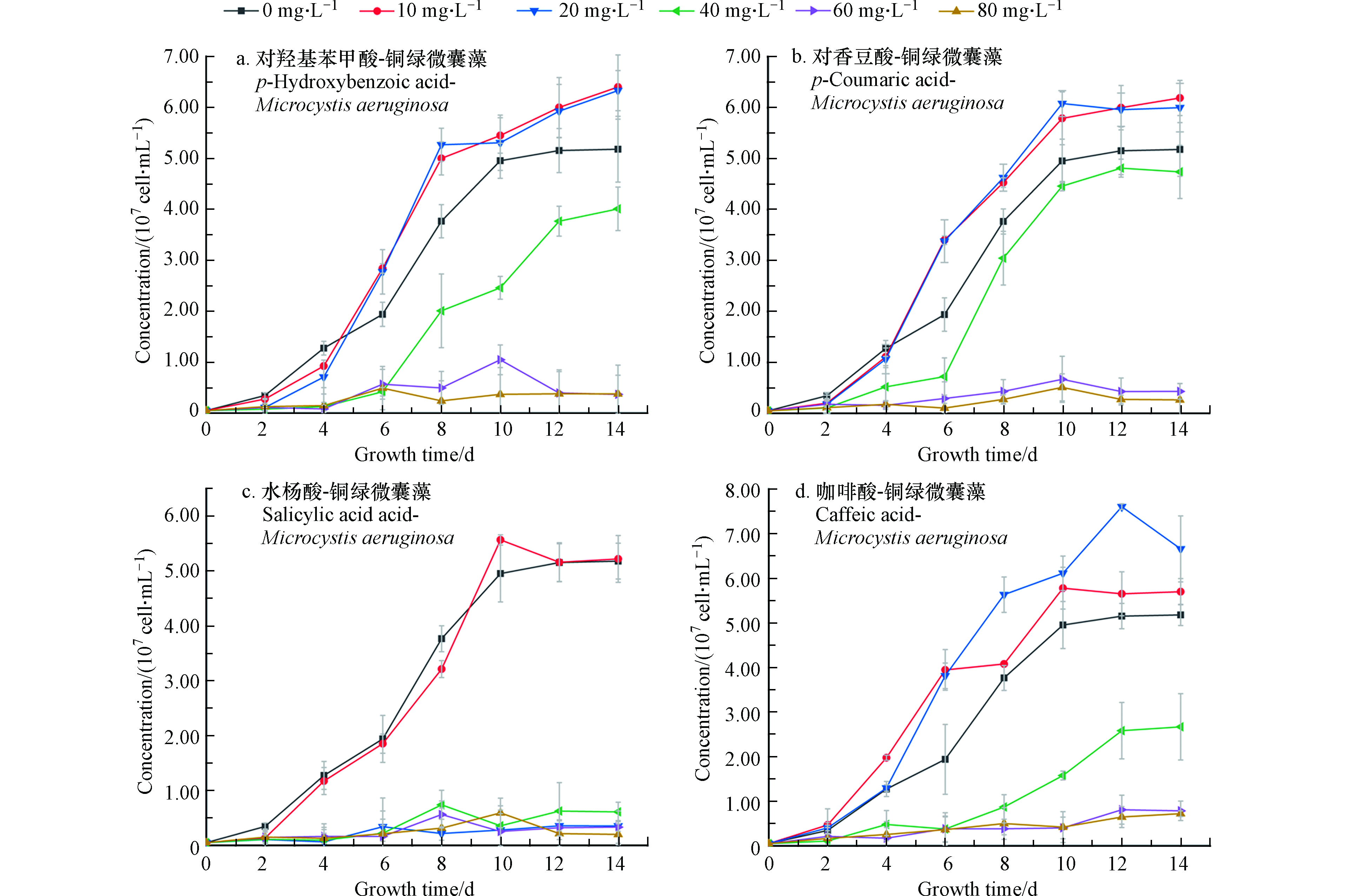
在微囊藻培养体系中分别加入不同浓度四种酚酸溶液,经过14 d培养和检测,得到微囊藻-酚酸的生长曲线如图1所示。图1中A、B为不同浓度的对羟基苯甲酸和对香豆酸对微囊藻生长情况的影响。可以看出,当酚酸浓度为10 mg·L−1和20 mg·L−1时,微囊藻的生长速率和最终达到的终点浓度明显高于控制组(0)抑制率为-23.5%—18%。从微囊藻浓度上来看,当酚酸浓度为10 mg·L−1和20 mg·L−1时,生长情况比较接近,说明在此浓度下,这两种酚酸对微囊藻的生长有一定的刺激作用。在A、B组中当酚酸浓度超过20 mg·L−1时,藻液浓度和藻的生长速率明显低于控制组;当浓度增加到40 mg·L−1时,这两种酚酸对微囊藻的生长起到了明显的抑制作用,而对羟基苯甲酸的对微囊藻生长的抑制作用更加明显;浓度继续增加到60—80 mg·L−1时,微囊藻前4—5天略有增长,然后基本停止了增长,保持在3×106 cell·mL−1左右。对香豆酸60 mg·L−1组的藻数量略高于80 mg·L−1组。
在C组水杨酸-微囊藻的实验中,水杨酸浓度为10 mg·L−1时,增长的速度与控制组接近,在8—10 d快速增长后,藻数量和控制组趋于一致。而当浓度大于10 mg·L−1时,都出现了明显的抑藻效果,抑制率约为80%。
结合图2中存活率来看(从培养的第4天开始测微囊藻的存活率)当浓度为10 mg·L−1时,微囊藻的存活率都略低于控制组,差值在10%左右浮动,当浓度为20—40 mg·L−1,在开始计数时,藻类的存活率就已不同程度地低于控制组,并且A、C、D存活率在4—14 d整体处于下降的趋势,可以看出,水杨酸对微囊藻的抑制作用最强。
表1是各组样品的Fv/Fm,最大光能转化效率Fv/Fm常用来表征叶绿素PsII反应中心内禀光能转换效率,反映当时所有的PsII反应中心均处于开放态时最大光量子产量。
在非胁迫环境下,植物叶片叶绿素荧光参数Fv/Fm变化极小,表现出稳定的特点,但在胁迫条件下,该参数明显下降[22]。Fv/Fm可作为植物受环境胁迫的响应指标[23]。控制组的Fv/Fm为0.308。一般情况下,微囊藻的Fv/Fm在0.3左右,当Fv/Fm过低表明藻类受到环境胁迫,PSII中心受到损伤进而降低光合作用效率。由表1可以看出,当水杨酸浓度大于20 mg·L−1时会对微囊藻的光合作用产生明显抑制,当各组酚酸浓度超过60 mg·L−1时,藻类基本停止了光合作用,这和前文中藻类的生物量变化和存活率相吻合。表2是各个组叶绿素含量的均值,数据表明:各组中相对低浓度的酚酸,不仅对藻类数量的增长有促进作用,也促进了叶绿素含量的增加。
表 1 铜绿微囊藻的Fv/FmTable 1. Fv/Fm of Microcystis aeruginosa对羟基苯甲酸P-hydroxybenzoic acid 对香豆酸P-coumaric acid 水杨酸Salicylic acid 咖啡酸Caffeic acid 010×10−620×10−640×10−660×10−680×10−6 0.3080.3100.2920.3020.0390.000 0.3080.3100.3140.3240.0490.000 0.3080.3090.0230.0140.0000.000 0.3080.3310.2760.3600.0380.000 注:0—80×10−6分别对应添加的4种酚酸浓度,表中数据是在微囊藻培养期结束时测得的Fv/Fm。 Note: 0—80×10−6 respectively correspond to the four added phenolic acid concentrations. The data in the table are the Fv/Fm measured at the end of the Microcystis culture period. 表 2 铜绿微囊藻叶绿素含量(g·L-1)Table 2. Chlorophyll content of Microcystis aeruginosa对羟基苯甲酸P-hydroxybenzoic acid 对香豆酸P-coumaric acid 水杨酸Salicylic acid 咖啡酸Caffeic acid 010×10−620×10−640×10−660×10−680×10−6 0.5681.0141.1380.7750.0000.000 0.5680.7370.8620.5680.0000.000 0.5680.7960.0090.0000.0000.000 0.5682.0932.2011.3590.0000.000 注:0—80×10−6分别对应添加的4种酚酸浓度,表中数据是微囊藻培养期结束时测得的叶绿素含量。 Note: 0—80×10−6 respectively correspond to the four phenolic acid concentrations added. The data in the table is the chlorophyll content measured at the end of the Microcystis culture period. 2.2 酚络合态铁的生物可利用性
根据上述试验结果可以得出,当这4种典型泥炭源酚酸的浓度达10 mg·L−1时,从生物量、存活率以及光合作用强度来说对微囊藻的生长没有明显抑制作用。普遍认为,藻类吸收Fe主要是离子形态,而不是有机络合态Fe[24]。目前,仅观察到在产生铁载体的微生物中存在铁载体复合物的吸收及其在细胞中的还原[25]。已有研究发现,有机络合态铁中铁的释放途径不同。其中包括简单的配体-金属平衡(Ligand-Metal balance),平衡在初级生产者消耗铁后发生变化,促进铁从络合物中分离。另一个途径是基于配体的降解,这也导致了Fe和配体的分离。第三种可能是通过有机态铁的还原,降低配体对铁的亲和力,并导致Fe的释放。这个过程可能是由于络合物的自还原/氧化而发生的,这意味着配体氧化同时也释放产生Fe[26]。尤其是光还原分解对铁的生物利用度有很大影响,这一释放铁途径被称为AHS(aquatic humic substances)机制[12]。
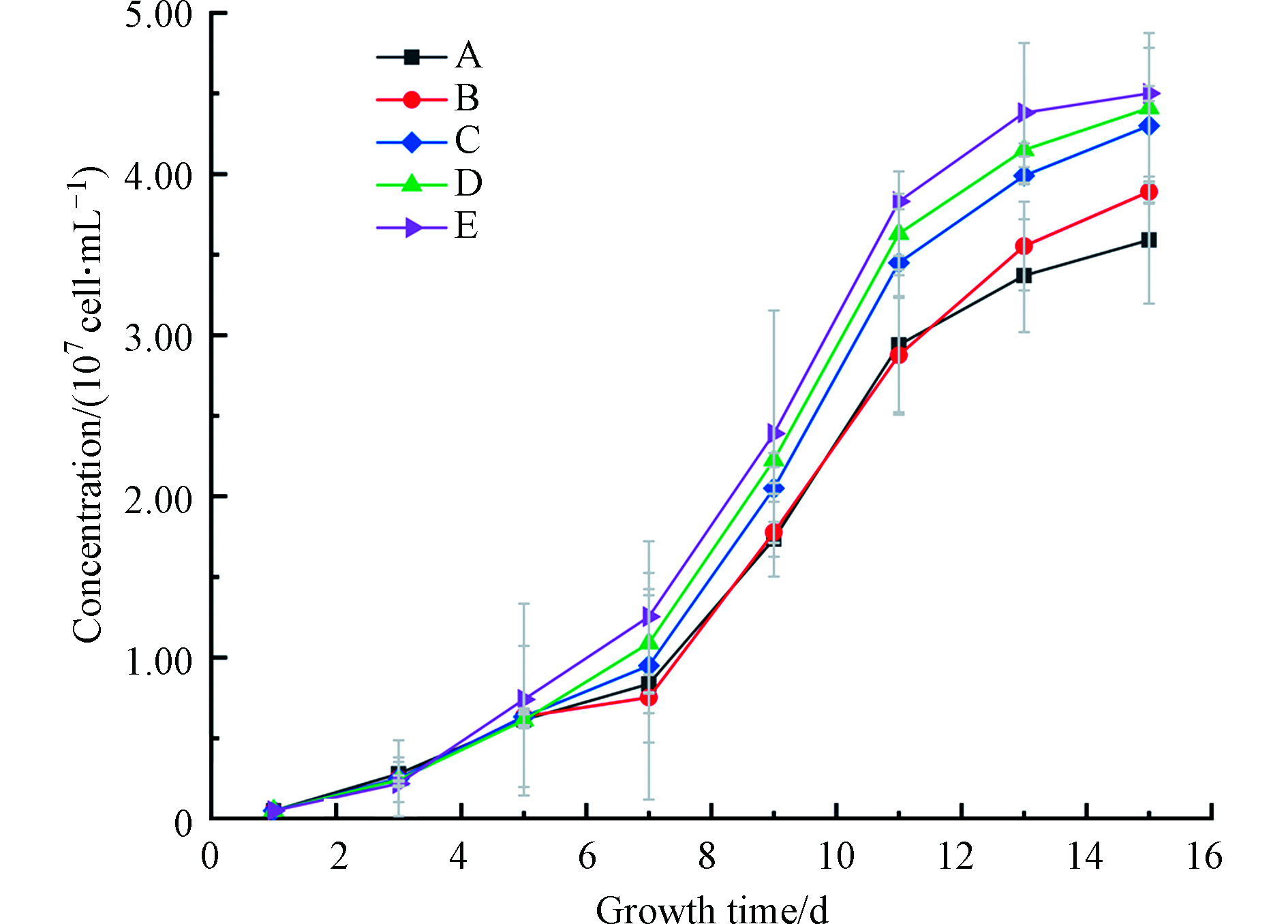
图3是加入不同酸和Fe2+的微囊藻生长曲线。施加和不加Fe2+的对照试验表明,在培养1—9 d,两组生长速度以及生物量大致相同。在第9天后,施加Fe2+组的生长速度放缓,最终的藻密度低于对照组。图3表明在没有配体存在的情况下,加入一定量的铁对微囊藻生长促进作用不明显。同时,观察发现,在藻类指数生长阶段出现了较高的pH值(高达10.5),这与二氧化碳生物需求增加有关。在指数生长结束和平台期开始后,pH值略下降。在藻类生长平缓或生长不良的样品中,pH值无显著变化,pH值大多保持在6—8。
能促进藻类生长的酚酸应当与三价铁有较高的亲和力,与二价铁有较低的亲和力[27]。试验表明,相对其他3种酚酸铁配合物体系,水杨酸铁不能有效地为微囊藻提供生物可利用性铁,这可能与水杨酸的稳定性较强有关[27]。对照表明,用咖啡酸处理的微囊藻生长良好,最高浓度达到2.19×107 cell·mL−1。这可能是咖啡酸中的儿茶酚基结构所引起的,并且有更高的氧化还原潜力,更容易将Fe从配合物中释放。Santana等 [28]的研究也证实了在生物条件下还原络合物的可能性。总体上,酚酸的加入提高了藻类对Fe的生物可利用率。
图2显示藻类存活率从第10天开始明显下降,藻类计数可能包括了死藻,因此选择第11天数据进行显著性分析。结果表明(表3),在0.05的置信水平下,咖啡酸的加入对微囊藻生长有显著促进作用,而水杨酸在0.05的置信水平下,对微囊藻生长无显著促进作用。
 图 3 微囊藻生长曲线Figure 3. Microcystis growth curveA.水杨酸+硫酸亚铁 B.咖啡酸+硫酸亚铁 C.水杨酸+草酸+硫酸亚铁 D.水杨酸+乙酸+硫酸亚铁 E.咖啡酸+草酸+硫酸亚铁 F.咖啡酸+乙酸+硫酸亚铁 G.水杨酸+柠檬酸+硫酸亚铁 H.咖啡酸+柠檬酸+硫酸亚铁 1_3.不添加酸和铁的对照组 Fe1_3硫酸亚铁A. Salicylic acid+Ferrous sulfate B. Caffeic acid+Ferrous sulfate C. Salicylic acid+Oxalic acid+Ferrous sulfate D. Salicylic acid+Acetic acid+Ferrous sulfate E. Caffeic acid+Oxalic acid+Ferrous sulfate F. Caffeic acid+Acetic acid+Ferrous sulfate G. Salicylic acid+Citric acid+Ferrous sulfate H. Caffeic acid+Citric acid+Ferrous sulfate 1_3. Control group without acid and iron Fe1_3. Ferrous sulfate表 3 第11天不同试验组微囊藻浓度变化的相关性矩阵Table 3. Correlation matrix of changes in the concentration of Microcystis in different test groups on the 11th day
图 3 微囊藻生长曲线Figure 3. Microcystis growth curveA.水杨酸+硫酸亚铁 B.咖啡酸+硫酸亚铁 C.水杨酸+草酸+硫酸亚铁 D.水杨酸+乙酸+硫酸亚铁 E.咖啡酸+草酸+硫酸亚铁 F.咖啡酸+乙酸+硫酸亚铁 G.水杨酸+柠檬酸+硫酸亚铁 H.咖啡酸+柠檬酸+硫酸亚铁 1_3.不添加酸和铁的对照组 Fe1_3硫酸亚铁A. Salicylic acid+Ferrous sulfate B. Caffeic acid+Ferrous sulfate C. Salicylic acid+Oxalic acid+Ferrous sulfate D. Salicylic acid+Acetic acid+Ferrous sulfate E. Caffeic acid+Oxalic acid+Ferrous sulfate F. Caffeic acid+Acetic acid+Ferrous sulfate G. Salicylic acid+Citric acid+Ferrous sulfate H. Caffeic acid+Citric acid+Ferrous sulfate 1_3. Control group without acid and iron Fe1_3. Ferrous sulfate表 3 第11天不同试验组微囊藻浓度变化的相关性矩阵Table 3. Correlation matrix of changes in the concentration of Microcystis in different test groups on the 11th day1_3 Fe1_3 A B C D E F G H 1_3 1 0.963 0.971 −0.358 0.474 0.657 0.246 0.461 0.983 0.491 Fe1_3 0.963 1.00 1.000* −0.095 0.221 0.835 −0.022 0.682 0.996 0.707 A 0.971 1.000* 1.00 −0.126 0.251 0.818 0.008 0.659 0.999* 0.685 B −0.358 −0.095 −0.126 1.00 −0.992 0.468 −0.993 0.663 −0.179 0.637 C 0.474 0.221 0.251 −0.992 1.00 −0.352 0.970 −0.563 0.302 −0.534 D 0.657 0.835 0.818 0.468 −0.352 1.00 −0.569 0.972 0.785 0.979 E 0.246 −0.022 0.008 −0.993 0.970 −0.569 1.00 −0.746 0.062 −0.723 F 0.461 0.682 0.659 0.663 0.663 0.972 −0.746 1.00 0.618 0.999* G 0.983 0.996 0.999* −0.179 0.302 0.785 0.062 0.618 1.00 0.645 H 0.491 0.707 0.685 0.637 −0.534 0.979 −0.723 0.999* 0.645 1.00 注:*. 在 0.05 水平(双侧)上显著相关。Notes:*. Significant correlation at 0.05(bilateral) level. 2.3 泥炭沼泽源DOM-Fe的藻类可利用性
许多泥炭源有机质同时含有酚羟基和羧基,具有酚酸性质。但由于泥炭有机质组成复杂多样,现有技术尚不能有效分离不同性质有机化合物。因此,利用不同分子量段有机质与铁的络合物,开展藻类培养试验有助于客观评估泥炭源DOM-Fe的藻类可利用性。利用不同分子量段DOM-Fe,进行培养试验,铜绿微囊藻的生长情况如图4。表4 结果表明,在0.05 的置信水平下,不同组之间差异不具统计显著性,但图4 还是反映出有机态铁对藻类生长的促进趋势.
结果显示(图3和图4),不同分子量结合态Fe均促进了铜绿微囊藻的生长,但影响程度不同。添加Fe后,铜绿微囊藻的生物量和控制组相比均有增加,微囊藻生长得到促进,最终达到107 cell·mL−1。其中,微囊藻在7—11 d增长最快;其次,对比生长终点可以发现不同DOM-Fe促进效果存在差异:E组>D组>C组>B组>A组>无Fe组;第三,添加DOM显著促进了藻的生长。研究表明,相对于Fe3+,藻类更倾向于利用Fe2+[29]。这是由于具有一定还原能力的DOM可以减缓二价铁的氧化[30],从而提高了藻类对铁的利用率。此外,不同分子量段DOM与Fe的络合稳定常数略有不同,较高分子量的DOM(>3 kD)与Fe的络合稳定常数较小[30],在光照或者其他条件下容易发生解离,产生易被藻类利用的Fe。而泥炭源低分子量DOM(<1 KD)络合态铁,由于其络合稳定的常数相对较高,在培养体系中更加稳定,相对不易被藻类利用。
表 4 第11天不同试验组铜绿微囊藻生长浓度变化的相关性矩阵Table 4. Correlation matrix of growth concentration changes of Microcystis aeruginosa in different test groups on the 11th dayA B C D E A 1 −.751 .350 −.167 .770 B −.751 1 −.881 .776 −.158 C .350 −.881 1 −.982 −.327 D −.167 .776 −.982 1 .500 E .770 −.158 −.327 .500 1 注:*. 在 0.05 水平(双侧)上显著相关. Notes:*. Significant correlation at 0.05(bilateral) level. 3. 结论(Conclusion)
(1)4种酚酸对藻类生长的影响均呈现“低促高抑”的规律。从藻类生物量和叶绿素含量来看,抑藻效果从高到低:水杨酸>对羟基苯甲酸>对香豆酸>咖啡酸;结合藻类的存活率,虽然低浓度酚酸刺激了藻类生物量的增长,但是也对藻类的生存产生了一定的负面影响:在添加10 mg·L−1酚酸的几组样品中,微囊藻的存活率都略低于控制组。
(2)添加酚酸的藻类样品中,当水杨酸浓度达到20 mg·L−1时,Fv/Fm明显降低(0.3降低到0.02左右),而其它3种酚酸浓度达到60 mg·L−1才出现抑制,说明水杨酸抑制作用最强。
(3)不同酚铁络合物的生物可利用性存在差异:相对咖啡酸和水杨酸,水杨酸络合态铁更难被藻类利用,除酚毒性效应外,还与其较高的络合稳定性有关。
(4)泥炭源不同分子段DOM-Fe对藻类生长的促进作用从高到低依次为:>3 KD,1—3 KD,<1 KD。高分子段DOM(>3 kD)与Fe的络合稳定常数最小,在光照或者其他条件下容易发生解离,更易释放Fe而被藻类利用;泥炭源低分子量DOM(<1 KD)络合态铁,因其络合稳定常数相对较高,相对不易被藻类利用。
致谢:感谢中国科学院水生生物研究所的大力支持。
-
图 2 不同剂量B[a]P暴露对小鼠肝脏氨基酸、TCA循环和胆汁酸代谢的影响
Figure 2. Effects of exposure to B[a]P on amino acids, TCA cycle and bile acid metabolism in the liver of mice (a) PLS-DA score plot;(b) Box plots of amino acids with the significant difference in different groups;(c) the relevant metabolic pathways after exposure to B[a]P with low doses ;(d) the relevant metabolic pathways after exposure to B[a]P with high doses
表 1 氨基酸代谢物的质谱参数
Table 1. Mass spectrometry parameters for amino acid metabolites
化合物Compounds 检测离子对Transitions 化合物Compounds 检测离子对Transitions 化合物Compounds 检测离子对Transitions 肾上腺素 183.9→166.1a 183.9→107.2b 去甲肾上腺素 170.2→107.1 170.2→152.2 3-羟基苯甲酸 154.1→136.1 154.1→80.1 5-羟色胺 177.2→160.2 177.2→115.1 褪黑素 233.2→174.2 233.2→159.1 3-羟基犬尿氨酸 224.9→208.1 224.9→162.1 胆碱 104.2→60.2104.2→58.2 肌酸 132.1→90.2132.1→44.2 5-氨基戊酸 118.4→55.2 118.4→101.1 谷氨酰胺 147.2→84.1 147.2→130.1 多巴胺 153.9→91.2 153.9→136.9 5-羟基吲哚乙酸 192.3→146.1192.3→91.2 甘氨酸 76.1→30.2 肌酐 114.3→44.2 二羟基苯乙酸 166.4→122.9 组胺 112.3→95.2 112.3→41.2 犬尿酸 190.1→144.1190.1→89.1 γ-氨基丁酸 104.1→87.1104.1→69.1 多巴 198.1→152.2198.1→107.2 二羟基苯乙醇 152.8→123.0152.8→95.1 犬尿氨酸 209.2→192.2209.2→94.1 丙氨酸 90.1→56.2 90.1→44.2 苯丙氨酸 166.1→120.2166.1→103.1 牛磺酸 126.0→107.8 126.0→43.95 色氨酸 205.2→188.0205.2→146.1 酪胺 138.2→121.1138.2→77.1 酪氨酸 182.1→91.1182.1→136.2 黄尿酸 206.1→160.1206.1→132.1 4-羟基脯氨酸 132.1→86.2132.1→68.1 乙酰胆碱 146.2→97.1 146.2→43.1 精氨酸 175.2→70.2 175.2→60.2 精氨琥珀酸 291.2→70.1 291.2→116.2 天冬精氨 133.1→87.2133.1→28.2 天冬氨酸 134.1→74.2134.1→88.1 肉碱 162.2→60.3162.2→85.2 瓜氨酸 176.2→70.2 176.2→159.2 半胱氨酸 122.2→59.2122.2→76.1 胱氨酸 241.3→74.1 241.3→152.1 谷氨酸 148.1→84.1148.1→56.1 组氨酸 156.2→110.2156.2→56.2 同型半胱氨酸 136.2→90.1136.2→56.2 异亮氨酸 132.2→86.2 132.2→69.2 亮氨酸 132.4→86.2 132.4→30.2 赖氨酸 147.4→84.2 甲硫氨酸 150.2→56.1 150.2→104.1 烟酰胺 123.1→80.1123.1→78.1 鸟氨酸 133.2→70.2 133.2→116.2 丝氨酸 106.1→60.1 脯氨酸 116.1→70.1 苏氨酸 120.1→104.1120.1→74.3 缬氨酸 118.1→72.2118.1→55.2 表 2 有机酸代谢物的质谱参数
Table 2. Mass spectrometry parameters for organic acid metabolites
化合物Compounds 检测离子对Transitions 化合物Compounds 检测离子对Transitions 化合物Compounds 检测离子对Transitions α-酮戊二酸 145.0→100.9 145.0→56.8 乌头酸 173.0→84.9173.0→129.0 柠檬酸 191.0→111191.0→86.9 富马酸 115.1→71.1115.1→26.9 衣康酸 129.0→60.1 129.0→40.8 乳酸 89.1→42.9 苹果酸 133.0→71.1 133.0→73.0 丙酮酸 87.1→43.0 琥珀酸 117→73.1 表 3 胆汁酸代谢物的质谱参数
Table 3. Mass spectrometry parameters for bile metabolites
化合物Compounds 检测离子对Transitions 化合物Compounds 检测离子对Transitions 化合物Compounds 检测离子对Transitions 甘氨胆酸 464.0→74.0a 464.0→402.2b 甘氨鹅脱氧胆酸 448.1→74.0 448.1→386.0 牛磺胆酸 514.2→124.0 514.2→107.0 α-鼠胆酸 373.1→355.3 373.1→373.2 牛磺鹅脱氧胆酸 498.0→124.0 498.0→80.0 β-鼠胆酸 391.1→355.3 391.1→373.2 ω-鼠胆酸 373.1→159.2 373.1→337.5 鹅去氧胆酸 357.1→105.1 357.1→135.4 猪去氧胆酸 357.1→161.2 357.1→135.2 石胆酸 359.1→135.2 359.1→95.1 去氧胆酸 391.0→345.3 391.0→327.1 胆酸 407.3→343.3 407.3→288.9 熊去氧胆酸 357.1→161.2 357.1→135.2 牛磺熊脱氧胆酸 498.0→124.0 498.0→80.0 甘氨熊脱氧胆酸 448.05→74.0 448.05→386.2 注:a定量离子对:quantitative ion; b定性离子对:qualitative ion. -
[1] HUANG Y Q, WANG Y, WANG H, et al. Prevalence of mental disorders in China: A cross-sectional epidemiological study [J]. The Lancet Psychiatry, 2019, 6(3): 211-224. doi: 10.1016/S2215-0366(18)30511-X [2] NAGARAJA A S, SADAOUI N C, DORNIAK P L, et al. SnapShot: stress and disease [J]. Cell Metabolism, 2016, 23(2): 388-388.e1. doi: 10.1016/j.cmet.2016.01.015 [3] SIRIVELU M P, MOHANKUMAR S M J, WAGNER J G, et al. Activation of the stress axis and neurochemical alterations in specific brain areas by concentrated ambient particle exposure with concomitant allergic airway disease [J]. Environmental Health Perspectives, 2006, 114(6): 870-874. doi: 10.1289/ehp.8619 [4] CLOUGHERTY J E, KUBZANSKY L D. A framework for examining social stress and susceptibility to air pollution in respiratory health [J]. Environmental Health Perspectives, 2009, 117(9): 1351-1358. doi: 10.1289/ehp.0900612 [5] VIRGOLINI M B, BAUTER M R, WESTON D D, et al. Permanent alterations in stress responsivity in female offspring subjected to combined maternal lead exposure and/or stress [J]. NeuroToxicology, 2006, 27(1): 11-21. doi: 10.1016/j.neuro.2005.05.012 [6] ZHOU L L, XU J, ZHANG J S, et al. Prenatal maternal stress in relation to the effects of prenatal lead exposure on toddler cognitive development [J]. NeuroToxicology, 2017, 59: 71-78. doi: 10.1016/j.neuro.2017.01.008 [7] CLOUGHERTY J E, ROSSI C A, LAWRENCE J, et al. Chronic social stress and susceptibility to concentrated ambient fine particles in rats [J]. Environmental Health Perspectives, 2010, 118(6): 769-775. doi: 10.1289/ehp.0901631 [8] KUBZANSKY L D, KAWACHI I, SPARROW D. Socioeconomic status, hostility, and risk factor clustering in the normative aging study: Any help from the concept of allostatic load? [J]. Annals of Behavioral Medicine, 1999, 21(4): 330-338. doi: 10.1007/BF02895966 [9] ZHANG L B, LIU X L, YOU L P, et al. Benzo(a)Pyrene-induced metabolic responses in Manila clam Ruditapes philippinarum by proton nuclear magnetic resonance (1H NMR) based metabolomics [J]. Environmental Toxicology and Pharmacology, 2011, 32(2): 218-225. [10] KALKHOF S, DAUTEL F, LOGUERCIO S, et al. Pathway and time-resolved benzo[a]Pyrene toxicity on Hepa1c1c7 cells at toxic and subtoxic exposure [J]. Journal of Proteome Research, 2015, 14(1): 164-182. doi: 10.1021/pr500957t [11] OH T W, KIM K Y, DO H J, et al. Comparative analysis of acute and chronic stress-induced neurobehavioral alteration and liver injury in mice [J]. Molecular & Cellular Toxicology, 2020, 16(4): 367-375. [12] RIEDL J, SCHREIBER R, OTTO M, et al. Metabolic effect level index links multivariate metabolic fingerprints to ecotoxicological effect assessment [J]. Environmental Science & Technology, 2015, 49(13): 8096-8104. [13] 石磊. 苯并(a)芘及大气PM2.5染毒大鼠肝和脑代谢组学研究[D]. 太原: 山西医科大学, 2017. SHI L. Metabolism studies on liver and brain in rats exposed to benzo(a) Pyrene and atmospheric fine particulate matter[D]. Taiyuan: Shanxi Medical University, 2017(in Chinese).
[14] MEYNIAL-DENIS D. Glutamine metabolism in advanced age [J]. Nutrition Reviews, 2016, 74(4): 225-236. doi: 10.1093/nutrit/nuv052 [15] WANG Q L, XUE Y J. Characterization of solid tumors induced by polycyclic aromatic hydrocarbons in mice [J]. Medical Science Monitor Basic Research, 2015, 21: 81-85. doi: 10.12659/MSMBR.893945 [16] MICHURINA S V, BORODIN I I, KOLESNIKOV S I, et al. [Liver and Its Lymph Region at Benzo[a]pyrene Effects in an Experiment] [J]. Vestnik Rossiiskoi akademii meditsinskikh nauk, 2015, 2: 242-248. [17] BRÖER S. Amino acid transporters as modulators of glucose homeostasis [J]. Trends in Endocrinology & Metabolism, 2022, 33(2): 120-135. [18] BIGOT A, TCHAN M C, THOREAU B, et al. Liver involvement in urea cycle disorders: A review of the literature [J]. Journal of Inherited Metabolic Disease, 2017, 40(6): 757-769. doi: 10.1007/s10545-017-0088-5 [19] LIU X J, LIU H L, ZHAO D, et al. Hepatic metabolomics of the compatibility effect of Xiaoyaosan on CUMS-induced depression based on the TCM theory of “Treating Diseases via Regulating the Liver's Function” [J]. Journal of Pharmaceutical and Biomedical Analysis, 2021, 201: 114123. doi: 10.1016/j.jpba.2021.114123 [20] 林珠灿, 易开, 许文, 等. 超高效液相色谱-四极杆飞行时间质谱法研究菊三七总生物碱致肝毒性的血清代谢组学 [J]. 分析科学学报, 2018, 34(3): 297-302. doi: 10.13526/j.issn.1006-6144.2018.03.001 LIN Z C, YI K, XU W, et al. A serum metabonomic evaluation of the total alkaloids of Gynura segetum merr.-induced liver toxicity in rats by ultra-high performance liquid chromatography-quadrupole-time of flight mass spectrometry [J]. Journal of Analytical Science, 2018, 34(3): 297-302(in Chinese). doi: 10.13526/j.issn.1006-6144.2018.03.001
[21] WEISS N, BARBIER SAINT HILAIRE P, COLSCH B, et al. Cerebrospinal fluid metabolomics highlights dysregulation of energy metabolism in overt hepatic encephalopathy [J]. Journal of Hepatology, 2016, 65(6): 1120-1130. doi: 10.1016/j.jhep.2016.07.046 [22] LIU X, WANG H, LIANG X, et al. Hepatic metabolism in liver health and disease[M]//Liver Pathophysiology. Amsterdam: Elsevier, 2017: 391-400. [23] LI H, YUAN L, WANG Z L, et al. Effects of dietary whole grain buckwheat and oat on benzo[a]Pyrene-induced genotoxicity, oxidative and pyroptotic injury in liver of mice [J]. Journal of Functional Foods, 2022, 93: 105082. doi: 10.1016/j.jff.2022.105082 [24] JIA K K, PAN S M, DING H, et al. Chaihu-Shugan San inhibits inflammatory response to improve insulin signaling in liver and prefrontal cortex of CUMS rats with glucose intolerance [J]. Biomedicine & Pharmacotherapy, 2018, 103: 1415-1428. [25] LIU S Z, LUO Y H, MORAIS C L M, et al. Spectrochemical determination of effects on rat liver of binary exposure to benzo[a]Pyrene and 2, 2', 4, 4'-tetrabromodiphenyl ether [J]. Journal of Applied Toxicology:JAT, 2021, 41(11): 1816-1825. doi: 10.1002/jat.4165 [26] MEHRANFARD N, YAZDI A, SARDOOI A R, et al. Honey protects against chronic unpredictable mild stress induced- intestinal barrier disintegration and hepatic inflammation [J]. Molecular Biology Reports, 2020, 47(11): 8475-8484. doi: 10.1007/s11033-020-05888-4 [27] CLOUGHERTY J E, LEVY J I, KUBZANSKY L D, et al. Synergistic effects of traffic-related air pollution and exposure to violence on urban asthma etiology [J]. Environmental Health Perspectives, 2007, 115(8): 1140-1146. doi: 10.1289/ehp.9863 [28] SONG X Y, LIU J H, GENG N B, et al. Multi-omics analysis to reveal disorders of cell metabolism and integrin signaling pathways induced by PM2.5 [J]. Journal of Hazardous Materials, 2022, 424: 127573. doi: 10.1016/j.jhazmat.2021.127573 [29] WANG F D, ZHANG H J, GENG N B, et al. A metabolomics strategy to assess the combined toxicity of polycyclic aromatic hydrocarbons (PAHs) and short-chain chlorinated paraffins (SCCPs) [J]. Environmental Pollution, 2018, 234: 572-580. doi: 10.1016/j.envpol.2017.11.073 -




 下载:
下载: