-
部分亚硝化-厌氧氨氧化 (partial nitrotation anammox process, PN/A) 工艺是一种新型、高效、节能的自养脱氮工艺,相对于传统硝化/反硝化脱氮工艺,具有无需碳源投加,可减少约60%曝气量、80%污泥产量、83% N2O排放量等优势[1],为处理含氮废水提供了新途径。目前,PN/A工艺已成功应用于污泥消化液、食品工业、养殖畜牧业、垃圾渗滤液等废水的处理,且脱氮性能良好[2-3]。这得益于在高温 (≥30 ℃) 、高NH4+-N (≥500 mg·L−1) 的废水中,其游离氨 (free ammonia, FA) >0.1 mg·L−1,游离亚硝酸盐 (free nitrous acid , FNA) >0.06 mg·L−1,达到了抑制NOB (nitrite oxidizing bacteria)生长的条件[4]。在可持续发展理念指引下,PN/A工艺具有广阔应用前景。然而,虽然PN/A工艺研究已较为深入,且已实现了高NH4+-N废水处理的工程应用,但PN/A工艺在城市污水主流处理中的应用仍未被充分确认。
PN/A工艺是氨氧化菌 (ammonia oxidizing bacteria, AOB) 在有氧条件下先将废水中约50%的NH4+-N转化为NO2−-N,剩余50%的NH4+-N和生成的NO2−-N在无氧条件下由厌氧氨氧化菌(anaerobic ammonia oxidizing bacteria, AnAOB)转化为N2[5]。在主流低温、低NH4+-N的条件下,NOB具有竞争优势;在有氧条件下,生成的NO2−-N极易被NOB进一步氧化为NO3−-N,从而引起出水NO3−-N升高,抑制AnAOB生长,严重破坏系统的脱氮性能和稳定性。因此,实现主流PN/A工艺稳定运行的关键是NOB活性抑制。为此,研究者们试图通过控制溶解氧 (dissolved oxygen, DO) 、污泥龄(sludge age, SRT)、好氧/缺氧交替、侧流驯化、添加抑制剂等策略抑制NOB活性。2007—2021年,关于PN/A工艺的年均发文量为16篇。2021年的发文量为60篇,达到研究顶峰,而2016年为年均增长率顶峰,为66.67%。其中,关于主流PN/A工艺的论文量在2017—2019年呈陡升趋势,而在2019年之后呈下降趋势。同时,调研当下主流PN/A工艺的工程应用情况,仅有荷兰鹿特丹污水处理厂、新加坡樟宜污水处理厂、奥地利Strass污水处理厂和西安第四污水处理厂实现了大规模的应用。综合分析判定,目前主流PN/A工艺普遍表现出脱氮性能低、稳定性差的问题,相关研究遇到了瓶颈。如何提高主流PN/A工艺的脱氮性能并实现长期稳定运行成为研究热点。
本文总结PN/A工艺中主要功能微生物的生长动力学特性,探讨目前主流PN/A中DO限制、好氧-缺氧交替、生物强化、投加抑制剂、SRT筛选、低NO2−-N质量浓度等NOB抑制策略的可靠性,并从性能和工艺复杂程度,探讨普遍采用的实现多重策略联合调控的反应系统,提出应用活性污泥数学模型 (activated sludge model, ASM) 助力主流PN/A工艺稳定运行调控的方案,帮助研究者从众多影响因子中辨认出关键调控参数、有效识别调控范围,以期探索将该模型应用于小试研究中的方法,并助力主流PN/A工艺中NOB活性抑制的研究和实践。
-
1) AOB。AOB是一类化能自养型微生物,分为5个属:Nitrosomonas、Nitrosospira、Nitrosolobus、Nitrosovibrio、Nitrosococcus[6]。在当前污水处理研究中报道的AOB均属于这5个菌属[7]。不同的AOB菌属表现出不同的生物特性。在已知AOB菌属中,AOB对DO的亲和能力 (以氧的半饱和系数Ko表征) 为0.03~0.30 mg·L−1,对底物NH4+-N的亲和能力(以氨氮饱和系数Ks表征)为0.50~1.62 mg·L−1 [8-14]。2) NOB。NOB是一类具有专一性的化能自养型微生物,分为7个属: Nitrobacter、Nitrococuus、Nitrospina、Nitrospira、Nitrotoga、 Nitrolancea和andidatus Nnitmaltima[15]。在污水处理中,主要以Nitrospira和Nitrobacter这2类菌属为主。在已知NOB菌属中,NOB的Ko为0.43~1.98 mg·L−1,对底物的Ks为0.11~13 mg·L−1 [14-23]。3) AnAOB。AnAOB的系统发育地位属于浮霉状菌目 (Planclomycetales) 。现已发现的菌属有6类:Caudidatus Brocadia、Caudidatus Kueueuia、Caudidatus Scaliudua、Caudidatus Auammoxoglobus、Caudidatus Jetteuia 和 Canditatus Anammoximicrobium[15]。在污水处理系统中,Caudidatus Brocadia和Caudidatus Kueueuia较为常见。AnAOB为自养菌,在32~33 ℃的倍增时间约为11 d[24]。在已知AnAOB菌属中,AnAOB对底物NH4+-N的Ks为0.10~0.39 mg·L−1,对底物NO2−-N的Ks为0.01~0.51 mg·L−1 [24-27]。
-
稳定高效的亚硝化过程是厌氧氨氧化发挥脱氮效能的基础。在这个过程中,伴随着NOB氧化中间产物NO2−-N过程,NOB与AOB对DO的竞争及与AnAOB对NO2−-N的争夺,都会影响PN/A工艺稳定运行。因此,主流条件下,维持稳定的亚硝化过程,关键是实现NOB活性的稳定抑制[25]。对比3类主要功能微生物动力学特性 (表1) 。当游离氨 (FA) 质量浓度为10~150 mg·L−1时会抑制AOB,而FA对NOB抑制作用更强,在FA质量浓度为0.1~1.0 mg·L−1时即对NOB有抑制作用。
-
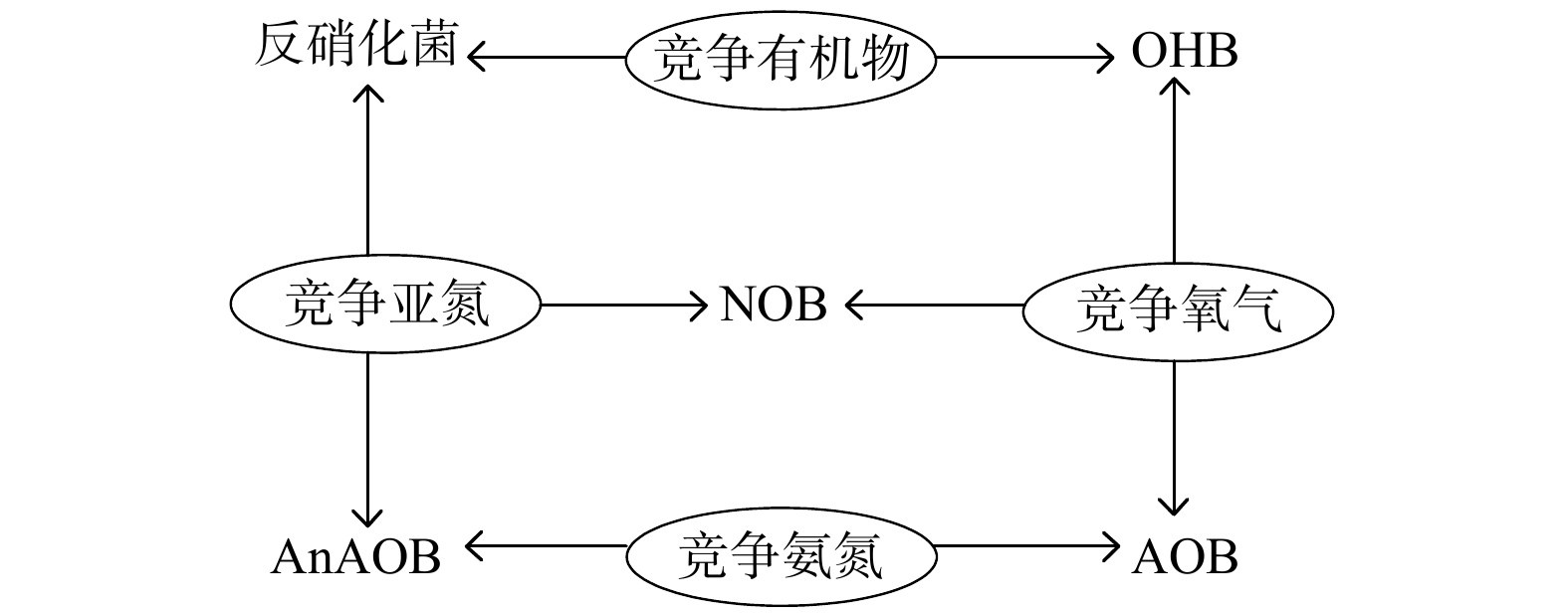
AOB、NOB、AnAOB和异养菌 (heterotrophic bacteria, HB) 是参与主流PN/A工艺的主要菌群。HB又分为反硝化菌和普通异养菌 (ordinary heterotrophic bacteria, OHB) 。各类微生物间的相互作用关系见图1。其中,AOB、NOB与OHB竞争氧气;NOB、AnAOB与反硝化菌竞争NO2−-N;反硝化菌和OHB竞争有机碳[22]。探究各类微生物特性和相互间复杂的协作竞争关系,从而挑选出有利于主流PN/A工艺长期稳定运行的功能微生物,对主流PN/A工艺稳定运行调控是十分有意义的。NOB是主流PN/A工艺中最主要的竞争性微生物,实现对NOB的有效抑制是当前主流PN/A工艺稳定运行的关键。
-
DO限制是NOB氧化亚硝酸盐的关键限制性因素。相对于NOB,AOB对DO具有更强的亲和力,其氧饱和常数为0.25~0.50 mg·L−1,而NOB的氧饱和常数为0.72~1.84 mg·L−1[27]。因此,在低曝气量下运行时,AOB比NOB的生长优势更强。WANG等[28]发现,当DO从1.5 mg·L−1降至0.3 mg·L−1,亚氮积累率 (nitrous accumulation rate, NAR) 从30%增至95%。然而,在DO为0.3 mg·L−1的条件下运行3个月后,NAR降至10%。CUI等[29]发现,控制反应器内DO为0.5 mg·L−1,在运行的前30 d,反应器内NAR大于90%;运行70 d以后,NAR降至80%以下;运行至第130天,NAR已降至10%以下,此时短程硝化转变为完全硝化,NOB活性抑制失效。包鹏等[30]发现,Nitrospira在低DO运行时的含量远高于Nitrobacter;在高DO运行时,Nitrobacter逐渐取代Nitrospira,成为优势菌属,而Nitrospira逐渐消失。随着DO的变化,NOB的优势菌属会发生可逆变化,长期低DO运行,NOB活性逐渐恢复。尽管控制DO是实现亚硝化的有效途径,但长期抑制NOB活性和增殖的目标尚不能实现,调控DO以实现抑制NOB也存在争议。因此,在PN/A工艺中除了进一步优化DO限制的控制策略外,还应与其他方法联用,以加强NOB活性抑制效果。
-
在主流条件下,通过创造交替缺氧与好氧的环境让污泥经历缺氧/好氧变化,有助于抑制NOB的活性。目前,普遍认同的抑制机理有:一是DO作为AOB和NOB共同的底物,AOB的氧亲和力高于NOB,控制合理DO,可在不影响AOB 活性的同时抑制 NOB 生长;二是利用NOB从缺氧阶段转变为好氧阶段后活性恢复的滞后性,采取好氧-缺氧交替以不断改变DO,利用其差异从而实现对NOB的有效抑制;三是好氧-缺氧交替扰乱生物的代谢过程,从而产生有抑制性的中间产物,如NO。QIU等[31]采用间歇曝气策略,设置曝气时间30 min、停曝时间15 min、DO<0.5 mg·L−1的反应条件,结果使氨氮转化率 (ammonia nitrogen conversion rate, ACR) 达到93.3%,NAR达到95%。这表明间歇曝气可抑制NOB生长。MIAO等[32]采用间歇曝气策略,设置曝气时间7 min、停曝时间21 min、DO<0.3 mg·L−1。在该条件下,ACR达到81%,出水NO3−-N<2 mg·L−1,这说明NOB的活性出现显著下降。XIE等[33]通过接种不同污泥,采用间歇曝气策略,考察了不同停曝比对NOB活性抑制的影响,发现在接种普通污泥和不稳定亚硝化污泥的反应器内, ACR分别为75.11%和65.65%,NAR均为0。这表明在接种这2类污泥的反应器内,间歇曝气无法抑制NOB活性。而在接种成熟的亚硝化污泥反应器内,平均ACR为65.42%,NAR也会从97.95%逐渐降至9.36%,这表明当接种该污泥时,反应初期NOB活性被短暂抑制,但随着反应时间延长,NOB活性不断恢复,最终NOB抑制失效。在上述研究中,尽管间歇曝气创造了缺氧/好氧交替和低DO环境[32-31],但当接种不同特性的污泥时,却无法全部实现NOB抑制。因此,在间歇曝气成功应用的案例中,可能还存在未被发现的其他抑制机制,间歇曝气对NOB活性的抑制机制还有待进一步研究。
-
生物强化策略是在PN/A系统中投加高AOB、AnAOB丰度的污泥,以提高生物质浓度的同时降低NOB的相对丰度,从而使NOB处于竞争劣势,实现城市污水部分亚硝化。如奥地利Strass污水处理厂在主流工艺上安装旋流器[34],通过旋流器从侧流 (污泥消化液) 中分离AnAOB和AOB补充主流工艺,从而强化AOB在主流中的数量,实现了对NOB的抑制[30]。曹丽娟等[35]发现,将主流反应器内的污泥混合液与侧流反应器内的污泥消化液进行交换,通过7 d交替40%污泥混合液的方式运行,总氮去除速率 (nitrogen removal rate, NRR) 达到0.08 kg·(m3·d)−1,总氮去除率 (nitrogen removal efficiency, NRE) 达到70%。当污泥消化液温度和NH4+-N质量浓度较高时,可为主流工艺提供富含AOB的亚硝化污泥来实现稳定的亚硝化。但值得思考的是,当侧流工艺中不能满足主流区对亚硝化污泥的需求量时,如何连续不断地给主流工艺提供亚硝化污泥,使主流PN/A工艺稳定运行。另一方面,如何确定侧流中短程硝化污泥给主流的补给量,使其能满足主流PN/A工艺中NH4+-N与NO2−-N的基质配比需求,仍尚待研究。
-
在城市污水PN/A系统中,特定化学物质的投加可降低NOB活性,又对其他脱氮功能微生物作用较小[28]。NO、NO2等氮氧化合物和NH2OH、N2H4等AnAOB代谢中间产物可作为NOB抑制剂,对系统脱氮性能有改善作用[34]。LI等[36]研究了NH2OH对好氧颗粒污泥PN化的影响,发现NH2OH投加质量浓度为8 mg·L−1时对NOB抑制效果最佳。然而,WANG等[37]发现,NH2OH对NOB的抑制为可逆性抑制,当NH2OH停止投加时,系统的硝酸盐会再次积累,NOB抑制失效[38]。因此,投加抑制剂对NOB抑制是可行的,若要维持长期、稳定的NOB抑制效果,则需不断地投加抑制剂,这无疑会增加成本,有悖于可持续发展理念。
-
污泥龄 (sludge retention time,SRT) 筛选即利用AOB与NOB生长速率间的差异,通过控制系统SRT大于AOB的世代周期,而小于NOB的世代周期,使AOB在系统内保持较高的浓度,而NOB被淘洗出系统[36]。在高温下,通过短SRT成功淘洗NOB的研究早有报道。在28~30 ℃下,新加坡樟宜污水处理厂将SRT控制为2.5 d,有效地维持了部分亚硝化[38]。LI[36]和HUBAUX等[39]均在30 ℃条件下,通过控制SRT (10~15 d) 实现了对NOB的有效抑制。而在中、低温条件下,随着AOB活性的受限,AOB与NOB很难形成很高的生长速率差,故利用SRT控制较难实现对NOB的淘洗[12]。高佳琦将[40]温度控制在20~25 ℃,在DO为0.27 mg·L−1时,将SRT从21 d缩短至10 d,以达到淘洗NOB的目的。尽管此时PN区的NAR随着排泥从38%增至62%,硝酸盐生成速率 (NaPR) 亦从0.1 kg·(m3·d)−1降至0.05 kg·(m3·d)−1,NOB活性显著降低,但系统生物量随着SRT的缩短而减少,造成NOB活性抑制效果不稳定。这与SEUNTJENS等[41]的研究结果一致。
目前,研究者多采用一段式反应器开展PN/A工艺的SRT筛选。在一段式反应器中,AnAOB颗粒污泥与硝化絮状污泥共存,SRT的调控受AnAOB低生长速率限制,因此,很难通过SRT筛选实现稳定、高效的亚硝化。相比于一段式,两段式反应器可为各功能微生物创造适宜的生存环境,在不同反应器中富集AOB和AnAOB,避免AnAOB与NOB对NO2−-N的竞争,还可对不同区进行SRT控制,从而实现稳定、高效的亚硝化。因此,更有望通过两段式反应器开展PN/A工艺的SRT筛选研究,以实现稳定、高效的亚硝化。
-
低NO2−-N策略是基于AnAOB对亚硝酸盐的亲和常数 (Ks= 0.005 mg·L−1) 比NOB (Ks=0.5 mg·L−1) 低的原理提出[40-43]。这表明AnAOB会优先利用产生的NO2−-N,使得AnAOB与NOB在争夺底物NO2−-N时竞争力更强,从而使得NOB缺少底物而生长被抑制。GU [44]发现当DO为1.2~1.5 mg·L−1,将每个缺氧段出水的NO2−-N控制在1.5 mg·L−1以下,NAR可达到92.5%,从而实现NOB抑制,并达到了0.16 kg·(m3·d)−1的脱氮效率。林兴[45]控制进入PN段的NO2−-N质量浓度为2.04 mg·L−1,NO3−-N质量浓度为13.75 mg·L−1,此时PN区硝氮生成速率 (nitrate nitrogen produce rate,NaPR) 从123.45 g·(m3·d)−1降至116.22 g·(m3·d)−1,出水NO3−-N维持稳定。这表明系统内NOB活性受到了抑制,脱氮效率达到0.29 kg·(m3·d)−1。然而,目前国内外对该策略研究仍较少,低NO2−-N控制对NOB的抑制还需进一步系统研究。
-
实现NOB的有效抑制是目前主流PN/A工艺的瓶颈。在现阶段的主流条件下,传统单一的NOB抑制策略虽取得了一定进展,但实施效果不佳,长期运行仍无法实现稳定的NO2−-N积累。NOB会通过二次增殖、优势菌种演替等方式对某一特定的控制策略产生适应性,这就造成了单一的控制策略对NOB所产生的抑制效果具有暂时性、可逆性的特点,使得二次增殖产生的NOB,很难通过原来的手段被有效控制[46]。近年来,研究者们试图构建实现多重调控的PN/A系统来解决NOB抑制问题,已证实了多重策略联用实现长期NOB抑制的可行性。
-
林兴[45]构建了分区一体式PN/A反应系统 (图2) 。PN区采用生物膜,AN区采用悬浮污泥。通过气升装置将AN区出水回流至PN区,通过设置不同的回流比促使PN区低NO2−-N (2.04 mg·L−1)的实现。调节PN区曝气量将DO控制在0.3 mg·L−1。运行结果表明,反应系统的NRR为0.2 kg·(m3·d)−1,NRE为55%,d(NO3−-N) /d(NH4+-N)=0.25,NOB抑制效果较好。d(NO3−-N) /d(NH4+-N)这一比值表明亚硝化反应出水的NO3−-N由NH4+-N转化的比例,该值越小则表示NOB抑制效果越好。但也发现,NOB会附着在PN区的膜上导致后期难以去除,使得NOB活性的抑制效果不稳定。高佳琦[40]在上述反应器的基础上,将PN区生物膜换成了悬浮污泥,通过PN区排泥实现短SRT (10 d) 控制,结合低NO2−-N(2 mg·L−1),低DO(0.3 mg·L−1),在反应器运行初期,实现了NAR为30%~40%,这表明NOB活性得到了有效抑制。但随着反应时间延长,系统生物量不断减少,系统脱氮性能不断降低,NOB抑制效果依然不稳定。
-
GU [44]构建了连续多级一体式PN/A系统 (图3) ,在好氧区 (PN) 采用活性污泥,缺氧区 (AN) 在采用anammox的生物填料。采用多点进水的方式,多级分段设置回流,污泥在空间上不断经历好氧和缺氧变化,通过N2进行混合,再经过厌氧氨氧化过程,使每个缺氧室的出水NO2−-N 小于1.5 mg·L−1。在下一个好氧室的NOB上产生了NO2−-N限制的情况,控制DO在1.2~1.5 mg·L−1,最终NRR为0.16 kg·(m3·d)−1,NRE为87.13%, d(NO3−-N) /d(NH4+-N)=0.11,这说明NOB得到有效抑制。然而,从实现方式难度来看,N2在实际应用中并不可行,且该工艺构造复杂。本课题组自主研发的反应系统采用分区一体化设计,利用气升回流使缺氧区出水回流至好氧区以稀释NO2−-N质量浓度,该方式操作更为简单。但目前国内外对该策略的研究仍较少,低NO2−-N策略对NOB的抑制还需进一步系统研究。
-
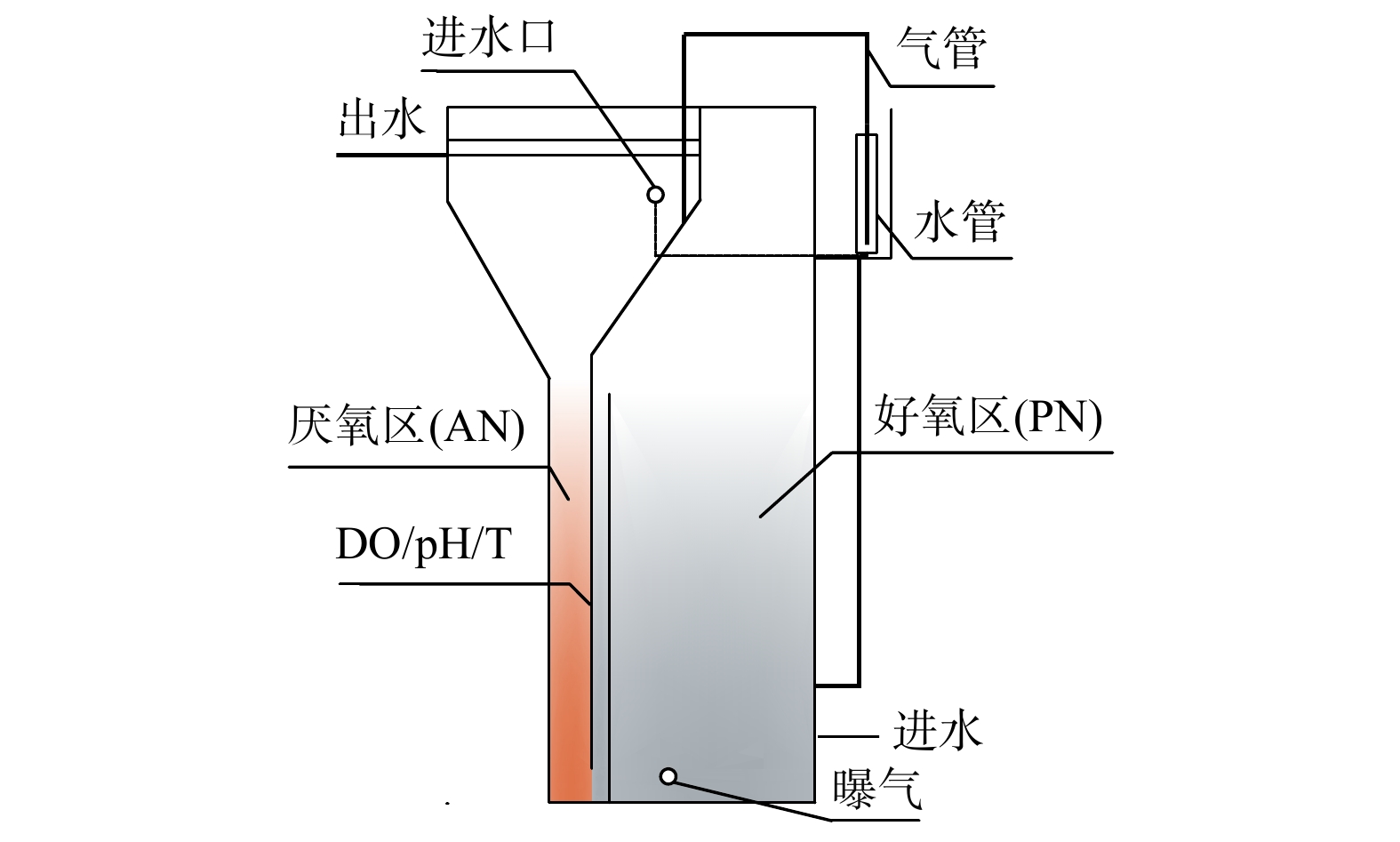
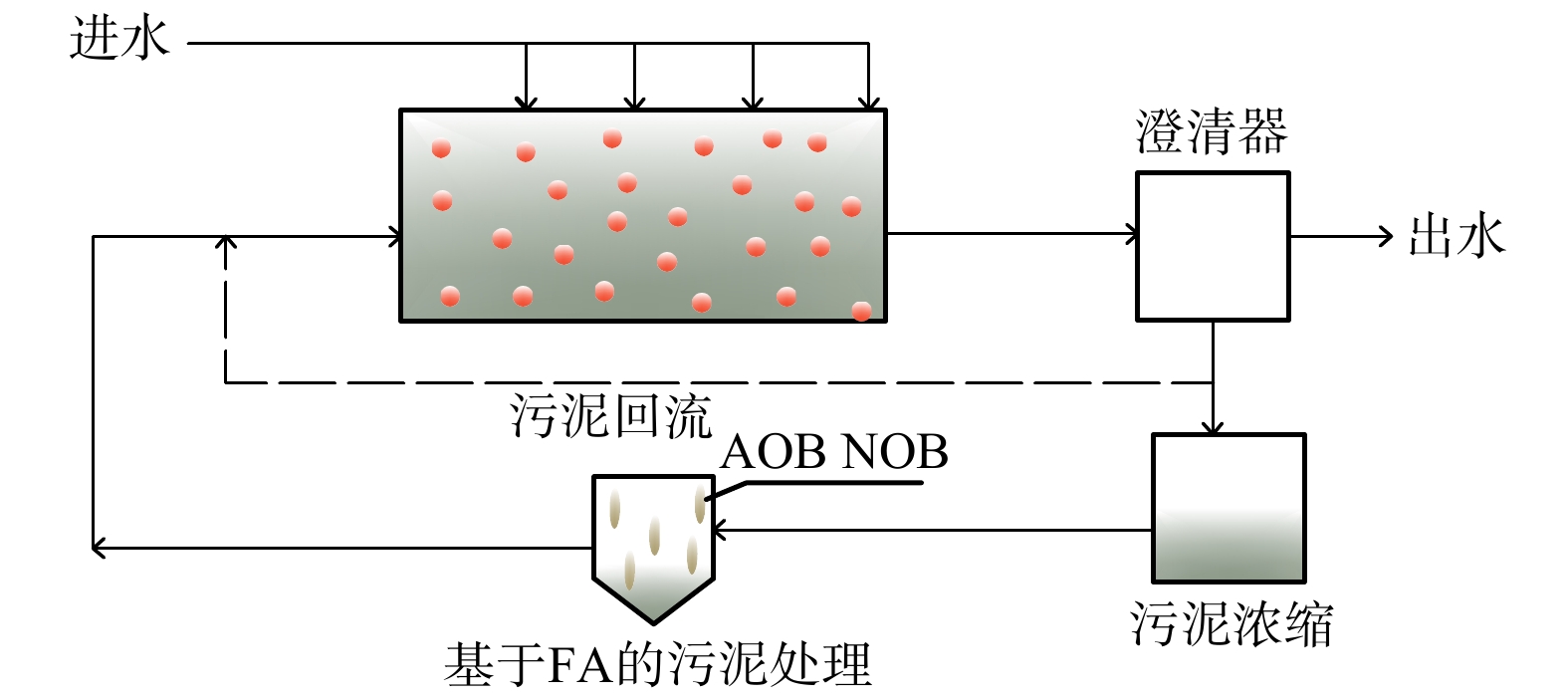
WANG [28]构建了生物膜和悬浮生长模式的一体化固定膜活性污泥反应器 (integrated fixed-film activated sludge,IFAS) (图4) ,这是一种混合一体式PN/A系统。实验在2个实验室规模的序批式反应器 (SBR) 上进行,反应器接纳实际主流废水,通过FA处理侧流污泥灭活NOB,使用低DO和厌氧氨氧化菌清除NO2−-N。NOB对高FA、低DO均具有适应性,短暂抑制后NOB又大量繁殖,而耦合低NO2−-N浓度策略后,维持有效的NOB活性抑制状态。与只有FA、低DO策略相比,在其他条件相同的情况下,NRE提高74%。出水NO3−-N为4 mg·L−1, d(NO3−-N) /d(NH4+-N)=0.1,这表明NOB活性得到了显著抑制。然而,采用混合构型的PN/A系统时,NOB会因附着在生物膜上而难以去除,导致PN/A工艺的效果和稳定性出现严重恶化。这与林兴等[45]研究结果相似。同时,该工艺中高FA的实现是由于采用了侧流污泥处理的方式,在实际中操作难度相对较大,还需要进一步研究更简单的策略以耦合低NO2−-N策略来实现对NOB的抑制。
-
以往研究表明,采用多重调控策略可能更有利于实现NOB抑制,但从系统脱氮性能、工艺稳定性等角度来看,仍无法运用到实际工程中。一方面,尽管联合调控已成为共识,但目前对于联合调控如何实现的问题还未找到切实可行的对策;另一方面,传统实验方法探究多重调控策略对NOB抑制效果的协同关系存在盲目性,在实际运行中去探索新的调控参数面临着耗时长、难稳定的困扰。ASM是1983年由国际水质协会(International Association on Water Quality,IAWQ)组织专家经过多年收集、分析、比较、归纳,在前人建立的活性污泥模型基础上提出的污水处理模型[47],可用于表征不同调控策略下AOB、NOB生长、衰减过程,以快速获取不同参数条件下的稳态运行结果,从而对实际调控给予一定的指导方向,推动对工艺参数的研究进展[48]。
毛鹤群[49]选用活性污泥数学3号模型 (ASM3) 作为基础模型,在SBR反应器中模拟了高温 (32 ℃) 、高pH值 (8.0~8.7) 和低曝气量 (25 L·h−1) 联合策略对NOB抑制效果的影响。模拟结果表明,在该综合调控策略下,NRE达到98%,NAR>80%,NOB生长受到了抑制。蔡庆[50]基于活性污泥模型 (ASM1) 中微生物生长衰亡理论,构建动力学模型,模拟了低DO ( (0.3±0.05) mg·L−1) 、低曝气速率 (250~350 mL·min−1) 联合策略对SBR短程硝化系统的影响。结果表明,空气曝气负荷/进水总氮负荷≈0.18 L·mg−1时,系统NRE≈90%。徐婷[51]采用构建的硝化模型,对SBR进行为期500 d的运行情况模拟,分析了SRT=1~10 d和DO<2 mg·L−1的联合调控策略下对NOB活性抑制效果的影响。结果表明,当SRT=6 d,pH=7.3~8.0,DO=1.5 mg·L−1时,NAR≈95%,NOB活性抑制效果显著。在上述的研究工作中,模型模拟发挥了重要支撑和引导作用。这表明该模型是探讨主流PN/A工艺模型构建、动力学调控以及作用机制的可行有效的工具。
-
PN/A工艺强化城市污水脱氮的理论和应用价值明显,然而复杂的工艺流程和运行调控策略提高了该技术的应用门槛。主流城市污水低温、低NH4+-N的水质特点,导致的NOB抑制问题仍是PN/A工艺应用的瓶颈。多种策略联合调控抑制NOB已成为共识,但如何经济有效、可持续、因地制宜地实现工艺的稳定运行仍需进一步系统研究。同时,采用ASM模型模拟可有力支持系统,增加运行灵活性的假设,显示了其对主流PN/A工艺中NOB抑制的潜力。本文结合对PN/A工艺中NOB抑制理论与策略的系统分析,提出未来可行的研究方向。
1) 选择工艺类型。尽管一体化PN/A 工艺较传统的硝化-反硝化工艺具有诸多优势,但对运行策略的严苛要求却使其始终无法推广至城市污水的工程应用。近年来,研究还开发了部分反硝化 (partial denitrification, PD) 作为厌氧氨氧化提供NO2−-N的方案。与传统硝化反硝化相比,PD结合厌氧氨氧化 (partial denitrification anammox process, PD/A) 工艺可节省50%的曝气和80%的有机物需求[23]。尽管节省量低于PN/A工艺 (60%的曝气和100%的有机物需求) ,但PD/A工艺的长期稳定性似乎更容易保持,是一项具有较强可行性的新型污水处理技术,有望为未来城市污水处理厂提质增效提供技术支撑。
2) 深化基础研究。分子生物学技术的发展促进了微生物组的深入研究,逐渐重视不同属、种水平NOB之间的差异,使抑制NOB活性的机制认知不断加深。全程硝化菌 (complete ammonia oxidizer bacteria, CAOB) 的发现为PN/A工艺中NOB的控制提供了新的视角。CAOB缓慢的比生长速度使其在短期内不会对PN/A工艺产生明显的影响,而是在长期的运行过程中对PN/A 工艺产生影响[52]。因此,需要对Nitrotoga和CAOB等不同种属在PN/A工艺中的潜在影响和针对性的控制策略给予足够重视。同时,抑制效果可因反应器结构或运行方式的不同而受到影响,实验结果的重现性尚不能保证。因此,探讨一体化PN/A工艺中NOB增殖的触发机制,明确工艺长期稳定运行的边界条件,解决工艺的迅速启动和恢复问题,是未来研究的一个重要方向。
3) 重视应用研究。在向中试或工程应用推进时,PN/A工艺面临着模型放大、操作策略优化、操作成本控制等问题,而以投加抑制剂为代表的NOB控制策略虽然显示了良好的实验效果,但受限于成本因素,很难实现工程应用。因此,针对PN/A工艺存在的瓶颈问题,开发经济高效的抑制剂和适用于工程应用的不同工艺控制策略,以加强系统运行的稳定性,寻求经济性与实用性的平衡,是今后研究城市污水厌氧氨氧化脱氮的重要发展方向。
城市污水中部分亚硝化-厌氧氨氧化工艺NOB抑制策略的研究进展
Research progress of NOB inhibition strategy of partial nitrosation-anammox process in municipal wastewater
-
摘要: 城市污水具有低温低氨氮(NH4+-N)的特点,不利于亚硝酸盐氧化菌(NOB) 的长期稳定抑制,而NOB的过度增殖会导致出水硝氮 (NO3−-N) 指标升高,对其他功能微生物产生竞争性抑制作用,进而降低部分亚硝化-厌氧氨氧化 (PN/A) 系统的脱氮性能和稳定性。以氨氧化菌 (AOB) 、NOB、厌氧氨氧化菌 (AnAOB) 等功能微生物动力学参数、生长特性为基础,探讨了主流条件下的城市污水处理系统中优势功能微生物的变迁。综述了当前普遍采用的低溶氧 (DO) 限制、好氧-缺氧交替、生物强化、投加抑制剂、泥龄 (SRT) 筛选、低亚氮等NOB抑制策略,并总结了单一抑制策略无法长期、稳定抑制NOB活性,需进一步考察多重策略的联合作用。继而,从性能和工艺复杂程度,对目前普遍采用的实现多重策略联合调控的反应系统进行了探讨。提出采用活性污泥模型 (ASM) 与实验相结合的方法,为助力主流PN/A工艺运行调控提供了新思路,并指出深化基础理论的研究,开发新型的组合工艺强化NOB的抑制及脱氮性能稳定也是可行的发展方向。Abstract: Municipal sewage is characterized by low temperature and low ammonia nitrogen (NH4+-N), and nitrite oxidizing bacteria (NOB) can hardly be stably inhibited for a long time, while excessive proliferation of NOB will lead to the increase of NO3--N in effluent, which will produce competitive inhibition on other functional microorganisms, thus, the nitrogen removal performance and stability of partial nitrosation-anammox (PN/A) system is reduce. Based on the dynamic parameters and growth characteristics of functional microorganisms such as ammonia oxidizing bacteria (AOB), NOB and anaerobic ammonium oxidation bacteria (AnAOB), the changes of dominant functional microorganisms under mainstream conditions were discussed. The commonly used NOB inhibition strategies, such as low soluble oxygen (DO restriction), aerobic and hypoxia alternations, bioenhancement, inhibitor injection, mud age (SRT) panning, and low nitazine, were reviewed. It was concluded that a single inhibition strategy could not inhibit NOB activity in a long-term and stablly, and the combined effects of multiple strategies should be further investigated. Then, from the aspect of performance and the complexity of the process, the reaction system widely used to realize the joint control of multiple strategies was discussed. The method of combining activated sludge model (ASM) with experiment was proposed, which could provide a new idea for facilitating the operation and regulation of mainstream PN/A process. It was also pointed out that deeping the research of basic theories and developing a new combined process to strengthen the inhibition of NOB and the stability of nitrogen removal performance would also be a feasible development direction.
-
生物完整性指数(index of biological integrity, IBI)通过从候选参数中选取对人类干扰较为敏感的核心参数,构建评估体系评估河流生态健康[1]。最早是由KARR[2]以鱼类作为指示生物而提出的,而后研究对象逐步发展至浮游生物[3-5]、藻类[6-7]和大型底栖动物[8-9]等类群。作为河流中稳定的生物类群,大型底栖动物具有种类丰富、生命周期长、迁移能力弱、方便采集,且不同种类对环境变化敏感性呈现出较大差异性等特点[7-10],能够较为准确地表征河流生态环境状况和人类活动对河流水体的扰动程度,对河流健康具有较为精准的诊断作用,是构建IBI的理想对象。
KERANS et al[11]最先利用大型底栖动物完整性指数(benthic index of biological integrity, B-IBI)进行了河流水生态健康评价,而后该指数在全球范围内得到了广泛应用,并取得了良好的河流健康诊断效果[12-15]。我国在20世纪80年代就已应用大型底栖动物评价河流水质[16],王备新等[9]首次在国内应用B-IBI评价了黄山地区的溪流,随后B-IBI在我国地表水水体评价中得到广泛应用。然而,现有研究多为我国南部地区河流湖泊,有关西北干旱区河流研究较少,且不同地区河流底质和环境状况各异,B-IBI体系也并不相同,因此,构建适用于西北地区干旱半干旱区河流B-IBI体系是非常必要的。
清水河是宁夏境内黄河最长的一级支流,流域水资源极度匮乏,河流水体矿化度高、天然水质差、含沙量大,天然来水年内分配不均且年际变化悬殊,具有干旱半干旱地区河流的典型特征[17]。关于清水河这类干旱半干旱区域河流的水生生物研究相对较少,对底栖动物群落结构组成、健康状况评估及其与水环境要素的关系研究尚未见报道。故本研究以大型底栖动物为指示生物,以水质较好及Shannon-Wiener多样性指数较大、较少人类活动的点作为参考点,构建B-IBI体系对清水河健康状况进行评估,并分析对B-IBI有显著影响的环境因子,对于改善清水河河流健康状况具有指导作用,也为开展干旱半干旱区域河流健康评估提供一定的借鉴。
1. 研究区域与方法
1.1 区域概况
清水河位于宁夏中南部地区,地势南高北低,全长320 km,流域面积14 481 km2[18-19]。受温带大陆性气候影响,流域干旱少雨,雨季集中在7~10月,降雨时空不均匀,水资源十分短缺,水土流失现象严重,具有半干旱、干旱区河流特征,是宁夏生态环境最为脆弱的区域之一[20]。
1.2 样品采集处理与分析
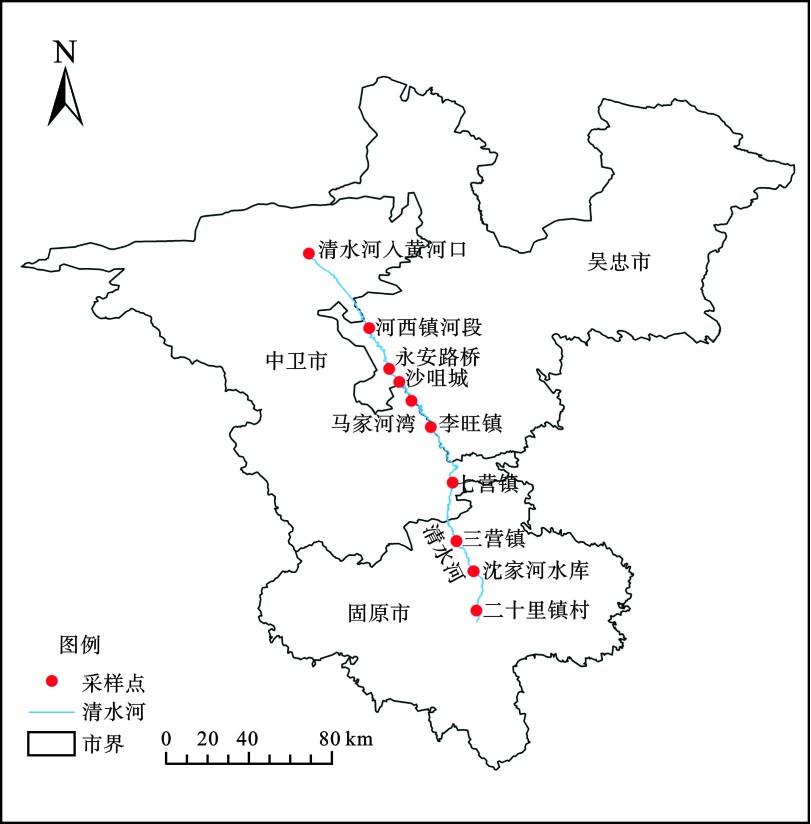
于2020年7月开展现场采样及监测工作,沿清水河干流在已有6个国控、区控监测断面(点位)的基础上(其中三营镇、入黄河口为国控,其余为区控)另根据清水河从南到北依次穿越宁夏南部黄土丘陵区、中部干旱风沙区和北部引黄灌溉区等各区域的实际情况,重点考虑采样点的交通可达性、生境的典型性等合理增设4个采样点,共设置10个采样点,所布设的采样点基本可代表清水河干流的整体特征。采样点位置,见图1。
水温、电导率和pH采用多功能水质分析仪现场监测,溶解氧采用便携式溶解氧分析仪现场监测,COD、BOD5、氨氮和总磷等水质指标根据《水和废水监测分析方法》在实验室测定。
采用1/16 m2改良彼得逊采泥器和手抄网(直径40 cm)进行大型底栖无脊椎动物的采集,用底栖筛(420 μm)淘洗后挑拣出放入50 mL标本瓶中,加入10%甲醛溶液保存,在实验室用显微镜镜检将物种鉴定至最低的分类单元并计数,最后用滤纸吸干水分,在万分之一天平上称量获得生物量数据。
1.3 B-IBI评估体系构建
1.3.1 确定参考点与受损点
参考点是指没有遭受人类活动扰动或者扰动较小的点位,是利用IBI进行河流健康评价的基准。因目前除部分湿地保护区河流外,其他河流均或多或少受到人类活动干扰,不存在严格意义上的参考点,因此本研究结合已有参照点选取的方法和实际情况,确立了参照点的选取标准[21-22]:水质综合评价在Ⅲ类及以上,Shannon-Wiener多样性指数>2(以2为底);极少人类活动、两岸500 m内无农田(定性观察)。
1.3.2 筛选评估参数
根据以往的研究[1,23]和清水河实际,本研究选取了能反映丰富度与多样性、群落结构组成、耐污能力、功能摄食类群与生活型等类型的20个参数(即表1的M1~M20)作为候选参数,采用如下方法筛选出核心参数:(1)变异度分析:计算参考点评估参数的平均值、标准差、最大值、最小值、极差、25%分位数和75%分位数,保留变异度较小的参数。(2)判别能力分析-利用箱线图对比参考点和受损点在25%~75%分位数范围内箱体的重叠程度,对生物判别能力(interquartile range, IQ)赋值,保留部分重叠但中位数均在对方箱体之外(IQ=2)和箱体无重叠(IQ=3)的参数。(3)冗余度分析-采用Spearman相关性分析,ρ>0.8时表明2个参数有显著相关性,此时选其中1个即能表示2个参数间所包含的几乎全部的信息,优先选取反映信息较多的参数。
表 1 候选参数及其对干扰响应的方向Table 1. Candidate metrics and their response to disturbance参数编号 参数类型 参数 对干扰增大的响应 M1 多样性和丰富性 总分类单元数 减小 M2 EPT分类单元数 减小 M3 蜉蝣目分类单元数 减小 M4 鞘翅目分类单元数 减小 M5M6 半翅目分类单元数Shannon-Wiener多样性指数 减小减小 M7 群落结构组成 EPT个体数百分比 减小 M8M9 蜉蝣目个体数百分比半翅目个体数百分比 减小减小 M10 最优类群个体数百分比 减小 M11 耐污能力 敏感类群分类单元数 减小 M12 耐污类群分类单元数 增大 M13 Hilsenhoff生物指数(HBI) 增大 M14 大型无脊椎动物敏感类群评估指数(BMWP指数) 减小 M15 ASPT指数 减小 M16 科级耐污指数(FBI) 增大 M17 功能摄食类群与生活型 粘附者分类单元数 减小 M18 粘附者个体数百分比 减小 M19 滤食者个体数百分比 增大 M20 刮食者个体数百分比 减小 1.3.3 计算B-IBI指数
选取比值法计算B-IBI的值[23]。对于随着干扰增大而减小的参数,应按由低至高排序的以95%分位数作为最佳期望值,该类参数的分值为参数实际值与最佳期望值的比值;对于随着干扰增大而增大的参数,应以由低至高排序的5%分位数作为最佳期望值,该类参数的分值为最大值与实际值、最佳期望值差值的比值。最终计算各类参数和,即为各断面B-IBI指数值[24]。
1.3.4 建立评价标准
得到各样点的B-IBI值后,选取所有点位B-IBI分值的95%分位值作为最佳期望值,然后利用四分法确定河流健康等级划定标准[21],按照《河流水生态环境质量监测与评价技术指南(征求意见稿)(2020)》将河流分为5个健康等级:非常健康、健康、亚健康、不健康和病态,分级标准,见表2。
表 2 河流健康等级划定标准Table 2. River health assessment grading on B-IBI健康等级 B-IBI得分 病态 (0~1.25] 不健康 (1.25~1.83] 亚健康 (1.83~1.94] 健康 (1.94~2.83] 非常健康 (>2.83) 2. 结果与分析
2.1 大型底栖动物群落结构
本次调查共采集到大型底栖动物42个分类单元,隶属于3门4纲11目32科,其中昆虫纲6目27科35种属,占物种总比例83.33%,软甲纲2目2科3种属,占比7.14%,腹足纲1目2科3种属,占比7.14%,蛭纲1种属,占比2.38%。
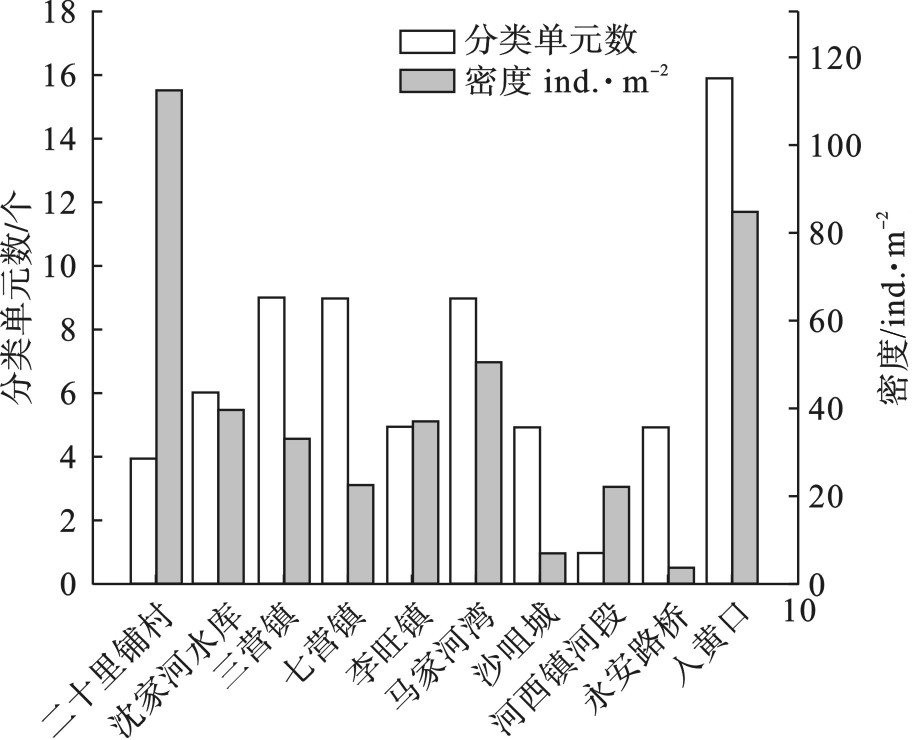
调查期间,各样点采集到的大型底栖动物分类单元数差别较大,其中三营镇、七营镇、马家河湾和入黄河口物种较为丰富。清水河底栖动物密度为4~112.5 ind./m2,平均密度41.45 ind./m2;其中水生昆虫类密度最高,为375 ind./m2,占总密度的90.5%,其次为软甲类,占比8.1%;蛭纲和腹足纲密度较低,分别为2 ind./m2和4 ind./m2。见图2。
清水河各点位底栖动物分布,见图3。
图3可知,清水河水生昆虫种类比例较多,种群出现频率前3名分别是划蝽科、龙虱科和水龟甲科,出现频率分别为90%、60%和50%,均为水生昆虫。划蝽科为第一优势种,耐污性较强,而敏感性物种,如蜉蝣目的扁蜉科仅出现在生态较好的清水河入黄口,其他采样点位没有发现。
2.2 B-IBI指数构建
2.2.1 参照点与受损点
通过对各监测断面水质监测和实地调查,三营镇、七营镇、沙咀城和清水河干流入黄河口4个点位符合全部参考点选取的标准要求,确定为参考点,其余断面作为受损点。
2.2.2 核心参数的确定
(1) 变异度分析。对20个参数在参考点中的平均值、标准差、最大值、最小值、极差、25%分位数和75%分位数进行比较,见表3,剔除数值范围变动太小或太大的参数,它们不适合用来建立B-IBI评价体系。
表 3 候选参数变异度分析结果Table 3. Variation results of candidate metrics参数编号 平均值 标准差 最小值 最大值 极差 25%分位数 75%分位数 M1 9.75 3.96 5.00 16.00 11.00 8.00 10.75 M2 0.50 0.87 0.00 2.00 2.00 0.00 0.50 M3 0.25 0.43 0.00 1.00 1.00 0.00 0.25 M4 2.50 0.87 2.00 4.00 2.00 2.00 2.50 M5 2.75 1.92 0.00 5.00 5.00 1.50 4.25 M6 2.42 0.18 2.23 2.60 0.37 2.24 2.60 M7 2.06% 3.57% 0.00% 8.24% 8.24% 0.00% 2.06% M8 1.47% 2.55% 0.00% 5.88% 5.88% 0.00% 1.47% M9 36.15% 19.09% 14.29% 60.87% 46.58% 19.48% 51.39% M10 33.72% 17.94% 14.29% 56.52% 42.24% 17.21% 48.54% M11 1.25 1.09 0.00 3.00 3.00 0.75 1.50 M12 8.50 3.20 4.00 13.00 9.00 7.00 10.00 M13 4.95 0.50 4.34 5.45 1.11 4.51 5.44 M14 40.00 16.81 28.00 69.00 41.00 30.25 41.25 M15 4.66 0.59 4.00 5.60 1.60 4.32 4.85 M16 4.99 0.52 4.36 5.52 1.16 4.52 5.49 M17 0.75 0.83 0.00 2.00 2.00 0.00 1.25 M18 7.26% 10.23% 0.00% 24.71% 24.71% 0.00% 9.44% M19 5.49% 4.83% 0.00% 13.04% 13.04% 2.27% 7.67% M20 6.56% 5.08% 0.00% 14.29% 14.29% 4.41% 8.12% 首先删除最大值过小的参数EPT分类单元数M2、蜉蝣目分类单元数M3。鞘翅目分类单元数M4、Shannon-Wiener多样性指数M6、EPT个体数百分比M7、蜉蝣目个体数百分比M8、半翅目个体数百分比M9、敏感类群分类单元数M11和ASPT指数M15,这些随干扰增加而减小的参数,其25%分位数、75%分位数变化很小,说明随着干扰增大,参数值基本不变,不能有效反映干扰对河流的影响,应剔除;Hilsenhoff生物指数(HBI)M13、科级耐污指数(FBI)M16随干扰增加而增大,随干扰增大,其25%分位数、75%分位数基本不变,故也应剔除。剩9个参数进入下一步判别能力分析。
(2) 判别能力分析。剩余9个候选参数参考点和受损点的箱体IQ重叠情况,见图4。
图4可知,M1、M5、M10、M12和M20等5个参数符合IQ≥2的情况,这说明参数在受损点和参考点之间差别显著,保留5个参数进行冗余度分析。
(3) 冗余度分析。对剩余参数开展Spearman相关分析的结果,见表4。M1和M12相关性显著,M1能反映更多信息,故剔除M12,保留M1。
表 4 候选参数相关性分析结果Table 4. Spearman correlation analysis of candidate metrics参数 M1 M5 M10 M12 M20 M1 1.00 M5 0.77 1.00 M10 −0.18 −0.41 1.00 M12 0.97** 0.77 −0.24 1.00 M20 0.48 0.20 −0.48 0.56 1.00 注:**表示p<0.01。 2.2.3 B-IBI指数的计算
根据4个参数对干扰增大的响应,计算它们在所有样点中的95%分位数或5%分位数的值和最佳期望值,见表5,根据比值法计算采样点4个参数的分值,加和即得各断面的B-IBI值,见表6。
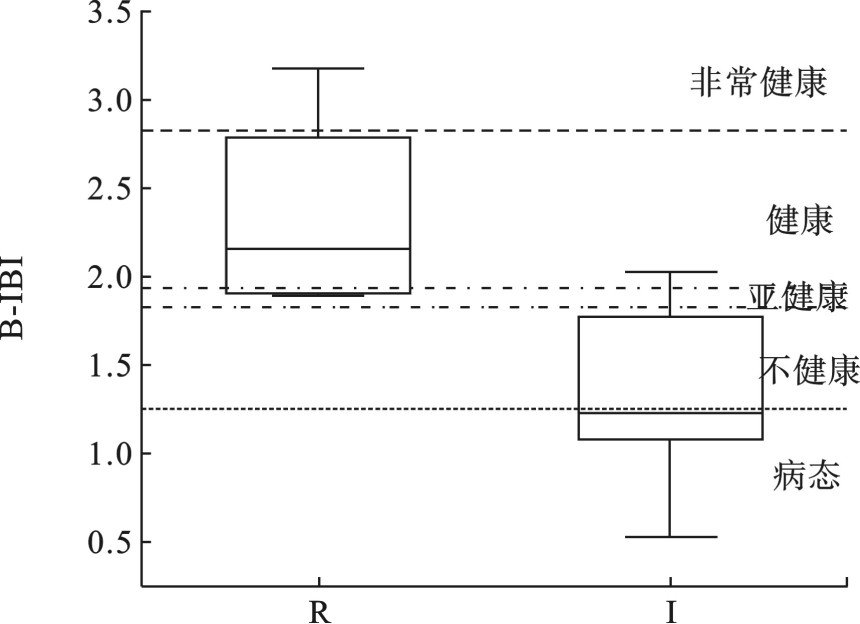
表 5 核心参数分位数计算结果Table 5. Quantile calculation results of core metrics参数编号 对干扰的响应 最大值 5%分位数 95%分位数 最佳期望值 M1 减小 16.00 2.35 12.85 12.85 M5 减小 5.00 0.00 4.55 4.55 M10 减小 100.00% 0.06 0.93 0.93 M20 减小 14.29% 0.00 0.11 0.11 表 6 各断面B-IBI值和断面评估结果Table 6. Grade for B-IBI of river health assessment断面 断面类型 B-IBI 健康度 二十里铺村 受损点 0.53 病态 沈家河水库 受损点 1.77 不健康 三营镇 参考点 1.91 亚健康 七营镇 参考点 2.41 健康 李旺镇 受损点 1.29 不健康 马家河湾 受损点 2.03 健康 沙咀城 参考点 1.89 亚健康 永安路桥 受损点 1.07 病态 河西镇河段 受损点 1.16 病态 清水河干流入黄河口 参考点 3.17 非常健康 2.3 B-IBI指数评价
以参考样点B-IBI值由高到低排序,计算所有点位95%分位数作为B-IBI的最佳期望值为2.83,按照等级划定标准表进行赋分,判断健康度,健康评估,见表6。
2.4 B-IBI指数与环境因子分析
对采样点B-IBI和环境因子进行Kolmogorov-Smirnov正态性检验,结果表明两者均满足正态分布。采用Pearson相关分析分析影响B-IBI的环境因子,见表7,清水河B-IBI指数仅与氟化物具有显著的相关性,而与pH、COD、流速、水温、电导率、透明度、溶解氧、氨氮和总磷等相关性并不显著,表明影响清水河B-IBI的主要环境因子为氟化物浓度。
表 7 B-IBI指数与水质指标Pearson相关关系Table 7. Pearson correlation analysis between the B-IBI and environmental factors水质指标 相关系数 水质指标 相关系数 pH −0.30 透明度 −0.40 COD −0.62 溶解氧 0.05 流速 0.34 氨氮 −0.41 水温 −0.25 氟化物 −0.72** 电导率 0.04 总磷 −0.12 注:**表示p<0.01,*表示p<0.05。 3. 讨论
3.1 生物指数筛选与清水河健康评价
不同地区河流底质和环境状况不同,大型底栖动物群落组成也不同[25-26],因此构建的B-IBI指标体系也各异。本研究通过箱线图及冗余度分析,选择了总分类单元数、半翅目分类单元数、最优类群个体数百分比和刮食者个体数百分比共4个核心参数构建了宁夏清水河B-IBI指标体系。清水河B-IBI值的箱线图分布,见图5,校验结果显示,参考点和受损点箱体无重叠,参照点的箱体基本落在健康、非常健康级别,受损点箱体落在亚健康、不健康和病态级别,这表明参照点的选取是有效的,本研究所建立的B-IBI评价体系适用于宁夏清水河健康评价。
从参考点的健康状态来看,1处非常健康,1处健康,另外2处为亚健康,在清水河评估的10个点位上,均为较好的状态。受损点马家河湾处为健康状态,该点位为健康状态主要是受底栖动物总分类单元数、最优类群个体数这2类核心参数的数值的影响,也表明应用底栖动物完整性指数评估清水河健康状态时,在参数的选取上还需要进一步地深入研究和优化。
通过对清水河进行评价,结果显示,宁夏清水河处于非常健康、健康、亚健康、不健康和病态水平的点位分别占总点位的10%、20%、20%、20%和30%。健康状况为“病态”的点位在二十里铺、永安路桥和河西镇河段,可能与二十里铺水质较差、永安路桥上游处有农田退水,水质变差有关。健康状况为“亚健康”“不健康”的点主要位于支流汇入口,为宁夏中部干旱风沙区,主要土地类型为裸地,存在的问题主要是自然栖息地破坏严重,植被退化,受人类干扰胁迫较大。健康水平较高的点位主要位于清水河北部入黄口,河流连通性较好,水质及生境较好,河道底质多为卵石和砾石,有利于水生昆虫附着生存。
3.2 B-IBI指数影响因子分析
将B-IBI指数与环境因子进行Pearson相关性分析,结果表明,B-IBI与氟化物关联最强,而同时氟化物也是限制清水河受损点水质类别的主要参数。文献[27]研究表明,氟化物具有高度毒性,会对大型底栖动物群落组成和分布产生影响。通常水中氟化物浓度越高,表示人为扰动越强烈,B-IBI的分值就越低。因此,有效降低河流氟化物浓度,是当前恢复清水河生态健康的重点。
清水河部分区域地层岩石以高氟岩石为主,地下水流经时通过侵蚀作用使氟化物进入水体,后地下水补充地表水时就会使清水河含氟量较高[18];另一方面,清水河流域地处干旱半干旱地带,水体蒸发作用强烈,氟化物被留在土壤中,加之人为活动如河岸带土地利用,农田开垦等导致清水河下垫面降低,河岸带植被稀疏,水土流失严重,大量氟化物进入水体,影响河流水质,并对水生生物产生不利影响[18]。受支流汇入产生的叠加效应,流域气候、地貌等因素,干流各采样点氟化物浓度不同[18],对大型底栖动物影响也不同。氟化物可以通过摄食或皮肤接触进入底栖动物体内,并在其体内蓄积,使底栖动物生长缓慢、繁殖率降低,死亡率大大增加[27]。可见,进行水土流失控制与治理,优化河岸带状况能有效改善清水河底栖动物群落结构,维护和修复清水河生态健康。
-
表 1 AOB、NOB、AnAOB生长动力学参数对比
Table 1. Comparison of growth kinetics parameters of AOB, NOB and AnAOB
菌种 世代周期/h 最佳pH Ks/(mg·L−1) Ko/(mg·L−1) 温度/℃ FA质量浓度/(mg·L−1) AOB 8~36 7.5~8.5 0.50~1.62 0.03~0.30 <15或>30 10~150 (不敏感) NOB 12~59 6.5~7.5 0.11~13 0.06~1.98 15~30 0.1~1.0 (较敏感) AnAOB 10~12d 7.8~8.3 0.10~0.39 NA 25~45 NA -
[1] KARTAL B, KUENEN J G, VAN L M. Engineering sewage treatment with anammox[J]. Science, 2010, 328(5979): 702-703. doi: 10.1126/science.1185941 [2] LACKNER S, GILBERT E M, VLAEMINCK S E, et al. Full-scale partial nitritation/anammox experiences--an application survey[J]. Water Research, 2014, 55: 292-303. doi: 10.1016/j.watres.2014.02.032 [3] ZHANG M, WANG X, ZHANG D, et al. Food waste hydrolysate as a carbon source to improve nitrogen removal performance of high ammonium and high salt wastewater in a sequencing batch reactor[J]. Bioresource Technology, 2022, 349: 126855. doi: 10.1016/j.biortech.2022.126855 [4] 吕心涛. 游离氨(FA)和游离亚硝酸(FNA)对亚硝酸盐氧化菌(NOB)活性的影响试验研究[D]. 兰州: 兰州交通大学, 2017. [5] CAO Y, VAN L. Mainstream partial nitritation-anammox in municipal wastewater treatment: status, bottlenecks, and further studies[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1365-1383. doi: 10.1007/s00253-016-8058-7 [6] 姚仁达, 苑泉, 王凯军. 底物流加-间歇运行方式下氨氧化细菌富集培养的效果及影响因素分析[J]. 环境工程学报, 2020, 14(4): 925-934. doi: 10.12030/j.cjee.201907043 [7] MANDELKER D R, HEETER D. Novel nitrospira-like bacteria as dominant nitrite-oxidizers in biofilms from wastewater treatment plants: diversity and in situ physiology[J]. Journal of the Physical Society of Japan, 2000, 41(4): 85-90. [8] CAPODICI M, CORSINO S F, TRAPANI D D, et al. Achievement of partial nitrification under different carbon-to-nitrogen ratio and ammonia loading rate for the co-treatment of landfill leachate with municipal wastewater[J]. Biochemical Engineering Journal, 2019, 149: 107229. doi: 10.1016/j.bej.2019.05.006 [9] BRENNAN R B, CLIFFORD E, DEVROEDT C, et al. Treatment of landfill leachate in municipal wastewater treatment plants and impacts on effluent ammonium concentrations[J]. Environment Management, 2017, 188: 64-72. [10] SIRIPONG S, RITTMANN B E. Diversity study of nitrifying bacteria in full-scale municipal wastewater treatment plants[J]. Water Research, 2007, 41(5): 1110-20. doi: 10.1016/j.watres.2006.11.050 [11] BLACKBURNE R, YUAN Z, KELLER J. Demonstration of nitrogen removal via nitrite in a sequencing batch reactor treating domestic[J]. Water Research, 2007, 42: 2166-2176. [12] DONG W, LU G, YAN L, et al. Characteristics of pellets with immobilized activated sludge and its performance in increasing nitrification in sequencing batch reactors at low temperatures[J]. Chinese Journal of Environment Science (China), 2016, 42: 202-209. doi: 10.1016/j.jes.2015.09.002 [13] PARK H D, NOGUERA D R. Characterization of two ammonia oxidizing bacteria isolated from reactors operated with low dissolved oxygen concentrations[J]. Applied and Environmental Microbiology, 2007, 102(5): 1401-1417. doi: 10.1111/j.1365-2672.2006.03176.x [14] SCHRAMM A, BEER D, VAN D H. Microscale distribution of populations and activities of Nitrosospira and Nitrospira spp. along a macroscale gradient in a nitrifying bioreactor: quantification by in situ hybridization and the use of microsensors[J]. Applied and Environmental Microbiology, 1999, 65(8): 3690-3696. doi: 10.1128/AEM.65.8.3690-3696.1999 [15] SIRIPONG S, RITTMANN B. Diversity study of nitrifying bacteria in full-scale municipal wastewater treatment plants[J]. Water Research, 2006, 41(5): 1110-1120. [16] SU Y, PENG Y, WANG J, et al. Rapid enrichment of anammox bacteria and transformation to partial denitrification/anammox with nitrification/denitrification sludge[J]. The Science of the Total Environment, 2022, 856(1): 158973. [17] ZHENG M, WANG Z, MENG J, et al. Inactivation kinetics of nitrite-oxidizing bacteria by free nitrous acid[J]. The Science of the Total Environment, 2020, 752: 141876. [18] NOWKA B, DAIMS H, SPIECK E. Comparison of oxidation kinetics of nitrite-oxidizing bacteria[J]. Applied and Environmental Microbiology, 2015, 81: 745-753. doi: 10.1128/AEM.02734-14 [19] GUISASOLA A, JUBANY I, BAEZA J A, et al. Respirometric estimation of the oxygen affinity constants for biological ammonium and nitrite oxidation[J]. Journal of Chemical Technology & Biotechnology Biotechnology, 2010, 80(4): 388-396. [20] TROUS M M, KUENEN J G, JETTEN M. Key physiology of anaerobic ammoniumoxidation.[J]. Applied and Environmental Microbiology, 1999, 65(7): 3248-3250. doi: 10.1128/AEM.65.7.3248-3250.1999 [21] VADIVELU V M, YUAN Z G, FUX C, et al. The inhibitory effects of free nitrous acid on the energy generation and growth processes of an enriched Nitrobacter culture[J]. Environment Science of Technology, 40(14): 4442– 4448. [22] WETT B, OMARI A, PODMIRSEG S M, et al. Going for mainstream deammonification from bench to full-scale for maximized resource efficiency[J]. Water Science of Technology, 58(6): 1155–1171 [23] CAO S, KOCH K, DU R, et al. Toward Mainstream Anammox by Integrating Sidestream Treatment[J]. Environment Science of Technology, 2022, 56(15): 10553-10556. doi: 10.1021/acs.est.2c03256 [24] 刘文龙. 城市污水主流厌氧氨氧化连续流工艺的脱氮除磷效能研究[D]. 哈尔滨: 哈尔滨工业大学, 2019. [25] OSHIKI M, SHIMOKAWA M, FUJII N, et al. Physiological characteristics of the anaerobic ammonium-oxidizing bacterium candidatus brocadia sinica[J]. Microbiology Reading, 2011, 157(Pt 6): 1706-1713. [26] STAR W, MICLEA A I, DONGEN U, et al. The membrane bioreactor: a novel tool to grow anammox bacteria as free cells[J]. Biotechnology and Bioengineering, 2008, 101(2): 286-294. doi: 10.1002/bit.21891 [27] ALICE M, OSHIKI M, AWATA T, et al. Physiological characterization of anaerobic ammonium oxidizing bacterium “ Candidatus Jettenia caeni”[J]. Environmental Microbiology, 2014, 17(6): 2172-2189. [28] WANG Z Y, ZHENG M, HU Z T, et al. Unravelling adaptation of nitrite-oxidizing bacteria in mainstream PN/A process: Mechanisms and counter-strategies[J]. Water Research, 2021, 200: 117239. doi: 10.1016/j.watres.2021.117239 [29] CUI B, YANG Q, LIU X, et al. The effect of dissolved oxygen concentration on long-term stability of partial nitrification process[J]. Chinese Journal of Environment Science, 2020, 90: 343-351. doi: 10.1016/j.jes.2019.12.012 [30] 包鹏,王淑莹,马斌,等. 不同溶解氧间歇曝气对亚硝酸盐氧化菌的影响[J]. 中国环境科学, 2016, 36(9): 2696-2702. [31] QIU J G, LI X Y, PENG Y Z, et al. Advanced nitrogen removal from landfill leachate via a two-stage combined process of partial nitrification-Anammox (PNA) and partial denitrification-Anammox (PDA)[J]. Science of the Total Environment, 2021, 80: 151186. [32] MIAO Y, ZHANG L, YANG Y, et al. Start-up of single-stage partial nitrification-anammox process treating low-strength swage and its restoration from nitrate accumulation[J]. Bioresource Technology, 2016, 218: 771-9. doi: 10.1016/j.biortech.2016.06.125 [33] YUAN Y, XIE Y Y, XU P L. Verification of inhibition effects of anoxic/aerobic alternation on NOB in nitrosation system under mainstream conditions[J]. Journal of Water Process Engineering, 2022, 45: 1012. [34] 李剑宇, 王少坡, 邱春生, 等. PN/A技术应用于城市污水主流处理的挑战与实践[J]. 水处理技术, 2020, 46(11): 24-30. doi: 10.16796/j.cnki.1000-3770.2020.11.005 [35] CAO L J, YAN W, YU L, et al. Challenges of THP-AD centrate treatment using partial nitritation-anammox (PN/A) - inhibition, biomass washout, low alkalinity, recalcitrant and more[J]. Water Research, 2021, 117(5): 555. [36] LI J, LI J, GAO R, et al. A critical review of one-stage anammox processes for treating industrial wastewater: Optimization strategies based on key functional microorganisms[J]. Bioresource Technology, 2018, 265: 498-505. doi: 10.1016/j.biortech.2018.07.013 [37] WANG Z, ZHANG L, ZHANG F, et al. Nitrite accumulation in comammox-dominated nitrification-denitrification reactors: effects of DO concentration and hydroxylamine addition[J]. Hazardous Materials, 2020, 384: 121375. doi: 10.1016/j.jhazmat.2019.121375 [38] CAO Y S, KWOK B H, YAN Z, et al. 新加坡最大回用水处理厂污水短程硝化厌氧氨氧化脱氮工艺[J]. 北京工业大学学报, 2015, 41(10): 1441-1454. doi: 10.11936/bjutxb2014120074 [39] HUBAUX N, WELLS G, MORGENROTH E. Impact of coexistence of flocs and biofilm on performance of combined nitritation-anammox granular sludge reactors[J]. Water Research, 2015, 68: 127-39. doi: 10.1016/j.watres.2014.09.036 [40] 高佳琦. 主流条件下多重调控抑制NOB的模拟与实验研究[D]. 苏州: 苏州科技大学, 2021. [41] SEUNTJENS D, ARROYO J, TENDELOO M V. Mainstream partial nitritation anammox with integrated fixed-film activated sludge: Combined aeration and floc retention time control strategies limit nitrate production[J]. Bioresource Technology, 2020, 314: 123711. doi: 10.1016/j.biortech.2020.123711 [42] 杨宗玥, 付昆明, 廖敏辉, 等. 短程硝化过程2种亚硝酸盐氧化菌抑制策略探讨[J]. 环境工程学报, 2019, 13(1): 222-231. doi: 10.12030/j.cjee.201806158 [43] 孙洪伟, 于雪, 李维维, 等. 游离亚硝酸抑制硝化杆菌属(Nitrobacter)活性动力学研究[J]. 中国环境科学, 2018, 38(11): 4246-4254. doi: 10.3969/j.issn.1000-6923.2018.11.033 [44] GU J, ZHANG M, WANG S, et al. Integrated upflow anaerobic fixed-bed and single-stage step-feed process for mainstream deammonification: A step further towards sustainable municipal wastewater reclamation[J]. The Science of the Total Environment, 2019, 678: 559-564. doi: 10.1016/j.scitotenv.2019.05.027 [45] 林兴. 回流PN-ANAMMOX脱氮工艺处理城市生活污水研究[D]. 苏州: 苏州科技大学, 2018. [46] 张亮, 李朝阳, 彭永臻. 城市污水PN/A工艺中NOB的控制策略研究进展[J]. 北京工业大学学报, 2022, 48(4): 421-429. doi: 10.11936/bjutxb2020110022 [47] 王文英, 黄勇, 顾晓丹, 等. 活性污泥数学模型在污水处理中的研究进展[J]. 工业水处理, 2014, 34(7): 1-4. doi: 10.11894/1005-829x.2014.34(7).001 [48] 顾晓丹, 黄勇. 活性污泥数学模型在污水处理中的应用研究[J]. 广东化工, 2012, 39(9): 129-132. doi: 10.3969/j.issn.1007-1865.2012.09.069 [49] 毛鹤群. 短程硝化反硝化动力学模型的建立及其应用[D]. 西安: 长安大学, 2012. [50] 蔡庆. 完全自养脱氮SBR反应器的运行、强化及模拟优化[D]. 重庆: 重庆大学, 2013. [51] 徐婷, 王丽, 吴军. 不同pH条件下短程硝化序批实验和数学模拟[J]. 环境工程学报, 2016, 10(6): 2840-2846. doi: 10.12030/j.cjee.201512198 [52] 张亮, 于静仪, 李朝阳, 等. 污水生物处理系统中全程氨氧化菌的研究进展[J]. 北京工业大学学报, 2020, 46(4): 402-411. doi: 10.11936/bjutxb2019090014 -




 下载:
下载: