-
饮用水的嗅味异常是导致消费者质疑用水安全的主要原因之一。这类问题在许多国家都非常普遍,并且引起了广泛的环境和生态关注[1-8]。水库水源作为最为重要的饮用水供水来源,嗅味异常背后的污染问题严重威胁城镇的供水安全。饮用水嗅味问题的根源通常与水源中的藻类有关[9-10]。例如,一些蓝藻和放线菌的代谢产物会引起土臭味、霉味,如2-甲基异莰醇和土臭素普遍存在于各大供水系统中[11-17]。除土臭味、霉味外,近年来国内外也爆发了数十起水源地鱼腥味事件[18-21]。有研究表明,鱼腥味通常与硅藻、绿藻、隐藻和甲藻的生长代谢有关[22-23]。藻类细胞除可以分泌饱和醛类化合物(如正己醛、庚醛、壬醛)外,还通常含有大量的不饱和脂肪酸。不饱和脂肪酸在环境中可以转化为富含嗅味的不饱和醛衍生物(如2,4-庚二烯醛、2,4-癸二烯醛、2,4,7-癸三烯醛和2,6-壬二烯醛)[24-27]。近年来报道的饮用水嗅味问题中大约41%为土臭味、霉味,36%为沼泽味、化粪池味[28],鱼腥味类型的藻源性嗅味问题罕有出现。因此,与土臭味、霉味相比,引起鱼腥味的藻类和嗅味物质尚未明确,相关信息和研究仍非常有限[29]。红升水库曾在2016年短暂出现了水源地嗅味(以鱼腥味为主)问题,至今来源不清,无法采取有效措施预防和解决该类嗅味问题。为探索引起鱼腥味的藻类与嗅味物质,研究团队进行了为期8个月的环境调查,以跟踪2021年3—10月期间水源水嗅味特征、强度和藻类数量的变化。本研究采用嗅味层次分析法描述水样中10种潜在藻类代谢物(正己醛、庚醛、壬醛、癸醛、2-辛烯醛、2,6-壬二烯醛、2,4-庚二烯醛、2,4-癸二烯醛、苯甲醛和β-环柠檬醛)的嗅味特征和强度。本研究将为更好地为解释藻源性鱼腥味问题提供数据参考。
-
本研究于2021年3—10月进行。红升水库为蓄水型水库,库容3 100×104 m3,日供水量约1.95×104 t,供应人口约8×104,水源由富尔江引水工程和旧门电站跨流域调水汇入。研究人员于调查期间每月开展1次覆盖10个地点的全面采样。单次每处使用500 mL的棕色玻璃瓶采集相同的样品3份,分别用于感官评估、藻类分析和气味定量,共计30份,且采样位置均在水面以下5 m处。在1号瓶中加入5 mL Lugol’s溶液用于固定藻类(藻类分析),在2号瓶中加入10 mL HgCl2用于检测气味(气味定量)。所有样品均储存在冷藏保温箱中,于2 h内送往实验室。红升水库基本水质参数见表1。
-
12种嗅味标准参考物质相关信息见表2(纯度>95%)。其中包括2种萜类化合物(2-甲基异莰醇、土臭味素)和10种醛(正己醛、庚醛、壬醛、癸醛、苯甲醛、2-辛烯醛、β-环柠檬醛、2,4-庚二烯醛、2,6-壬二烯醛和2,4-癸二烯醛),均从Sigma Aldrich公司(美国)采购。嗅味定量分析所需分析级NaCl、KI、HgCl2和Na2SO4购自国药集体化学试剂有限公司。超纯水(18.2MΩ cm)由Milli-Q净化系统生产。
-
FPA(flavor profile analysis)用于描述嗅味特征[30],使用1~12的7个点标度来描述样本的嗅味强度(1为嗅味阈值,2~4为弱嗅味强度,6~8为中等嗅味强度,10~12为强烈嗅味强度)。在评估过程中,每项测试都由至少4名合格的专家组成员进行。使用不同质量浓度的嗅味标准样提醒测试人员注意嗅味组,并对每批样品进行评级[31-34]。待评价样品在水浴中保持在45 ℃,其中设置1个空白组,由标记为无气味的试剂水组成。在收到水样后立即进行评估,保证评估的时效性和准确性[35]。每位测试人员分别对嗅味类型和强度进行评估,取平均值作为最终评估结果[36]。
-
使用顶空固相微萃取结合气相色谱/质谱(Gas chromatograohy-mass spectrometry)法对包括土味素(Geosmin)、2-甲基异莰醇(2-Methylisoborneol)、正己醛、庚醛、壬醛、癸醛、苯甲醛、2-辛烯醛、β-环柠檬醛、2,4-庚二烯醛、2,6-壬二烯醛和2,4-癸二烯醛在内的潜在嗅味物质进行定量分析[37-38]。将固相微萃取纤维插入装有水样的小瓶顶部空间中(65 ℃,30 min),并持续搅拌水样后,将纤维收回并直接插入GC-MS的进样器中,对嗅味物质进行热脱附(250 ℃,2 min)。GC温度程序:最初(40 ℃,2 min),然后以(8 ℃·min−1)编程至(240 ℃·min−1)后保持2 min。系统在选择性离子监测模式下进行定量操作[39-41]。12种标准品的校准曲线线性良好,回归系数高(R2>0.99)。
-
使用显微镜(BX 51 Olympus,日本)在20倍物镜下,用1 mm浮游植物计数箱(1801-G20,美国Wildco公司)进行藻类分类和细胞计数。高细胞密度的样品直接进行显微计数。细胞密度较低的样品,在100 mL水样中加入Lugol’s溶液,自然沉淀24 h后倾倒上清液,收集底部的浓缩藻液10 mL,重复操作10次,完成预浓缩。收集3份1 mL浓缩样品进行计数[42-44]。根据形态学观察,将藻类分为属或种。
-
主成分分析法(principal component analysis)用于分析主要嗅味物质及对应贡献值。相关性分析帮助发现在嗅味问题出现期间检测到的嗅味物质与藻类之间的关联程度[45]。PCA将各种嗅味物质和藻类转化为新的变量和主成分,并通过线性回归分析保证变量和主成分是正交和非相关的[46-48]。PCA和所有数据的统计处理均使用SPSS 26.0软件进行。
-
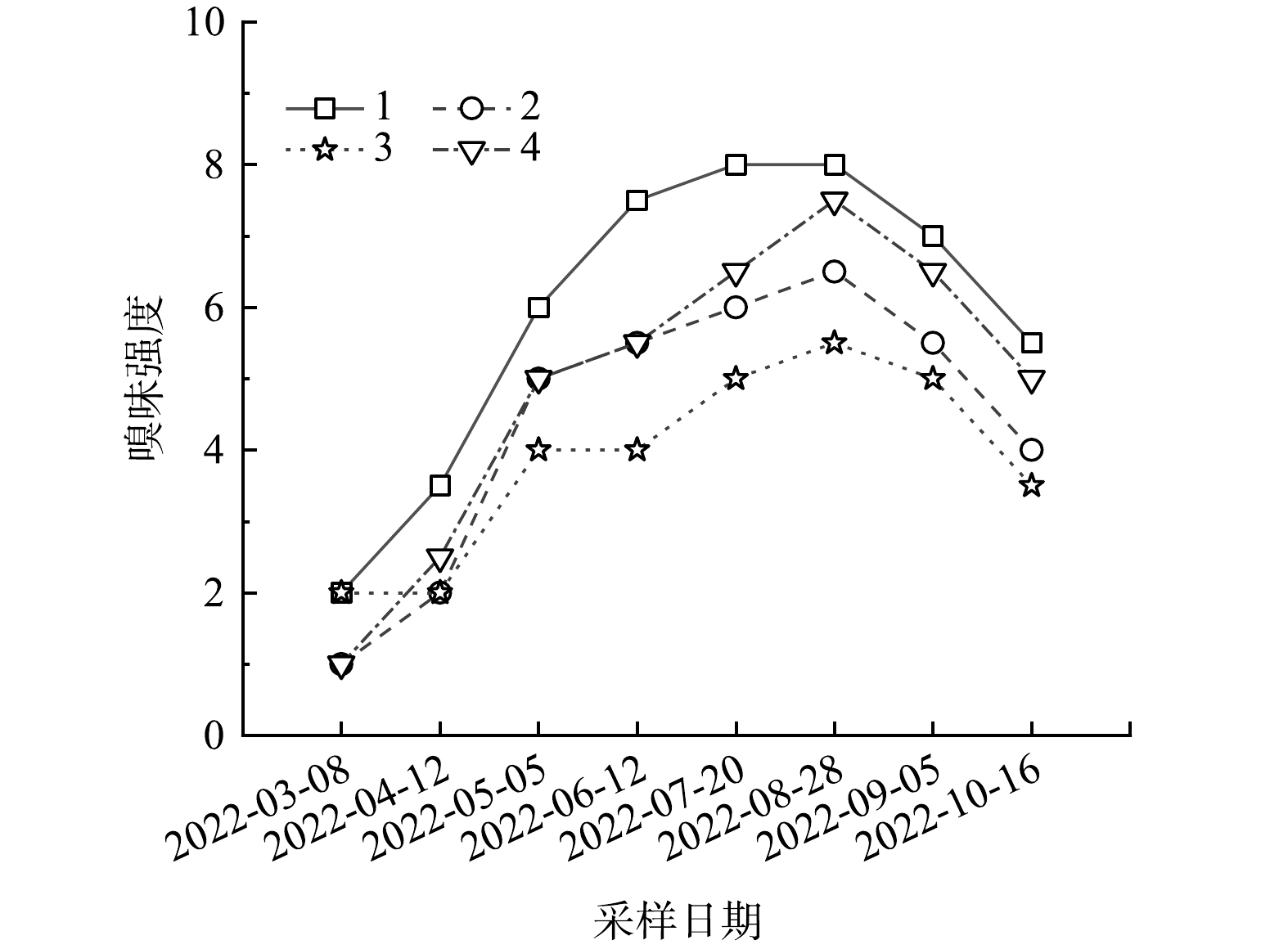
2021年3—10月,红升水库的嗅味问题持续了约8个月,水样FPA评价情况见表3。由表3可见,10个采样点的水样嗅味类型为鱼腥味混合土臭味、霉味。由于土臭味、霉味强度较弱(FPA<4),且产生土臭味、霉味的原因在以往的研究中可归因于蓝藻和放线菌的代谢产物导致,因此不对土臭味、霉味问题做更为深入的研究。选取4个重要采样点进行分析,采样点1位于水库西南处的荷花池附近,采样点2位于水域流速最低处,采样点3位于水源汇入处,采样点4靠近取水构筑物。如图1所示,重要采样点的水体鱼腥味嗅味强度均在研究期间呈现先升高后降低的趋势,且均在8月前后出现峰值。
-
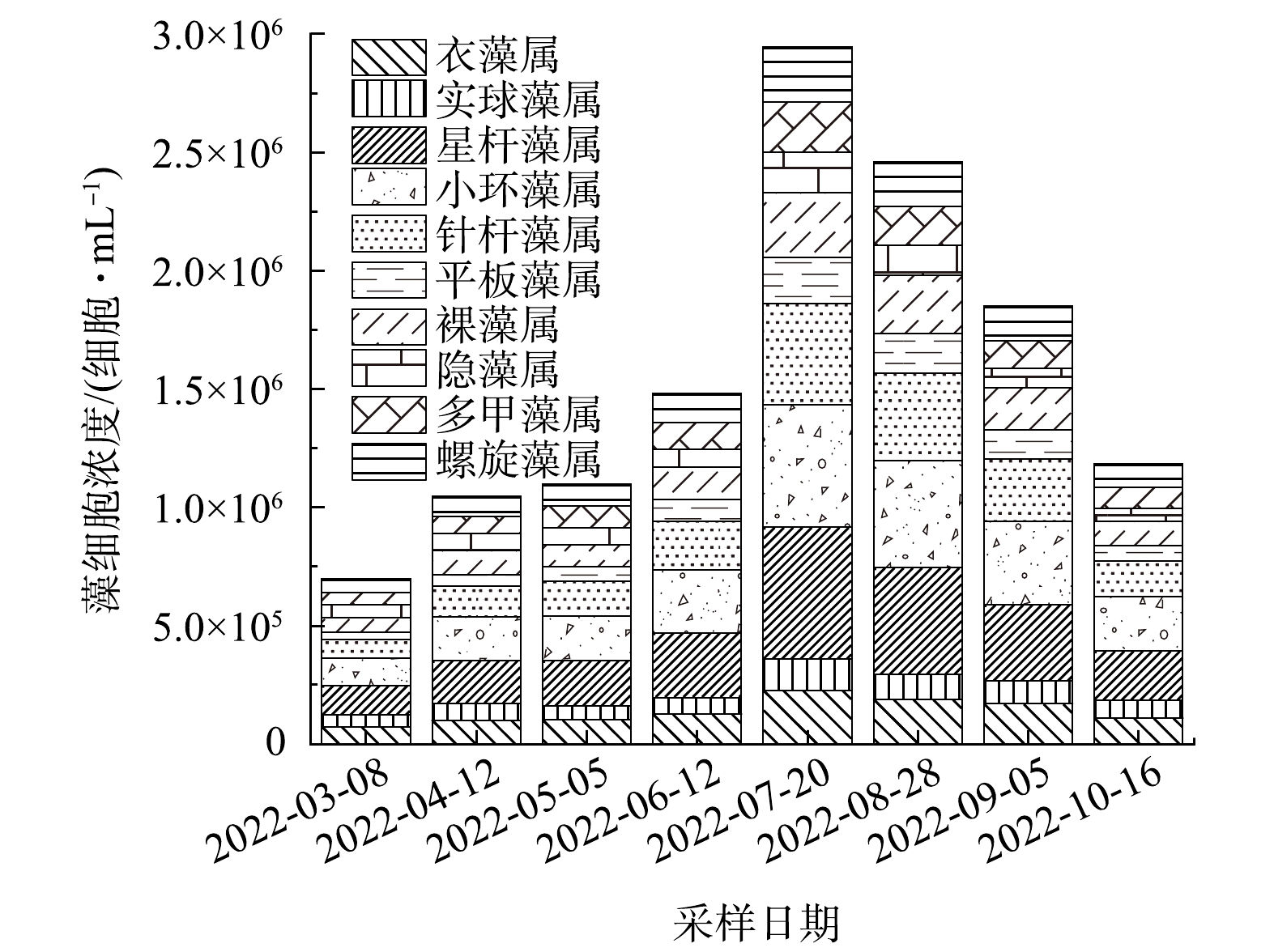
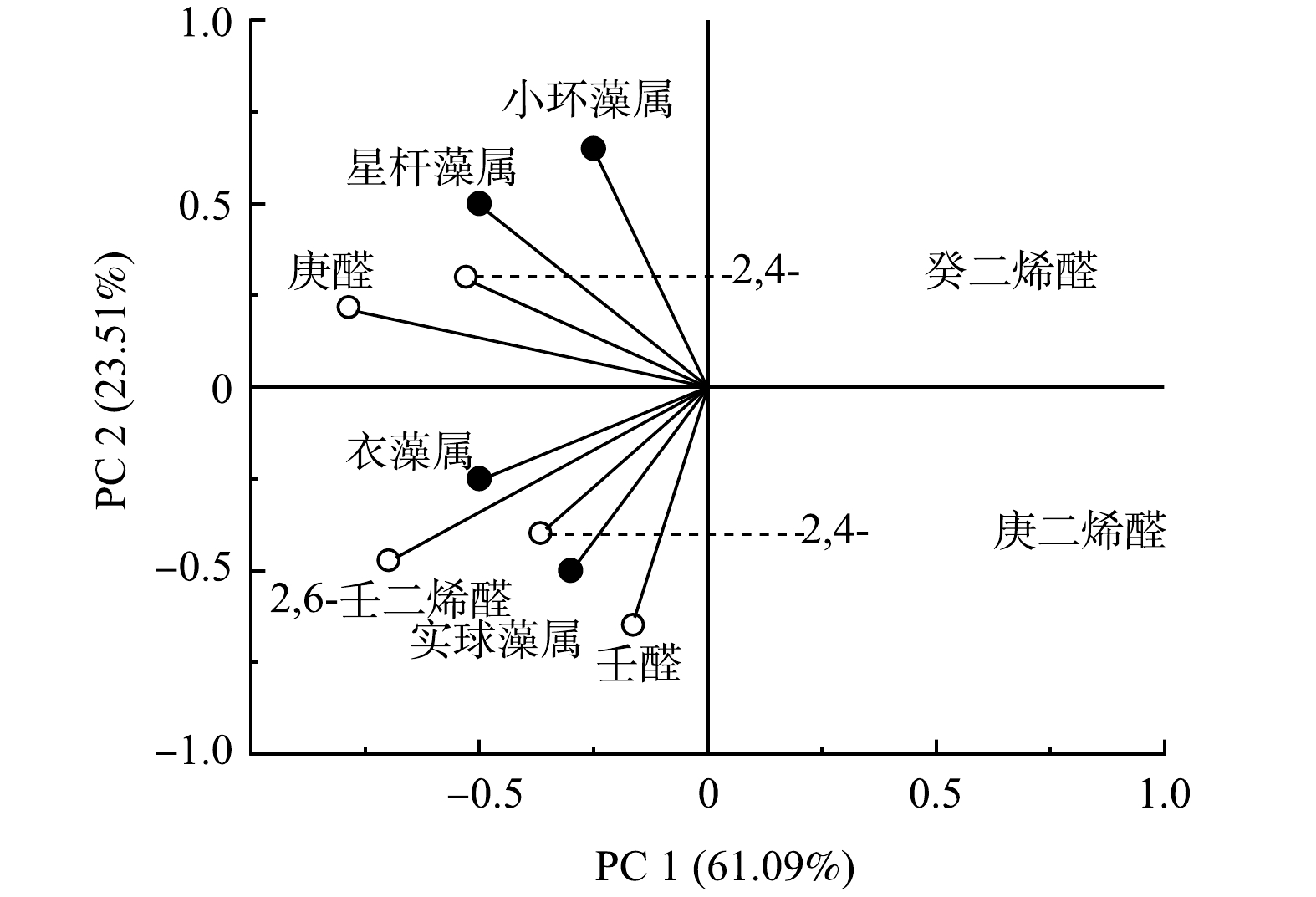
如图2所示,在采集到的水样中共检测到11种藻类,包含4种硅藻(星杆藻属(Asterionella sp.)、小环藻属(Cyclotella sp.)、针杆藻属(Synedra sp.)和平板藻属(Tabellaria sp.)),2种绿藻((衣藻属(Chlamydomonas sp.)、实球藻属(Pandorina sp.)),2种蓝藻(螺旋藻属(Sporoides sp.)、类颤藻属(Oscillarioides sp.)),1种裸藻(裸藻属)(Euglena sp.),1种隐藻(隐藻属) (Cryptomomas sp.),1种甲藻(多甲藻属)(Peridinium sp.)。其中星杆藻属和小环藻属最为丰富。为避免因局部因素出现较大偏差,采用10个采样点同期样品的均值描述对应的藻生物量。水库内的藻生物总量于7月20日达到峰值,为1.38×107细胞·mL−1。有研究[49-50]表明,星杆藻属和小环藻属可以在细胞破裂后分泌不饱和醛衍生物,如2-辛烯醛,2,4-辛二烯醛等鱼腥味嗅味物质,由于缺乏标准物质,本研究未对其进行分析。截至2022年5月仍没有相关证据表明平板藻属和针杆藻属与鱼腥味嗅味物质关联。因此,本研究重点关注星杆藻属和小环藻属与鱼腥味嗅味物质之间的关系。
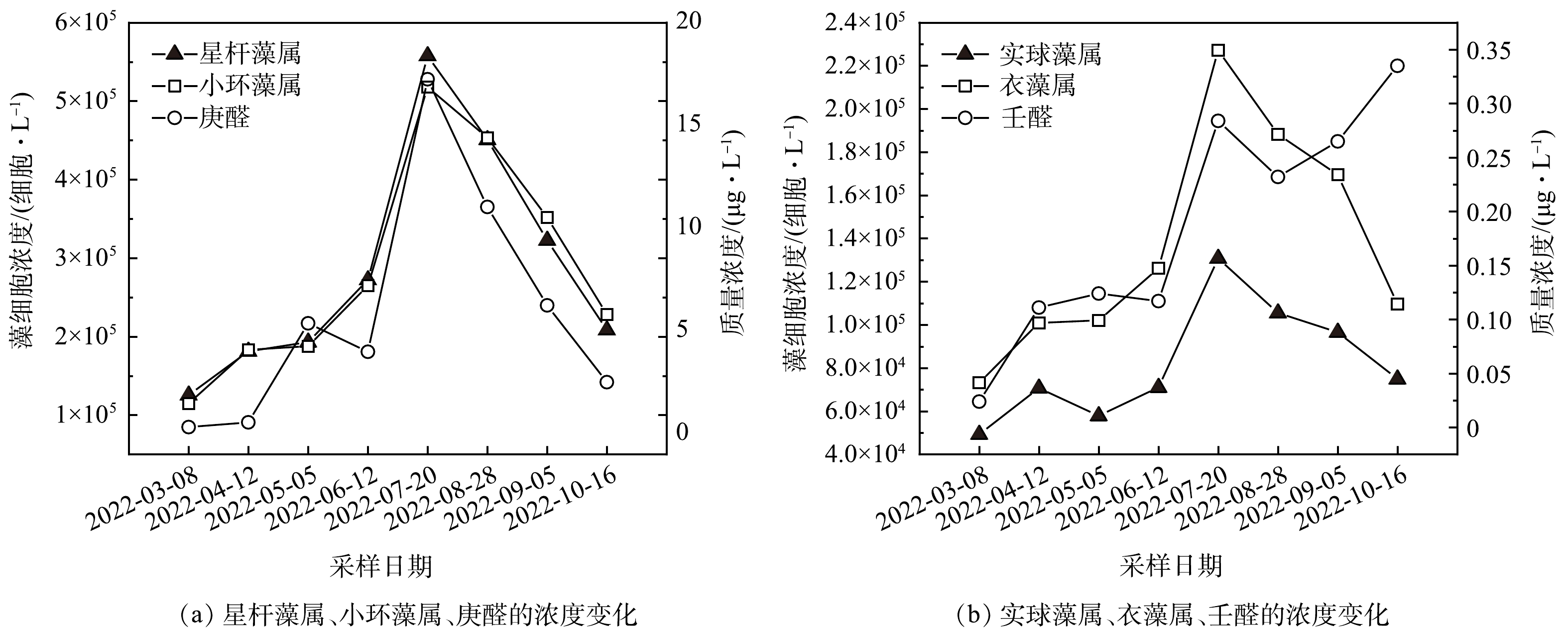
2021年5月9日,取样点4检测到的星杆藻属、小环藻属最高密度分别为5.58×105细胞·mL−1和5.18×105 细胞·mL−1。该位置位于水库的取水构筑物附近,即水厂中可能存在星杆藻属和小环藻属。星杆藻属和小环藻属可以在低温(4~15 ℃)和低光照条件下生长,即使是在冬季冰封期,水库也有可能出现嗅味问题[51]。通过分析4号取样点水样的嗅味强度和藻类细胞密度的变化,发现尽管嗅味强度和细胞密度之间存在时间滞后现象,但均表现出相似的变化趋势。
-
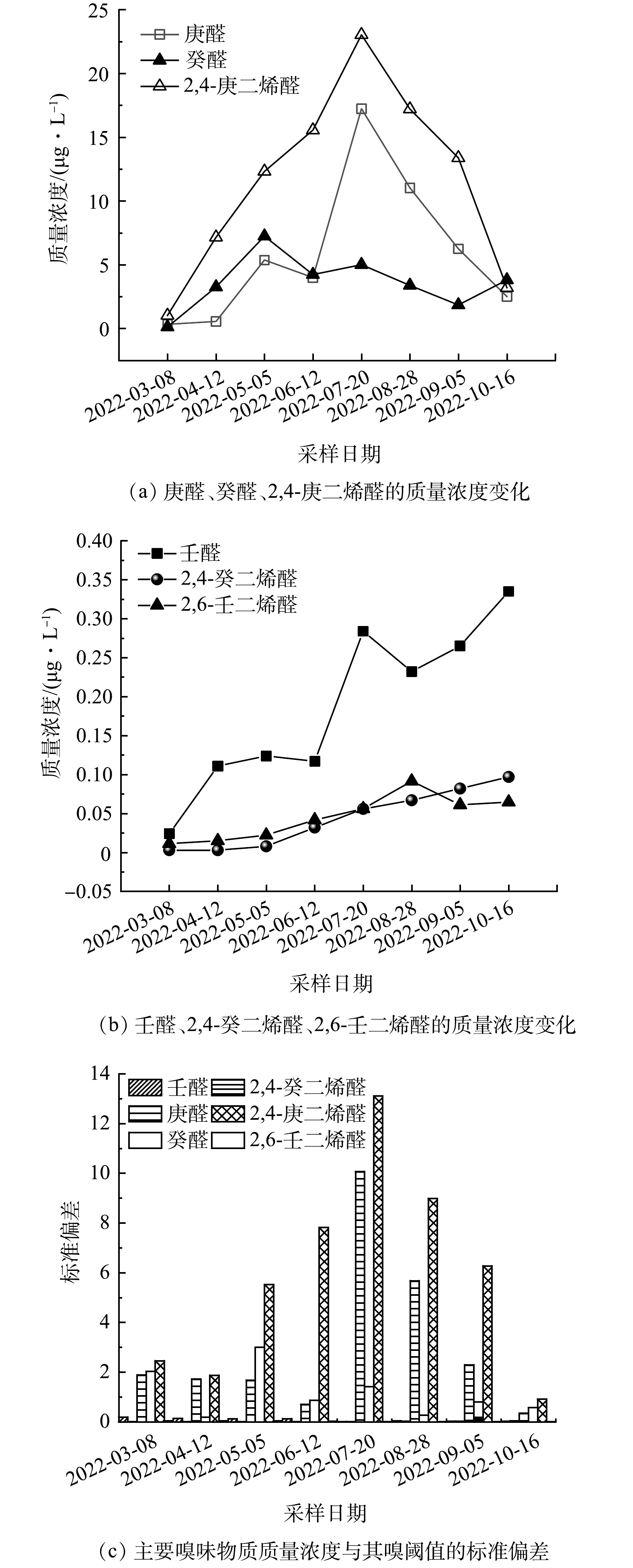
如表2所示,在水样中检测到12种嗅味标准参考物质中的8种,其中2种萜类化合物(2-MIB、GSM)和6种醛类化合物(庚醛、壬醛、癸醛、2,4-庚二烯醛、2,6-壬二烯醛、2,4-癸二烯醛)。因嗅味类型不属于鱼腥味,排除β-环柠檬醛和苯甲醛。如图3所示,2-MIB、GSM嗅味类型为土腥味、霉味,最高质量浓度出现在7—8月,约为其嗅阈值(Olfactory coefficient)的1.3倍和3.3倍。在检测到的6种醛类化合物中,庚醛、壬醛、癸醛、2,4-庚二烯醛、2,6-壬二烯醛、2,4-癸二烯醛均具有鱼腥味。其中2,4-庚二烯醛的质量浓度最高,为23.04 μg·L−1,约为OTC值(4.5 μg·L−1)的3倍;庚醛的最高质量浓度为17.24 μg·L−1,约为OTC(3.0 μg·L−1)的5.7倍;壬醛的最高质量浓度为0.34 μg·L−1,略高于OTC(0.3 μg·L−1);癸醛的最高质量浓度约为OTC(3.0 μg·L−1)的2.4倍。虽然2,6-壬二烯醛的峰值质量浓度为其OTC(0.08 μg·L−1)的1.5倍,但该物质仅具有青草、黄瓜气味。因此除2,6-壬二烯醛外,剩下的5醛都可能与本研究中的鱼腥味有关。
-
由表4中主成分分析(PCA)结果可见,庚醛对鱼腥味贡献最大,占比61.091%;壬醛次之,占比23.51%;癸醛占比10.72%。合计高达95.32%。
同时,采用相关性分析揭示藻类物种与6种潜在藻类代谢物之间的关系[52-54]。由图4可知,小环藻属、星杆藻属与庚醛和2,4-癸二烯醛的关系密切,壬醛、2,6-壬二烯醛和2,4-庚二烯醛与衣藻属和实球藻属密切相关。其中壬醛、2,4-庚二烯醛、庚醛和2,4-癸二烯醛均是具有鱼腥味的嗅味物质。癸醛的最高质量浓度可达其OTC的2.4倍,对鱼腥味的贡献不可忽视,占比高达21.23%,但并未发现癸醛与检测到的11种藻类具有相关性,无法就癸醛来源做出解释。此问题具有后续开展相关研究的价值。
如表5所示,庚醛质量浓度与小环藻属和星杆藻属的密度显著相关(r>0.9),庚醛可能由小环藻属和星杆藻属分泌产生;同样的,壬醛质量浓度与衣藻属和实球藻属相关性也较高(r>0.65),壬醛可能由衣藻属和实球藻属分泌产生。从图5中可以看出8月28日后壬醛质量浓度仍具有上升趋势,说明其它藻类物种也有产生壬醛的可能性。该问题在本研究中尚未得到准确的解释,后续情况有待深入调查研究。
因此,研究判断庚醛和2,4-癸二烯醛(可能是硅藻的代谢物)以及壬醛、2,4-庚二烯醛(可能是绿藻的代谢物)是导致鱼腥味嗅味问题发生的主要原因。值得注意的是,尽管隐藻属、裸藻属和多甲藻属的细胞密度明显低于硅藻和绿藻,但其对鱼腥味的贡献不能完全忽视。
-
1)此次红升水库水源的嗅味问题为鱼腥味混合土臭味、霉味。检测到8种嗅味物质(2种萜类化合物(2-MIB、GSM)、6种醛类化合物(庚醛、壬醛、癸醛、2,4-庚二烯醛、2,6-壬二烯醛、2,4-癸二烯醛)和11种藻类。
2)硅藻类群中的星杆藻属最为丰富,峰值为5.58×105 细胞·mL−1,小环藻属次之,峰值为5.18×105 细胞·mL−1。
3) PCA结果表明,在检测到的6种醛中,庚醛、2,4-癸二烯醛(可能是硅藻的代谢物)、壬醛、2,4-庚二烯醛(可能是绿藻的代谢物)与本研究中的鱼腥味问题有关,庚醛的贡献值最大(61.091%),壬醛次之(23.51%)。癸醛对鱼腥味的贡献为10.72%,但无法解释其来源。
4)蓝藻是已知藻类中唯一可产生2-MIB和GSM的藻类,红升水库的土臭味、霉味问题主要是由库区蓝藻数量异常增长所引起的。鱼腥味问题则是源于库区螺旋藻属、类颤藻属、星杆藻属、小环藻属、衣藻属和实球藻属的大量增殖。
红升水库藻源性嗅味问题解析
Analysis of algae-derived odor problem in Hongsheng Reservoir
-
摘要: 2021年红升水库出现了一次严重的饮用水嗅味问题,结合同期的水样采集和分析,对嗅味特征、嗅味物质和藻类等主要参数进行了系统调查。采用嗅味层次分析法(FPA)对嗅味类型和强度进行了评估,并参考主成分(PCA)和相关性分析结果对藻类和嗅味物质进行关联。在藻类物种中,绿藻和硅藻最为丰富,占比分别为43.6%和29.1%。其中,星杆藻属密度最大(5.58×105 细胞·mL−1)。检测到土臭素(GSM)、2-甲基异莰醇(2-MIB)、庚醛、壬醛、癸醛、2,4-庚二烯醛、2,6-壬二烯醛、2,4-癸二烯醛等8种嗅味物质。根据FPA分析,红升水库饮用水嗅味为强烈的鱼腥味伴随轻微的土臭味、霉味,2种嗅味强度最高值均出现在水库西南侧的荷花池附近。PCA分析结果表明,饱和醛(庚醛、壬醛和癸醛)是产生鱼腥味的主要嗅味物质,但不饱和醛的影响仍不可忽略。庚醛和2,4-癸二烯醛可能与硅藻中星杆藻属和小环藻属的生长代谢有关,而壬醛、2,4-庚二烯醛和2,6-壬二烯醛则可能是绿藻中衣藻属和实球藻属的代谢产物。研究结果表明,蓝藻的暴发是红升水库出现土臭味、霉味的主要原因,而更为严重的鱼腥味问题则是由水中的螺旋藻属、类颤藻属、星杆藻属、小环藻属、衣藻属和实球藻属的大量繁殖引起的。Abstract: A serious drinking water odor problem occurred in 2021 at Hongsheng Reservoir, and the main parameters such as odor characteristics, odor substances and algae were systematically investigated in combination with the water sample collection and analysis during the same period. The odor hierarchy analysis (FPA) was used to assess the type and intensity of odor, and the algae and odorant substances were correlated with reference to results of principal component (PCA) and correlation analysis. Among the algal species, green algae and diatoms were the most abundant, accounting for 43.6% and 29.1%, respectively. Among them, the greatest density (5.58×105 cell·mL−1) occurred in the genus Starry rod algae. Eight olfactory substances, including earth odorant (GSM), 2-methylisobornyl (2-MIB), heptanal, nonanal, decanal, 2,4-heptadienal, 2,6-nonadienal and 2,4-decadienal, were detected. According to the FPA analysis, the drinking water odor of Hongsheng Reservoir was a strong fishy odor accompanied by a slight earthy and musty odor, and the highest intensities of both odors occurred near the Lotus pond on the southwest side of the reservoir. PCA results showed that saturated aldehydes (heptanal, nonanal and decanal) were the main odor substances that produced fishy odors, but the influence of unsaturated aldehydes was still not negligible. Heptanal and 2,4-decadienal could be associated with the growth metabolism of the diatom genera Stellaria and Chlorella, while nonanal, 2,4-heptadienal and 2,6-nonadienal could be the metabolites of the green algae genera Chlamydomonas and Solidococcus. Cyanobacteria are the only algae known to produce 2-MIB and GSM, and cyanobacterial outbreaks were the main cause of earthy/moldy odor in water at Hongsheng Reservoir. More serious fishy odor problem in Hong Sheng Reservoir could be caused by the abnormal growth of Spirulina, Chlamydomonas, Chlamydomonas, Chlamydomonas, and Chlorella in the water.
-
Key words:
- drinking water /
- fishy odor /
- saturated aldehyde /
- odor characterization /
- principal component analysis
-
南水北调中线工程作为世界上最大的调水措施,旨在缓解华北地区的水资源短缺问题。中线干渠水源来自多条河流,含有大量的营养物质如氮、磷等,且水流速度较慢,容易形成静水区域,使得藻类容易生长繁殖。水流通过干渠断面的过程中由于流速减慢,水中携带的泥沙、沉积物等物质会逐渐沉淀,形成堆积在干渠底部的底泥[1]。藻类的释放是丹江口水库溶解性有机物(dissolved organic matter, DOM)的重要来源,直接关系到南水北调水源地的水质安全[2]。而作为污染物、养分和有机物的汇,底泥中的DOM可以提供比其上覆水更多的物质循环信息[3]。总干渠水质应达到《地表水环境质量标准》(GB3838-2002)的Ⅰ-Ⅱ类水标准。近年来主河道输水至北京和天津时DOM浓度有上升趋势,导致水质的重要有机污染指标化学需氧量(chemical oxygen demand, COD)上升,对京津两地的饮用水供应安全构成威胁[4]。
地表水中的DOM是由多糖、蛋白质和木质素等各种活性物质组成的复杂和非均相混合物[5]。在输送溶解性有机碳(dissolved organic carbon, DOC)的过程中,DOM会受到阳光照射而发生转化和降解,是从地表水中除去DOC的重要途径之一[6]。MORAN等[7-8]研究了地表水DOM在紫外辐射下的光漂白和光矿化作用,包括紫外吸光度和荧光强度的损失及DOC浓度的降低。但关于比较分析不同来源DOM光反应行为的研究较少。考虑到水环境中DOM来源的复杂性及其生态重要性,需要更全面地了解控制其转化的行为。
北京段清河位于中线的末端,来水已经流经了中线所有的区域,可以提供水质累积影响的有价值的信息。本文以南水北调终点清河段的水、底泥中DOM及微囊藻衍生的I-DOM和E-DOM为研究对象,利用三维荧光光谱和紫外可见吸收光谱技术比较了不同来源DOM光学性质和光降解行为的差异性,对控制输水过程DOM的积累具有重要价值。
1. 材料与方法
1.1 样品准备与预处理
地表水和底泥采集自南水北调北京段清河(40°0′43.73″N, 116°16′27.55″E),样品分别简写为W-DOM和S-DOM。采集的底泥与Milli-Q水充分混合后在4 000 r·min−1转速下离心10 min,上清液为底泥DOM [9]。对干渠中相对丰度最高的常见藻类——微囊藻(Microcystis sp.)进行纯藻种培养,培养箱温度设置为(25±1) ℃,光照和黑暗循环时长均为12 h,光照强度2 000 lux,模拟藻类的生长环境[10]。培养结束后分别采用离心和冻融法提取胞内和胞外DOM [11],样品分别简写为I-DOM和E-DOM。
1.2 光化学降解实验
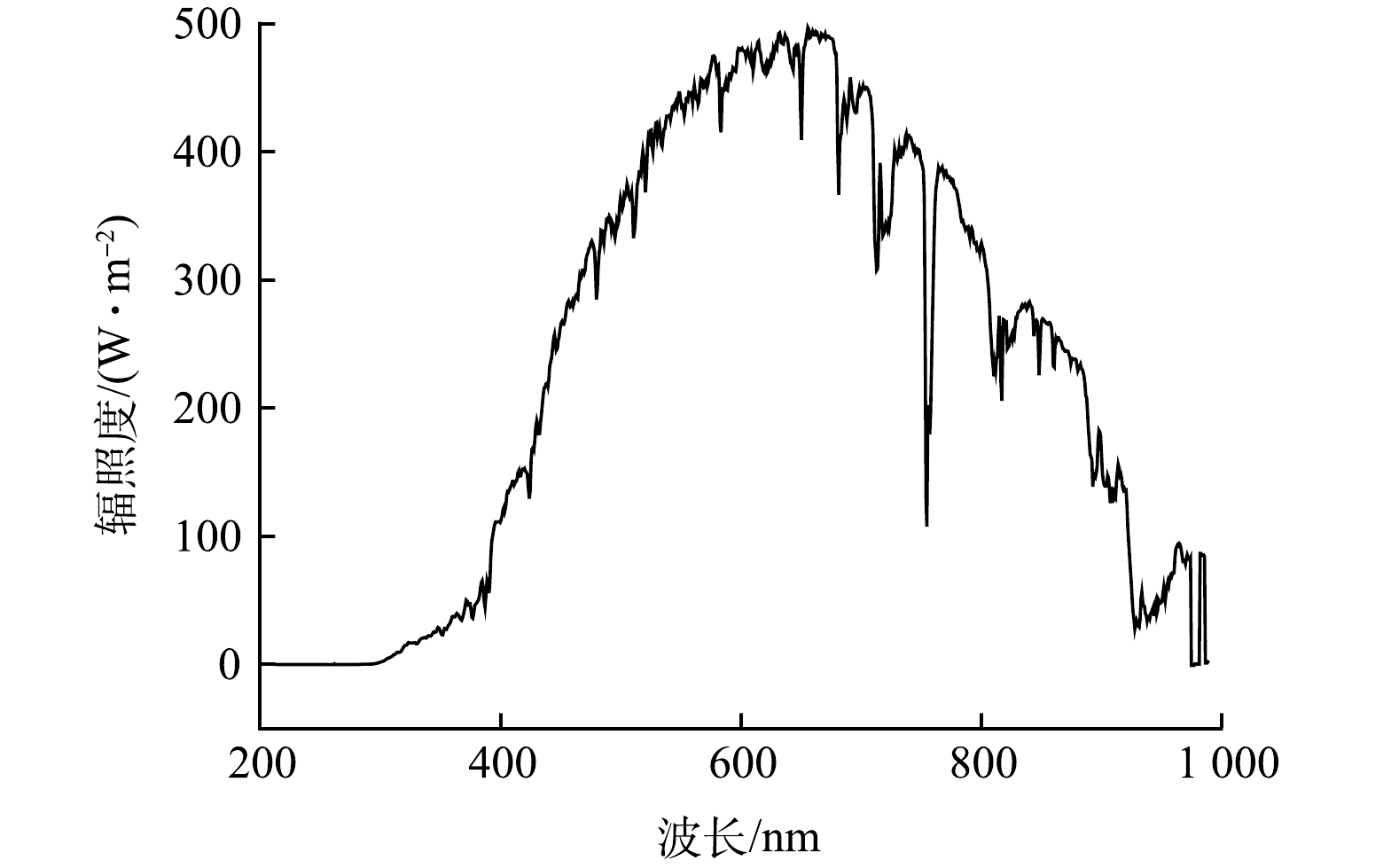
实验前所有DOM样品用0.22 μm的纤维素酯膜过滤。光降解实验在装有1 000W氙灯的太阳光模拟器(Sol 2A ABA,美国Newport公司)中进行,采用持续光照模式。氙灯光谱如图1所示,其在紫外波段的辐照度与实际太阳光的辐照度相近。采用恒温装置将反应器中的温度保持在约25 ℃。在光照第0、1、2、3、5、7 d取平行样品分析。
1.3 分析方法
用Lambda 850型分光光度计(Perkinelmer,美国)检测波长范围在200~600 nm的紫外-可见吸收光谱,测得的吸光度(A)用式(1)转换为波长λ处的吸收系数(aλ)[12]。
aλ=2.303Aλ/r (1) 式中:aλ为波长λ处的吸收系数,m−1;r为比色皿厚度,m。
由于原始光谱在光照过程中信号变化较微弱,所以参考DRYER等[13]对光谱的处理方法:分别将测得的原始光谱与光照前的原始光谱做差,即为吸收损失光谱。用320 nm处的吸收系数(a320)近似表示CDOM浓度[14]。特征紫外吸光度(SUVA254)通过254 nm处的吸收系数除以DOC浓度计算,代表样品的芳香性碳含量[15]。通过非线性拟合得到275~295 nm和350~400 nm的光谱斜率S275~295和S350~400,计算出斜率比(SR),其与DOM的分子质量成反比[16]。
使用F-4500型荧光光谱仪(Hitachi,日本)测量荧光激发-发射矩阵(EEM)光谱,并以5 nm的增量在200~450 nm改变激发波长(Ex),随后以5 nm的增量在270~600 nm扫描发射波长(Em)。荧光光谱分为5个峰:类腐殖质峰A(Ex/Em=260 nm/400~460 nm)、峰M(Ex/Em=290~310 nm/370~410 nm)和峰C(Ex/Em=320~360 nm/420~460 nm)、类蛋白质峰B(Ex/Em=225nm/340nm)和峰T(Ex/Em=275 nm/340 nm),并利用荧光区域积分法计算各个荧光峰强度。采用性质相似的类腐殖质荧光组分之和Ch(即A+M+C)和类蛋白质荧光组分之和Cp(即B+T)代替单一组分分析降解规律。荧光指数(fluorescence index, FI)可以表示DOM的来源,FI<1.4时;DOM主要为陆生植物及土壤有机质等外源物质输入,FI>1.9时,DOM主要为微生物活动等内源过程产生[17]。腐殖化指数(humification index, HIX)可以衡量DOM的腐殖化程度,HIX越大,说明分子组成越复杂,腐殖质的含量越高。自生源指数(biological index, BIX)主要反映DOM的生物可利用性,BIX越高,说明DOM的降解程度越高,内源碳产物越容易生成[18]。
2. 结果与讨论
2.1 DOM光学性质差异
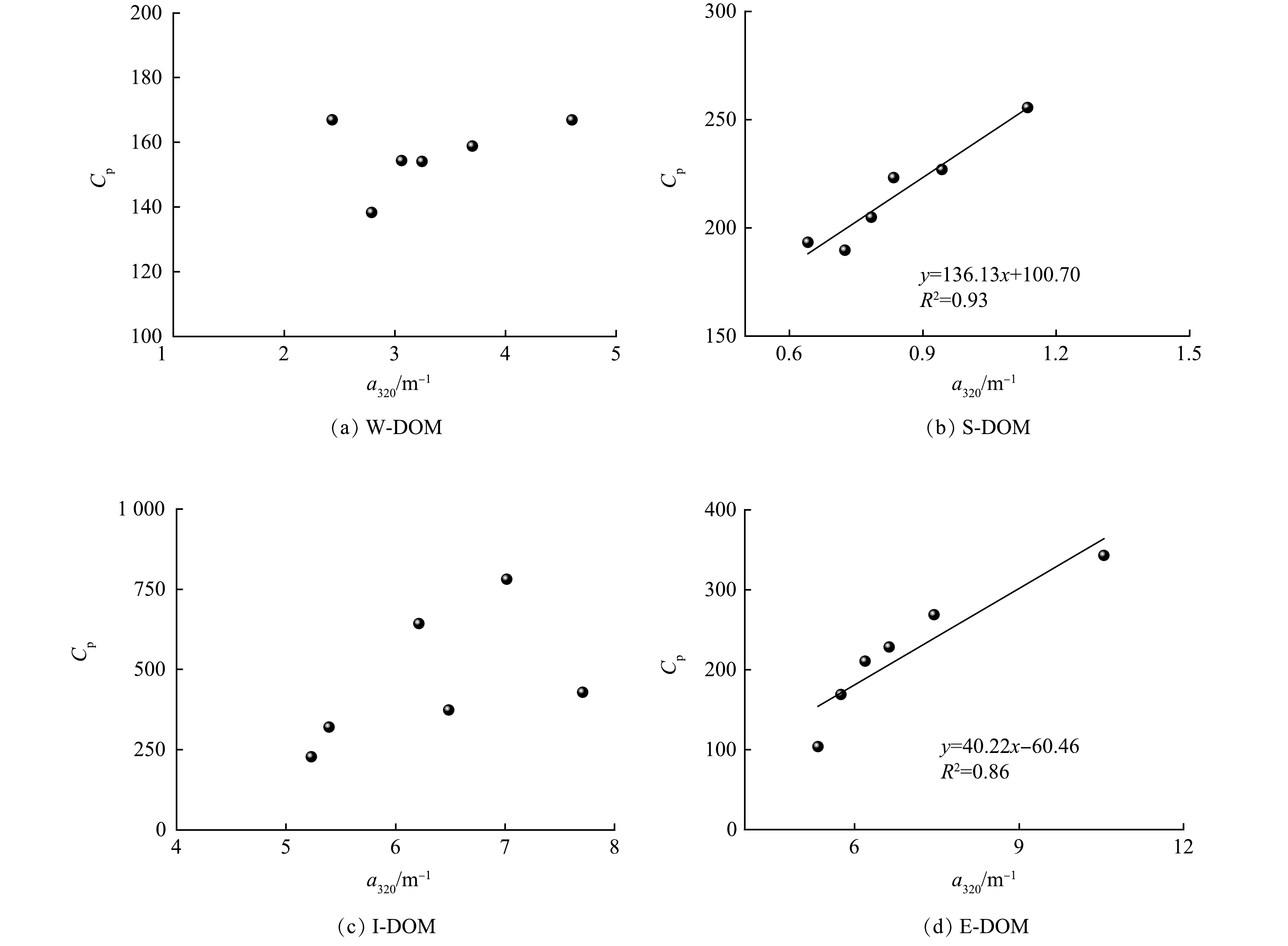
DOM样品的三维荧光光谱、荧光组分含量和荧光参数分别如图2和表1所示。不同来源DOM样品在荧光峰的分布和强度上表现出明显的异质性。W-DOM中峰A、峰M和峰C的强度较高,其主要荧光组分是类腐殖质。S-DOM中峰B和峰T的强度较高,其主要荧光组分是类蛋白质和类色氨酸[19]。微囊藻衍生的DOM中5种峰的强度都较高,其中I-DOM中强度最高的是峰T,E-DOM中强度最高的是峰A。
表 1 DOM样品荧光组分的含量和荧光光谱参数Table 1. Content of fluorescent components and fluorescence spectra parameters of DOM samples样品名称 荧光峰强度 FI HIX BIX B T A M C W-DOM 67.23 99.68 187.04 155.82 158.82 2.18 0.80 1.01 S-DOM 138.53 116.99 53.24 221.10 60.69 2.45 0.48 3.62 I-DOM 239.13 542.06 240.33 193.62 126.29 2.79 0.53 0.70 E-DOM 103.90 239.01 441.23 151.60 212.18 2.16 0.82 1.07 所有样品的FI均大于2.0,说明清河DOM基本为内源过程产生。W-DOM和E-DOM的腐殖化程度较高,而S-DOM和I-DOM的腐殖化程度较低。除S-DOM的生物可利用性较高外,其余样品都较低。本研究中I-DOM的BIX值与KIM等[20]对Miho河中藻类DOM的研究结果(BIX=0.67)接近,其认为荧光参数会受生物地球化学过程影响而发生变化,从而导致高估或低估DOM源的相对贡献率。因此,荧光光谱参数只提供定性分析,FI和BIX之间没有必然的联系和相关性。W-DOM和E-DOM的荧光特征具有一定的相似性;S-DOM和I-DOM的荧光特征具有一定的相似性,这可能与不同的生物地球化学过程有关。藻类代谢产生的E-DOM不断释放到水体中,是河道DOM的主要来源之一。藻类死亡后会在河流底部沉降积累,成为沉积物的一部分。因此,藻细胞破裂后释放的I-DOM是S-DOM的重要组成部分。
2.2 光漂白对DOM紫外可见吸收性质的影响
样品的吸收损失光谱如图3所示。可以看出所有样品在UV-B波段(280~320 nm)的吸光度损失率大于UV-A波段(320~400 nm),说明CDOM的光漂白效率与光子的能量密切相关[21]。CDOM在可见光波段的吸光度损失很小,说明光照主要影响其在紫外区的吸光度损失。值得注意的是,在光照中期的某些时间点I-DOM的吸光度反而略微增加,这个现象被认为与DOM中含有更高分子质量、更高度芳香结构物质的生成有关。CHEN等[22]发现了低分子质量芳烃,如来自单宁分解的多酚或通过从生物质中浸出的低分子质量DOM的光腐殖化反应可以增强吸光度信号。
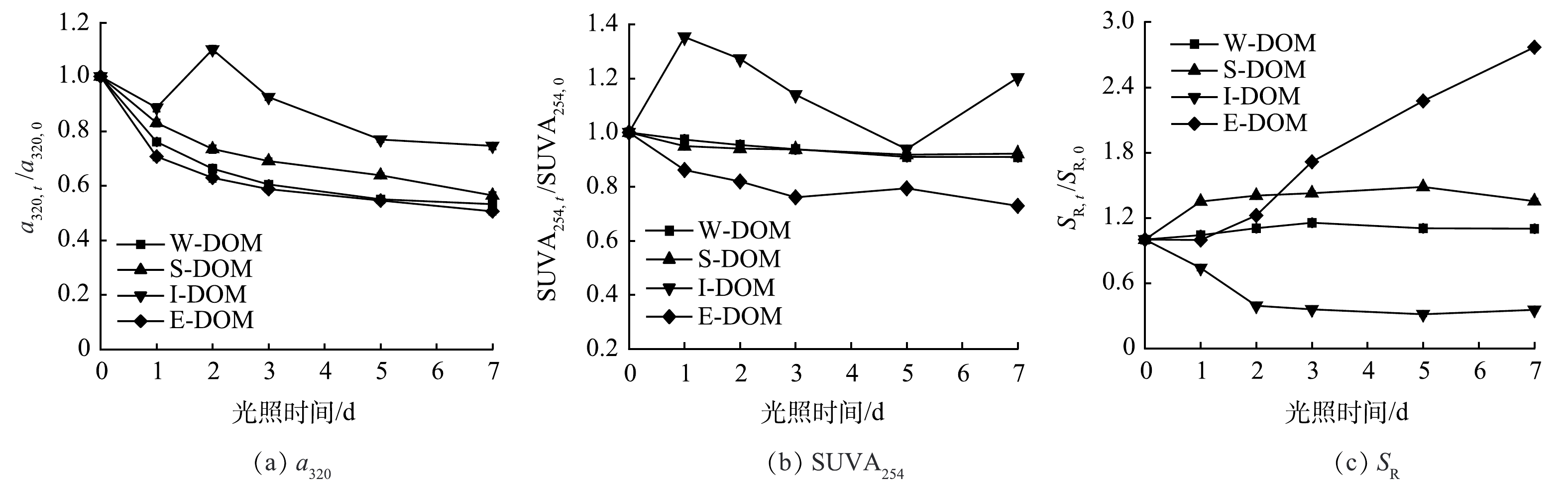
将a320、SUVA254和SR分别以第0 天为基准归一化处理后得到3种指标随光照时间的变化如图4所示。光照后所有样品的a320均显著降低,其中I-DOM降低幅度最小,约为25%,其他样品的降解比例大体相同,约为40%~50%。这表明CDOM具有很强的吸光能力,当受到光照时其吸收能力会发生变化,通过自由基反应导致化学结构和分子大小发生变化,从而降低其吸收光谱的强度。光照显著降低了E-DOM中芳香性碳含量,这是因为光照激发了水中的氧,产生一系列活性物质,如羟基自由基(·OH)和超氧自由基(O2·-),可以与芳香碳发生氧化反应,使其分解成更小的分子[23]。光照对S-DOM和W-DOM中芳香性碳含量的影响很小,而I-DOM中芳香性碳的含量波动较大,这也表明可能发生了光腐殖化作用。除I-DOM外,其他样品的SR均有增加趋势,表明光照能够将大分子DOM分解为小分子DOM。I-DOM的SR下降的确切原因尚不清楚,但先前的报道称浮游生物衍生的DOM的存在会干扰S275~295的值,因为蛋白质的典型的宽吸收带集中在280 nm[24]。
进一步分析表明,除I-DOM外,其余3个样品CDOM降解率随光照时间的增加而指数减少,最终逐渐稳定。为了定量评估光降解过程,选择指数模型进行拟合,拟合公式如式(2)所示[25]。
Y=R0+RP⋅exp(−Kx) (2) 式中:x为光照时间,d;Y为以第0 天为基准归一化的a320;R0为耐光性组分所占百分比,%;Rp为光不稳定组分所占百分比,%;K为光降解速率常数,d−1。
拟合结果如表2所示。可以看出3个DOM样品拟合的相关系数都是0.99,拟合结果较好。结果表明E-DOM中的CDOM光降解速率最高,其次是W-DOM,S-DOM最低。
表 2 CDOM的光降解动力学拟合结果Table 2. Fitting results of photodegradation kinetics of CDOM样品名称 拟合方程 R2 光降解速率常数/d−1 W-DOM Y=0.46exp(−0.66x)+0.53 0.99 0.66 S-DOM Y=0.43exp(−0.44x)+0.57 0.99 0.44 E-DOM Y=0.46exp(−0.84x)+0.53 0.99 0.84 2.3 光漂白对DOM荧光性质的影响
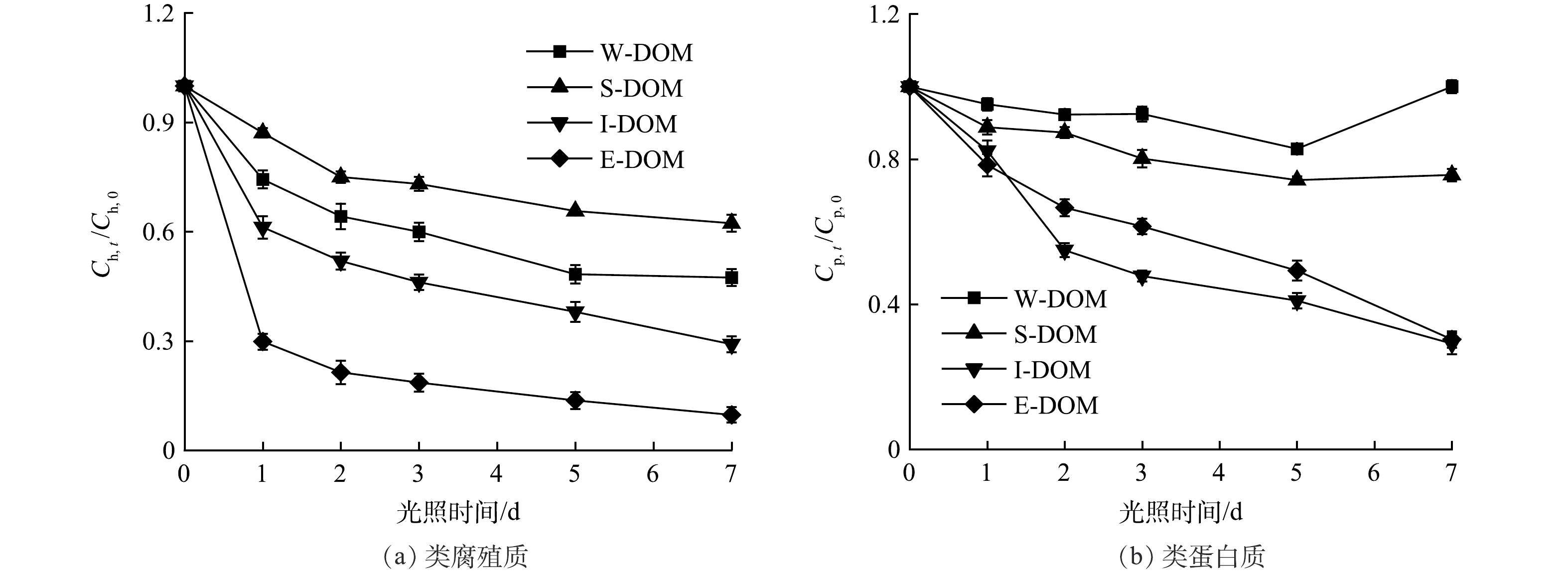
类腐殖质荧光组分Ch和类蛋白质荧光组分Cp分别以第0 d为基准归一化处理后得到其随光照时间的变化如图5所示。从图5(a)中可以看出光照过程中所有样品的类腐殖质的含量均有降低趋势,但降解比例各不相同。E-DOM的降解比例最大,超过90%;其次是I-DOM和W-DOM,分别约70%和50%;S-DOM的降解比例最低,不到40%。由图5(b)中可以看出,W-DOM的类蛋白质的含量在光照过程中小幅波动,光照后没有明显的降低;S-DOM降解了约25%;藻衍生的DOM降解比例最高,约70%。综合以上结果,类腐殖质的光降解比例普遍大于类蛋白质,表明其光活性更强。
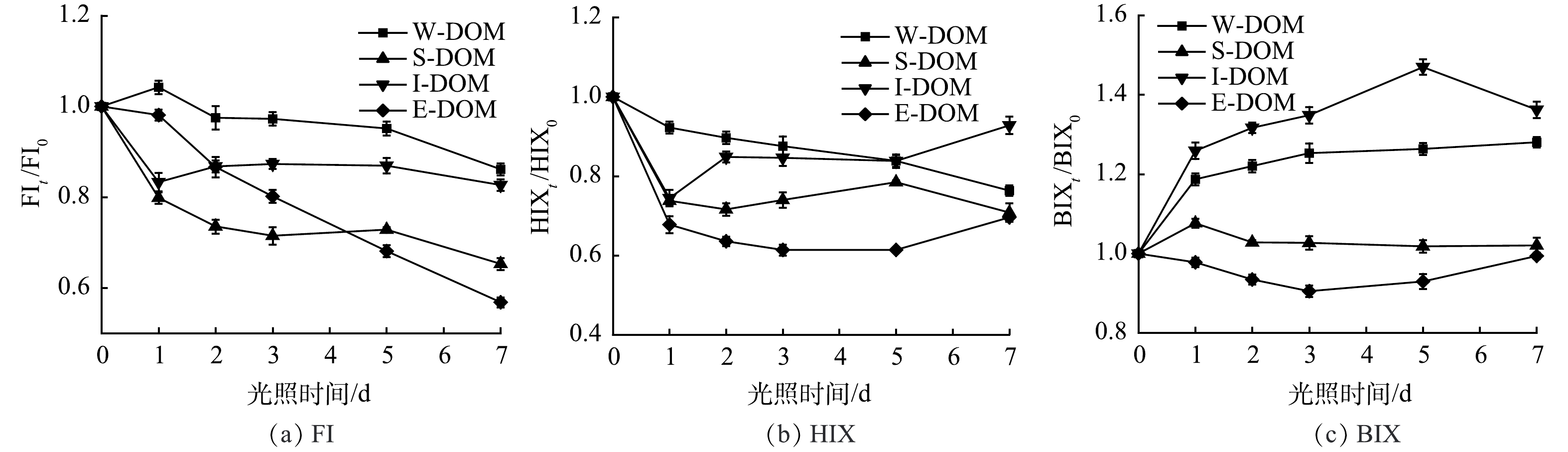
归一化的荧光光谱参数FI、HIX和BIX随光照时间的变化如图6所示。所有样品的FI和HIX均有下降趋势,表明荧光组分的降解程度不断增加,结构复杂的腐殖质类物质容易受到破坏,可被光降解为结构简单的物质。I-DOM与W-DOM样品的BIX明显升高,其余样品变化不明显。结果表明光照可以在一定程度上将难以被微生物利用的DOM转化为更具生物利用性的低分子量光产物,这取决于DOM的来源。BERTILSSON等[26]已经发现腐殖质湖中羧酸在光照中大量生成,并利用同位素示踪证明了羧酸是浮游生物利用的主要底物。
2.4 光漂白过程荧光组分与CDOM含量变化相关性
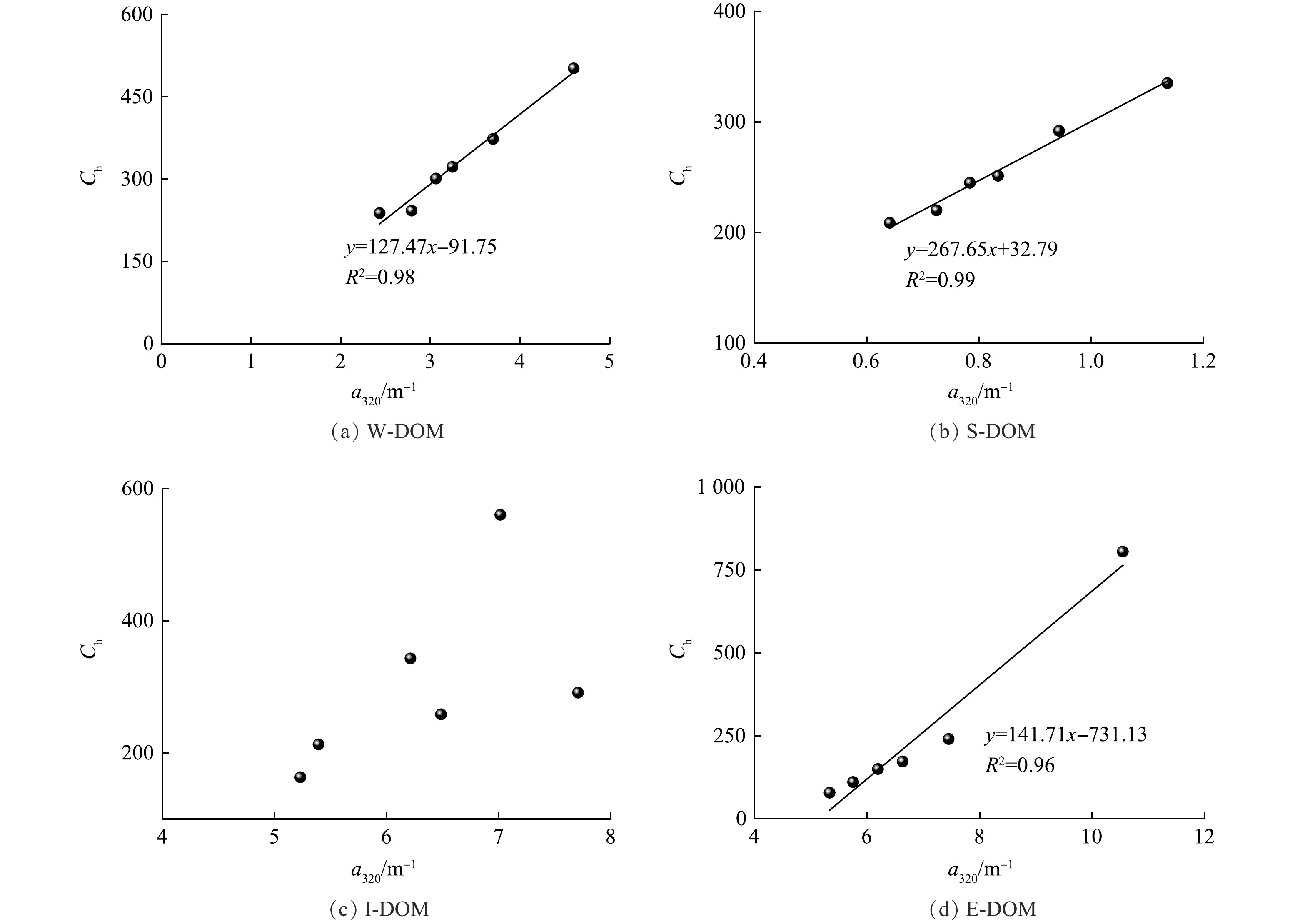
对DOM样品在7 d光漂白过程中类腐殖质含量与a320进行相关性分析,结果如图7所示。结果表明,在W-DOM、S-DOM和E-DOM中类腐殖质含量与a320变化趋势呈显著正相关,说明这些样品中CDOM的光降解速率与类腐殖质的光降解速率在相同时间下基本保持一致。
对DOM样品在7 d光漂白过程中类蛋白质含量与a320进行相关性分析,结果如图8所示。结果表明,在S-DOM和E-DOM中类蛋白质含量与a320变化趋势呈显著正相关,说明这些样品中CDOM的光降解速率与类蛋白质的光降解速率在相同时间下基本保持一致。在I-DOM中类腐殖质、类蛋白质含量与a320变化趋势均无显著相关,说明I-DOM中CDOM与类腐殖质、类蛋白质的光降解速率在相同时间下均不一致。
3. 结论
1)清河水和底泥中DOM在荧光特征上分别与微囊藻衍生的胞外和胞内DOM具有较高相似性,说明清河中的DOM主要形成于内源的微生物过程。
2)DOM的光漂白主要发生在紫外区,且UV-B波段的光漂白效率大于UV-A波段。清河水、底泥和微囊藻胞外DOM中CDOM的降解率为40%~50%,光照可以将其中复杂的大分子物质分解成结构简单的小分子物质;I-DOM中CDOM降解率相对较低,约为25%。
3)CDOM中类腐殖质的光降解率比类蛋白质更高,清河水、底泥和微囊藻胞外DOM中CDOM与类腐殖质的光降解速率在相同时间下基本保持一致;清河底泥和微囊藻胞外DOM中CDOM与类蛋白质的光降解速率在相同时间下基本保持一致。
-
表 1 红升水库基本水质参数
Table 1. Basic water quality parameters of Hong Sheng Reservoir
水质指标 TN/(mg·L−1) TP/(mg·L−1) NH3−N/(mg·L−1) COD/(mg·L−1) BOD5/(mg·L−1) pH OD/(mg·L−1) 红升水库 1.53 0.09 0.54 22.52 2.93 7.2 8.99 Ⅳ类标准参考值 1.50 0.30 1.50 30.00 6.00 6.9 3.00 SD(标准偏差) 0.02 0.15 0.68 5.29 2.17 0.2 4.24 表 2 嗅味物质基本信息
Table 2. Basic information on odorant substances
化合物 嗅味物质 嗅味类型 嗅阈值/(μg·L−1) 检出限/(ng·L−1) 萜类化合物 土臭素 土臭味/霉味 0.003 0.830 2-甲基异莰醇 0.001 0.470 醛类化合物 正己醛 鱼腥味(油腻) 4.500 1.420 庚醛 鱼腥味(油腻) 3.000 6.290 壬醛 青草味(少量)鱼腥味(过量) 1.000 0.430 癸醛 鱼腥味 3.000 13.750 2-辛烯醛 橘子气味(少量)鱼腥味(过量) 0.021 8.330 2,4-庚二烯醛 鱼腥味(油腻) 5.000 70.550 2,4-癸二烯醛 鱼腥味 0.029 9.210 2,6-壬二烯醛 青草/黄瓜气味 0.080 60.610 苯甲醛 杏仁味 4.500 10.870 β-环柠檬醛 干草/烟草气味 500.000 3.350 表 3 嗅味特征评估情况
Table 3. Assessment of odor characteristics
采样日期 不同采样点的嗅味强度(鱼腥味/土臭味) 1 2 3 4 5 6 7 8 9 10 2022-03-08 2/2 1/1.5 2/1.5 1/1 2/1 1/1.5 2/2.5 1/1 2/1.5 1.5/0.5 2022-04-12 3.5/4 2/3 2/2 2.5/2 2.5/1.5 2.5/1 3/3.5 2/1.5 2.5/2 2/1 2022-05-05 6/3 5/3.5 4/2 5/3.5 4/2 4/2 5/3.5 4/4 5/4 5/3 2022-06-12 7.5/3.5 5.5/4 4/2.5 5.5/4 4/2.5 4/2.5 7/4 4/3 6/3 6/4 2022-07-20 8/4 6/4 5/3 6.5/3 5/3 5/3 8/3.5 6/3 8/4 6.5/3.5 2022-08-28 8/2.5 6.5/4 5.5/2.5 7.5/2 6.5/3 5.5/3 8/3 6.5/3.5 8.5/3.5 8/3 2022-09-05 8.5/3.5 7.5/3 6/2 8/4 6/2 6/4 8.5/2 6/4 9/4 7/3.5 2022-10-16 8.5/4 7/3.5 6.5/2 8/3.5 6.5/2 6.5/3 8.5/3 6.5/3 9.5/3 8/3 表 4 主成分分析结果
Table 4. Principal component analysis results
成分 初始特征值 提取载荷平方和 总计 方差百分比 累积/% 总计 方差百分比 累积/% 庚醛 3.665 61.091 61.091 3.665 61.091 61.091 壬醛 1.410 23.505 84.596 1.410 23.505 84.596 癸醛 0.643 10.722 95.317 0.643 10.722 95.317 2,4-庚二烯醛 0.160 2.675 97.992 2,4-癸二烯醛 0.104 1.733 99.725 表 5 典型贡献嗅味物质与相关藻类的皮尔逊相关系数
Table 5. Pearson correlation coefficients of typical odor contributing substance with related algae
藻类 皮尔逊相关系数r 庚醛 壬醛 星杆藻属 0.957 — 小环藻属 0.928 — 实球藻属 — 0.709 衣藻属 — 0.65 -
[1] BAI X Z. Occurrence and distribution of taste and odor compounds in subtropical water supply reservoirs and their fates in water treatment plants[J]. Environmental Science and Pollution Research, 2016, 24(10): 2904-2913. [2] CHEN Y Z, ZHU J R. Observation and simulation of 2-methylisoborneol in the Qingcaosha Reservoir, Changjiang estuary[J]. Journal of Oceanology and Limnology, 2018, 36(5): 1586-1596. doi: 10.1007/s00343-018-7124-7 [3] LU J P, SU M, SU Y L, et al. Driving forces for the growth of MIB-producing Planktothricoides raciborskii in a low-latitude reservoir[J]. Water Research, 2022, 220: 118670. doi: 10.1016/j.watres.2022.118670 [4] MING S, JAN W Y, JUN Z Z, et al. MIB-producing cyanobacteria ( Planktothrix sp. ) in a drinking water reservoir: Distribution and odor producing potential[J]. Water Research, 2015, 68: 444-453. doi: 10.1016/j.watres.2014.09.038 [5] LIN T F, WONG J Y, KAO H P. Correlation of musty odor and 2-MIB in two drinking water treatment plants in south Taiwan[J]. Science of the Total Environment, 2002, 289(1/2/3): 225-235. [6] LIU H B. Occurrence and emergency response of 2-Methylisoborneol and Geosmin in a large shallow drinking water reservoir[J]. Clean-Soil Air Water, 2016, 44: 63-71. doi: 10.1002/clen.201500077 [7] Watson S B. Aquatic taste and odor: A primary signal of drinking-water integrity[J]. Journal of Toxicology and Environmental Health-Part A-Current Issues, 2004, 67(20/21/22): 1779-1795. [8] HOEFEL D, HO L, AUNKOFER W, et al. Cooperative biodegradation of geosmin by a consortium comprising three gram-negative bacteria isolated from the biofifilm of a sand fifilter column[J]. Letters in Applied Microbiology, 2006, 43(4): 417-423. doi: 10.1111/j.1472-765X.2006.01974.x [9] SU M, ZHU Y P, JIA Z Y, et al. Identification of MIB producers and odor risk assessment using routine data: A case study of an estuary drinking water reservoir[J]. Water Research, 2021, 192: 116848. doi: 10.1016/j.watres.2021.116848 [10] KALOUDIS T, TRIANTIS T M, HISKIA A. Taste and odour compounds produced by Cyanobacteria[M]. Handbook of Cyanobacterial Monitoring and Cyanotoxin Analysis. 2017 [11] DEVI A, CHIU Y T, HSUEH H T, et al. Quantitative PCR based detection system for cyanobacterial geosmin/2-methylisoborneol (2-MIB) events in drinking water sources: Current status and challenges[J]. Water research, 2021: 188. [12] FINK P, VON E E, JUTTNER F. Volatile foraging kairomones in the littoral zone: Attraction of an herbivorous freshwater gastropod to algal odors[J]. Journal of Chemical Ecology, 2006, 32(9): 1867-1881. doi: 10.1007/s10886-006-9115-y [13] ZAITLIN B, WATSON S B. Actinomycetes in relation to taste and odour in drinking water: Myths, tenets and truths[J]. Water Research, 2006, 40(9): 1741-1753. doi: 10.1016/j.watres.2006.02.024 [14] LI Z L, YU J W, YANG M, et al. Cyanobacterial population and harmful metabolites dynamics during a bloom in Yanghe Reservoir[J]. North China. Harmful Algae, 2010, 9(5): 481-488. doi: 10.1016/j.hal.2010.03.003 [15] MING S, MD S, YI P Z, et al. Ecological niche and in-situ control of MIB producers in source water[J]. Journal of Environmental Sciences, 2021, 110: 119-128. doi: 10.1016/j.jes.2021.03.026 [16] WESTERHOFF P, RODRIGUEZ-HERNANDEZ M, BAKER L, et al. Seasonal occurrence and degradation of 2-methylisoborneol in water supply reservoirs[J]. Water Research, 2005, 39(20): 4899-4912. doi: 10.1016/j.watres.2005.06.038 [17] UWINS H K, TEASDALE P, STRATTON H. A case study investigating the occurrence of geosmin and 2-methylisoborneol in the surface waters of the Hinze Dam, Gold Coast, Australia[J]. Water Science and Technology, 2007, 55(5): 231-238. doi: 10.2166/wst.2007.184 [18] CHEN J, XIE P, MA Z M, et al. A systematic study on spatial and seasonal patterns of eight taste and odor compounds with relation to various biotic and abiotic parameters in Gonghu Bay of Lake Taihu, China[J]. Science of the Total Environment, 2010, 409(2): 314-325. doi: 10.1016/j.scitotenv.2010.10.010 [19] NAUMENKO Y V. Chrysophytes of the middle stream of the Ob River[J]. Sibirskii Biologicheskii Zhurnal, 1992(5): 76-81. [20] WATSON S B, SATCHWILL T, DIXON E. Underice blooms and source-water odour in a nutrient-poor reservoir: biological, ecological and applied perspectives[J]. Freshwater Biology, 2001, 46(11): 1553-1567. doi: 10.1046/j.1365-2427.2001.00769.x [21] LI X. Source-water odor during winter in the Yellow River area of China: Occurrence and diagnosis[J]. Environmental pollution, 2016, 218: 252-258. doi: 10.1016/j.envpol.2016.06.069 [22] ZHAO, YUN Y. A fishy odor episode in a north China reservoir: occurrence, origin, and possible odor causing compounds[J]. Journal of environmental sciences, 2013, 25(12): 2361-2366. doi: 10.1016/S1001-0742(12)60317-9 [23] BRUTEMARK A, GRANELI E. Role of mixotrophy and light for growth and survival of the toxic haptophyte Prymnesium parvum[J]. Harmful Algae, 2011, 10(4): 388-394. doi: 10.1016/j.hal.2011.01.005 [24] GRADINGER R. Occurrence of an algal bloom under Arctic pack ice[J]. Marine Ecology-Progress Series, 1996, 131(1-3): 301-305. [25] WENDEL T, JTTNER F. Lipoxygenase-mediated formation of hydrocarbons and unsaturated aldehydes in freshwater diatoms[J]. Phytochemistry, 1996, 41(6): 1445-1449. doi: 10.1016/0031-9422(95)00828-4 [26] WATSON S B, SATCHWILL T, MCCAULEY E. Drinking water taste and odour: A chrysophyte perspective[J]. Nova Hedwigia Beiheft, 2001, 122: 119-146. [27] WATSON S B, SATCHWILL T. Chrysophyte odour production: resource-mediated changes at the cell and population levels[J]. Phycologia, 2003, 42(4): 393-405. doi: 10.2216/i0031-8884-42-4-393.1 [28] Sun D L. Occurrence of odor problems in drinking water of major cities across china[J]. Frontiers of Environmental Science & Engineering, 2013, 25(3): 411-416. [29] VENKATESHWARLU G, LET M B, MEYER A S. Chemical and olfactometric characterization of volatile flflavor compounds in a fifish oil enriched milk emulsion[J]. Journal of Agricultural and Food Chemistry, 2004, 52(2): 311-317. doi: 10.1021/jf034833v [30] LIN T F, WONG J Y, KAO H P. Correlation of musty odor and 2-MIB in two drinking water treatment plants in South Taiwan[J]. Science of the Total Environment, 2001, 289(1/2/3): 225-235. [31] Standard Methods for the Examination of Water and Wastewater (21st ed) [S]. Washington DC, USA. [32] 施烨闻. 饮用水中主要异嗅物质仪器检测和感官分析法建立和应用[D]. 上海: 复旦大学, 2011. [33] 罗妮娜. 饮用水异臭异味来源及检测方法研究[J]. 资源节约与环保, 2013(10): 156-157. doi: 10.3969/j.issn.1673-2251.2013.10.124 [34] 徐旭冉. 太湖水源地水体异味检测及预警系统研究[D]. 南京: 南京理工大学, 2010. [35] 杨旭. 水中土霉味化合物的鉴定与去除研究[D]. 南京: 南京理工大学, 2008. [36] 荣超. 深圳水源水中土霉味物质来源识别与检测分析[D]. 哈尔滨: 哈尔滨工业大学, 2017. [37] SUFFRT I H, KHIARI D, BRUCHET A. The drinking water taste and odor wheel for the millennium: Beyond geosmin and 2-methylisoborneol[J]. Water Science and Technology, 1999, 40(6): 1-13. doi: 10.2166/wst.1999.0248 [38] SATCHWILL T, WATSON S B, DIXON E. Odourous algal-derived alkenes: difffferences in stability and treatment responses in drinking water[J]. Water Science and Technology, 2007, 55(5): 95-102. doi: 10.2166/wst.2007.167 [39] 马杰, 崔勇, 石矛, 等. 一起自来水异味事件调查[J]. 环境与健康杂志, 2017, 34(10): 906-907. doi: 10.16241/j.cnki.1001-5914.2017.10.018 [40] 周洋, 代嫣然, 钟非, 等. 合肥塘西河异味物质及异味影响因子研究[J]. 湖泊科学, 2016, 28(02): 312-318. doi: 10.18307/2016.0210 [41] HU H J, WEI Y X. The Freshwater Algae of China Systematics, Taxonomy and Ecology[J]. Science Press, Beijing. 2006, 423-425. [42] NICHOLLS K H. Three new freshwater species of Dinobryon(Chrysophyceae)[J]. Phycologia, 2000, 39(2): 134-138. doi: 10.2216/i0031-8884-39-2-134.1 [43] FRANKE W W, HERTH W. Cell and lorica fifine-structure of the chrysomonad alga, Dinobryon sertularia Ehr(Chrysophyceae)[J]. Archiv Fr Mikrobiologie, 1973, 91(4): 323-344. doi: 10.1007/BF00425052 [44] PARINET J, RODRIGUZE M J, SRODES J. Influence of water quality on the presence of off-flavour compounds (geosmin and 2-methylisoborneol)[J]. Water Research, 2010, 44(20): 5847-5856. doi: 10.1016/j.watres.2010.06.070 [45] 刘玉金. 基于主成分分析与多元线性回归分析的灌溉水利用效率影响因素分析[D]. 呼和浩特: 内蒙古农业大学, 2014. [46] 赵倩. 雾霾现象的主成分分析及治理的演化博弈模型[D]. 兰州: 西北师范大学, 2015. [47] 高爽. 主成分分析-BP神经网络法在漳河水质评价中的联合应用[D]. 邯郸: 河北工程大学, 2018. [48] SATPATHY, KAMALA K, KVK N. Occurrence of phytoplankton bloom and its effect on coastal water quality[J]. Indian Journal of Marine Sciences, 1996, 25: 145-147. [49] SUGISAWA H. , NAKAMURA K, TAMURA H. The Aroma profile of the volatiles in marine green algae(Ulvapertusa)[J]. Food Reviews International, 1990, 6: 573-589. doi: 10.1080/87559129009540893 [50] VIJVER, BART V D, STEYEN D. Cyclotella deceusteriana, a new centric diatom species (Bacillariophyta) from the sub-Antarctic Region[J]. Phytotaxa, 2018: 108-116. [51] 李能能, 吴福雨, 李霞, 等. 水洞沟水库冬季水质嗅味及产嗅藻类分析[J]. 广东化工, 2019, 46(1): 57-60. doi: 10.3969/j.issn.1007-1865.2019.01.029 [52] 傅金祥, 刘梦阳, 由昆. 基于层次分析法的敏感水源识别方法[J]. 沈阳建筑大学学报自然科学版, 2017, 33(3): 9. [53] 刘亚臣, 常春光, 刘宁, 等. 基于层次分析法的城镇化水平模糊综合评价[J]. 沈阳建筑大学学报自然科学版, 2008, 24(1): 132-136. [54] 张敏江, 张文博, 于保阳. 基于层次分析法的沥青路面冷再生技术后评价指标权重分析[J]. 沈阳建筑大学学报自然科学版, 2012, 28(4): 6. -




 下载:
下载: