-
骆马湖地处江苏省北部,作为徐州市和宿迁市的重要水源地,以及我国南水北调东线工程的重要调节水库,其水质状况对人体健康和环境生态安全具有重要意义。
作为典型持久性有机污染物,多环芳烃(PAHs)具有较强的致癌、致畸、致突变等毒性[1],严重影响人体健康和生态安全。美国环境保护局(US EPA)对此高度重视,已将毒性较强的16种PAHs列在优先控制污染物[2-3]名单中。我国在发展过程中也紧跟国际社会发展需要,并结合我国实际环境污染状况,也已将7种PAHs列在我国水中优先控制污染物名单中[4]。环境中的PAHs主要来自石油等不完全燃烧、泄露、精炼及加工[5]。研究表明,我国多个地表水已被PAHs污染[6-9],且污染水平相对较高[9-11]。随着我国能源消耗的飞速增加,PAHs污染已成为我国面临的最严重环境问题之一[12]。作为京杭运河的一部分,骆马湖担负着江苏省南北航运的交通重任。船舶石油泄漏,以及骆马湖流域农业生物质的燃烧、车船尾气排放等均可对水质产生不良影响,威胁骆马湖供水和灌溉功能。然而,关于骆马湖及其入湖河流水中PAHs的时空分布特征与风险评估的报道较少。开展骆马湖流域水中PAHs的污染水平、分布及风险状况研究,对保障骆马湖水源地和饮用水安全具有重要意义。
-
骆马湖位于江苏省北部,横跨宿迁、徐州两市,长约27 km,最大宽度约20 km,湖水面积为296 km2。充分考虑上游来水、入湖河流和骆马湖不同功能区,43个采样点覆盖水源地、国考断面、省考断面、入湖河流、入湖河流支流汇入口和骆马湖出口,采样点位布设见图1。
-
分别于2019年11月5~7日(枯水期)、2020年4月24~26日(平水期)和2020年7月15~16日(丰水期)采集骆马湖流域监测点位的水样,样品运输至实验室后尽快处理。
参照《气相色谱/质谱联用法测定 半挥发性有机物》 (US EPA 8270E)[13]进行水样前处理,主要过程如下:1 L水样放置于2 L分液漏斗中,加入60 g的氯化钠完全溶解后,加入60 mL二氯甲烷,振荡10 min进行液液萃取,静置后收集有机相。萃取2次后,有机相经无水硫酸钠除水,氮吹至1.0 mL以下,加入内标,定容至1.0 mL后,待测。
-
运用气相色谱-质谱联用仪(Thermo, GC Trace 1300/MS ISQ7000)对16种优控的PAHs进行分析,包括萘(Nap)、苊烯(Acy)、二氢苊(Ace)、芴(Flu)、蒽(Ant)、菲(Phe)、荧蒽(Fla)、芘(Pyr)、苯并[a] 蒽(BaA)、䓛(Chr)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、二苯并[a, h]蒽 (DbA)、茚并[1, 2, 3-cd]芘(IcdP)和苯并[g,h,i]苝(BghiP)。
GC-MS色谱柱为DB-5MS石英毛细柱(30 m×250 μm×0.25 μm);进样口温度280 ℃,不分流进样;载气氦气流量1.0 mL/min;程序升温:
80℃20℃/min→180℃(5min)10℃/min→290℃(10min) ;EI源,离子源电子能量70 eV,温度300 ℃,传输线温度290 ℃。根据目标化合物的色谱峰保留时间、碎片离子质荷比及其丰度进行定性,根据峰面积采用内标法定量。方法检出限范围为1.2~4.8 ng/L。样品回收率在60.8%~106%范围,平行样中目标化合物相对偏差<10%,全程序空白中未检出目标化合物,满足相关质控要求。 -
采用US EPA评价模型对骆马湖湖区水中PAHs进行健康风险评价。PAHs的日均暴露量分别计算经饮用水途径摄入量(ADIing, μg/(kg·d))和经皮肤接触水体途径摄入的量(ADIderm, μg/(kg·d)),见式(1)和(2):
式中,cw为水中PAHs的实测浓度,μg/L;IR为成人每日饮用水摄入量,1.9 L/d[14];EF为暴露频率,365 d/a [14];ED为暴露期,70 a [14];BW为人体体重,62 kg [14];AT为暴露时间,25 550 d[14];
式中:cw为水中PAHs的实测浓度,μg/L;KP为PAHs在皮肤中的渗透系数,cm/h;SA和ET分别为皮肤接触表面积,16 000 cm2 [14]和接触时间,
1060 h/d [14];EF为暴露频,365 d/a [14];ED为暴露期限,70 a [14] ;CF为单位转换因子,1×10−3 L/cm3 [14];BW为人体体重,62 kg [14] ;AT为暴露时间,25 550 d[14]。PAHs单体的致癌风险指数Ri、非致癌风险指数HQi,以及总PAHs致癌风险RT和总非致癌指数HI的计算公式,见式(3~6):
式中:ADIij为PAHi单体在第j种暴露途径的日均暴露量,μg/(kg·d);SFij为PAHi单体在第j种暴露途径的致癌物斜率因子,(kg·d)/mg;RfDij为PAHi单体在第j种暴露途径的非致癌参考剂量,mg/(kg·d)。Ri或RT在1×10−4时为最大可接受风险水平,≤10−6时表明致癌风险可忽略;HQi或HI>1表示水中PAHs存在潜在非致癌风险,<1时表示其非致癌风险可忽略[15]。
-
本研究采用风险商值(RQ)评估骆马湖及其入湖河流水中PAHs对水生生物的潜在生态风险[15-16],计算见式(7~9):
式中:cPAHs为水中多环芳烃的实测浓度,ng/L;cQV为风险标准值,ng/L;cQV(NCs)和cQV(MPCs)分别为PAHs的最低和最高风险标准值[16],ng/L(表1);RQNCs为最低生态风险商值,RQNCs<1时,表示生态风险极低,RQNCs≥1时,表示具有中等生态风险;RQMPCs为最高生态风险商值,RQMPCs<1为具有中等生态风险,RQMPCs≥1表示具有高生态风险[17];RQΣPAHs为16种PAHs的RQ之和,其风险评见表2。具有RQNCs和RQMPCs的10种PAHs可直接进行生态风险评价,其余6种PAHs(Ace、Acy、Fla、Pyr、BbF和 DbA)需采用毒性等效因子推出其RQNCs和RQMPCs后再进行评估[17]。
部分PAHs的皮肤渗透系数、致癌斜率因子(SF)、非致癌参考计量(RfD)、最低风险标准值(cQV(NCs))和最高风险标准值(cQV(MPCs)),见表1。
-
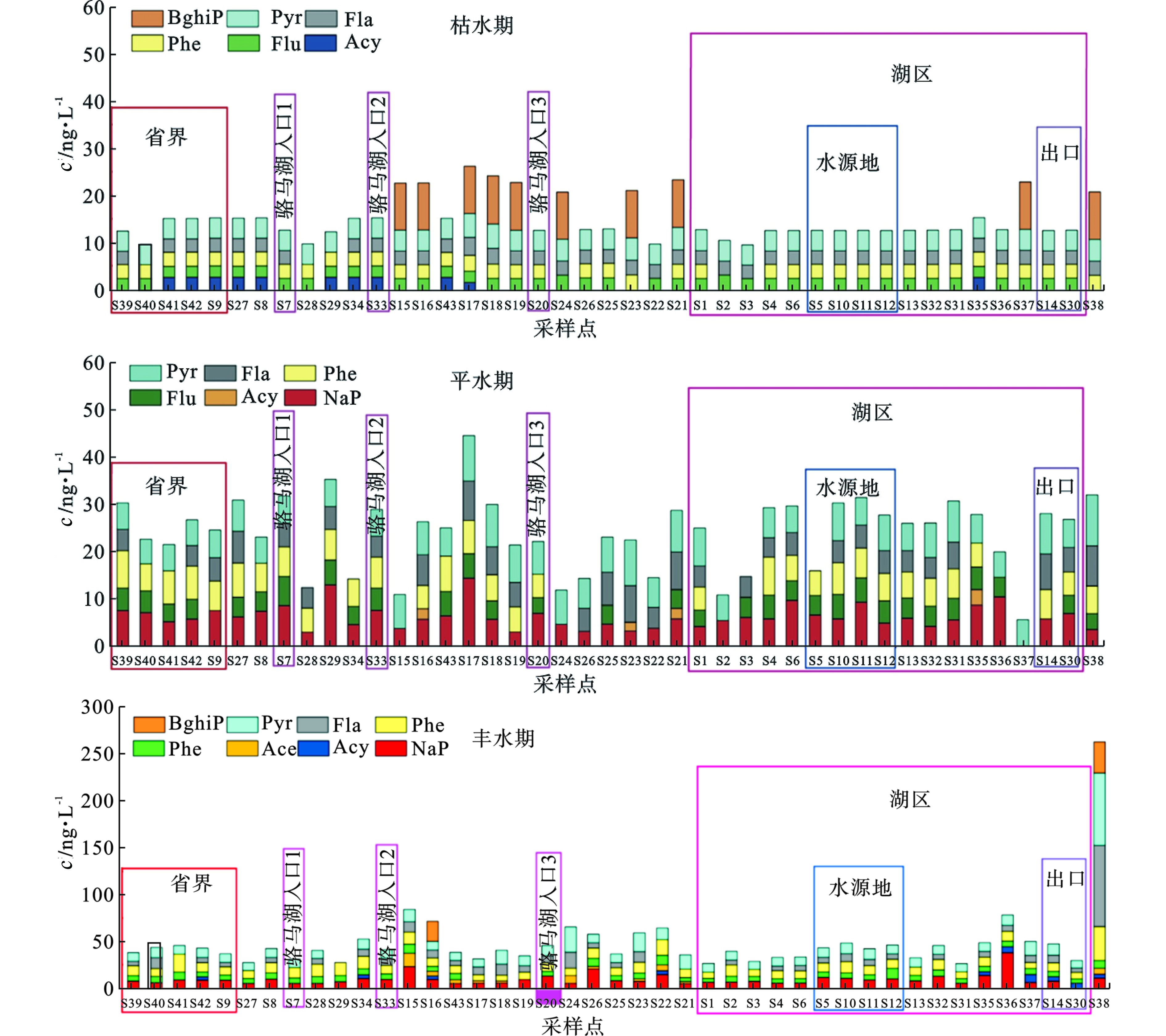
骆马湖及入湖河流水中PAHs含量,见图2。
8种PAHs检出率较高,2019年11月、2020年4月和2020年7月水中PAHs总量分别在9.45~26.1、5.45~44.3和26.3~264 ng/L。图2可知,骆马湖流域水中污染水平随时间而波动,丰水期∑PAHs的含量较高,枯水期较低。这可能因为丰水期大量的外来径流输入和大气沉降增加了PAHs的输入量[18]。此外,丰水期的风浪潮流作用等可能造成沉积物的再悬浮,再悬浮沉积物中PAHs的解析释放也可能造成水中PAHs浓度水平的增加[19]。骆马湖及入湖河流水中低环PAHs(2~3环)浓度明显高于高环PAHs(4~6环),这可能是由于PAHs在水中的溶解度随着其环数的增加而减少的原因。
骆马湖湖区水中∑PAHs含量分别为10.4~22.8 ng/L(枯水期)、10.7~31.3 ng/L(平水期)、26.3~78.2 ng/L(丰水期)。骆马湖中4个水源地点位水中PAHs含量相对较低,浓度范围在12.5~48.2 ng/L。骆马湖4个水源地、2个国考断面、1个省考断面和5个省界采样点位水中PAHs浓度均未超出我国地表水环境质量标准[20]、美国国家水质标准[21]和加拿大环境质量准则[22]中PAHs的浓度限值。骆马湖水源地水中PAHs污染水平低于京津冀(15.49~212.69 ng/L)[23]、广州(86.15~177.35 ng/L)[24]、太湖(63.5~393.9 ng /L)[25]、松花江(100 ng/L)[26]和南京(234.96 ng/L)[27]等水源地。
骆马湖及入湖河流水中ΣPAHs含量较高的点位主要位于京杭运河河道S17~S24点位。该河道S17~S24点位位于徐州市工业较密集的区域,该地区含有较高浓度PAHs的大气颗粒物和土壤可能通过干湿沉降和雨水径流等途径汇入该河道,导致S17~S24点位水中PAHs浓度较高。此外,该河道船只来往频繁,其含油废水和石油泄漏也可能造成水中PAHs含量较高。此外,宿迁船闸(S38)作为京杭运河苏北段10座大型船闸的第四梯级,承担着“北煤南运”、成品油和矿建等重点物资的运输任务,常年有苏、鲁、豫、皖、沪和浙等10多个省(市)船舶通行,航运交通繁忙可能导致该点位ΣPAHs浓度较高。
研究表明,相同分子量的PAHs环境行为相似,其挥发性、吸附性和溶解性等差异性较小,因此,相同分子量PAHs之间的浓度比值常用来推测PAHs的来源[28]。本研究采用Flu/(Flu+Pyr)的比值分析骆马湖及入湖河流水中PAHs的来源。通常情况下,Flu/(Flu+Pyr)值﹤0.4表明主要来自石油类排放,介于0.4~0.5之间表明主要来自石油和石化产品类燃烧,>0.5表明主要来自生物质、煤等燃烧[28]。京杭运河(中运河)点位及S38的Flu/(Flu+Pyr)值均﹤0.4,表明上述点位的PAHs主要来自石油排放,该地区航运交通过程中石油类燃料的泄漏可能是其主要原因。
-
健康风险评价主要考虑饮水及皮肤接触途径导致的健康风险,所以仅对湖区的点位进行评价。骆马湖湖区水体中PAHs在枯水期经饮用水摄入途径及皮肤接触途径的非致癌风险值分别为8.34×10−6~2.19×10−5、1.89×10−13~6.35×10−13;平水期分别为5.57×10−6~3.40×10−5、1.00×10−13~6.93×10−13;丰水期分别为2.50×10−5~2.45×10−4、5.14×10−13~6.28×10−12,丰水期非致癌风险高于枯水期和平水期,经饮用水摄入产生的非致癌风险对总非致癌风险贡献较大。骆马湖湖区3个水期水中PAHs产生的HQ和HI均<1,表明其非致癌风险可忽略。
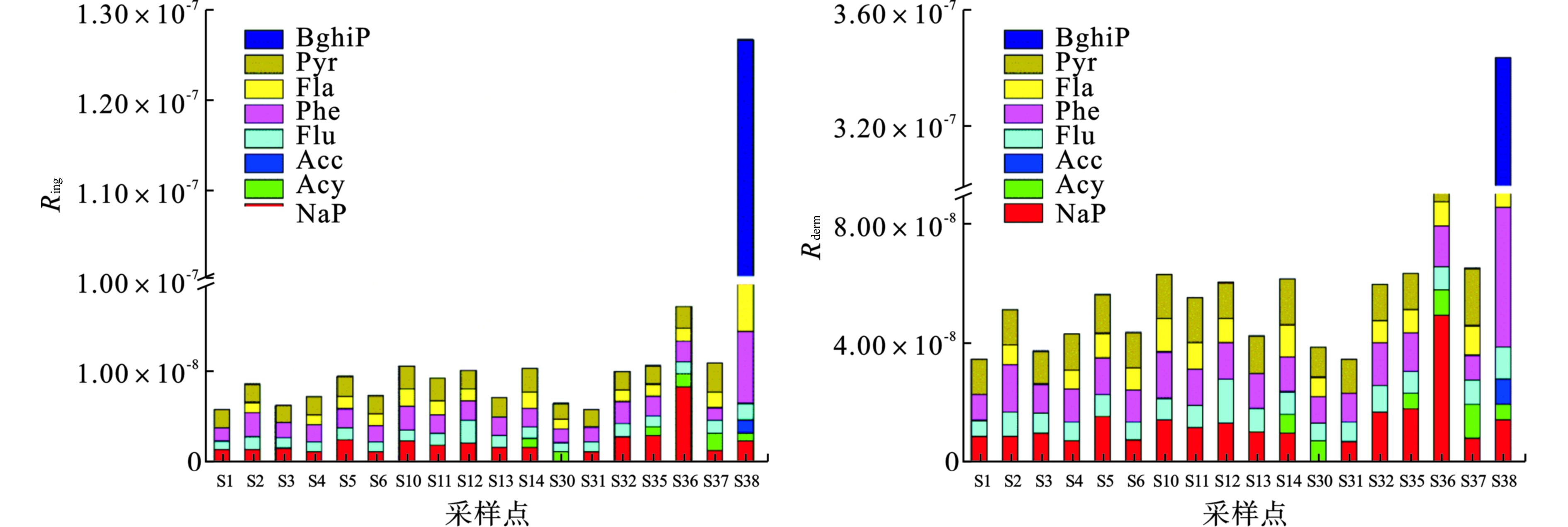
湖区水体中PAHs在枯水期经饮用水摄入途径及皮肤接触途径的致癌风险值分别2.11×10−9~2.54×10−8、1.23×10−8~2.97×10−8;平水期分别为1.92×10−9~7.11×10−9、7.08×10−9~4.13×10−8;丰水期分别为5.88×10−9~1.27×10−7、3.42×10−8~3.43×10−7。丰水期骆马湖湖区水中PAHs经饮用水摄入及皮肤接触所导致的致癌风险值,见图3。与非致癌相似,丰水期致癌风险高于枯水期和平水期,但皮肤接触暴露途径对总致癌风险贡献率大。骆马湖湖区水中的总致癌风险低于可忽略风险水平。丰水期S38水中PAHs浓度最高,其所致的致癌风险最高。由丰水期S38水体中BghiP经口摄入和Fla、Pyr经皮肤接触途径所贡献较大,其中BghiP对经饮用水摄入途径致癌风险贡献率为59.3%,Fla和Pyr对经皮肤接触途径致癌风险贡献率分别33.0%和29.3%,见表3。如前所述,S38位于宿迁船闸,航运繁忙,导致该点位水中致癌风险对其他点位较高。
研究期间,骆马湖湖区水中单一及总致癌风险、非致癌风险均低于可忽略风险值,但在丰水期S38水中PAHs致癌风险相对较高,为保护骆马湖水资源安全,应长期关注该点位PAHs的污染水平变化。
-
根据表1、表2及PAHs的监测结果,2019年11月,骆马湖入湖河流水体中PAHs的RQMPCs值<1,检出的Fla、Pyr和Acy的RQNCs值>1,S2、S17、S18、S23、S25~S27、S35、S36、S41检出的Phe的RQNCs值>1,表明骆马湖流域水中Fla、Pyr、Acy和Phe具有中等风险。2020年4月,PAHs的RQMPCs值<1,Flu、Pyr、Acy和Phe的RQNCs值>1,为中等风险。
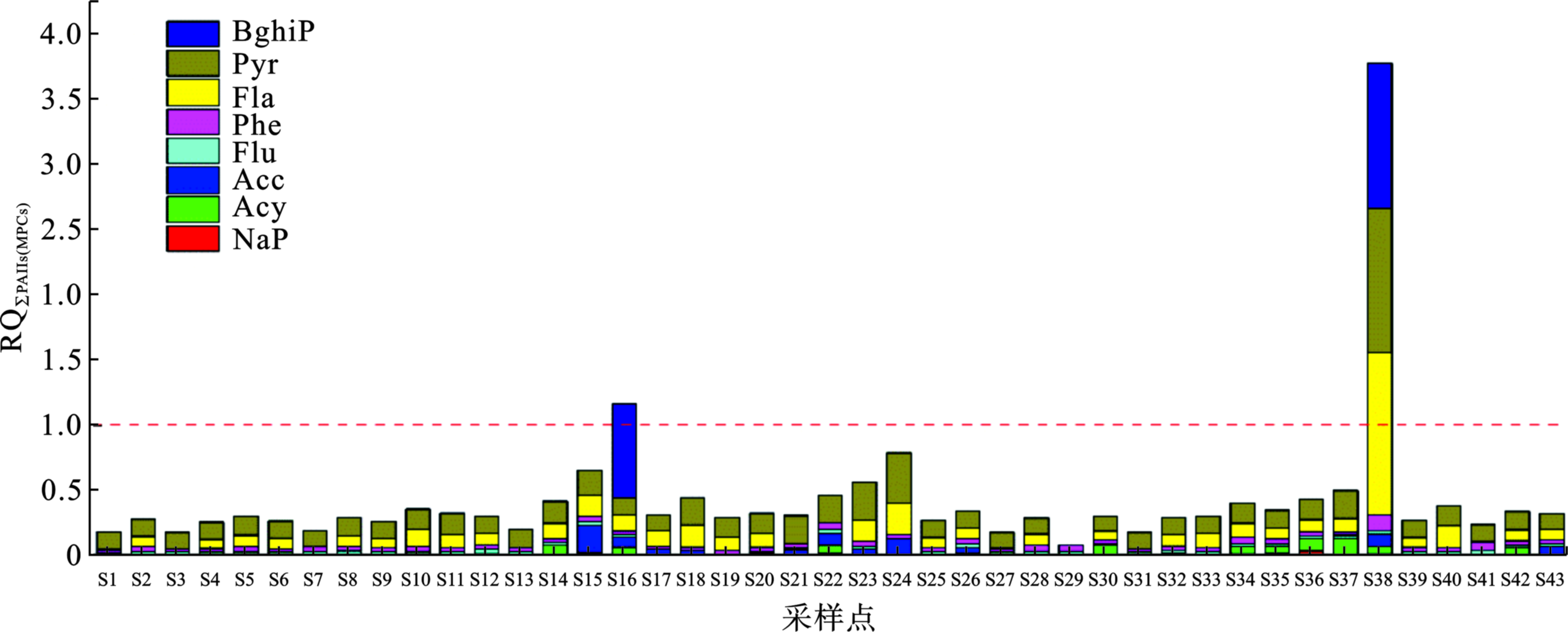
2020年7月S38水中Fla、Pyr和BghiP的RQMPCs值>1,表明S38的Fla、Pyr和BghiP为高风险,其他点位的RQMPCs值<1,Flu、Pyr、Acy、Phe、Ace及S15、S20、S22、S26、S32、S35、S36的NaP,其RQNCs值>1,表明具有中等风险。RQ∑PAHs(NCs)和RQ∑PAHs(MPCs)分析表明,2020年7月,S16和S38水中RQ∑PAHs(MPCs)≥1,见图4,RQ∑PAHs(NCs)<800,表明该2个点位水中PAHs可能对水生生物造成中等生态风险,应当重点关注。
S16水中BghiP对该点位的RQ∑PAHs(MPCs)贡献最大(62.2%),S38水中Fla、BghiP和Pyr对该点位的RQ∑PAHs(MPCs)贡献大,分别为33.0%、29.6%和29.3%;BghiP、Pyr、Fla、Phe和Flu对生态风险RQ∑PAHs(NCs)贡献也较大,见表3。骆马湖流域水中RQ∑PAHs( MPCs)和RQ∑PAHs(NCs)总体呈丰水期>平水期>枯水期,与PAHs的浓度变化规律一致。
-
(1)骆马湖及其入湖河流枯水期、平水期和丰水期水中PAHs总量分别在9.45~26.1 、5.45~44.3和26.3~264 ng/L。ΣPAHs含量较高的点位主要位于京杭运河河道等航运繁忙的区域。骆马湖流域内的4个水源地、2个国考断面、1个省考断面和5个省界采样点位水中PAHs质量浓度均低于相应的水质标准限值。
(2)骆马湖湖区水中PAHs的致癌风险和非致癌风险可忽略,经饮用水暴露途径对非致癌风险贡献率较大,经皮肤接触暴露途径对致癌风险贡献率较大。
(3)骆马湖及入湖河流S16和S38水体中ΣPAHs在丰水期可能对水生生物造成中等生态风险,其中S38水中Fla、BghiP和Pyr为高风险PAHs单体。
(4)骆马湖流域中宿迁闸(S38)航运繁忙,其水体中ΣPAHs含量较高,致癌风险相对较大,生态风险较高,需对该点位给予重点关注。
骆马湖及其入湖河流水中PAHs时空分布特征及风险评估
Spatiotemporal distribution characteristics and risk assessment of PAHs in Luoma Lake and its inflow river
-
摘要: 为研究骆马湖及其入湖河流水中PAHs的时空分布特征、健康风险及生态风险状况,分别于2019年11月(枯水期)、2020年4月(平水期)和2020年7月(丰水期)对骆马湖及其入湖河流水样中16种多环芳烃(PAHs)进行了采样调查研究,并采用健康风险评价和生态风险评价方法对骆马湖流域水中PAHs进行风险评估。结果表明,骆马湖及其入湖河流水中PAHs总量在5.45~264 ng/L范围,ΣPAHs浓度丰水期>平水期>枯水期,低环PAHs平均质量浓度明显高于高环PAHs。ΣPAHs含量较高的点位主要位于京杭运河河道等航运繁忙的区域,来源分析结果表明,该区域PAHs可能主要来自水上交通过程中石油制品的泄漏。骆马湖流域内的4个水源地、2个国考断面、1个省考断面和5个省界点位水中PAHs浓度均符合相应的水质标准。骆马湖湖区水中PAHs经饮水途径和经皮肤接触途径所引起的致癌风险和非致癌风险均可忽略,但在丰水期S16和S38水中PAHs可能造成中等生态风险,其中荧蒽(Fla)、苯并[g, h, i]苝(BghiP)和芘(Pyr)具有较高生态风险。Abstract: The spatiotemporal distribution characteristics, health risk and ecological risk of polycyclic aromatic hydrocarbons (PAHs) in water of Luoma Lake and its main inflow rivers were investigated in November 2019 (dry season), April 2020 (normal season) and July 2020 (wet season). 16 types of PAHs were sampled and the risk was assessed by the health risk and the ecological risk assessment methods. The result showed that the total PAHs concentrations in Luoma Lake Basin ranged from 5.45 ng/L to 264 ng/L for different seasons with the order of wet season> normal season> dry season. The concentration of the low ring PAHs was significantly higher than these of the high ring. The ΣPAHs concentration in the busy shipping areas, such as Beijing Hangzhou canal was higher than other studied areas. The source analysis showed that the PAHs in the above mentioned area mainly came from the leakage of petroleum products in the process of water transportation. The concentrations of PAHs in four water sources, two national and one provincial sections and five provincial boundary sampling points in Luoma Lake basin all met the corresponding water quality standards. The health risk of PAHs in Luoma Lake area through drinking water and skin contact could be ignored. However, PAHs in water of S16 and S38 in wet season belonged to a high ecological risk level, and fluoranthene (Fla), benzo [g, h, i] perylene (BghiP) and pyrene (Pyr) were high risk PAHs, which contributed to the higer ecological risk.
-
Key words:
- Luoma Lake /
- inflow river /
- PAHs /
- spatiotemporal distribution characteristics /
- health risk /
- ecological risk
-
骆马湖地处江苏省北部,作为徐州市和宿迁市的重要水源地,以及我国南水北调东线工程的重要调节水库,其水质状况对人体健康和环境生态安全具有重要意义。
作为典型持久性有机污染物,多环芳烃(PAHs)具有较强的致癌、致畸、致突变等毒性[1],严重影响人体健康和生态安全。美国环境保护局(US EPA)对此高度重视,已将毒性较强的16种PAHs列在优先控制污染物[2-3]名单中。我国在发展过程中也紧跟国际社会发展需要,并结合我国实际环境污染状况,也已将7种PAHs列在我国水中优先控制污染物名单中[4]。环境中的PAHs主要来自石油等不完全燃烧、泄露、精炼及加工[5]。研究表明,我国多个地表水已被PAHs污染[6-9],且污染水平相对较高[9-11]。随着我国能源消耗的飞速增加,PAHs污染已成为我国面临的最严重环境问题之一[12]。作为京杭运河的一部分,骆马湖担负着江苏省南北航运的交通重任。船舶石油泄漏,以及骆马湖流域农业生物质的燃烧、车船尾气排放等均可对水质产生不良影响,威胁骆马湖供水和灌溉功能。然而,关于骆马湖及其入湖河流水中PAHs的时空分布特征与风险评估的报道较少。开展骆马湖流域水中PAHs的污染水平、分布及风险状况研究,对保障骆马湖水源地和饮用水安全具有重要意义。
1. 材料与方法
1.1 研究区概况
骆马湖位于江苏省北部,横跨宿迁、徐州两市,长约27 km,最大宽度约20 km,湖水面积为296 km2。充分考虑上游来水、入湖河流和骆马湖不同功能区,43个采样点覆盖水源地、国考断面、省考断面、入湖河流、入湖河流支流汇入口和骆马湖出口,采样点位布设见图1。
1.2 样品采集与处理
分别于2019年11月5~7日(枯水期)、2020年4月24~26日(平水期)和2020年7月15~16日(丰水期)采集骆马湖流域监测点位的水样,样品运输至实验室后尽快处理。
参照《气相色谱/质谱联用法测定 半挥发性有机物》 (US EPA 8270E)[13]进行水样前处理,主要过程如下:1 L水样放置于2 L分液漏斗中,加入60 g的氯化钠完全溶解后,加入60 mL二氯甲烷,振荡10 min进行液液萃取,静置后收集有机相。萃取2次后,有机相经无水硫酸钠除水,氮吹至1.0 mL以下,加入内标,定容至1.0 mL后,待测。
1.3 样品分析
运用气相色谱-质谱联用仪(Thermo, GC Trace 1300/MS ISQ7000)对16种优控的PAHs进行分析,包括萘(Nap)、苊烯(Acy)、二氢苊(Ace)、芴(Flu)、蒽(Ant)、菲(Phe)、荧蒽(Fla)、芘(Pyr)、苯并[a] 蒽(BaA)、䓛(Chr)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、二苯并[a, h]蒽 (DbA)、茚并[1, 2, 3-cd]芘(IcdP)和苯并[g,h,i]苝(BghiP)。
GC-MS色谱柱为DB-5MS石英毛细柱(30 m×250 μm×0.25 μm);进样口温度280 ℃,不分流进样;载气氦气流量1.0 mL/min;程序升温:
80℃20℃/min→180℃(5min)10℃/min→290℃(10min) 1.4 风险评估
1.4.1 健康风险评价方法
采用US EPA评价模型对骆马湖湖区水中PAHs进行健康风险评价。PAHs的日均暴露量分别计算经饮用水途径摄入量(ADIing, μg/(kg·d))和经皮肤接触水体途径摄入的量(ADIderm, μg/(kg·d)),见式(1)和(2):
stringUtils.convertMath(!{formula.content}) (1) 式中,cw为水中PAHs的实测浓度,μg/L;IR为成人每日饮用水摄入量,1.9 L/d[14];EF为暴露频率,365 d/a [14];ED为暴露期,70 a [14];BW为人体体重,62 kg [14];AT为暴露时间,25 550 d[14];
stringUtils.convertMath(!{formula.content}) (2) 式中:cw为水中PAHs的实测浓度,μg/L;KP为PAHs在皮肤中的渗透系数,cm/h;SA和ET分别为皮肤接触表面积,16 000 cm2 [14]和接触时间,
1060 PAHs单体的致癌风险指数Ri、非致癌风险指数HQi,以及总PAHs致癌风险RT和总非致癌指数HI的计算公式,见式(3~6):
stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) stringUtils.convertMath(!{formula.content}) (6) 式中:ADIij为PAHi单体在第j种暴露途径的日均暴露量,μg/(kg·d);SFij为PAHi单体在第j种暴露途径的致癌物斜率因子,(kg·d)/mg;RfDij为PAHi单体在第j种暴露途径的非致癌参考剂量,mg/(kg·d)。Ri或RT在1×10−4时为最大可接受风险水平,≤10−6时表明致癌风险可忽略;HQi或HI>1表示水中PAHs存在潜在非致癌风险,<1时表示其非致癌风险可忽略[15]。
1.4.2 生态风险评价
本研究采用风险商值(RQ)评估骆马湖及其入湖河流水中PAHs对水生生物的潜在生态风险[15-16],计算见式(7~9):
stringUtils.convertMath(!{formula.content}) (7) stringUtils.convertMath(!{formula.content}) (8) stringUtils.convertMath(!{formula.content}) (9) 式中:cPAHs为水中多环芳烃的实测浓度,ng/L;cQV为风险标准值,ng/L;cQV(NCs)和cQV(MPCs)分别为PAHs的最低和最高风险标准值[16],ng/L(表1);RQNCs为最低生态风险商值,RQNCs<1时,表示生态风险极低,RQNCs≥1时,表示具有中等生态风险;RQMPCs为最高生态风险商值,RQMPCs<1为具有中等生态风险,RQMPCs≥1表示具有高生态风险[17];RQΣPAHs为16种PAHs的RQ之和,其风险评见表2。具有RQNCs和RQMPCs的10种PAHs可直接进行生态风险评价,其余6种PAHs(Ace、Acy、Fla、Pyr、BbF和 DbA)需采用毒性等效因子推出其RQNCs和RQMPCs后再进行评估[17]。
表 1 部分PAHs暴露浓度及风险计算参数物质 化合物质登记号(CAS) 皮肤渗透系数[17] SF/(kg·d) ·mg−1 RfD/mg·(kg·d)−1 c QV(NCs)/ng·L−1 cQV( MPCs)/ng·L−1 经口摄入 皮肤接触 经口摄入 皮肤接触 NaP 91-20-3 0.069 0.007 3 0.007 3 0.02 0.016 0 12.0 1 200 Acy 208-96-8 0.138 0.007 3 0.007 3 0.06 0.018 6 0.7 70 Ace 83-32-9 0.155 0.007 3 0.007 3 0.06 0.060 0 0.7 70 Flu 86-73-7 0.214 0.007 3 0.007 3 0.04 0.020 0 3.0 300 Phe 85-01-08 0.300 0.007 3 0.007 3 0.03 0.030 0 3.0 300 Fla 206-44-0 0.360 0.007 3 0.007 3 0.04 0.040 0 0.7 70 Pyr 129-00-0 0.510 0.007 3 0.007 3 0.03 0.040 0 0.7 70 BghiP 191-24-2 2.068 0.07 3 0.073 0 0.03 0.030 0 0.3 30 表 2 ∑PAHs的风险分级风险等级 RQ∑PAHs(NCs) RQ∑PAHs(MPCs) 极低风险 0~1 - 低风险 ≥1;<800 =0 中等风险 1 ≥800 =0 中等风险 2 <800 ≥1 高风险 ≥800 ≥1 部分PAHs的皮肤渗透系数、致癌斜率因子(SF)、非致癌参考计量(RfD)、最低风险标准值(cQV(NCs))和最高风险标准值(cQV(MPCs)),见表1。
2. 结果与讨论
2.1 PAHs污染水平及分布
骆马湖及入湖河流水中PAHs含量,见图2。
8种PAHs检出率较高,2019年11月、2020年4月和2020年7月水中PAHs总量分别在9.45~26.1、5.45~44.3和26.3~264 ng/L。图2可知,骆马湖流域水中污染水平随时间而波动,丰水期∑PAHs的含量较高,枯水期较低。这可能因为丰水期大量的外来径流输入和大气沉降增加了PAHs的输入量[18]。此外,丰水期的风浪潮流作用等可能造成沉积物的再悬浮,再悬浮沉积物中PAHs的解析释放也可能造成水中PAHs浓度水平的增加[19]。骆马湖及入湖河流水中低环PAHs(2~3环)浓度明显高于高环PAHs(4~6环),这可能是由于PAHs在水中的溶解度随着其环数的增加而减少的原因。
骆马湖湖区水中∑PAHs含量分别为10.4~22.8 ng/L(枯水期)、10.7~31.3 ng/L(平水期)、26.3~78.2 ng/L(丰水期)。骆马湖中4个水源地点位水中PAHs含量相对较低,浓度范围在12.5~48.2 ng/L。骆马湖4个水源地、2个国考断面、1个省考断面和5个省界采样点位水中PAHs浓度均未超出我国地表水环境质量标准[20]、美国国家水质标准[21]和加拿大环境质量准则[22]中PAHs的浓度限值。骆马湖水源地水中PAHs污染水平低于京津冀(15.49~212.69 ng/L)[23]、广州(86.15~177.35 ng/L)[24]、太湖(63.5~393.9 ng /L)[25]、松花江(100 ng/L)[26]和南京(234.96 ng/L)[27]等水源地。
骆马湖及入湖河流水中ΣPAHs含量较高的点位主要位于京杭运河河道S17~S24点位。该河道S17~S24点位位于徐州市工业较密集的区域,该地区含有较高浓度PAHs的大气颗粒物和土壤可能通过干湿沉降和雨水径流等途径汇入该河道,导致S17~S24点位水中PAHs浓度较高。此外,该河道船只来往频繁,其含油废水和石油泄漏也可能造成水中PAHs含量较高。此外,宿迁船闸(S38)作为京杭运河苏北段10座大型船闸的第四梯级,承担着“北煤南运”、成品油和矿建等重点物资的运输任务,常年有苏、鲁、豫、皖、沪和浙等10多个省(市)船舶通行,航运交通繁忙可能导致该点位ΣPAHs浓度较高。
研究表明,相同分子量的PAHs环境行为相似,其挥发性、吸附性和溶解性等差异性较小,因此,相同分子量PAHs之间的浓度比值常用来推测PAHs的来源[28]。本研究采用Flu/(Flu+Pyr)的比值分析骆马湖及入湖河流水中PAHs的来源。通常情况下,Flu/(Flu+Pyr)值﹤0.4表明主要来自石油类排放,介于0.4~0.5之间表明主要来自石油和石化产品类燃烧,>0.5表明主要来自生物质、煤等燃烧[28]。京杭运河(中运河)点位及S38的Flu/(Flu+Pyr)值均﹤0.4,表明上述点位的PAHs主要来自石油排放,该地区航运交通过程中石油类燃料的泄漏可能是其主要原因。
2.2 骆马湖流域水中PAHs风险评估
2.2.1 骆马湖湖区水中PAHs健康风险评估
健康风险评价主要考虑饮水及皮肤接触途径导致的健康风险,所以仅对湖区的点位进行评价。骆马湖湖区水体中PAHs在枯水期经饮用水摄入途径及皮肤接触途径的非致癌风险值分别为8.34×10−6~2.19×10−5、1.89×10−13~6.35×10−13;平水期分别为5.57×10−6~3.40×10−5、1.00×10−13~6.93×10−13;丰水期分别为2.50×10−5~2.45×10−4、5.14×10−13~6.28×10−12,丰水期非致癌风险高于枯水期和平水期,经饮用水摄入产生的非致癌风险对总非致癌风险贡献较大。骆马湖湖区3个水期水中PAHs产生的HQ和HI均<1,表明其非致癌风险可忽略。
湖区水体中PAHs在枯水期经饮用水摄入途径及皮肤接触途径的致癌风险值分别2.11×10−9~2.54×10−8、1.23×10−8~2.97×10−8;平水期分别为1.92×10−9~7.11×10−9、7.08×10−9~4.13×10−8;丰水期分别为5.88×10−9~1.27×10−7、3.42×10−8~3.43×10−7。丰水期骆马湖湖区水中PAHs经饮用水摄入及皮肤接触所导致的致癌风险值,见图3。与非致癌相似,丰水期致癌风险高于枯水期和平水期,但皮肤接触暴露途径对总致癌风险贡献率大。骆马湖湖区水中的总致癌风险低于可忽略风险水平。丰水期S38水中PAHs浓度最高,其所致的致癌风险最高。由丰水期S38水体中BghiP经口摄入和Fla、Pyr经皮肤接触途径所贡献较大,其中BghiP对经饮用水摄入途径致癌风险贡献率为59.3%,Fla和Pyr对经皮肤接触途径致癌风险贡献率分别33.0%和29.3%,见表3。如前所述,S38位于宿迁船闸,航运繁忙,导致该点位水中致癌风险对其他点位较高。
表 3 点位S38和S16PAHs单体对致癌风险值和RQMPCs的贡献% 物质 S38 S16 Ring Rderm RQ∑PAHs(MPCs) RQ∑PAHs(MPCs) NaP 1.9 4.0 0.2 0.6 Acy 0.7 1.5 1.5 4.6 Ace 1.2 2.5 2.5 6.5 Flu 1.5 3.1 0.7 1.5 Phe 6.4 13.8 3.2 2.5 Fla 15.4 33.0 33.0 10.8 Pyr 13.7 29.3 29.3 11.2 BghiP 59.3 12.7 29.6 62.2 研究期间,骆马湖湖区水中单一及总致癌风险、非致癌风险均低于可忽略风险值,但在丰水期S38水中PAHs致癌风险相对较高,为保护骆马湖水资源安全,应长期关注该点位PAHs的污染水平变化。
2.2.2 骆马湖流域水中多环芳烃生态风险评估
根据表1、表2及PAHs的监测结果,2019年11月,骆马湖入湖河流水体中PAHs的RQMPCs值<1,检出的Fla、Pyr和Acy的RQNCs值>1,S2、S17、S18、S23、S25~S27、S35、S36、S41检出的Phe的RQNCs值>1,表明骆马湖流域水中Fla、Pyr、Acy和Phe具有中等风险。2020年4月,PAHs的RQMPCs值<1,Flu、Pyr、Acy和Phe的RQNCs值>1,为中等风险。
2020年7月S38水中Fla、Pyr和BghiP的RQMPCs值>1,表明S38的Fla、Pyr和BghiP为高风险,其他点位的RQMPCs值<1,Flu、Pyr、Acy、Phe、Ace及S15、S20、S22、S26、S32、S35、S36的NaP,其RQNCs值>1,表明具有中等风险。RQ∑PAHs(NCs)和RQ∑PAHs(MPCs)分析表明,2020年7月,S16和S38水中RQ∑PAHs(MPCs)≥1,见图4,RQ∑PAHs(NCs)<800,表明该2个点位水中PAHs可能对水生生物造成中等生态风险,应当重点关注。
S16水中BghiP对该点位的RQ∑PAHs(MPCs)贡献最大(62.2%),S38水中Fla、BghiP和Pyr对该点位的RQ∑PAHs(MPCs)贡献大,分别为33.0%、29.6%和29.3%;BghiP、Pyr、Fla、Phe和Flu对生态风险RQ∑PAHs(NCs)贡献也较大,见表3。骆马湖流域水中RQ∑PAHs( MPCs)和RQ∑PAHs(NCs)总体呈丰水期>平水期>枯水期,与PAHs的浓度变化规律一致。
3. 结论
(1)骆马湖及其入湖河流枯水期、平水期和丰水期水中PAHs总量分别在9.45~26.1 、5.45~44.3和26.3~264 ng/L。ΣPAHs含量较高的点位主要位于京杭运河河道等航运繁忙的区域。骆马湖流域内的4个水源地、2个国考断面、1个省考断面和5个省界采样点位水中PAHs质量浓度均低于相应的水质标准限值。
(2)骆马湖湖区水中PAHs的致癌风险和非致癌风险可忽略,经饮用水暴露途径对非致癌风险贡献率较大,经皮肤接触暴露途径对致癌风险贡献率较大。
(3)骆马湖及入湖河流S16和S38水体中ΣPAHs在丰水期可能对水生生物造成中等生态风险,其中S38水中Fla、BghiP和Pyr为高风险PAHs单体。
(4)骆马湖流域中宿迁闸(S38)航运繁忙,其水体中ΣPAHs含量较高,致癌风险相对较大,生态风险较高,需对该点位给予重点关注。
-
表 1 部分PAHs暴露浓度及风险计算参数
物质 化合物质登记号(CAS) 皮肤渗透系数[17] SF/(kg·d) ·mg−1 RfD/mg·(kg·d)−1 c QV(NCs) /ng·L−1cQV( MPCs)/ng·L−1 经口摄入 皮肤接触 经口摄入 皮肤接触 NaP 91-20-3 0.069 0.007 3 0.007 3 0.02 0.016 0 12.0 1 200 Acy 208-96-8 0.138 0.007 3 0.007 3 0.06 0.018 6 0.7 70 Ace 83-32-9 0.155 0.007 3 0.007 3 0.06 0.060 0 0.7 70 Flu 86-73-7 0.214 0.007 3 0.007 3 0.04 0.020 0 3.0 300 Phe 85-01-08 0.300 0.007 3 0.007 3 0.03 0.030 0 3.0 300 Fla 206-44-0 0.360 0.007 3 0.007 3 0.04 0.040 0 0.7 70 Pyr 129-00-0 0.510 0.007 3 0.007 3 0.03 0.040 0 0.7 70 BghiP 191-24-2 2.068 0.07 3 0.073 0 0.03 0.030 0 0.3 30 表 2 ∑PAHs的风险分级
风险等级 RQ∑PAHs(NCs) RQ∑PAHs(MPCs) 极低风险 0~1 - 低风险 ≥1;<800 =0 中等风险 1 ≥800 =0 中等风险 2 <800 ≥1 高风险 ≥800 ≥1 表 3 点位S38和S16PAHs单体对致癌风险值和RQMPCs的贡献
% 物质 S38 S16 Ring Rderm RQ∑PAHs(MPCs) RQ∑PAHs(MPCs) NaP 1.9 4.0 0.2 0.6 Acy 0.7 1.5 1.5 4.6 Ace 1.2 2.5 2.5 6.5 Flu 1.5 3.1 0.7 1.5 Phe 6.4 13.8 3.2 2.5 Fla 15.4 33.0 33.0 10.8 Pyr 13.7 29.3 29.3 11.2 BghiP 59.3 12.7 29.6 62.2 -
[1] JONES K C, DE VOOGT P. Persistent organic pollutants (POPs): state of the science[J]. Environmental Pollution, 1999, 100(1-3): 209 − 221. doi: 10.1016/S0269-7491(99)00098-6 [2] U. S. Environmental Protection Agency. Provisional guidance for quantitative risk assessment of polycyclic aromatic hydrocarbons (EPA/600/R-93/089)[M]. Washington DC: United State Environmental Protection Agency, Office of Research and Development, 1993. [3] S B. Regionally based assessment of persistent toxic substances (GF /3100-98-07)[M]. Kenya: UNEP, 2003: 125-158. [4] 周文敏, 傅德黔, 孙宗光. 水中优先控制污染物黑名单[J]. 中国环境监测, 1990, 6(4): 1 − 3. doi: 10.19316/j.issn.1002-6002.1990.04.001 [5] KEYTE I J, HARRISON R M, Lammel G. Chemical reactivity and long-range transport potential of polycyclic aromatic hydrocarbons-A review[J]. Chemical Society Reviews, 2013, 42(24): 9333 − 9391. doi: 10.1039/c3cs60147a [6] 吴兴让, 尹平河, 赵玲, 等. 珠江广州段水体微表层与次表层中多环芳烃的分布与组成[J]. 环境科学学报, 2010, 30(4): 868 − 873. [7] ZHANG L, DONG L, REN L, et al. Concentration and source identification of polycyclic aromatic hydrocarbons and phthalic acid esters in the surface water of the Yangtze River Delta, China[J]. Journal of Environmental Sciences (China), 2012, 24(2): 335 − 342. doi: 10.1016/S1001-0742(11)60782-1 [8] SUN J H, WAND G L, CHAI Y, et al. Distribution of polycyclic aromatic hydrocarbons (PAHs) in Henan Reach of the Yellow River, Middle China[J]. Ecotoxicology and Environmental Safety, 2009, 72(5): 1614 − 1624. doi: 10.1016/j.ecoenv.2008.05.010 [9] 范博, 王晓南, 黄云, 等. 我国七大流域水体多环芳烃的分布特征及风险评价[J]. 环境科学, 2019, 40(5): 2101 − 2114. [10] ARIAS A H, SPETTER C V, FREIJE R H, et al. Polycyclic aromatic hydrocarbons in water, mussels (Brachidontes sp., Tagelus sp. ) and fish (Odontesthes sp. ) from Bahía Blanca Estuary, Argentina[J]. Estuarine, Coastal and Shelf Science, 2009, 85(1): 67 − 81. doi: 10.1016/j.ecss.2009.06.008 [11] FERNANDES M B, SICRE M A, BOIREAU A, et al. Polyaromatic hydrocarbon (PAH) distributions in the Seine River and its estuary[J]. Marine Pollution Bulletin, 1997, 34(11): 857 − 867. doi: 10.1016/S0025-326X(97)00063-5 [12] ZHI H, ZHAO Z, ZHANG L. The fate of polycyclic aromatic hydrocarbons (PAHs) and organochlorine pesticides (OCPs) in water from Poyang Lake, the largest freshwater lake in China[J]. Chemosphere, 2015, 119: 1134 − 1140. doi: 10.1016/j.chemosphere.2014.09.054 [13] U. S. Environmental Protection Agency. EPA Method 8270E (SW-846): Semivolatile Organic Compounds by Gas Chromatography/Mass Spectrometry (GC-MS)[EB/OL]. https://www.epa.gov/esam/epa-method-8270e-sw-846-semivolatile-organic-compounds-gas-chromatographymass-spectrometry-gc. [14] 环境保护部. 中国人群暴露参数手册(成人卷)[M]. 北京: 中国环境科学出版社, 2013. [15] 朱琳跃, 蓝家程, 孙玉川, 等. 典型岩溶区土壤和地下水中多环芳烃的分布特征及健康风险研究[J]. 环境科学学报, 2010, 40(9): 3361 − 3374. doi: 10.13671/j.hjkxxb.2020.0181 [16] KALF D F, CROMMENTUJIN T, VAN DE PLASSCHE E J. Environmental quality objectives for 10 polycyclic aromatic hydrocarbons (PAHs)[J]. Ecotoxicology and Environmental Safety, 1997, 36(1): 89 − 97. doi: 10.1006/eesa.1996.1495 [17] 曹治国, 刘静玲, 王雪梅, 等. 漳卫南运河地表水中溶解态多环芳烃的污染特征、风险评价与来源辨析[J]. 环境科学学报, 2010, 30(2): 254 − 260. [18] 李晓静, 于玉玲, 马莉, 等. 太湖胥口湾表层水和沉积物中多环芳烃的浓度水平及生态风险[J]. 生态毒理学报, 2016, 11(2): 547 − 555. [19] 王晓慧, 毕春娟, 韩景超, 等. 再悬浮过程中河流底泥PAHs 迁移与释放[J]. 环境科学, 2014, 35(6): 2185 − 2192. [20] 中国环境科学研究院, 国家环境保护总局. 地表水环境质量标准GB 3838-2002[S]. 北京: 中国环境科学出版社, 2002. [21] U. S. Environmental Protection Agency. Risk Assessment Guidance for Superfund, Volume I: Human Health Evaluation Manual (part F), Supplemental Guidance for Inhalation Risk Assessment) [R]. EPA/540/R/070 /002. Washington, DC: Office of Superfund Remediation and Technology Innovation, 2009. [22] Canadian Council of Ministers of the Environment. Canadianwater Quality Guidelines for the Protection of Aquatic Life[S]. 2018. [23] 张俊, 王乙震, 袁媛, 等. 京津冀地区典型地表水水源地多环芳烃污染特征分析[C]//持久性有机污染物论坛2017暨第十二届持久性有机污染物学术研讨会论文集, 武汉, 2017. [24] 宋玉梅, 王畅, 刘爽, 等. 广州饮用水水源地多环芳烃分布、来源及人体健康风险评价[J]. 环境科学, 2019, 40(8): 3489 − 3500. doi: 10.13227/j.hjkx.201811006 [25] 于英鹏, 刘敏. 太湖流域水源地多环芳烃分布、溯源与生态风险评估[J]. 水资源保护, 2017, 33(3): 82 − 89. doi: 10.3880/j.issn.1004-6933.2017.03.015 [26] MA W L, LIU L Y, QI H, et al. Polycyclic aromatic hydrocarbons in water, sediment and soil of the Songhua river Basin, China[J]. Environmental Monitoring and Assessment, 2013, 185(10): 8399 − 8409. doi: 10.1007/s10661-013-3182-7 [27] WU B, ZHANG Y, ZHANG X X, et al. Health risk from exposure of organic pollutants through drinking water consumption in Nanjing, China[J]. Bulletin of Environmental Contamination and Toxicology, 2010, 84(1): 46 − 50. doi: 10.1007/s00128-009-9900-8 [28] YUNKER M B, MACDONALD R W, VINGARZAN R, et al. PAHs in the Fraser River basin: a critical appraisal of PAH ratios as indicators of PAH source and composition[J]. Organic Geochemistry, 2002, 33(4): 489 − 515. doi: 10.1016/S0146-6380(02)00002-5 -





 下载:
下载: