-
抗生素因其具有抗菌谱广、抗菌力强、结构简单、活性强等特点,在医疗业、畜牧业及水产养殖业发挥着重要的作用。但抗生素不能被生物体有效的吸收代谢[1],约70%—80%的抗生素会进入水生系统[2],且在环境中长期存在,除了会造成化学药物污染外,长期接触抗生素也会对生物体造成慢性毒性影响[3],诱导细菌产生抗生素抗性基因(ARGs),造成一系列生态问题[4]。对生态系统和人类健康存在不利的影响。环丙沙星(CIP)是一种典型的氟喹诺酮类抗生素,也是世界范围内应用最广泛的抗生素之一。由于环丙沙星在水环境中广泛残留,近年来,在中国的地表水源、淡水养殖环境、海水养殖环境和养殖生物中均被检出[1, 5-9],由于其卤代的杂环结构,在常规的废水处理工艺中很难被去除。因此,亟需找到一种能够高效去除废水中环丙沙星的技术。
高级氧化工艺(AOPs)对于难降解药物和个人护理产品(PPCPs)的降解非常有效,紫外/氯组合工艺作为作为一种新兴的高级氧化工艺,是一种很有应用前景的水处理技术。该工艺主要借助紫外线辐照氯从而激发产生的·OH和活性氯物种(RCS)(包括氯自由基Cl·、氧化氯·ClO、二氯自由基·Cl2等)来氧化降解有机污染物,其中,HO·是一种非选择性氧化剂,氧化电位约为2.80 V[10],能够与有机物快速反应;活性氯物种(Cl·、·ClO、·
Cl−2 )的氧化还原电位分别为2.47 V、1.5—1.8 V、2.0 V[10-12],活性氯是选择性的氧化剂,可通过单电子氧化、吸氢和不饱和碳碳键与富电子部分反应[13]。上述这些活性自由基在氧化反应中具有协同增效的作用,共同参与降解有机污染物[14-15]。近年来,紫外/氯高级氧化工艺被广泛用于去除水中的新型有机污染物,如磺胺甲恶唑[16]、氯贝酸[17]、美托洛尔[14]、二碘乙酰胺[18]、甲硝唑[19]等。作为水环境中常见有机污染物,近年来有许多利用高级氧化方法去除环丙沙星的研究,包括中压紫外线激活过氧单硫酸盐(MPUV/PMS)[20],紫外臭氧(UV/O3)[21]、紫外激活过硫酸盐(UV/PS)[22]等,但这些关于环丙沙星的去除研究主要集中于饮用水,系统研究紫外/氯高级氧化组合工艺降解废水中环丙沙星报道较少。因此,本文采用模拟的环丙沙星废水为研究对象,开展紫外/氯高级氧化工艺降解环丙沙星效能研究,分别从影响因素、反应动力学、降解产物、毒性效应等方面阐述废水中环丙沙星的降解效能与机理,并对降解工艺进行经济成本分析,进而为紫外/氯组合工艺用于废水中环丙沙星的去除提供理论基础与数据支撑。
-
环丙沙星(CIP,纯度98%)、腐植酸(透明质酸,脂肪酸≥90%)、牛血清蛋白(BSA)、碳酸氢钠、氯化钠、高效液相色谱级的乙腈和甲醇均购自麦克林生化科技有限公司(中国上海)。次氯酸钠(NaOCl,有效氯< 5%,游离碱10%—20%)购自阿拉丁生化科技股份有限公司(中国上海),硫代硫酸钠(Na2S2O3)购自国药化学试剂有限公司(中国上海)。实验所用试剂均采用超纯水配置,所用超纯水(电导率为18.25 MΩ·cm)通过优普纯水机(UPT-II-10T)制备,实验中使用的实际水体经0.45 μm水相滤膜过滤后保存备用。
-
在装有一个11 W低压汞灯(波长= 254 nm)的光化学反应器中进行,垂直光筒下放置容积为 100 mL的玻璃平皿,平皿置于磁力搅拌器上,用磁力搅拌器将反应溶液完全混合。实验开始前对紫外灯进行30 min的预热。降解实验过程中使用10 mmol·L−1的磷酸盐进行缓冲,反应溶液的pH分别采用0.1 mol·L−1NaOH和0.1 mol·L−1H2SO4进行调节,除特殊说明外,反应溶液的pH值均为7,反应体积为100 mL。实验中向含有CIP的溶液中加入特定量的氧化剂,并开始紫外线照射,在预定的时间间隔取1 mL反应液加入50 μL硫代硫酸钠的液相小瓶中进行猝灭,随后立即进行检测分析。
-
毒性实验中的小球藻采用BG-11培养基并置于光照培养箱中培养,进入对数生长期中后期后,使用250 mL锥形瓶分装,向分装的小球藻液中分别投加相同体积的CIP溶液和降解后的反应溶液,按照原始培养条件在光照培养箱中继续培养,每隔24 h取样,取样前将样品摇匀,稀释后用浮游植物荧光分析仪测定光合系统Ⅱ(PSⅡ)的最大光合效率(Fv/Fm),所有实验均重复至少2次以上。
-
CIP的浓度采用高效液相色谱(Agilent 1260, USA)测定,色谱柱采用Poroshell 120 SB (2.1 mm ×150 mm, 2.7 μm, Agilent),流动相为甲醇和0.10%甲酸溶液(V∶V ,50∶50),流速为0.8 mL·min−1,柱温为40 ℃; 荧光检测器(FLD)的激活波长为278 nm,发射波长为450 nm, 进样量为20 μL。NaOCl溶液中的有效游离氯浓度采用DPD分光光度法测定。溶液中有机物的荧光强度使用日立F-2700荧光分光光度计进行分析,激发波长设置为250—400 nm,发射波长设置为 270—500 nm,扫描间隔为5 nm,激发光和发射光的狭缝为10 nm;扫描速度为1200 nm·min−1。反应过程中的降解产物采用Thermo Fisher UltiMate 3000 液相色谱串联Thermo Scientific Q Exactive组合型四极杆-Orbitrap 质谱仪测定,选择全扫模式,扫描范围的m/z为100—1000,正离子模式(ESI+)。毒性实验中小球藻的最大光合效率(Fv/Fm)利用浮游植物荧光分析仪(Phyto-PAM, Walz, 德国)测定,综合生态毒性分析通过ECOSAR模型计算得出。
-
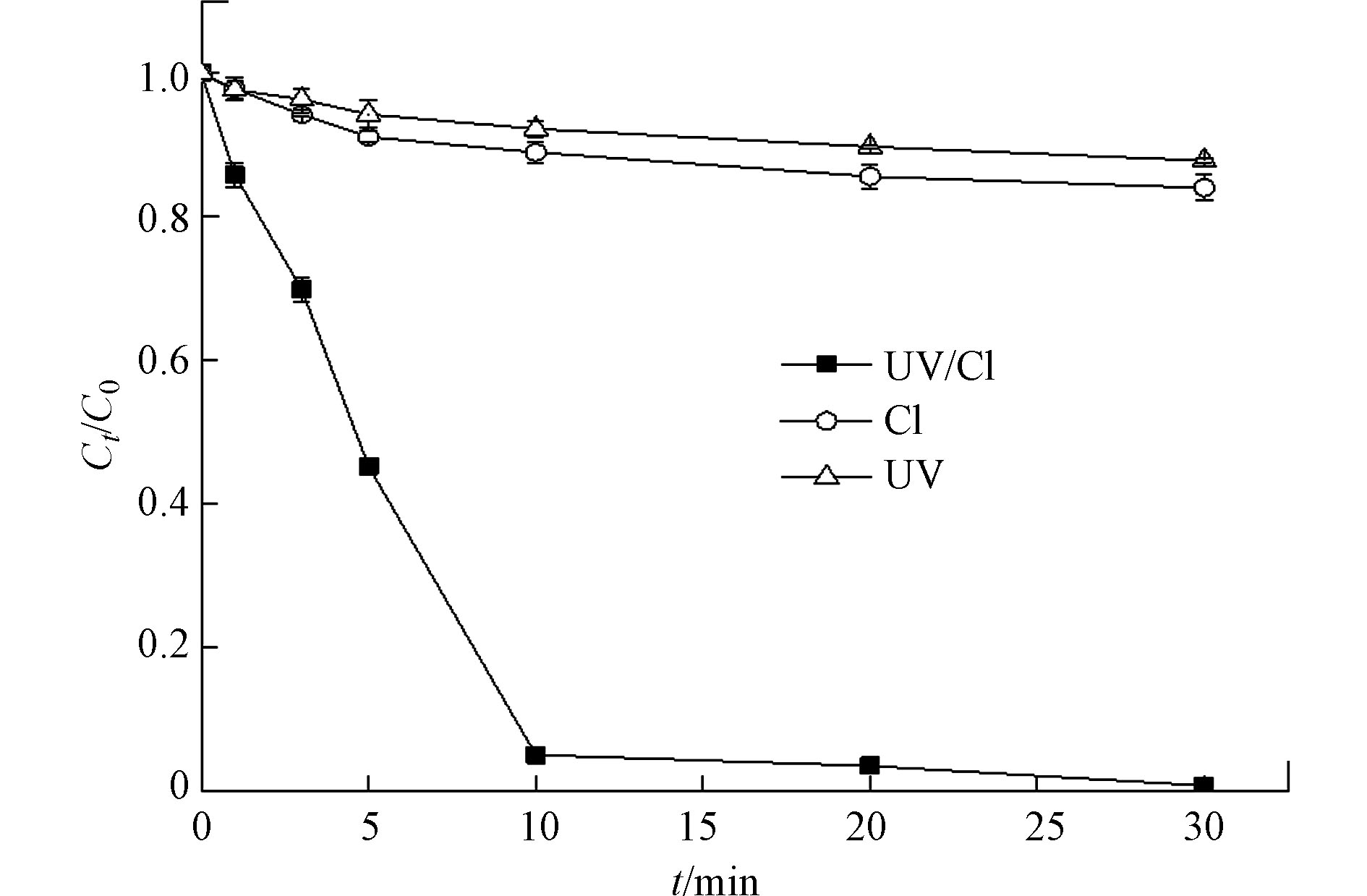
实验控制CIP的初始浓度为30 μmol·L−1,NaClO的初始浓度为0.28 mmol·L−1,反应体系但初始pH值为7.0,温度为25 ℃,CIP在单独紫外线照射、单独氯化和紫外/氯工艺过程中的降解效果如图1所示,单独紫外光照射和单独氯化对CIP的降解效果不明显,30 min内分别只有12%和16%的去除率,而紫外光照射和氯化组合工艺对CIP的降解表现出协同效应,经过30 min,CIP的去除率高达99%,分别是单独紫外照射和单独氯化的7.75倍和5.81倍。上述结果可以归结于紫外/氯组合工艺中生成了强氧化性羟基自由基(∙OH)和活性氯(RCS)。反应如式(1)—(2)。
-
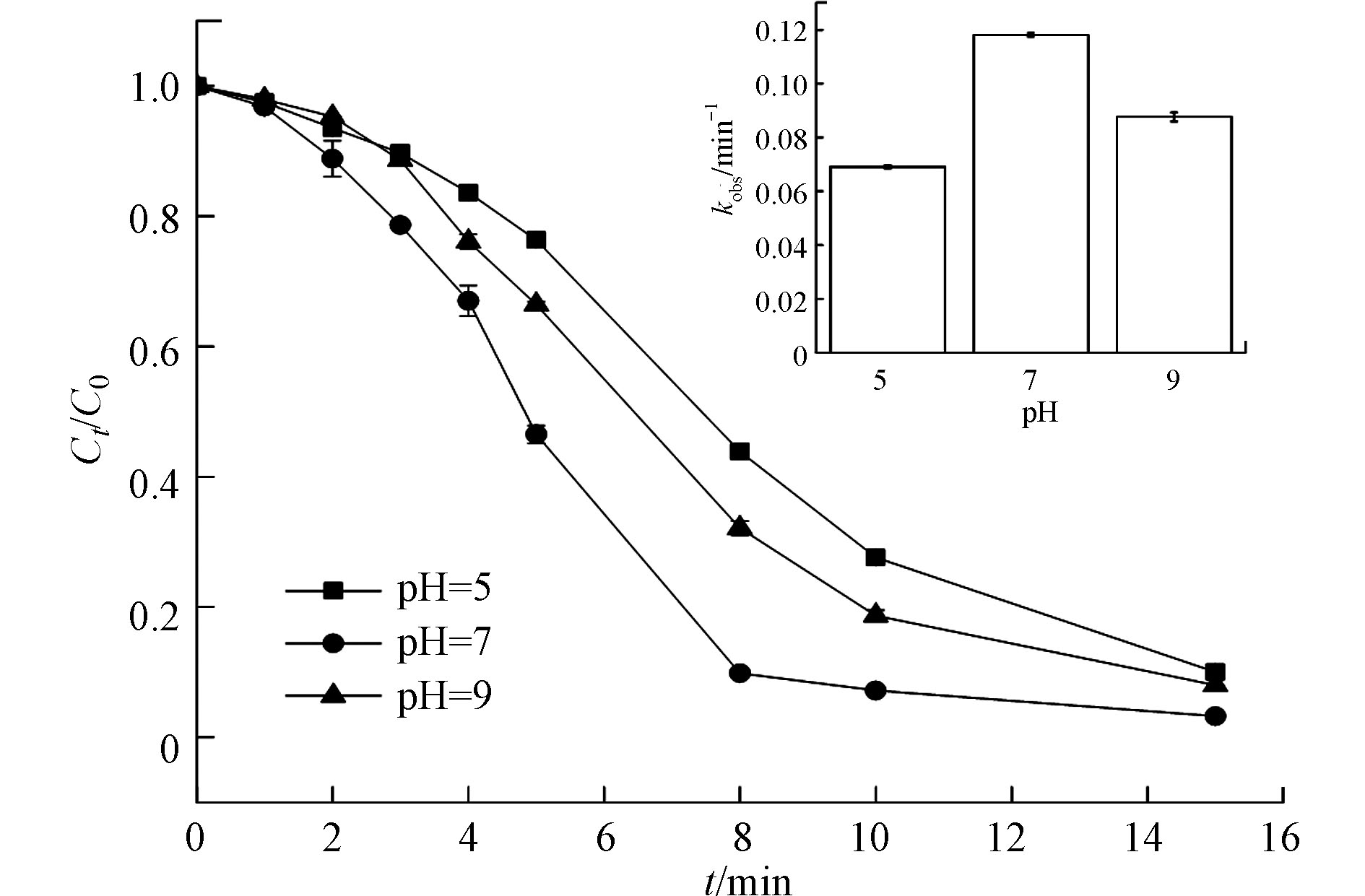
控制CIP的初始浓度为30 μmol·L−1,NaClO的初始浓度为0.28 mmol·L−1,紫外光辐照强度为0.2 mW·cm−2,温度为25 ℃,利用 0.1 mol·L−1NaOH和0.1 mol·L−1H2SO4调节溶液初始pH值分别为 5.0、7.0、9.0,探究不同的溶液初始pH值对CIP降解效能的影响,结果如图2所示。在pH=5、pH=7和pH=9时,CIP降解率8 min后分别达到57 %、91 %和68 %。其一级反应速率常数依次为0.069 min−1、0.118 min−1、0.088 min−1,由此可知,环丙沙星在酸性条件(pH=5)下降解最慢,在中性条件(pH=7)下降解最快。
这一现象与紫外/氯组合工艺降解双酚A[23]、苯甲酮[24]的趋势一致。有研究指出,紫外线对有机物的降解并不表现出pH依赖性[25-26],而pH对有机物降解效率的差异主要归因于两方面,第一,pH影响HOCl/ClO−的量子产率和溶液基质的自由基清除效果[27-28],如式3所示,次氯酸可以分解为次氯酸根,酸碱度影响HOCl/ ClO−的解离(pKa=7.5),相比于pH=9的碱性条件下,pH=7时,HClO为优势物种,254 nm紫外光照射下,HClO的量子产率高于ClO−(1.45 mol Es−1>0.95 mol Es−1)[29],可以形成更多的HO·和Cl·。溶液pH的增加导致OCl−的比例增加,降低了羟基和氯自由基的数量。同时,HClO对羟基和氯的自由基清除作用也较低[29-30],HOCl与羟基和氯自由基的速率常数分别为2.0×109 L·(mol·s)−1和3.0×109 L·(mol·s)−1,而OCl−与羟基和氯自由基的速率常数分别为8.8×109 L·(mol·s)−1和8.2×109 L·(mol·s)−1 [31-33]。当酸碱度从7.0下降到5.0,CIP去除率下降的原因可能是,由于pH值不同,CIP的形态不同(pKa= 6.2)。在酸性条件下,质子化形式的CIP(CIP3+,CIP2+和CIP1+)占主要优势,质子化的程度随着酸碱度的增加而降低;在酸碱度为7—8左右,CIP以中性/两性离子形式存在(CIP0),在碱性溶液中,CIP以去质子化形式存在(CIP−1),质子化、中性和去质子化形式的CIP均可以与HOCl反应,二级速率常数分别为4.3 × 103 L·(mol·s)−1、3.8 × 105 L·(mol·s)−1和4.9×107 L·(mol·s)−1 [34],有研究者在一项比较实验中发现,氟喹诺酮化合物(诺氟沙星、氧氟沙星和恩诺沙星)在不同的pH条件下显示出相似的直接光解降解动力学:最高反应速率常数均是目标分子的中性形式,其次是去质子化形式和质子化形式[35] ,pH=5时,虽然HOCl是主要的形式,但是由于静电相互作用(pKa= 6.2),在pH =5的质子化形式的CIP与HOCl之间的反应的kobs(4.3×103 L·(mol·s)−1)是3种CIP形式中最低的,故在中性条件下,CIP的降解效率高于酸性和碱性条件。
-
控制CIP的初始浓度30 μmol·L−1, 紫外光强为0.2 mW·cm−2,pH为7.0,投加不同浓度的次氯酸钠,研究不同氧化剂投加量对CIP的去除效果的影响,结果如图3所示,增加次氯酸纳的剂量能够显著提高环丙沙星的去除。随着游离氯量从0.07 mmol·L−1增加到0.42 mmol·L−1,10 min后CIP的去除率从76.9%增加到98.5%,反应速率常数由0.078 min−1增加至0.106 min−1。
化学氧化中,氧化剂的剂量在自由基的产生过程中起着至关重要的作用。随着氧化剂用量从0.07 mmol·L−1增加到0.28 mmol·L−1,加速了游离氯的光解,能够促进水中Cl·和HO·的产生,环丙沙星的降解速率明显增加。而随着氯用量从0.28 mmol·L−1增加到0.42 mmol·L−1,环丙沙星的降解速率没有明显的提高,这种现象可能与过量的HOCl和OCl−的清除作用有关[32, 36],如(4)—(7)所示,HOCl能清除羟基和氯自由基,速率常数分别为2.0×109 L·(mol·s)−1和3.0×109 L·(mol·s)−1,OCl−也能清除羟基和氯自由基,速率常数分别为8.8×109 L·(mol·s)−1和8.2×109 L·(mol·s)−1 [31-33],在最近的研究中,当将紫外/氯工艺应用于美托洛尔[14]、环柠檬醛[37]、阿米替利[38]、非那西丁[39]、布洛芬[15]去除时,也观察到了类似的趋势。
-
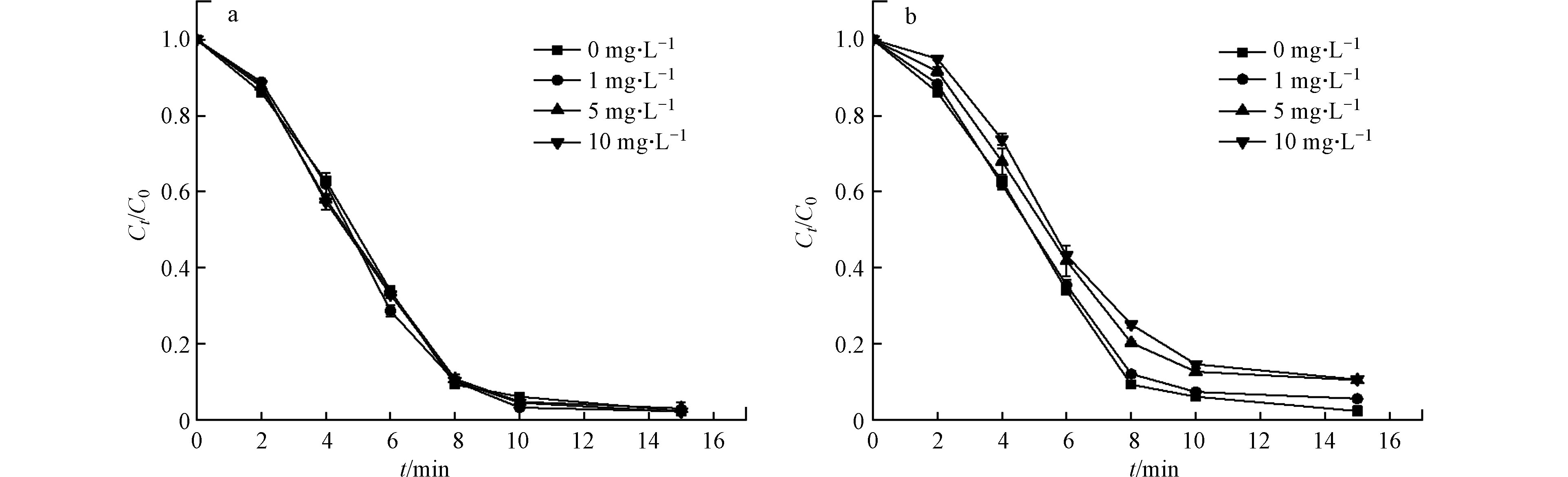
水体中广泛存在着一些无机阴离子,其中硝酸根离子的浓度高达数百毫克升,是水体中常见的阴离子,可与·OH反应而消耗部分自由基,氯离子也是一种常见的阴离子,广泛存在于自然环境中。本实验研究了在中性环境下不同浓度的氯离子和硝酸根离子对紫外/氯组合工艺去除环丙沙星的影响,结果如图4所示。
如图4a所示,当氯离子的浓度从0增加到10 mg·L−1,CIP的降解效果的几乎保持不变,可以看出,氯离子的存在对CIP降解的影响很小,其主要的原因是Cl−能与HO·和C·反应生成弱氧化性自由基[40-42],如
ClOH⋅− 和Cl⋅−2 ,然而,这些弱氧化能力的自由基可以再次分解为HO·和Cl·,ClOH⋅− 的解离反应的速率常数也达到了6.1×109 L·(mol·s)−1,自由基的数量基本保持不变,如反应(8)—(11)[41, 43]所示。与氯离子不同,由图4b可以看出,NO−3 的存在一定程度上降低了CIP的降解效率,造成这种现象的一种可能是由于NO−3 被还原成NO−2 ,NO−2 消耗了HO·形成低氧化能力的自由基,如中反应(11)—(13)所列[44],从而抑制了CIP的降解。 -
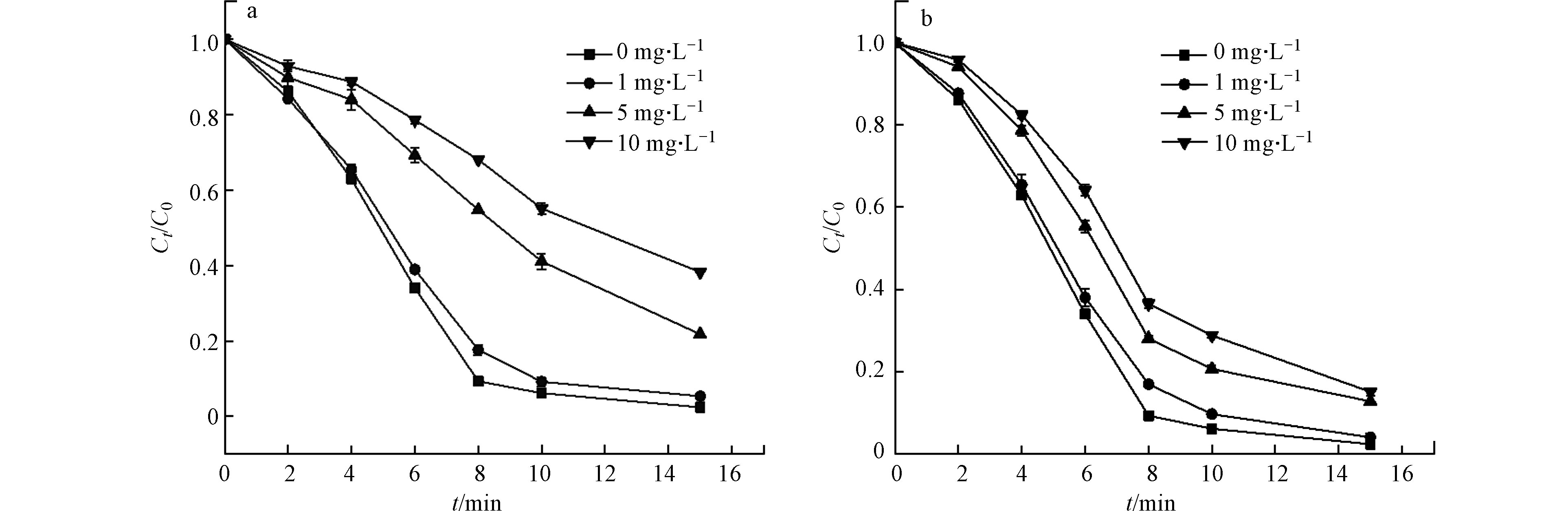
天然有机物广泛存在于各类水体中,对水处理过程会产生一定的影响。选取腐殖酸(FA)作为天然有机物的代表,从图5可以看出,1 mg·L−1的腐殖酸对降解的抑制作用不明显,随着腐殖酸的浓度增加到5.0 mg·L−1,CIP降解受到明显的抑制,经过10 min的氧化降解,CIP降解效率从93.8%减小至59.9%。当腐殖酸的浓度增加至10.0 mg·L−1,CIP降解率下降至45.8%。
造成这一现象的主要原因是天然有机物的紫外过滤、光子吸收和自由基抑制作用。首先,天然有机物(NOM)可以作为自由基清除剂消耗自由基[32, 45],研究表明,NOM可以以1.3×104 L·(mol·s)−1 [32]和2.5×104 L·(mol·s)−1 [45]的二级反应速率与Cl·和·OH反应,在消耗活性自由基的方面与CIP形成竞争关系,导致了CIP降解的抑制;其次,在相同的体系中,NOM可以通过氯化降解,其拟一级动力学常数为3×10−5 s−1[46],造成一定比例氯的消耗;最后,NOM可以作为一种内部过滤器,过滤吸收254 nm处的紫外线并发生光解作用,改变紫外光通量,减少了氯和CIP对紫外线的吸收,减少了自由基的产生[47]。
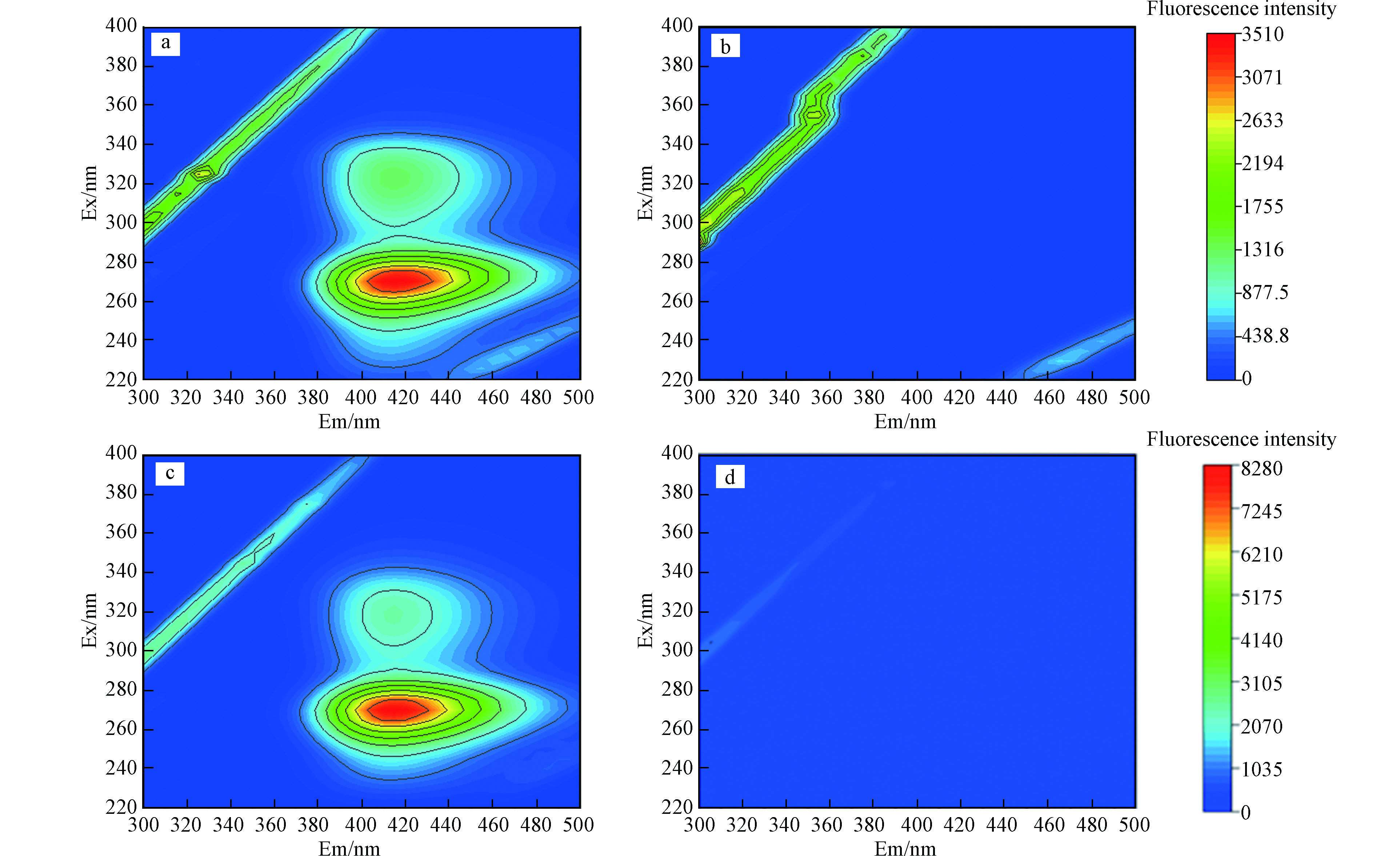
废水中不仅含有大量无机离子,而且还含有许多有机大分子物质,包括多种蛋白质,本文选取牛血清蛋白(BSA)作为蛋白类有机物代表,研究了不同浓度的BSA对CIP降解的影响,结果如图5b所示,1 mg·L−1的BSA对降解有一定的抑制作用,8 min时CIP降解效率从90.7%下降至82.4%。随着BSA浓度持续增加,10.0 mg·L−1BAS存在时,CIP的降解效率仅为42.2%。在化学结构上BSA是由不同的氨基酸组成,研究表明,特定的氨基酸与臭氧分子和HO·都有较高的反应速率[48],因此 BSA会与环丙沙星竞争HO·等其他活性自由基,进而抑制 CIP的降解效果。在对同时含有FA和CIP的水体与同时含有BSA和CIP的水体进行了氧化反应前后的三维荧光分析,结果如图6,环丙沙星、FA和BAS均具有显著的荧光特征,FA主要存在两个征吸收峰,范围在Ex/Em = 310—360/370—450 nm、Ex/Em = 240—270/370—440 nm,CIP也存在两个荧光峰Ex/Em = 270/420 nm、Ex/Em = 315/420 nm,与FA和BSA部分荧光特征峰的范围重叠,经紫外/氯工艺处理20 min后,体系荧光强度迅速下降,可以看出紫外/氯工艺组合除了对CIP有较好的去除效果,也可以有效去除水中的FA和BSA,同时也间接证实了FA和BSA与CIP之间具有争夺自由基的竞争关系。
-
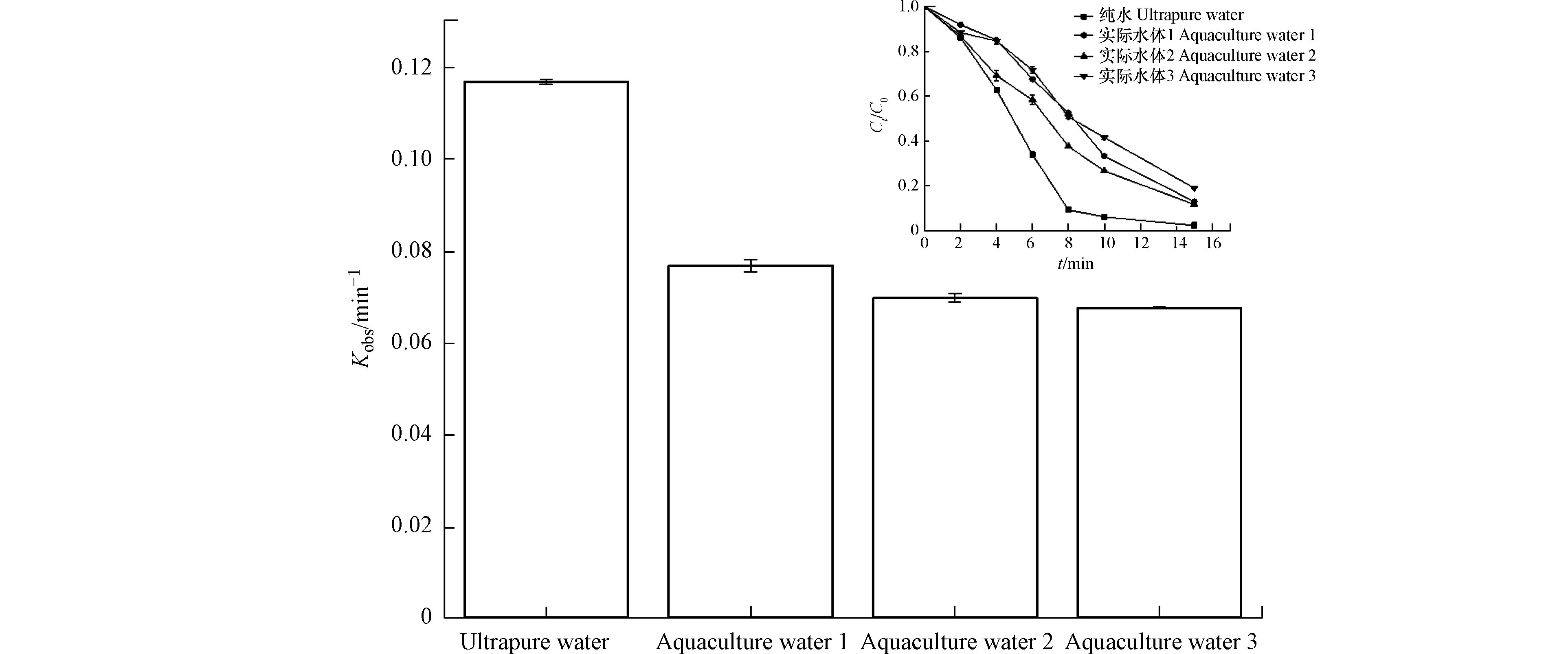
养殖废水是水环境中环丙沙星的一个重要来源,因此,实验选取了3种养殖废水开展废水中CIP降解研究,水质参数见表1,降解结果如图7所示,与超纯水相比,实际的养殖水体中的CIP降解速率常数均有所降低,造成这一现象的原因可能有两个,第一,废水中存在可能影响光降解的溶解和悬浮物质,其中,溶解有机物(DOM)可以消耗氯氧化剂,其消光系数为3.15 L·m−1·g−1[32],会降低光降解效率;第二,水体中的无机碳(
HCO−3 /CO23 )和DOM对紫外/氯工艺中污染物的去除有不利影响[15, 42, 49],HCO−3 将与CIP竞争,与⋅OH 和Cl⋅ 反应[50],NOM也会消耗⋅OH 和Cl⋅ ,其二级速率常数分别为2.5×104 L·(mol·s)−1和1.3×104 L·(mol·s)−1 [51],因此只有少量的加标氯作为游离氯参与反应。尽管CIP在实际废水中的降解速率常数低于超纯水,然而,由于多种活性物质的协同作用,其氧化降解速率仍保持较高水平,表明紫外/氯组合工艺处理环丙沙星废水的潜力。 -
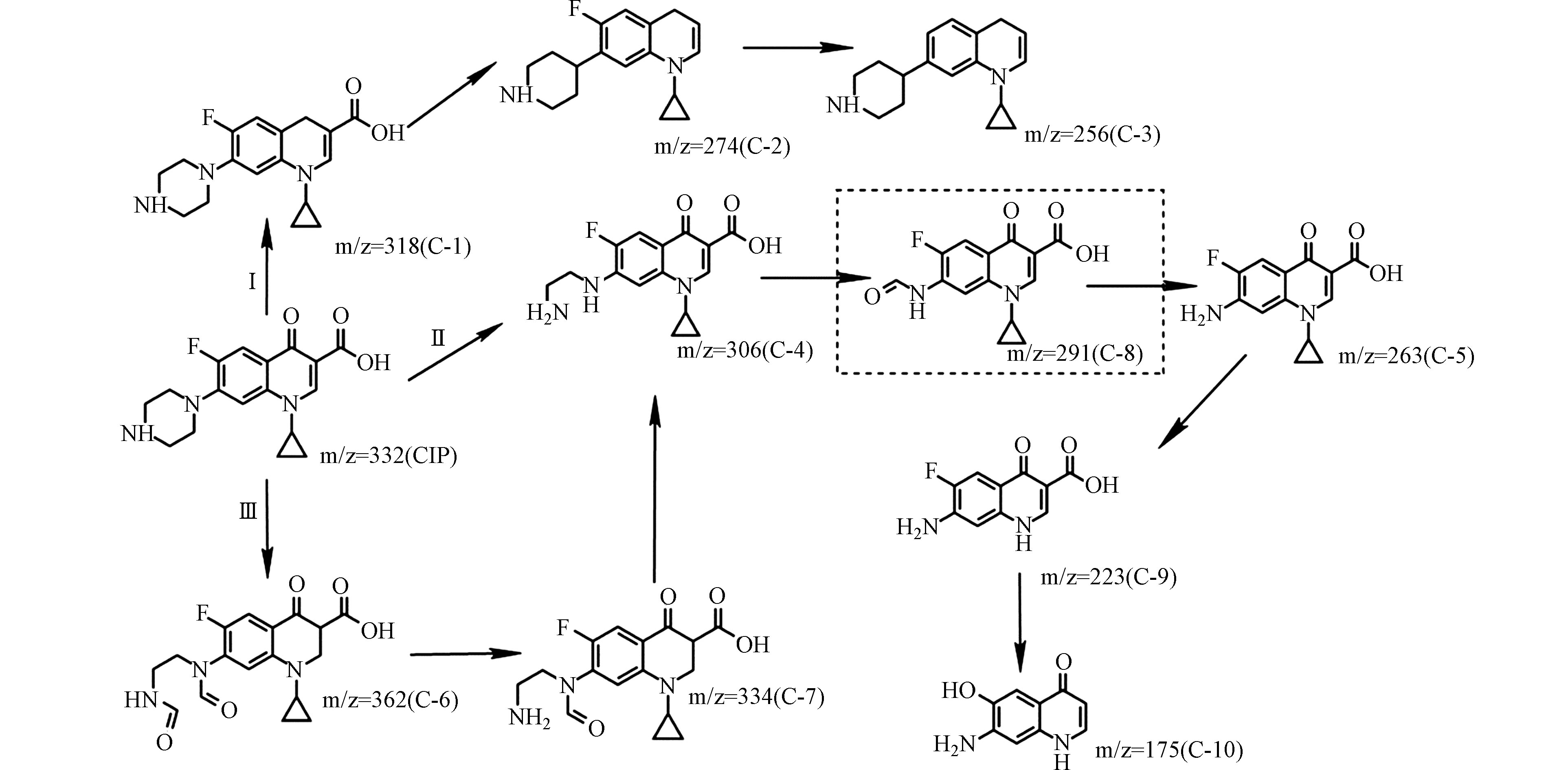
通过液相色谱串联质谱法对紫外/氯降解CIP过程中的产物进行检测分析,结合报道的CIP氧化降解途径结果提出了CIP在紫外/氯工艺中降解路径[52-54],如图8所示。
紫外/氯组合工艺氧化降解CIP主要有三个途径。CIP中的两个主要反应位点是哌嗪环中的芳族叔胺基团和脂族仲胺基团[55],因此除了碳氟键的取代反应和喹诺酮部分的氧化,从而导致脱氟和羟基取代反应以外,CIP的大多数氧化反应发生在哌嗪环上。在路径Ⅰ中,环丙沙星失去羰基形成C-1,C-1脱羧基和脱氟后,形成C-2和C-3。碳氟键的键能高于碳碳键和碳氮键,而紫外线照射可以为此提供能量,在紫外线/过硫酸盐和紫外线/臭氧的研究中下也观察到了碳氟键的断裂[21]。在路径Ⅲ中,哌嗪环上的仲胺首先被攻击,可以产生中间产物C-6,两个羰基断裂,形成C-7和C-4;而在路径Ⅱ中,自由基攻击CIP的哌嗪环,碳氮键被打破,哌嗪环开环裂解,则会直接形成产物C-4脱乙烯环丙沙星,去乙烯环丙沙星的进一步氧化,通过氨基的损失产生带有羰基的C-8,哌嗪环被自由基进一步氧化,哌嗪取代基被完全破坏,形成苯胺,出现产物C-5,碳氮键断裂,环丙烷氧化断裂,形成C-9,随后进行脱羧基反应,形成C-10,这些产物可能进一步降解为CO2、H2O、F−和其他小分子化合物。
-
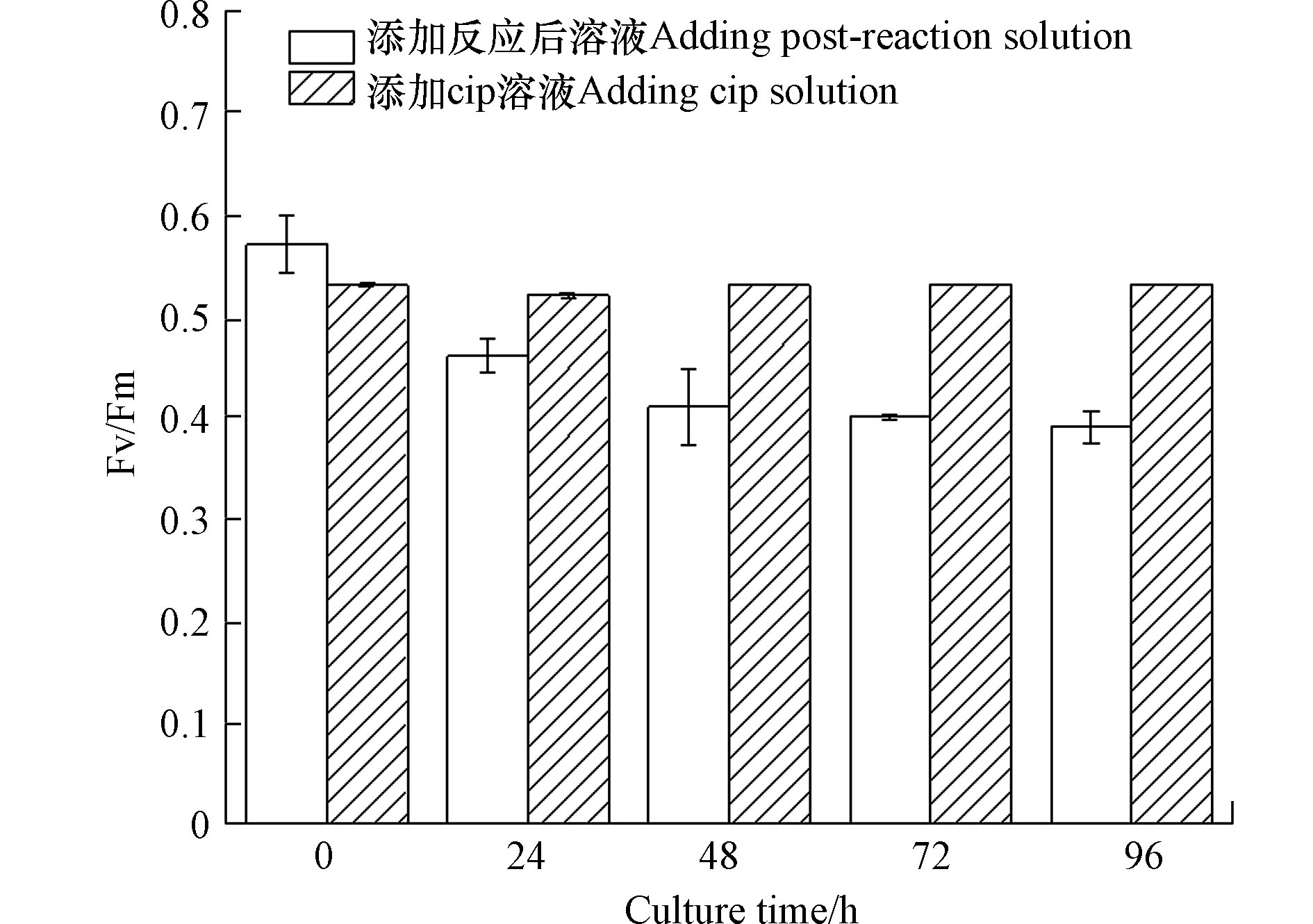
小球藻的毒性实验结果如图9所示,纵坐标为小球藻光合系统Ⅱ(PSⅡ)的最大光合效率(Fv/Fm),横坐标为投加CIP溶液和氧化降解处理后溶液的两组小球藻的培养时间。添加降解反应后溶液的小球藻组在48 h内,Fv/Fm值随着时间的增长呈现下降趋势,由0.57下降至0.41,培养48 h后趋于稳定,而只添加CIP溶液的小球藻组的Fv/Fm值没有明显变化,说明CIP降解产生的产物具有一定的急性毒性,抑制了小球藻的光合能力,限制了光合作用中的能量捕获,阻断了初级反应中的电子传递链,造成小球藻的最大光合效率下降。此外,采用了ECOSAR(V2.0)综合评价了CIP及其降解产物的毒性,结果如表2所示,LC50、EC50和ChV值分别代表半致死浓度、半有效浓度和慢性毒性。在推测的降解路径中,产物C-4, C-6, C-7外,已鉴定的中间产物的半数致死浓度、半有效浓度和慢性毒性值均高于CIP本身,说明在降解过程中,CIP产生了具有更高生态风险的中间产物,也例证了小球藻实验中,反应后的溶液会导致小球藻的最大光合效率下降的现象。此外,在反应结束后,毒性较大的产物C-3仍被检出,这意味着导致小球藻的最大光合效率下降急性毒性可能来自产物C-3。
-
为了进一步研究紫外/氯组合工艺处理实际废水的可行性,采用电能消耗率(EE/O)对其电能成本进行了经济成本分析。电能消耗率(EE/O)是指单位体积的水中污染物降解一个数量级所需的电能[56],单位为千瓦时(kWh),可通过如下公式计算得出:
其中,P为总电功率(kW),t是时间(h),V是溶液的体积(m3),C0和Ct是污染物的初始和最终浓度,取总电能消耗的45%作为维护费。
当初始CIP浓度为30 μmol·L−1时,温度 25 ℃,pH=7时,计算出的电能电耗值为0.85 kWh·m−3,经查阅文献,整理其他基于紫外的高级氧化工艺降解CIP的EE/O值于表3,可以观察到,与其他工艺相比,紫外/氯工艺的电能消耗显著降低,仅为紫外/过氧化氢、紫外/臭氧工艺的1/20和1/5,进一步证实紫外/氯组合工艺用于降解环丙沙星废水的可行性。
-
(1)紫外与氯组合工艺对CIP的去除具有协同增效的效果,10 min去除率高达95%。其降解速率随着氧化剂浓度的增高而增高,中性反应条件有利于环丙沙星的氧化降解;氯离子对降解效率影响不大,硝酸根离子抑制反应进行,降低CIP的降解率;天然有机物和牛血清蛋白浓度的浓度越高,其对CIP降解的抑制作用越明显。
(2)紫外/氯组合工艺氧化降解CIP的机理包括哌嗪环的氧化开环和喹诺酮氧化导致的脱羧基。小球藻毒性试验和ECOSAR分析结果均表明CIP氧化过程中生成了毒性更高的具有高生态风险的产物。
(3)实际废水环境中,CIP的降解受到一定程度的抑制,但仍保持较高的降解速率。相比于基于紫外的其他氧化工艺,紫外/氯组合工艺的电能消耗率较低,表明该工艺降解实际CIP废水的极大潜力。
紫外/氯组合工艺降解环丙沙星废水的效能、机理及毒性
UV/chlorine as an advanced oxidation process for the degradation of ciprofloxacin:Degradation efficiency, mechanism and toxicity evaluation
-
摘要: 环丙沙星是一种被广泛使用的氟喹诺酮类抗生素,在水体环境中经常被检测到,常规废水处理工艺对其去除效果有限,对水环境安全构成潜在威胁。本文拟采用紫外/氯组合工艺处理环丙沙星废水,系统研究其降解环丙沙星的效能、机理及毒性效应。考察了不同氯投加量、溶液pH、常见阴离子、腐殖酸浓度等环境因素对环丙沙星(CIP)降解效能的影响,并探究了CIP的降解路径以及产物毒性。结果表明,单独氯化和单独紫外对CIP的去除有限,而紫外/氯组合工艺对CIP的去除效果较好,去除率高达99.31%。当氯投加量由0.07 mmol·L−1增加至0.42 mmol·L−1,CIP的降解速率由0.078 min−1增加至0.106 min−1。中性反应条件更有利于CIP氧化降解。水体中存在的硝酸根离子、天然有机物和牛血清蛋白不同程度抑制CIP的降解。CIP降解过程中,共鉴定出9种氧化产物,阐述了CIP的几种降解途径。小球藻毒性试验和ECOSAR分析结果表明CIP氧化降解过程中产生了毒性较高的中间产物。经济成本分析结果表明紫外/氯组合工艺可用于处理环丙沙星废水。Abstract: Ciprofloxacin is a widely used fluoroquinolone antibiotic frequently detected in the aqueous environment and poses a threat to environmental safety. To effectively remove the antibiotic ciprofloxacin, which is difficult to remove by conventional water treatment processes, the degradation of Ciprofloxacin (CIP) by UV/ chlorine processes was evaluated. The efficacy of the process in degrading ciprofloxacin was investigated, and the degradation effect of ciprofloxacin was studied under different conditions of chlorine concentration, pH, common anion concentration and humic acid concentration, The degradation pathway of CIP and the toxicity of CIP products were explored. The results showed that compared with direct photolysis and Individual chlorination, UV/chlorine has a more pronounced CIP degradation efficiency. Remarkable CIP degradation was observed in the UV/chlorine system. the removal percentage of CIP can be reached to 99. 31%. The increase of oxidant dosing could promote the degradation of CIP, When the oxidant concentration increases from 0.07 mmol·L−1 to 0.42 mmol·L−1, the degradation rate constant reduces from 0.078 min−1 to 0.106 min−1.The CIP degradation could be improved under neutral conditions, while the presence of nitrate ions, natural organicmatter(NOM) and Bovine albumin (BSA) in the water inhibited the degradation of CIP. intermediates were identified by high performance liquid chromatography–tandem mass spectrometry. The possible degradation pathways were proposed based on the intermediate products. The results of the Chlorella toxicity test and ECOSAR analysis indicate that highly toxic intermediates are produced during the oxidative degradation of CIP. The electrical energy per order (EE/O) analysis showed that UV/chlorine process was a less energy consumption process, providing a feasible method for the treatment of ciprofloxacin in wastewater.
-
产业是经济发展的基础,产业升级和科技创新是我国最近几年的重点工作。近年来,我国的研发投入每年都在平稳且快速增长,与越来越高的研发经费对应的却是并不匹配的科技成果转化率。目前我国的科技成果转化率10%~30%被应用于实际生产中,真正产业化的科技成果还不到20%,远低于发达国家40% 的水平[1],生态环境科技领域的成果尤甚。诸多科技成果长期处于隐匿于书架,作为商品难以走向货架,大部分优秀的生态环境前沿科技的成果都只能停留在科学层面。现在中国已经在由环境集中治理阶段逐步转向减污降碳和绿色生态阶段,国家生态环境科技成果应用的需求十分迫切。
分析现有生态环境产业的投资情况,总投资不足和缺少完善的资金投入机制是最大的问题。由于生态环境成果的科技成果转化在中间试验和产品化阶段需要大量的前期资金支持,生态环境科技成果转化工作经常面临资金不足的困境,大量科技成果转化都受制于此。我国70%以上的生态环境资金来源于政府或公共部门,投资相对受限,难以满足科技成果转化需求。在科技孵化领域,新建中小企业自有资金非常有限,融资渠道狭窄困难,空有技术、市场难以形成规模化的产业,生态环境科技成果产业化路径受阻。因此政府成立产业基金,利用有限的金融资源带动市场,促进生态科技成果转化。如何利用现有生态环境科技成果,借助基金等金融力量将产生的科技创新市场化,完善投资机制,提升创新动力获取收益,维持行业的良性发展,是创新新格局、引领高质量发展的关键。
1. 研究背景
科技是潜在生产力,也是提高社会生产力和综合国力的根本动力之一。世界各国也纷纷出台各类科技政策促进科技成果转化,建设科技成果转化的生态体系。生态环境产业中的先进生态环境产业从“十二五”开始就被确定为是中央和地方的配套支持政策确定的7个国家战略性新兴产业之一,承担着技术改造、改善发展结构、振兴经济的重任。生态环境产业虽然是战略性新兴产业,但投资高、投资周期长、投资前景不明显、缺乏核心技术、市场发展缓慢等特点使其不受资本市场的青睐。直接导致生态环境产业虽然整体市场规模巨大,但资金来源还是以政府为主,整体投资不足市场障碍较多,生态环境科技转化困难。2022年4月,中央全面深化改革委员会第二十五次会议上明确要求加快推进金融支持创新体系建设,促进科技成果转化,从推进国家科技成果转化产业基金改革、充分发挥金融机构对科技成果转化的支持作用和坚持市场化导向3个方面贯彻落实[2]。
在生态环境科技金融中,众多原因导致了行业资本市场的复杂性。一方面,我国经济改革起源于计划经济,所以地方政府掌握着大量土地、金融、国有企业等资源,在金融市场中政府与实业投资难以完全分离。由于实业投资的连续性、复杂性和不可逆性,政府的介入必然也是深度的,和企业产生复杂密切的关系,不易退出。另一方面,由于环保的公益属性,生态环境市场发展早期的环保投资需要由政府主导推进,引导生态环境技术方向,保障污染治理的成效。所以资本市场上常见对高科技企业风险投资基金在移植和适应我国的政治经济土壤的过程中,产生了政府生态环境产业基金。生态环境产业基金是由地方政府设立,按市场化方式运作,在生态环境上下游产业进行引导性投资的政策性基金,可以引导市场的发展方向,改善市场投融资环境,助力战略新兴企业成长,提高政府资金使用效率。
2. 我国生态环境产业基金运行主要存在问题
生态环境产业基金作为地方政府投资高新产业的方式,与传统地方政府投资企业方式相比有3个特点:(1)大多数生态环境产业基金不直接投资企业,而是通过投资市场化私募基金的方式间接投资企业。由于私募基金中不止有生态环境产业基金还有其他社会资本,有限的政府基金就可以通过投资私募基金的方式撬动更多社会资本投资目标产业,起到引导市场发展方向的作用;(2)把生态环境产业基金交给市场化的基金管理人运作,实质上是借用市场力量去使用财政资金;(3)大多数生态环境产业基金的最终投向都是具有市场前景技术的战略新兴企业,而不允许投向基础设施工程类项目,与常见的PPP模式不同。
2005年后,我国参考国际的生态环境产业基金开始陆陆续续成立生态环境产业基金,基金为生态环境领域的技术创新和产业化提供了大量金融帮助,取得了不错的反响,但依然存在部分问题导致生态环境科技成果产业化进度缓慢。
2.1 生态环境产业总投资不足,参与的社会资本活跃度低
我国的生态环境产业起步较晚,在现阶段生态环境产业属于政府主导的产业,第三方市场不明朗。因为生态环境产业具有很强的公益属性,政府部门是生态环境治理技术的主要需求方,政府的政策调整对于生态环境产业发展影响难以忽视,市场发挥的调控作用有限,市场资本难以介入。市场资本力量的缺失使得生态环境产业整体上投资不足,尤其是地方的生态环境产业,且投入上整体以科研为主,研究应用投入不足。目前用于成果转化应用方面的资金缺口仍很大。多渠道筹措成果转化资金的机制尚未完全形成,经费不足成为制约成果转化的重要因素。科技成果转化的市场运行机制不畅。
2.2 研发与市场供需错位,有限资金难以投入到产业化
高等院校、科研院所等科研单位是科技成果的供给主体,但科研单位在课题设计和科研成果研发时更多关注的是研究成果的档次和水平[3],不能充分考虑成果产生后在生产上的应用状况,中间试验条件和手段缺乏[4-5]。而作为成果主要应用方的环保企业,则缺少产业化动力。大部分环保企业特别是大型企业,不是以科技进步为扩张企业或增加效益的方式,对环境技术革新基本没有需求,缺少科技成果二次研发和市场化应用的内在动力[6]。这样的研发动力和市场动力的不匹配使数量不多的资金主要集中在研发阶段和已有技术的重复建设上,资金难以分配到需要大量资金支持的中间试验阶段和产品化阶段,使得投资更显不足。并且供需双方的需求错位使自由市场上的资本也难以介入,投资热情降低,生态环境领域的第三方资本不活跃。
2.3 技术市场机制不健全,金融市场发展受限
金融市场上,科技成果转化市场机制和体系没有完全建立起来。(1)科技成果产业化体系是以公共服务体系为主,民营较少的体系,缺少科技成果转化需要的专业性人才。生态环境产业基金的专业管理人由于受到管理国有资产的限制,取得可观收益后无法如私募基金的管理人一样获得市场上同级别基金管理人的收益,可委托的基金管理人较少;(2)虽然原则上基金可以亏损,但管理过程中出现亏损难以向政府交代,所以一般投资的财务回报率并不重要,更多的是完成保值目标;(3)生态环境产业基金本质上还是由地方政府主导成立的产业基金,本质上还是地方政府的招商工具,而非纯粹的金融产品,在完成投资退出过程中还需要考虑资金流向问题,退出道路不顺畅。这3个原因使得现有生态环境基金整体不温不火。技术市场上,缺少具有收集多地信息或有针对性的第三方评估机构或中介机构。针对各地的环境现状及不同区域的财政状况等,目前生态环境产业的市场中存在许多不同的需求。由于污染源或污染程度的不同,当地企业发展对于技术的需求差异较大。而我国的生态环境产业投资中,缺少对接需求和攻击的技术中介平台,现有的技术中介机构质量参差不齐,无法对成果进行深层次的评估和咨询,难以匹配适合的场景和企业,也影响了生态环境科技成果转化成功率。对于市场的需求很难得到及时且准确的反馈,导致技术应用到中小型企业这个阶段的困难。
2.4 专利等无形资产评估转让机制尚不完善,科研人员对成果转化不积极
因为科研力量主要依赖于院校和科研机构,企业科研力量相对薄弱,技术创新能力差,所以突破性的科技成果大部分归属权都在高校和科研机构。而高校和科研院所属于事业单位,所产出的成果按照《事业单位国有资产管理暂行办法》属于国有资产[7],商业化道路涉及科技成果使用权、处置权管理机制。且专利等无形资产评估转让尚不完善,厘清复杂的使用权处置权后,在转让过程中大部分科研人员获得报酬较少,影响了科研人员在科技成果转化过程中的热情[8]。
3. 国内外科技成果产业化模式研究
3.1 美国科技成果产业化模式案例
生态环境产业基金尚处于探索阶段,借鉴国际的生态科技成果产业化基金运行模式及经验尤为重要。美国从20世纪《拜杜法案》颁布开始,出台了一系列的科技成果转化政策,为美国的科技成果转化和研发提供了优渥的土壤,科技金融和各类基金在此过程中发挥了巨大的作用,产生了大量优秀科技成果转化案例。作为金融巨头,美国的科技成果转化和生态环境金融市场相对成熟[9],其中以美国清洁水州周转基金和美国超级基金较为典型。
美国清洁水州周转基金(Clean Water State Revolving Fund,CWSRF)是美国1987年建立的基金,为美国50个州和波多黎各自治区(Puerto Rico)的水污染相关项目提供了资金支持。基金由联邦政府和州政府按照83%和17%的份额注入作为基础资金,联邦、州与地方政府互相协作,由各州政府进行投资操作,是很多环境基础设施建设的重要资金来源,被称为“环境基础设施建设银行”。目前基金运转良好,在过去的35年已经为美国社会提供了约1630亿的资金援助,为超过46200个项目提供了低息贷款,是美国历史上最成功的联邦水质基金计划。美国清洁水州周转基金,见图1。
清洁水州周转基金主要依靠向项目或企业提供低息或无息贷款,项目成功后或企业经营盈利后,资金以归还贷款和利息返还的方式回归到CWSRF基金循环中,偿还的贷款本金和利息收入被回收到各个州的CWSRF项目中,以资助新项目。基金按照优先水质相关项目的原则向其他企业或者项目分配新一轮贷款,使资金能够随着时间的推移在州一级的水质项目中完成“周转”。
CWSRF的主要目标是通过一系列的绿色工程项目,完成环境基础设施的建设、提高水资源使用效率等生态环境改善目标。各州基金通过贷款、再融资、购买或担保地方债务以及购买债券保险等各种CWSRF援助方式为水污染项目(如建设污水处理厂、点源污染溯源治理、国家河口相关工程和雨污分流工程等)提供资金。在具体贷款发放过程中,各州还可以根据需求和项目设定具体的贷款条款,比如还款利率设置范围可以从0到正常市场利率,也可以规定最多不超过30年的还款期,以便各州可以灵活地将基金的金融资源满足社会或环境需求。各州也可以自行设定项目的贷款条件,以满足小型企业或者需要政策倾斜区域的需求,或为某些类型的项目提供奖励。比如从2009年开始,美国国会授权CWSRF通过额外补贴(如赠款、本金减免和负利率贷款)为水质改善工程额外的金融援助。基金也会做一些短期投资项目来维持基金效益[10],各州还可以通过发行“平衡债券”(用周转基金中的1美元做担保发行2美元的债券)来增加可使用资金[11],吸引民间资本参与到清洁水项目的投资。
通过CWSRF参与的项目和低息贷款,企业可以通过低成本联合开发水污染技术并获得基金补助或者低成本建设水务设施,提高市场竞争力;购买债券的平民可以以相对低廉的价格购买市政债券获取更高的收益,并且当地水环境也会有所改善;政府通过企业的污染治理技术开发和水务设施建设完成环境治理任务,同时因为环境改善,需要政府投资的污染治理项目减少,所需要的财政支出也相应降低。
3.2 我国生态环境产业基金典型案例与探索
3.2.1 力合科创投资孵化基金——全链式特色金融投资和跟踪管理服务
深圳清华大学研究院主要由科研主体的清华研究院、高科技服务投资的力合科创、加速企业发展的孵化平台组成。力合科创是属于深圳清华大学研究院控股但相对独立的法人运作企业的第三方高科技投资服务机构,专门负责基金管理和股权投资,参与管理的政府引导基金或子基金有龙岗引导基金、力合天使基金、力合英飞基金和力合新能源基金。力合科创以股权投资和产业服务为手段,为科技成果转化、科技企业孵化和科技产业升级提供专业化金融服务,从而为基金出资人获取优异投资回报,为社会实现区域产业培育及产业升级。本研究以力合科创对深圳清华大学研究院的盐碱地治理改造项目的投资为研究案例,分析力合科创投资孵化基金在产业化过程中的作用。
盐碱地通过技术改良盐碱地可以大大增加可综合利用的土地面积,但利用石膏改良碱化土壤的前瞻理论因为天然石膏的物理性状不适合实际应用且成本很高,致使“石膏改良说”长期停留在理论研究阶段,无法发挥前沿科技的社会价值[12]。清华大学的徐旭常院士与陈昌和教授在该理论的基础上尝试利用工厂排放的脱硫石膏改良碱化土地并缺取得了一定实验成效。为了将该技术应用到实际盐碱地上,清华大学将技术团队部分转移至深圳清华大学研究院。深圳清华大学研究院对技术成果进行了技术评价,确认技术具有产业化前景后由深圳清华大学控股的力合科创集团有限公司评估成果,通过管理的基金投资进行技术的市场应用二次开发,协助技术完成中试和联合研发并帮助成果的宣传及融资,拓宽金融渠道。经过二次开发待技术成熟后,由清华大学牵头,力合科创集团有限公司参与,组建华清农业开发有限公司,在力合科创基金和其他产业基金的支持下,技术成果得以在示范区的效果进行产业化推广和使用,并取得了显著的效果。在力合科创的投资及帮助下,获得多轮融资。经过20年的积累,最终电厂燃煤烟气脱硫废弃物改良盐碱地的核心技术的产业化取得了经济利益和社会效应的双丰收,一方面解决了中国耕地的有效利用,另一方面也解决了火电厂所产生的脱硫废弃物。华清农业在多地建立示范基地,供投资人及社会人员观察成效,于2011与华能集团公司签署《利用脱硫副产物改造盐碱地合作协议》着手大范围改造盐碱地,目前已改善盐碱土地数万亩,并已建立了4个万亩级的示范基地,覆盖全国13个省市。
在该案例中,力合科创的投资孵化基金对接研发平台中有潜力的项目,从技术转移阶段开始的跟踪投资和金融服务,投资技术完成适应市场的二次开发,帮助生态环境科技成果转化度过困难期,并在成果具备产业化市场的推广阶段通过自身对接市场的优势聚拢企业和其他产业基金资源,为成果的后续市场化铺平道路。其独立法人运作的全链式特色金融投资和基金管理服务机构在从科研到市场化产业链中发挥了重要作用。力合科创以成果产业化为出发点,为初创企业提供规划辅导、技术或产业链对接等服务,为传统企业提供产业转型和技术升级方案,为政府建设科技创新孵化体系加速经济转型,成为在高校科研院所和企业之间、市场产品之间的科研成果桥梁。研究院借力于科技特色的金融体制创新推出了一大批拥有自主知识产权、面向市场的科技成果,加速科技成果的转化,投资培育了战略性新兴产业的多家高科技创业企业及人才。此外,力合科创集团作为投资机构独立运营,不仅投资研究院项目,也与集团内业务板块联动,针对有前景的社会上的高新技术导向项目进行投资,利用市场推出机制或股权分红转让获得收益,最后以持股的方式反哺研究院成为新的一批研发资金。
清华大学学科平台优势与力合科创的金融助力相结合,研究所也由政府科研经费为主要资本转变为承接包括政府项目、企业咨询、技术创新产品开发的市场化合约经营。力合科创也成长为助力科技成果、投资孵化科技企业,专注战略性新兴产业投资的高科技金融公司。
3.2.2 源创基金——助力二次开发的天使类基金
水体污染控制与治理科技重大专项(以下简称水专项)是根据《国家中长期科学和技术发展规划纲要(2006—2020年)》设立的16个重大科技专项之一,经过多年的研究和工程验证,已经产生了千余项前沿专利技术。目前,水专项科技成果产业化过程中,虽然困难主要在从工程化到形成产品的产品化的瓶颈阶段,但实际大部分水专项技术成果都还是专利,并没有进入验证和工程阶段。为了让技术研究发挥其社会价值,各地政府建立了许多科技平台加速生态环境科技成果转化,设立了众多生态环境产业基金,扬子江生态文明创新中心的源创基金也是其中之一。
南京扬子江生态文明创新中心是由南京市政府、江苏省政府联合南京大学共同建立的集技术研发、平台建设、产业孵化、人才培养等功能定位于一体,建成的“政—产—学—研—用—金—介”深度融合的高水平科技创新平台和创新链产业链[13]。扬子江中心目前主要的产业基金是源创基金。源创基金是由南京市科创基金(占30%)、区产业引导基金(占10%)和龙头企业联盟(占60%)共建的股权投资基金,按照市场化方式运作,以股权投资方式投向源创公司。基金筹资规模控制在1亿,分2~3期进行资金筹措,首期规模不低于总规模的20%,后续根据出资方案、投资进度和实际用款需要确定分期资金规模。基金投资期2年,每个技术项目总投资不超过400万元。天使类投资项目需具备前瞻性突破技术的原始技术创新或模式创新;项目处于二次开发试验阶段,需具备前瞻性的技术路线或前瞻性市场;水专项科技成果产业投资方式采取参股模式为主,融资担保模式为辅。
扬子江中心的源创基金主要面向就绪度较低但具备前瞻性、突破性与创新性的技术,投资标的选择处于工程化阶段或尚需二次开发的项目,主要为天使、初创期的低碳环保、绿色科技类项目。源创基金针对符合上述要求的创新项目进行投资,并由高校院所和新研机构共同组成的混合攻关团队根据市场需求进行二次开发及产业化。首先由技术专家筛选出部分符合国内环保产业前景的就绪度不足、需二次开发的优秀水专项技术,再与技术开发团队对接,探索技术实际应用前景,针对具备良好市场推广价值,以及前瞻性、先进性、创新性的技术,成立以研发团队为核心的源创公司,开展关键技术的二次开发、工程放大与应用示范,推动科技成果的转化落地并最终实现商品化和产业化。
扬子江源创基金的设立,有力推动了混合攻关团队对生态环境关键技术的二次开发、转化及产业化,支撑环保初创企业对相关核心技术、装备、材料等方面的需求,贯通科学研究、技术开发、产业孵化全链条,强化科技成果转化、知识产权共享、多元化资金投入,助力跨越环保产业科技成果转化的“死亡鸿沟”。
除源创基金外,扬子江中心设立专项科研资金,采用“拨投结合”的方式,对源创公司获得的源创基金投资金额,以最高1∶1比例匹配科研项目经费资助,共同推动生态环境关键技术成果转移转化与工程化应用。
4. 总结与建议
针对上述现状,结合国内外科技成果转化实践经验,围绕我国生态环境科技创新的薄弱环节:社会资本参与较少,行业总体投资不足;科研院所和企业人才内在驱动力不同,科研机构仅停留于论文,缺少和企业共同研发的动力,企业在能保证达标的情况下也缺少改善技术的动力;生态环境产业投资体系不成熟,对于生态环境科技成果评估缺乏成熟的第三方机构,且环保行业属于政府引导行业,政府在投资中扮演角色较重,参与环节较多,被投资企业很难保持相对独立的运作管理;专利等无形资产评估转让尚不完善,成果产业化成本较高且有潜在风险,障碍转化路径。有必要从国家层面在产业投资、人才合作、体系建设、法律法规等方面给予针对性地加强,推进完善我国生态环境科技成果产业化基金推广链条,发挥政府、企业、人才多方面作用,将“政产学研用”融合为一体。
4.1 合理分配投入资金,提高投资的广度和深度
基金分配方式上,投入更多在成果产业化,减少科研经费占投入的比重。比如拥有成熟产业化市场的美国科研经费与用于成果产业化的经费比例大约为3∶7。
从资金和政策上提供便利,鼓励发展企业运行管理的具有不同学科背景的第三方评估机构以及中介服务机构,积累第三方机构经验,完善市场机制。具有跨专业跨学科背景的第三方评估机构能结合市场了解对科技成果产业前景进行分析和估计,并从不同角度提出不同产品及适合的市场。通过协调科研机构和企业,基于市场需求和科研产品运用场景,第三方机构能沟通双方的问题更好地进行开发合作。同时在发展到一定规模的时候,中介机构可以利用资源帮助未成果化的成果联系有兴趣的企业,为科研成果提供途径,为企业提供创新技术。其次资金多层次投入,除了成熟传统环保产业外也投资创新型环保产业。主体目标首先是保证投资基金的可持续投资,经过团队评估后,投资大概率能适应市场可盈利的产品。在保证投入收益的基础上,多投资创新型科技成果产业,阶梯式投资,丰富投资层次减少风险。积累团队评估经验,发展出成熟的第三方评估机构,完善市场机制。对于高新技术成果产业化的科技企业,制定相应优惠政策,如减免相关企业前几天的税款,并为企业产品提供采购机会,为企业初期发展提供条件。
4.2 统筹科研机构和企业的创新成果内在驱动力,匹配供需
政府可以在通过项目的方式,促成高校科研院所与相关企业合作,对可能的成果和市场双方进行交流协商后提交申请。增进双方了解的同时,使科技成果在设计研究初始时对于市场有大概的估量,使之不脱离市场。同时企业对于科研成果有大致了解,便于开发应用于市场,减少二次开发投入和成本风险。
制定优惠政策吸引创业投资,鼓励本地中小型企业,投入一些大企业与中小企业合作项目或者大型企业与政府新兴科技的合作项目。加强政府企业或大型企业与新兴技术的合作,一些新兴技术可以由龙头企业带头应用,引导中小型企业对新技术的重视和应用。促进行业联盟成立,由大型环保企业牵头与中小企业共同参与,增进与科研机构的交流合作,提供交流平台和机会。
4.3 完善市场机制,扩宽融资渠道
国有资金与金融机构合作成立基金进行引导性投资,不参与企业的独立运作,降低投资风险的同时通过金融机构的信用担保机制建立良好的信用体系,促进市场成熟进程。完善专利担保和信用担保机制,允许科研成果所有方知识产权作价入股,降低中小企业融资门槛和前期投资成本,开拓专利融资渠道。建立社会和个人参与环保项目的投资渠道,让更多人参与市场,逐渐吸引资本进入行业。
从人才吸引和地方实施细则上,对于全国各地的政策需根据当地市场特色进行适当的差异化修正和完善,如在经济发展较好的省份地区积极与其他资本(如外资)开放合作,根据该地区生态环境产业特色发展相应科技成果。在部分地区涉及具体工程时可以参考PPP环保基金模式投资,捆绑高利润项目与低利润项目承包给企业,保证企业利润的同时调整了产业结构,促进行业内企业的健康发展。
4.4 改革国有知识产权归属和权益分配机制,激活科技成果转化的热情
进一步明确知识产权的法律依据,厘清、理顺与现行相关法律、条例中有关规定的关系,明确知识产权归属制度,完善发明人的权利保障机制,明确成果转化收益分配制度,形成以发明人为主体的成果转换体系和激励机制[14]。《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》提出“创新科技成果转化机制”改革国有知识产权归属和权益分配机制,扩大科研机构和高等院校知识产权处置自主权。完善无形资产评估制度,形成激励与监管相协调的管理机制",同样是希望从政策上激活科技成果转化的热情。建立知识产权和科技成果产权交易体系,坚持市场化导向,探索推行知识产权证券化金融化的道路。
-
表 1 实际水体水质参数
Table 1. Water quality parameter of actual water bodies
水质参数Water quality parameter 实际水体1Aquaculture water 1 实际水体2Aquaculture water 2 实际水体3Aquaculture water 3 pH 9.06 8.55 9.47 NH4+-N/(mg·L−1) 1.16 0.89 1.36 NO3-N/(mg·L−1) 3.84 2.68 7.85 TP/(mg·L−1) 0.11 0.28 0.49 CODMn/(mg·L−1) 15.65 13.65 17.68 表 2 基于ECOSAR软件分析评估CIP及主要氧化产物的急性毒性结果(mg ·L−1)
Table 2. Estimated acute toxicity of CIP and its intermediates using ECOSAR software (mg · L−1)
物质 Compouds 鱼Fish 水蚤Daphnia 绿藻Green algae 96h-LC50 ChV 48h-LC50 ChV 96h-EC50 ChV CIP 13100 1550 1240 81.3 1620 455 C-1 1070 122 102 6.78 130 36.9 C-2 6.04 0.212 0.850 0.082 0.505 0.189 C-3 8.17 0.313 1.12 0.105 0.702 0.258 C-4 47300 7700 4020 238 6470 1680 C-5 899 12.4 42.8 0.488 128 47.9 C-6 237000 194000 330000 30500 121000 14400 C-7 141000 29000 11100 609 20800 5120 -
[1] SU H, XU W, HU X, et al. Spatiotemporal variations and source tracking of antibiotics in an ecological aquaculture farm in Southern China [J]. Sci Total Environ, 2021, 763: 143022. [2] BURRIDGE L, WEIS J S, CABELLO F, et al. Chemical use in salmon aquaculture: A review of current practices and possible environmental effects [J]. Aquaculture, 2010, 306(1-4): 7-23. doi: 10.1016/j.aquaculture.2010.05.020 [3] YANG Y, SONG W, LIN H, et al. Antibiotics and antibiotic resistance genes in global lakes: A review and meta-analysis [J]. Environ Int, 2018, 116: 60-73. doi: 10.1016/j.envint.2018.04.011 [4] HE Z, CHENG X, KYZAS G Z, et al. Pharmaceuticals pollution of aquaculture and its management in China [J]. Journal of Molecular Liquids, 2016, 223: 781-789. doi: 10.1016/j.molliq.2016.09.005 [5] LIU X, STEELE J C, MENG X Z. Usage, residue, and human health risk of antibiotics in Chinese aquaculture: A review [J]. Environ Pollut, 2017, 223: 161-169. doi: 10.1016/j.envpol.2017.01.003 [6] CHEN H, LIU S, XU X R, et al. Antibiotics in typical marine aquaculture farms surrounding Hailing Island, South China: occurrence, bioaccumulation and human dietary exposure [J]. Mar Pollut Bull, 2015, 90(1-2): 181-187. doi: 10.1016/j.marpolbul.2014.10.053 [7] 胡冠九, 穆肃, 赵永刚, 等 南京典型县区饮用水源抗生素含量特征 [J]. 环境化学, 2015, 37(1): 192-193. HU G J, MU S , ZHAO Y G et al. Characteristics of antibiotic content in drinking water sources in typical counties of Nanjing, China [J]. Environmental Chemistry, 2015, 37(1): 192-193(in Chinese).
[8] 李兆新, 董晓, 吴蒙蒙, 等 黄海桑沟湾养殖区海水中喹诺酮类抗生素的残留状况 [J]. 海洋环境科学 2018, 37(2): 182-192. LI Z X, DONG X, WU M M, et al. Quinolone residues in seawater of aquaculture area, Sanggou bay, Yellow Sea, China[J]. Marine Environmental Science 2018, 37(2): 182-192(in Chinese).
[9] 刘晓晖. 洞庭湖流域水环境中典型抗生素污染特征, 来源及风险评估 [D]. 济南, 山东师范大学, 2017. LIU D H, Pollution level, source and ecological risk of typical antibiotics in the Dongting Lake, China [D]. Jinan, Shandong Normal University(in Chinese).
[10] LEE Y, GUNTEN U V. Oxidative transformation of micropollutants during municipal wastewater treatment: comparison of kinetic aspects of selective (chlorine, chlorine dioxide, ferrate Ⅵ, and ozone) and non-selective oxidants (hydroxyl radical) [J]. Water Research, 2010, 44(2): 555-566. doi: 10.1016/j.watres.2009.11.045 [11] ALFASSI Z B, HUIE R E, MOSSERI S, et al. Kinetics of one-electron oxidation by the ClO radical [J]. J. Phys. Chem, 1988, 32(1): 3888-3891. [12] GUO K, WU Z, SHANG C, et al. Radical Chemistry and Structural Relationships of PPCP Degradation by UV/Chlorine Treatment in Simulated Drinking Water [J]. Environmental Science & Technology 2017, 51(18): 10431-10439. [13] GREBEI J E, PIGNATELLO J I, MITCH W A, et al. Effect of halide ions and carbonates on organic contaminant degradation by hydroxyl radical-based advanced oxidation processes in saline waters [J]. Environmental Science & Technology 2010, 44(17): 6822-6828. [14] GAO Y Q, ZHANG J, LI C, et al. Comparative evaluation of metoprolol degradation by UV/chlorine and UV/H2O2 processes [J]. Chemosphere, 2020, 243: 125325, 10.1016/j. chemosphere. 2019.125325. [15] XIANG Y, FANG J, SHANG C. Kinetics and pathways of ibuprofen degradation by the UV/chlorine advanced oxidation process [J]. Water Research, 2016, 90: 301-308. doi: 10.1016/j.watres.2015.11.069 [16] KWON M, YOON Y, KIM S, et al. Removal of sulfamethoxazole, ibuprofen and nitrobenzene by UV and UV/chlorine processes: A comparative evaluation of 275nm LED-UV and 254nm LP-UV [J]. Sci Total Environ, 2018, 637-638: 1351-1357. doi: 10.1016/j.scitotenv.2018.05.080 [17] LU X, SHAO Y, GAO N, et al. Investigation of clofibric acid removal by UV/persulfate and UV/chlorine processes: Kinetics and formation of disinfection byproducts during subsequent chlor(am)ination [J]. Chemical Engineering Journal, 2018, 331: 364-371. doi: 10.1016/j.cej.2017.08.117 [18] LIU Z, LIN Y L, XU B, et al. Degradation of diiodoacetamide in water by UV/chlorination: Kinetics, efficiency, influence factors and toxicity evaluation [J]. Chemosphere, 2020, 240: 124761. [19] PAN Y, LI X, FU K, et al. Degradation of metronidazole by UV/chlorine treatment: Efficiency, mechanism, pathways and DBPs formation [J]. Chemosphere, 2019, 224: 228-236. doi: 10.1016/j.chemosphere.2019.02.081 [20] AO X, LIU W, SUN W, et al. Medium pressure UV-activated peroxymonosulfate for ciprofloxacin degradation: Kinetics, mechanism, and genotoxicity [J]. Chemical Engineering Journal, 2018, 345: 87-97. doi: 10.1016/j.cej.2018.03.133 [21] LIU H, GAO Y, WANG J, et al. The application of UV/O3 process on ciprofloxacin wastewater containing high salinity: Performance and its degradation mechanism [J]. Chemosphere, 2021, 276: 130220. doi: 10.1016/j.chemosphere.2021.130220 [22] HM A, XYA B, DC B, et al. Degradation of ciprofloxacin using UV-based advanced removal processes: comparison of persulfate-based advanced oxidation and sulfite-based advanced reduction processes [J]. Science of The Total Environment, 2020, 764: 144510. [23] CHAVES F P, GOMES G, DELLA-FLORA A, et al. Comparative endocrine disrupting compound removal from real wastewater by UV/Cl and UV/H2O2: Effect of pH, estrogenic activity, transformation products and toxicity [J]. Sci Total Environ, 2020, 746: 141041. doi: 10.1016/j.scitotenv.2020.141041 [24] LEE Y M, LEE G, KIM M K, et al. Kinetics and degradation mechanism of Benzophenone-3 in chlorination and UV/chlorination reactions [J]. Chemical Engineering Journal, 2020, 393: 124780. doi: 10.1016/j.cej.2020.124780 [25] KONG X, JIANG J, MA J, et al. Degradation of atrazine by UV/chlorine: Efficiency, influencing factors, and products [J]. Water Research, 2016, 90: 15-23. doi: 10.1016/j.watres.2015.11.068 [26] KHAN J A, HE X, SHAH N S, et al. Kinetic and mechanism investigation on the photochemical degradation of atrazine with activated H2O2, S2O8 and HSO5 [J]. Chemical Engineering Journal, 2014, 252: 393-403. doi: 10.1016/j.cej.2014.04.104 [27] STUMM W, MORGAN J J . Aquatic chemistry : Chemical equilibria and rates in naturalwaters [M]. New York : Wiley, 1995. [28] WATTS M J, LINDEN K G. Chlorine photolysis and subsequent OH radical production during UV treatment of chlorinated water [J]. Water Research, 2007, 41(13): 2871-2878. doi: 10.1016/j.watres.2007.03.032 [29] NOWELL L H, HOIGNÉ L N J. Photolysis of aqueous chlorine at sunlight and ultraviolet wavelengths—II. Hydroxyl radical production [J]. Water Research, 1992, 26: 599-660. doi: 10.1016/0043-1354(92)90233-T [30] DEBORDE M, GUNTEN U V . Reactions of chlorine with inorganic and organic compounds during water treatment--kinetics and mechanisms: A critical review [J]. Water Research. 2008, 42(1-2): 13-51. [31] BUXTON G V, GREENSTOCK C L, HELMAN W P, et al. Critical Review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals ·OH/·O− in Aqueous Solution [J]. Journal of Physical & Chemical Reference Data 1988, 17: 536-635. [32] FANG J, YUN F, SHANG C, et al. The roles of reactive species in micropollutant degradation in the UV/free chlorine system [J]. Environmental Science & Technology, 2014, 48(3): 1859-1868. [33] MATTHEW B M, ANASTASIO C. A chemical probe technique for the determination of reactive halogen species in aqueous solution: Part 1 – bromide solutions [J]. Atmospheric Chemistry and Physics, 2006, 6(1): 899-940. [34] DODD M C, SHAH A D, GUNTEN U V, et al. Interactions of fluoroquinolone antibacterial agents with aqueous chlorine: Reaction kinetics, mechanisms, and transformation pathways [J]. Environmental Science & Technology, 2005, 39: 7065-7076. [35] WAMMER K H, KORTE A R, LUNDEEN R A, et al. Direct photochemistry of three fluoroquinolone antibacterials: Norfloxacin, ofloxacin, and enrofloxacin [J]. Water Research, 2013, 47(1): 439-448. doi: 10.1016/j.watres.2012.10.025 [36] HUANG N, WANG T, WANG W L, et al. UV/chlorine as an advanced oxidation process for the degradation of benzalkonium chloride: Synergistic effect, transformation products and toxicity evaluation [J]. Water Research, 2017, 114: 246-253. doi: 10.1016/j.watres.2017.02.015 [37] XIANG H, SHAO Y, GAO N, et al. Removal of β-cyclocitral by UV/persulfate and UV/chlorine process: Degradation kinetics and DBPs formation [J]. Chemical Engineering Journal, 2020, 382: 122659. doi: 10.1016/j.cej.2019.122659 [38] YANG W, TANG Y, LIU L, et al. Chemical behaviors and toxic effects of ametryn during the UV/chlorine process [J]. Chemosphere, 2020, 240: 124941. doi: 10.1016/j.chemosphere.2019.124941 [39] ZHU Y, WU M, GAO N, et al. Degradation of phenacetin by the UV/chlorine advanced oxidation process: Kinetics, pathways, and toxicity evaluation [J]. Chemical Engineering Journal, 2018, 335: 520-529. doi: 10.1016/j.cej.2017.10.070 [40] BUXTON G V, BYDDER M, SALMON G A. The reactivity of chlorine atoms in aqueous solution [J]. Physical Chemistry, 1999, 1(1): 269-273. [41] SUN P, LEE W N, ZHANG R, et al. Degradation of DEET and caffeine under UV/chlorine and simulated sunlight/chlorine conditions [J]. Environmental Science & Technology, 2016, 50(24): 13265-13273. [42] WU Z, FANG J, XIANG Y, et al. Roles of reactive chlorine species in trimethoprim degradation in the UV/chlorine process: Kinetics and transformation pathways [J]. Water Research, 2016, 104(NOV.1): 272-282. [43] ABDALRHMAN A S, WANG C, HOW Z T, et al. Degradation of cyclohexanecarboxylic acid as a model naphthenic acid by the UV/chlorine process: Kinetics and by-products identification [J]. J Hazard Mater, 2020, 402: 123476, 10.1016/j. jhazmat. 2020.123476. [44] ZHANG T Y, LIN Y L, XU B, et al. Effect of UV irradiation on the proportion of organic chloramines in total chlorine in subsequent chlorination [J]. Chemosphere, 2016, 144(FEB.): 940-947. [45] LEE C, YOON J, GUNTEN U V. Oxidative degradation of N-nitrosodimethylamine by conventional ozonation and the advanced oxidation process ozone/hydrogen peroxide [J]. Water Res, 2007, 41(3): 581-590. doi: 10.1016/j.watres.2006.10.033 [46] A P W, B P C, C H M. Reactivity of natural organic matter with aqueous chlorine and bromine [J]. Water Res, 2004, 38(6): 1502-1513. doi: 10.1016/j.watres.2003.12.014 [47] XUE T, SHI, YONG Z, et al. Kinetics and pathways of Bezafibrate degradation in UV/chlorine process [J]. Environmental Science and Pollution Research, 2017, 25(1): 672-682. [48] BUFFLE M O, GUNTEN U V. Phenols and amine induced HO· generation during the initial phase of natural water ozonation [J]. Environmental Science & Technology, 2006, 40(9): 3057-3063. [49] LU X, SHAO Y, GAO N, et al. Degradation of diclofenac by UV-activated persulfate process: Kinetic studies, degradation pathways and toxicity assessments [J]. Ecotoxicology and Environmental Safety, 2017, 141: 139-147. [50] YANG Y, JIANG J, LU X, et al. Production of sulfate radical and hydroxyl radical by reaction of ozone with peroxymonosulfate: A novel advanced oxidation process [J]. Environmental Science & Technology, 2015, 49(12): 7330-7339. [51] KATSOYIANNIS I A, CANONICA S, GUNTEN U V. Efficiency and energy requirements for the transformation of organic micropollutants by ozone, O3/H2O2 and UV/H2O2 [J]. Water Research, 2011, 45(13): 3811-3822. doi: 10.1016/j.watres.2011.04.038 [52] DENG J, XU M, FENG S, et al. Iron-doped ordered mesoporous Co3O4 activation of peroxymonosulfate for ciprofloxacin degradation: Performance, mechanism and degradation pathway [J]. Science of The Total Environment, 2018, 658(MAR.25): 343-356. [53] DING X, YANG X, WANG P, et al. Oxygen vacancy boosted photocatalytic decomposition of ciprofloxacin over Bi2MoO6: Oxygen vacancy engineering, biotoxicity evaluation and mechanism study [J]. Journal of Hazardous Materials, 2019, 364: 691-699. doi: 10.1016/j.jhazmat.2018.10.063 [54] LUO K, YANG Q, PANG Y, et al. Unveiling the mechanism of biochar-activated hydrogen peroxide on the degradation of ciprofloxacin [J]. Chemical Engineering Journal, 2019, 374: 520-530. doi: 10.1016/j.cej.2019.05.204 [55] HU L, STEMIG A M, WAMMER K H, et al. Oxidation of antibiotics during water treatment with potassium permanganate: Reaction pathways and deactivation [J]. Environmental Science & Technology, 2011, 45(8): 3635-3642. [56] MIKLOS D B, REMY C, JEKEL M, et al. Evaluation of advanced oxidation processes for water and wastewater treatment - A critical review [J]. Water Research, 2018, 139: 118-131. doi: 10.1016/j.watres.2018.03.042 [57] LESTER Y, AVISAR D, GOZLAN I, et al. Removal of pharmaceuticals using combination of UV/H2O2/O3 advanced oxidation process [J]. Water Sci Technol, 2011, 64(11): 2230-2238. doi: 10.2166/wst.2011.079 [58] MAHDI AHMED M, CHIRON S. Ciprofloxacin oxidation by UV-C activated peroxymonosulfate in wastewater [J]. J Hazard Mater, 2014, 265: 41-46. doi: 10.1016/j.jhazmat.2013.11.034 -





 下载:
下载: