-
以传统活性污泥法为主的污水处理工艺存在能耗高、污泥产量大、温室气体排放量大等问题[1]。厌氧生物处理技术可将污水中的有机质转化为甲烷,还具有无需曝气、剩余污泥量小等优点,已成为双碳政策驱动下的污水处理研究领域的热点[2-3]。然而,由于厌氧工艺的出水具有低化学需氧量(chemical oxygen demand,COD)和低COD/N的特征,在不额外投加碳源情况下,传统的硝化反硝化工艺难以实现高效脱氮。
部分硝化/厌氧氨氧化(partial nitrification/anaerobic ammonia oxidation,PN/A)是基于氨氧化菌(ammonia oxidizing bacteria,AOB)和厌氧氨氧化菌(anammox bacteria)两种自养菌的新型污水脱氮工艺,适于处理低COD、低COD/N的厌氧工艺出水[4],可节约至少60%的曝气量,且具有剩余污泥量极少、自养脱氮过程无需外加碳源(理论上)等优势。将PN/A工艺用于高浓度含氮废水(如垃圾渗滤液)的处理,效果良好且稳定[5]。而对于低TN的城市污水,由于缺乏游离
NO−2 -N(free nitrous acid,FNA)和游离NH+4 -N (free ammonia,FA)对亚硝氮氧化菌(Nitrite oxidizing bacteria,NOB)的抑制,会导致系统产生过多NO−3 -N而出现NO−2 -N不足等问题,故PN过程难以长期高效稳定运行[6-7]。因此,探究城市污水处理中PN/A工艺的调控和优化显得尤为重要。一些研究者将厌氧生物处理与膜分离结合组成的厌氧膜生物反应器(AnMBR)与PN/A耦联,用于城市污水处理[8-10]。其中,由于在PN/A各单元中COD和氮素的转化路径与污泥形态和微生物种群结构等因素之间的相互关联机制、在低碳氮比条件下AnMBR出水有机物可能驱动的潜在部分反硝化(Partial denitrification,PD)过程[11]对
NO−3 -N强化脱除效果,以及PN/A的协同脱氮机理尚不明晰,使得该工艺的设计和运行仍缺乏切实依据。本研究以模拟城市污水AnMBR单元出水为研究对象,系统考察了HRT为10、8、6和4 h的条件下PN/A系统的脱氮性能,结合不同HRT条件下anammox段内的污泥形态结构(包括污泥粒径、荧光原位杂交(FISH)等数据)和微生物种群结构分析,并通过解析PN/A系统内典型物质的转化路径,进一步明确系统中主要的脱氮路径及其对脱氮效率的贡献,以期筛选出最优运行参数,为PN/A耦合厌氧生物处理单元的应用提供参考。
-
实验装置由1个有效体积为1.0 L的序批式反应器(sequencing batch reactor,SBR)和1个有效体积为2.3 L的上流式厌氧污泥床反应器(upflow sludge bed reactor,UASB)组成。其中,SBR中主要进行部分硝化(partial nitrification,PN)过程(以下将这部分反应器简称为“PN反应器”),以定时装置控制蠕动泵开关,实现包括进水、间歇曝气、沉淀和出水的4阶段循环,以增氧机和玻璃转子流量计实现定量曝气,曝气阶段控制溶解氧(DO)低于0.5 mg·L−1;UASB中主要进行厌氧氨氧化过程(以下将这部分反应器简称为“anammox反应器”),其内径为5 cm、非沉淀区高度为80 cm,采用连续进水、溢流出水的方式运行,且密封反应器以隔绝空气。用恒温水浴将反应器系统的温度维持在(25±1)℃。PN反应器进水为某有效体积为6 L的厌氧膜生物反应器(AnMBR)出水,具体水质指标如图1和图2所示;PN反应器的出水则进入anammox反应器,从而形成两段式PN/A系统。AnMBR出水中的荧光类物质主要包含类富里酸物质、色氨酸类蛋白质和类腐殖酸物质,以及一定量的多糖类物质[12]。该AnMBR的进水为人工模拟废水,其水质指标为COD (500±50) mg·L−1、TN (50±3) mg·L−1、总磷 (5±11) mg·L−1。该水样的主要成分有:尿素88.2 mg·L−1、乙酸钠220.6 mg·L−1、NaHCO3 800 mg·L−1、KH2PO4 21.9 mg·L−1、FeSO4·7H2O 5 mg·L−1、MgCl2·6H2O 5 mg·L−1、酵母浸膏56.8 mg·L−1、牛肉浸膏64.6 mg·L−1、酵母56.8 mg·L−1、葡萄糖220.6 mg·L−1。其中,微量元素的成分见参考文献[10]。AnMBR接种污泥取自西安汉斯啤酒厂的中温污泥厌氧消化池;PN/A反应器污泥取自西安某污水处理厂的A2O缺氧池末端。
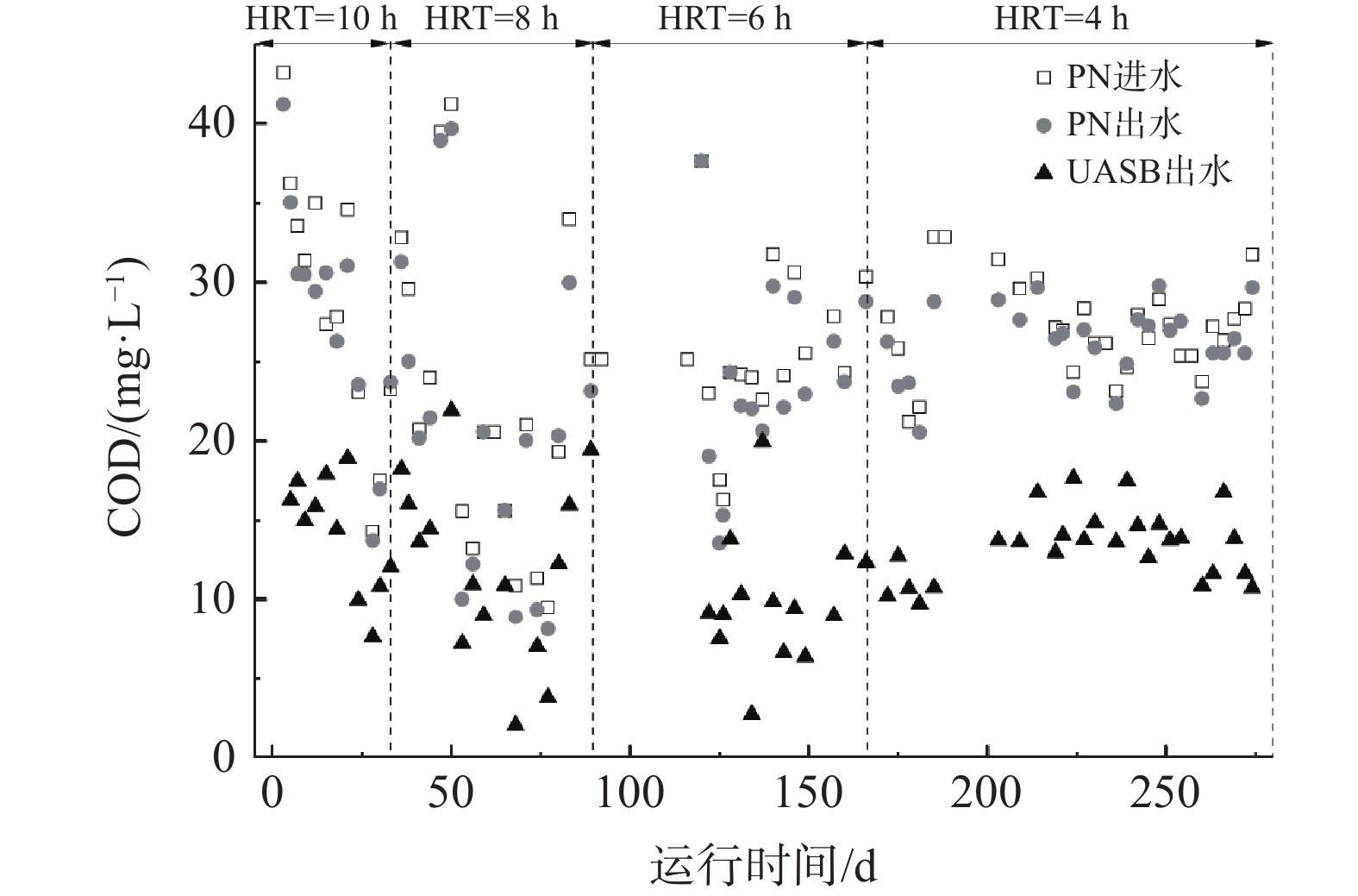
根据HRT的变化将实验分为4个阶段,其运行周期分别为1~33 d(HRT为10 h)、34~89 d(HRT为8 h)、90~166 d(HRT为6 h)及167~274 d(HRT为4 h)。
-
测定方法:COD为快速消解分光光度法;
NH+4 -N为钠氏试剂分光光度法;NO−2 -N为N-(1-萘基)-乙二胺分光光度法;NO−3 -N为紫外分光光度法。 -
1)高通量测序。在系统稳定运行期间,从anammox反应器中采集污泥样品。取均匀混合的污泥样品置于−20 ℃冰箱中保存备用。利用DNA提取试剂盒(Omega Bio-tek Inc,USA)提取样品中DNA,并选用16Sr DNA V3-V4区域的引物341F(5'-CCTACGGGNGGCWGGAG-3’)和805R(5’- GACTACHVGGGTATCTAATCC-3’)进行聚合链式反应(PCR)扩增,并将PCR扩增产物通过Sangon Biotech Co.(中国上海)的lllumina MiSeq平台进行高通量测序,分析不同条件下微生物的群落特征。
2)荧光原位杂交(FISH)。颗粒污泥采用冷冻切片机(Leica CM 1950,Germany)进行切片,杂交后的样品通过激光共聚焦显微镜(TCS SP8,莱卡)进行观察并采集图像。实验所用探针:总细菌为EUBmix(EUB338、EUBⅡ、EUB338Ⅲ、EUB338Ⅳ);厌氧氨氧化菌为anammox820。具体实验操作参考文献[13]。
3)粒径分析。先采用湿氏筛分法[14]测定污泥粒径。筛孔直径分别为 0.9、1.5、2.0和 2.5 mm。针对小于 0.9 mm 的污泥粒径,再用激光粒度分析仪(LS230/SVM+,Beckman Coulter,USA)和重量法结合分析并计算其比例。
-
Anammox反应器处于密闭状态,而PN反应器出水DO不超过0.5 mg·L−1,可忽略不计。因此,假设反应器内未发生
NO−3 -N或NO−2 -N还原反应时,只发生anammox反应;又由于PN反应器出水NO−2 -N与NH+4 -N的质量浓度之比一直小于1.32,即NO−2 -N质量浓度决定了anammox反应的脱氮上限,其理论脱氮效率可根据式(1)计算。式中:[
NO−2 -N]为PN出水中NO−2 -N的质量浓度,mg·L−1;TN为PN出水总氮,mg·L−1。 -
随着HRT从10 h降至6 h,PN/A系统的脱氮效率逐渐升高(如图1所示),且在HRT为6 h达到最大值81.3%,而出水TN基本低于16 mg·L−1。当HRT缩短至4 h时,系统脱氮效率迅速降至41.2 %。由不同阶段PN/A系统的氮素组成变化可知,在前3个阶段内,anammox出水中
NO−2 -N的质量浓度不超过2 mg·L−1,而NH+4 -N有一定剩余,表明脱氮的限制因素是NO−2 -N的不足。另外,整个实验期间PN出水的NO−3 -N质量浓度均稳定在较低水平(小于8 mg·L−1)。这是由于在低HRT、低溶解氧环境下,NOB的活性稳定持续地受到控制。 -
PN/A系统进水为AnMBR出水,COD为(24.7±6.8)mg·L−1。自HRT为8 h开始,anammox反应器出水COD都稳定低于20 mg·L−1。相比进水的变化,PN出水COD始终未出现波动。这可能是由于PN内DO与HRT相对较低,而PN/A系统内COD的去除主要发生在anammox反应器内。考虑到该系统为COD与
NO−3 -N共存的厌氧环境,推测COD的主要去除途径可能是反硝化过程。 -
控制较低COD/N、保持适宜的有机物种类可促进PD过程发生[15]。由图3(a)可知,anammox反应器进水的
NO−2 -N与NH+4 -N质量浓度之比([NO−2 -N]/[NH+4 -N])在大多数时间内都远低于anammox反应理论所需的1.32[16]。而计算结果表明,anammox段理论脱氮效率(假设anammox反应器内仅发生anammox反应)远低于实际脱氮效率,这意味着该反应器内可能发生了除anammox反应外的可提供NO−2 -N的反应,如PD反应。另外,由于anammox反应器内的[NO−3 -N]与[NH+4 -N]变化量的绝对值之比(Δ[NO−3 -N]/Δ[NH+4 -N])远远低于anammox反应的理论值0.26,即系统内NO−3 -N的确被部分转化,也进一步验证了PD过程的发生。本研究中,平均COD/N始终维持在0.40~0.55。由于部分反硝化(PD)过程的最佳COD/N大约为2.0~3.5[11],此时
NO−2 -N还原受抑制而NO−3 -N还原速率较高,从而可实现NO−2 -N的积累。然而,本研究中COD/N远低于该范围,即理论上来说对NO−2 -N还原的抑制会更强;另一方面,碳源不足也导致NO−3 -N的还原速率维持较低状态,但足以辅助anammox反应实现脱氮,并在anammox反应器进水[NO−2 -N]/[NH+4 -N]低于1.32的情况下,可将脱氮效率提升至最高水平(约81.3%)。 -
当HRT为8、6和4 h时,在anammox反应器中,与氮转化相关及相对丰度高于1%的属水平下微生物相对丰度如图4所示。其中,anammox菌主要为Candidatus Brocadia属,当HRT为8、6 h时,其相对丰度分别为1.79 %、5.32 %。这表明HRT的缩短和氮负荷的提升可促进Candidatus Brocadia的富集。而在HRT为4 h时,属于AOB的Nitrosomonas、Nitrosospira和属于NOB的Nitrospira相对丰度有所提升,则意味着溶解氧随进水被引入使得DO增大。另外,属于反硝化菌的Denitratisoma相对丰度随HRT的缩短而升高,意味着在HRT为6 h时污泥的反硝化能力增强可能是脱氮效率提升一个重要因素。当HRT为4 h时,Candidatus Brocadia和Denitratisoma的相对丰度又进一步提升,分别为16.25 %和3.54 %,而此时脱氮效率相比HRT为6 h时明显下降。这表明该系统内微生物的相对丰度与系统性能之间的关系可能较为复杂,还需要从微生物在污泥内的分布等角度进行深入分析。
-
当HRT分别为8、6和4 h时,anammox反应器下端污泥粒径质量分布变化如图5所示。随着HRT的增大和反应的进行,anammox反应器内粒径小于0.2 mm的絮体污泥的占比持续大幅减少,这说明污泥一直处在快速颗粒化的过程中。然而,当HRT为4 h时,粒径大于0.9 mm的污泥占比却从HRT为6 h时的13.7 %降至10.5 %。有研究证明,anammox颗粒的粒径大小与反应器内水力剪切力存在平衡关系,较大的剪切力会导致污泥粒径的降低[17-18]。随着HRT的提升,anammox内的上升流速也随之增大,从HRT为6 h时的0.28 m·h−1增至HRT为4 h时的0.42 m·h−1。与相关研究中约0.5m·h−1的UASB上升流速[19-20]相比,该数值虽不高,但HRT由6 h减小至4 h的短期内上升流速增加了约50%,说明即使上升流速绝对值较小,其变动速率过大,也可能会对粒径污泥的结构造成破坏。
FISH图像(图6)表明anammox菌更加倾向于生长在颗粒的内侧,且颗粒污泥内部存在明显的孔道结构。通常认为,anammox颗粒污泥的空间结构是外围生长AOB、NOB及异养菌,而anammox菌生长在内部以避免不良环境的影响,比如高DO的冲击等[21-23]。另外,anammox颗粒污泥的内部孔道又提供了物质交换通道,在一定程度上提升了颗粒内部微生物的代谢速率上限。当HRT从6 h降至4 h后,污泥粒径受到的冲刷作用变强,可能导致颗粒内部的anammox菌直接暴露在液相环境中,而更强的水力冲刷本身也会导致固液界面传质阻力下降,从而增大了不利环境因素的冲击风险。
在HRT分别为10 h和8 h的工况下,进水氮负荷过低导致anammox菌等功能菌相对丰度较低,且污泥粒径较小,限制了系统的脱氮效率。在HRT为6 h时,氮负荷的上升导致anammox菌相对丰度上升,并且在适宜的上升流速下污泥粒径也明显增大,优化了anammox菌的生存环境。当HRT为4 h时,由于进水氮负荷的提升和长期的富集作用,anammox菌的相对丰度虽比之前发生了突跃,已达到最大值16.25%,但系统脱氮效率相比HRT为6 h时却明显下降。这可能是由于上升流速提升使得污泥结构受到破坏,且反应器内高度沿程的污泥分布被扰乱。随后,更多微生物暴露于DO较大的液相环境中,导致anammox菌活性受到抑制[23]。以上因素使得系统很难达到较好的脱氮效率。
-
PN/A系统在HRT为6 h时获得了最高的脱氮效率。该阶段氮素和COD的转化路径如图7所示。PN反应器进水含50 mg·L−1的
NH+4 -N,在AOB作用下占TN 54%的NH+4 -N被转化为NO−2 -N,仅有10.6 %TN被转化为NO−3 -N;相比而言,PN进水COD(约24 mg·L−1)仅有8.4%被消耗,剩余的91.6%均进入anammox反应器。在anammox反应器内,anammox反应(主要参与的菌群为Candidatus Brocadia菌,相对丰度5.32 %)作为主反应分别消耗了37.6%NH+4 -N和49.6%NO−2 -N,产生了9.6%NO−3 -N(均以进水TN计),脱除了77.4%的TN。此外,在anammox反应器内还发生了PD反应(主要菌群为Denitratisoma菌,相对丰度为1.68%),消耗了占进水TN10.8%的NO−3 -N和26.3%进水COD并补充了NO−2 -N,提升了PN/A系统的脱氮效率。在城市污水处理中,anammox反应器内的PD反应降低了PN/A系统对于前端PN反应的依赖度,从而有效提升了整个系统的稳定性。 -
1) COD在anammox反应器内驱动的PD过程使得anammox反应最终代谢产物
NO−3 -N被转化为NO−2 -N,并再次成为anammox反应的基质,从而提高了系统的脱氮效率。2) UASB形式的anammox反应器内功能菌的相对丰度和污泥结构共同决定系统脱氮性能。随着HRT的缩短,氮负荷增加促进Anammox菌富集,但过短的HRT引发反应器内水力冲刷过强可能会导致污泥形态破坏并使得脱氮效率降低。
3)在PN/A系统HRT为6 h条件下,anammox反应器内氮负荷与水力冲刷2个因素达到平衡点,使得系统可实现最高81.3 %的脱氮效率。
部分硝化/厌氧氨氧化(PN/A)工艺对城市污水厌氧处理单元出水的强化脱氮效果
Enhanced nitrogen removal efficiency of partial nitrification/anaerobic ammonia oxidation (PN/A) on the effluent of municipal wastewater anaerobic treatment unit
-
摘要: 为探究部分硝化/厌氧氨氧化(PN/A)工艺对城市污水厌氧处理工艺出水的强化脱氮效能,以厌氧膜生物反应器(AnMBR)出水为研究对象,比较了不同水力停留时间(HRT)下(10、8、6和4 h),PN/A系统的脱氮效率、代谢路径及微生物群落及结构特征。结果表明:随着HRT的逐渐降低,PN/A系统的脱氮效率呈现先升高后降低的趋势;HRT为6 h时脱氮效率达到最高,为81.3%;在稳定运行期间,出水TN和COD分别低至(11.97±2.44 mg)·L−1和(9.98±3.42) mg·L−1;随着HRT缩短至4 h,anammox菌丰度随着氮负荷升高而有所提升,但水力冲刷过强破坏污泥形态等原因导致了系统脱氮效率的下降。通过对系统内COD与氮素转化的核算可知,厌氧氨氧化段内发生的部分反硝化(PD)过程是使系统脱氮效率明显提升的根本原因,而HRT为6 h时大约19%的
NO−2 -N由PD提供。本研究证明了PN/A系统作为城市污水主流脱氮工艺的可行性,可为该系统的应用提供参考。-
关键词:
- 部分硝化/厌氧氨氧化 /
- 部分反硝化 /
- 水力停留时间 /
- 代谢路径 /
- 微生物群落结构
Abstract: In order to explore the enhanced nitrogen removal efficiency of partial nitrification/anaerobic ammonia oxidation (PN/A) process on the effluent of municipal wastewater anaerobic treatment process, the effluent of anaerobic membrane bioreactor (AnMBR) was taken as the research object, and the nitrogen removal efficiency, metabolic path, microbial community and structure characteristics of PN/A system under different hydraulic retention times (HRT) (10, 8, 6 and 4 h) were compared. The results showed that with the gradual decrease of HRT, the nitrogen removal efficiency of PN/A system increased first and then decreased. When HRT was 6 h, the nitrogen removal efficiency reached the highest, which was 81.3%. During stable operation, the total nitrogen (TN) and total chemical oxygen demand (COD) in effluent were as low as (11.97±2.44) mg∙L−1 and (9.98±3.42) mg∙L−1, respectively. With the reduction of HRT to 4 h, the abundance of anammox bacteria increased with the increased of nitrogen load, while the nitrogen removal efficiency of the system decreased due to strong hydraulic scouring and destruction of sludge morphology. According to the calculation of COD and nitrogen conversion in the system, partial denitrification (PD) process in the Anammox section was the fundamental reason for the significant improvement of nitrogen removal efficiency of the system, about 19% ofNO−2 -N was provided by PD process when the HRT was 6 h. The research results proved the feasibility of PN/A system as the mainstream nitrogen removal process of municipal wastewater, which can provide reference for the application of the system. -
农药在现代农业中应用广泛,是提高质量和产量的有效和经济途径,从而确保全球不断增长的人口的粮食安全,因此农药成为农业生产的必需品[1]. 然而,随着农药广泛的使用很可能进入水体和土壤等环境介质中,造成环境中出现大量的农药残留[2 − 3]. 有机杀虫剂——杀线威(oxamyl, OXA)、残杀威(propoxur, PRO) 和敌百虫(dipterex, DIP)在国内外都有着较长的使用历史,且是化学性质稳定的持久性有机污染物,在环境中的残留量较大[4 − 5],如Hussain等[6]测定牛奶液体中OXA的检测量为0.031 ng·mL−1;Guarda等[7]在水中检测出中PRO含量为
0.0255 μg·L−1;Paul等[8]在养殖水体中检测出DIP的残留量为0.18 ng·mL−1. 由于有机杀虫剂往往具有长期生物毒性和生物累积性,不仅会对环境中空气、水、土壤和作物产生危害,还会对环境中的生物产生巨大的危害,其中包括鸟类、鱼类、益虫等非靶标生物. 如An等[9]发现OXA对斑马鱼的发育具有毒性作用;Gonçalves等[10]发现PRO对淡水鱼的氧化应激生化反应有影响. 然而,杀虫剂在水中的溶解度高,进入水生生态系统中往往不是以单一形式存在,通常是以多种药物混合构成复杂的混合体,并随着长期的接触和积累使其相互作用,对水生生态系统造成更大的潜在威胁. Feng等[11]发现四环素和聚苯乙烯纳米颗粒对海洋微藻有联合毒性作用,张小旭等[12]发现3种氟喹诺酮的联合毒性比单一毒性强.目前已有关于杀虫剂对目标污染物虫类的毒性研究[13],然而少有研究有机杀虫剂对非目标污染物蛋白核小球藻(Chlorella pyrenoidosa, C. pyrenoidosa)的联合毒性. C. pyrenoidosa作为一种低营养级水生生物,是水生食物链的基础,由于其分布广、生成时间短、易于观察和对污染物的敏感性,它已被广泛地选择为生态毒理学测定的指示生物之一,对水生生态系统的平衡起着至关重要的作用[14]. 如卞志强等[15]研究了C. pyrenoidosa在氨基甲酸酯类农药胁迫下的联合毒性作用,Hund-Rinke等[16]研究了纳米材料与藻类的相互作用,并预测了其生态毒性.
综上所述,本文拟采用C. pyrenoidosa为指示生物,以3种常见的有机杀虫剂:杀线威(OXA)、残杀威(PRO) 和敌百虫(DIP)作为目标污染物,采用适当的方法设计农药的二元(OXA-PRO、OXA-DIP和PRO-DIP) 和三元(OXA-PRO-DIP) 混合物体系,应用时间微板毒性分析法(time-dependent microplate toxicity analysis, t-MTA)测定单一杀虫剂和混合物在不同时间和浓度的毒性,并绘制偏离浓度加和模型的绝对残差 (deviation from CA, dCA) 模型的三维曲面图分析混合物体系毒性相互作用. 通过分析暴露前后C. pyrenoidosa中叶绿素 (a和b)和蛋白质含量,以及超氧化物歧化酶(superoxide dismutase, SOD)活性和脂质过氧化物丙二醛(malondialdehyde, MDA)累积量,初步揭示杀虫剂对C. pyrenoidosa的致毒机制.
1. 材料与方法(Materials and methods)
1.1 试剂与仪器
选取常用于农业的3种有机合成杀虫剂:杀线威(OXA)、残杀威 (PRO) 和敌百虫(DIP),纯度均在99%以上,购于国药集团化学试剂有限公司. OXA和DIP两种药物的理化性质及储备液浓度见参考文献[17],PRO的理化性质及储备液浓度如表1所示. 所有药品的储备液配制均采用超纯水,用棕色玻璃瓶将其储存并放于4 ℃冰箱中备用.
表 1 残杀威的理化性质及Weibull函数的毒性拟合数据Table 1. Physical and chemical properties of propoxur and toxicity fitting data by Weibull function杀虫剂Pesticide 简称Abbreviation 分子式Molecularformula CAS-号CAS number 分子量Molecularweight 储备液浓度/(mol·L−1)Stock solution concentration 时间/hTime 拟合参数Fit parameters 统计学参数Statistical parameters EC50/(mol·L−1) pEC50 α β RMSE r 残杀威Propoxur PRO C11H15NO3 114-26-1 209.24 4.78×10−4 12 3.63 1.27 0.031 0.9639 7.13×10−4 3.15 24 3.49 1.13 0.044 0.9531 3.87×10−4 3.41 48 6.49 1.66 0.088 0.9527 7.41×10−5 4.13 72 9.76 2.36 0.092 0.9667 5.12×10−5 4.29 96 14.98 3.53 0.074 0.9874 4.49×10−5 4.35 注:α是位置参数,β是斜率或曲率参数; RMSE是均方根误差,r是相关系数; EC50 是半数效应浓度; pEC50 是EC50的负对数. Note: α is a positional parameter, β is a slope or curvature parameter; RMSE is the Root-mean-square deviation, and r is the determination coefficient; EC50 is the half effect concentration; pEC50 is the negative logarithm of EC50. 所用实验仪器有ESJ182-4 万分之一电子天平 (沈阳龙腾电子有限公司)、MGC-250 光照培养箱 (上海一恒科学仪器有限公司)、Genex 系列移液器 (宝予德(中国) 有限公司)和Synery-2 酶标仪 (美国伯腾仪器有限公司)等.
1.2 受试生物及藻种培养
实验选用指示生物蛋白核小球藻(C. pyrenoidosa),购自中国科学院典型培养物保藏委员会淡水藻种库(FACHB),编号为FACHB-5,实验采用BG11培养基进行培养. 培养基的配制和藻的具体培养方法参考文献[18].
1.3 时间微板毒性分析法
杀虫剂的单一毒性和联合毒性数据均采用时间微板毒性分析法 (t-MTA)[19]获得. 实验载体选择为96孔透明微板. 采用0.6的稀释液因子对污染物进行12个浓度梯度的设计,在微孔板中加入等量不同浓度梯度的药物,再加入等量处于对数生长期的藻液,空白对照设计在微孔板中间两列加入等量超纯水与藻液,为了减少误差实验组设计3组平行. 然后置于光照培养箱中培养,具体培养方法参考文献[20]. 最后在5个暴露时间(12、24、48、72、96 h)应用酶标仪测定微板各孔的吸光度(OD=683 nm),采用抑制率E来表示毒性结果,其数学表达式(1)如下:
stringUtils.convertMath(!{formula.content}) (1) 式中,OD0和OD分别为空白和实验组的C. pyrenoidosa吸光度.
1.4 混合物设计
由于直接均分射线法(direct equipartition ray, Equray)[21]可以全面的表证二元混合物体系的浓度分布且全面考察二元混合物毒性变化,因此选择3种药物EC50的浓度设计出二元(OXA-PRO、OXA-DIP和PRO-DIP) 混合物体系,每个体系包含5条射线(R1、R2、R3、R4、R5). 直接均分射线法只适用于二元混合物,而均匀设计射线法(uniform design ray, UD-Ray) [22]适用于考察三元及三元以上混合物毒性变化. 因此,选择3种药物5个效应浓度(EC10、EC20、EC30、EC40、EC50)设计出三元 (OXA-PRO-DIP) 混合物体系的5条射线. 混合体系各个混合物射线的组分浓度比 (pi) 值如下表2所示.
表 2 杀虫剂4组混合体系组分及浓度比Table 2. Composition and concentration-ratios (pi) of four mixture systems of insecticides射线Rays OXA-PRO OXA-DIP PRO-DIP OXA-PRO-DIP pOXA pPRO pOXA pDIP pPRO pDIP pOXA pPRO pDIP R1 0.790 0.2.10 0.320 0.680 0.385 0.615 0.022 0.088 0.890 R2 0.601 0.3.99 0.159 0.841 0.200 0.800 0.082 0.274 0.644 R3 0.429 0.5.71 0.086 0.914 0.111 0.889 0.056 0.041 0.903 R4 0.273 0.727 0.045 0.955 0.059 0.941 0.121 0.141 0.738 R5 0.131 0.869 0.018 0.982 0.024 0.976 0.077 0.103 0.820 1.5 毒性数据拟合
通过测定不同时间和浓度的单个和混合药物对C. pyrenoidosa的毒性得到时间-浓度-效应数据,采用相关系数(correlation coefficient, R)或均方根误差(root mean square error, RMSE)合适的两参数 (α和β)非线性函数 Weibull函数对浓度-效应数据进行非线性最小二乘拟合[23 − 25],具体数学表达式见式 (2). 从而得到时间-剂量-效应曲线(time-concentration-response curves, t-CRCs). 采用CRCs的 95% 观测置信区间(Observation-based confidence interval, OCI) 评估数据的不确定度.
stringUtils.convertMath(!{formula.content}) (2) 式中,α表示位置参数,β表示斜率或曲率参数;C表示单个污染物或混合物的浓度, mol·L−1.
1.6 混合物毒性相互作用分析
浓度加和(concentration addition, CA)模型[26 − 27]用于评估毒理学相互作用和预测混合物毒性,但CA模型只能实现对混合物毒性相互作用的定性评估. 为了定性定量评估各种混合物在不同时间和浓度作用下的相互作用动态变化,对混合物浓度加和(CA) 模型进行适当的改变,得到偏离CA模型的绝对残差(deviation from CA, dCA)模型. dCA处于95%的置信区间之上、之内和之下时,分别表示混合物体系为拮抗、加和和协同作用,且dCA的绝对值越大说明混合体系的相互作用越强. 因此本文采用以dCA模型定量描述混合物不同浓度和时间的毒性相互作用强度. dCA模型和95%的置信区间dOCI的数学表达式分别见 (3)和(4)如下:
stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) 式中,EPRD为以CA模型为基础的某指定效应,EOBS为该效应下对应效应的预测浓度下的观测效应.
1.7 生理生化指标的测定
1.7.1 超氧化物歧化酶(SOD)和脂质氧化产物丙二醛(MDA) 测定
取暴露于杀虫剂96 h后的40 mL藻液,进行离心、洗涤、裂解和再离心等,得到上清液进行低温保存待测,具体实验方法参考文献[17]. 对于SOD 的活性和MDA 的含量分别采用购自biosharp生物公司的总SOD活性检测试剂盒(WST-8法)和MDA含量检测试剂盒检测. 具体测定方法参考试剂盒说明.
1.7.2 叶绿素含量a、b测定
叶绿素含量的测定采用丙酮萃取法,取暴露于杀虫剂96 h后的5 mL藻液进行离心,加入80%的丙酮,然后振荡放于4 ℃黑暗中静置后再离心,最后用紫外分光光度计测定其吸光度值 (OD= 645 nm和663 nm),具体实验方法参考文献[28]. 将所得吸光值代入光合色素含量数学表达式(5)和 (6)如下:
stringUtils.convertMath(!{formula.content}) (5) stringUtils.convertMath(!{formula.content}) (6) 式中,A645和A663分别表示提取液在645 nm和663 nm处吸光度值.
1.7.3 蛋白总含量测定
取暴露于杀虫剂96 h后的20 mL藻液,进行离心、破碎、加入适量PBS缓冲液再离心,得到上清液,用紫外分光光度计测定吸光度值(OD=260 nm和280 nm),具体实验方法参考文献[29]. 将测得吸光值代入蛋白质含量数学表达式(7)如下:
stringUtils.convertMath(!{formula.content}) (7) 式中,A280和A260分别表示提取液在280nm、260nm处吸光度值.
1.7.4 扫描电子显微镜制样
取3种杀虫剂及其混合物中拮抗作用明显的射线对C. pyrenoidosa进行实验,取暴露96 h后的40 mL藻液,进行离心、冲洗、过夜固定、再冲洗和脱水,最后冷冻干燥和喷金制作成样本进行电镜扫描观察细胞形态变化,具体实验方法参考文献[20].
2. 结果与讨论(Results and discussion)
2.1 杀虫剂对C. pyrenoidosada单一毒性
PRO杀虫剂的时间-浓度-效应曲线(t-CRCs) 如图1所示,OXA和DIP两种杀虫剂的t-CRCs曲线见参考文献[17]. 由图1和文献[17]可知, 3种杀虫剂对C. pyrenoidosa的毒性均随着暴露时间的增加呈现逐渐增大的规律,即表现出毒性的时间依赖性. 此外,3种杀虫剂均在低浓度区域对C. pyrenoidosa毒性较低,而在中高层浓度区域毒性显著增加,且随着浓度的增加呈现增大规律,即表现出浓度依赖毒性. 这说明3种杀虫剂在环境中的残留达到一定浓度和时间后会产生明显的毒性. 以3种杀虫剂对C. pyrenoidosada暴露时间的测试终点96 h下的毒性指标(pEC50)为毒性大小判断依据,其毒性大小排序为 OXA(pEC50=4.47)>PRO(pEC50=4.35)>DIP(pEC50 = 3.45) (见表1和文献[17]).
2.2 三种杀虫剂对C. pyrenoidosa的联合毒性
2.2.1 二元和三元混合物时间依赖毒性
以pEC50为毒性指标绘制5个暴露时间点下二元和三元混合物体系共20条射线的热图,如图2所示,图中颜色越深表示毒性越大.
由图2可知,在12—72 h时毒性变化较大,在76—96 h时毒性变化较小,呈现3种杀虫剂混合体系5条射线的毒性强度随暴露时间的延长先增加后趋于稳定,这与杀虫剂的单一毒性表现相似. 由图2还可知,同一射线下杀虫剂混合体系对C. pyrenoidosa的毒性大小随着暴露时间的不同而表现出不同. OXA-PRO二元混合体系5条射线pEC50在12—72 h时随着暴露时间延长而增加,各暴露时间节点的毒性大小排序:72 h-pEC50>48 h-pEC50>24 h-pEC50>12 h-pEC50. 而另外的两组二元 (OXA-DIP和PRO-DIP)与三元 (OXA-PRO-DIP)混合体系的5条射线毒性大小基本随暴露时间的增加而变大,即呈现出时间依赖毒性,各暴露时间节点的毒性大小排序:96 h-pEC50>72 h-pEC50>48 h-pEC50>24 h-pEC50>12 h-pEC50. 这说明二元和三元混合物体系均呈现时间依赖毒性. 张静等[29]研究中也表明了抗生素对绿藻具有时间依赖毒性.
2.2.2 二元和三元混合物组分浓度比依赖毒性
由图2可知,同一暴露时间下杀虫剂混合体系对C. pyrenoidosa的毒性大小也随着组分浓度比的不同而表现出不同. 以最终暴露时间96 h下的pEC50值为毒性指标,OXA-DIP和PRO-DIP混合体系毒性分别与表2中pOXA和pPRO有明显的关系,随着pOXA和pPRO的减小,pEC50值也在逐渐变小,即呈现组分浓度比依赖毒性效应,其5条射线的毒性依次排序为:R1>R2>R3>R4>R5. 曾健平等[30]研究中也发现氨苄西林钠抗生素在二元混合物中对大肠杆菌具有组分浓度比依赖毒性. 而OXA-PRO混合体系的毒性在最终暴露时间点96 h时无法直接看出与某一药物的组分浓度比有关,但在最终暴露时间之前的24—72 h之内,与表2结合可以看出与pPRO有关. 此外,由图2 (a) 与表1和参考文献[17]中最终暴露时间点96 h的pEC50值可知,OXA-PRO混合体系各射线的毒性(pEC50(R1)=4.17、pEC50(R2)=4.22、pEC50(R3)=4.17、pEC50(R4)=4.29和pEC50(R5)=4.20) 均小于两种杀虫剂对C. pyrenoidosada单一毒性(pEC50(OXA)=4.47和pEC50(PRO)=4.35). 三元 (OXA-PRO-DIP)混合体系毒性大小变化虽不能直接看出与某单一药物浓度比有关,但结合表2混合物体系中pOXA和pPRO之和,可确定其毒性与组分浓度比有关.
为了更直观分析混合体系组分浓度比与毒性的相关性,结合表2中混合物体系各组分的浓度占比计算混合物不同暴露时间的pEC50与组分浓度比之间的皮尔逊相关系数,并绘制相关性分析图,如图3所示.
由图3可知,OXA-PRO混合体系毒性大小与pPRO比呈现正相关,与pOXA呈现负相关,其中在24—48 h时,混合物体系毒性大小与两种药的浓度占比均呈现显著相关(P< 0.05). 且在24—96 h暴露时间内,相关性系数随着时间的延长而减小,其中相关系数最大值为0.9. 另外两组二元 (OXA-DIP和PRO-DIP)混合体系毒性大小分别与pOXA和pPRO均呈现正相关,均与pDIP呈现负相关, 其在48—96 h时,混合物体系毒性大小与两种药的浓度占比均呈现显著相关,随着混合物对C. pyrenoidosada暴露时间的延长相关系数逐渐增大,其相关系数最大值为1.0. 三元混合物体系毒性大小与pOXA和pPRO之和呈现正相关,与pDIP呈现负相关. 在24—96 h时,混合物体系毒性大小与三种药的组分浓度比均呈现显著相关,且相关性系数随着时间的延长而增大,其相关系数最大值为0.98. 这也说明二元和三元混合物体系均呈现显著的组分浓度比依赖毒性. PRO和OXA在混合物体系中对藻的毒性影响起主要作用,而DIP对C. pyrenoidosada的毒性影响较小.
综上所述,OXA与PRO这两种药物对环境危害大于DIP,且在混合体系中也表现主要的毒性,但OXA-PRO混合物体系对藻的毒性均小于单一毒性,OXA-DIP与PRO-DIP混合体系对藻的毒性均大于DIP单一药物的毒性小于对应的另一种药物,这说明同类药物之间可能发生反应,降低其毒性. 污染物对C. pyrenoidosada的毒性不仅与其种类数量有关,还与污染物在环境中暴露时间和组分浓度比有关. 因此,在对环境污染物的风险评估中,不仅要考虑单一污染物时间和浓度,还要考虑混合污染物的时间和组分浓度比因素.
2.3 三种杀虫剂混合体系对C. pyrenoidosada毒性相互作用
由CA模型拟合数据,计算出三种杀虫剂的二元和三元混合物体系各射线在不同暴露时间节点的dCA值,并绘制二元和三元混合物体系dCA三维曲面图,如图4所示. 上下置信曲面外的绿色和橘色分别代表着拮抗和协同作用区域,随着相互作用的增强(dCA绝对值的增大),dCA三维曲面与上下置信曲面的截面面积越大.
由图4(a)可知,OXA-PRO二元混合体系R1、R3射线,在最终暴露时间96 h时,dCA三维曲面位于上置信曲面之外,则呈现明显拮抗作用;在24—72 h时,dCA三维曲面位于上下置信区间曲面内,则呈现加和作用. R2、R4和R5射线在24—96 h均呈现加和作用. 由图4(b) 可知,OXA-DIP二元混合体系R1射线,在96 h时,呈现明显拮抗作用;在24—72 h时,则呈现加和作用. R2、R3、R4和R5射线在24—96 h均呈现加和作用. 图4(c) 可知,PRO-DIP二元混合体系R2、R3、R4和R5射线,在96 h时,则呈现明显拮抗作用;在24—72 h时,则呈现加和作用. 而R1射线在24—96 h均呈现加和作用. 由图4(d) 可知,OXA-PRO-DIP三元混合物体系除R4射线之外的R1、R2、R3和R5射线在24—72 h时呈现加和作用;在96 h时,均呈现拮抗作用. 而R4射线在在整个暴露时间内呈现加和作用. 然而,所有呈现加和作用的射线在最终暴露时间96 h时均有向上置信曲面偏离趋势,即这些射线的联合毒性作用表现为拮抗作用趋势.
由图4还可知,二元和三元混合物体系的拮抗作用强度也均随着时间的延长而增大,即拮抗作用具有时间依赖性. 从最终暴露时间(96 h) 可知,所有二元和三元混合物体系共20条射线均在中浓度区域呈现拮抗作用,而在低浓度和高浓度区域呈现加和作用. 三组二元混合物体系呈现拮抗作用,并且三元混合物体系也呈现拮抗作用,这可以说明3种杀虫剂的拮抗作用具有传递性. 杀虫剂的二元和三元混合体系5条射线的组分浓度比不同拮抗作用强度也不同,但在最终暴露时间点96 h下均表现拮抗作用. 由以上结果可说明药物的暴露时间、混合物浓度和混合物组分浓度比对C. pyrenoidosada的联合毒性作用均有所影响. 其影响可能是由于在暴露初期3种杀虫剂对藻细胞联合毒性作用不同,藻细胞暴露于混合物体系中时,不同药物共同对C. pyrenoidosada发挥作用则呈现联合毒性加和作用;而达到一定暴露时间(72 h之后) 暴露藻细胞的结合位点已被占据,不同药物对藻细胞的作用出现竞争,混合物体系对C. pyrenoidosada的联合毒性作用呈现拮抗作用. 由三组二元混合物体系的dCA三维曲面图的置信区间的截面积可知,PRO-DIP二元混合体系拮抗强度大,说明PRO与DIP对藻细胞联合作用有明显的竞争.
2.4 三种杀虫剂胁迫下C. pyrenoidosa的致毒机理
本研究选择3种杀虫剂及其混合物体系中对C. pyrenoidosa拮抗作用明显的射线作为机理实验浓度,且选择最终暴露时间96h对C. pyrenoidosa的蛋白质、蛋白质溶出、叶绿素(a和b)、SOD和MDA等含量进行观测,以此来初步分析杀虫剂对C. pyrenoidosa的致毒机理.
2.4.1 杀虫剂及其混合物对C. pyrenoidosa的蛋白质含量和蛋白质溶出量的影响
蛋白质是细胞膜的重要组成成分,包括各种离子通道、信号分子的受体、各种功能酶、转运蛋白等,蛋白质不仅是C. pyrenoidosa构成细胞结构的材料也是各种反应进行的催化剂,因而是细胞生命代谢变化的重要生理生化指标[31]. 本研究测定了C. pyrenoidosa暴露于3种杀虫剂96 h后,藻细胞中蛋白质含量和蛋白质溶出量的变化,如图5所示.
由图5可知,空白对照组蛋白质含量最高,而C. pyrenoidosa在药物暴露的实验组蛋白质含量明显减少,这可能是由于C. pyrenoidosa在多种药物胁迫下细胞中相关蛋白质的合成不足或降解氨基酸的速率增加[32]. 其中OXA、DIP、PRO单一药物的蛋白质含量抑制率分别为0.280、 0.364和 0.242,OXA-PRO、OXA-DIP、PRO-DIP、OXA-PRO-DIP混合物药物体系抑制率分别为 0.484、 0.476、 0.483和 0.511,混合物体系对C. pyrenoidosa的蛋白质抑制率明显高于单一药物抑制率,且三元混合物对蛋白质含量的影响比二元混合物大. 这说明混合物体系加快了氨基酸降解或者更大程度抑制了蛋白质的合成,可能由于混合物致毒机理共同作用于不同位点,导致蛋白质含量显著降低. 此外,通过对蛋白质溶出量与蛋白质含量的对比,可以直观地看到具有最高蛋白质含量的空白组溶出的蛋白质最少,这可能是由于C. pyrenoidosa在正常环境中细胞形态完整,细胞内大分子物质得到保护几乎不溶出[33]. 而C. pyrenoidosa在药物胁迫下其蛋白质溶出量均比空白组明显增多,这可能是由于藻细胞暴露于当前浓度下,破坏了细胞膜完整性,使细胞丧失保护,造成细胞内大分子流失,从而导致藻细胞的死亡.
2.4.2 杀虫剂及其混合物作用C. pyrenoidosa的细胞形态观察
应用电镜扫描观察C. pyrenoidosa在3种杀虫剂及混合物96 h暴露下的细胞形态与结构,如图6所示. 由图6可知,空白对照组的藻细胞形态完整,外形圆润饱满无破裂,而3种杀虫剂及其混合物对C. pyrenoidosa作用96 h后出现细胞形态破裂和细胞内物质溶出的现象,这表明杀虫剂及混合物均破坏了藻细胞膜的完整性. 其中单一药物作用下的藻细胞膜破裂程度比混合物作用程度大,这说明二元和三元混合物的组分间发生了拮抗作用,减弱了药物对细胞膜的作用位点的破坏程度,即使细胞破坏程度减弱.
2.4.3 杀虫剂及其混合物对C. pyrenoidosa的叶绿素色素含量的影响
叶绿体作为光合作用的主要反应场所含有的大量的光合色素,这些叶绿素不仅可以吸收光能维持光合作用的运行,而且能反映污染物胁迫下的逆境环境中藻类的生长发育状况[34]. 因而本研究测定了3种杀虫剂对C. pyrenoidosa暴露96 h后,藻细胞中叶绿素a和b的含量的变化,如图7所示.
由图7可知,3种杀虫剂及其混合物体系对C. pyrenoidosa胁迫下叶绿素a和叶绿素b含量均有明显减小,这说明C. pyrenoidosa在多种药物胁迫下对叶绿素合成有影响. Ismaiel[35]研究了在Cd胁迫对P. pringsheimii中叶绿素的含量生产发生抑制作用. 其中不同药物对叶绿素的合成有不同程度的抑制作用,单一药物对叶绿素的抑制率大小排序为OXA>PRO>DIP,与毒性大小呈正相关,可以认为单一药物的毒性变化是由于药物对叶绿素的作用而导致藻细胞的死亡. 二元混合物体系对C. pyrenoidosa的叶绿素抑制率大小表现出含有OXA的混合物抑制率明显大于未含有OXA的混合体系(PRO-DIP),这说明OXA对叶绿素破坏的程度更深,且混合物体系对C. pyrenoidos的叶绿素抑制率高于单一药物,三元混合物对叶绿素的影响比二元混合物大. 这与蛋白质含量变化相似,这可能是由于多种药物对C. pyrenoidosa中叶绿体的生理功能破坏,导致叶绿素无法吸收光能转化为核糖体所需能量,进而导致蛋白质的合成受到影响.
2.4.4 杀虫剂及其混合物对C. pyrenoidosa的SOD和MDA的影响
SOD是细胞抵御氧化中毒的第一道防线,SOD是一种必需的过氧化物酶,以自由基为底物,催化毒性产生过氧化氢为水和氧气[36 − 37]. SOD的变化是反应有机污染物对C. pyrenoidosa抗氧化损害的一种机制,MDA是膜脂质中脂肪酸的过氧化产物,也是脂质过氧化的重要指标[38]. 它通常用于反映环境污染胁迫对藻类细胞造成的过氧化损伤. 由于C. pyrenoidosa的抗氧化损伤能力变化与氧化损伤程度呈反比,则本研究测定了3种杀虫剂对C. pyrenoidosa暴露96 h后,藻细胞的SOD和MDA含量,分别计算其抑制率和增加率来表现其变化,如图8所示.
由图8可知,实验组藻细胞中SOD含量均有所减少,抑制率最大可达到0.25,这说明C. pyrenoidosa在杀虫剂的胁迫下,藻细胞体内SOD酶活性不但没有增加,反而出现其活性不足,难以清除过氧化损伤产生的自由基,活性氧化物的自我调节失衡[38]. 实验组藻细胞中MDA含量有明显增加,且增加率平均达到0.45. 这表明藻细胞在药物的刺激下产生氧化应激反应,产生大量脂质过氧化物. Khazri等[39]也表明当丝状蓝绿藻暴露于Cd时,藻细胞中MDA的含量显着增加. 结合图7可知,MDA的增加率与叶绿素b抑制率变化相似,这可能是由于杀虫剂作用于藻细胞叶绿素上的膜脂质,造成其过氧化损伤(即MDA增加),从而导致叶绿体细胞膜损坏,使叶绿素合成受到影响. 由图8可知,PRO-DIP混合物抑制率小于PRO和DIP单个药物的抑制率,说明这两种药物竞争SOD酶的作用位点,对SOD的抑制有所减小;OXA-PRO-DIP三元混合物抑制率也均小于3种药单独的抑制率,也说明了药物之间对SOD酶有竞争作用位点. 因此3种药物对C. pyrenoidosa的联合毒性作用呈现拮抗作用.
综上所述,3种杀虫剂及其混合物对C. pyrenoidosa的致毒机制:可能是由于藻细胞在药物的胁迫下产生大量的H2O2和超O2-自由基,使抗氧化损伤所需的SOD含量降低,抗氧化作用发生失调. 过氧化氢和自由基作用于膜脂质产生大量MDA,从而导致叶绿体细胞膜的损伤,叶绿体生理功能受损无法转化蛋白质所需能量,蛋白质合成受到影响,最终导致藻细胞生长受到抑制. 此外,由MDA的大量产生,结合电镜扫描图6,可知致毒机制也可能是由于过氧化氢和自由基作用于膜脂质破坏了细胞膜的完整性,造成了藻细胞中大分子物质蛋白质溶出,最终导致藻细胞死亡.
3. 结论(Conclusion)
(1)杀虫剂(OXA、PRO和DIP)对C. pyrenoidosa的单一毒性均表现出浓度和时间依赖毒性. 3种杀虫剂的毒性大小顺序为:OXA>PRO>DIP. 杀虫剂的二元和三元混合体系对C. pyrenoidosa均呈现出时间依赖毒性,且毒性强度随暴露时间的延长先增加后趋于稳定. 二元混合物体系对C. pyrenoidosa均呈现组分浓度比依赖毒性,而三元混合物体系则与OXA和PRO浓度之和呈现组分浓度比依赖毒性.
(2) 杀虫剂的二元和三元混合体系对C. pyrenoidosa的联合毒性作用在最终暴露时间96 h下均呈现拮抗作用或拮抗作用趋势,各混合物射线均随着暴露时间的延长而呈现出拮抗作用或弱拮抗作用强度增大,呈现时间依赖拮抗作用,且拮抗作用均出现在中浓度区域.
(3)C. pyrenoidosa在3种杀虫剂及其混合物胁迫下,蛋白质与叶绿素(a和b) 的变化均呈混合物抑制率明显高于单一药物抑制率,且三元混合物对其影响更大. MDA和SOD呈现相反的变化,SOD受到抑制而MDA大量增加. 通过蛋白质、叶绿素(a和b)、SOD和MDA之间的密切联系,初步推测其致毒机制:C. pyrenoidosa在药物胁迫下,一方面产生大量的过氧化物破坏藻细胞的抗氧化能力,造成藻细胞中SOD活性下降和MDA的大量积累,进而使蛋白质和叶绿素含量下降,导致细胞死亡;另一方面大量的过氧化物作用于膜脂质产生大量MDA,使细胞膜遭到严重破坏,其细胞内容物溶出,导致细胞死亡.
-
-
[1] MCCARTY P L. What is the best biological process for nitrogen removal: When and why?[J]. Environmental Science & Technology, 2018, 52(7): 3835-3841. doi: 10.1021/acs.est.7b05832 [2] STAZI V, TOMEI M C. Enhancing anaerobic treatment of domestic wastewater: State of the art, innovative technologies and future perspectives[J]. Science of the Total Environment, 2018, 635: 78-91. doi: 10.1016/j.scitotenv.2018.04.071 [3] COGERT K I, ZIELS R M, WINKLER M. Reducing cost and environmental impact of wastewater treatment with denitrifying methanotrophs, anammox, and mainstream anaerobic treatment[J]. Environmental Science & Technology, 2019, 53(21): 12935-12944. doi: 10.1021/acs.est.9b04764 [4] CAO Y, VAN LOOSDRECHT M C, DAIGGER G T. Mainstream partial nitritation-anammox in municipal wastewater treatment: status, bottlenecks, and further studies[J]. Applied Microbiology and Biotechnology, 2017, 101(4): 1365-1383. doi: 10.1007/s00253-016-8058-7 [5] LI H S, ZHOU S Q,MA W H, et al. Long-term performance and microbial ecology of a two-stage PN–ANAMMOX process treating mature landfill leachate[J]. Bioresource Technology, 2014, 159: 404-411. [6] MA B, WANG S, CAO S, et al. Biological nitrogen removal from sewage via anammox: Recent advances.[J]. Bioresource Technology, 2016, 200: 981-990. [7] WANG B, WANG Z, WANG S Y, et al. Recovering partial nitritation in a PN/A system during mainstream wastewater treatment by reviving AOB activity after thoroughly inhibiting AOB and NOB with free nitrous acid[J]. Environment International, 2020, 139: 105684. [8] WANG J, LEI Z, WANG L X, et al. Insight into using up-flow anaerobic sludge blanket-anammox to remove nitrogen from an anaerobic membrane reactor during mainstream wastewater treatment[J]. Bioresource Technology, 2020, 314: 123710. doi: 10.1016/j.biortech.2020.123710 [9] LEI Z, YANG S, WANG L X, et all. Achieving successive methanation and low-carbon denitrogenation by a novel three-stage process for energy-efficient wastewater treatment[J]. Journal of Cleaner Production, 2020, 276: 124245. [10] 杨舒茗, 雷振, 黄兴园, 等. AnMBR-Anammox耦合污水甲烷回收及自养脱氮的工艺特性研究[J]. 环境科学学报, 2019, 39(10): 3265-3272. [11] DU R, PENG Y Z, JI J, et al. Partial denitrification providing nitrite: Opportunities of extending application for anammox.[J]. Environment International, 2019, 131: 105001. [12] 杨舒茗. 厌氧MBR耦合Anammox处理城市污水的工艺特性研究[D]. 西安:西安建筑科技大学, 2020. [13] 黄兴园. PN/A用于城市污水厌氧消化出水的深度脱氮研究[D]. 西安:西安建筑科技大学, 2020. [14] 王衫允. 低氨氮浓度厌氧氨氧化工艺强化及颗粒污泥菌群特性研究[D]. 哈尔滨:哈尔滨工业大学, 2016. [15] ZHANG Z Z, ZHANG Y, CHEN Y. Recent advances in partial denitrification in biological nitrogen removal: From enrichment to application[J]. Bioresource Technology, 2020, 298: 122444. doi: 10.1016/j.biortech.2019.122444 [16] STROUS M, KUENEN J G, JETTEN M S. Key physiology of anaerobic ammonium oxidation[J]. Applied Microbiology and Biotechnology, 1999, 65(7): 3248-3250. doi: 10.1128/AEM.65.7.3248-3250.1999 [17] CHEN X M, SIN G, NI B J. Impact of granule size distribution on nitrous oxide production in autotrophic nitrogen removal granular reactor[J]. Science of the Total Environment, 2019, 689: 700-708. doi: 10.1016/j.scitotenv.2019.06.490 [18] WANG Y Y, XIE H C, WANG D, et al. Insight into the response of anammox granule rheological intensity and size evolution to decreasing temperature and influent substrate concentration[J]. Water Research, 2019, 162: 258-268. doi: 10.1016/j.watres.2019.06.060 [19] LI W, ZANG J L, ZHOU Y Y, et al. Metagenomics reveals microbial community differences lead to differential nitrate production in anammox reactors with differing nitrogen loading rates[J]. Water Research, 2020,169:115279. [20] DENG S Y, PENG Y Z, ZHANG L, et al. Advanced nitrogen removal from municipal wastewater via two-stage partial nitrification-simultaneous anammox and denitrification (PN-SAD) process[J]. Bioresource Technology, 2019, 162: 258-268. [21] BAETEN J, BATSTONE D J, SCHRAA O J, et a. Advanced nitrogen removal from municipal wastewater via two-stage partial nitrification-simultaneous anammox and denitrification (PN-SAD) process[J]. Water Research, 2020, 304: 122955. doi: 10.1016/j.biortech.2020.122955 [22] HUBAUX N, WELLS G, MORGENROTH E. Impact of coexistence of flocs and biofilm on performance of combined nitritation-anammox granular sludge reactors[J]. Water Research, 2019, 149: 322-341. doi: 10.1016/j.watres.2018.11.026 [23] JIN R C, YANG G F, YU J J, et al. The inhibition of the Anammox process: A review[J]. Chemical Engineering Journal, 2015, 68: 127-139. doi: 10.1016/j.watres.2014.09.036 -






 DownLoad:
DownLoad: