-
我国抗生素生产和使用量均居世界首位,其中青霉素类位居前列[1]。青霉素发酵生产过程中会产生废母液、废滤液、溶剂萃取残液、发酵罐冲洗废液等废水,其成分复杂,含有高有机物、高硫酸盐、高氨氮且有低生化降解性的特点,还含有高浓度残留青霉素,具有生物毒性,难于直接采用好氧工艺进行处理[2-3]。厌氧工艺一方面无需供氧耗能且可通过分解废水中的有机物产生可回收的甲烷能源;另一方面,厌氧工艺中的核心微生物产甲烷菌属于古菌,其细胞壁结构中缺乏可被青霉素干扰合成的肽聚糖,从而具备耐受青霉素的潜在优势[4],因此,其适合处理青霉素生产废水[2-3,5-7]。赵志瑞等[5]采用升流式厌氧污泥床反应器处理青霉素综合生产废水,发现常温条件下(20 ℃或25 ℃)稳定运行期内的反应器COD去除率分别为70%和65%。MULLAI等[8]采用厌氧混合反应器在中温(30~35 ℃)条件下处理实际青霉素G生产废水,当进水COD保持在4 000 mg·L−1时,改变水力停留时间使有机负荷在高达16 kg·(m3·d)−1的条件下,反应器的COD去除率仍能达到82.5%。王开红等[9]采用升流式厌氧污泥床反应器处理实际青霉素制药废水,在活化时不断提高实际废水与葡萄糖的比例直至全部进水均为实际废水,在进水COD在4 000 mg·L−1的条件下,COD去除率可达84%以上。王路光等[6]采用膨胀颗粒污泥床反应器处理青霉素生产废水,重点分析了硫酸盐对青霉素废水厌氧降解的影响。上述研究已证实各类厌氧反应器处理青霉素生产废水的可行性,但大都未涉及废水中青霉素自身的去除转化,有关青霉素与厌氧微生物间的相互作用机制仍鲜见报道,而解析青霉素在厌氧反应器中的转化归趋、青霉素及其水(降)解产物对厌氧微生物的影响机制是降低青霉素潜在负面效应(抑制产甲烷活性、诱导青霉素抗性基因等)、提高青霉素废水厌氧生物处理效能(COD去除率、甲烷转化率等)的关键。基于以上研究,本研究开展厌氧批式实验对模拟青霉素G生产废水进行了处理,考察了厌氧污泥对青霉素G的影响以及不同浓度的青霉素G对厌氧污泥产甲烷活性的影响,进而解析两者间的相互作用机制,以期为优化青霉素生产废水厌氧生物处理提供参考。
-
接种污泥取自某有机废物处理厂的完全混合式厌氧消化反应器出料口,悬浮固体(SS)和挥发性悬浮固体(VSS)含量分别为8.5%和3.9%。该反应器主要处理污水厂的剩余污泥,已投入正常运行近8 a,污泥停留时间为20 d。因此,出料口污泥属于典型的成熟厌氧活性污泥,具有良好的代表性。另外,由于已经过充分厌氧消化,故出料口污泥有机质含量偏低。
根据《发酵类制药工业废水治理工程技术规范》(HJ2044-2014),包括青霉素在内的β-内酰胺类抗生素生产工艺废水水质概况如下:COD 15 000~28 000 mg·L−1,BOD5 3 000~7 000 mg·L−1,SS 1 100~3 400 mg·L−1,硫酸盐500~8 000 mg·L−1,氨氮100~360 mg·L−1。实验用水利用自来水配置,采用淀粉、硫酸铵和青霉素G钠盐(C16H17N2NaO4S)模拟青霉素生产废水中的主要污染物,另外投加碳酸氢钠以提供厌氧消化所需碱度[10]。
-
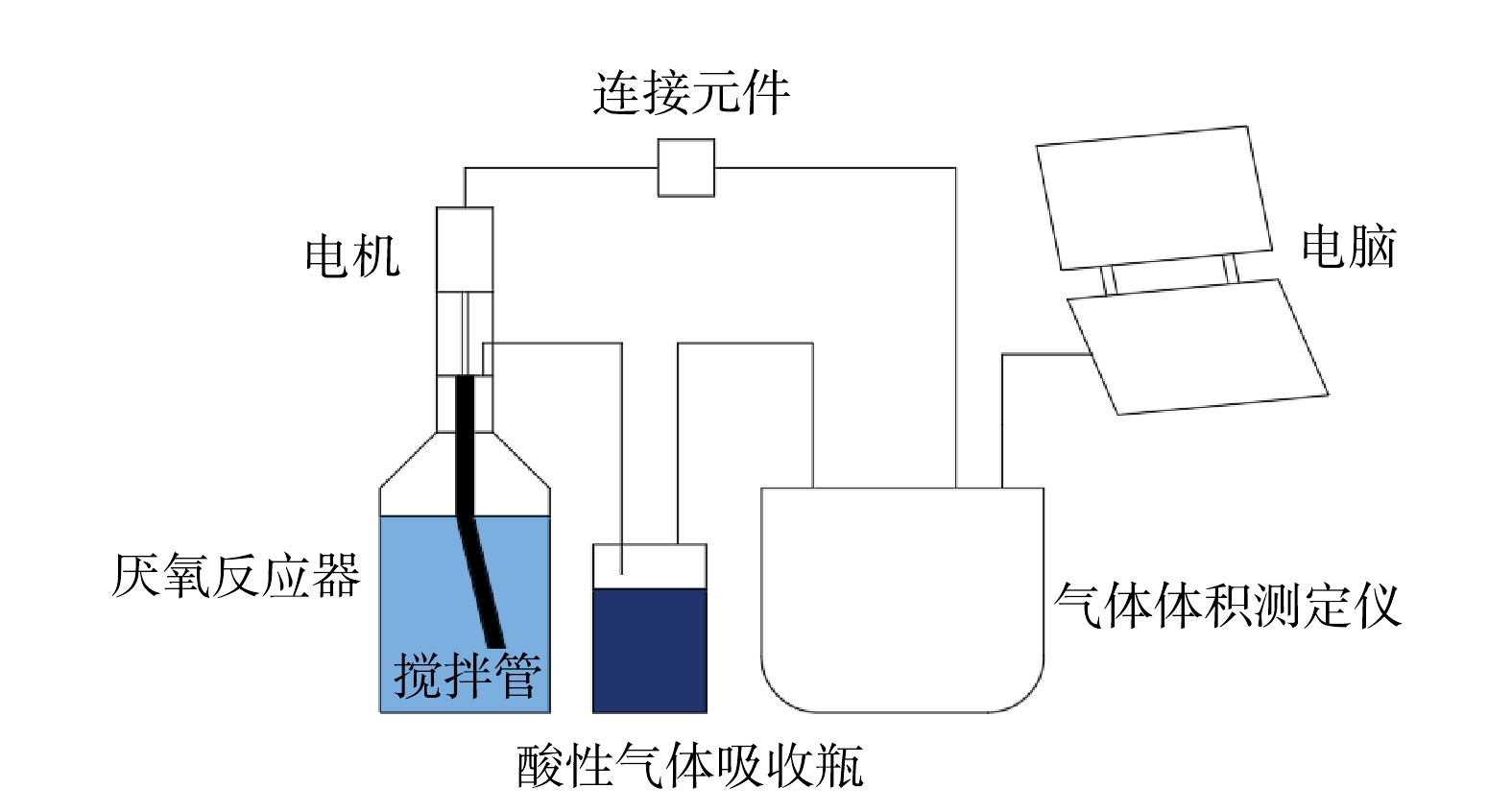
本研究采用AMPTS全自动甲烷潜力测试系统(图1)开展批式实验。该系统最多可同时运行15个厌氧反应器,每个反应器有效容积400 mL,置于35 ℃水浴恒温箱中,通过电脑控制驱动电机带动搅拌管,使反应器中污泥与废水混合均匀。循环搅拌模式为:以10 r·s−1每转动6 s停止2 s循环(顺逆时针交替)。每个反应器中产生的沼气单独通过NaOH和百里酚酞混合液,以去除二氧化碳等酸性气体,然后进入湿式微量气体体积测定仪计量甲烷体积,并通过电脑软件进行实时记录。该测量仪依据浮力和气泡排水法的基本原理,达到设定体积(8 mL)后以气泡形式排出,同时产生电子脉冲通过嵌入式数据采集系统,记录显示分析气体产生情况。每次实验开始前,先进行氮气吹脱5 min,以去除反应器中的残余氧气以保证厌氧环境。
批式实验分为3个阶段。第1阶段开展厌氧污泥的活(驯)化以适应模拟配水基质,采用4个相同的反应器1~4#(一方面作为平行反应器考察可重现性,另一方面为第2阶段实验准备足够的污泥),接种SS为32.87 g·L−1、淀粉以COD计15 g·L−1、硫酸铵0.5 g·L−1、碳酸氢钠15 g·L−1,初始pH=7.86,运行8 d,监测甲烷产量和COD去除情况。第2阶段开展不同水体(纯水、模拟配水、模拟配水+灭活污泥、模拟配水+活性污泥)条件下青霉素G钠盐的水(降)解实验,以考察厌氧污泥对青霉素G钠盐的作用机制(包括可能的生物水/降解和非生物吸附作用),将第1阶段结束后的反应器混合液经离心(4 000 r·min−1、10 min)后取沉淀污泥,再经自来水淋洗后,平均分至4个反应器。其中2个反应器内的污泥进行高温灭菌处理(120 ℃、1 h)作为灭活污泥,另2组作为正常活性污泥,再加上纯水和模拟配水共分8个反应器,初始条件如表1所示。实验开始后定期(0、1、3、6、12、24、36、48、60、72、84、96、108、120 h)检测液相和固相中的青霉素G钠盐浓度。
第3阶段开展不同浓度青霉素G钠盐条件下的厌氧污泥产甲烷实验以考察青霉素G钠盐对厌氧污泥的作用机制。先重复第1阶段方法活(驯)化一批污泥,然后将其平均分到10个反应器(初始SS为32.80 g·L−1),再加入相同基质(15 g·L−1淀粉、15 g·L−1碳酸氢钠、0.5 g·L−1硫酸铵),参照实际废水中的青霉素按0、1、10、100、1 000 mg·L−1质量浓度梯度每2个反应器一组投加青霉素G钠盐,反应9 d后,实时监测甲烷产量。
-
常规指标按照标准方法[11]测定。SS和VSS采用灼烧称重法,COD采用重铬酸钾氧化—硫酸亚铁铵滴定法,pH采用pH测定仪法。挥发性脂肪酸(VFA)采用气相色谱法测定。将混合液离心,取1 mL上清液过0.22 μm硝酸纤维滤膜至1.5 mL棕色试样瓶,加入0.1 mL色谱级甲酸,然后采用配有氢火焰检测器的气相色谱仪(GC7980,上海天美)测定VFA(检测范围为乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸),并根据标准曲线计算出VFA的含量。青霉素G钠盐采用液相色谱法测定[12]。取混合液离心后的上清液过0.45 μm玻璃纤维滤膜,滤后液用于检测液相中青霉素G钠盐浓度;取离心后下层污泥,加入0.2 mol·L−1磷酸二氢钾溶液和乙腈按19∶1比例配制的混合液(体积与所取下层污泥体积1∶1),振荡后离心,取该混合液离心后的上清液过0.45 μm玻璃纤维滤膜,滤后液用于检测固相中青霉素G钠盐浓度,最后将固相中青霉素G钠盐以质量(体积)浓度表示。采用Agilent1260型高效液相色谱仪,装配EelipseXDB-C18色谱柱(2.1×150 mm,3.5 μm),流动相为0.2 mol·L−1磷酸二氢钾溶液和乙腈(92∶8)混合液、流速1.0 mL·min−1,进样量10 μL,检测波长216 nm,柱温30 ℃,青霉素G钠盐出峰时间3.3 min。
-
在标准状况(1个标准大气压,温度为0 ℃)下,每降解1 g 耗氧有机物(以COD计),理论上完全厌氧分解可以产生350 mL甲烷。本研究中,甲烷经酸性气体吸收瓶后再进入湿式气体流量计检测时温度已达到与室温平衡的20 ℃,压力为1个标准大气压,根据理想气体状态方程,在此条件下,降解1 g 耗氧有机物(以COD计)理论产甲烷体积可根据式(1)计算,甲烷转化率可根据式(2)计算。
式中:V20为20 ℃下,降解1 g耗氧有机物(以COD计)的理论产甲烷体积,mL;V0为0 ℃下,降解1 g耗氧有机物(以COD计)的理论产甲烷体积,mL;T20为20 ℃下的绝对温度,K;T0为0 ℃下的绝对温度,K。
式中:C为甲烷转化率,%;A为反应器内每降解1 g耗氧有机物(以COD计)的所实际产生的甲烷体积,mL;V20为20 ℃下,降解1 g耗氧有机物(以COD计)的理论产甲烷体积,mL。
-
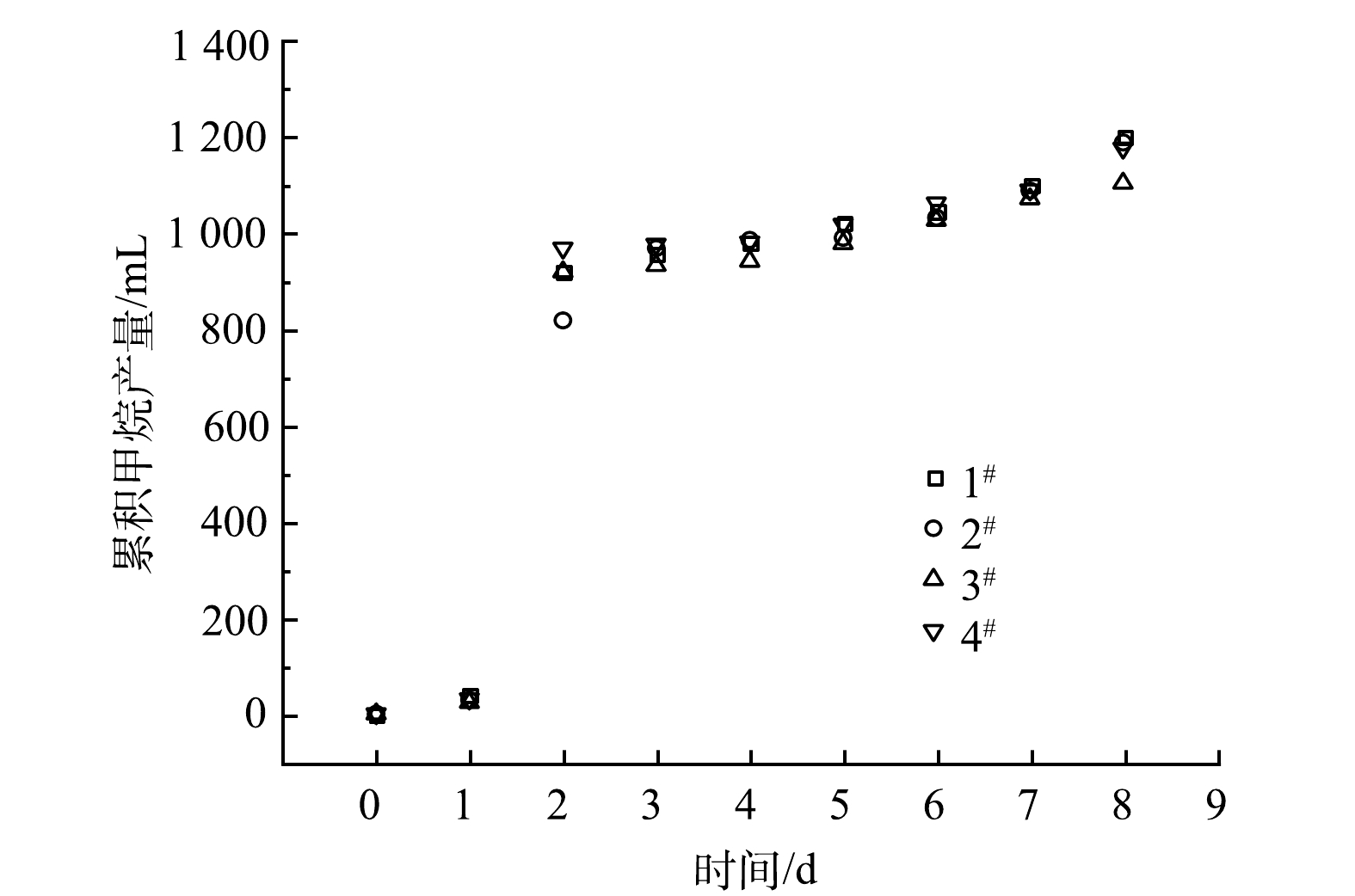
厌氧污泥活(驯)化过程中的甲烷产量变化情况如图2所示。各反应器的甲烷体积随反应时间的累积曲线基本重合,表明实验的可重复性良好。各反应器的甲烷体积第1天均微幅增长(24~31 mL),主要体现了厌氧污泥对模拟配水基质的适应期;第2天均大幅增长(790~937 mL),表明产甲烷菌活性良好;第3~8天均小幅增长(184~370 mL),这可能与易降解有机物不足和/或溶液pH逐渐偏离产甲烷菌最适pH (6.5~7.5)有关。如表2所示,各反应器运行至8 d结束时仍残存少部分VFA(均为乙酸和丙酸,其他酸未检测到),说明厌氧消化过程尚未彻底完成。但此时COD去除率已达到(71.8±0.8)%,甲烷转化率达到(72.5±1.6)%。此结果表明厌氧污泥活性良好,可以用于后续实验。残存丙酸的浓度显著高于乙酸的原因可能是:接种污泥以乙酸型产甲烷菌为主,导致乙酸被快速消耗,而丙酸降解速率显著低于乙酸[13],容易造成累积。
-
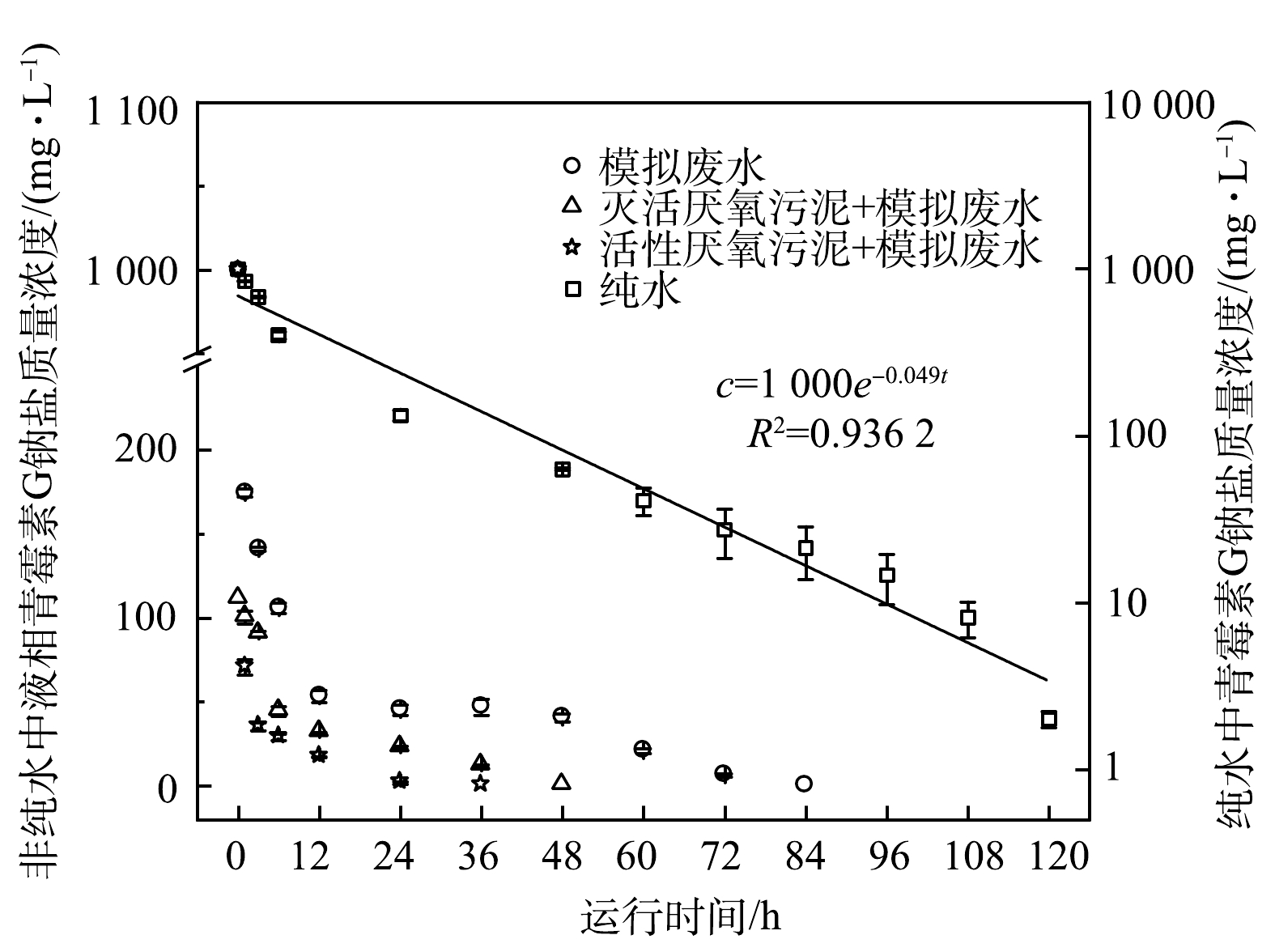
不同水体中,液相青霉素G钠盐浓度随时间的变化趋势如图3所示。液相青霉素G钠盐浓度随时间均呈下降趋势,不同水体条件下G钠盐浓度的下降速率依次为:纯水<模拟废水<灭活厌氧污泥+模拟废水<活性厌氧污泥+模拟废水。液相青霉素G钠盐浓度降至检测限(0.01 mg·L−1)以下所需时间分别为高于120、96、60、48 h,说明厌氧污泥具有较好的促进青霉素G钠盐水(降)解的能力。纯水中青霉素G钠盐水解过程符合伪一级反应动力学,拟合方程为c=1 000e−0.049t,可决系数R2=0.936 2,速率常数k=0.049 h−1,半衰期T1/2=14.15 h。处于水溶液中的青霉素分子内酰胺环的形变张力大,导致其内酰胺键不稳定,易受到溶液中含羟基、氨基、巯基、羧基等亲核物质的进攻而发生自然水解[14-15]。模拟废水中的淀粉及其水解产物(糊精、麦芽糖和葡萄糖)均含有羟基官能团,可促进青霉素的水解。因此,相比纯水,模拟废水中青霉素水解速率较快。此外,厌氧污泥絮体表面胞外聚合物一般含有氨基、羟基和羧基等官能团[16-19],活性厌氧污泥体系内淀粉转化生成的VFA也含有大量羧基官能团,从而可促进青霉素的水解。除亲核物质外,青霉素类抗生素水解还受温度、pH和重金属离子等的影响[20-22]。盛峰[23]考察了青霉素G钠盐在5种不同河湖水(pH=7.8~8.5)中的水解速率,发现伪一级反应动力学方程能较好地拟合青霉素G钠盐在对照组(pH 8.0的10 mmol·L−1 PBS缓冲溶液)和5种水体中的水(降)解过程,R2均大于0.98;青霉素G在5种水体中的水(降)解速率存在差异,速率常数k在(0.002 4±0.000 6) ~(0.015 7±0.001 2) h−1,低于本研究的纯水中的水解速率,这主要与两者溶液环境差异有关。厌氧污泥絮体中含有大量的菌胶团,比表面积较大,具有较强的吸附性能。房晓君等[24]发现,β-内酰胺类抗生素在污水处理工艺中的总吸附率为17.8%。因此,相比模拟废水,投加灭活厌氧污泥后的液相青霉素浓度下降较快。这可能与污泥絮体吸附部分青霉素有关。青霉素及其水(降)解产物本质上仍属于含碳氮有机物,理论上能够与厌氧微生物所分泌的酶发生反应从而被进一步分解或转化。因此,相比灭活厌氧污泥,投加活性厌氧污泥后的液相青霉素浓度下降较快。这可能与厌氧污泥的分解代谢(水解酸化、产氢产乙酸、产甲烷)和合成代谢(菌体增殖)有关。
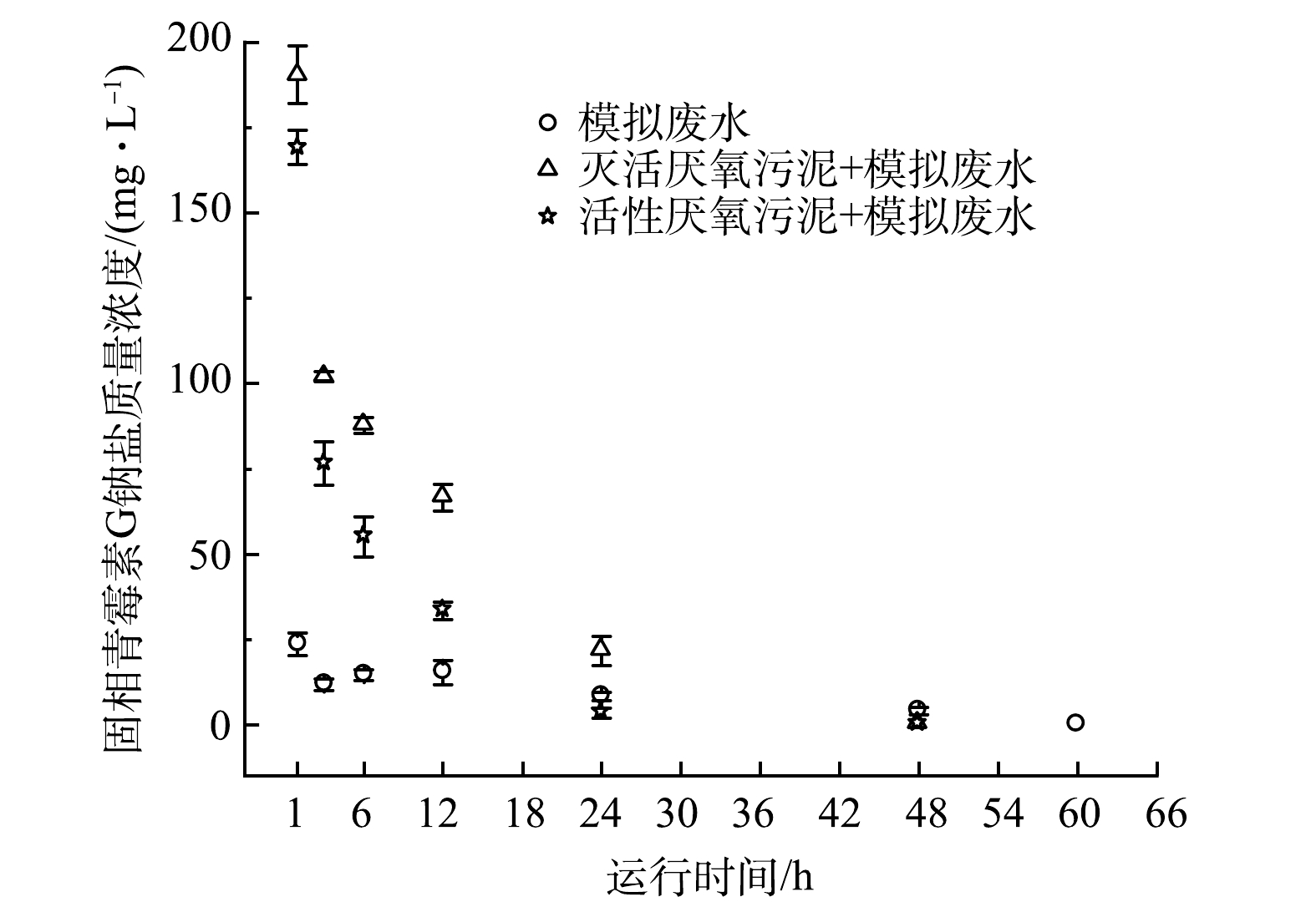
固相青霉素G钠盐在不同水体中浓度随时间的变化趋势如图4所示。模拟废水中呈悬浮状态的淀粉颗粒能在一定程度上吸附青霉素G钠盐(1 h时吸附量约20 mg·L−1),随青霉素水解的进行,淀粉颗粒吸附的青霉素G钠盐浓度随时间不断降低,72 h时低于检测限。模拟废水中添加灭活厌氧污泥后,与单独淀粉颗粒相比,固相物质浓度更高,从而表现出更强的青霉素G钠盐吸附能力(1 h时吸附量约为180 mg·L−1)。灭活厌氧污泥固相与液相中的青霉素G钠盐浓度随时间变化趋势基本一致,均呈现指数下降趋势,60 h时低于检测限。活性厌氧污泥与灭活厌氧污泥的初始青霉素G钠盐吸附量相当,但活性厌氧污泥中的青霉素G钠盐浓度下降更快。这可能与活细胞对青霉素G钠盐水解的促进或直接降解作用有关。
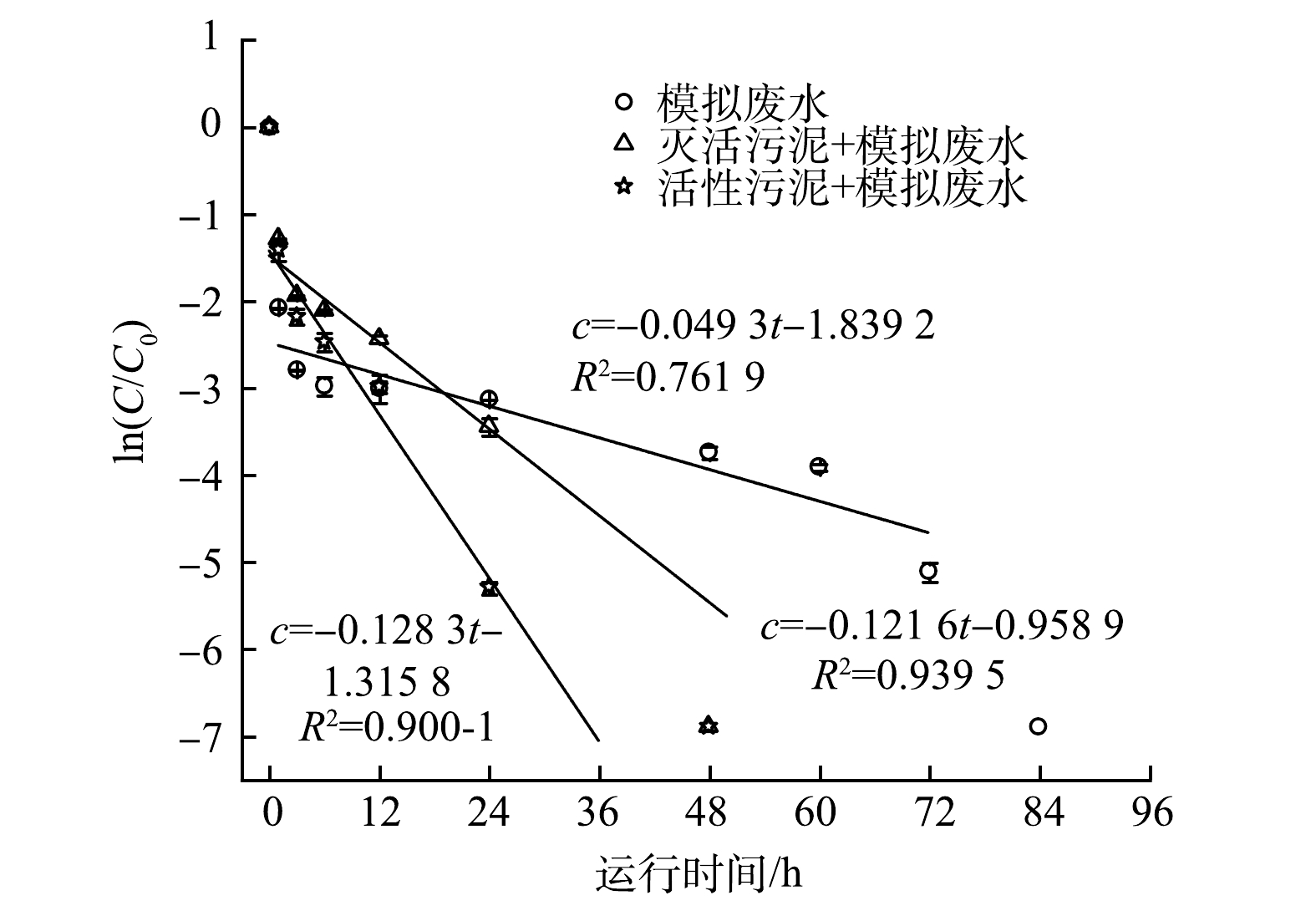
综合固相和液相中青霉素G钠盐浓度的变化情况,模拟废水、灭活厌氧污泥+模拟废水和活性厌氧污泥+模拟废水条件下反应器内青霉素G钠盐总浓度(C)降至检测限以下所需时间分别为96、60和60 h。为便于进行伪一级动力学方程(C=C0e−kt)拟合,采用取对数后的线性表达式(ln(C/C0)=b−kt)在图5中进行拟合,结果如图5所示。灭活厌氧污泥+模拟废水和活性厌氧污泥+模拟废水两组实验拟合结果较好,其速率常数k分别为0.121 6 h−1和0.128 3 h−1,均显著高于纯水(0.048 h−1)。灭活厌氧污泥和活性灭活厌氧污泥絮体表面胞外聚合物一般均含有羟基、氨基和羧基等官能团[16-19],可促进青霉素的水解,因此,添加厌氧污泥可显著提高青霉素G钠盐的水解速率。活性厌氧污泥组的速率常数又高于灭活厌氧污泥组,这主要与厌氧污泥的生物活性进一步促进青霉素G钠盐的水(降)解有关。模拟废水中青霉素G钠盐的水解过程用伪一级反应动力学拟合时相关性较低,具体原因尚需要进一步探究。
-
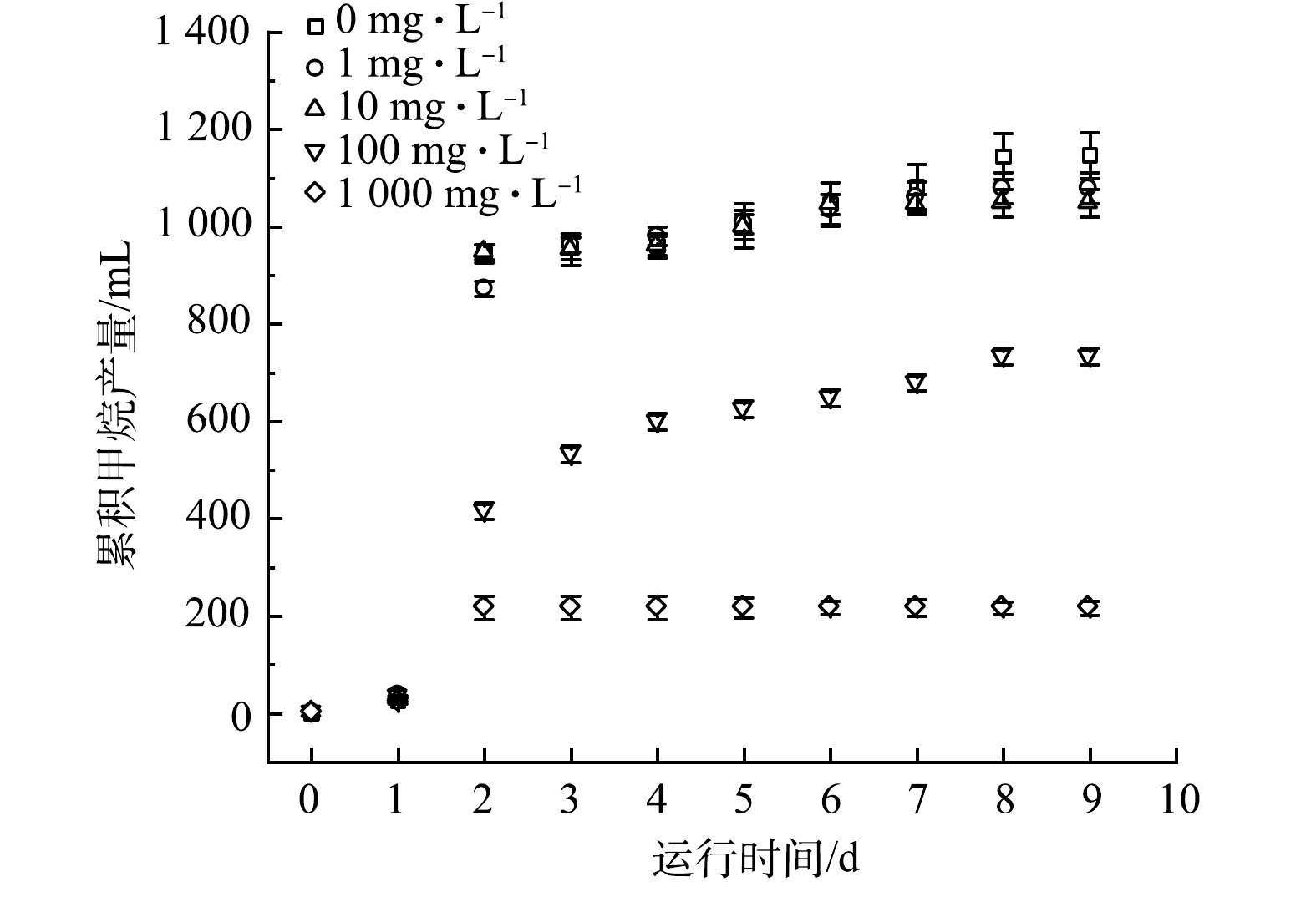
不同浓度的青霉素G钠盐对厌氧污泥累积甲烷产量的影响如图6所示。投加1 mg·L−1、10 mg·L−1青霉素G钠盐组与未投加青霉素G钠盐组中厌氧污泥的甲烷产量基本相同,均呈现第1天微幅增加(26~36 mL)、第2天迅速增加(837~919 mL)、第3~9天小幅增长(101~202 mL)的趋势(与图2基本一致)。这表明,低浓度(≤10 mg·L−1)青霉素G钠盐对厌氧污泥产甲烷活性没有显著的抑制作用,其原因主要与初始青霉素G钠盐浓度较低且其水(降)解速率较快有关。投加100 mg·L−1青霉素G钠盐组第1天的甲烷产量(34 mL)与其他组无显著差异,第2天虽迅速增加(382 mL)但显著低于未添加青霉素G钠盐组,第3~9天缓慢增长(318 mL),最终产量(734 mL)显著低于未投加青霉素G钠盐组(1 147 mL)。这说明100 mg·L−1青霉素G钠盐对厌氧污泥的产甲烷活性产生了显著抑制作用。投加1 000 mg·L−1青霉素G钠盐组第1天的甲烷产量(23 mL)与其他组无显著差异,第2天虽迅速增加(217 mL)但显著低于未添加青霉素G钠盐组,第3~9天基本未增长,最终产量仅为未添加青霉素G钠盐组的19.9%,表明1 000 mg·L−1青霉素G钠盐对厌氧污泥的产甲烷活性产生了严重抑制作用。胡晓东等[25]也发现,中低浓度(100~500 mg·L−1)青霉素对厌氧微生物活性无显著抑制作用。
从有机物降解转化来看(表3),实验结束时,低浓度(1 mg·L−1和10 mg·L−1)青霉素G钠盐组的残留COD、乙酸和丙酸与未投加青霉素G钠盐组无显著差异,与对甲烷产量的影响规律一致。中高浓度(100 mg·L−1和1 000 mg·L−1)青霉素G钠盐组的残留COD显著高于未投加青霉素G钠盐组,造成COD去除率显著降低,与对甲烷产量的影响规律一致,但甲烷转化率(即甲烷产量/去除COD)仍与未投加青霉素G钠盐组相当,而且残留乙酸和丙酸显著低于未投加青霉素G钠盐组。相比未投加青霉素G钠盐组的高残留COD和低残留VFA特征,中高浓度青霉素G钠盐主要通过直接抑制水解酸化菌,造成有机物无法有效转化为VFA,使得产甲烷菌因缺少可利用基质而间接影响产甲烷活性,这也与青霉素无法直接作用于产甲烷菌的现象一致,青霉素无法直接作用于产甲烷菌的原因是产甲烷菌(属于古细菌)细胞壁中缺少肽聚糖(即青霉素作用靶点)。
-
1)青霉素G钠盐的水(降)解反应符合伪一级动力学,在纯水、灭活和活性厌氧污泥条件下的速率常数分别为0.049、0.121 6和0.128 3 h−1。灭活厌氧污泥因其絮体表面的亲核官能团攻击青霉素分子的内酰胺键而显著提高了青霉素G钠盐的水(降)解速率,活性厌氧污泥因其生物活性进一步提高了青霉素G钠盐的水(降)解速率。
2)低浓度(≤10 mg·L−1)青霉素G钠盐对厌氧污泥的产甲烷活性无显著的抑制作用;100 mg·L−1青霉素G钠盐对厌氧污泥的产甲烷活性有一定的抑制作用,该组反应器甲烷产量是正常厌氧污泥的64.0%;1 000 mg·L−1青霉素G钠盐对厌氧污泥的产甲烷活性产生了严重的抑制作用,该组反应器甲烷产量仅为正常厌氧污泥的19.9%。中高浓度青霉素G钠盐主要直接抑制水解酸化菌,造成有机物无法有效转化为VFA,使得产甲烷菌因缺少可利用基质从而间接影响产甲烷活性。
制药废水中青霉素与厌氧污泥的相互作用机制
Interaction mechanism between penicillin and anaerobic sludge in pharmaceutical wastewater
-
摘要: 通过批式实验考察了制药废水中青霉素G钠盐与厌氧污泥的相互作用机制。结果表明:青霉素G钠盐的水(降)解反应符合伪一级动力学,在纯水、灭活和活性厌氧污泥条件下的速率常数分别为0.048、0.121 6和0.128 3 h−1。灭活厌氧性污泥因其絮体表面的亲核官能团显著提高了青霉素G钠盐的水(降)解速率,活性厌氧污泥因其生物活性进一步提高了青霉素G钠盐的水(降)解速率。低浓度(≤10 mg·L−1)、中浓度(100 mg·L−1)和高浓度(1 000 mg·L−1)的青霉素G钠盐对厌氧污泥的产甲烷活性分别呈现无显著抑制作用、有一定的抑制作用、有显著抑制作用。投加中、高浓度青霉素G钠盐的厌氧污泥的甲烷产量分别是正常厌氧污泥的64.0%和19.9%。中高浓度青霉素G钠盐主要直接抑制水解酸化菌,从而间接影响产甲烷活性。Abstract: Batch tests were conducted to investigate the interaction mechanism between penicillin G sodium and anaerobic sludge for pharmaceutical wastewater treatment. The results showed that hydrolysis (degradation) of penicillin G sodium followed pseudo-first-order reaction kinetics, and the rate constants were 0.048 h−1, 0.121 6 h−1 and 0.128 3 h−1 in pure water, inactivated and activated anaerobic sludge, respectively. Inactivated anaerobic sludge significantly increased the hydrolysis (degradation) rate of penicillin G sodium due to the nucleophilic function groups on its floc surface, while activated anaerobic sludge further increased the hydrolysis (degradation) rate of penicillin G sodium due to its biological activity. Low-concentration (≤10 mg·L−1), medium-concentration (100 mg·L−1) and high-concentration (1 000 mg·L−1) penicillin G sodium had no significant inhibition effect, some inhibition effect and significant inhibition effect on the methanogenic activity of anaerobic sludge, respectively. The methane yields of anaerobic sludge with addition of medium-concentration (100 mg·L−1) and high-concentration (1 000 mg·L−1) penicillin G sodium were 64.0% and 19.9% of normal anaerobic sludge without penicillin G sodium addition, respectively. Penicillin G sodium with medium-high concentration (100~1 000 mg·L−1) mainly inhibited acidogenic bacteria directly and thus affected methanogenic activity indirectly.
-
随着人口的增长,城市化的加剧以及现代采矿业和冶金业的快速发展,含高浓度硫酸盐酸性矿山废水(acidic mine drainage, AMD)引起的污染问题亟待解决[1-2]。硫酸盐还原菌(SRB)通常指能够通过异化作用进行硫酸盐(
SO2−4 )还原的一类细菌[3-4]。用SRB来处理矿山废水具有成本低、效果好、无二次污染等优点,已成为现今研究的热点课题。王正辉[5]利用硫酸盐还原菌处理高浓度硫酸盐化工废水,当COD、硫酸盐浓度分别从5 000、700 mg·L−1逐渐增高至13 000、1 700 mg·L−1时,经过对污泥的驯化,启动结束时反应器的硫酸盐负荷率为5 kg·(m3·d)−1,硫酸盐平均去除率达到85%以上;ELKE等[6]应用两相工艺处理制革废水,当进水硫酸盐浓度为1 180 mg·L−1时,硫酸盐去除率为58%(单相厌氧工艺去除率为30%)。
在生物法处理AMD废水的研究中,生物固定化方法具有稳定性好、易于实现连续化和处理效率高等优点,受到了国内外学者的广泛关注[7-11]。SRB包埋固定化技术,除了上述优点外,还可以解决其沉降性能差的问题,减少了SRB的流失。同时,细菌包埋后,可以降低重金属沉淀的分离难度,便于实现重金属的回收[12]。林洁松[13]利用内聚甲醇固定化硫酸盐还原菌小球去除硫酸盐和铬,在初始Gr6+浓度为100 mg·L−1和初始
SO2−4 浓度为200 mg·L−1时,最大去除率分别为99.40%和97.49%;胡希佳等[14]采用聚乙二烯醇-硼酸二次交联方法,将SRB进行局部包埋固定化处理
SO2−4 ,在
SO2−4 进水浓度为2 000 mg·L−1时,生物滤池对硫酸盐的还原率稳定在85%以上。
然而,上述实验一般只考察了较低负荷的进水
SO2−4 浓度和包埋后处理情况,对于散泥培养、细菌包埋、包埋填料活性恢复连续过程以及高负荷条件下的废水处理却鲜有报道。本研究将纤维丝活性填料驯化富集(中试)阶段、活性污泥包埋填料驯化富集实验阶段联系起来,详细考察了硫酸盐还原菌、活性包埋填料的驯化情况及其生物群落分析,为工程实际提供技术参考。
1. 材料与方法
1.1 污泥富集培养材料与方法
污泥来自实验室原有的硫酸盐还原生物反应器,实验采用间歇[15-16]、小空间厌氧移动床[17]培养方式进行高效富集培养及挂膜。
实验用水为人工配制的模拟硫酸盐有机废水。市政自来水静置12 h后,投加乳酸钠、无水硫酸钠、氯化铵、硫酸二氢钾和微量重金属离子[18]。实验用原水中的有机物为乳酸钠,保证原水的COD:
SO2−4 ≥2∶1,以满足硫酸盐还原过程对有机碳源的需求。在实验各阶段用水中,保持HRT=10 h、COD∶N∶P=200∶5∶1、DO≤0.5 mg·L−1、pH=7.0~7.5、温度为30~35 ℃[19-20]。
1.2 污泥富集培养实验装置
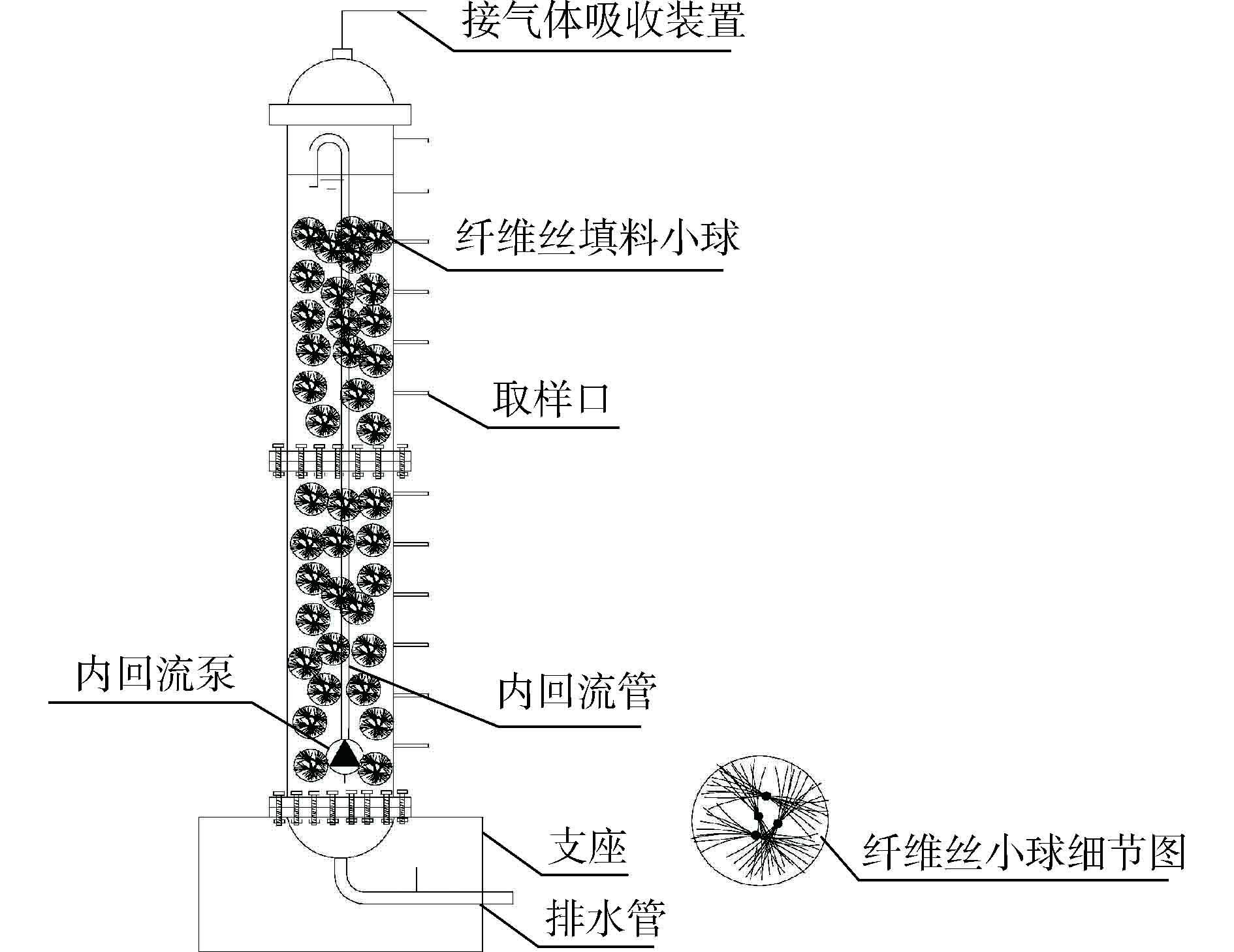
本实验中纤维丝填料的高效富集培养采用间歇培养的方式,培养过程中间歇投加底物,每隔5 d左右,更换上清液,并注入晾晒后的自来水,实验装置如图1所示。反应器总有效体积为200 L,顶部设有尾气(H2S)回收装置,反应器一侧每隔10 cm设有取样口。反应器内部装满纤维丝小球。内设回流装置Q回流泵≈2 000 L·h−1,强化反应器内溶液混合,使溶液达到均质的效果。反应器内部设有加温棒,外部设有保温棉,以保证内部恒温30~35 ℃,维持SRB适宜的环境。
1.3 包埋填料的制备与应用
取培养后污泥,后经隔膜压滤机(景津环保股份有限公司)浓缩成含水率为85%的污泥,与质量分数20%PVA凝胶混合,污泥与PVA体积比为1∶4,以保证其适宜的生物量及稠度。同时,经响应面[21]分析,加入添加剂活性炭18.32 g·L−1, 碳酸钙38.30 g·L−1,放入过饱和的硼酸溶液交联2 h,再用晾晒的自来水清洗后,放入70 g·L−1的硫酸钠溶液中,二次交联4 h,期间不断地调节交联剂的pH在3.5以下。将包埋液均匀涂在圆柱体网格条子上(长50 cm,直径1.0 cm),然后切成1 cm长度的小圆柱体[22-25],如图2(a)所示。包埋体活性恢复采用500 mL摇瓶于培养箱中培养,如图2(b)所示,包埋填料填充率为20%。实验采用人工模拟硫酸盐有机废水,COD为4 000 mg·L−1,
SO2−4 为2 000 mg·L−1,其他条件同上。
1.4 常规指标及检测方法
所有检测项目均采用国家规定的标准方法[26],采用铬酸钡分光光度法(CdCl2除S2−干扰)测定
SO2−4 浓度;采用联华科技的5B-3F型COD快速测定仪测定COD;采用pHS-2C型pH计测定pH,测定前用标准pH缓冲溶液进行校正;采用手提式DO测定仪测定溶解氧(DO);采用温度计测定水温; 采用高通量测序方法进行微生物种群鉴定。
2. 结果与讨论
2.1 硫酸盐还原菌富集培养结果及分析
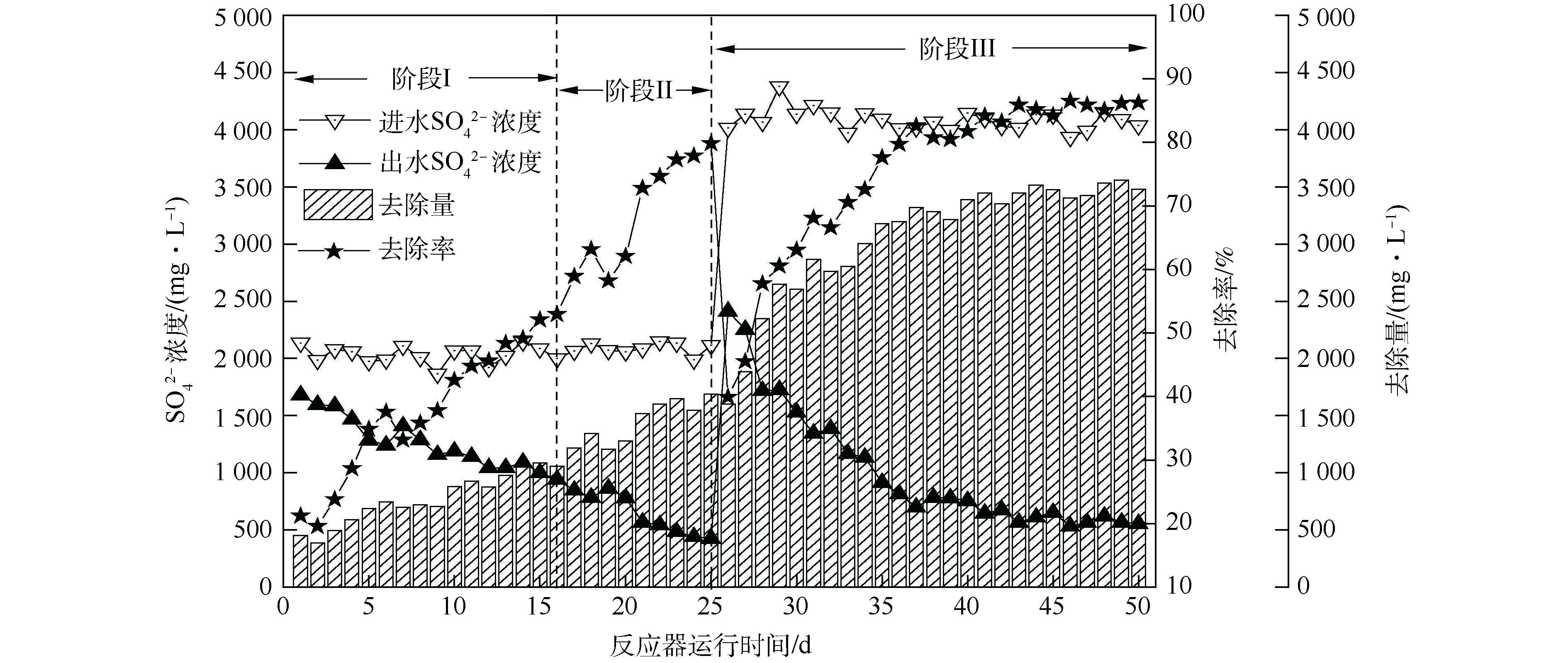
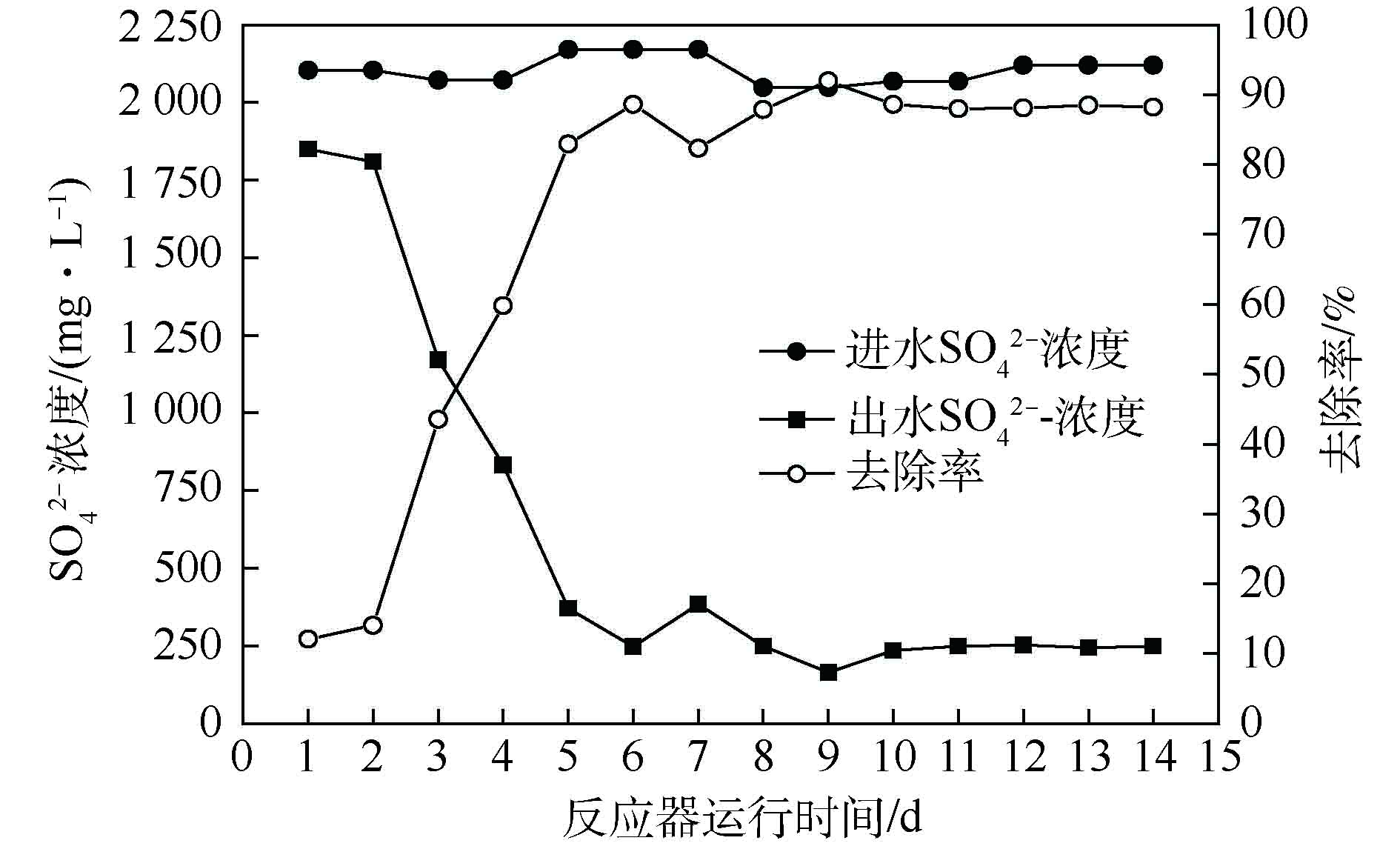
由图3可知,生物反应器启动后,硫酸盐去除量整体呈上升趋势。初始硫酸盐去除率在20%左右,随着运行时间的延长,硫酸盐去除率逐渐升高,出水
SO2−4 浓度整体呈现出下降趋势,经过25 d的驯化富集,硫酸盐去除率可达79.83%。
第Ⅰ阶段(0~16 d),由于起始生物量过少[14],硫酸盐还原速率呈缓慢上升趋势;第Ⅱ阶段(17~25 d),在生物量增多、生物还原性能提高的双重作用下,硫酸盐还原速率由52.93%迅速上升至79.83%;在第Ⅲ阶段(25~50 d),提高
SO2−4 负荷至4 000 mg·L−1后,在第26天,硫酸盐还原速率为39.93%,随运行时间的延长,硫酸盐还原菌逐渐适应高负荷的
SO2−4 ,在第37天,系统的
SO2−4 还原率稳定在80.47%~86.48%。杨宏等[17]发现,当进水
SO2−4 质量浓度由1 500~2 250 mg·L−1增至2 500 mg·L−1时,由于S2−大量积累,抑制了SRB活性,
SO2−4 还原率由87.48%~88.89%下降至78.77%。而本研究进水
SO2−4 为4 000 mg·L−1时,连续运行26 d,富集培养过程中未发现硫化物、乙酸等代谢产物对其的抑制。
关于硫化物的毒性抑制浓度各类报道相差甚远,其值为100~1 100 mg·L−1,这可能与实验条件、污泥驯化方法与驯化程度、反应器类型等因素有关[27]。本研究可能由于反应器中内回流泵的搅拌作用(Q泵≈2 000 L·h−1),加快H2S气体排出系统,使系统内游离H2S的浓度大大减弱,减轻了S2−对微生物的抑制作用,为SRB处理高浓度硫酸盐废水提供了理论参考。
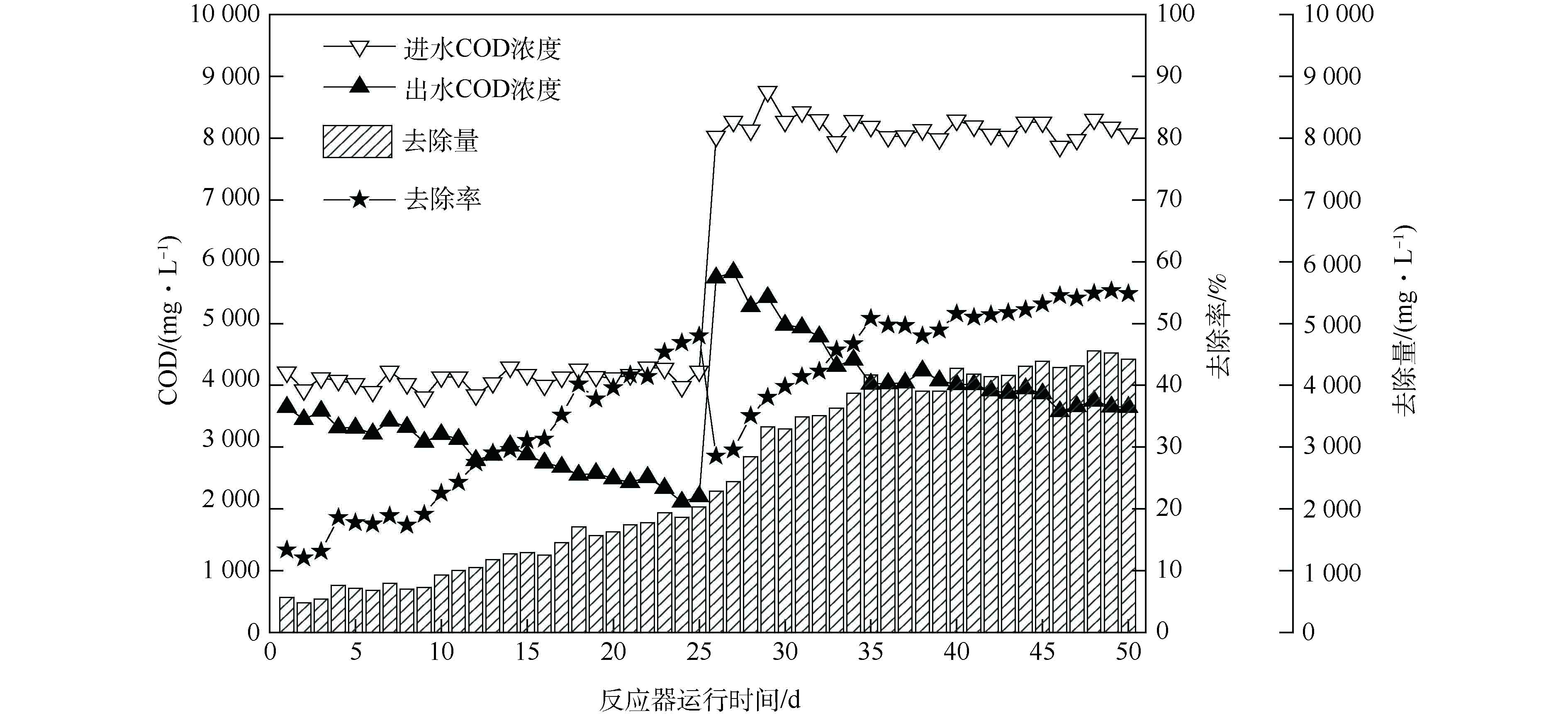
图4为硫酸盐还原菌富集培养过程中COD的逐日变化情况。随着反应时间的延长,COD的去除量有所增加,去除率基本稳定在50%左右。提高进水COD负荷至8 000 mg·L−1,去除量虽然明显提升,但去除率仍然维持在较低水平,最终去除率稳定在53.17%~55.31%。
2.2 高通量测序分析
2.2.1 微生物群落丰富度和多样性分析
通过对2组样品16S rRNA基因文库高通量测序,污泥原样(MC-1)与筛选后的污泥样品(MC-2) alpha多样性指标计算结果见表1。
表 1 多样性指标计算结果Table 1. Calculation results of diversity index样品编号 Sequence个数 Chao1指数 ACE指数 Shannon指数 Simpson指数 覆盖率 MC-1 84 964 28 757.03 69 448.43 3.92 0.10 0.96 MC-2 73 096 54 620.06 128 278.84 2.09 0.36 0.97 由表1可知,2个样品的文库覆盖率均大于0.95,表明测序深度已经基本覆盖到样本中所有的物种。MC-2的Chao1和ACE指数均大于MC-1,并且MC-2具有较大的OTU数,即高效富集培养后的污泥物种丰富度大于原始污泥,具有较多的物种总数。而MC-1的Shannon多样性指数和Simpson多样性指数大于MC-2,说明原污泥群落多样性高于富集培养后的污泥。由此可知,多样性指数较高的原始污泥群落各种之间个体分配较均匀,而筛选后的污泥各种之间生物量差异较大,但优势种群明显。
2.2.2 菌群变化分析
硫酸盐还原菌(sulfate reducing bacteria,SRB)通常指能够通过异化型硫酸盐还原过程进行硫酸盐代谢的一类细菌[28]。在目前已经掌握的硫酸盐还原菌中,属于革兰氏阴性的主要菌属有脱硫叶菌属(Desulfobulbus)、脱硫微菌属(Desulfomicrobium)、脱硫单胞菌属(Desulfomonas)、脱硫菌属(Desulfobacter)、脱硫弧菌属(Desulfovibrio)、脱硫杆菌属(Desulfobacterium)、脱硫球菌属(Desulfococcus)、脱硫念珠菌属(Desulfomonile)、脱硫螺旋体属(Desulfonema)、脱硫八叠菌属(Desulfosarcina);革兰氏阳性菌的代表菌属有脱硫肠状菌属(Desulfotomaculum);嗜热细菌的代表属有热脱硫杆菌(Thermodesulfo bacterium);嗜热古细菌的代表属有古生球菌属(Archaeoglobus)[29-30]。在水处理领域常见的硫酸盐还原菌包括脱硫弧(Desulfovibrio)和脱硫微菌属(Desulfomicrobium)。
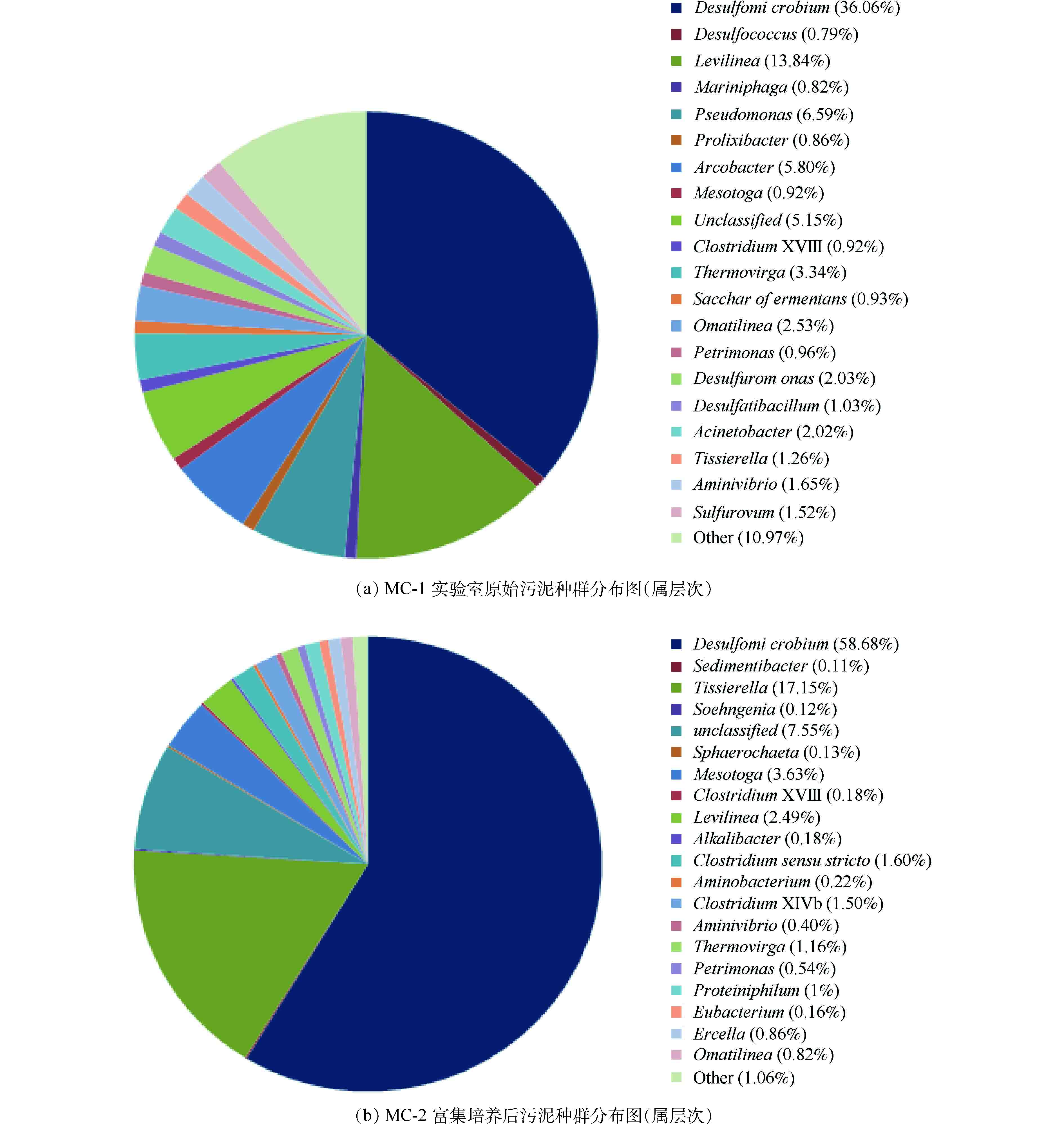
图5(a)和图5(b)表明,具有脱硫作用的I类SRB(Desulfomicrobium)与II类SRB(Desulfococcus)菌属在实验室原始污泥中比例分别为36.06%和0.79%,经过富集培养以后,Desulfomicrobium为58.68%,Desulfococcus未检出,证明了硫酸盐还原菌的富集,为后续包埋提供了菌源。
富集培养后Desulfomicrobium依旧是优势菌种,而Desulfococcus等比例下降。究其原因,是由于ASRB(利用乙酸的硫酸盐还原菌)种群的竞争能力远远低于1-SRB(利用乳酸的硫酸盐还原菌)[31]。富集过程并未出现产甲烷菌(MPB)与硫酸盐还原菌的竞争生长现象,硫酸盐还原菌(Desulfomicrobium)占绝对优势,这与VIKAS[32]的发现(即:当ρ(COD)∶ρ(
SO2−4 )>1时,MPB就占优势的现象)有所不同。究其原因主要有两个方面。一方面是由于其热力学和动力学因素的影响[28],SRB利用COD和氢的自由能低,且对氢的竞争中,SRB占优势。另一方面,实验原水中含有较高的硫酸盐浓度,有研究[33]表明,采用高硫酸盐负荷启动硫酸盐还原菌生物反应器可以有效地抑制MPB的活性,提高SRB的活性。另外,也可能是由于1-SRB或者Desulfomicrobium菌属竞争能力远高于MPB。
2.3 含硫酸盐还原菌包埋填料富集培养结果及分析
纤维丝生物活性填料经过50 d的驯化富集培养,硫酸盐还原菌富集培养结果较好。高通量结果表明,Desulfomicrobium比例由36.06%上升至58.68%。由图3可知,还原速率由49.32 mg·(L·h)−1上升至338.7 mg·(L·h)−1。以此为菌源,进行了包埋活性驯化实验并考察了包埋填料对于饥饿环境的抵抗能力。
2.3.1 包埋填料效率恢复阶段
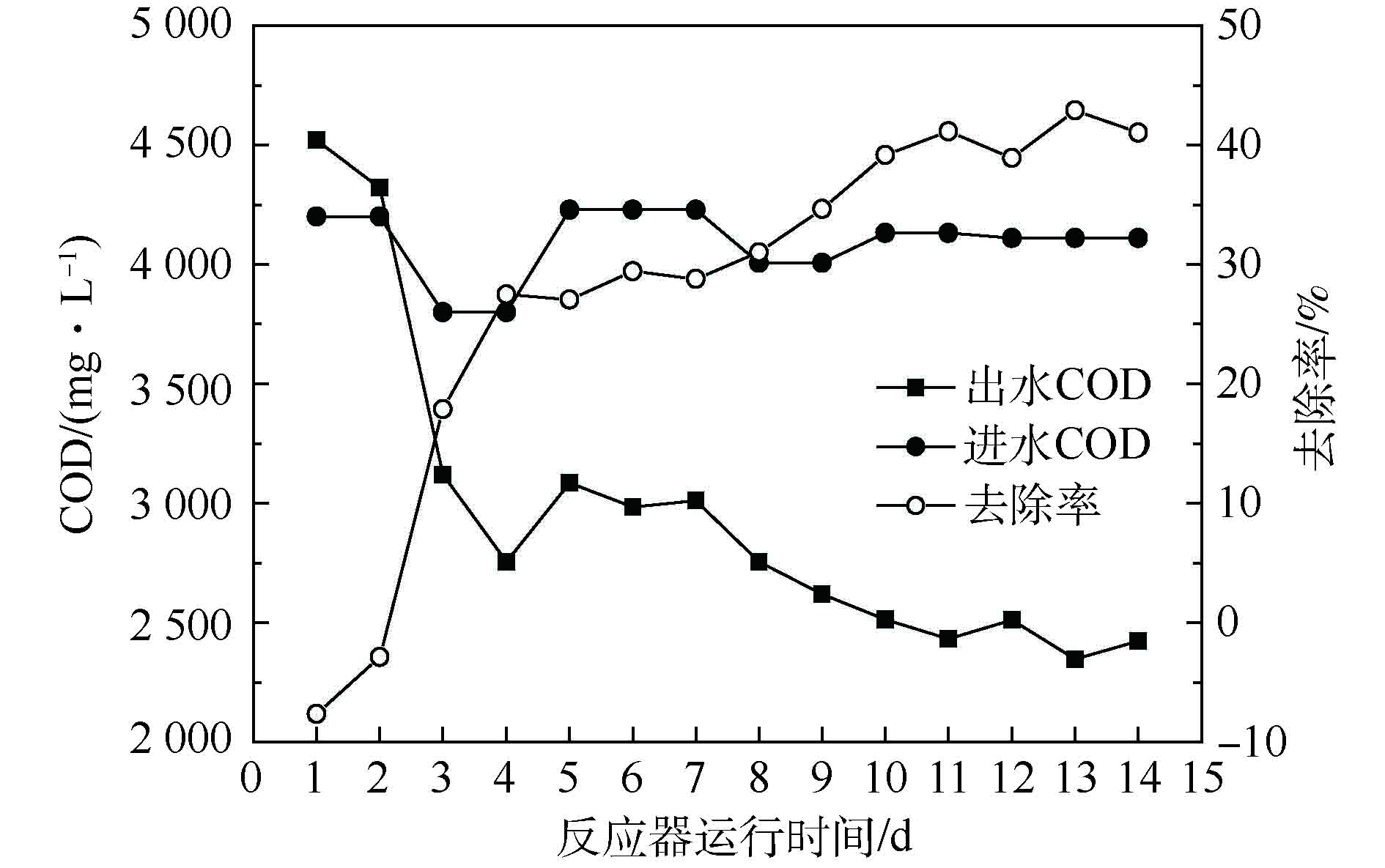
在此阶段,对包埋填料进行活性恢复。由图6可知,反应器初始启动时,出水COD高于进水COD;随反应器运行时间的延长,COD去除率稳定在38.91%~42.90%,大部分COD还未被有效利用。究其原因:一方面是因为PVA的溶出;另一方面,实验中主要功能菌为非完全氧化型硫酸盐还原菌(Desulfomicrobium),出水中含有大量的溶解性硫化物以及未被完全利用的乳酸钠和代谢产物乙酸。因此,实验可适当降低C/S[14],以减少COD的浪费,降低反应运行成本。
如图7所示,经过5 d的恢复培养,
SO2−4 去除率稳定在80%以上,去除率最高可达91.96%。出水硫酸盐浓度维持在250 mg·L−1以下,满足地表水环境标准,证明了包埋生物活性填料良好的工程实用性。
2.3.2 包埋生物活性填料二次恢复考察
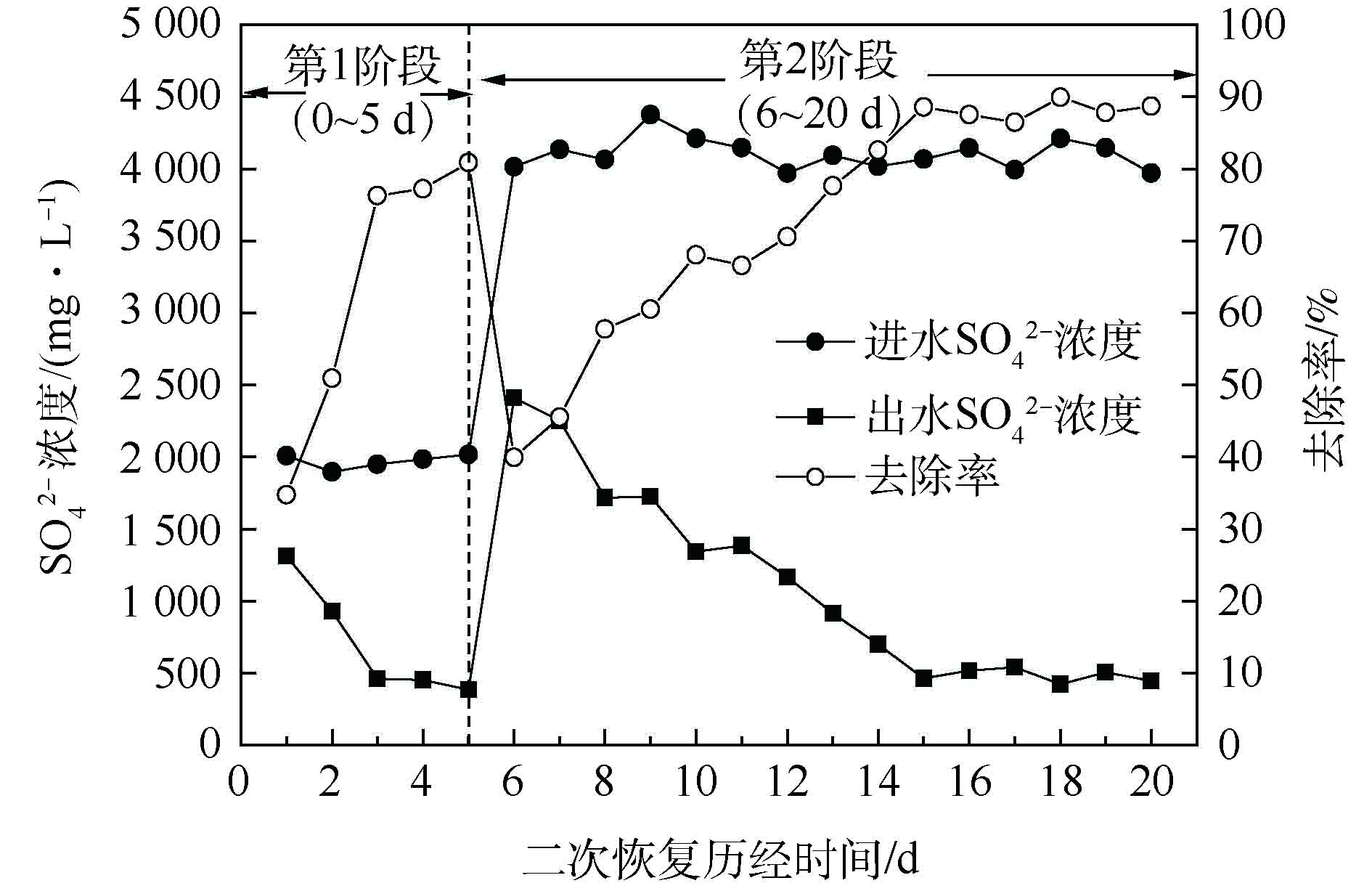
为进一步探究包埋活性填料对饥饿环境的忍耐能力,本研究将填料静置15 d后,在适宜条件下对填料进行为期20 d的二次恢复。硫酸盐还原菌富集培养过程采用硫酸盐浓度指标表征,C/S=2。结果如图8所示。实验采用间歇培养方式,控制温度在30~35 ℃、pH=7.0~7.5、DO≤0.5 mg·L−1、C/S=2、HRT=10 h。实验共分为第1阶段(0~5 d)和第2阶段(6~20 d)2个阶段。
由图8可以看出,在第1阶段,经3 d的恢复,硫酸盐还原率由34.72%上升至80.89%。为考察较高
SO2−4 负荷下包埋填料的处理情况,在第2阶段,继续提高进水
SO2−4 负荷,由2 000 mg·L−1增至4 000 mg·L−1。经过9 d的培养,硫酸盐还原率即可达到87.87%,最终出水稳定在500 mg·L−1以下。与纤维丝填料驯化富集过程相比,包埋生物活性填料具有明显的驯化时间短、处理效率高等特点。究其原因:一方面由于填料为外圆中空的圆柱状,比表面积相对较大,SEM结果也表明,包埋填料内存在大量利于传质的通道,从而保证了包埋填料与培养液的传质畅通[34];另一方面可能是由于细菌包埋后,减少了细菌的流失,为SRB提供了良好的厌氧环境。以上实验表明,该SRB活性包埋填料具有较强的生存能力和耐高负荷能力,在适宜条件下,经短期培养,即可实现恢复利用。
3. 结论
1)采用小空间厌氧移动床的运行方式,逐渐提高基质浓度,到
SO2−4 浓度为4 000 mg·L−1、COD值为8 000 mg·L−1时,实现了硫酸盐还原菌的规模化富集,
SO2−4 和COD的去除率分别稳定在80.47%~86.48%和53.17%~55.31%。
2)高通量测序结果表明,筛选后的污泥系统多样性较原污泥小,Desulfomicrobium依然为系统的优势菌种,比例从36.06%提高到58.68%,培养过程中未出现SRB与MPB种群竞争生长的现象。
3)包埋筛选富集后的活性污泥,通过短期的驯化,硫酸盐还原率可达91.96%。将静置15 d后的包埋生物活性填料进行二次恢复,最终在高负荷(
SO2−4 浓度为4 000 mg·L−1)下,硫酸盐去除率稳定在85%以上, 包埋活性污泥具有较强的还原性能及恢复性能,具有较强的工程实用性。
-
表 1 不同水体条件下青霉素G钠盐水(降)解实验初始条件
Table 1. Initial conditions for hydrolysis (degradation) test of penicillin G sodium in different water matrix
反应器 初始配置 初始pH 1#、2# 纯水 + 1 g·L−1青霉素G钠盐 7.35 3#、4# 自来水 + 15 g·L−1淀粉 + 15 g·L−1碳酸氢钠 + 0.5 g·L−1硫酸铵 + 1 g·L−1青霉素G钠盐 8.15 5#、6# 灭活污泥(SS 32.75 g·L−1) + 自来水 + 15 g·L−1淀粉 + 15 g·L−1碳酸氢钠 + 0.5 g·L−1硫酸铵 + 1 g·L−1青霉素G钠盐 7.40 7#、8# 活性污泥(SS 32.75 g·L−1) + 自来水 + 15 g·L−1淀粉 + 15 g·L−1碳酸氢钠 + 0.5 g·L−1硫酸铵 + 1 g·L−1青霉素G钠盐 8.20 表 2 厌氧污泥活(驯)化的有机物降解和甲烷转化效果
Table 2. Performance of organics degradation and methane conversion during anaerobic sludge activation
反应器 初始COD/(mg·L−1) 末端COD/(mg·L−1) COD去除率/% 甲烷产量/mL 甲烷转化率/% 末端乙酸/(mg·L−1) 末端丙酸/(mg·L−1) 末端pH 1# 14 906 4 093 72.5 1 199 73.8 75 213 8.25 2# 14 906 4 180 72.0 1 189 73.8 78 221 8.30 3# 14 906 4 399 70.5 1 104 69.9 83 235 8.25 4# 14 906 4 122 72.4 1 177 72.6 76 215 8.35 表 3 不同浓度青霉素G钠盐条件下厌氧污泥的有机物降解和甲烷转化效果
Table 3. Performance of organics degradation and methane conversion by anaerobic sludge at different concentrations of penicillin G sodium
反应器 初始青霉素G钠/(mg·L−1) 初始COD/(mg·L−1) 末端COD/(mg·L−1) COD去除率/% 甲烷产量/mL 甲烷转化率/% 末端乙酸/(mg·L−1) 末端丙酸/(mg·L−1) 1~2# 0 14 906 4 024±171 73.0±1.1 1 147±15 70.3±2.9 47.2±1.4 232.7±7.0 3~4# 1 14 908 4 100±145 72.5±1.0 1 080±47 67.3±0.6 48.0±1.7 237.0±8.3 5~6# 10 14 923 4 357±182 70.8±1.2 1 049±32 68.1±1.6 51.1±1.5 251.9±7.6 7~8# 100 15 072 8 228±135 45.4±0.9 734±29 71.5±0.9 29.5±1.2 102.6±4.1 9~10# 1 000 16 570 14 492±236 12.5±1.4 217±17 73.2±5.5 13.2±0.5 25.3±1.0 -
[1] ZHANG Q Q, YING G G, PAN C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of china: source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 2015, 49(11): 6772-6782. [2] 张昱, 冯皓迪, 唐妹, 等. β-内酰胺类抗生素的环境行为与制药行业源头控制技术研究进展[J]. 环境工程学报, 2020, 14(8): 18. [3] 胡晓东. 制药废水处理技术及工程实例[M]. 制药废水处理技术及工程实例, 2008. [4] 赵一章. 产甲烷菌选择性连续富集的研究——青霉素对富集和分离的影响[J]. 中国沼气, 1984(3): 3-9. [5] 赵志瑞, 冯爱民, 万敬敏, 等. 低温UASB处理青霉素综合废水及动力学分析[J]. 环境工程学报, 2017, 11(9): 4910-4916. [6] 王路光, 贾璇, 王靖飞. EGSB工艺处理青霉素生产废水试验研究[J]. 水处理技术, 2009, 35(2): 92-96. [7] 巩有奎, 相会强, 穆兰. 厌氧折流板反应器降解青霉素废水的特性研究[J]. 现代化工, 2006(S1): 172-175. [8] MULLAI P, ARULSELVI S, NGO H H, et al. Experiments and ANFIS modelling for the biodegradation of penicillin-G wastewater using anaerobic hybrid reactor[J]. Bioresour Technol, 2011, 102(9): 5492-5497. doi: 10.1016/j.biortech.2011.01.085 [9] 王开红, 廉静, 岳琳, 等. UASB反应器处理青霉素废水启动特性的研究[J]. 河北工业科技, 2012, 29(2): 73-77. doi: 10.7535/hbgykj.2012yx0204 [10] 赵明明, 李夕耀, 李璐凯, 等. 碱度类型及浓度对剩余污泥中温厌氧消化的影响[J]. 中国环境科学, 2019, 39(5): 1954-1960. doi: 10.3969/j.issn.1000-6923.2019.05.019 [11] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社, 2002. [12] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中氨苄青霉素的测定-高效液相色谱法: GB/T 23385-2009[S]. 北京: 中国标准出版社, 2009. [13] QIAN L, WEI Q, WANG X, et al. Kinetic characterization of thermophilic and mesophilic anaerobic digestion for coffee grounds and waste activated sludge[J]. Waste Management, 2015, 36(feb.): 77-85. [14] 余翠花, 方平飞, 朱运贵, 等. 青霉素类、单环β-内酰胺类及碳青霉烯类抗生素在5种常用输液中的稳定性[J]. 中南药学, 2012, 10(12): 943-945. [15] 王桂荣, 孙丽萍, 栾芳. 临床应用青霉素G钠易忽略的几个问题[J]. 中国误诊学杂志, 2001(5): 783-784. doi: 10.3969/j.issn.1009-6647.2001.05.130 [16] 林志福, 伍健东, 周兴求, 等. 厌氧颗粒污泥胞外聚合物的影响因素研究[J]. 环境工程学报, 2009, 3(7): 1311-1315. [17] NARUMIYA M, NAKADA N, YAMASHITA N, et al. Phase distribution and removal of pharmaceuticals and personal care products during anaerobic sludge digestion[J]. Journal of hazardous materials, 2013, 260C(sep.15): 305-312. [18] LIU F, TENG S, SONG R, et al. Adsorption of methylene blue on anaerobic granular sludge: Effect of functional groups[J]. Desalination, 2010, 263(1-3): 11-17. doi: 10.1016/j.desal.2010.06.026 [19] 季军远, 林久淑, 朱晓桐, 等. ANAMMOX-UASB反应器启动过程中的生物特性[J]. 环境工程学报, 2021, 15(10): 3358-3367. doi: 10.12030/j.cjee.202106067 [20] MITCHELL S M, ULLMAN J L, TEEL A L, et al. pH and temperature effects on the hydrolysis of three beta-lactam antibiotics: Ampicillin, cefalotin and cefoxitin[J]. Science of the Total Environment, 2013, 466-467C: 547-555. [21] CHEN J, SUN P, ZHOU X, et al. Cu(II)-catalyzed transformation of benzylpenicillin revisited: The overlooked oxidation[J]. Environmental Science & Technology, 2015, 49(7): 4218. [22] 高雪泉. 抗生素等有机物的水解速率常数及产物研究[D]. 大连: 大连理工大学, 2016. [23] 盛峰. 青霉素在天然水体及土壤矿物上的转化机理及毒性研究[D]. 南京: 南京大学, 2019. [24] 房晓君, 贾丽英, 刘娟. 城镇污水处理厂中β-内酰胺类抗生素的分布与迁移[J]. 河北工程大学学报(自然科学版), 2014, 31(2): 64-67. [25] 胡晓东, 梁晓媚, 樊建军, 等. 青霉素废水厌氧毒性试验研究[J]. 工业水处理, 2009, 29(8): 52-55. doi: 10.3969/j.issn.1005-829X.2009.08.015 期刊类型引用(9)
1. 生弘杰,王芳,冯发运,程金金,张银萍,葛静,张雷刚,蒋新,余向阳. 基于群体感应的生物膜技术在土壤污染修复中的应用与展望. 土壤学报. 2024(03): 583-593 .  百度学术
百度学术
2. 王文标,谢靖,谢丽. 硫酸盐对厌氧消化的影响及强化工艺研究进展. 净水技术. 2024(S1): 8-14 .  百度学术
百度学术
3. 李伟华,王家祥,郭宁,朱兆亮. SRB处理硫酸盐废水的影响因素探究. 工业用水与废水. 2024(04): 12-17 .  百度学术
百度学术
4. 邹宇,沙海超,向茹滢,袁恺成,杨金辉,曾涛涛. 生物炭负载微生物处理含镉废水的效能与机理. 工业水处理. 2023(07): 135-143 .  百度学术
百度学术
5. 何蕊,康志超,朱国鹏,王琪荣,于洪文. 海藻酸钠固定硫酸盐还原菌、镍-铁纳米粒子生物微球对污水中Cd~(2+)的去除. 环境工程学报. 2022(05): 1480-1489 .  本站查看
本站查看
6. 郑彭生. 煤化工废水厌氧生物处理技术研究进展. 水处理技术. 2021(06): 24-27+33 .  百度学术
百度学术
7. 张颖,程千瑞,张磊,李喜林,李致格. 响应曲面法对杂化材料-SRB处理铬和氟地下水优化研究. 四川轻化工大学学报(自然科学版). 2020(04): 22-28 .  百度学术
百度学术
8. 张颖,李致格,张磊,李喜林,张富隆. 纳米ZrO_2-SRB颗粒对铬和氟污染地下水修复的动态实验. 环境工程学报. 2020(09): 2548-2559 .  本站查看
本站查看
9. 杨宗政,许文帅,吴志国,曹井国,武莉娅,王春虎,赵晓宇. 微生物固定化及其在环境污染治理中的应用研究进展. 微生物学通报. 2020(12): 4278-4292 .  百度学术
百度学术
其他类型引用(3)
-






 下载:
下载: