-
苯胺是化工、印染等工业废水中的常见污染物,其结构中的芳香环和胺基对微生物具有很强的毒性[1]。苯胺类废水的可生化性较差,不易用生物法有效处理[2],而吸附法、光催化氧化法、电化学法等常用处理方法存在费用高、效率低、可能引发二次污染等问题[3]。因此,为防治苯胺类废水污染,减轻其危害,亟需开发经济、高效、环保的苯胺废水处理方法。
目前,城镇污水处理厂基于经济性和运行效果的综合考虑,多选择基于活性污泥的A2/O工艺。但常规的A2/O工艺易受有毒物质影响,且存在硝化菌和反硝化菌泥龄不平衡的问题,脱氮效率受到限制[4-5],苯胺难以有效降解。因此,如能对A2/O系统进行强化,使之能更有效地处理苯胺废水,将对该类废水处理提供现实借鉴。近年来,固定化包埋技术在污水处理领域成为研究热点[6]。投加到污泥系统中的包埋菌可改善污泥菌群,增强系统耐冲击负荷性能[7],提高对苯胺等污染物的去除能力。同时,包埋菌不随污泥回流,可避免功能菌群流失,解决常规A2/O系统菌群泥龄不平衡的问题。以上优点令该技术具备应用上的潜在价值,而目前针对苯胺废水在A2/O工艺中的处理,使用包埋菌进行生物强化的研究还鲜见报道。
为研究包埋菌生物强化A2/O系统对苯胺废水的处理效果,本研究采用好氧、厌氧型包埋菌对常规A2/O系统进行生物强化,并研究了常规A2/O和生物强化A2/O对废水中化学需氧量(COD)、总氮(TN)、氨氮(
NH+4 -N)的去除性能,此外,进一步考察了系统内活性污泥比好氧呼吸速率(specific oxygen uptake rate, SOUR)、胞外聚合物(extracellular polymeric substances,EPS)和微生物菌群结构的变化情况,从微生物角度揭示处理能力变化原因,为城镇污水处理厂高效处理苯胺类工业废水提供参考。
全文HTML
-
A2/O系统接种污泥分别取自常州某污水处理厂厌氧池、缺氧池、好氧池。A2/O系统进水为实验室配置的模拟废水,配置参考YOO等[8]和刘静[9]的研究中所用的配方。进水组分为:无水葡萄糖300 mg·L−1、大豆蛋白胨100 mg·L−1、乙酸铵242 mg·L−1、磷酸二氢钾21.88 mg·L−1、氯化钙10 mg·L−1、七水硫酸镁51.5 mg·L−1、酵母浸膏50 mg·L−1、微量元素0.1 mg·L−1,另依次添加5、15、30、60 mg·L−1苯胺作为特征污染物。
用于生物强化的好氧及厌氧型包埋菌购自南京霖恒彦水处理技术有限公司。包埋菌为在好氧及厌氧条件下经驯化、筛选并固定的菌群。包埋菌外观为1 cm3左右的凝胶状固体颗粒,并具有一定的机械强度,耐水力冲击。
-
实验装置采用自制的A2/O反应器,厌氧池、缺氧池和好氧池体积分别为2.2、2.2、4.8 L,总有效容积为9.2 L。在厌氧池和好氧池出水口处用孔径为0.5 cm的铁丝网遮挡,防止包埋菌在投加后随泥水混合物流出而流失。反应器使用蠕动泵(LongerPump,BT100-2J)进水和回流污泥;好氧池使用气泵(Hailea,AC0-9601)供氧。污泥回流比为70%~80%,硝化液回流比为200%,水力停留时间为24 h。
-
常规A2/O系统运行总计44 d。前9 d进水为生活污水(进水组分中无苯胺),第10~44天进水中按照5、15、30、60 mg·L−1浓度添加苯胺,生物强化A2/O系统运行总计30 d。第1~10天,好氧池投加4%(体积分数)好氧型包埋菌;第11~20天,在好氧池另投加4%好氧菌;第21~30天,在厌氧池另投加4%厌氧菌。之后系统继续运行30 d,以考察系统的长期稳定性。
-
在常规和强化A2/O系统运行最后的1 d,从好氧池末端提取污泥样品,测定污泥SOUR、EPS,提取DNA并分析微生物群落。
比好氧呼吸速率(SOUR)采用自制设备测定:好氧池污泥取样,充分曝气后在密封环境下以30 s为间隔用溶解氧仪测定溶解氧(DO)浓度的变化,另取污泥样品测定MLSS,SOUR根据式(1)进行计算。
式中:S为比好氧呼吸速率,mg·(g·h)−1;CDO为溶解氧变化值,mg·L−1;Δt为时间变化值,h;X为生物固体浓度,g·L−1。
本研究以污泥细胞中蛋白质 (PN) 和多糖 (PS) 含量之和来表示活性污泥EPS含量。蛋白质采用Lowry法[10]测定,多糖采用蒽酮-硫酸法[11]测定。
活性污泥微生物群落分析通过上海美吉生物有限公司生物云平台完成,具体步骤如下:采用美国MP公司Fast DNA Spin Kit for Soil试剂盒提取污泥DNA,DNA纯度及浓度由NanoDrop2000微量分光光度计测定,满足要求后进行PCR扩增;采用TruSeqTM DNA Sample Prep Kit试剂盒构建测序文库;采用引物338F和806R进行测序;DNA文库混合后,使用Illumina MiSeq测序仪测序。通过比对Silva 128/16s数据库,分别在各个分类水平统计各样本的群落组成。
-
每2 d对系统进出水进行取样,测定水样中TN、
NH+4 -N和COD含量。TN采用碱性过硫酸钾紫外分光光度法(HJ 636-2012)测定;NH+4 -N采用纳氏试剂分光光度法(HJ 535-2009)测定;COD采用哈希COD试剂盒(哈希DR6000分光光度计)测定。
1.1. 实验原料
1.2. 实验装置
1.3. 实验方案
1.4. 微生物响应分析
1.5. 水质分析
-
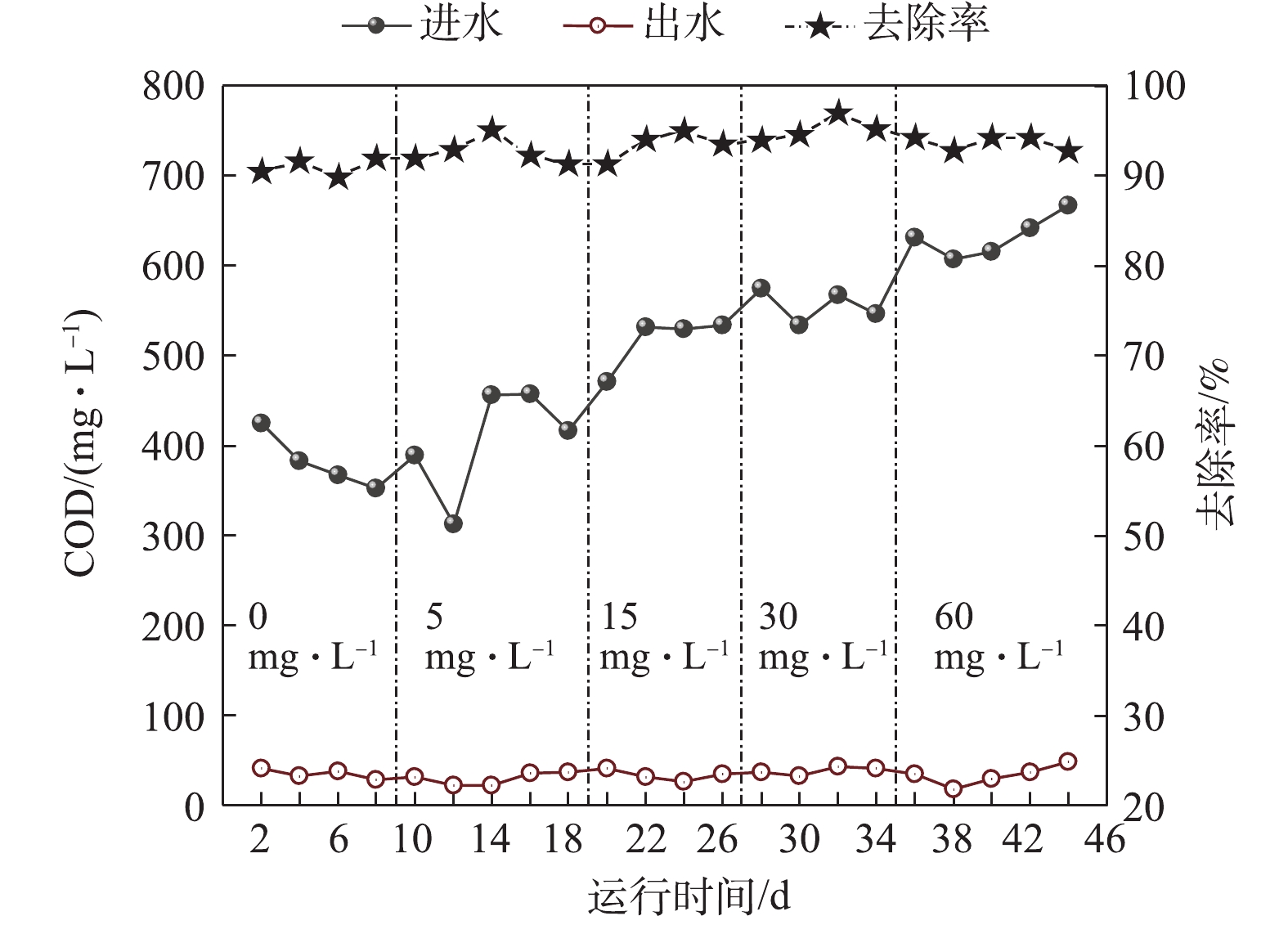
常规A2/O系统对生活污水和苯胺废水中COD的去除性能如图1所示。第1~9天,COD进水平均值为381.5 mg·L−1,出水COD平均值为34.6 mg·L−1,平均去除率为91.0%。在第9天,在进水中依次添加5~60 mg·L−1苯胺,用于模拟苯胺废水。如图1所示,废水中COD随着苯胺浓度的提高而不断提高,从406.3 mg·L−1提升至632.4 mg·L−1。在此过程中,反应器出水COD维持在18.2~48.5 mg·L−1,平均去除率维持在92.7%~95.2%。COD的去除效果受水质影响较小,常规A2/O系统对苯胺废水中COD的去除效果较为稳定。
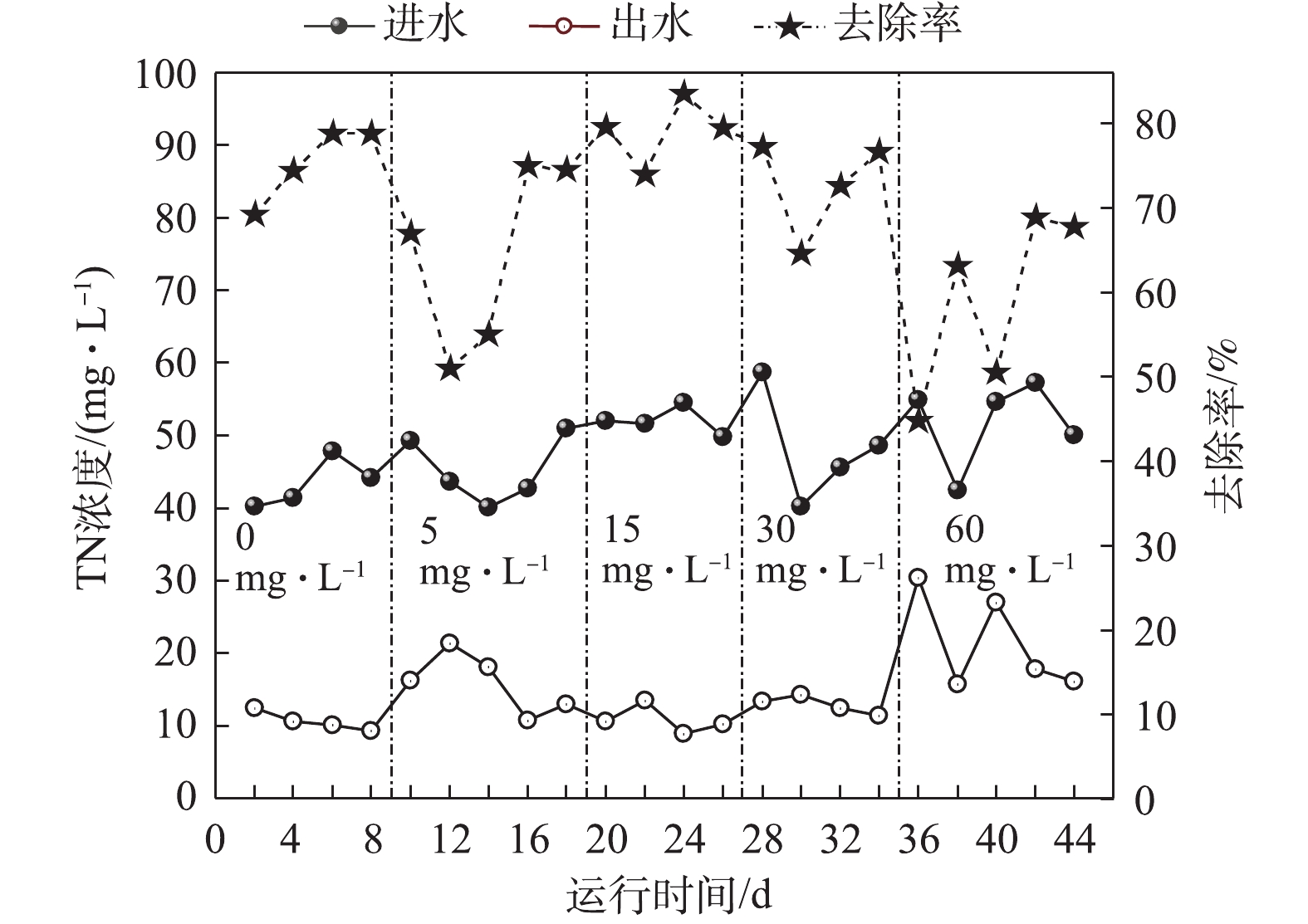
图2显示了常规A2/O系统对苯胺废水中TN的去除效果。第1~9天,TN进水平均浓度为43.4 mg·L−1,去除率为75.3%。第9~12天,当5 mg·L−1苯胺进入A2/O系统后,TN平均去除率下降到64.4%,此时活性污泥菌群可能受到苯胺毒害作用,导致脱氮性能下降。随后在第13~19天,脱氮性能逐渐恢复。第20~34天,TN的平均去除率为75.9%。在第35天后,由于苯胺浓度继续提高,系统污泥脱氮性能再次恶化,系统TN平均去除率下降至59.0%,TN平均出水浓度为21.4 mg·L−1。
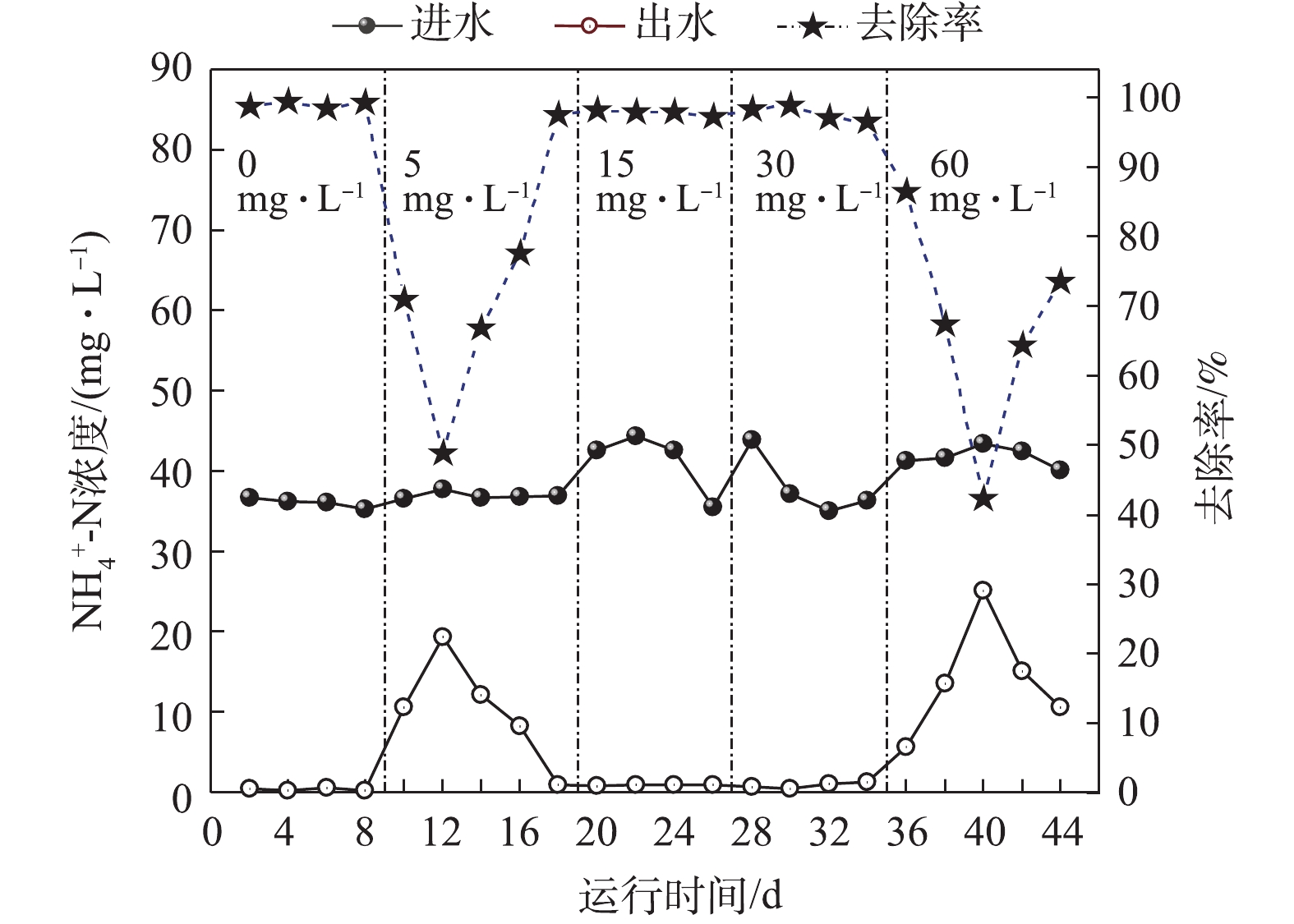
常规A2/O系统对
NH+4 -N的去除效果如图3所示。全程进水NH+4 -N平均浓度为38.8 mg·L−1。第1~9天,NH+4 -N平均出水浓度为0.4 mg·L−1,平均去除率为98.9%,去除稳定且高效。第9天,当苯胺以5 mg·L−1含量进入A2/O系统后,系统对NH+4 -N的去除能力明显下降。第12天的去除率下降至该阶段的最低值48.8%。这是由于苯胺对于硝化细菌具有毒害作用,可与硝化菌胞外酶或细胞膜上酶的活性部位发生作用,抑制氨氧化的进行[12]。有研究[13]表明,硝化反应在苯胺浓度高于3~4 mg·L−1时较难有效进行。另一方面,苯胺在微生物降解的开环过程中有额外的NH+4 -N生成,部分可被微生物利用,而多余部分需要通过硝化反应去除[14],这也造成了NH+4 -N在系统内的累积。随后,常规A2/O系统又经过8 d的运行,污泥能较好地适应苯胺负荷,NH+4 -N去除率逐渐恢复至97.40%。第20~27天,苯胺浓度提升至15 mg·L−1;第28~35天,苯胺浓度提升到30 mg·L−1。在此期间,系统仍能维持96.9% ~ 98.8%的NH+4 -N去除率。第36天以后,当苯胺浓度提升至60 mg·L−1时,系统NH+4 -N平均出水浓度为14.01 mg·L−1,去除能力再次明显下降至66.8%,且未再恢复至初始水平。这表明常规A2/O系统在60 mg·L−1苯胺负荷下,活性污泥难以维持高效的氨利用率。本节对比了常规A2/O系统对生活污水和苯胺废水处理效果的差异。常规A2/O系统对生活污水有较好的处理效果,COD、TN、
NH+4 -N的出水在运行初期已达到城镇污水处理厂污染物排放一级A标准(GB 18918-2002);对苯胺废水的处理效果不佳,主要表现为脱氮能力在较高浓度苯胺负荷下恶化。为使系统有效处理苯胺废水,投加包埋菌以研究生物强化A2/O系统对污染物的处理效果。 -
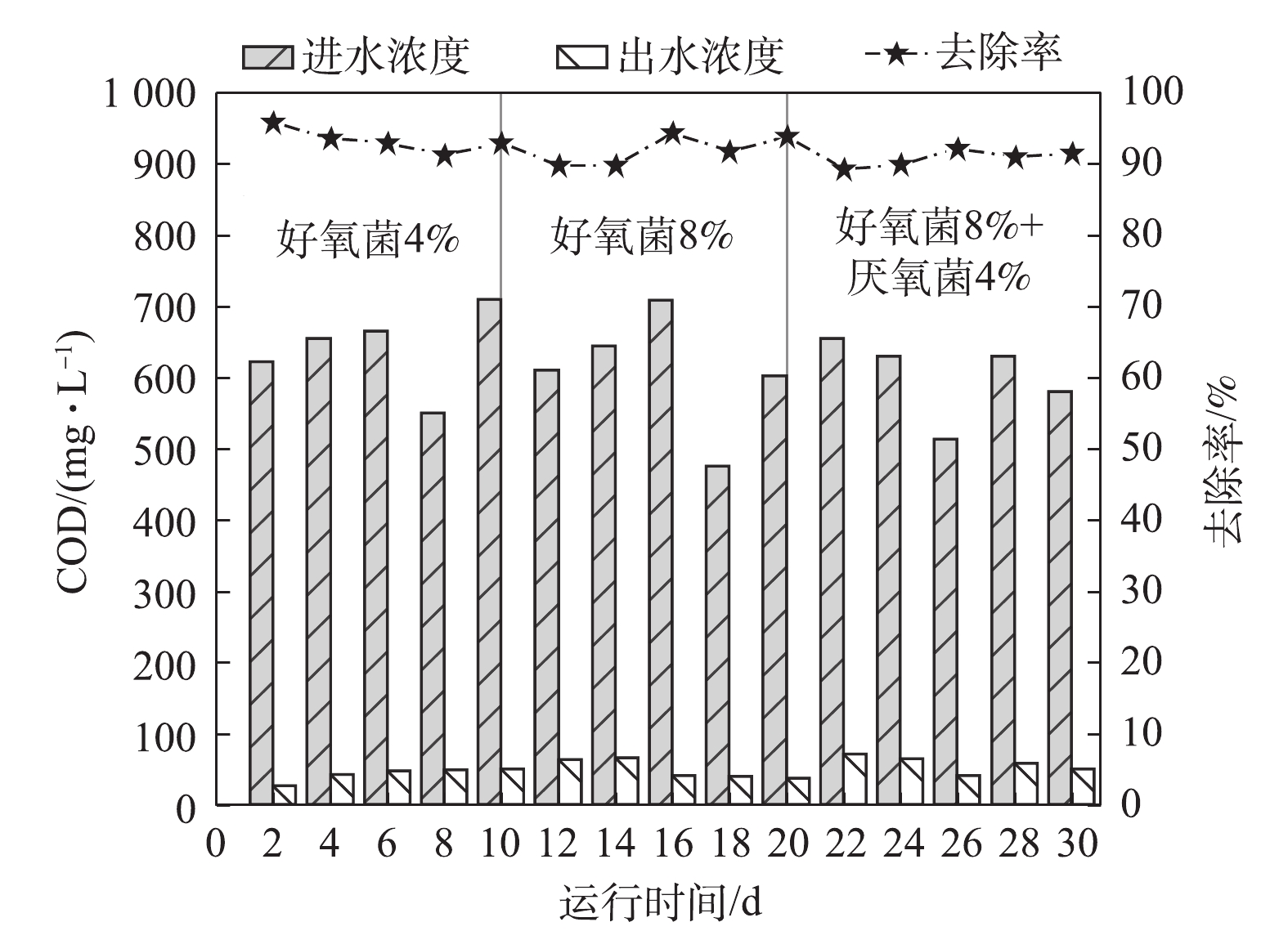
包埋菌强化A2/O系统对COD的去除效果如图4所示,进水COD平均值为616.5 mg·L−1,出水平均值为49.2 mg·L−1。COD在3种投菌方式下的平均去除率分别为93.3%、91.9%、90.7%,并无明显变化,这表明强化型A2/O系统对有机基质的利用率仍然较高,对COD仍维持在较高的去除水平。
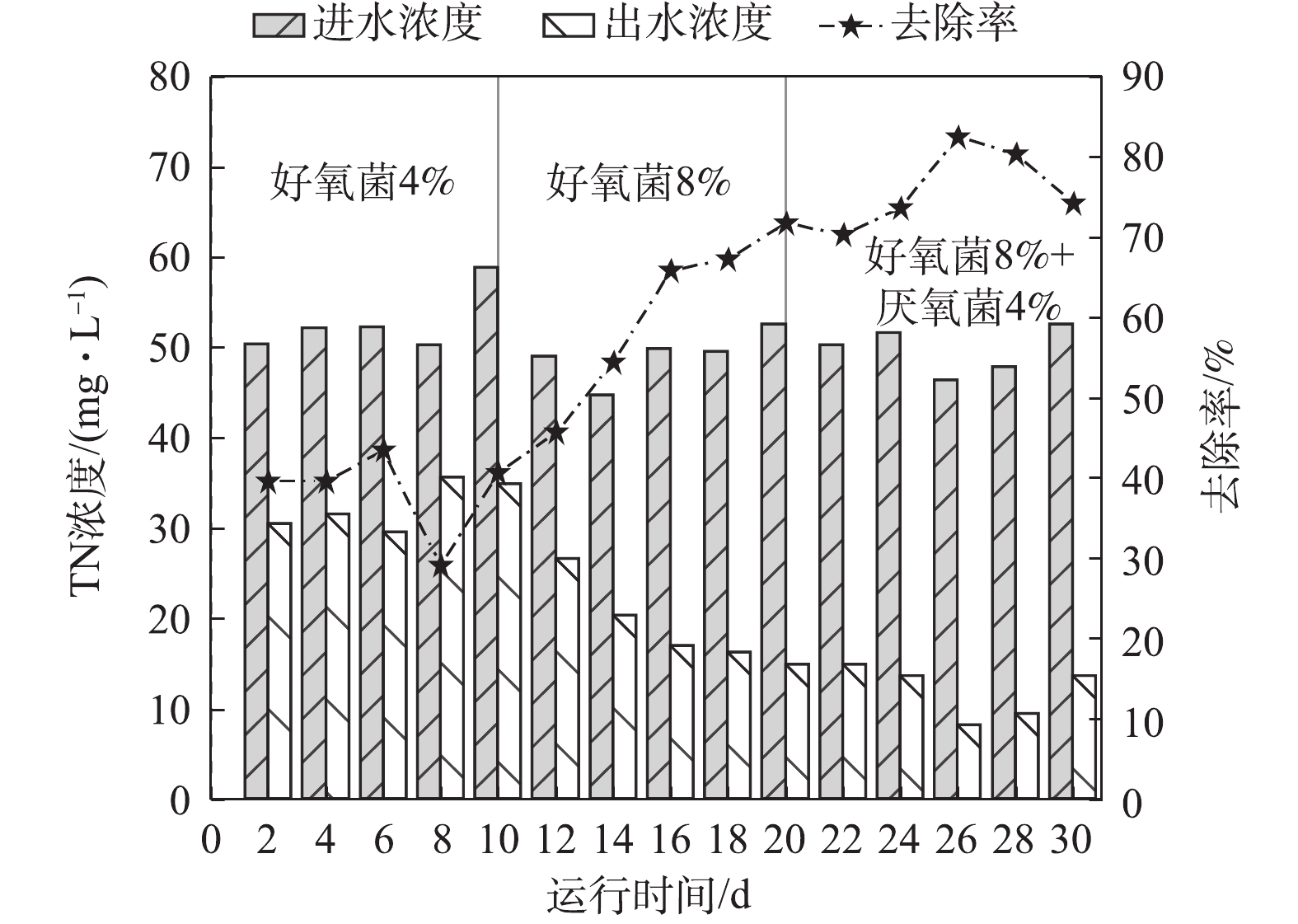
由图5可知,包埋菌强化A2/O系统对TN去除表现出显著的强化效果。强化系统全程TN进水平均浓度为50.5 mg·L−1。在3种投菌方式下,第1~10天,TN出水平均浓度为32.4 mg·L−1,平均去除率为38.5%;第11~20天,TN出水平均浓度逐步降低到19.0 mg·L−1,去除率逐步上升到61.0%;第21~30天,TN出水平均浓度进一步降低到11.9 mg·L−1,去除率达到76.2%,脱氮性能得到进一步改善。
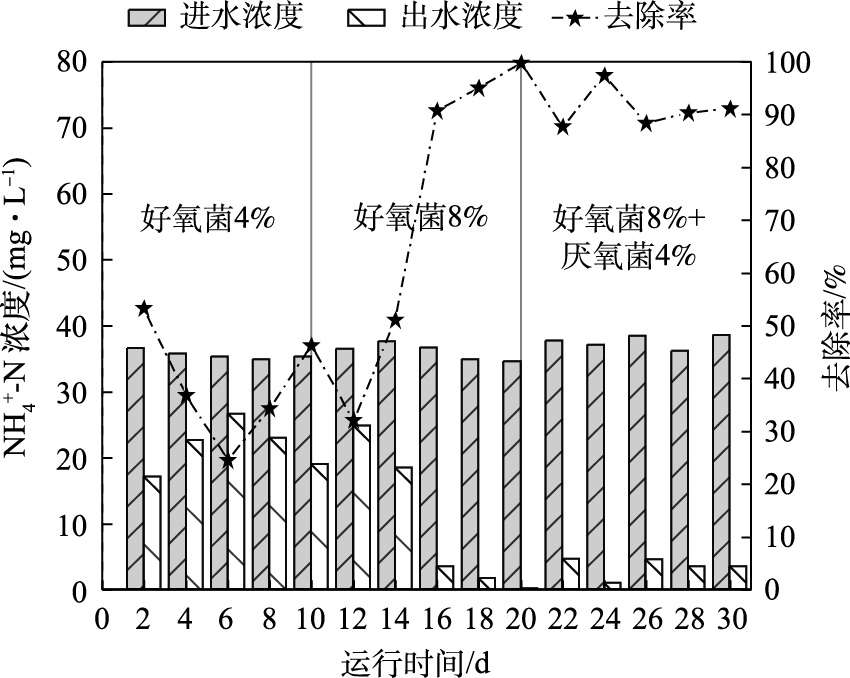
由图6可知,生物强化A2/O系统对
NH+4 -N的去除效果呈现与TN相似的变化趋势。全程NH+4 -N进水平均浓度为36.4 mg·L−1。第1~10天,NH+4 -N的出水平均浓度为21.6 mg·L−1,去除率为39.0%;第11~20天,NH+4 -N出水平均浓度下降到9.7 mg·L−1,去除率升高到73.7%。结合图5可知,在第16天出水NH+4 -N浓度降低至3.4 mg·L−1。但此时TN出水浓度仍为17.0 mg·L−1。这是因为系统内硝态氮的浓度较高,硝化菌活性得到增强,但反硝化过程可能仍未有效进行,导致硝态氮积累。随着系统继续运行,第21~30天,NH+4 -N去除率达91.0%,且NH+4 -N和TN出水浓度均较低,这表明系统脱氮性能得到恢复。本节结果展示了生物强化A2/O系统对苯胺废水的处理效果。在强化过程中,COD始终具有高去除率,说明污泥微生物保持了旺盛的代谢水平,而脱氮能力的变化则反映了菌群结构的改变。包埋菌在20 d内就对污泥菌群有了较好的优化效果,30 d内使TN和
NH+4 -N出水达到一级A标准(GB 18918-2002)。在此基础上,系统继续保持运行30 d,TN出水浓度范围为3.9~17.5 mg·L−1,平均浓度为8.9 mg·L−1,NH+4 -N出水浓度为0.9~6.8 mg·L−1,平均浓度为2.2 mg·L−1,有28 d达标(一级A)。总体来看,包埋菌强化A2/O系统运行稳定性较好。在此基础上,本研究对运行过程中的污泥微生物响应情况进行了考察。 -
在适宜的微生物生长条件下,SOUR可在一定程度上反映降解过程中污泥微生物的代谢活性,从而间接表征污泥活性状态[15-16]。由式(1)的计算结果看出,常规A2/O系统好氧池活性污泥的SOUR为5.82 mg·(g·h)−1,强化A2/O系统为9.07 mg·(g·h)−1。该数据表明,系统在生物强化后活性污泥的耗氧量大幅增加,好氧菌群活性上升。结合2.2节可知,活性污泥对废水中污染物的代谢能力增强。
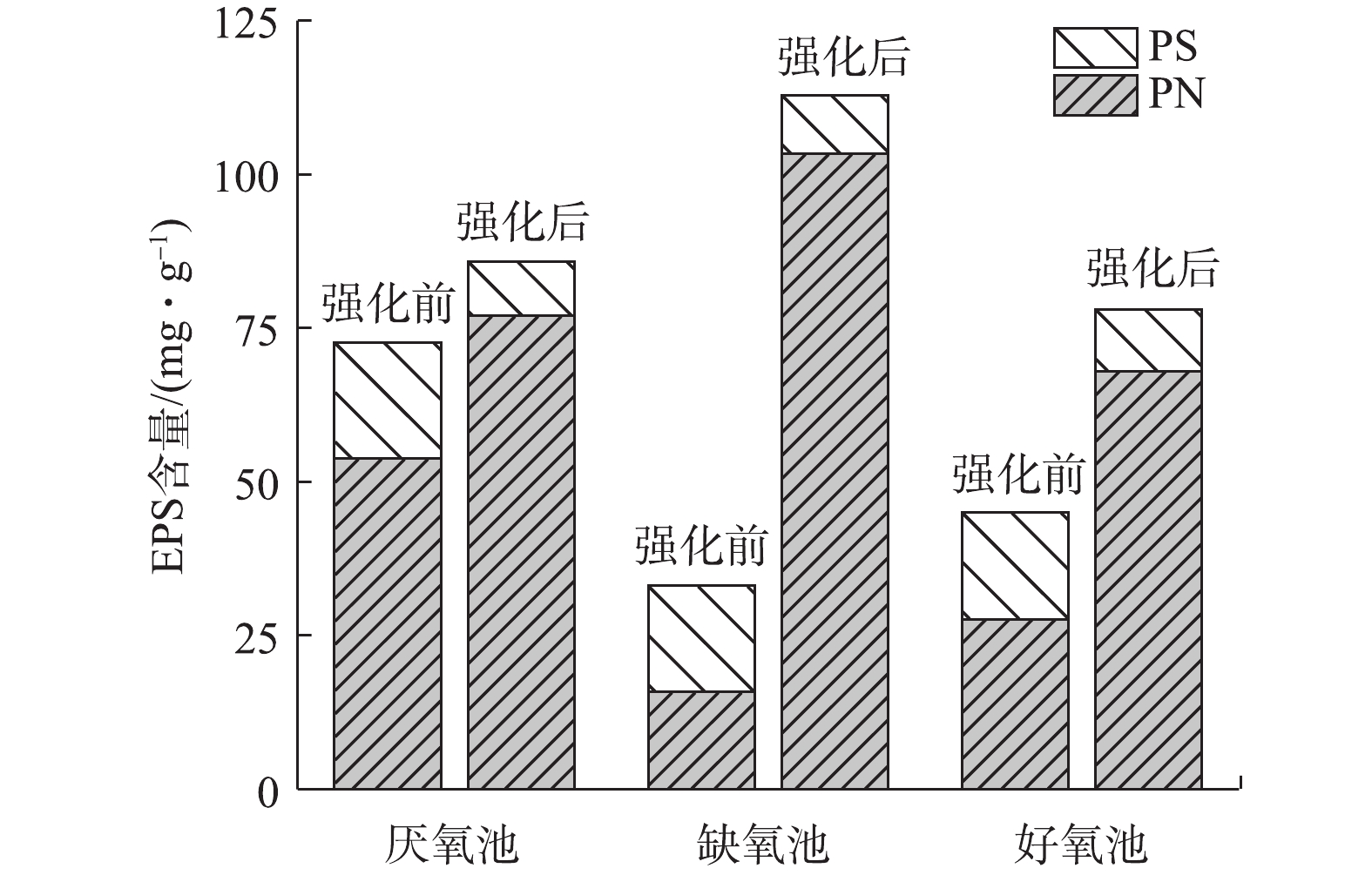
EPS存在于活性污泥絮体内部及表面,主要包括一些高分子物质如PS、PN和核酸等聚合物,其中PS和PN在活性污泥中约占EPS的70%~80%,是EPS中的主要成分[17]。图7显示了常规和强化A2/O系统各区域活性污泥EPS的变化情况。常规A2/O系统厌氧池、缺氧池、好氧池中活性污泥的EPS分别为51.8、75.8、40.2 mg·g−1,强化A2/O系统中的EPS分别为85.8、112.9、78.1 mg·g−1。强化A2/O系统各反应池EPS含量均高于常规A2/O系统。有研究[18]表明,EPS可通过胞外酶将基质降解为小分子后吸收到细胞内,还可抵御有毒物质对细胞的危害。强化系统中EPS的增加提高了微生物表面的疏水性,有利于团聚体的形成[19]。团聚体为活性污泥微生物提供更强的保护作用,从而能够减轻废水中有毒物质对微生物细胞的毒性。EPS中PN的含量均高于PS,这是由于反应器中的微生物降解以糖代谢为主[20],对PN的代谢较弱。PN相较于PS疏水性更强,使污泥更易粘附在包埋菌颗粒表面,在反应池中停留时间更长,从而与污染物进行充分接触。
为探明A2/O系统在生物强化前后处理能力变化的生物学机理,本研究对常规和强化A2/O系统的活性污泥DNA进行测序并分析了群落的变化情况。在门水平上,常规及强化系统活性污泥的优势种群均为Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门)和Firmicutes(厚壁菌门),但各菌群的比例有所变化。强化系统中Proteobacteria的相对丰度比常规系统低15.37%;Bacteroidetes的相对丰度比常规系统高12.88%;Firmicutes比常规系统高1.02%。Proteobacteria包含许多氨氧化细菌(AOB),能在降解有机物的同时实现脱氮[21]。进水中的氯化铵和苯胺降解产生的铵为该类微生物提供了较好的生存环境,从而使Proteobacteria成为污泥微生物中最丰富的菌群。Bacteroidetes能在较恶劣的环境中生存,同时具有非常强的代谢能力,能代谢复杂有机物、脂类和蛋白质等物质[22]。Firmicutes中的Clostridia(芽孢杆菌纲)可能与难以分解的大分子有机物的降解有关[23]。强化A2/O系统中Bacteroidetes和Firmicutes2类微生物增长,使系统对污染物降解和对苯胺废水中有毒物质的抵御能力增强。
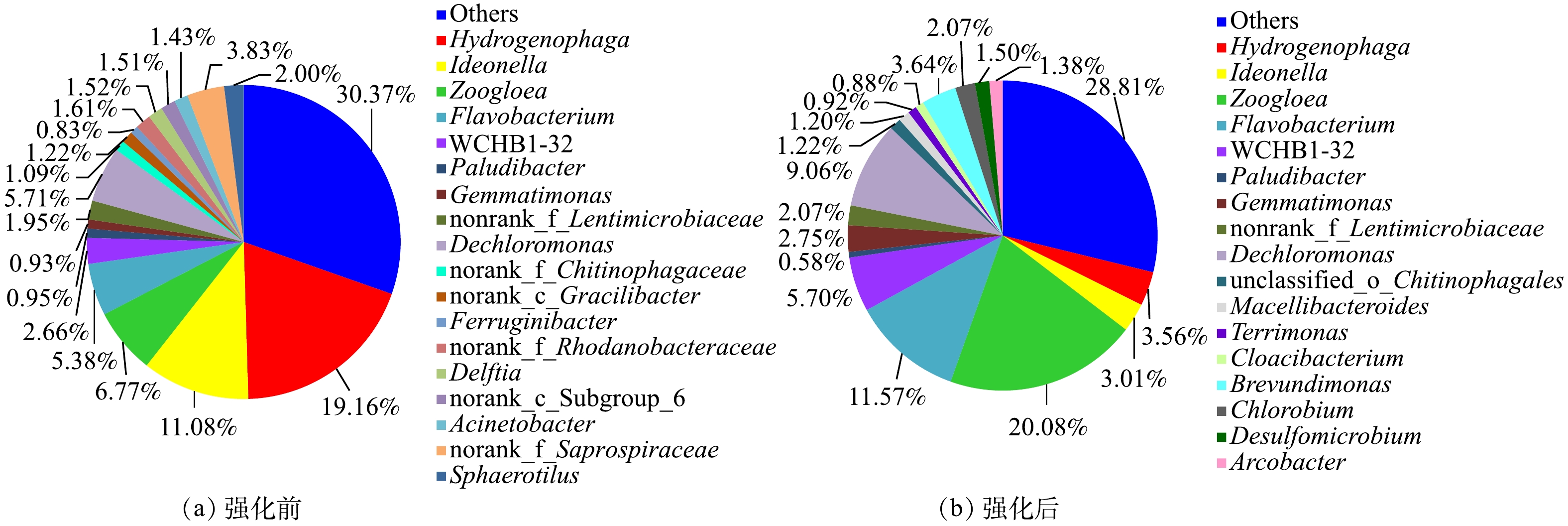
研究进一步分析了在属水平下,活性污泥微生物群落的改变情况,结果如图8所示。在常规A2/O系统中,Hydrogenophaga(氢噬胞菌属)为优势种群,相对丰度为19.16%,Ideonella(艾德昂菌属)、Zoogloea(动胶菌属)、Flavobacterium(黄杆菌属)的相对丰度分别为11.08%、6.77%、5.38%。在强化A2/O系统中,Zoogloea相对丰度增加至20.08%,Flavobacterium增加至11.57%,Hydrogenophaga和Ideonella的相对丰度分别降低为3.56%和3.01%。
Hydrogenophaga属于Proteobacteria,能利用碳源对生化池尾水进行反硝化脱氮的作用。其中有的种具有反硝化作用,但很少利用碳水化合物。Zoogloea对活性污泥中的有机物具有很强的吸附和氧化能力,一些属于Zoogloea的菌株具有反硝化作用,可利用铵作为电子供体[24]。Flavobacterium属于Bacteroidetes,具有异养硝化特性,存在保守的硝酸盐还原和反硝化途径[25]。这说明其对反应器的脱氮能力也有促进作用[26]。生物强化后,在Hydrogenophaga减少的同时,Zoogloea和Flavobacterium的占比大幅增加,对
NH+4 -N的利用更为充分,从而使NH+4 -N去除率恢复到较高的水平。另外,常规A2/O系统中Acinetobacter(不动杆菌属)、Sphaerotilus(球衣菌属)分别占有1.43%和2.00%。二者为丝状细菌,能引起污泥结构的不稳定性,从而可降低污泥的沉降性能[27]。强化后两者消失,表明活性污泥稳定性增强。强化系统的活性污泥中出现了Brevundimonas(短波单胞菌属,3.64%)、Chlorobium(绿菌属,2.07%)等菌群。Brevundimonas是好氧反硝化菌,具有良好的脱氮效果[28],Chlorobium则具有较好的生物除磷作用[29],这进一步表明经生物强化后,系统功能菌种类丰度增加,处理能力增强。
2.1. 常规A2/O系统的运行效果
2.2. 包埋菌强化A2/O系统的运行效果
2.3. 运行过程中活性污泥微生物响应
-
1)常规A2/O系统可有效处理生活污水,但难以有效处理有毒物质浓度较高的苯胺废水。在苯胺浓度为60 mg·L−1时,
NH+4 -N去除率仅为59.0%,TN去除率仅为66.8%。2)生物强化A2/O系统在采用好氧型8%+厌氧型4%包埋菌联合投加方式时,对系统强化效果最佳。强化型的A2/O系统可有效去除苯胺废水中的污染物,COD去除率达90.0%以上,TN去除率达76.2%,
NH+4 -N去除率达91.0%,且运行的稳定性较好。3)与常规A2/O系统相比,生物强化A2/O系统中污泥的SOUR和EPS均有所增加,污泥活性增强,微生物群落分布发生改变。Proteobacteria、Bacteroidetes和Firmicutes为污泥微生物优势种。Zoogloea、Flavobacterium和Brevundimonas等具有反硝化功能的菌属在强化后的相对丰度有所增加,从而提高了强化A2/O系统的脱氮性能。









 DownLoad:
DownLoad: