-
科技的高速发展在提高人类生活水平的同时对环境也会造成极大影响,近年来,国内外水体污染问题日益严峻[1-3]。2015年,中国废水排放总量为7.353×1010 t。其中,城镇生活污水排放量达到了5.352×1010 t[4]。城镇生活污水的处理问题备受关注,因此,AO、A2O、OAO、氧化沟等优良工艺应运而生[5-6]。
缺氧好氧工艺即AO工艺是我国目前广泛应用的一种生物脱氮工艺,由于其脱氮效果较好、原理简单被国内外学者和工程师持续研究和改进[7-9]。OAO工艺即是AO工艺的一种改良工艺,其在传统AO工艺的缺氧池前端增设一级曝气池,具有良好的废水处理效果[10-11]。
微生物是污水生物处理的核心部分,利用分子生物学技术对污水处理过程中活性污泥的微生物菌群进行动态跟踪和功能群种鉴定,有助于筛选并培养出利于污水处理的优势菌种,构建更加合理的活性污泥生态系统,提高污水处理效率[12]。MATSUDA等[13]对日本大阪8个城市污水厂的活性污泥微生物组成进行了分析,发现不同工艺在不同时期微生物群落差异很大。DING等[14]和YE等[15]分别应用AO工艺和A2O工艺处理混合废水和酱油废水,发现Proteobacteria是污水处理中的第一优势菌门。HAN等[16]、曾涛涛等[17]研究氧化沟工艺处理生活污水时发现,大部分细菌属于Proteobacteria和Bacteroidetes这2大门类,其优势菌属有Pseudomonas、Phycisphaera、Methylocystis等。但是,关于OAO工艺处理城镇生活污水过程中活性污泥的微生物特性,目前还少有研究。本研究拟采用16S rDNA高通量测序技术对OAO和AO工艺处理城镇生活污水过程中各反应池的活性污泥中的微生物进行测序分析,为OAO工艺处理城镇生活污水中优势菌种的筛选及培养提供参考。
-
实验装置如图1所示,AO和OAO工艺所用一体化装置均为有机玻璃制作。AO工艺装置长、宽、高分别为0.78、0.4、0.6 m,其中,缺氧池有效容积为30 L,好氧池有效容积为90 L。OAO工艺则在AO工艺基础上,前置1个容积为46 L的曝气池及1个一级沉淀池,装置尺寸为1.16 m×0.4 m×0.6 m。
-
本实验采用实验室配置的模拟城镇生活污水,水质指标如下:COD为340~360 mg·L−1、NH3-N为50.2~72.3 mg·L−1、TN为54.2~75.5 mg·L−1、TP为3.3~8.0 mg·L−1、pH为7.3~8.0。
-
本研究从郑州市某生活污水处理厂的污泥脱水机房获取污泥,其含水率约为80%,将反应器平均污泥浓度设为3 500 mg·L−1,以此计算出OAO工艺需投加的污泥量为2 905 g,AO工艺为2 100 g。同时,从该污水厂硝化液回流管道中取部分混合液,将混合液与污泥一并加入反应器内。而后,开始进水并搅拌混合液,使泥水混合均匀。同时,开启风机进行闷曝,闷曝2 d后,污泥基本恢复生物活性。
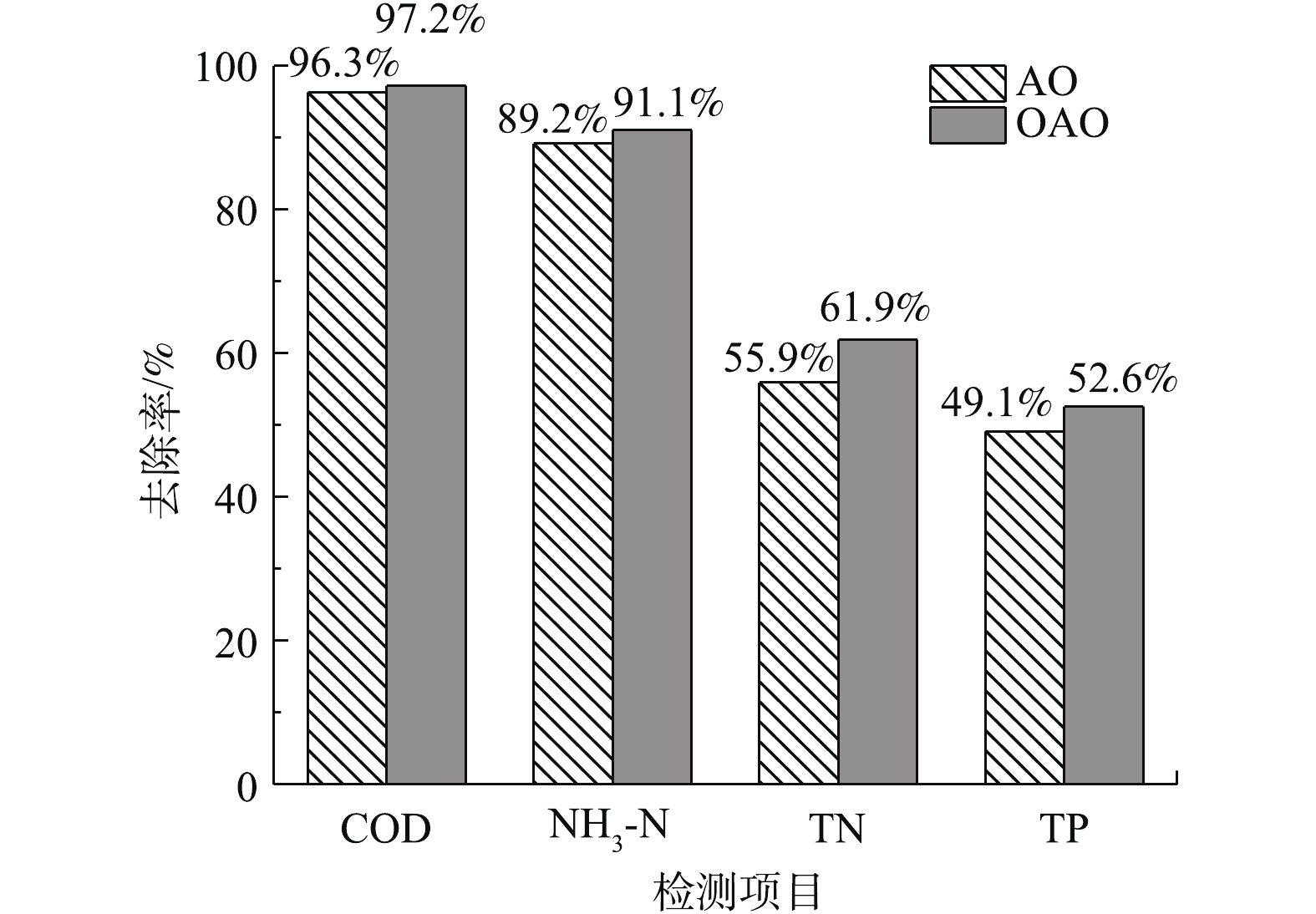
闷曝工作完成后,开始连续不间断地向反应器内进水以驯化污泥,AO工艺进水流量约为12 L·h−1,OAO工艺约为16.6 L·h−1。AO工艺污泥回流比为100%,混合液回流比为200%,OAO工艺2段污泥和混合液回流比均为100%。AO工艺为单点进水,新鲜污水均进入缺氧池中。考虑到缺氧池碳源问题,OAO工艺采用两点进水,1/3的污水进入缺氧池,2/3进入曝气池。驯化期间,每天对进出水水质进行检测,COD采用重铬酸钾法(HJ 828-2017)、NH3-N采用纳氏试剂分光光度法(HJ 535-2009)、TN采用碱性过硫酸钾消解紫外分光光度法(HJ 636-2012)、TP采用钼酸铵分光光度法(GB 11893-1989)、溶解氧采用电化学探头法(HJ 506-2009)、pH采用玻璃电极法(GB 6920-1986)、温度使用水温计法(GB 13195-1991)进行测量[18-24]。进水检测大约持续30 d,AO工艺在第9天达到稳定状态,OAO工艺在第12天时达到稳定,稳定后,2种工艺对COD、NH3-N、TN、TP的平均去除率见图2。2种工艺稳定后的出水COD、NH3-N指标基本符合《城镇污水处理厂污染物排放标准》中的一级A标准[25]。
-
在连续进水第30天时进行取样,此时2种工艺各反应池均已稳定运行。污泥样品取自AO工艺的好氧池、AO工艺的缺氧池、OAO工艺的好氧池、OAO工艺的缺氧池、OAO工艺的曝气池,分别记为AO.H、AO.Q、OAO.H、OAO.Q、OAO.B。每个反应池取100 mL泥水混合液,静置30 min,除去上清液,所得沉淀混合均匀后,分装于瓶中,保存于−30 ℃环境中,以便后续DNA提取。污泥样品中的DNA采用PowerSoil®DNA提取试剂盒,按照试剂盒使用方法提取。
-
采用NanoDrop 1000分光光度法测定样品中提取的DNA的浓度和纯度[26],将符合要求的DNA样品使用无菌水稀释至1 ng·μL−1后,用作模板DNA。以上述基因组DNA为模板,在16S rDNA基因的保守区V4区域,通过融合引物515F(5′-GTGCCAGCMGCCGCGG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)进行PCR扩增,扩增反应体系体积为30 μL,扩增流程为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退温30 s,72 ℃延伸40 s,进行30个循环;72 ℃延伸10 min;最后将样品保持在10 ℃恒温环境中。扩增产物采用1%琼脂糖凝胶电泳检测,选择明亮主条带的样品用于进一步的实验。使用AxyPrep DNA凝胶抽提试剂盒(AXYGEN)对PCR产物切胶纯化。之后,通过Illumina建库试剂盒和相应的质检方案完成文库的构建和质检。将合格的文库送往Illumina平台(Miseq)进行测序,用下机得到的数据进行相应的生物信息分析。
-
为了反映样品中微生物菌群的丰富度及多样性,对每个样本分别进行微生物菌群的Alpha多样性分析[27],结果见表1。覆盖率均在99%以上,证明本次测序数据可靠度极高。在97%相似度下,将样本中的优质Tags进行聚类,共得到1 237个OTUs,其中OAO工艺的OTUs为1 135个,AO工艺为1 063个。OAO工艺中的3个反应器都比AO工艺中的OTU数目高,反映了本实验中OAO工艺的细菌数目要大于AO工艺。从Chao指数和Ace指数来看,2种工艺各反应器的物种丰富度为OAO曝气池<AO好氧池<AO缺氧池<OAO缺氧池<OAO好氧池。OAO工艺独有的曝气池丰富度较低,初步分析其可能的原因是,该曝气池的相对进水流量为AO工艺和OAO工艺后续反应池的2/3,污水水量较少,营养物质浓度较低,且没有混合液回流,水源单一,进水水质的差异造成了其丰富度的差异[28]。同时,曝气池后的初沉池污泥直接内回流于曝气池,处于一种相对封闭的状态,故OAO工艺的一级曝气池丰度要略低于其他反应器。从Shannon和Simpson指数来看,OAO工艺中的微生物群落多样性显著高于AO工艺。2种工艺好氧池物种多样性均大于缺氧池,其原因可能是,在缺氧和好氧2种不同运行条件下,微生物的生态系统体系有所差异[29]。总体来看,OAO工艺的微生物物种丰度和多样性均优于AO工艺。
-
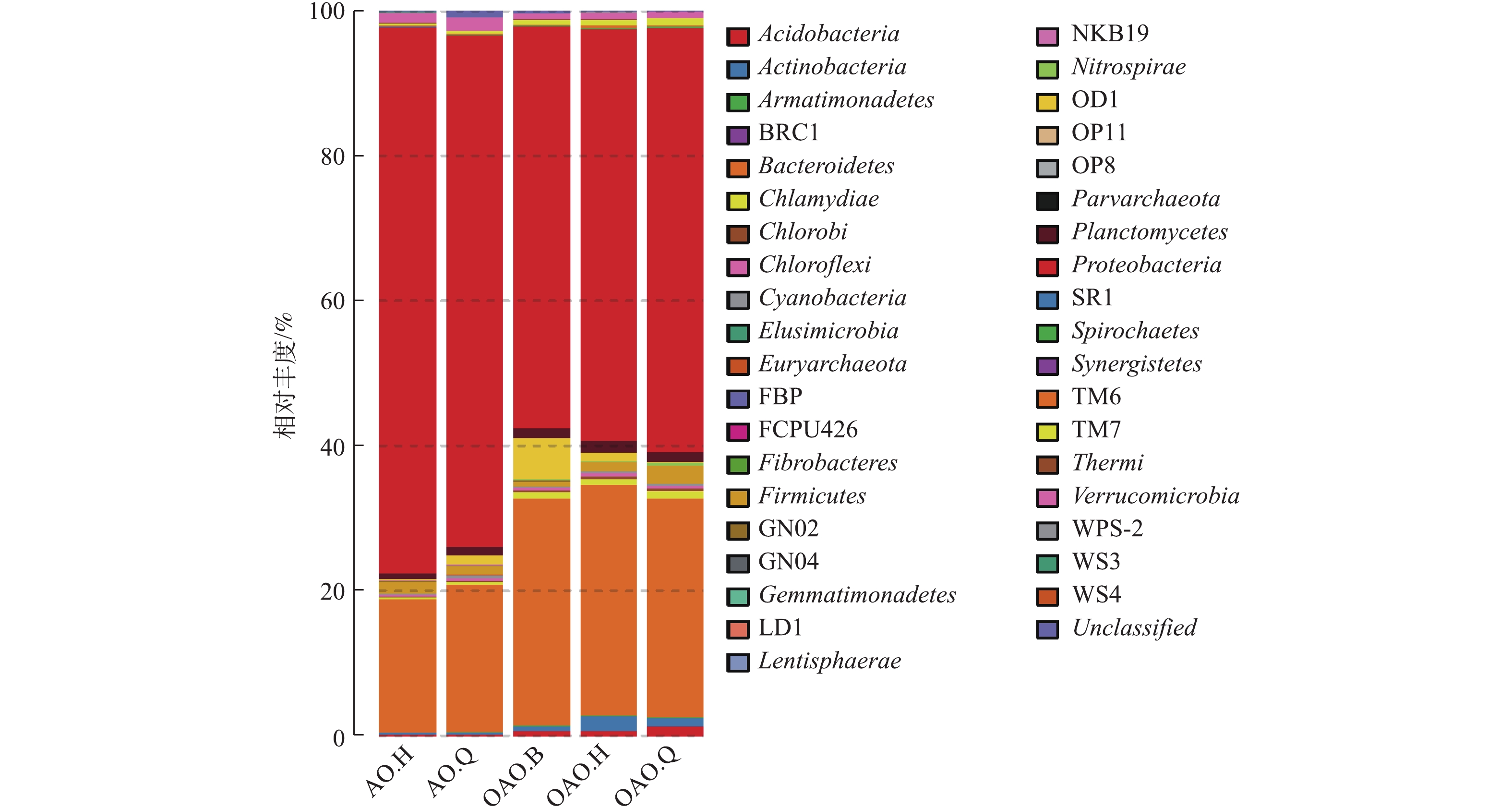
本次测序共检测出已知门38个,结果见图3。OAO工艺中的细菌门类较AO多。Proteobacteria和Bacteroidetes为2种工艺的第1和第2优势菌门,这与HAN等[16]、曾涛涛等[17]、郑向阳等[30]在氧化沟和AO工艺研究中的研究结果一致。Proteobacteria和Bacteroidetes是自然界细菌中2个较大的门类,一些反硝化细菌和大多数固氮细菌也属于这2种门类[31]。康晓荣[32]研究发现总氮和总磷的去除率与Proteobacteria和Bacteroidetes的丰度成正相关。本实验中,AO工艺中的Proteobacteria丰度要大于OAO工艺,但OAO工艺中的Bacteroidetes丰度要远大于AO工艺。
在纲水平下,对Proteobacteria门和Bacteroidetes门的细菌在各反应器中的分布进行统计分析,结果如表2所示。γ-Proteobacteria除在OAO的曝气池为第2优势菌纲外,在其他各反应器均为第1优势菌纲。在Proteobacteria门里,除γ-Proteobacteria外,β-Proteobacteria、α-Proteobacteria、δ-Proteobacteria也为2种工艺的优势菌纲。β-Proteobacteria和γ-Proteobacteria的富集可以大大提高污水中有机物和氮、磷去除率[33];α-Proteobacteria作为一种成员变异性极大、共通点极少的菌纲[34],在OAO的各反应器内的占比均明显高于AO工艺,其成员有根瘤菌、立克次氏体、光合细菌等,在某些光生物反应器实验中表现为优势菌种[33, 35]。在Bacteroidetes门中,Saprospirae、Sphingobacteria、Flavobacteriia、Cytophagia在2种工艺里占比较高。Cytophagia在AO工艺中的占比几乎是OAO工艺的2倍,Flavobacteriia在OAO缺氧池占比较小,其他该门菌纲在OAO工艺中的各反应器占比明显高于AO工艺。OGONOWSKI等[36]研究发现,Cytophagia在天然纤维素基材上富集较多,该菌纲在OAO工艺较少且曝气池>缺氧池>好氧池,这可能是因为部分纤维素作为部分微生物的碳源在前置曝气池中被转化。Flavobacteriia在许多海洋环境中都很丰富,可以在极端环境中降解水中不稳定的有机碳[37]。Saprospirae、Sphingobacteria在一些其他AO改良工艺和厌氧、好氧工艺中也表现为优势菌纲[38-40]。
除上述2种菌门外,在2种工艺中均存在且丰度较高的菌门还有Nitrospirae、Planctomycetes、Firmicutes、Verrucomicrobia、OD1等,Nitrospirae、Planctomycetes、Firmicutes中的某些细菌具有较好的碳氮去除能力,短程硝化反硝化中的厌氧氨氧化菌就来自Planctomycetes。TM7、Actinobacteria、Chlamydiae、Acidobacteria等菌门在OAO工艺中的丰度较高,但在AO工艺中则相反。Actinobacteria是OAO好氧池中的第3优势菌门,具有多样化的次级代谢,在生态环境中有许多潜在用途[41];Acidobacteria是OAO缺氧池中的第4优势菌门,在土壤生态中占细菌总量的30%~50%,具有纤维素降解的功能,并且参与土壤中的铁循环和光合作用[42]。除Verrucomicrobia外,AO工艺中相对丰度大于0.5%的菌门在OAO中的相对丰度也均在0.5%以上。Verrucomicrobia作为一种在氮、磷、钾含量较低的情况下依然能利用碳源生长的菌门[43-44],在AO工艺中的平均占比几乎是OAO工艺中的2倍,这与OAO工艺前置曝气池消耗掉部分有机物不无关系。
-
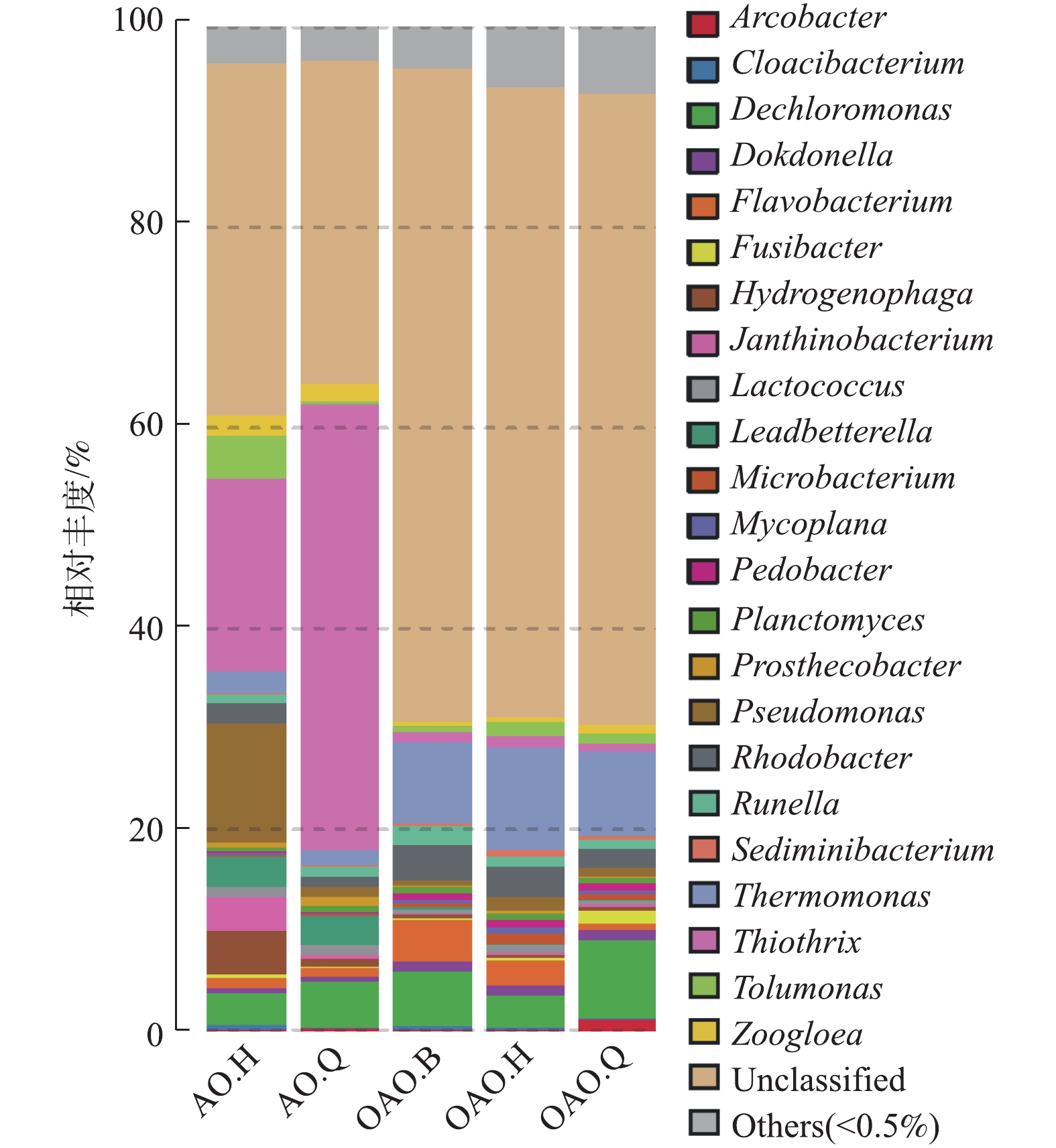
在本次测序的5个样本中,共检出菌属347个,丰度大于0.5%的已知菌属为23个,各池微生物群落相对丰度见图4。未知菌属(Unclassified)在各池的占比为35.07%~65.13%,在OAO工艺内的相对丰度要远大于AO工艺。已知属中来自Proteobacteria门的Thiothrix、Thermomonas、Dechloromonas相对丰度较高,三者总丰度占比为24%。与何嘉鹏[45]的实验结果不同,作为硝化细菌的重要菌属Nitrosomonas、Nitrospira虽均在2种工艺中检出,但含量皆小于0.5%,在本实验中,被归类为其他菌属(others)。Thiothrix、Pseudomonas、Hydrogenophaga是AO工艺好氧池中的优势菌属;Thiothrix、Dechloromonas、Leadbetterella是AO工艺缺氧池中的优势均属;Thermomonas、Flavobacterium、Dechloromonas是OAO工艺曝气池中的优势菌属;Thermomonas、Dechloromonas是OAO工艺好氧池中的优势菌属;Thermomonas、Dechloromonas、Rhodobacter是OAO工艺缺氧池中的优势菌属。
WANG等[46]研究发现,Thermomonas与硝酸盐还原酶基因呈正相关,对同时厌氧氨氧化-反硝化系统中的硝酸盐还原起重要作用;WANG等[47]研究发现,Dechloromonas在反硝化过程时可以进行磷的去除。在本实验中,上述2种菌属在OAO工艺各部分的相对丰度均大于AO工艺,这可能是OAO工艺对TN和TP去除效果显著优于AO工艺的原因之一。OAO工艺里其他优势菌属中,Flavobacterium为好氧反硝化菌[48],Rhodobacter具有固氮的功能,也属于好氧反硝化菌[49]。AO工艺里,Pseudomonas为第1优势菌属,其主要功能为异养硝化-好氧反硝化菌[50]和反硝化聚磷菌[48],其在AO工艺和OAO工艺好氧池中的大量存在可能是2种工艺高效脱氮的重要原因之一。Thiothrix作为一种能以硫化物为唯一能源生长的菌属,被认为是造成活性污泥膨胀的主要原因之一[51]。本次实验虽未见明显的污泥膨胀现象,但2种工艺在HRT、温度、水质等条件相同的情况下,Thiothrix在AO工艺中的相对丰度要远大于OAO工艺,这使得AO工艺发生污泥膨胀的可能性要远大于OAO工艺。Nitrosomonas在2种工艺的好氧池中的相对丰度分别为AO.H 0.05%、OAO.H 0.47%;Nitrospira则为AO.H 0.02%、OAO.H 0.45%。MA等[52]研究发现,污水厂活性污泥中的AOB和NOB相对丰度在0.1%~1%时,脱氮效率依旧很高,这与本次实验水质检测结果基本相符。2种硝化菌属在2种工艺中好氧池的丰度均为OAO好氧池>AO好氧池,这可能是因为OAO工艺中的第1段曝气池的作用使得工艺整体的污泥BOD负荷较AO工艺小,从而减轻硝化细菌与其他异养型细菌的竞争压力,为硝化细菌提供了更佳的生长环境。
-
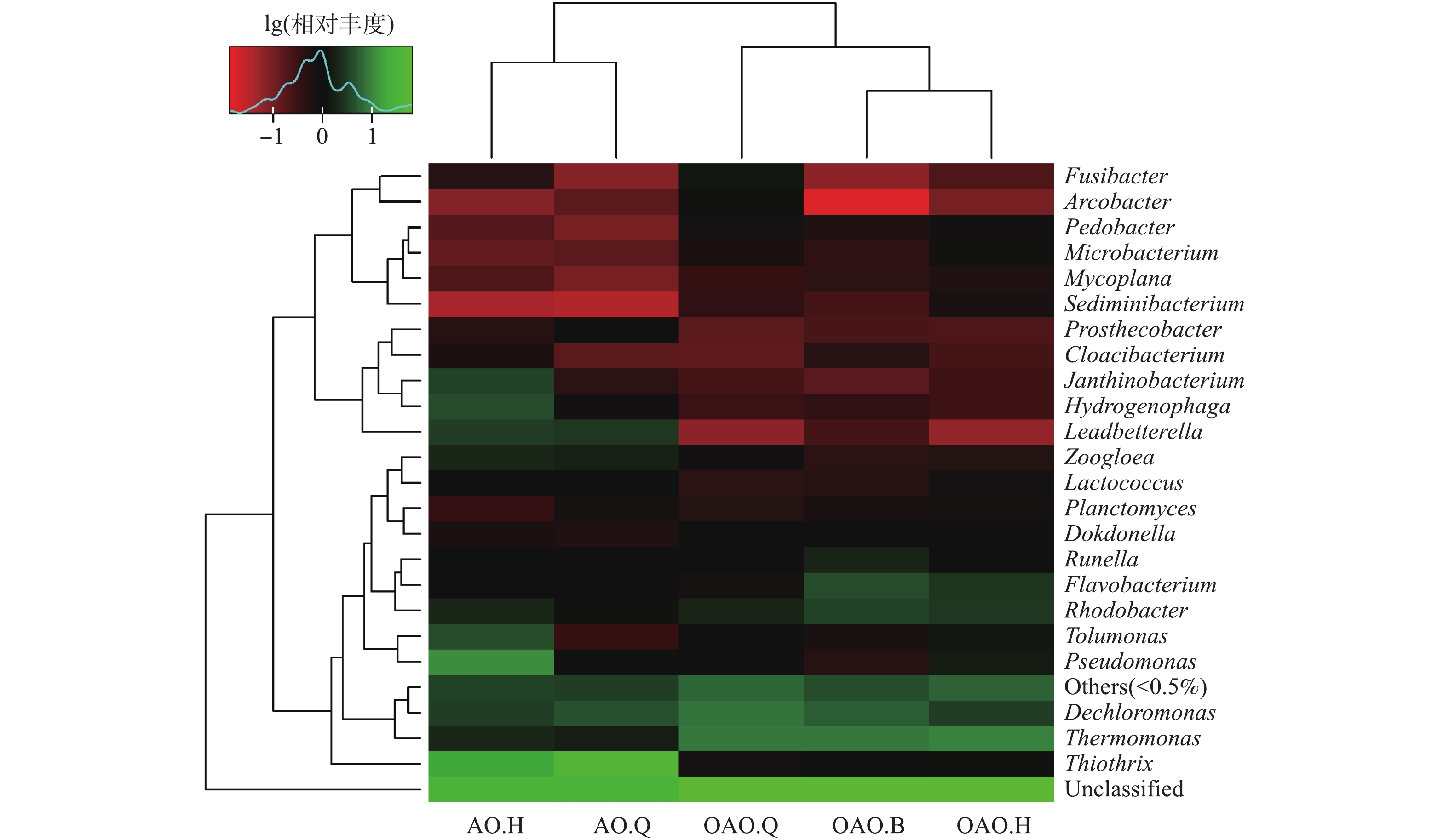
图5为2种工艺各反应池中微生物在属水平下的物种丰度热图,该图将微生物属水平的聚类结果按照其在该样品中所占相对丰度数值用不同梯度的颜色表示,用颜色矩阵来直观地表示不同样品中物种的丰度。微生物群落组成在不同反应池间的相似性和差异性由纵向聚类表示,距离越近,枝长越短,说明样品的物种组成及丰度越相似。由于本次测序结果显示不同物种间相对丰度差异较大,颜色梯度难以满足要求,因此,将原始相对丰度以10为底进行对数转化,若某物种相对丰度为0,则取样品中物种相对丰度最小(大于0)的值除以2然后进行对数转化。
由图5可知,OAO和AO工艺间微生物群落具有较大的差异性,OAO工艺内部的缺氧池、曝气池和好氧池3个反应池间的差异性要略大于AO工艺内部的2个反应池间的差异性。这进一步说明OAO工艺中活性污泥微生物生态体系更为复杂,多样性更高。Planctomyces、Dokdonella、Mycoplana等在2种工艺中的相对丰度相近,初步推测其受2种工艺间差异的影响较小,采用OAO工艺并不能使该类菌属在原AO工艺中发挥的作用发生改变。Thiothrix、Pseudomonas、Tolumonas、Zoogloea、Leadbetterella、Hydrogenophaga、Janthinobacterium在AO工艺的丰度明显大于OAO工艺,同时,Thermomonas、Runella、Flavobacterium、Rhodobacter在OAO工艺中的丰度又显著大于AO工艺。采用OAO工艺会增加或减少上述菌属在原AO工艺反应器内的丰度,某些具有脱氮除磷功能的菌属的增减使污水处理效果发生变化。
5个反应池内的优势菌属中部分功能菌属的相对丰度统计分析结果见表3。Hydrogenophaga、Pseudomonas作为异养硝化-好氧反硝化菌[53],在BOD负荷较高有机碳源充足的AO工艺好氧池中大量存在,其可在同一个空间内进行硝化和反硝化,在本次AO工艺生物脱氮过程中起到了重要作用。Dechloromonas、Flavobacterium、Rhodobacter、Thermomonas均为具有反硝化功能的菌属,在OAO工艺中的相对丰度大于AO工艺,尤其是Thermomonas作为一种自养反硝化菌[54],在BOD负荷较小的OAO工艺中的相对丰度远高于AO工艺。这解释了OAO工艺在对TN的去除效果上优于AO工艺的原因。
-
1) OAO和AO工艺在稳定运行时对COD、NH3-N、TN、TP的平均去除率分别为97.23%和96.31%、91.07%和89.16%、61.91%和55.90%、52.59%和49.15%,OAO工艺对TN和TP的去除效果要显著优于AO工艺。
2)微生物群落的Alpha多样性分析表明,AO工艺和OAO工艺二者间的丰度和多样性有显著差异,OAO工艺的丰度和多样性皆优于AO工艺。
3)微生物物种结构分析结果表明,2种工艺的优势菌门均为Proteobacteria和Bacteroidetes,且Proteobacteria门中的β-Proteobacteria和γ-Proteobacteria均为2种工艺的优势菌纲。2种工艺在优势菌属上差异较大,OAO工艺的优势菌属为Thermomonas、Dechloromonas、Rhodobacter,AO工艺的优势菌属为Pseudomonas、Thiothrix、Dechloromonas。
4)属水平下物种丰度热图表明,OAO和AO工艺间微生物群落具有较大的差异性,Thiothrix、Pseudomonas、Thermomonas等受2工艺间差异的影响,相对丰度差异性较大。
5)由于OAO工艺前置曝气池的设置,OAO工艺污泥BOD负荷较AO工艺小,导致Verrucomicrobia门、Cytophagia纲等对碳源需求较高的微生物在OAO中丰度较小,Thermomonas属、Dechloromonas属、Nitrospira属、Nitrosomonas属等具有脱氮除磷功能的细菌有了合适的生长环境,其在OAO的丰度明显高于AO工艺。据此推测,若将OAO工艺用于处理中高浓度的污水,其脱氮效率要远大于AO工艺。
OAO和AO工艺处理城镇生活污水的微生物群落特征分析
Analysis of microbial community characteristics of OAO and AO processes for domestic wastewater treatment
-
摘要: 以模拟城镇生活污水为对象,采用AO和OAO 2种工艺进行处理,通过常规水质检测和高通量测序技术来分析和探究导致2种工艺运行效果不同的微生物层面原因。结果表明:OAO工艺对COD和NH3-N的平均去除率略高于AO工艺,但OAO工艺对TN和TP的去除效果较为显著,平均去除率分别比AO工艺高6.01%和3.44%;2种工艺的优势菌门均为Proteobacteria和Bacteroidetes,2种工艺的优势菌纲也均为β-Proteobacteria和γ-Proteobacteria;2种工艺间微生物群落差异性较大,OAO工艺的微生物种群丰度和多样性均大于AO工艺;AO工艺优势菌属为Pseudomonas、Thiothrix、Dechloromonas,OAO工艺为Thermomonas、Dechloromonas、Rhodobacter。此外,Nitrosomonas、Nitrospira作为亚硝化和硝化阶段的重要菌属在AO工艺好氧池的相对丰度为0.05%和0.02%,在OAO工艺中则显著提高,为0.47%和0.45%。其原因是OAO工艺的好氧池污泥BOD负荷较AO小,更适合硝化细菌生长。硝化细菌及其他功能菌在OAO工艺中的大量存在是OAO工艺的能够高效脱氮的主要原因。以上结果可为OAO工艺处理城镇生活污水中优势菌种的筛选及培养提供参考。Abstract: To reveal the reason for the different domestic wastewater treatment effects of OAO(oxic-anoxic-oxic) and AO(anoxic-oxic) process at the perspective of microorganism, the ordinary wastewater quality test and high-throughput sequencing technique were used to analyze the different bacterial community in the activated sludge. The results showed that the average removal rates of COD and NH3-N in OAO process were slightly higher than those in AO process, while TN and TP removal effect by OAO process were significant, and its average removal rates were 6.01% and 3.44% higher than in AO process, respectively. Proteobacteria and Bacteroidetes were the dominant phyla in the two processes, and β-Proteobacteria and γ-Proteobacteria were the dominant classes. A significant difference in the bacteria community occurred in these two systems, the abundance and diversity of species in OAO process were greater than AO process. Pseudomonas, Thiothrix, Dechloromonas were the dominant genus in AO process. Thermomonas, Dechloromonas, Rhodobacter were the dominant genus in OAO process. Nitrosomonas and Nitrospira, as important genus of nitrosation and nitrification stages, had a relative abundance of 0.05% and 0.02% in AO process and 0.47% and 0.45% in OAO process, respectively. The higher abundance of these two bacteria in OAO process might correspond to its lower BOD loading of the activated sludge, which was suitable for the growth of nitrifying bacteria. The high abundances of nitrifying bacteria and other functional bacteria in the OAO process ultimately resulted in high nitrogen removal efficiency. The above results can be used as the theoretical basis for the screening and culture of the dominant bacterial in domestic wastewater treatment using OAO process.
-
沙尘颗粒物是全球大气颗粒物的主要贡献来源之一,最新研究表明,全球的沙尘排放量随着土地荒漠化和气候变化的加剧而增加[1 − 3],其中全球沙尘年排放总量预估达
1000 —8000 Tg[4]. 沙尘颗粒物能够通过吸收和反射太阳光影响区域热辐射和气候变化[5]. 沙尘天气不仅对起沙源及附近区域造成空气质量影响,沙尘细颗粒物也可通过远距离传输并造成半球甚至全球范围的影响. 例如,2021年3月蒙古国和我国西北地区发生大规模沙尘天气,受沙尘影响部分地区PM10峰值浓度超过5000 µg·m−3[6],同时沙尘颗粒物通过高层气流远距离传输并与我国华南地区的城市大气污染物耦合形成了复合型大气污染事件[7]. 2023年春季(3—4月),我国共爆发数十次高强度、大范围的沙尘天气。在季风和蒙古气旋的影响下,沙尘的发生和传输对下风向城市的空气质量和居民生活产生了显著的影响[8]. 沙尘天气的产生是非常复杂且难以预测的,我国2021年和2023年相继发生的大范围沙尘也引发了人们对于沙尘暴发生的频率和强度增加的担忧. 研究沙尘暴对城市环境的影响以及其与城市大气污染物的复合过程也变得越加重要,其中污染物的耦合、分布、迁移、转化和沉降仍然具有高度的不确定性,阻碍了对沙尘复合污染事件的溯源、归因和环境风险等分析.本文讨论了沙尘颗粒物的化学组成、传输和大气化学过程,重点梳理沙尘颗粒物与气态化合物非均相反应机理的研究现状,对气态分子在沙尘颗粒物表面的吸附规律、氧化机制、非均相过程和间接环境影响展开讨论,并对未来研究进行了展望.
1. 沙尘颗粒物的化学组分及大气传输(Chemical composition and atmospheric transport of mineral dust particles)
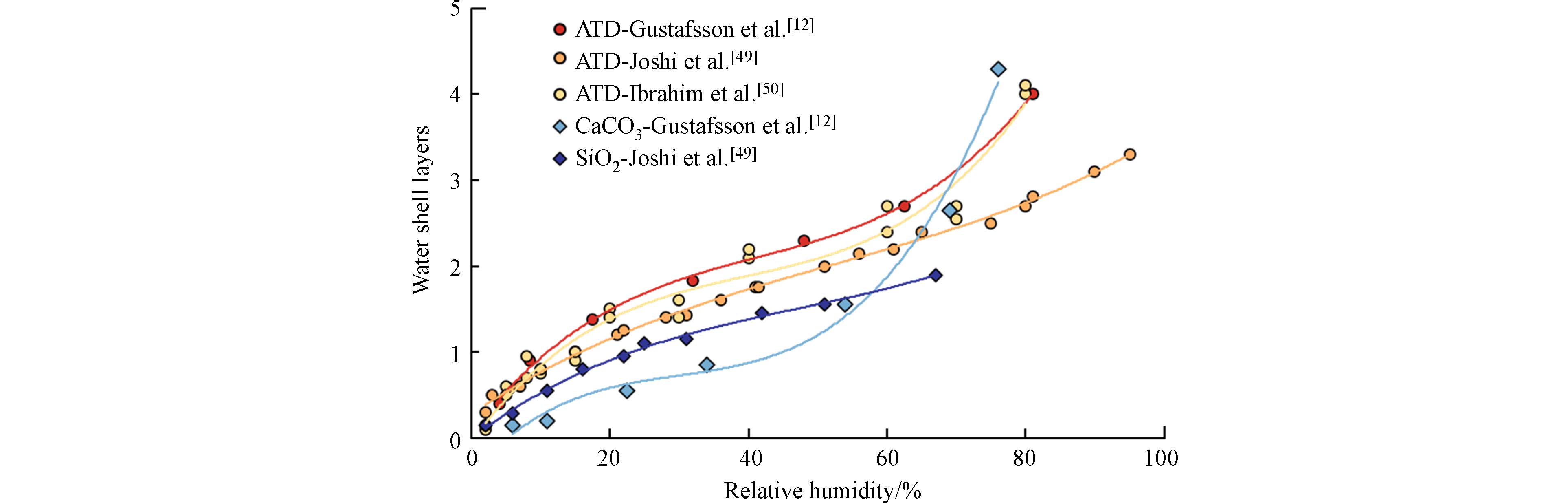
沙尘颗粒物主要指由强风吹过裸露的土壤和荒漠地表而形成的大气悬浮颗粒物. 其颗粒物的粒径通常小于100 µm,且富含各类矿物质,主要包括二氧化硅、硅酸盐、碳酸盐以及金属氧化物等. 大气中沙尘颗粒物的矿物质组分可以通过X射线衍射(XRD)、X射线荧光光谱(XRF)、电感耦合等离子体质谱和离子色谱等进行分析. 沙尘颗粒物的元素组成与地壳基本一致,其中含量最高的元素是O和Si,含量最高的金属元素是Al[9]. 沙尘通常同时含有Fe、Ca、K、Mg、Na、Ti等常见的金属元素,以及Mn、P等微量元素. 沙尘中的矿物质元素主要以金属氧化物、碱性氢氧化物和硅酸盐等形式存在[10]. 沙尘颗粒物的矿物质组分差异通常受到母岩种类、岩石风化和土壤发生过程、气候条件、植被种类和人类活动等多种因素影响[11],因此不同地区的沙尘颗粒物通常具有不同的元素类型及比例(图1)[12 − 23]. 例如,由于岩石类型和风化过程的区别,亚洲地区的沙尘颗粒物(黄土高原和戈壁沙漠等)中的碱性金属元素(Ca和Mg)含量较其他地区的沙尘更高,而撒哈拉沙漠南部区域的沙尘颗粒物中则含有较多的Al元素. 不同区域的沙尘颗粒物因风化程度和传输过程等差异,颗粒物比表面积也不一样. 例如,亚利桑那测试沙尘(Arizona Test Dust, ATD)、腾格里沙漠沙尘和北京沙尘天气期间采集的东亚沙尘的比表面积(Brunauer–Emmett–Teller,BET)分别为4.0、16.5 、 6.1 m2·g−1 [24]. 此外,前期研究发现沙尘颗粒物经过大气复合过程后,其理化性质有所改变. 例如,有报道采用X射线扫描电镜分析黄河三角洲区域的沙尘与霾混合颗粒并发现沙尘暴后颗粒物被硝酸钙包裹,从而对颗粒物的吸湿性造成一定的影响 [25].
沙尘颗粒物中粒径较小的细颗粒物通常能够在表层紊流和对流空气的作用下悬浮,并进一步在季风等高空大气环流的作用下实现中、远距离的迁移和传输. 沙尘颗粒物的形成、传输和沉降与地表的裸露程度、区域气候的条件以及植被覆盖的程度都有一定的关联. 在冬春季节,我国西北部地区干燥、多风,同时植被覆盖率低,而土壤和岩石风化频率的增加也导致了沙尘释放量的升高[26]. 近期有研究指出,在我国西北部的起沙区域内,由于受到上风向大范围起尘的影响,位于下风向的城市整体沙尘的传输和沉降量呈现自西向东和自北向南逐渐增加的趋势[27]. 沙尘颗粒物的矿物质组分对传输过程中的大气化学过程具有重要的影响,而矿物质类型则主要由起沙源决定. 目前常用的沙尘颗粒物溯源技术包括同位素示踪法[28 − 31]和基于拉格朗日轨迹模型的理论计算. 例如,Chen等[32]结合区域气象模式和轨迹模型分析了2023年3月至4月我国北部强沙尘暴事件,发现蒙古和塔克拉玛干沙漠是主要的沙尘源,其中蒙古对我国北部沙尘浓度有超过42%的贡献. 在全球范围内,沙尘颗粒物的主要影响范围涉及非洲撒哈拉沙漠区域、中东、亚洲、澳大利亚和北美洲西海岸部分区域. 其中,撒哈拉沙漠的沙尘通过跨大西洋传输到加勒比海地区和美洲东部,并维持了亚马逊区域的矿物质输入[33];中东地区的沙尘则主要源自伊拉克、叙利亚和沙特阿拉伯等地区,并可通过中远距离传输到东亚地区[34];而亚洲的沙尘主要来自中国西北和蒙古地区,通过季风和气旋传输到朝鲜半岛、日本,甚至北美洲和北极地区[35].
2. 沙尘颗粒物的大气化学过程(Atmospheric chemical process of dust particles)
2.1 沙尘颗粒物对气体分子的吸附摄取
沙尘颗粒物的平均寿命可达数周,从起沙源头至远距离迁移的过程中,沙尘通过其表面的自然孔隙吸附、摄取各类气态污染物分子. 与大气中其他有机或无机盐颗粒物相比,沙尘颗粒物的表面形状多变且比表面积更大. 沙尘颗粒物对气体分子的吸附主要通过气体分子扩散与颗粒物表面碰撞并发生摄取,其中吸附速率常数或摄取系数(
γ stringUtils.convertMath(!{formula.content}) (1) 其中,[X]为气体化合物的空气质量浓度,
ˉc γBETss 沙尘作为主要的大气颗粒物之一,既参与了大气污染物的多相反应过程,也是对流层凝结核重要来源之一,因此沙尘颗粒物对水分子的吸附特性即吸湿性对大气成云、降水、热辐射和区域气候都有一定的影响[40]. 研究表明,沙尘颗粒物的吸湿性受物理化学因素和环境条件的影响,包括沙尘颗粒物表面的亲水基团、化学组成、颗粒物尺寸和几何形状等[38, 40]. 另一方面,颗粒物吸湿性的提高显著增加了水分子在其表面的吸附速率、覆盖厚度和覆盖范围,也对气体分子的吸附和非均相反应造成了一定的影响. 在低湿条件下,颗粒物表面尚未形成单层水分子壳,水分子和其他气体分子可能发生竞争机制,争夺颗粒表面的吸附位点. Mogili等[41]通过吸附实验发现O3在Fe2O3和Al2O3颗粒表面的初始吸附速率随湿度增加(RH<30%)而降低. 随着环境湿度的不断升高,颗粒物吸附的水分子将逐渐超过并覆盖其表面积并最终形成多层水合壳(图2)[12, 42 − 43]. 同时,颗粒物表面的部分空隙被水分子填充并导致比表面积的降低,从而使气体分子的吸附从气-固交换逐渐转变为气-液交换,颗粒表面水层则作为反应媒介进一步加速推动液相反应的进行[40]. 目前采用较多的沙尘吸湿性分析方法包括水分子气压变化测定[44]、质量动态测定[45]、FTIR测定含水量[46]、扫描电镜和扫描隧道显微镜等手段观测颗粒物的吸湿变化[47]、基于双差分电迁移分析仪(Differential Mobility Analyzer, DMA)的H-TMDA颗粒物吸湿增长测定法等[48]. 研究表明,沙尘颗粒物的吸湿性随颗粒物的迁移、老化等一系列环境化学过程而改变. 例如,硝酸盐具有较强的亲水性,沙尘颗粒物在吸附或表面形成硝酸盐后其吸湿性有明显的增强[49, 50]. 外场观测证实,沙尘过程后约有32%的沙尘颗粒由于硝酸盐的包裹而发生了吸湿增强[20].
2.2 沙尘颗粒物表面的氧化物
吸附于沙尘颗粒物表面的化合物分子往往会与颗粒物表面的氧化物或自由基发生氧化还原反应,并生成二次产物. 黑暗条件下,颗粒物表面的活性位点上的氧原子能够与表面吸附的化合物分子发生缓慢的氧化还原反应,即表面自发性氧化反应[51]. 其反应速率主要受到化合物分子的吸附速率、氧分子的吸附速率以及表面反应速率的影响. 在光照条件下,沙尘颗粒物中具有一定光催化活性的金属氧化物,如Fe2O3、Al2O3和TiO2等,能够激发形成电子-空穴对(e−cb-h+vb),并与颗粒物表面的氧气和水等反应生成强氧化自由基(如羟基自由基和超氧自由基)[48, 52 − 54]. 具体反应可由方程(2—5)表示:
stringUtils.convertMath(!{formula.content}) (2) stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) 其中,“d”表示沙尘表面的反应物或产物. 反应产生的羟基自由基和超氧自由基会进一步氧化吸附于颗粒物表面的化合物分子(如SO2和NO2等). 大部分电子-空穴对会发生泯灭反应并以能量的形式发散[55, 56],具体反应如式(6):
stringUtils.convertMath(!{formula.content}) (6) 由于电子空穴对的不稳定性,反应式(2)中的光激发速率较难定量,而通过假定电子对的泯灭速率(10−2)再结合紫外-可见光谱对沙尘颗粒物吸收光谱的测定,可以近似推算沙尘颗粒物的光吸收截面和量子产率并计算光激发速率[48, 51]. 进一步采用光激发参数化方程可以对反应速率(J·s−1)进行计算,如式(7)[57-58]:
stringUtils.convertMath(!{formula.content}) (7) 其中l、m和n为经验参数,
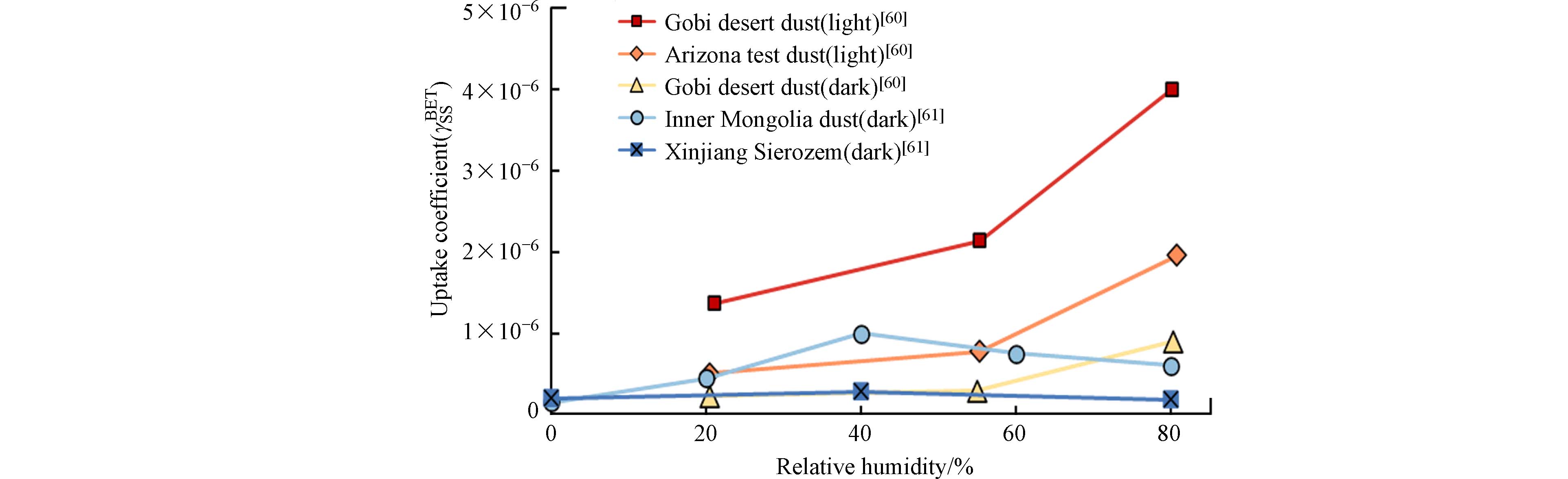
χ 表 1 自然沙尘颗粒物的光激发近似参数Table 1. Photoactivation coefficients of mineral dust particles沙尘表面氧化物的生成速率受到多个方面因素的影响,包括光照强度、温湿度、具有光激发活性的金属氧化物含量以及电子空穴对泯灭速率等[51]. 例如,Dupart等[59]通过分析NO2在亚利桑那试验沙尘表面的吸附速率发现,光照下NO2的吸附速率是无光下的4倍以上. 此外,研究发现湿度对SO2在沙尘表面的光催化氧化反应速率也有较大的影响,在特定的光照下SO2在蒙古国戈壁沙尘表面的吸附反应速率增加了约4—7倍(图3)[60,-61].
目前,沙尘颗粒物对气体分子的吸附摄取系数主要由反应物浓度变化或二次产物的生成速率计算得到. 然而,沙尘表面的光催化反应过程既包括光激发、电子-空穴对和表面自由基的生成,也涉及到气体分子的氧化还原反应,因此并不能完全由单步反应进行简化计算得到. 受限于氧化自由基和多相反应中间产物的测量难度,目前沙尘颗粒物光催化反应的研究还十分匮乏,相关反应过程参数的定量分析十分有限. 此外,由于化学机理和反应参数的缺失,目前区域空气质量模式对受沙尘影响下的二次产物的模拟预测精度整体较无沙尘条件的结果更低[62].
2.3 沙尘颗粒物的非均相反应
沙尘颗粒物通过提供吸附位点和反应界面,与各类气态分子耦合并发生非均相反应,同时加快了大气污染物的演化速度并增加了大气化学过程的复杂度[63]. 本段落将进一步讨论沙尘颗粒物与臭氧、二氧化硫和氮氧化物、有机物以及二氧化碳等化合物的非均相反应过程.
2.3.1 臭氧的非均相反应
臭氧作为城市大气环境中主要的二次污染物之一,其与沙尘颗粒物之间的相互作用和耦合机制受到广泛的关注. 黑暗条件下,臭氧在沙尘颗粒物表面的吸附和反应过程可以由方程(8—9)表示[64]:
stringUtils.convertMath(!{formula.content}) (8) stringUtils.convertMath(!{formula.content}) (9) 光照条件下,吸附于沙尘颗粒物表面的臭氧分子会参与光催化反应,通过与电子-空穴对反应,快速转化并生成羟基自由基[65- 66],如式(10—12):
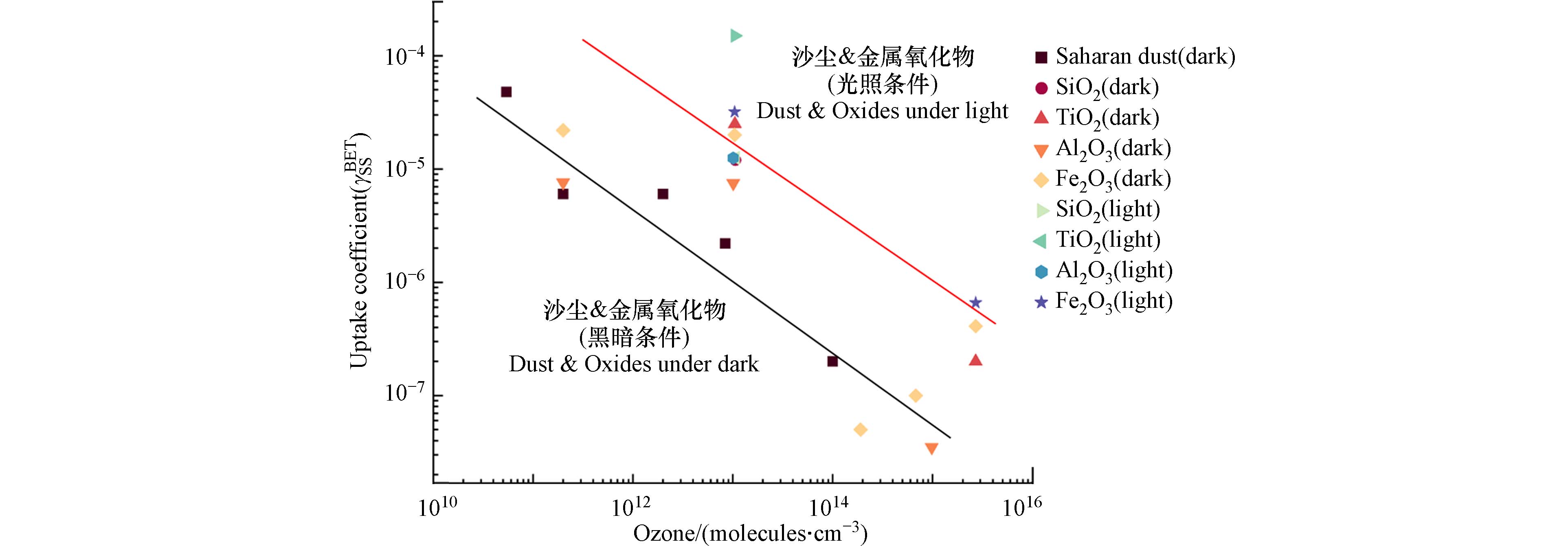
stringUtils.convertMath(!{formula.content}) (10) stringUtils.convertMath(!{formula.content}) (11) stringUtils.convertMath(!{formula.content}) (12) 目前,较多研究测定并报道了臭氧在各类矿质颗粒物和沙尘颗粒物表面的吸附过程及反应参数[16, 41, 66 − 70]. 图4结合了文献数据并基于公式(1)中的吸附模型,分析了不同光照条件和臭氧初始浓度下,臭氧在沙尘颗粒物表面的稳定态吸附摄取常数(
γBETss 2.3.2 二氧化硫的非均相反应
城市大气中的二氧化硫(SO2)主要来自煤炭和石化燃料中含硫元素的燃烧和释放[72]. SO2在排放进入大气后会参与大气氧化还原反应生成SO3,最终形成硫酸盐并由干、湿沉降进入地表[73]. 其中,在颗粒物表面发生的氧化还原反应是SO2的关键转化路径之一. 吸附于沙尘颗粒物表面的SO2能够自发地与颗粒物表面的氧分子或氧化自由基反应,形成硫酸根离子和硫酸盐,相关反应可由以下方程(13—14)简化表示[74]:
stringUtils.convertMath(!{formula.content}) (13) stringUtils.convertMath(!{formula.content}) (14) SO2在自然沙尘表面的吸附摄取系数
γBETss 2.3.3 氮氧化物与多元污染物的非均相反应过程
氮氧化物(NOx)是交通运输过程中产生的主要大气污染物之一,能够参与一系列大气光化学反应,对臭氧(O3)和颗粒物的形成都有重要的影响. 沙尘期间, NO2能够通过在沙尘颗粒物表面吸附并进行自发性氧化反应和光催化氧化反应,最终形成氧化产物包括HONO[59, 81]、HNO3[59, 82-83]、N2O4[81, 84- 85]和N2O5[86]等. 在傍晚和夜间,大气中NO3自由基的光解速率降低而N2O5的浓度逐渐升高,因此NO3和N2O5在沙尘颗粒物表面的吸附和非均相反应也是夜间硝酸盐生成的关键演化路径[38, 87 − 89]. 在光照条件下,沙尘表面的NO2分子会与电子空穴对发生电子转移,并进一步氧化产生自由基和硝酸根离子,如式(15—16) [48, 82-83]:
stringUtils.convertMath(!{formula.content}) (15) stringUtils.convertMath(!{formula.content}) (16) 氮氧化物同时也能够作为弱氧化剂,氧化吸附于沙尘颗粒物表面的其他化合物. 例如,研究发现在黑暗条件下,吸附于沙尘颗粒物表面的NO2也能够生成N2O4,并通过异构化和电离水解反应促进SO2向硫酸盐的转化,如式(17—22) [84-85]:
stringUtils.convertMath(!{formula.content}) (17) stringUtils.convertMath(!{formula.content}) (18) stringUtils.convertMath(!{formula.content}) (19) stringUtils.convertMath(!{formula.content}) (20) stringUtils.convertMath(!{formula.content}) (21) stringUtils.convertMath(!{formula.content}) (22) 其中,M是沙尘颗粒表面金属位点,MO则是表面活性氧位点. 反应形成的HONO会通过快速吸附平衡过程,与空气中的HONO交换,并在沙尘颗粒物表面达到稳定[90]. He等[91]通过对中国京津冀地区2013年大气观测,并证实NO2和SO2在沙尘颗粒物表面的协同反应促进了SO2向硫酸盐的快速转变,且由沙尘、氮氧化物和硫酸盐等复合污染产生的新粒子可能是引发城市重雾霾天气的关键因素之一.
颗粒物中的钙、镁氧化物和碳酸钙等碱性碳酸盐能够通过酸碱反应捕捉和固定非均相反应过程中形成的硝酸根离子. 前期研究发现硝酸根和硫酸根离子在沙尘颗粒物表面与钙、镁离子的反应存在一定的竞争机制,随着硫酸盐的形成和气溶胶酸性的降低,硝酸根离子更易从颗粒物表面逃逸[48]. 由于硝酸盐具有较强的吸湿性,由硝酸盐形成主导的非均相化学过程会使沙尘颗粒通过吸湿增长而逐渐改变其形状和表面积,从而影响颗粒物的光学特性和区域沉降特性[92, 93]. 随着我国SO2排放的逐年降低,氮氧化物和颗粒态硝酸盐也将逐渐成为我国城市大气污染的主导因素之一,与此相关的大气反应过程亟需进一步评估. 另一方面,光照条件下的颗粒态硝酸盐存在部分光解现象[94],虽然反应本身与气溶胶酸度的相关性较小,但是反应产物的分配则受酸度变化的影响(主要产物为NO2−(pH < 3)和 HONO(pH > 3))[95 − 96]. 研究表明,酸性条件下颗粒态硝酸盐的光解也会间接生成氧化自由基,并可能激活氯离子的转化和日间大气Cl2的形成[97].
此外,NOx在大气化学过程中也同时与臭氧、挥发性有机物(VOC)和有机自由基反应,并与其他氧化物或自由基存在一定的反应竞争,由此形成复杂的NOx-VOC-O3大气污染体系. 目前,沙尘对NOx-VOC-O3复合污染体系的影响仍然不太清楚,亟需结合实验数据和外场观测结果来进一步厘清其中的关键大气化学机理.
2.3.4 有机化合物的非均相反应
沙尘颗粒物不仅能与气态无机化合物进行耦合,还能与有机化合物发生非均相反应. 众多沙尘天气期间的观测研究发现,沙尘颗粒物对大气中的有机化合物有一定的吸附和非均相转化作用. Falkovich等[98]分析了2000—2001年沙尘暴期间的大气颗粒物样品,发现沙尘能够作为载体吸附并携带传输多环芳烃、杀虫剂和短链有机酸等半挥发和低挥发性的有机物. 最近研究也发现在沙尘天气下,大气颗粒物样品中有机酸和可溶性有机氮的质量浓度都有一定的提高[99 − 100]. Romanias等[15]使用漫反射傅里叶变换红外光谱仪(DRIFTS)等仪器研究了撒哈拉沙漠沙尘颗粒物样品对柠檬烯和甲苯的吸附作用. Wang等[17]分析了甲酸和乙酸在沙尘颗粒物中的富集量,发现富含碳酸钙的新疆灰钙土沙尘对有机酸的吸附速率远高于亚利桑那试验沙尘. Al-Hosney等[101]在实验室环境中采用Kundsen反应器测定了甲酸在碳酸钙颗粒物表面的吸附摄取常数(3×10−3). Lederer等[102]通过气相色谱质谱联用仪分析了d-柠檬烯在亚利桑那测试沙尘表面的吸附和转化过程,生成的主要产物包括香芹醇、葛缕酮、1,2-柠檬烯醇以及α-松油醇. 沙尘颗粒物的光催化特性对吸附于其表面的有机污染物也有一定的催化转化效应,研究发现光照条件下的沙尘颗粒物能够显著促进甲苯和三甲苯的大气氧化过程[103]. Ponczek等[104]采用质子转移反应飞行时间质谱(Proton-Transfer-Reaction Time-of-flight Mass Spectrometer,PTR-ToF-MS)和超高分辨液相质谱(Ultra-High-Performance Liquid Chromatograph Mass Spectrometer, UHPLC-MS)分别分析了气态和沙尘颗粒物表面吸附的有机酸浓度,发现颗粒物对有机酸的催化反应具有显著的促进作用.
除了实验室的模拟研究外,外场观测研究也证实了沙尘颗粒物对挥发性有机物的转化具有显著影响. 例如,Xue等[105]通过西安地区的外场观测实验发现,沙尘天气期间沙尘颗粒物加速了挥发性有机物的转化过程,导致其浓度迅速降低. 沙尘颗粒物在促进大气中碳氢化合物的转化的同时也影响了有机化合物的大气生命周期和沉降规律,然而目前大部分的研究主要集中在外场观测和特定污染物的靶向分析,尚缺少与有机污染物和沙尘颗粒物非均相反应过程相关的化学参数和机理研究.
2.3.5 二氧化碳的非均相反应
TiO2等过渡金属氧化物,由于其易产生光激发并进行电子传递,因此也对CO2也有一定的非均相反应催化作用,如式(23) [106 − 107]:
stringUtils.convertMath(!{formula.content}) (23) 光照和常温条件下的TiO2能通过光激发反应和电子传递推动颗粒物表面吸附的CO2和H2O之间的反应,生成甲烷和甲醇等产物[108 − 110]. 自然沙尘颗粒物也具有类似的效应,其表面活性位点能够吸附CO2,且颗粒物中的过渡金属氧化物也对CO2的非均相转化有一定的催化作用. 例如,Deng等[111]采用13C同位素标记的方法,研究了CO2在TiO2、亚利桑那测试沙尘、伊利石、蒙脱石和高岭土颗粒物表面的光催化降解机理,通过测定CO的生成证实自然沙尘对CO2具有催化降解作用. 相关反应及产物如下(24—26):
stringUtils.convertMath(!{formula.content}) (24) stringUtils.convertMath(!{formula.content}) (25) stringUtils.convertMath(!{formula.content}) (26) 实验测得CO2在亚利桑那测试沙尘表面的吸附摄取常数(
γBETss 3. 总结和展望(Conclusions and perspectives)
随着近年来中亚和东亚地区沙尘天气的频繁发生,沙尘传输带来的城市空气污染和影响受到政府和居民的广泛关注. 大量实验室研究和外场观测结果表明,沙尘颗粒物能够以载体的形式,对各类大气污染物进行吸附、催化、转化和携带传输. 沙尘天气期间,沙尘颗粒物表面发生的非均相反应则可能在一定程度上改变传统初次排放污染物的沉降通路,通过影响二次产物的生成加速初次产物的分解和转化. 众多实验结果证实,沙尘颗粒物对以SO2和NO2等为代表的无机氧化物具有一定的吸附和催化转化作用,然而仍有部分机理和观测结果需要进一步解释. 目前,大气污染物在沙尘颗粒物表面的非均相反应研究主要集中在单一污染物系统,少数研究讨论了二元无机污染物在颗粒物表面的复合效应. 然而城市环境下的大气污染通常呈现多源、多类型的污染特征,因此对多元系统中的复合过程和反应机理研究提出了新的挑战. 此外,沙尘颗粒物的大气化学过程参数化和模式模拟仍然停留在一次反应机理(吸附反应机理)的假设阶段,难以对复杂的污染过程进行描述,同时缺少关键的反应速率常数和参数化方案. 随着中国大气污染治理工作的不断推进,城市大气中二氧化硫的浓度逐年降低,而氮氧化物和挥发性有机物的复合污染将成为目前以及未来一段时间内的主要污染类型,因此氮氧化物和有机物在沙尘颗粒物中的多元复合污染过程和模拟预测方法的研究有待深入开展. 此外,沙尘颗粒物表面非均相反应的机理尚未完全阐明,沙尘颗粒物与有机气态污染物的非均相反应机制、与人为源大气颗粒物的相互作用机制都有待进一步研究.
沙尘作为主要的大气颗粒物成分,不仅对城市空气质量产生显著影响,同时也影响着区域辐射平衡. 然而,目前对沙尘颗粒物的矿物类型、形貌特征和粒径分布与其光学辐射的影响研究较为有限. 此外,沙尘与城市大气污染的相互作用,特别是在沙尘颗粒物与其他污染物的复合过程中,不仅改变了沙尘颗粒物在传输过程中的形态,还影响了其化学组成. 这些变化如何影响沙尘颗粒物的光学特性、可溶性离子的分布,以及如何进一步影响区域气候和矿质元素的循环,都是值得进一步探讨. 沙尘颗粒物在大气老化过程中发生改变的特性还可能影响凝结核及云的形成,进而影响局部甚至全球的降水模式. 另一方面,最新研究提出沙尘颗粒物和TiO2等金属氧化物是CO2的潜在固碳路径,而相关反应机理和对大气碳循环的贡献则需要进一步的系统性分析.
沙尘颗粒物大气化学过程的全面研究不仅对区域空气质量的改善至关重要,对于分析气候变化和理解大气污染过程都具有重要意义. 通过深入研究其中的化学机理和反应参数,可以更好地理解沙尘颗粒物对气溶胶二次产物的形成以区域气候变化的影响,将有助于更好地应对环境变化带来的挑战.
-
表 1 2种工艺各反应器中微生物的Alpha多样性指数
Table 1. Alpha diversity index of microorganisms in each tank of the two processes
样本 Chao Ace Shannon Simpson 覆盖率/% AO.H 928.01 954.09 3.96 0.060 99.79 AO.Q 938.10 967.41 3.42 0.202 99.81 OAO.B 913.39 927.97 4.28 0.030 99.81 OAO.H 959.64 980.46 4.44 0.029 99.85 OAO.Q 943.01 980.01 4.37 0.034 99.82 表 2 Proteobacteria和Bacteroidetes中的各纲在各反应池中的分布
Table 2. Distribution of bacteria classes belonging to Proteobacteria and Bacteroidetes in each tank %
菌门 菌纲 AO.H AO.Q OAO.B OAO.H OAO.Q Proteobacteria α-Proteobacteria 3.75 3.04 6.52 7.16 5.24 β-Proteobacteria 22.30 14.14 26.98 19.24 24.67 δ-Proteobacteria 2.99 2.58 2.58 2.83 1.86 γ-Proteobacteria 46.22 50.51 19.28 27.45 25.48 Other 0.19 0.27 0.16 0.05 1.16 Bacteroidetes Sphingobacteria 2.95 4.29 6.65 13.36 11.02 Cytophagia 4.36 4.15 2.81 1.69 1.71 Flavobacteriia 1.74 1.18 4.85 3.13 1.10 Saprospirae 8.83 10.20 16.67 13.42 15.62 Other 0.53 0.54 0.20 0.33 0.64 表 3 功能菌在各反应池中的分布
Table 3. Distribution of functional bacteria in each tank
% 菌属 主要功能 AO.H AO.Q OAO.B OAO.H OAO.Q Dechloromonas 好氧反硝化、氨氧化 3.08 4.57 5.44 3.18 7.78 Flavobacterium 好氧反硝化 0.95 0.85 4.17 2.59 0.67 Hydrogenophaga 异养硝化-好氧反硝化 4.30 0.82 0.38 0.29 0.30 Pseudomonas 异养硝化-好氧反硝化 11.90 0.92 0.46 1.43 0.85 Rhodobacter 好氧反硝化 2.01 1.10 3.53 3.03 1.91 Thermomonas 自养反硝化 2.12 1.60 7.97 10.20 8.48 -
[1] 中华人民共和国生态环境部. 2018年中国生态环境状况公报[R]. 北京, 2019. [2] BARLETTA M, LIMA A R A, COSTA M F. Distribution, sources and consequences of nutrients, persistent organic pollutants, metals and microplastics in South American estuaries[J]. Science of the Total Environment, 2019, 651: 1199-1218. doi: 10.1016/j.scitotenv.2018.09.276 [3] WEN Y, SCHOUPS G, VAN DE GIESEN N. Organic pollution of rivers: Combined threats of urbanization, livestock farming and global climate change[J]. Scientific Reports, 2017, 7: 43289. doi: 10.1038/srep43289 [4] 中华人民共和国环境保护部. 中国环境统计年报·(2015)[M]. 北京: 中国环境科学出版社, 2016. [5] JIN L, ZHANG G, TIAN H. Current state of sewage treatment in China[J]. Water Research, 2014, 66: 85-98. doi: 10.1016/j.watres.2014.08.014 [6] ZHANG Q H, YANG W N, NGO H H, et al. Current status of urban wastewater treatment plants in China[J]. Environment International, 2016, 92-93: 11-22. doi: 10.1016/j.envint.2016.03.024 [7] 张健. A/O-MBR+O3溶胞组合工艺污泥减量及强化脱氮效能与机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2018. [8] XU Y, FANG Y, WANG Z, et al. In-situ sludge reduction and carbon reuse in an anoxic/oxic process coupled with hydrocyclone breakage[J]. Water Research, 2018, 141: 135-144. doi: 10.1016/j.watres.2018.05.010 [9] 邹胜萍, 洪平. 一种四内循环改良A/O一体化污水处理装置: CN207645902U[P]. 2018-07-24. [10] 汤清泉, 魏宏斌, 陈良才. AAO与OAO工艺处理焦化废水的对比研究[J]. 工业用水与废水, 2016, 47(3): 31-35. doi: 10.3969/j.issn.1009-2455.2016.03.007 [11] 岳培恒, 王宝强, 夏辉, 等. OAO工艺在非熔渣-熔渣气化废水处理中的应用[J]. 中国给水排水, 2016, 32(10): 116-119. [12] 彭永臻, 高守有. 分子生物学技术在污水处理微生物检测中的应用[J]. 环境科学学报, 2005, 25(9): 1143-1147. doi: 10.3321/j.issn:0253-2468.2005.09.001 [13] MATSUDA M, INOUE D, ANAMI Y, et al. Comparative analysis of DNA-based microbial community composition and substrate utilisation patterns of activated sludge microorganisms from wastewater treatment plants operated under different conditions[J]. Water Science & Technology, 2010, 61(11): 2843-2851. [14] DING L, ZHOU Q, WANG L, et al. Dynamics of bacterial community structure in a full-scale wastewater treatment plant with anoxic-oxic configuration using 16S rDNA PCR-DGGE fingerprints[J]. African Journal of Biotechnology, 2011, 10(4): 589-600. [15] YE D, LIANG H, ZHOU W, et al. Total and active microbial communities in a full-scale system treating wastewater from soy sauce production[J]. International Biodeterioration & Biodegradation, 2017, 123: 206-215. [16] HAN Y P, LI L, LIU J X. Characterization of the airborne bacteria community at different distances from the rotating brushes in a wastewater treatment plant by 16S rRNA gene clone libraries[J]. Journal of Environmental Sciences, 2013, 25(1): 5-15. doi: 10.1016/S1001-0742(12)60018-7 [17] 曾涛涛, 蒋小梅, 韩科昌, 等. 生活污水处理厂微生物群落结构解析[J]. 安全与环境学报, 2018, 18(2): 697-703. [18] 国家环境保护局. 水质pH值的测定玻璃电极法: GB 6920-1986[S]. 北京: 中国标准出版社, 1986. [19] 中华人民共和国环境保护部. 水质氨氮的测定纳氏试剂分光光度法: HJ 535-2009[S]. 北京: 中国环境科学出版社, 2009. [20] 中华人民共和国环境保护部. 水质化学需氧量的测定重铬酸盐法: HJ 828-2017[S]. 北京: 中国环境科学出版社, 2017. [21] 中华人民共和国环境保护部. 水质溶解氧的测定电化学探头法: HJ 506-2009[S]. 北京: 中国环境科学出版社, 2009. [22] 国家环境保护局. 水质水温的测定温度计或颠倒温度计测定法: GB 13195-1991[S]. 北京: 中国标准出版社, 1991. [23] 中华人民共和国环境保护部. 水质总氮的测定碱性过硫酸钾消解紫外分光光度法: HJ 636-2012[S]. 北京: 中国环境科学出版社, 2012. [24] 国家环境保护总局. 水质总磷的测定钼酸铵分光光度法: GB 11893-1989[S]. 北京: 中国标准出版社, 1989. [25] 国家环境保护总局, 国家质量监督检验检疫总局. 城镇污水处理厂污染物排放标准: GB 18918-2002[S]. 北京: 中国环境科学出版社, 2003. [26] LI Y, HE J, HE Z, et al. Phylogenetic and functional gene structure shifts of the oral microbiomes in periodontitis patients[J]. ISME Journal, 2014, 8(9): 1879-1891. doi: 10.1038/ismej.2014.28 [27] SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: Open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. doi: 10.1128/AEM.01541-09 [28] ZHANG T, SHAO M F, YE L. 454 pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J]. ISME Journal, 2012, 6(6): 1137-1147. doi: 10.1038/ismej.2011.188 [29] WELLS G F, PARK H, EGGLESTON B, et al. Fine-scale bacterial community dynamics and the taxa-time relationship within a full-scale activated sludge bioreactor[J]. Water Research, 2011, 45(17): 5476-5488. doi: 10.1016/j.watres.2011.08.006 [30] 郑向阳, 罗晓, 袁立霞, 等. AO工艺处理淀粉污水效能及微生物群落解析[J]. 环境工程学报, 2018, 12(3): 804-814. doi: 10.12030/j.cjee.201708047 [31] MADIGAN M A J M. Brock Biology of Microorganisms[M]. 11th Ed. Upper Saddle River: Prentice Hall, 2005. [32] 康晓荣. 超声联合碱促进剩余污泥水解酸化及产物研究[D]. 哈尔滨: 哈尔滨工业大学, 2013. [33] ZHANG B, LENS P N L, SHI W, et al. Enhancement of aerobic granulation and nutrient removal by an algal-bacterial consortium in a lab-scale photobioreactor[J]. Chemical Engineering Journal, 2018, 334: 2373-2382. doi: 10.1016/j.cej.2017.11.151 [34] WILLIAMS K P, SOBRAL B W, DICKERMAN A W. A robust species tree for the Alphaproteobacteria[J]. Journal of Bacteriology, 2007, 189(13): 4578-4586. doi: 10.1128/JB.00269-07 [35] BEROUAL W, BIONDI E G. A new factor controlling cell envelope integrity in Alphaproteobacteria in the context of cell cycle, stress response and infection[J]. Molecular Microbiology, 2019, 111(3): 553-555. doi: 10.1111/mmi.14201 [36] OGONOWSKI M, MOTIEI A, ININBERGS K, et al. Evidence for selective bacterial community structuring on microplastics[J]. Environmental Microbiology, 2018, 20(8): 2796-2808. doi: 10.1111/1462-2920.14120 [37] LIU J, XUE C, SUN H, et al. Carbohydrate catabolic capability of a Flavobacteriia bacterium isolated from hadal water[J]. Systematic and Applied Microbiology, 2019, 42(3): 263-274. doi: 10.1016/j.syapm.2019.01.002 [38] 宁欣强. A+OSA污泥减量工艺微生物群落结构及代谢特征研究[D]. 重庆: 重庆大学, 2015. [39] 戴昕. 好氧颗粒污泥工艺运行过程重要功能菌群研究[D]. 杭州: 浙江大学, 2014. [40] 胡健. 混凝-两级A/O组合工艺处理高浓度聚酯树脂废水技术研究[D]. 杭州: 浙江大学, 2015. [41] VAN DER MEIJ A, WORSLEY S F, HUTCHINGS M I, et al. Chemical ecology of antibiotic production by actinomycetes[J]. FEMS Microbiology Reviews, 2017, 41(3): 392-416. doi: 10.1093/femsre/fux005 [42] 刘彩霞, 董玉红, 焦如珍. 森林土壤中酸杆菌门多样性研究进展[J]. 世界林业研究, 2016, 29(6): 17-22. [43] AGUIRRE-VON-WOBESER E, ROCHA-ESTRADA J, SHAPIRO L R, et al. Enrichment of Verrucomicrobia, Actinobacteria and Burkholderiales drives selection of bacterial community from soil by maize roots in a traditional milpa agroecosystem[J]. Plos One, 2018, 13(12): e0208852. [44] NAVARRETE A A, SOARES T, ROSSETTO R, et al. Verrucomicrobial community structure and abundance as indicators for changes in chemical factors linked to soil fertility[J]. Antonie van Leeuwenhoek, 2015, 108(3): 741-752. doi: 10.1007/s10482-015-0530-3 [45] 何嘉鹏. 多点进水OAO工艺模拟城镇生活污水处理的生物特性研究[D]. 郑州: 郑州大学, 2018. [46] WANG D, LI T, HUANG K, et al. Roles and correlations of functional bacteria and genes in the start-up of simultaneous anammox and denitrification system for enhanced nitrogen removal[J]. Science of the Total Environment, 2019, 655: 1355-1363. doi: 10.1016/j.scitotenv.2018.11.321 [47] WANG X, ZHAO J, YU D, et al. Evaluating the potential for sustaining mainstream anammox by endogenous partial denitrification and phosphorus removal for energy-efficient wastewater treatment[J]. Bioresource Technology, 2019, 284: 302-314. doi: 10.1016/j.biortech.2019.03.127 [48] 肖晶晶, 郭萍, 霍炜洁, 等. 反硝化微生物在污水脱氮中的研究及应用进展[J]. 环境科学与技术, 2009, 32(12): 97-102. doi: 10.3969/j.issn.1003-6504.2009.12.022 [49] 李小义, 王丽萍, 杜雅萍, 等. 好氧反硝化微生物多样性及其反硝化功能初步研究[J]. 氨基酸和生物资源, 2016, 38(2): 37-45. [50] 孙庆花, 于德爽, 张培玉, 等. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性[J]. 环境科学, 2016, 37(2): 647-654. [51] MAESTRE J P, ROVIRA R, ÁLVAREZ-HORNOS F J, et al. Bacterial community analysis of a gas-phase biotrickling filter for biogas mimics desulfurization through the rRNA approach[J]. Chemosphere, 2010, 80(8): 872-880. doi: 10.1016/j.chemosphere.2010.05.019 [52] MA Q, QU Y, SHEN W, et al. Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing[J]. Bioresource Technology, 2015, 179: 436-443. doi: 10.1016/j.biortech.2014.12.041 [53] 杨浩, 张国珍, 杨晓妮, 等. 16S rRNA高通量测序研究集雨窖水中微生物群落结构及多样性[J]. 环境科学, 2017, 38(4): 1704-1716. [54] XING W, LI J, LI D, et al. Stable-isotope probing reveals the activity and function of autotrophic and heterotrophic denitrifiers in nitrate removal from organic-limited wastewater[J]. Environmental Science & Technology, 2018, 52(14): 7867-7875. -







 下载:
下载: