-
随着人口的增长,城市化的加剧以及现代采矿业和冶金业的快速发展,含高浓度硫酸盐酸性矿山废水(acidic mine drainage, AMD)引起的污染问题亟待解决[1-2]。硫酸盐还原菌(SRB)通常指能够通过异化作用进行硫酸盐(
${\rm{SO}}_4^{2-} $ )还原的一类细菌[3-4]。用SRB来处理矿山废水具有成本低、效果好、无二次污染等优点,已成为现今研究的热点课题。王正辉[5]利用硫酸盐还原菌处理高浓度硫酸盐化工废水,当COD、硫酸盐浓度分别从5 000、700 mg·L−1逐渐增高至13 000、1 700 mg·L−1时,经过对污泥的驯化,启动结束时反应器的硫酸盐负荷率为5 kg·(m3·d)−1,硫酸盐平均去除率达到85%以上;ELKE等[6]应用两相工艺处理制革废水,当进水硫酸盐浓度为1 180 mg·L−1时,硫酸盐去除率为58%(单相厌氧工艺去除率为30%)。在生物法处理AMD废水的研究中,生物固定化方法具有稳定性好、易于实现连续化和处理效率高等优点,受到了国内外学者的广泛关注[7-11]。SRB包埋固定化技术,除了上述优点外,还可以解决其沉降性能差的问题,减少了SRB的流失。同时,细菌包埋后,可以降低重金属沉淀的分离难度,便于实现重金属的回收[12]。林洁松[13]利用内聚甲醇固定化硫酸盐还原菌小球去除硫酸盐和铬,在初始Gr6+浓度为100 mg·L−1和初始
${\rm{SO}}_4^{2-} $ 浓度为200 mg·L−1时,最大去除率分别为99.40%和97.49%;胡希佳等[14]采用聚乙二烯醇-硼酸二次交联方法,将SRB进行局部包埋固定化处理${\rm{SO}}_4^{2-} $ ,在${\rm{SO}}_4^{2-} $ 进水浓度为2 000 mg·L−1时,生物滤池对硫酸盐的还原率稳定在85%以上。然而,上述实验一般只考察了较低负荷的进水
${\rm{SO}}_4^{2-} $ 浓度和包埋后处理情况,对于散泥培养、细菌包埋、包埋填料活性恢复连续过程以及高负荷条件下的废水处理却鲜有报道。本研究将纤维丝活性填料驯化富集(中试)阶段、活性污泥包埋填料驯化富集实验阶段联系起来,详细考察了硫酸盐还原菌、活性包埋填料的驯化情况及其生物群落分析,为工程实际提供技术参考。 -
污泥来自实验室原有的硫酸盐还原生物反应器,实验采用间歇[15-16]、小空间厌氧移动床[17]培养方式进行高效富集培养及挂膜。
实验用水为人工配制的模拟硫酸盐有机废水。市政自来水静置12 h后,投加乳酸钠、无水硫酸钠、氯化铵、硫酸二氢钾和微量重金属离子[18]。实验用原水中的有机物为乳酸钠,保证原水的COD:
${\rm{SO}}_4^{2-} $ ≥2∶1,以满足硫酸盐还原过程对有机碳源的需求。在实验各阶段用水中,保持HRT=10 h、COD∶N∶P=200∶5∶1、DO≤0.5 mg·L−1、pH=7.0~7.5、温度为30~35 ℃[19-20]。 -
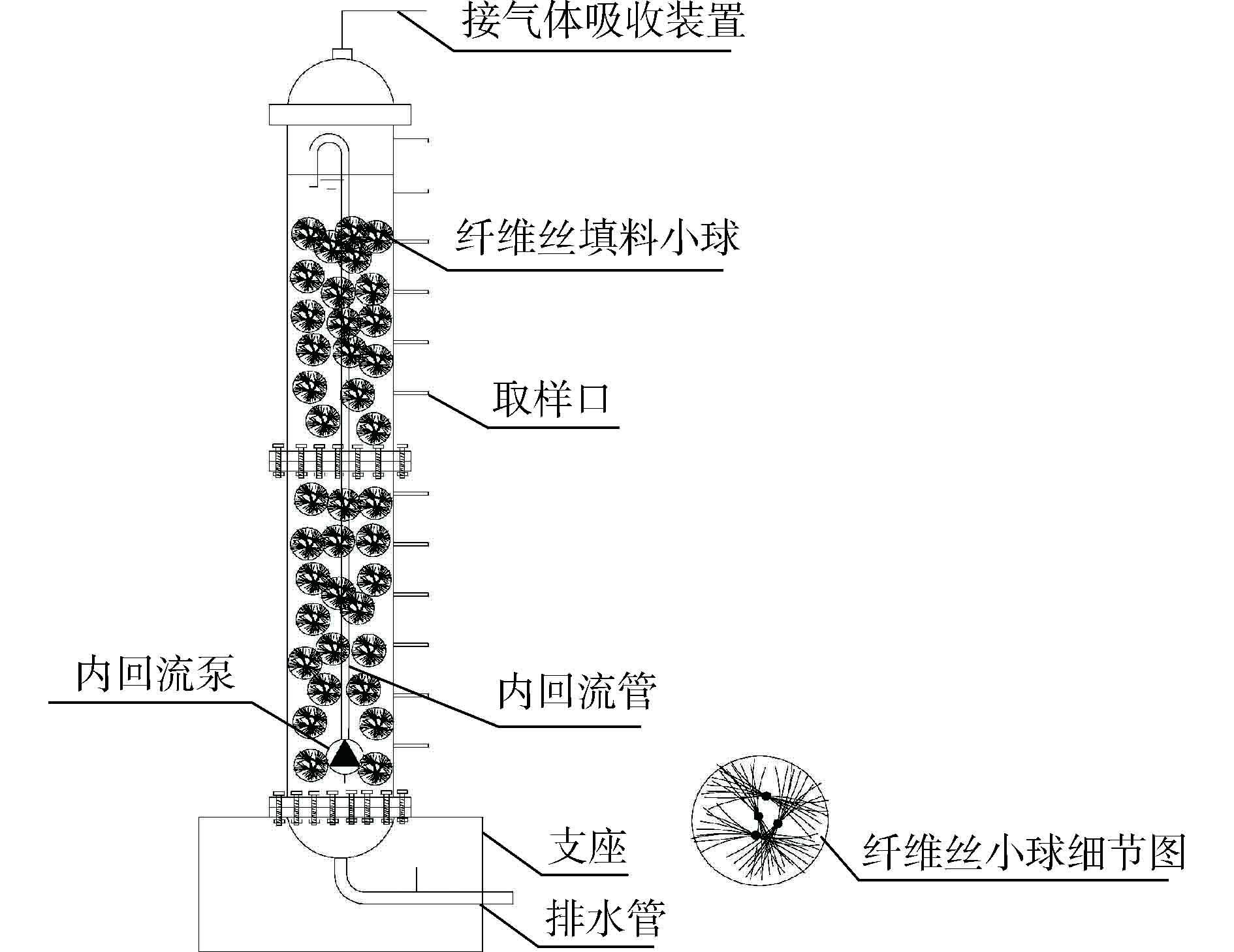
本实验中纤维丝填料的高效富集培养采用间歇培养的方式,培养过程中间歇投加底物,每隔5 d左右,更换上清液,并注入晾晒后的自来水,实验装置如图1所示。反应器总有效体积为200 L,顶部设有尾气(H2S)回收装置,反应器一侧每隔10 cm设有取样口。反应器内部装满纤维丝小球。内设回流装置Q回流泵≈2 000 L·h−1,强化反应器内溶液混合,使溶液达到均质的效果。反应器内部设有加温棒,外部设有保温棉,以保证内部恒温30~35 ℃,维持SRB适宜的环境。
-
取培养后污泥,后经隔膜压滤机(景津环保股份有限公司)浓缩成含水率为85%的污泥,与质量分数20%PVA凝胶混合,污泥与PVA体积比为1∶4,以保证其适宜的生物量及稠度。同时,经响应面[21]分析,加入添加剂活性炭18.32 g·L−1, 碳酸钙38.30 g·L−1,放入过饱和的硼酸溶液交联2 h,再用晾晒的自来水清洗后,放入70 g·L−1的硫酸钠溶液中,二次交联4 h,期间不断地调节交联剂的pH在3.5以下。将包埋液均匀涂在圆柱体网格条子上(长50 cm,直径1.0 cm),然后切成1 cm长度的小圆柱体[22-25],如图2(a)所示。包埋体活性恢复采用500 mL摇瓶于培养箱中培养,如图2(b)所示,包埋填料填充率为20%。实验采用人工模拟硫酸盐有机废水,COD为4 000 mg·L−1,
${\rm{SO}}_4^{2-} $ 为2 000 mg·L−1,其他条件同上。 -
所有检测项目均采用国家规定的标准方法[26],采用铬酸钡分光光度法(CdCl2除S2−干扰)测定
${\rm{SO}}_4^{2-} $ 浓度;采用联华科技的5B-3F型COD快速测定仪测定COD;采用pHS-2C型pH计测定pH,测定前用标准pH缓冲溶液进行校正;采用手提式DO测定仪测定溶解氧(DO);采用温度计测定水温; 采用高通量测序方法进行微生物种群鉴定。 -
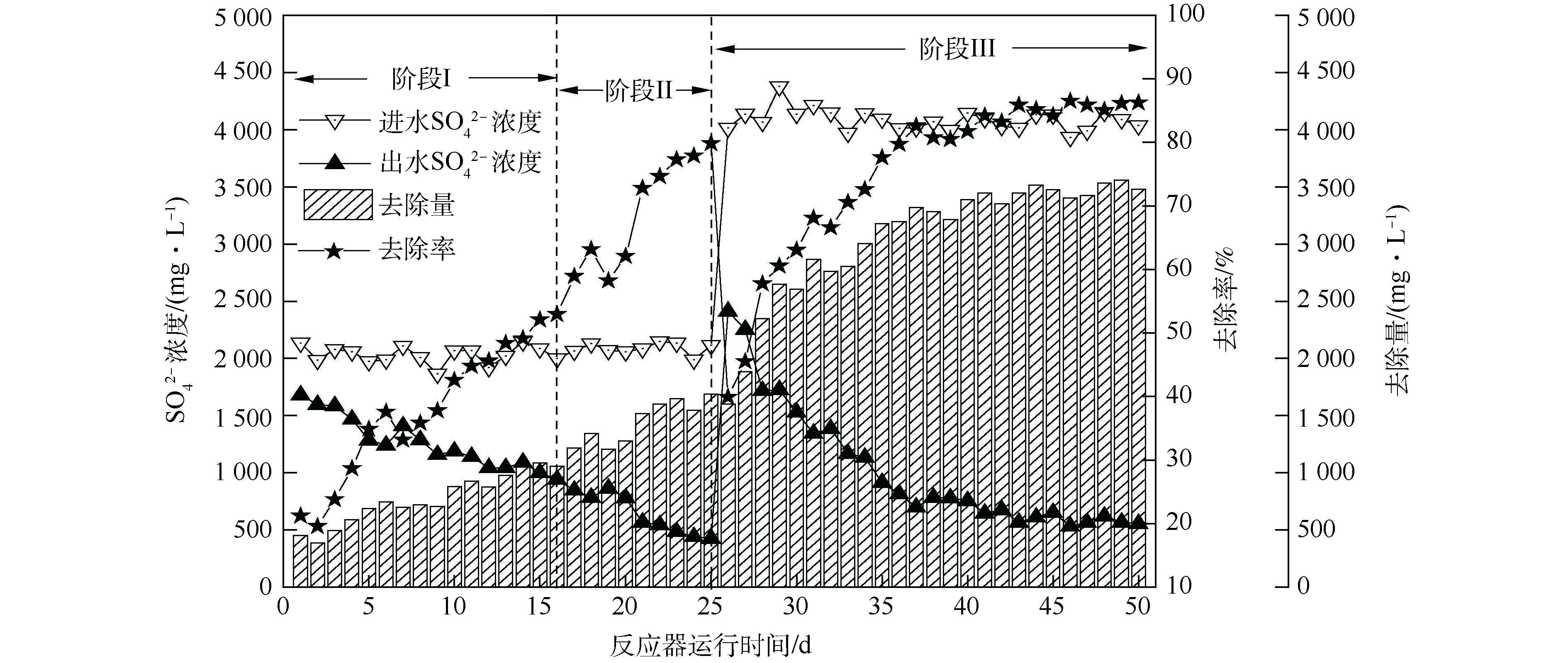
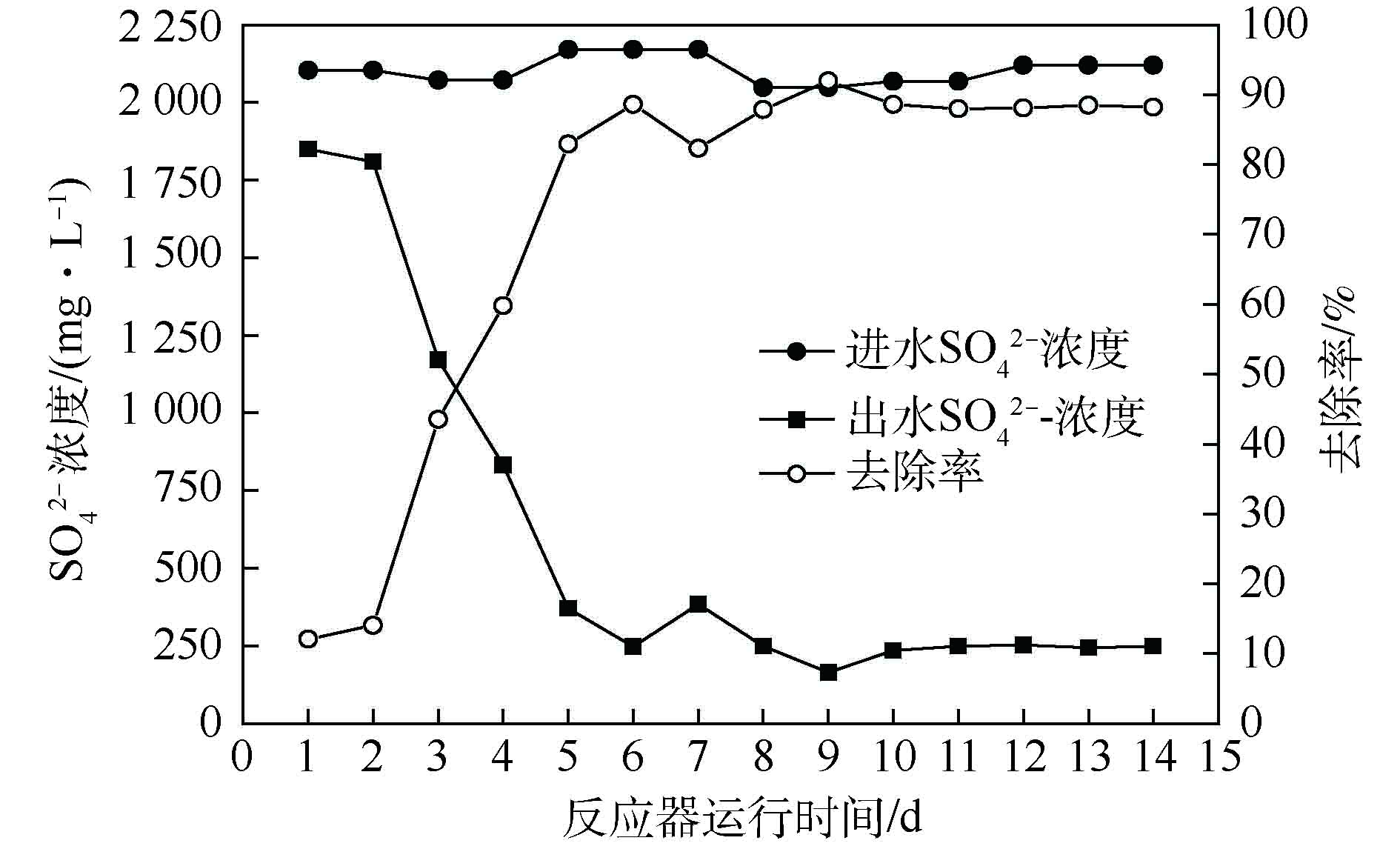
由图3可知,生物反应器启动后,硫酸盐去除量整体呈上升趋势。初始硫酸盐去除率在20%左右,随着运行时间的延长,硫酸盐去除率逐渐升高,出水
${\rm{SO}}_4^{2-} $ 浓度整体呈现出下降趋势,经过25 d的驯化富集,硫酸盐去除率可达79.83%。第Ⅰ阶段(0~16 d),由于起始生物量过少[14],硫酸盐还原速率呈缓慢上升趋势;第Ⅱ阶段(17~25 d),在生物量增多、生物还原性能提高的双重作用下,硫酸盐还原速率由52.93%迅速上升至79.83%;在第Ⅲ阶段(25~50 d),提高
${\rm{SO}}_4^{2-} $ 负荷至4 000 mg·L−1后,在第26天,硫酸盐还原速率为39.93%,随运行时间的延长,硫酸盐还原菌逐渐适应高负荷的${\rm{SO}}_4^{2-} $ ,在第37天,系统的${\rm{SO}}_4^{2-} $ 还原率稳定在80.47%~86.48%。杨宏等[17]发现,当进水${\rm{SO}}_4^{2-} $ 质量浓度由1 500~2 250 mg·L−1增至2 500 mg·L−1时,由于S2−大量积累,抑制了SRB活性,${\rm{SO}}_4^{2-} $ 还原率由87.48%~88.89%下降至78.77%。而本研究进水${\rm{SO}}_4^{2-} $ 为4 000 mg·L−1时,连续运行26 d,富集培养过程中未发现硫化物、乙酸等代谢产物对其的抑制。关于硫化物的毒性抑制浓度各类报道相差甚远,其值为100~1 100 mg·L−1,这可能与实验条件、污泥驯化方法与驯化程度、反应器类型等因素有关[27]。本研究可能由于反应器中内回流泵的搅拌作用(Q泵≈2 000 L·h−1),加快H2S气体排出系统,使系统内游离H2S的浓度大大减弱,减轻了S2−对微生物的抑制作用,为SRB处理高浓度硫酸盐废水提供了理论参考。
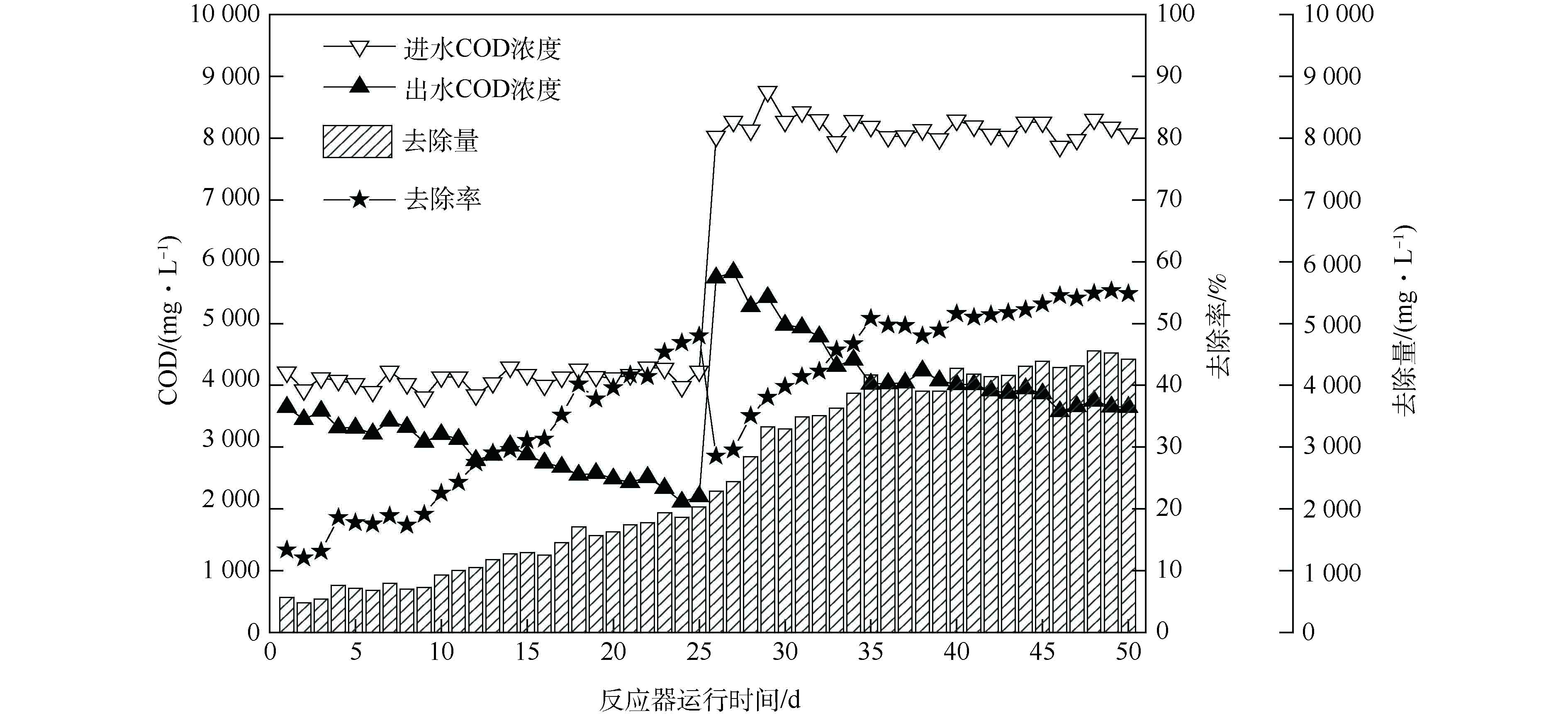
图4为硫酸盐还原菌富集培养过程中COD的逐日变化情况。随着反应时间的延长,COD的去除量有所增加,去除率基本稳定在50%左右。提高进水COD负荷至8 000 mg·L−1,去除量虽然明显提升,但去除率仍然维持在较低水平,最终去除率稳定在53.17%~55.31%。
-
通过对2组样品16S rRNA基因文库高通量测序,污泥原样(MC-1)与筛选后的污泥样品(MC-2) alpha多样性指标计算结果见表1。
由表1可知,2个样品的文库覆盖率均大于0.95,表明测序深度已经基本覆盖到样本中所有的物种。MC-2的Chao1和ACE指数均大于MC-1,并且MC-2具有较大的OTU数,即高效富集培养后的污泥物种丰富度大于原始污泥,具有较多的物种总数。而MC-1的Shannon多样性指数和Simpson多样性指数大于MC-2,说明原污泥群落多样性高于富集培养后的污泥。由此可知,多样性指数较高的原始污泥群落各种之间个体分配较均匀,而筛选后的污泥各种之间生物量差异较大,但优势种群明显。
-
硫酸盐还原菌(sulfate reducing bacteria,SRB)通常指能够通过异化型硫酸盐还原过程进行硫酸盐代谢的一类细菌[28]。在目前已经掌握的硫酸盐还原菌中,属于革兰氏阴性的主要菌属有脱硫叶菌属(Desulfobulbus)、脱硫微菌属(Desulfomicrobium)、脱硫单胞菌属(Desulfomonas)、脱硫菌属(Desulfobacter)、脱硫弧菌属(Desulfovibrio)、脱硫杆菌属(Desulfobacterium)、脱硫球菌属(Desulfococcus)、脱硫念珠菌属(Desulfomonile)、脱硫螺旋体属(Desulfonema)、脱硫八叠菌属(Desulfosarcina);革兰氏阳性菌的代表菌属有脱硫肠状菌属(Desulfotomaculum);嗜热细菌的代表属有热脱硫杆菌(Thermodesulfo bacterium);嗜热古细菌的代表属有古生球菌属(Archaeoglobus)[29-30]。在水处理领域常见的硫酸盐还原菌包括脱硫弧(Desulfovibrio)和脱硫微菌属(Desulfomicrobium)。
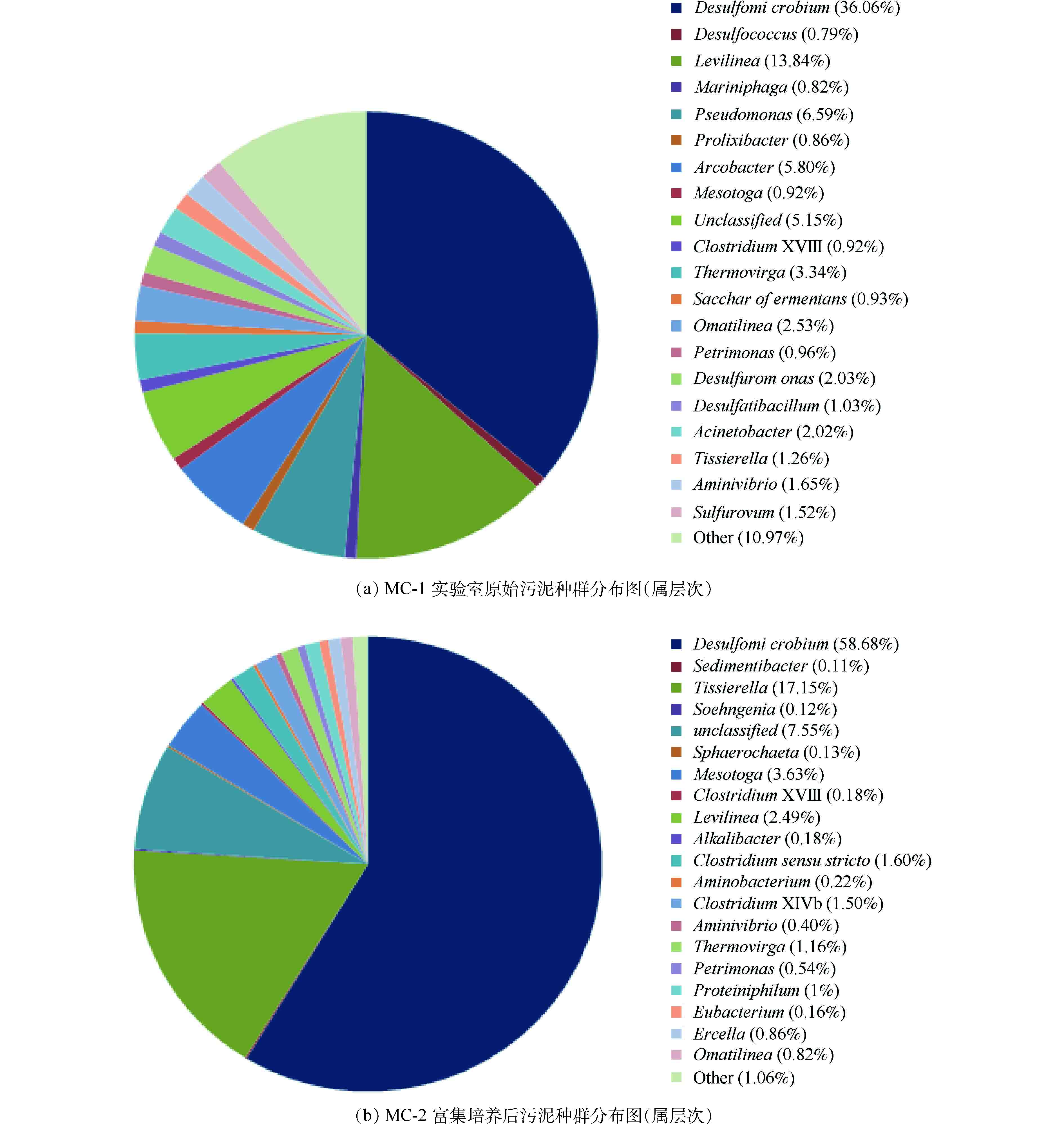
图5(a)和图5(b)表明,具有脱硫作用的I类SRB(Desulfomicrobium)与II类SRB(Desulfococcus)菌属在实验室原始污泥中比例分别为36.06%和0.79%,经过富集培养以后,Desulfomicrobium为58.68%,Desulfococcus未检出,证明了硫酸盐还原菌的富集,为后续包埋提供了菌源。
富集培养后Desulfomicrobium依旧是优势菌种,而Desulfococcus等比例下降。究其原因,是由于ASRB(利用乙酸的硫酸盐还原菌)种群的竞争能力远远低于1-SRB(利用乳酸的硫酸盐还原菌)[31]。富集过程并未出现产甲烷菌(MPB)与硫酸盐还原菌的竞争生长现象,硫酸盐还原菌(Desulfomicrobium)占绝对优势,这与VIKAS[32]的发现(即:当ρ(COD)∶ρ(
${\rm{SO}}_4^{2-} $ )>1时,MPB就占优势的现象)有所不同。究其原因主要有两个方面。一方面是由于其热力学和动力学因素的影响[28],SRB利用COD和氢的自由能低,且对氢的竞争中,SRB占优势。另一方面,实验原水中含有较高的硫酸盐浓度,有研究[33]表明,采用高硫酸盐负荷启动硫酸盐还原菌生物反应器可以有效地抑制MPB的活性,提高SRB的活性。另外,也可能是由于1-SRB或者Desulfomicrobium菌属竞争能力远高于MPB。 -
纤维丝生物活性填料经过50 d的驯化富集培养,硫酸盐还原菌富集培养结果较好。高通量结果表明,Desulfomicrobium比例由36.06%上升至58.68%。由图3可知,还原速率由49.32 mg·(L·h)−1上升至338.7 mg·(L·h)−1。以此为菌源,进行了包埋活性驯化实验并考察了包埋填料对于饥饿环境的抵抗能力。
-
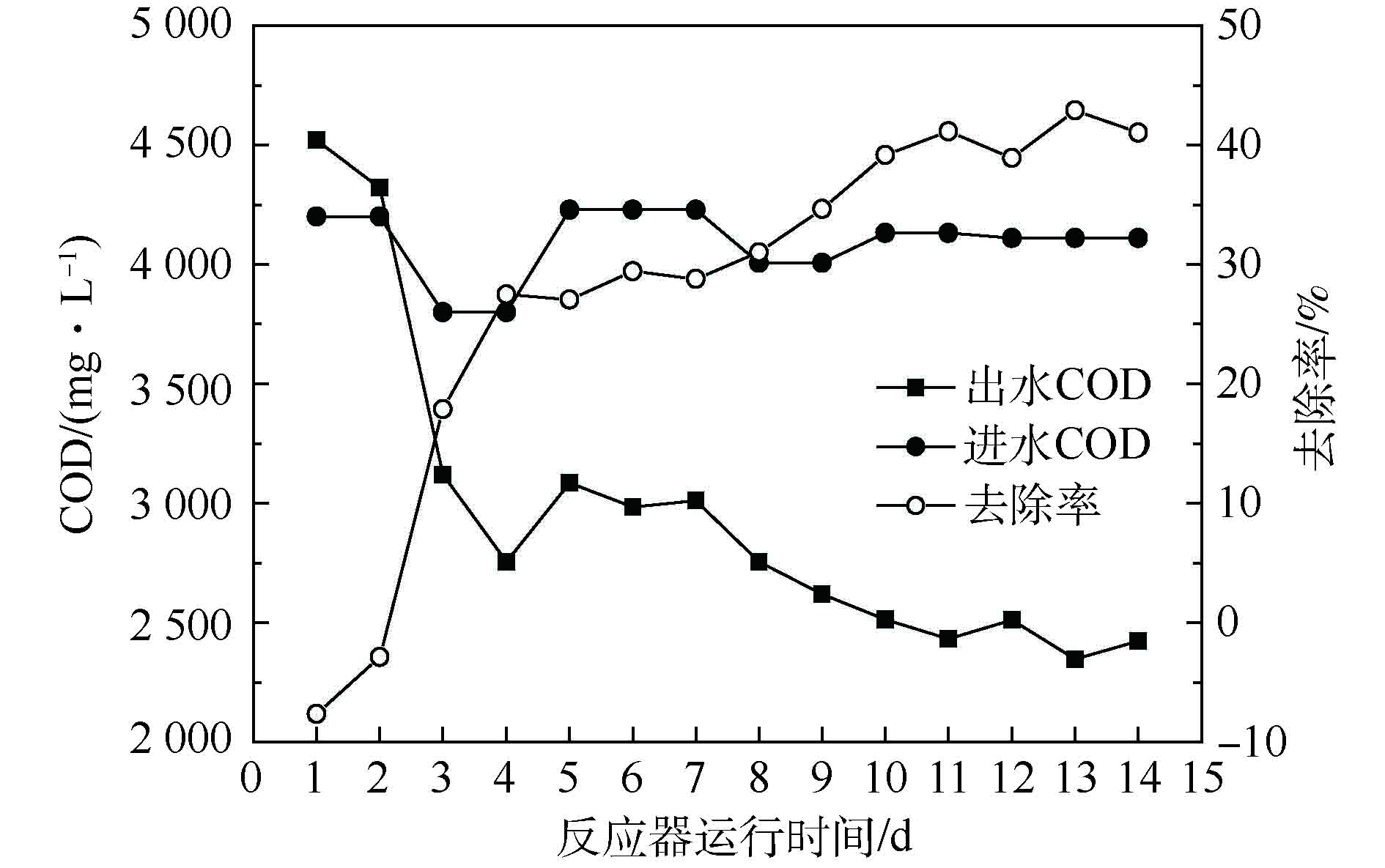
在此阶段,对包埋填料进行活性恢复。由图6可知,反应器初始启动时,出水COD高于进水COD;随反应器运行时间的延长,COD去除率稳定在38.91%~42.90%,大部分COD还未被有效利用。究其原因:一方面是因为PVA的溶出;另一方面,实验中主要功能菌为非完全氧化型硫酸盐还原菌(Desulfomicrobium),出水中含有大量的溶解性硫化物以及未被完全利用的乳酸钠和代谢产物乙酸。因此,实验可适当降低C/S[14],以减少COD的浪费,降低反应运行成本。
如图7所示,经过5 d的恢复培养,
${\rm{SO}}_4^{2-} $ 去除率稳定在80%以上,去除率最高可达91.96%。出水硫酸盐浓度维持在250 mg·L−1以下,满足地表水环境标准,证明了包埋生物活性填料良好的工程实用性。 -
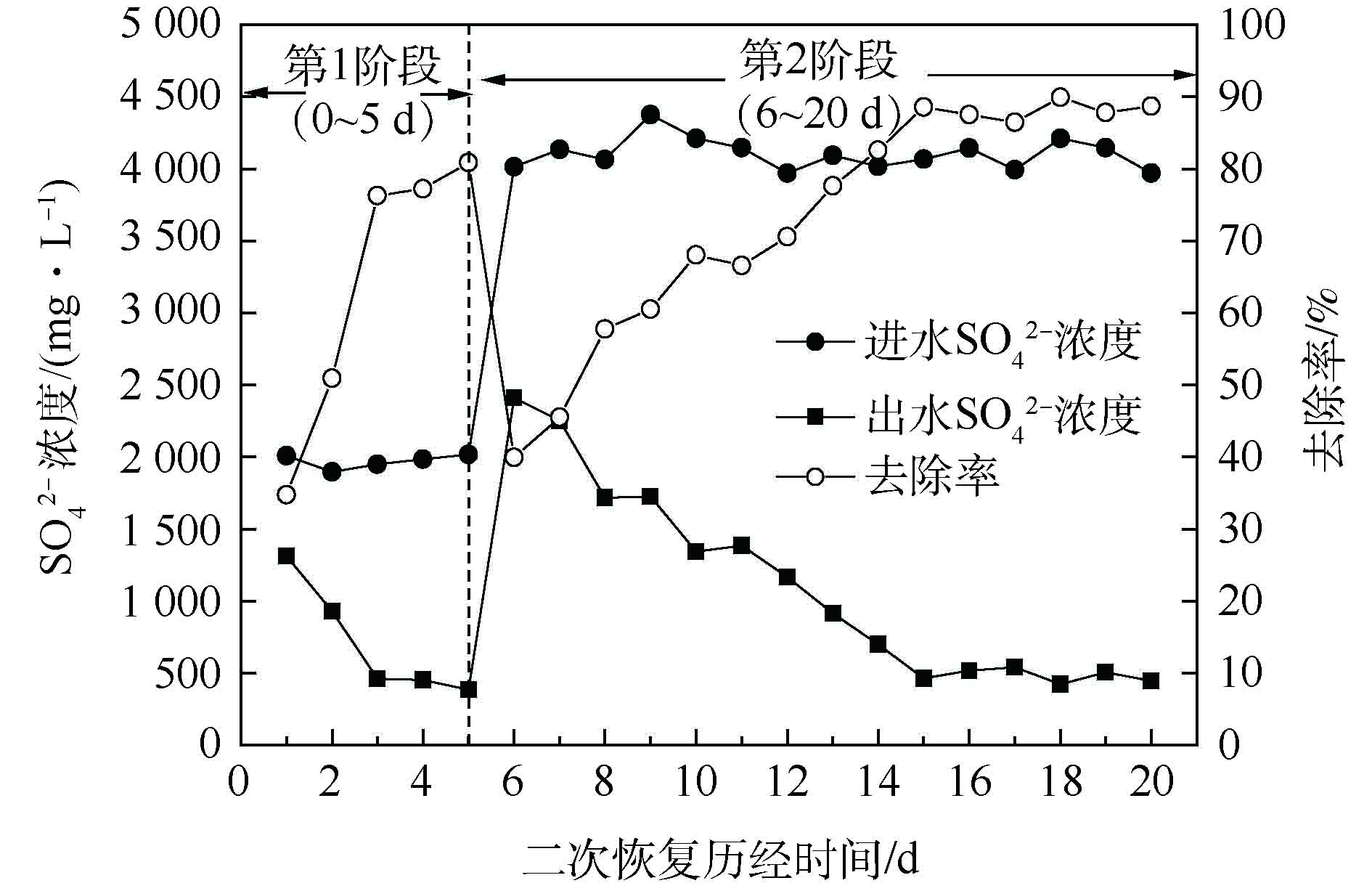
为进一步探究包埋活性填料对饥饿环境的忍耐能力,本研究将填料静置15 d后,在适宜条件下对填料进行为期20 d的二次恢复。硫酸盐还原菌富集培养过程采用硫酸盐浓度指标表征,C/S=2。结果如图8所示。实验采用间歇培养方式,控制温度在30~35 ℃、pH=7.0~7.5、DO≤0.5 mg·L−1、C/S=2、HRT=10 h。实验共分为第1阶段(0~5 d)和第2阶段(6~20 d)2个阶段。
由图8可以看出,在第1阶段,经3 d的恢复,硫酸盐还原率由34.72%上升至80.89%。为考察较高
${\rm{SO}}_4^{2-} $ 负荷下包埋填料的处理情况,在第2阶段,继续提高进水${\rm{SO}}_4^{2-} $ 负荷,由2 000 mg·L−1增至4 000 mg·L−1。经过9 d的培养,硫酸盐还原率即可达到87.87%,最终出水稳定在500 mg·L−1以下。与纤维丝填料驯化富集过程相比,包埋生物活性填料具有明显的驯化时间短、处理效率高等特点。究其原因:一方面由于填料为外圆中空的圆柱状,比表面积相对较大,SEM结果也表明,包埋填料内存在大量利于传质的通道,从而保证了包埋填料与培养液的传质畅通[34];另一方面可能是由于细菌包埋后,减少了细菌的流失,为SRB提供了良好的厌氧环境。以上实验表明,该SRB活性包埋填料具有较强的生存能力和耐高负荷能力,在适宜条件下,经短期培养,即可实现恢复利用。 -
1)采用小空间厌氧移动床的运行方式,逐渐提高基质浓度,到
${\rm{SO}}_4^{2-} $ 浓度为4 000 mg·L−1、COD值为8 000 mg·L−1时,实现了硫酸盐还原菌的规模化富集,${\rm{SO}}_4^{2-} $ 和COD的去除率分别稳定在80.47%~86.48%和53.17%~55.31%。2)高通量测序结果表明,筛选后的污泥系统多样性较原污泥小,Desulfomicrobium依然为系统的优势菌种,比例从36.06%提高到58.68%,培养过程中未出现SRB与MPB种群竞争生长的现象。
3)包埋筛选富集后的活性污泥,通过短期的驯化,硫酸盐还原率可达91.96%。将静置15 d后的包埋生物活性填料进行二次恢复,最终在高负荷(
${\rm{SO}}_4^{2-} $ 浓度为4 000 mg·L−1)下,硫酸盐去除率稳定在85%以上, 包埋活性污泥具有较强的还原性能及恢复性能,具有较强的工程实用性。
硫酸盐还原菌包埋固定化及微生物群落分析
Embedding immobilization of sulfate-reducing bacteria and the microbial community analysis
-
摘要: 为实现硫酸盐还原菌(SRB)批量富集培养与包埋技术的工业化应用,采用纤维丝挂膜方式进行SRB的批量富集培养,以高通量测序方法分析SRB培养前后微生物种群变化,并采用生物包埋技术对富集后的厌氧污泥进行包埋;研究了SRB纤维丝填料、包埋填料活性恢复过程及对高浓度硫酸盐的去除情况;探讨了饥饿环境对于该包埋填料的影响。结果表明:采用间歇运行的小空间厌氧移动床进行SRB的培养,历时50 d,硫酸盐去除率最终稳定在80%以上;富集后的硫酸盐还原功能菌Desulfomicrobium比例由36.06%上升至58.68%,还原速率由49.32 mg·(L·h)−1上升至338.7 mg·(L·h)−1;采用聚乙烯醇(PVA)制作了SRB生物活性包埋填料,在包埋填料填充率为20%情况下,包埋填料对硫酸盐的去除效率最高可达91.96%;经15 d的饥饿环境后,对SRB包埋填料进行短期恢复,即可实现重复利用。该包埋填料具有良好的硫酸盐还原性能和恢复性能,为其工业化应用提供技术参考。Abstract: In order to realize industrialized application of batch enrichment culture and embedding technology of sulfate reducing bacteria (SRB), the batch enrichment culture of SRB was carried out by filament membrane method. The changes of microbial population before and after SRB culture were analyzed by high throughput sequencing method, and the enriched anaerobic sludge was embedded by biological embedding technology. The SRB fibrous filler, recovery process of embedded filler and high-concentration sulfate removal were studied. The effect of starvation environment on the embedded filler was also discussed. The results showed that SRB culture was conducted in a small space anaerobic moving bed with intermittent operation, the sulfate removal rate finally maintained above 80% after 50 days. After enrichment, the proportion of sulfate-reducing functional bacteria Desulfomicrobium increased from 36.06% to 58.68%, and the reduction rate increased from 49.32 mg·(L·h)−1 to 338.7 mg·(L·h)−1. PVA (polyvinyl alcohol) was used to prepare the embedded SRB bioactive filler, and its filling rate with 20% could lead to the highest sulfate removal efficiency up to 91.96%. After 15 days of starvation environment, short-term recovery of embedded SRB filler could be recycled. Good sulfate reduction performance and recovery performance of the embedded filler provides theoretical support for its industrial application.
-
随着人口的增长,城市化的加剧以及现代采矿业和冶金业的快速发展,含高浓度硫酸盐酸性矿山废水(acidic mine drainage, AMD)引起的污染问题亟待解决[1-2]。硫酸盐还原菌(SRB)通常指能够通过异化作用进行硫酸盐(
${\rm{SO}}_4^{2-} $ )还原的一类细菌[3-4]。用SRB来处理矿山废水具有成本低、效果好、无二次污染等优点,已成为现今研究的热点课题。王正辉[5]利用硫酸盐还原菌处理高浓度硫酸盐化工废水,当COD、硫酸盐浓度分别从5 000、700 mg·L−1逐渐增高至13 000、1 700 mg·L−1时,经过对污泥的驯化,启动结束时反应器的硫酸盐负荷率为5 kg·(m3·d)−1,硫酸盐平均去除率达到85%以上;ELKE等[6]应用两相工艺处理制革废水,当进水硫酸盐浓度为1 180 mg·L−1时,硫酸盐去除率为58%(单相厌氧工艺去除率为30%)。
在生物法处理AMD废水的研究中,生物固定化方法具有稳定性好、易于实现连续化和处理效率高等优点,受到了国内外学者的广泛关注[7-11]。SRB包埋固定化技术,除了上述优点外,还可以解决其沉降性能差的问题,减少了SRB的流失。同时,细菌包埋后,可以降低重金属沉淀的分离难度,便于实现重金属的回收[12]。林洁松[13]利用内聚甲醇固定化硫酸盐还原菌小球去除硫酸盐和铬,在初始Gr6+浓度为100 mg·L−1和初始
${\rm{SO}}_4^{2-} $ 浓度为200 mg·L−1时,最大去除率分别为99.40%和97.49%;胡希佳等[14]采用聚乙二烯醇-硼酸二次交联方法,将SRB进行局部包埋固定化处理
${\rm{SO}}_4^{2-} $ ,在
${\rm{SO}}_4^{2-} $ 进水浓度为2 000 mg·L−1时,生物滤池对硫酸盐的还原率稳定在85%以上。
然而,上述实验一般只考察了较低负荷的进水
${\rm{SO}}_4^{2-} $ 浓度和包埋后处理情况,对于散泥培养、细菌包埋、包埋填料活性恢复连续过程以及高负荷条件下的废水处理却鲜有报道。本研究将纤维丝活性填料驯化富集(中试)阶段、活性污泥包埋填料驯化富集实验阶段联系起来,详细考察了硫酸盐还原菌、活性包埋填料的驯化情况及其生物群落分析,为工程实际提供技术参考。
1. 材料与方法
1.1 污泥富集培养材料与方法
污泥来自实验室原有的硫酸盐还原生物反应器,实验采用间歇[15-16]、小空间厌氧移动床[17]培养方式进行高效富集培养及挂膜。
实验用水为人工配制的模拟硫酸盐有机废水。市政自来水静置12 h后,投加乳酸钠、无水硫酸钠、氯化铵、硫酸二氢钾和微量重金属离子[18]。实验用原水中的有机物为乳酸钠,保证原水的COD:
${\rm{SO}}_4^{2-} $ ≥2∶1,以满足硫酸盐还原过程对有机碳源的需求。在实验各阶段用水中,保持HRT=10 h、COD∶N∶P=200∶5∶1、DO≤0.5 mg·L−1、pH=7.0~7.5、温度为30~35 ℃[19-20]。
1.2 污泥富集培养实验装置
本实验中纤维丝填料的高效富集培养采用间歇培养的方式,培养过程中间歇投加底物,每隔5 d左右,更换上清液,并注入晾晒后的自来水,实验装置如图1所示。反应器总有效体积为200 L,顶部设有尾气(H2S)回收装置,反应器一侧每隔10 cm设有取样口。反应器内部装满纤维丝小球。内设回流装置Q回流泵≈2 000 L·h−1,强化反应器内溶液混合,使溶液达到均质的效果。反应器内部设有加温棒,外部设有保温棉,以保证内部恒温30~35 ℃,维持SRB适宜的环境。
1.3 包埋填料的制备与应用
取培养后污泥,后经隔膜压滤机(景津环保股份有限公司)浓缩成含水率为85%的污泥,与质量分数20%PVA凝胶混合,污泥与PVA体积比为1∶4,以保证其适宜的生物量及稠度。同时,经响应面[21]分析,加入添加剂活性炭18.32 g·L−1, 碳酸钙38.30 g·L−1,放入过饱和的硼酸溶液交联2 h,再用晾晒的自来水清洗后,放入70 g·L−1的硫酸钠溶液中,二次交联4 h,期间不断地调节交联剂的pH在3.5以下。将包埋液均匀涂在圆柱体网格条子上(长50 cm,直径1.0 cm),然后切成1 cm长度的小圆柱体[22-25],如图2(a)所示。包埋体活性恢复采用500 mL摇瓶于培养箱中培养,如图2(b)所示,包埋填料填充率为20%。实验采用人工模拟硫酸盐有机废水,COD为4 000 mg·L−1,
${\rm{SO}}_4^{2-} $ 为2 000 mg·L−1,其他条件同上。
1.4 常规指标及检测方法
所有检测项目均采用国家规定的标准方法[26],采用铬酸钡分光光度法(CdCl2除S2−干扰)测定
${\rm{SO}}_4^{2-} $ 浓度;采用联华科技的5B-3F型COD快速测定仪测定COD;采用pHS-2C型pH计测定pH,测定前用标准pH缓冲溶液进行校正;采用手提式DO测定仪测定溶解氧(DO);采用温度计测定水温; 采用高通量测序方法进行微生物种群鉴定。
2. 结果与讨论
2.1 硫酸盐还原菌富集培养结果及分析
由图3可知,生物反应器启动后,硫酸盐去除量整体呈上升趋势。初始硫酸盐去除率在20%左右,随着运行时间的延长,硫酸盐去除率逐渐升高,出水
${\rm{SO}}_4^{2-} $ 浓度整体呈现出下降趋势,经过25 d的驯化富集,硫酸盐去除率可达79.83%。
第Ⅰ阶段(0~16 d),由于起始生物量过少[14],硫酸盐还原速率呈缓慢上升趋势;第Ⅱ阶段(17~25 d),在生物量增多、生物还原性能提高的双重作用下,硫酸盐还原速率由52.93%迅速上升至79.83%;在第Ⅲ阶段(25~50 d),提高
${\rm{SO}}_4^{2-} $ 负荷至4 000 mg·L−1后,在第26天,硫酸盐还原速率为39.93%,随运行时间的延长,硫酸盐还原菌逐渐适应高负荷的
${\rm{SO}}_4^{2-} $ ,在第37天,系统的
${\rm{SO}}_4^{2-} $ 还原率稳定在80.47%~86.48%。杨宏等[17]发现,当进水
${\rm{SO}}_4^{2-} $ 质量浓度由1 500~2 250 mg·L−1增至2 500 mg·L−1时,由于S2−大量积累,抑制了SRB活性,
${\rm{SO}}_4^{2-} $ 还原率由87.48%~88.89%下降至78.77%。而本研究进水
${\rm{SO}}_4^{2-} $ 为4 000 mg·L−1时,连续运行26 d,富集培养过程中未发现硫化物、乙酸等代谢产物对其的抑制。
关于硫化物的毒性抑制浓度各类报道相差甚远,其值为100~1 100 mg·L−1,这可能与实验条件、污泥驯化方法与驯化程度、反应器类型等因素有关[27]。本研究可能由于反应器中内回流泵的搅拌作用(Q泵≈2 000 L·h−1),加快H2S气体排出系统,使系统内游离H2S的浓度大大减弱,减轻了S2−对微生物的抑制作用,为SRB处理高浓度硫酸盐废水提供了理论参考。
图4为硫酸盐还原菌富集培养过程中COD的逐日变化情况。随着反应时间的延长,COD的去除量有所增加,去除率基本稳定在50%左右。提高进水COD负荷至8 000 mg·L−1,去除量虽然明显提升,但去除率仍然维持在较低水平,最终去除率稳定在53.17%~55.31%。
2.2 高通量测序分析
2.2.1 微生物群落丰富度和多样性分析
通过对2组样品16S rRNA基因文库高通量测序,污泥原样(MC-1)与筛选后的污泥样品(MC-2) alpha多样性指标计算结果见表1。
表 1 多样性指标计算结果Table 1. Calculation results of diversity index样品编号 Sequence个数 Chao1指数 ACE指数 Shannon指数 Simpson指数 覆盖率 MC-1 84 964 28 757.03 69 448.43 3.92 0.10 0.96 MC-2 73 096 54 620.06 128 278.84 2.09 0.36 0.97 由表1可知,2个样品的文库覆盖率均大于0.95,表明测序深度已经基本覆盖到样本中所有的物种。MC-2的Chao1和ACE指数均大于MC-1,并且MC-2具有较大的OTU数,即高效富集培养后的污泥物种丰富度大于原始污泥,具有较多的物种总数。而MC-1的Shannon多样性指数和Simpson多样性指数大于MC-2,说明原污泥群落多样性高于富集培养后的污泥。由此可知,多样性指数较高的原始污泥群落各种之间个体分配较均匀,而筛选后的污泥各种之间生物量差异较大,但优势种群明显。
2.2.2 菌群变化分析
硫酸盐还原菌(sulfate reducing bacteria,SRB)通常指能够通过异化型硫酸盐还原过程进行硫酸盐代谢的一类细菌[28]。在目前已经掌握的硫酸盐还原菌中,属于革兰氏阴性的主要菌属有脱硫叶菌属(Desulfobulbus)、脱硫微菌属(Desulfomicrobium)、脱硫单胞菌属(Desulfomonas)、脱硫菌属(Desulfobacter)、脱硫弧菌属(Desulfovibrio)、脱硫杆菌属(Desulfobacterium)、脱硫球菌属(Desulfococcus)、脱硫念珠菌属(Desulfomonile)、脱硫螺旋体属(Desulfonema)、脱硫八叠菌属(Desulfosarcina);革兰氏阳性菌的代表菌属有脱硫肠状菌属(Desulfotomaculum);嗜热细菌的代表属有热脱硫杆菌(Thermodesulfo bacterium);嗜热古细菌的代表属有古生球菌属(Archaeoglobus)[29-30]。在水处理领域常见的硫酸盐还原菌包括脱硫弧(Desulfovibrio)和脱硫微菌属(Desulfomicrobium)。
图5(a)和图5(b)表明,具有脱硫作用的I类SRB(Desulfomicrobium)与II类SRB(Desulfococcus)菌属在实验室原始污泥中比例分别为36.06%和0.79%,经过富集培养以后,Desulfomicrobium为58.68%,Desulfococcus未检出,证明了硫酸盐还原菌的富集,为后续包埋提供了菌源。
富集培养后Desulfomicrobium依旧是优势菌种,而Desulfococcus等比例下降。究其原因,是由于ASRB(利用乙酸的硫酸盐还原菌)种群的竞争能力远远低于1-SRB(利用乳酸的硫酸盐还原菌)[31]。富集过程并未出现产甲烷菌(MPB)与硫酸盐还原菌的竞争生长现象,硫酸盐还原菌(Desulfomicrobium)占绝对优势,这与VIKAS[32]的发现(即:当ρ(COD)∶ρ(
${\rm{SO}}_4^{2-} $ )>1时,MPB就占优势的现象)有所不同。究其原因主要有两个方面。一方面是由于其热力学和动力学因素的影响[28],SRB利用COD和氢的自由能低,且对氢的竞争中,SRB占优势。另一方面,实验原水中含有较高的硫酸盐浓度,有研究[33]表明,采用高硫酸盐负荷启动硫酸盐还原菌生物反应器可以有效地抑制MPB的活性,提高SRB的活性。另外,也可能是由于1-SRB或者Desulfomicrobium菌属竞争能力远高于MPB。
2.3 含硫酸盐还原菌包埋填料富集培养结果及分析
纤维丝生物活性填料经过50 d的驯化富集培养,硫酸盐还原菌富集培养结果较好。高通量结果表明,Desulfomicrobium比例由36.06%上升至58.68%。由图3可知,还原速率由49.32 mg·(L·h)−1上升至338.7 mg·(L·h)−1。以此为菌源,进行了包埋活性驯化实验并考察了包埋填料对于饥饿环境的抵抗能力。
2.3.1 包埋填料效率恢复阶段
在此阶段,对包埋填料进行活性恢复。由图6可知,反应器初始启动时,出水COD高于进水COD;随反应器运行时间的延长,COD去除率稳定在38.91%~42.90%,大部分COD还未被有效利用。究其原因:一方面是因为PVA的溶出;另一方面,实验中主要功能菌为非完全氧化型硫酸盐还原菌(Desulfomicrobium),出水中含有大量的溶解性硫化物以及未被完全利用的乳酸钠和代谢产物乙酸。因此,实验可适当降低C/S[14],以减少COD的浪费,降低反应运行成本。
如图7所示,经过5 d的恢复培养,
${\rm{SO}}_4^{2-} $ 去除率稳定在80%以上,去除率最高可达91.96%。出水硫酸盐浓度维持在250 mg·L−1以下,满足地表水环境标准,证明了包埋生物活性填料良好的工程实用性。
2.3.2 包埋生物活性填料二次恢复考察
为进一步探究包埋活性填料对饥饿环境的忍耐能力,本研究将填料静置15 d后,在适宜条件下对填料进行为期20 d的二次恢复。硫酸盐还原菌富集培养过程采用硫酸盐浓度指标表征,C/S=2。结果如图8所示。实验采用间歇培养方式,控制温度在30~35 ℃、pH=7.0~7.5、DO≤0.5 mg·L−1、C/S=2、HRT=10 h。实验共分为第1阶段(0~5 d)和第2阶段(6~20 d)2个阶段。
由图8可以看出,在第1阶段,经3 d的恢复,硫酸盐还原率由34.72%上升至80.89%。为考察较高
${\rm{SO}}_4^{2-} $ 负荷下包埋填料的处理情况,在第2阶段,继续提高进水
${\rm{SO}}_4^{2-} $ 负荷,由2 000 mg·L−1增至4 000 mg·L−1。经过9 d的培养,硫酸盐还原率即可达到87.87%,最终出水稳定在500 mg·L−1以下。与纤维丝填料驯化富集过程相比,包埋生物活性填料具有明显的驯化时间短、处理效率高等特点。究其原因:一方面由于填料为外圆中空的圆柱状,比表面积相对较大,SEM结果也表明,包埋填料内存在大量利于传质的通道,从而保证了包埋填料与培养液的传质畅通[34];另一方面可能是由于细菌包埋后,减少了细菌的流失,为SRB提供了良好的厌氧环境。以上实验表明,该SRB活性包埋填料具有较强的生存能力和耐高负荷能力,在适宜条件下,经短期培养,即可实现恢复利用。
3. 结论
1)采用小空间厌氧移动床的运行方式,逐渐提高基质浓度,到
${\rm{SO}}_4^{2-} $ 浓度为4 000 mg·L−1、COD值为8 000 mg·L−1时,实现了硫酸盐还原菌的规模化富集,
${\rm{SO}}_4^{2-} $ 和COD的去除率分别稳定在80.47%~86.48%和53.17%~55.31%。
2)高通量测序结果表明,筛选后的污泥系统多样性较原污泥小,Desulfomicrobium依然为系统的优势菌种,比例从36.06%提高到58.68%,培养过程中未出现SRB与MPB种群竞争生长的现象。
3)包埋筛选富集后的活性污泥,通过短期的驯化,硫酸盐还原率可达91.96%。将静置15 d后的包埋生物活性填料进行二次恢复,最终在高负荷(
${\rm{SO}}_4^{2-} $ 浓度为4 000 mg·L−1)下,硫酸盐去除率稳定在85%以上, 包埋活性污泥具有较强的还原性能及恢复性能,具有较强的工程实用性。
-
表 1 多样性指标计算结果
Table 1. Calculation results of diversity index
样品编号 Sequence个数 Chao1指数 ACE指数 Shannon指数 Simpson指数 覆盖率 MC-1 84 964 28 757.03 69 448.43 3.92 0.10 0.96 MC-2 73 096 54 620.06 128 278.84 2.09 0.36 0.97 -
[1] 杨群, 宁平, 陈芳媛, 等. 矿山酸性废水治理技术现状及进展[J]. 金属矿山, 2009(1): 131-134. doi: 10.3321/j.issn:1001-1250.2009.01.037 [2] 王磊, 李泽琴, 姜磊. 酸性矿山废水的危害与防治对策研究[J]. 环境科学与管理, 2009, 34(10): 82-84. doi: 10.3969/j.issn.1673-1212.2009.10.020 [3] KLONOWSKA A, CLARK M E, THIEMAN S B, et al. Hexavalent chromium reduction in Desulfovibrio vulgaris hilden borough causes transitory inhibition of sulfate reduction and cell growth[J]. Applied Microbiology and Biotechnology, 2008, 78(6): 1007-1016. doi: 10.1007/s00253-008-1381-x [4] 李建军, 叶广运, 陈进林, 等. 一株硫酸盐还原菌的分离鉴定和系统发育分析[J]. 微生物学通报, 2009, 36(10): 1476-1482. [5] 王正辉. 两相厌氧工艺处理高浓度硫酸盐有机废水的研究[D]. 南昌: 南昌大学, 2008. [6] ELKE G, WERNER H, CHRISTIAN M. Biological sulfate removal from tannery wastewater in a two-stage anaerobic treatment[J]. Water Research, 1996, 30(9): 2072-2078. doi: 10.1016/0043-1354(96)00332-6 [7] HALLBERG K. B, JOHNSON D B. Biological manganese removal from acid mine drainage in constructed wetlands and prototype bioreactors[J]. Science of the Total Environment, 2005, 338(1): 115-124. [8] GONCALVES M M M, DA COSTA A C A, LEITE S G F, et al. Heavy metal removal from synthetic wastewaters in an anaerobic bioreactor using stillage from ethanol distilleries as a carbon source[J]. Chemosphere, 2007, 69(11): 1815-1820. doi: 10.1016/j.chemosphere.2007.05.074 [9] CRAIG A M, O'SULLIVAN A D, MILKE M W, et al. Sulfate and metal removal in bioreactors treating acid mine drainage dominated with iron and aluminum[J]. Water Research, 2008, 43(4): 961-970. [10] OZVERDI A, ERDEM M. Cu2+, Cd2+ and Pb2+ adsorption from aqueous solutions by pyrite and synthetic iron sulphide[J]. Journal of Hazardous Materials, 2006, 137(1): 626-632. doi: 10.1016/j.jhazmat.2006.02.051 [11] FU F L, WANG Q. Removal of heavy metal ions from wastewaters: A review[J]. Journal of Environmental Management, 2011, 92(3): 407-418. doi: 10.1016/j.jenvman.2010.11.011 [12] 张秀霞, 秦丽姣, 黄聪聪, 等. 微生物固定化载体的选择及其性能[J]. 化工进展, 2011, 30(12): 2781-2786. [13] 林洁松. 内聚甲醇固定化硫酸盐还原菌小球去除硫酸盐和铬[J]. 工业催化, 2016, 24(10): 77-80. doi: 10.3969/j.issn.1008-1143.2016.10.014 [14] 胡希佳, 陈伟, 陶慕翔, 等. 硫酸盐还原菌固定化填料滤池对硫酸盐的去除[J]. 中国给水排水, 2015, 31(11): 23-26. [15] 彭永臻. SBR法的五大优点[J]. 中国给水排水, 1993, 9(2): 29-31. doi: 10.3321/j.issn:1000-4602.1993.02.020 [16] 焦迪, 李进, 李娟, 等. 硫酸盐还原菌在中水中的分离及生长特性研究[J]. 环境科学与技术, 2010, 33(10): 64-67. [17] 杨宏, 陈伟, 谭科艳, 等. 利用小空间厌氧移动床还原硫酸盐的实验研究[J]. 北京工业大学学报, 2016, 42(7): 1102-1107. [18] VAN DE GRAAF A A. Autotrophic growth of anaerobic ammonium- oxidizing micro-organisms in a fluidized bed reactor[J]. Microbiology, 1996, 142(8): 2187-2196. doi: 10.1099/13500872-142-8-2187 [19] 陈伟. 生物法处理废水中硫酸盐的实验研究[D]. 北京: 北京工业大学, 2015. [20] 郑强. 生态因子对硫酸盐还原菌生长的影响[J]. 中国资源综合利用, 2009, 27(2): 25-27. doi: 10.3969/j.issn.1008-9500.2009.02.009 [21] 管清坤. PVA凝胶内基质扩散系数测定及其传质性能的优化[J]. 环境工程学报, 2017, 11(3): 1375-1382. [22] ZHANG S, WANG Y, HE W, et al. Linking nitrifying biofilm characteristics and nitrification performance in moving-bed biofilm reactors for polluted raw water pretreatment[J]. Bioresource Technology, 2013, 146: 416-425. doi: 10.1016/j.biortech.2013.07.056 [23] HUANG W, WANG W, SHI W, et al. Use low direct current electric field to augment nitrification and structural stability of aerobic granular sludge when treating low COD/NH4+-N wastewater[J]. Bioresource Technology, 2014, 171: 139-144. doi: 10.1016/j.biortech.2014.08.043 [24] YAO C. Application of magnetic enhanced bio-effect on nitrification: A comparative study of magnetic and non-magnetic carriers[J]. Water Science & Technology, 2013, 67(6): 1280-1287. [25] DONG Y, ZHANG Y, TU B, et al. Immobilization of ammonia-oxidizing bacteria by calcium alginate[J]. Ecological Engineering, 2014, 73: 809-814. doi: 10.1016/j.ecoleng.2014.09.020 [26] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [27] 赵宇华, 刘学东. 硫酸盐还原菌及其影响因子[J]. 环境污染与防治, 1997, 19(5): 41-43. [28] 王爱杰, 任南琪, 刘伟, 等. 产酸脱硫反应器中SRB种群的功能与地位[J]. 中国环境科学, 2001, 21(2): 119-123. doi: 10.3321/j.issn:1000-6923.2001.02.007 [29] 任南琪, 王爱杰, 赵阳国. 废水厌氧处理硫酸盐还原菌生态学[M]. 北京: 科学出版社, 2009. [30] 沈平, 范秀荣, 李广武. 微生物学实验[M]. 北京: 高等教育出版社, 1999. [31] 王爱杰, 任南琪, 杜大仲, 等. 硫酸盐还原过程中乙酸型代谢方式的形成及其稳定性[J]. 环境科学, 2004, 25(2): 73-76. doi: 10.3321/j.issn:0250-3301.2004.02.015 [32] VIKAS U. Interactions among sulfate reducers, acetogens, and methanogens in anaerobic propionate systems[J]. Water Environment Research, 1995, 67(3): 330-339. doi: 10.2175/106143095X131556 [33] 苏冰琴, 李亚新. 硫酸盐还原菌厌氧颗粒污泥的形成条件[J]. 化工环保, 2006, 26(1): 26-30. doi: 10.3969/j.issn.1006-1878.2006.01.007 [34] 杨宏, 徐富, 孟琛, 等. 包埋活性污泥反硝化性能的快速提高及群落分析[J]. 环境科学, 2018, 39(10): 4661-4669. -




 下载:
下载: